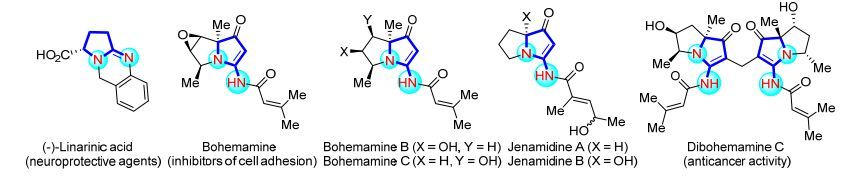
 图 1
具有生物活性的2-氨基吡咯啉类衍生物
Figure 1.
Representative biologically active 2-amino pyrroline derivatives
图 1
具有生物活性的2-氨基吡咯啉类衍生物
Figure 1.
Representative biologically active 2-amino pyrroline derivatives

Citation: Zhu Chaoze, Feng Jianjun, Zhang Junliang. Rhodium(Ⅰ)-Catalyzed Stereospecific [3+2] Cycloadditions of Vinylaziridines and Ynamides[J]. Chinese Journal of Organic Chemistry, 2017, 37(5): 1165-1172. doi: 10.6023/cjoc201701043

铑催化烯基氮杂环丙烷与炔胺的立体专一性[3+2]环加成反应
English
Rhodium(Ⅰ)-Catalyzed Stereospecific [3+2] Cycloadditions of Vinylaziridines and Ynamides
-
Key words:
- transition-metal catalysis
- / cycloaddition
- / vinylaziridine
- / ynamides
- / nitrogen heterocycles
-
吡咯啉类衍生物是一类重要的氮杂环化合物, 在医药、农药及材料化学等诸多领域具有广泛的应用前景, 因此对其的合成一直以来都是有机化学工作者们研究的热点和焦点[1].其中, 2-氨基吡咯啉类化合物作为一种具有独特结构的吡咯啉类衍生物, 广泛存在于具有生理活性的天然产物和药物分子中(Figure 1)[2].例如, (-)-Linarinic acids是很好的神经保护剂[2a]; 从海洋放射链霉菌中分离得到的Bohemamine家族的生物碱则具有共同的2-酰胺基-2-吡咯啉内核且都具有抗细胞粘附活性[2b]; 此外, Jenamidine A还是慢性髓细胞生长的抑制剂具有治疗白血病的效果(GI50=1.9 μg/mL)[2c]; 而Bohemamine类生物碱的二聚物Dibohemamine C则对肺癌细胞表现出优秀的抗癌活性(IC50=0.145 μmol/L)[2d].然而, 尽管用于合成2-氨基吡咯类化合物的方法被大量报道[3], 但是实现对2-氨基吡咯啉类化合物的高效合成的方法却相对较少[4a~4c], 对其的对映选择性的合成更是鲜有报道[4d~4e].因此, 探索高效、高选择性的方法实现对2-氨基吡咯啉类衍生物的合成就显得尤为重要.
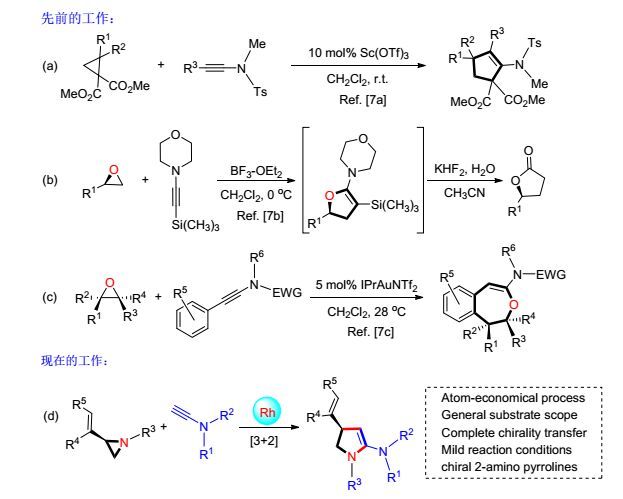
众所周知, 相比于传统的方法, 环加成反应在环状化合物的构建方面具有明显的优势, 符合原子经济性及绿色化学的要求[5].其中, 小环参与的环加成反应以小环开环释放环张力作为反应的驱动力被广泛用于环状化合物的合成[1a, 5].例如, 环丙烷[5a~5d]、环氧[5e]和氮杂环丙烷[1a, 5f]类三元环化合物参与的[3+2]环加成反应已成为构建五元碳环和杂环的高效方法.最近, 炔胺类合成子作为一种特殊的杂原子取代的炔烃衍生物, 一方面它可作为环化反应中的二碳组分参与反应; 另一方面它可方便地在产物中引入氨基片段.因而将炔胺引入到环加成体系而合成氨基取代的环状化合物的策略受到了化学家们越来越多的关注[6].例如, Johnson等[7a]发现在三氟甲磺酸钪的催化下, 供体-受体类型的环丙烷可与炔胺在室温下发生[3+2]环加成反应, 高效地制备氨基取代的环戊烯衍生物. Jacobsen小组[7b]则报道了三氟化硼促进的烷基取代的环氧化合物与炔胺的立体专一性[3+2]环加成反应制备氨基取代的二氢呋喃产物的方法.得到的二氢呋喃类中间体与KHF2反应可进一步转化为γ-丁内酯类化合物.与Jacobsen小组的工作不同, 刘瑞雄小组[7c]则发现在金催化下, 环氧与炔胺的环加成反应主要得到[4+3]环加成产物, 并且环氧的手性可高效转移至产物中, 进而为合成具有挑战性的手性氧杂七元环化合物提供了高选择性的合成方法.然而, 相比于环丙烷和环氧, 氮杂环丙烷与炔胺的环加成反应却没有相关报道.最近, 我们小组发现, 在铑催化下烯基氮杂环丙烷可与一系列2π组分(炔、烯、联烯及共轭双烯等)发生[3+2]、[3+4]和[5+2]环加成反应[8].基于此, 我们对烯基氮杂环丙烷与炔胺的环加成反应模式产生了浓厚的研究兴趣([3+2] versus [5+2]).对该类反应的研究不仅可以丰富氮杂环丙烷与炔胺的环加成化学, 而通过“手性转移”策略还可以为合成2-氨基吡咯啉类化合物提供一个高效、高选择性的合成方法.
1 结果与讨论
1.1 反应条件的优化
我们选取手性烯基氮杂环丙烷(R)-1a (98% ee)与炔胺2a为模板反应底物对反应条件进行筛选和优化.如表 1所示, 我们首先考察了三种路易斯酸催化剂Ag-SbF6、FeCl3和Sc(OTf)3, 它们常被用于苯基氮杂环丙烷和炔烃的[3+2]反应中[9].但令人遗憾的是, 在这三种条件下都没有相应的环加成产物生成(表 1, Entries 1~3).随后, 根据我们小组之前的工作, 我们对铑催化剂进行了筛选.当使用[Rh(CO)2Cl]2、Rh(PPh3)Cl/AgSbF6、[Rh(NBD)dppe]+BF4-、[Rh(η6-C10H8)(COD)]+SbF6-为催化剂时, 同样没有得到目标产物(表 1, Entries 4~7).令人惊喜的是, 当使用[Rh(NBD)2]+BF4-为催化剂时, 反应能以近乎当量的核磁收率得到[3+2]环加成产物, 且手性完全保持(98% ee)(表 1, Entry 8).产物(R)-3aa的结构及绝对构型由X单晶衍射确证[10].通过以上反应条件的优化, 确定了最佳反应条件为: 5 mol% [Rh(NBD)2]+BF4-为催化剂, 投料比1a:2a为1.0:1.5, 1, 2-二氯乙烷(DCE)为溶剂, 在室温氮气氛围下反应.

Entry Catalyst Temp./℃ Time/h Coversion/% Yieldb/% ee/% 1 AgSbF6 25 5 5 — — 2 FeCl3 80 5 42 — — 3 Sc(OTf)3 25 5 35 — — 4 [Rh(CO)2Cl]2 80 5 26 — — 5 Rh(PPh3)Cl/AgSbF6 80 5 25 — — 6 [Rh(NBD)dppe]+BF4- 80 5 0 — — 7 [Rh(η6-C10H8)(COD)]+SbF6- 25 17 22 — — 8 [Rh(NBD)2]+BF4- 25 0.25 100 92 98 a反应条件: (R)-1a (0.1 mmol), 2a (0.15 mmol), 催化剂(5 mol%), 溶剂DCE (1.5 mL), 室温(25 ℃); b核磁收率. 表 1 反应条件的优化a
Table 1. Optimization of reaction conditions1.2 炔胺底物的普适性
在确立反应的最优条件后, 我们固定烯基氮杂环丙烷(R)-1a (98% ee)为底物, 首先考察该[3+2]环加成反应中炔胺底物2的普适性.如表 2所示, 当炔胺底物氮原子上保护基R1为对甲苯磺酰基(Ts)时, R2基团既可以是芳基(2a)也可以是苄基(2b)、异丙基(2c)和正丁基(2d).而R1基团不仅可以为对甲苯磺酰基(Ts), R1为对硝基苯磺酰基(2e)和甲基磺酰基(2f)时上述反应仍可顺利进行, 以良好至优秀的产率和98~99%的ee值得到2-氨基吡咯啉产物.值得一提的是: N-炔基吲哚底物2g也可与(R)-1a发生立体专一性的[3+2]环加成反应, 只是产率偏低.但遗憾的是该反应体系对N-Boc取代的炔胺2h和非末端炔胺2i尚不能适用.除炔胺底物外, 我们还尝试了铑催化烯基氮杂环丙烷(R)-1a与炔基萘基醚底物2j的环加成反应, 令人失望的是该反应并没有得到预期的环加成产物.
 表 2 炔胺底物的拓展a
表 2 炔胺底物的拓展a
Table 2. Exploration of the substrate scope with respect to various ynamides1.3 烯基氮杂环丙烷底物的普适性
在最优反应条件下, 如表 3所示, 我们还固定炔胺2a为底物, 考察了烯基氮杂环丙烷底物1的普适性.烯基氮杂环丙烷氮上的保护基除Ts基团外, 还可以是Ns和Ms基团(Table 3, 1a~1d).这为氮上保护基的脱除提供了更多的选择性.此外, 该反应体系对烯基上有不同的取代基团的烯基氮杂环丙烷底物也显示出很好的兼容性.除甲基外(1a), 烯基氮杂环丙烷中烯基上的取代基R4还可是氢(1b)、异丙基(1e)、正丁基(1f)和苯基(1g).上述底物在标准条件下反应可以以81%~97%的产率得到[3+2]环加成产物, 且原料的手性信息可完全转移至产物中.值得注意的是, 与我们之前报道的烯基氮杂环丙烷与苯乙炔的[3+2]环加成反应的工作不同[8a], 烯基氮杂环丙烷(S, E)-1h (92% ee)和炔胺的反应也能得到相应的[3+2]环加成产物, 并以较好的手性转移效率得到手性的2-氨基吡咯啉产物3ha.
 表 3
烯基氮杂环丙烷底物的拓展a
Table 3.
Exploration of the substrate scope with respect to various vinylaziridines
表 3
烯基氮杂环丙烷底物的拓展a
Table 3.
Exploration of the substrate scope with respect to various vinylaziridines
 表 3 烯基氮杂环丙烷底物的拓展a
表 3 烯基氮杂环丙烷底物的拓展a
Table 3. Exploration of the substrate scope with respect to various vinylaziridines1.4 反应机理的探讨
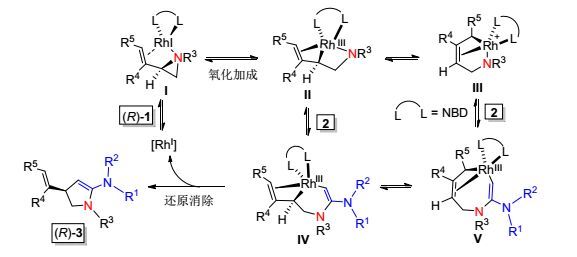
基于上述手性转移实验及我们小组前期研究工作基础[8a], 我们提出了如Scheme 2所示的可能反应机理.首先, 一价铑催化剂与烯基氮杂环丙烷底物(R)-1配位后, 经立体专一性的氧化加成反应可得到(σ+π)-络合物Ⅱ和Ⅲ.随后, 络合物Ⅱ和Ⅲ被炔胺2经插入反应捕获分别得到铑物种Ⅳ和V.最后, 络合物Ⅳ经还原消除得到[3+2]环加成产物(R)-3, 并再生一价铑催化剂完成催化循环.其中, 物种Ⅱ, Ⅲ, Ⅳ和V之间的转化是可逆的平衡过程.而使用含降冰片二烯(NBD)配体的铑催化剂[Rh(NBD)2]+BF4-时, 导致Ⅱ至Ⅲ以及Ⅳ至V的异构化反应难于中间体Ⅳ的不可逆的还原消除反应[11].因而, 在[Rh(NBD)2]+BF4-的催化下, 烯基氮杂环丙烷与炔胺的反应可以立体专一性地合成2-氨基吡咯啉产物3.
2 结论
本文研究了铑催化的烯基氮杂环丙烷与炔胺的立体专一性的[3+2]环加成反应, 并运用手性转移的策略发展了一种高效、高对映选择性且原子经济性地制备2-氨基吡咯啉类衍生物的方法.该方法为相关药物分子的合成和天然产物核心骨架的构建提供了新的思路.
3 实验部分
3.1 仪器与试剂
核磁共振氢谱(1H NMR)和碳谱(13C NMR)是通过Bruker公司的Bruker DPX-400 MHz和Bruker AVANCE Ⅲ 500 MHz核磁共振波谱仪测定, 内标物为四甲基硅烷(TMS), 溶剂为氘代氯仿(CDCl3).高分辨质谱(ESI)是通过maXis Impact+1290 Infinity质谱仪测定. ee值是通过DIONEX UltiMate 3000手性HPLC测定.旋光是通过WZZ-2B型自动旋光仪测定.熔点是通过上海精密科学仪器有限公司所生产的GW X-4显微熔点仪进行测定, 熔点仪未经校正.实验所用溶剂使用前均按照处理溶剂的标准方法进行处理.所用催化剂[Rh(η6-C10H8)-(COD)]SbF6[12a], 烯基氮杂环丙烷底物1[8], 炔胺底物2[12b]可按照文献方法制备.其中光学纯的烯基氮杂环丙烷底物主要以(L)-丝氨酸甲酯为起始原料经4~5步合成[8].其它实验药品均购自Adamas-beta®、安耐吉、百灵威等公司.
3.2 2-氨基吡咯啉产物3的制备方法
在氮气保护的条件下, 将烯基氮杂环丙烷1 (0.2 mmol)、炔胺2 (0.3 mmol)和铑催化剂[Rh(NBD)2]+BF4-(4.0 mg, 0.01 mmol)加入至10 mL的Schlenk反应管中.随后, 加入2 mL无水1, 2-二氯乙烷(DCE).加毕后, 将反应管在室温下搅拌, 薄层色谱(TLC)监测反应进程.待反应进行完全后, 浓缩, 并将反应液湿法上样经柱层析分离[硅胶, V(PE):V(CH2Cl2):V(EtOAc)=10:1:1]得到纯的2-氨基吡咯啉产物3.
(R)-1-对甲苯磺酰基-2-(N-苯基-N-对甲苯磺酰基)-氨基-4-异丙烯基-4, 5-二氢吡咯(3aa):白色固体, 产率85%, 98% ee. HPLC [AD-H, V(n-hexane):V(iso-propa-nol)=80:20, 0.8 mL/min, 254 nm]: t1=18.55 min, t2=19.60 min. m.p. 87.4~89.3 ℃; [α]D23+51.6 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.81 (d, J=8.0 Hz, 2H), 7.49 (d, J=8.4 Hz, 2H), 7.42~7.40 (m, 2H), 7.33~7.32 (m, 3H), 7.27 (d, J=8.8 Hz, 2H), 7.21 (d, J=8.0 Hz, 2H), 5.14 (d, J=2.8 Hz, 1H), 4.57~4.56 (m, 1H), 4.52 (s, 1H), 3.82 (dd, J=12.0, 10.0 Hz, 1H), 3.46 (dd, J=12.0, 7.6 Hz, 1H), 3.06~3.02 (m, 1H), 2.43 (s, 3H), 2.39 (s, 3H), 1.50 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 144.2, 144.0, 143.9, 139.8, 138.3, 135.3, 134.7, 129.4, 129.3, 128.8, 128.6, 128.42, 128.41, 128.1, 112.5, 111.7, 53.2, 45.4, 21.6, 20.1. HRMS (ESI) calcd for C27H28N2-NaO4S2 [M+Na+]: 531.1383, found 531.1386.
(R)-1-对甲苯磺酰基-2-(N-苄基-N-对甲苯磺酰基)-氨基-4-异丙烯基-4, 5-二氢吡咯(3ab):无色液体, 产率94%, 99% ee. HPLC[AD-H, V(n-hexane):V(iso-propa-nol)=70:30, 0.8 mL/min, 254 nm]: t1=12.17 min, t2=14.56 min. [α]D23+48.0 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.85 (d, J=8.4 Hz, 2H), 7.63 (d, J=8.4 Hz, 2H), 7.32 (d, J=8.0 Hz, 2H), 7.28~7.25 (m, 5H), 7.22 (d, J=8.4 Hz, 2H), 5.01 (d, J=2.4 Hz, 1H), 4.94 (d, J=15.2 Hz, 1H), 4.85 (d, J=15.2 Hz, 1H), 4.45 (s, 1H), 4.30 (s, 1H), 3.62 (dd, J=12.4, 9.2 Hz, 1H), 3.17~3.12 (m, 1H), 2.73~2.68 (m, 1H), 2.45 (s, 3H), 2.42 (s, 3H), 1.22 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 144.1, 143.6, 137.4, 136.7, 135.4, 134.6, 129.6, 129.5, 129.4, 128.6, 128.34, 128.31, 127.8, 114.3, 112.7, 53.2, 52.3, 45.7, 21.7, 19.6. HRMS (ESI) calcd for C28H30N2NaO4S2[M+Na+]: 545.1539, found 545.1551.
(R)-1-对甲苯磺酰基-2-(N-异丙基-N-对甲苯磺酰基)-氨基-4-异丙烯基-4, 5-二氢吡咯(3ac):白色固体, 产率89%, 99% ee. HPLC[AD-H, V(n-hexane):V(iso-propanol)=80:20, 0.8 mL/min, 254 nm]: t1=11.62 min, t2=12.55 min. m.p. 82.1~83.4 ℃; [α]D23+91.2 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 8.06 (d, J=8.0 Hz, 2H), 8.02 (d, J=8.4 Hz, 2H), 7.33 (d, J=8.0 Hz, 2H), 7.32 (d, J=7.6 Hz, 2H), 5.23 (s, 1H), 4.60 (s, 1H), 4.57 (s, 1H), 3.98~3.91 (m, 1H), 3.85 (dd, J=11.6, 10.0 Hz, 1H), 3.52 (dd, J=12.0, 8.4 Hz, 1H), 2.98~2.89 (m, 1H), 2.44 (s, 6H), 1.53 (s, 3H), 1.22 (bs, 6H); 13C NMR (100 MHz, CDCl3) δ: 144.0, 143.6, 136.3, 135.0, 129.6, 129.5, 128.8, 128.7, 112.7, 53.3, 52.2, 45.4, 21.6, 20.3. HRMS (ESI) calcd for C24H30N2NaO4S2[M+Na+]: 497.1539, found 497.1548.
(R)-1-对甲苯磺酰基-2-(N-正丁基-N-对甲苯磺酰基)-氨基-4-异丙烯基-4, 5-二氢吡咯(3ad):无色液体, 产率81%, 99% ee. HPLC[AD-H, V(n-hexane):V(iso-pro-panol)=80:20, 0.8 mL/min, 254 nm]: t1=11.51 min, t2=12.11 min. [α]D23+30.9 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.86 (d, J=8.4 Hz, 2H), 7.70 (d, J=8.0 Hz, 2H), 7.33 (d, J=8.0 Hz, 2H), 7.25 (d, J=8.0 Hz, 2H), 5.17 (d, J=2.4 Hz, 1H), 4.58 (s, 1H), 4.53 (s, 1H), 3.85 (dd, J=12.0, 9.6 Hz, 1H), 3.70~3.60 (m, 2H), 3.50 (dd, J=12.0, 8.0 Hz, 1H), 2.97~2.93 (m, 1H), 2.44 (s, 3H), 2.42 (s, 3H), 1.52 (s, 3H), 1.49~1.45 (m, 2H), 1.28~1.23 (m, 2H), 0.87 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 144.1, 144.0, 143.9, 138.0, 136.5, 134.7, 129.6, 129.5, 128.41, 128.37, 112.7, 112.5, 53.4, 48.7, 45.7, 29.6, 21.6, 20.1, 19.8, 13.8. HRMS (ESI) calcd for C25H32N2NaO4S2[M+Na+]: 511.1696, found 511.1698.
(R)-1-对甲苯磺酰基-2-(N-苄基-N-对硝基苯磺酰基)-氨基-4-异丙烯基-4, 5-二氢吡咯(3ae):白色固体, 产率79%, 99% ee. HPLC[AD-H, V(n-hexane):V(iso-pro-panol)=80:20, 0.8 mL/min, 254 nm]: t1=25.99 min, t2=35.95 min. m.p. 141.4~143.2 ℃; [α]D23+31.5 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 8.29 (d, J=8.8 Hz, 2H), 8.04 (d, J=8.8 Hz, 2H), 7.72 (d, J=8.4 Hz, 2H), 7.30~7.28 (m, 7H), 5.01 (d, J=1.6 Hz, 1H), 4.94 (d, J=15.2 Hz, 1H), 4.86 (d, J=14.8 Hz, 1H), 4.51 (s, 1H), 4.36 (s, 1H), 3.67 (dd, J=12.0, 9.6 Hz, 1H), 3.27~3.22 (m, 1H), 2.92~2.87 (m, 1H), 2.44 (s, 3H), 1.29 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 150.1, 145.5, 144.6, 143.3, 137.0, 134.9, 134.6, 129.7, 129.6, 129.3, 128.6, 128.3, 128.1, 124.0, 116.1, 112.9, 53.3, 53.0, 45.7, 21.7, 19.7. HRMS (ESI) calcd for C27H27N3NaO6S2[M+Na+]: 576.1233, found 576.1244.
(R)-1-对甲苯磺酰基-2-(N-苄基-N-甲磺酰基)-氨基-4-异丙烯基-4, 5-二氢吡咯(3af):无色液体, 产率89%, 99% ee. HPLC[AD-H, V(n-hexane):V(iso-propanol)=80:20, 0.8 mL/min, 254 nm]: t1=11.23 min, t2=12.79 min. [α]D23+114.4 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.87 (d, J=8.4 Hz, 2H), 7.42 (d, J=6.4 Hz, 2H), 7.36~7.28 (m, 5H), 5.01 (d, J=2.0 Hz, 1H), 4.83 (d, J=14.8 Hz, 1H), 4.74 (d, J=14.4 Hz, 1H), 4.49 (s, 1H), 4.32 (s, 1H), 3.70 (dd, J=12.4, 9.2 Hz, 1H), 3.25~3.20 (m, 1H), 3.14 (s, 3H), 2.81~2.76 (m, 1H), 2.45 (s, 3H), 1.24 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 144.5, 143.3, 136.8, 135.1, 134.5, 129.8, 129.3, 128.6, 128.2, 117.9, 112.8, 53.4, 51.7, 45.8, 41.2, 21.7, 19.6. HRMS (ESI) calcd for C22H26N2NaO4S2[M+Na+]: 469.1226, found 469.1233.
(R)-N-(2-(1-对甲苯磺酰基-4-异丙烯基)-4, 5-二氢吡咯基)-3-甲酸甲酯基-吲哚(3ag):白色固体, 产率17%, 98% ee. HPLC [IF, V(n-hexane):V(iso-propanol)=80:20, 0.8 mL/min, 254 nm]: t1=17.35 min, t2=20.09 min. m.p. 127.8~128.6 ℃; [α]D23+45.8 (c 0.25, CHCl3); 1H NMR (500 MHz, CDCl3) δ: 8.18 (d, J=8.0 Hz 1H), 8.02 (s, 1H), 7.39 (d, J=8.5 Hz, 3H), 7.31~7.23 (m, 2H), 7.14 (d, J=8.0 Hz, 2H), 5.35 (d, J=2.5 Hz, 1H), 4.74~4.71 (m, 1H), 4.64 (s, 1H), 4.31 (dd, J=12.5, 10.0 Hz, 1H), 3.95 (s, 3H), 3.86 (dd, J=12.5, 8.0 Hz, 1H), 3.37~3.33 (m, 1H), 2.40 (s, 3H), 1.68 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 164.9, 144.6, 143.8, 137.4, 136.6, 134.4, 133.2, 129.6, 127.9, 126.8, 123.6, 122.8, 121.9, 112.5, 111.6, 110.8, 109.6, 54.4, 51.2, 46.2, 21.6, 20.4.HRMS (ESI) calcd for C24H24N2NaO4S[M+Na+]: 459.1349, found 459.1353.
(S)-1-对甲苯磺酰基-2-(N-苯基-N-对甲苯磺酰基)-氨基-4-乙烯基-4, 5-二氢吡咯(3ba):白色固体, 产率81%. m.p. 112.2~113.4 ℃; [α]D23+82.5 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.84 (d, J=8.4 Hz, 2H), 7.51 (d, J=8.4 Hz, 2H), 7.41~7.39 (m, 2H), 7.33~7.29 (m, 5H), 7.21 (d, J=8.0 Hz, 2H), 5.30~5.22 (m, 1H), 5.17 (d, J=2.8 Hz, 1H), 4.87~4.81 (m, 2H), 3.82 (dd, J=12.0, 9.2 Hz, 1H), 3.36 (dd, J=12.4, 7.2 Hz, 1H), 3.04~2.97 (m, 1H), 2.43 (s, 3H), 2.40 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 144.3, 144.0, 139.9, 138.3, 137.3, 135.3, 134.6, 129.6, 129.4, 129.0, 128.7, 128.5, 128.3, 116.6, 112.1, 54.4, 42.7, 21.6. HRMS (ESI) calcd for C26H26N2NaO4S2[M+Na+]: 517.1226, found 517.1239.
(S)-1-对硝基苯磺酰基-2-(N-苯基-N-对甲苯磺酰基)-氨基-4-乙烯基-4, 5-二氢吡咯(3ca):黄色固体, 产率83%, 98% ee. HPLC[AD-H, V(n-hexane):V(iso-propa-nol)=60:40, 0.8 mL/min, 254 nm]: t1=15.41 min, t2=18.67 min. m.p. 73.4~75.6 ℃; [α]D23+67.0 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 8.35 (d, J=7.6 Hz, 2H), 8.20 (d, J=8.8 Hz, 2H), 7.44 (d, J=8.0 Hz, 2H), 7.41~7.34 (m, 5H), 7.22 (d, J=8.4 Hz, 2H), 5.41~5.33 (m, 1H), 5.14 (d, J=2.8 Hz, 1H), 4.90~4.83 (m, 2H), 3.89 (dd, J=15.2, 12.4 Hz, 1H), 3.49 (dd, J=8.8, 6.0 Hz, 1H), 3.17~3.11 (m, 1H), 2.40 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 150.4, 144.6, 143.4, 139.4, 138.0, 137.0, 135.0, 129.9, 129.5, 128.9, 128.6, 128.5, 128.3, 124.1, 117.2, 112.2, 54.4, 42.2, 21.6. HRMS (ESI) calcd for C25H23N3NaO6S2[M+Na+]: 548.0920, found 548.0927.
(S)-1-甲磺酰基-2-(N-苯基-N-对甲苯磺酰基)-氨基-4-乙烯基-4, 5-二氢吡咯(3da):白色固体, 产率84%, 88% ee. HPLC[AS-H, V(n-hexane):V(iso-propanol)=60:40, 0.8 mL/min, 254 nm]: t1=20.83 min, t2=25.50 min. m.p. 131.2~133.8 ℃; [α]D23+33.0 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.51 (d, J=8.4 Hz, 2H), 7.39~7.38 (m, 2H), 7.32~7.31 (m, 3H), 7.24 (d, J=8.0 Hz, 2H), 5.83~5.75 (m, 1H), 5.23~5.17 (m, 3H), 3.94 (dd, J=12.0, 10.0 Hz, 1H), 3.57 (dd, J=12.0, 6.0 Hz, 1H), 3.51~3.44 (m, 1H), 3.15 (s, 3H), 2.41 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 144.4, 139.8, 138.1, 137.9, 135.4, 129.5, 128.9, 128.8, 128.43, 128.37, 117.3, 111.8, 54.3, 42.1, 38.0, 21.6. HRMS (ESI) calcd for C20H22N2NaO4S2[M+Na+]: 441.0913, found 441.0930.
(R)-1-对甲苯磺酰基-2-(N-苯基-N-对甲苯磺酰基)-氨基-4-[2-(3-甲基-1-丁烯基)]-4, 5-二氢吡咯(3ea):无色液体, 产率97%, 91% ee. HPLC[AD-H, V(n-hexane):V(iso-propanol)=70:30, 0.8 mL/min, 254 nm]: t1=10.33 min, t2=14.36 min. [α]D23+32.6 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.82 (d, J=8.4 Hz, 2H), 7.49 (d, J=8.4 Hz, 2H), 7.43~7.41 (m, 2H), 7.34~7.32 (m, 3H), 7.27 (d, J=8.0 Hz, 2H), 7.20 (d, J=8.0 Hz, 2H), 5.12 (d, J=2.8 Hz, 1H), 4.60 (s, 1H), 4.52 (s, 1H), 3.88 (dd, J=11.6, 9.6 Hz, 1H), 3.38 (dd, J=12.0, 7.2 Hz, 1H), 3.03~2.98 (m, 1H), 2.42 (s, 3H), 2.39 (s, 3H), 2.04~1.96 (m, 1H), 0.87 (d, J=6.8 Hz, 3H), 0.87 (d, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 155.5, 144.2, 143.9, 139.7, 138.5, 135.4, 134.7, 129.5, 129.4, 128.9, 128.7, 128.6, 128.5, 128.2, 112.7, 109.6, 55.5, 42.5, 33.1, 22.0, 21.7, 21.6. HRMS (ESI) calcd for C29H32N2NaO4S2[M+Na+]: 559.1696, found 559.1701.
(R)-1-对甲苯磺酰基-2-(N-苯基-N-对甲苯磺酰基)-氨基-4-[2-(1-己烯基)]-4, 5-二氢吡咯(3fa):无色液体, 产率86%, 95% ee. HPLC [AD-H, V(n-hexane):V(iso-pro-panol)=80:20, 0.8 mL/min, 254 nm]: t1=13.53 min, t2=15.32 min. [α]D23+46.6 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.81 (d, J=8.0 Hz, 2H), 7.49 (d, J=8.4 Hz, 2H), 7.43~7.41 (m, 2H), 7.33~7.32 (m, 3H), 7.27 (d, J=8.0 Hz, 2H), 7.20 (d, J=8.0 Hz, 2H), 5.13 (d, J=2.8 Hz, 1H), 4.53 (s, 2H), 3.84 (dd, J=12.0, 10.0 Hz, 1H), 3.42 (dd, J=11.6, 6.8 Hz, 1H), 3.02~2.97 (m, 1H), 2.42 (s, 3H), 2.39 (s, 3H), 1.76~1.70 (m, 2H), 1.25~1.21 (m, 4H), 0.88~0.84 (m, 3H); 13C NMR (100 MHz, CDCl3) δ: 148.7, 144.2, 143.9, 139.7, 138.4, 135.4, 134.7, 129.5, 129.4, 128.9, 128.7, 128.5, 128.4, 128.2, 112.0, 111.1, 54.1, 44.3, 34.0, 29.7, 22.4, 21.6, 14.0. HRMS (ESI) calcd for C30H34N2NaO4S2 [M+Na+]: 573.1852, found 573.1856.
(R)-1-对甲苯磺酰基-2-(N-苯基-N-对甲苯磺酰基)-氨基-4-(2-苯乙烯基)-4, 5-二氢吡咯(3ga):白色固体, 产率81%, 99% ee. HPLC [AD-H, V(n-hexane):V(iso-pro-panol)=60:40, 0.8 mL/min, 254 nm]: t1=11.86 min, t2=21.69 min. m.p. 85.2~87.4 ℃; [α]D23-16.7 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.79 (d, J=8.0 Hz, 2H), 7.50 (d, J=8.4 Hz, 2H), 7.45~7.43 (m, 2H), 7.35~7.32 (m, 3H), 7.29~7.25 (m, 5H), 7.20 (d, J=8.0 Hz, 2H), 7.09~7.06 (m, 2H), 5.26 (d, J=2.8 Hz, 1H), 5.06 (s, 1H), 4.80 (s, 1H), 3.88 (dd, J=12.0, 10.0 Hz, 1H), 3.62~3.58 (m, 1H), 3.44 (dd, J=12.0, 5.6 Hz, 1H), 2.46 (s, 3H), 2.39 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 147.9, 144.3, 143.9, 140.1, 139.4, 138.4, 135.4, 134.8, 129.5, 129.4, 128.9, 128.73, 128.68, 128.50, 128.46, 128.3, 127.9, 126.1, 114.4, 110.8, 54.6, 42.5, 21.7, 21.6. HRMS (ESI) calcd for C32H30N2NaO4S2[M+Na+]: 593.1539, found 593.1543.
(R, E)-1-对甲苯磺酰基-2-(N-苯基-N-对甲苯磺酰基)-氨基-4-丙烯酸乙酯基-4, 5-二氢吡咯(3ha):无色液体, 产率31%, 86% ee. HPLC [IF, V(n-hexane):V(iso-propanol)=60:40, 0.8 mL/min, 254 nm]: t1=26.69 min, t2=29.55 min. [α]D23-94.8 (c 1.0, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.85 (d, J=8.4 Hz, 2H), 7.51 (d, J=8.4 Hz, 2H), 7.41~7.38 (m, 2H), 7.34~7.33 (m, 3H), 7.31 (d, J=8.0 Hz, 2H), 7.23 (d, J=8.0 Hz, 2H), 6.34 (dd, J=15.6, 7.2 Hz, 1H), 5.55 (dd, J=15.6, 1.2 Hz, 1H), 5.18 (d, J=2.4 Hz, 1H), 4.21~4.10 (m, 2H), 3.86 (dd, J=12.4, 9.2 Hz, 1H), 3.43 (dd, J=12.0, 6.4 Hz, 1H), 3.16~3.10 (m, 1H), 2.43 (s, 3H), 2.41 (s, 3H), 1.28 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 165.7, 146.0, 144.4, 141.0, 138.1, 135.1, 134.0, 129.7, 129.4, 129.0, 128.8, 128.47, 128.45, 128.4, 122.8, 109.4, 60.5, 53.4, 41.1, 21.6, 14.2. HRMS (ESI) calcd for C29H30N2NaO6S2[M+Na+]: 589.1437, found 589.1442.
辅助材料(Supporting Information) 产物3的核磁共振谱图, HPLC谱图以及(R)-3aa的单晶结构.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Feng, J. -J. ; Zhang, J. ACS Catal. 2016, 6, 6651. (b) Vo, C. -V. T. ; Bode, J. W. J. Org. Chem. 2014, 79, 2809. (c) He, L. ; Gu, M. ; Wang, D. ; Zhao, L. ; Wang, M. Acta Chim. Sinica 2015, 73, 1018 (in Chinese). (何玲, 顾梦迪, 王德先, 赵亮, 王梅祥, 化学学报, 2015, 73, 1018. )
-
[2]
(a) Cheng, M.; Li, Q.; Lin, B.; Sha, Y.; Ren, J.; He, Y.; Wang, Q.; Hua, H.; Ruud, K. Tetrahedron: Asymmetry 2006, 17, 179. (b) Bugni, T. S.; Woolery, M.; Kauffman, C. A.; Jensen, P. P.; Fenical, W. J. Nat. Prod. 2006, 69, 1626. (c) Fu, P.; La, S.; MacMillan, J. B. J. Nat. Prod. 2016, 79, 455. (d) Fu, P.; Legako, A.; La, S.; MacMillan, J. B. Chem. Eur. J. 2016, 22, 3491.
-
[3]
(a) Zhou, A.-H.; He, Q.; Shu, C.; Yu, Y.-F.; Liu, S.; Zhao T.; Zhang, W.; Lu, X.; Ye, L.-W. Chem. Sci. 2015, 6, 1265. (b) Xiao, X.-Y.; Zhou, A.-H.; Shu, C.; Pan, F.; Li T.; Ye, L.-W. Chem. Asian J. 2015, 10, 1854. (c) Yu, W.; Chen, W.; Liu, S.; Shao, J.; Shao, Z.; Lin, H.; Yu, Y. Tetrahedron 2013, 69, 1953. (d) Wang, W.; Xu, X.-P; Wang, S.-Y.; Zhou, W.; Ji, S.-J. Org. Lett. 2013, 15, 4246. (e) Qi, X.; Xiang, H.; He, Q.; Yang, C. Org. Lett. 2014, 16, 4186. (f) Fontaine, P.; Masson, G.; Zhu, J. Org. Lett. 2009, 11, 1555.
-
[4]
(a) Ghorai, M. K.; Tiwari, D. P. J. Org. Chem. 2013, 78, 2617. (b) Tsuge, O.; Hatta, T.; Tashiro, H.; Kakura, Y.; Maeda, H.; Kakehi, A. Tetrahedron 2000, 56, 7723. (c) Nestorak, I. Y.; Tverdokhlebov, A. V.; Tolmachev, A. A.; Volovenko, Y. M. Heterocycles 2010, 81, 611. (d) Duvall, J. R.; Wu, F.; Snider, B. B. J. Org. Chem. 2006, 71, 8579. (e) Stevens, K.; Tyrrell, A. J.; Skerratt, S.; Robertson, J. Org. Lett. 2011, 13, 5964.
-
[5]
(a) Carson, C. A. ; Kerr, M. A. Chem. Soc. Rev. 2009, 38, 3051. (b) Lu, B. -L. ; Dai, L. ; Shi, M. Chem. Soc. Rev. 2012, 41, 3318. (c) Jiao, L. ; Yu, Z. -X. J. Org. Chem. 2013, 78, 6842. (d) Wang, Y. ; Yu, Z. -X. Acc. Chem. Res. 2015, 48, 2288. (e) He, J. ; Ling, J. ; Chiu, P. Chem. Rev. 2014, 114, 8037. (f) Ohno, H. Chem. Rev. 2014, 114, 7784. (g) Wang, Q. ; Chang, H. ; Wei, W. ; Liu, Q. ; Gao, W. ; Li, Y. ; Li, X. Chin. J. Org. Chem. 2016, 36, 939 (in Chinese). (王清宇, 常宏宏, 魏文珑, 刘强, 高文超, 李彦威, 李兴, 有机化学, 2016, 36, 939. ) (h) Chen, W. ; Yang, D. Chin. J. Org. Chem. 2016, 36, 2075 (in Chinese). (陈文坤, 杨定乔, 有机化学, 2016, 36, 2075. ) (i) Li, D. ; Wu, Y. ; Chang, H. ; Gao, W. ; Wei, W. ; Li, X. Chin. J. Org. Chem. 2016, 36, 1994 (in Chinese). (李东君, 武彦芳, 常宏宏, 高文超, 魏文珑, 李兴, 有机化学, 2016, 36, 1994. ) (j) Cheng, G. ; Yang, D. Chin. J. Org. Chem. 2015, 35, 2023 (in Chinese). (程果, 杨定乔, 有机化学, 2015, 35, 2023. ) (k) Yang, L. ; Ma, J. Acta Chim. Sinica 2016, 74, 130 (in Chinese). (杨丽军, 马军安, 化学学报, 2016, 74, 130. ) (l) Lu, L. ; Yan, C. Chin. J. Chem. 2015, 33, 1178. (m) Sun, J. ; Yan, C. Chin. J. Chem. 2015, 33, 1049.
-
[6]
(a) Wang, X.-N.; Yeom, H.-S.; Fang, L.-C.; He, S.; Ma, Z.-X.; Kedrowski, B. L.; Hsung, R. P. Acc. Chem. Res. 2014, 47, 560. (b) Evano, G.; Coste, A.; Jouvin, K. Angew. Chem., Int. Ed. 2010, 49, 2840. (c) DeKorver, K. A.; Li, H.; Lohse, A. G.; Hayashi, R.; Lu, Z.; Zhang, Y.; Hsung, R. P. Chem. Rev. 2010, 110, 5064. (d) Pawar, S. K.; Vasu, D.; Liu, R.-S. Adv. Synth. Catal. 2014, 356, 2411. (e) Singh, R. K. R.; Pawar, S. K.; Huang, M.-J.; Liu, R.-S. Chem. Commun. 2016, 52, 11434. (f) Liu, J.; Chen, M.; Zhang, L.; Liu, Y. Chem. Eur. J. 2015, 21, 1009.
-
[7]
(a) Mackay, W. D.; Fistikci, M.; Carris, R. M.; Johnson, J. S. Org. Lett. 2014, 16, 1626. (b) Movassaghi, M.; Jacobsen, E. N. J. Am. Chem., Soc. 2002, 124, 2456. (c) Karad, S. N.; Bhunia, S.; Liu, R.-S. Angew. Chem., Int. Ed. 2012, 51, 8722.
-
[8]
(a) Feng, J.-J.; Lin, T.-Y.; Zhu, C.-Z.; Wang, H.; Wu, H.-H.; Zhang, J. J. Am. Chem. Soc. 2016, 138, 2178. (b) Lin, T.-Y.; Zhu, C.-Z.; Zhang, P.; Wang, Y.; Wu, H.-H.; Feng, J.-J.; Zhang, J. Angew. Chem., Int. Ed. 2016, 55, 10844. (c) Zhu, C.-Z.; Feng, J.-J.; Zhang, J. Angew. Chem., Int. Ed. 2017, 56, 1351. (d) Feng, J.-J.; Lin, T.-Y.; Zhu, C.-Z.; Wang, H.; Wu, H.-H.; Zhang, J. J. Am. Chem. Soc. 2015, 137, 3787. (e) Feng, J.-J.; Lin, T.-Y.; Wu, H.-H.; Zhang, J. Angew. Chem., Int. Ed. 2015, 54, 15854.
-
[9]
(a) Wender, P. A.; Strand, D. J. Am. Chem. Soc. 2009, 131, 7528. (b) Fan, J.; Gao, L.; Wang, Z. Chem. Commun. 2009, 5021. (c) Xu, C.-F.; Zheng, B.-H.; Suo, J.-J.; Ding, C.-H.; Hou, X.-L. Angew. Chem., Int. Ed. 2015, 54, 1604. (d) Hou, X.-L.; Wu, J.; Fan, R.-H.; Ding, C.-H.; Luo, Z.-B.; Dai, L.-X. Synlett 2006, 181.
-
[10]
Zhang, X. Zou, H. Huang, G. ChemCatChem 2016, 8, 2549. doi: 10.1002/cctc.201600349
-
[11]
(a) Wender, P. A.; Williams, T. J. Angew. Chem., Int. Ed. 2002, 41, 4550. (b) Mansfield, S. J.; Campbell, C. D.; Jones, M. W.; Anderson, E. A. Chem. Commun. 2015, 51, 3316.
-
[1]
-
表 1 反应条件的优化a
Table 1. Optimization of reaction conditions

Entry Catalyst Temp./℃ Time/h Coversion/% Yieldb/% ee/% 1 AgSbF6 25 5 5 — — 2 FeCl3 80 5 42 — — 3 Sc(OTf)3 25 5 35 — — 4 [Rh(CO)2Cl]2 80 5 26 — — 5 Rh(PPh3)Cl/AgSbF6 80 5 25 — — 6 [Rh(NBD)dppe]+BF4- 80 5 0 — — 7 [Rh(η6-C10H8)(COD)]+SbF6- 25 17 22 — — 8 [Rh(NBD)2]+BF4- 25 0.25 100 92 98 a反应条件: (R)-1a (0.1 mmol), 2a (0.15 mmol), 催化剂(5 mol%), 溶剂DCE (1.5 mL), 室温(25 ℃); b核磁收率. 表 2 炔胺底物的拓展a
Table 2. Exploration of the substrate scope with respect to various ynamides

表 3 烯基氮杂环丙烷底物的拓展a
Table 3. Exploration of the substrate scope with respect to various vinylaziridines

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 6
- 文章访问数: 1810
- HTML全文浏览量: 966


 下载:
下载:


 下载:
下载:

