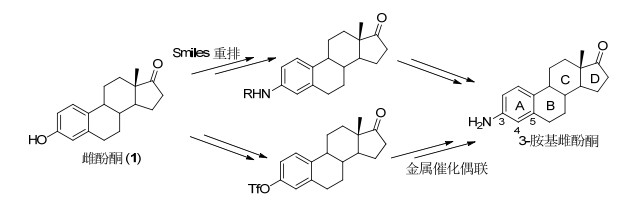
 图 图式 1
从雌酚酮合成3-胺基雌激素
Figure 图式 1.
Synthesis of 3-aminoestrogens from estrone
图 图式 1
从雌酚酮合成3-胺基雌激素
Figure 图式 1.
Synthesis of 3-aminoestrogens from estrone

Citation: Xie Xiantao, Jin Yu, Xu Sheng, Ding Kai. Efficient Synthesis of 6-Substitued-3-aminoestrogens[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 767-772. doi: 10.6023/cjoc201610005

6-取代-3-胺基雌激素的高效合成
English
Efficient Synthesis of 6-Substitued-3-aminoestrogens
-
Key words:
- estrogen
- / enamination
- / aromatization
- / intramolecular nucleophilic addition
-
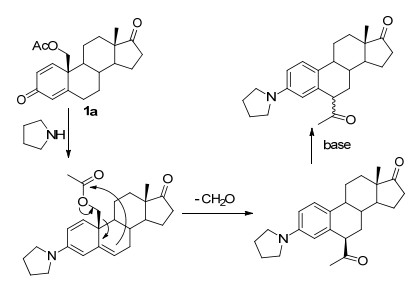
甾体雌激素类药物具有广泛的生理活性和药用价值, 长期吸引了药物化学家以其为基础进行药物设计.大多数雌激素药物A环为芳香化的六元碳环, 3位上有一个酚羟基. 3-胺基雌激素是它们的生物电子等排体, 作为潜在的甾体雌激素药物已被用于治疗前列腺癌、乳腺癌的研究[1].从易得的起始原料高效、快速、结构多样性地合成这类化合物是深入进行药物化学研究的前提.目前3-胺基雌激素合成一般都使用雌酚酮作为原料 (Scheme 1)[2].如通过分子内的Smiles反应[2a~2d]或使用钯催化C—N偶联反应[2e~2g]导入3位的胺基.但这些方法存在产率低、路线长、底物适用面较窄的问题, 难以快速构建化合物库.
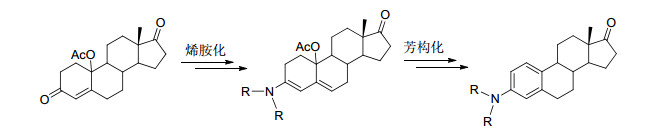
使用具有4-烯-3-酮结构的甾体化合物为原料, 通过烯胺化后再芳构化的策略也可合成3-胺基雌激素 (Scheme 2), 20世纪50~60年代就有相关例子报道[3].该策略中使用的起始物比雌酚酮容易衍生化, 非常适合多样性合成, 但由于原料未商品化, 合成困难, 限制了这一策略的应用.
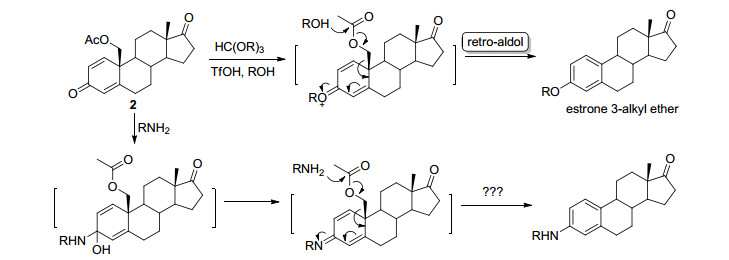
19-羟基-4-烯-3, 17-二酮雄甾是一种商品化的甾体中间体, 我们发展了以此化合物为原料, 通过retro-aldol后期芳构化策略合成甾体雌激素的一种方法[4].由于A环的4-烯3-酮结构非常容易衍生化, 可快速合成结构多样性的甾体雌激素.最近, 我们使用原甲酸酯作为烯醇化试剂, 一步合成了3位醚化的雌激素[4b].设想如果在芳构化前发生烯胺化, 有可能一步获得3位胺化的雌激素 (Scheme 3).
1 结果与讨论
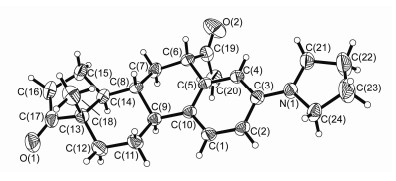
我们按先前报道的方法合成了底物二烯酮2[4].在一些常规的烯胺化条件下[3]测试了伯胺与二烯酮2的反应, 但是遗憾的是产物为雌酚酮1.显然, 小位阻的伯胺进攻19位酯基而不是3位羰基, 导致在烯胺化前直接发生了retro-aldol芳构化反应.改用位阻较大的仲胺, 当用甲醇作溶剂时, 获得了少量胺化物3, 但主产物仍是雌酚酮1(表 1, Entry 1).使用更为稳定的酯基保护19位羟基时, 反应明显变慢, 胺化物3的产率没有明显提高, 仍有大量雌酚酮形成 (Entry 2).我们猜想甲醇在碱性条件下形成小位阻的亲核试剂, 导致在烯胺化前发生芳构化, 改用无亲核能力的惰性溶剂有可能避免这一问题.苯和二氧六环作溶剂时, 反应速度明显变慢, 但对反应选择性没有太大影响 (Entries 3, 4).意外的是, 使用二甲基亚砜 (DMSO) 为溶剂时, 主要形成一个未知产物 (Entry 5), 核磁分析显示是一对异构体的混合物, 分子的A环发生了芳构化, 且具有吡咯烷的结构, 但是仍然存在一个甲基酮结构.尽管这对异构体无法通过柱层析分离, 通过重结晶幸运地获得了其中一个异构体的纯品4a, 通过单晶衍射 (图 1), 确认为6位连接一个乙酰基的3-胺基产物.此异构体在室温中性条件下稳定, 可长期保存而不发生差向异构化.进一步的研究发现, 使用大位阻的醇为溶剂, 也可以得到这一产物, 而且反应速度更快 (Entries 6, 7).经过反应优化, 以70%的产率获得6-乙酰基-3-胺基雌酮 (4, Entry 8).也尝试使用其他一些仲胺, 如二乙胺、甲基苯胺、二烯丙基胺等, 但在此条件下仅回收原料, 说明胺的位阻对反应至关重要, 太小会直接生成雌酚酮, 太大又无法发生烯胺化反应.

Entry 吡咯烷/equiv. 溶剂 温度/℃ 时间/h 产率/% 转化率b/% 1 3 4 1 2 MeOH 60 4 60 26 — 100 2 2c MeOH 60 20 24 31 98 3 2 Benzene 80 16 21 25 — 50 4 2 Dioxane 100 12 — 8 7 40 5 2 DMSO 100 12 — 8 44 55 6 2 EtOH 80 7 8 14 29 95 7 16 i-PrOH 80 16 — 10 63 100 8 4 i-PrOH 100 25 — — 70 100 a原料 (0.5 mmol), 溶剂 (5 mL); b分离收率; c19位羟基保护基为三甲基乙酰基 (Piv). 表 1 反应条件优化a
Table 1. 1 Optimization of reaction conditions以上结果说明, 除了前面假设的协同的retro-aldol芳构化机理[4], 在有竞争性反应存在下, 芳构化也可分步进行.可能的机理如下, 在惰性溶剂中, 3位羰基与胺反应形成烯胺[5a], 然后发生分子内的亲核加成, 导致19位酯基保护基转移到6位[5b], 同时发生芳构化反应.这个分子内的加成反应是立体专一性的, 但是由于芳环和羰基共同的活化作用, 6位极易发生异构化, 在过量碱的存在下, 最终得到异构体的混合物 (Scheme 4).
在甾体的6位导入取代基, 可显著改变甾体药物的活性.常见的6位取代的甾体药物有抗癌药exemestane (依西美坦) 和避孕药megestrol (甲地孕酮).合成可通过Vilsmeier反应或Mannich反应在C-6位引入次甲基, 再进一步转化获得[6].但这些方法一般多用于甲基的导入, 通用性不强.上述方法如果具有普适性, 对反应底物19位保护基进行简单的替换就可以导入各种结构的6位取代基, 对这些取代基进行简单的衍生化就可快速建立一个3-胺基-6取代的雌激素库.为此我们合成了一系列19位不同酯基保护的底物, 考察了反应的普适性 (表 2).

Entry Compd. R t/h Yieldb/% (Conv./%) 1 1a Ac 8 70 2 1b CHO 20 — 3 1c C2H5CO 22 52 4 1d CH3(CH2)2CO 22 50 5 1e (CH3)2CHCO 22 51 6 1f CH3(CH2)3CO 22 59 7 1g (CH3)2CHCH2CO 22 52 8 1h CH3(CH2)8CO 22 59 9 1i Piv 22 0 (41) 10 1j CH2=CHCO 22 — 11 1k PhCH=CHCO 22 — 12 1l MeOCO 7 48 13 1m Bz 32 40 14 1n 1-Naphthoyl 22 25 (87) aSubstrate (0.5 mmol), pyrrolidine (2 mmol), i-PrOH (5 mL), 100 ℃; bisolated yield. 表 2 反应底物拓展a
Table 2. Scope of the substrates甲酰基非常容易脱除, 主要得到雌酚酮 (Entry 1).其它的脂肪酯基获得的结果与乙酰基类似 (Entries 3~8), 形成了对应的C-6取代产物, 且产率接近.当取代基为特戊酰基时 (Entry 9), 反应22 h仍未转化完全, 且无6-取代产物形成, 可能由于位阻过大, 难以发生分子内亲核取代所致.当保护基是烯基酯时 (Entries 10, 11), 原料完全消失, 但是没有分离得到目标产物, 只获得少量无法鉴别的混合物, 可能是由于丙烯酸酯引发的副反应所致.保护基是碳酸酯时 (Entry 12), 反应也可顺利发生, 得到6位增加一个碳原子的产物.使用芳基酯保护基时 (Entries 13, 14), 同样获得了目标产物, 但是由于芳基对羰基的钝化作用, 反应进行较慢, 且产率较低.
2 结论
提供了一种以19羟基甾体化合物为原料, 通过后期芳构化策略高效合成6-酰基-3-胺基雌激素的方法.该方法操作简单, 原料易得, 一步可在3位引入胺基和6位引入酰基.值得一提的是, 简单改变19位的保护基团就可以快速地合成多种6位取代的产物, 为这类具有生理活性的甾体化合物的多样化合成提供了有效的途径.以此工作为基础, 后继的衍生化和生物活性测试正在进行中.
3 实验部分
3.1 仪器与试剂
1H NMR和13C NMR由Bruker-AM 400型或Bruker-AM 300型核磁共振仪测定, 若无特别注明, 均以CDCl3作溶剂, TMS为内标; ESI-LRMS采用美国Agilent 1100LCMSD SL液相色谱-质谱联用仪和Agilent 1200/G6100A液质联用仪测定; ESI-HRMS使用Bruker Daltonics FTMS-7质谱仪进行测定.
原料19-羟基雄甾-4-烯-3, 17-二酮由浙江仙琚制药有限公司提供提供. 1, 4-二烯-3酮化合物1a~1o按文献[4]报道的方法合成.试剂均经纯化.薄层色谱 (TLC) 采用GF254高效板, 显色剂为紫外灯照射、碘缸显色或10%磷钼酸乙醇溶液; 柱层析用硅胶H (200~300目) 作为固定相.
3.2 取代-3-胺基雌酚酮3, 4a~4o的合成
0.5 mmol化合物溶于5 mL无水溶剂中, 氩气保护下, 加入无水吡咯烷 (1.7 mL, 2 mmol), 100 ℃搅拌, 薄层色谱 (TLC) 监测反应, 反应结束后减压除去溶剂, 剩余物直接柱层析分离得到产品.
3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (3): m.p. 162~163 ℃; [α]d25+55.6 (c0.5, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.16 (d, J=8.5 Hz, 1H), 6.43 (dd, J=8.4, 2.2 Hz, 1H), 6.33 (s, 1H), 3.26 (t, J=6.4 Hz, 4H), 2.89 (d, J=5.1 Hz, 2H), 0.90 (s, 3H); 13C NMR (101 MHz, CDCl3) δ: 221.3, 146.3, 137.0, 126.8, 126.0, 111.8, 109.8, 77.3, 77.0, 76.7, 50.4, 48.1, 47.7, 43.9, 38.7, 35.9, 31.6, 29.9, 26.8, 26.0, 25.4, 21.6, 13.9; ESI-HRMS calcd for C22H30NO 324.2322, found 324.2320.
6-乙酰基-3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (4a): 3:7混合物, 浅绿色固体; 1H NMR (400 MHz, CDCl3) δ: 7.21 (d, J=8.6 Hz, 1H), 6.51 (dd, J=8.5, 2.1 Hz, 1H), 6.20 (d, J=2.2 Hz, 0.3H), 6.17 (d, J=2.0 Hz, 0.7H), 3.93 (t, J=8.5 Hz, 0.7H), 3.86 (d, J=5.6 Hz, 0.3H), 3.24~3.21 (m, 4H), 0.90 (s, 0.9H), 0.88 (s, 2.1H); ESI-HRMS calcd for C24H32NO2 366.2428, found 366.2420.
4a:6-α-异构体, 无色晶体. m.p. 157~158 ℃; [α]D25+222.5 (c1.00, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.21 (d, J=8.6 Hz, 1H), 6.50 (dd, J=8.6, 2.5 Hz, 1H), 6.16 (d, J=2.3 Hz, 1H), 3.92 (t, J=8.6 Hz, 1H), 3.23 (t, J=6.5 Hz, 4H), 2.03 (s, 3H), 0.88 (s, 3H); 13C NMR (101 MHz, CDCl3) δ: 220.6, 211.0, 146.5, 133.4, 127.0, 126.4, 111.2, 111.1, 77.4, 77.0, 76.7, 55.5, 50.3, 48.0, 47.7, 43.0, 37.4, 35.8, 31.3, 29.7, 26.0, 25.8, 25.4, 21.6, 13.7.
6-丙酰基-3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (4c): 3:7混合物, 浅绿色固体; 1H NMR (400 MHz, CDCl3) δ: 7.20 (d, J=8.6 Hz, 1H), 6.49 (dd, J=8.6, 2.2 Hz, 1H), 6.19 (d, J=2.4 Hz, 0.3H), 6.14 (d, J=2.3 Hz, 0.7H), 3.96 (t, J=8.5 Hz, 0.7H), 3.87 (d, J=6.6 Hz, 0.3H), 3.31~3.14 (m, 4H), 1.07 (t, J=7.2 Hz, 0.9H), 1.01 (t, J=7.3 Hz, 2.1H), 0.90 (s, 0.9H), 0.88 (s, 2.1H); ESI-HRMS calcd for C25H34NO2 380.2584, found 380.2582.
6-丁酰基-3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (4d): 3:7混合物, 浅绿色固体; 1H NMR (400 MHz, CDCl3) δ: 7.20 (d, J=8.6 Hz, 1H), 6.50 (dd, J=8.5, 2.0 Hz, 1H), 6.17 (d, J=2.2 Hz, 0.3H), 6.15 (d, J=2.1 Hz, 0.7H), 3.95 (t, J=8.3 Hz, 0.7H), 3.87 (d, J=6.4 Hz, 0.3H), 3.30~3.15 (m, 4H), 0.93~0.83 (m, 6H); ESI-HRMS calcd for C26H36NO2 394.2741, found 394.2737.
6-异丁酰基-3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (4e): 3:7混合物, 浅绿色固体; 1H NMR (400 MHz, CDCl3) δ: 7.19 (d, J=8.5 Hz, 1H), 6.48 (dd, J=8.5, 2.1 Hz, 1H), 6.15 (d, J=2.1 Hz, 0.7H), 6.13 (d, J=2.2 Hz, 0.3H), 4.09~4.04 (m, 1H), 3.30~3.13 (m, 4H), 1.97 (s, 6H), 1.16 (d, J=6.9 Hz, 0.9H), 1.15 (dd, J=9.9, 6.8 Hz, 2H), 1.07 (dd, J=12.5, 6.8 Hz, 4H), 1.05 (d, J=6.7 Hz, 2.1H), 0.90 (s, 0.9H), 0.88 (s, 2.1H); ESI-HRMS calcd for C26H36NO2 394.2741, found 394.2740.
6-戊酰基-3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (4f): 3:7混合物, 浅绿色固体; 1H NMR (400 MHz, CDCl3) δ: 7.20 (d, J=8.6 Hz, 1H), 6.49 (dd, J=8.5, 2.2 Hz, 1H), 6.17 (d, J=2.4 Hz, 0.3H), 6.14 (d, J=2.3 Hz, 0.7H), 3.95 (t, J=8.4 Hz, 0.7H), 3.87 (d, J=6.5 Hz, 0.3H), 3.31~3.14 (m, 4H), 0.96~0.80 (m, 6H); ESI-HRMS calcd for C27H38NO2 408.2897, found 408.2894.
6-异戊酰基-3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (4g): 3:7混合物, 浅绿色固体; 1H NMR (400 MHz, CDCl3) δ: 7.11 (d, J=8.6 Hz, 1H), 6.41 (dd, J=8.5, 2.0 Hz, 1H), 6.07 (d, J=2.4 Hz, 1H), 3.86 (t, J=8.3 Hz, 0.7H), 3.78 (d, J=6.4 Hz, 0.3H), 3.33~3.07 (m, 4H), 0.88~0.70 (m, 9H); ESI-HRMS calcd for C27H38NO2 408.2897, found 408.2893.
6-癸酰基-3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (4h): 3:7混合物, 浅绿色固体; 1H NMR (400 MHz, CDCl3) δ: 7.20 (d, J=8.6 Hz, 1H), 6.49 (dd, J=8.5, 1.9 Hz, 1H), 6.17 (d, J=2.3 Hz, 0.3H), 6.14 (d, J=2.3 Hz, 0.7H), 3.95 (t, J=8.4 Hz, 0.7H), 3.87 (d, J=6.4 Hz, 0.3H), 3.31~3.15 (m, 4H), 1.33~1.13 (m, 12H), 0.94~0.82 (m, 6H); ESI-HRMS calcd for C32H48NO2 478.3880, found 478.3668.
6-甲氧酰基-3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (4l): 1:1混合物, 浅绿色固体; 1H NMR (400 MHz, CDCl3) δ: 7.18 (t, J=8.0 Hz, 1H), 6.55~6.44 (m, 2H), 6.36 (s, 0.5H), 4.00 (dd, J=10.8, 7.0 Hz, 0.5H), 3.89 (d, J=6.4 Hz, 0.5H), 3.73 (s, 1.5H), 3.71 (s, 1.5H), 3.32~3.15 (m, 4H), 0.92 (s, 1.5H), 0.88 (s, 1.5H); ESI-HRMS calcd for C24H32NO3 382.2377, found 382.2370.
6-苯甲酰基-3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (4m): 1:2混合物, 浅绿色固体; 1H NMR (400 MHz, CDCl3) δ: 8.10~8.01 (m, 0.66H), 7.90 (d, J=7.3 Hz, 1.33H), 7.62 (t, J=7.4 Hz, 0.33H), 7.53 (dt, J=7.3, 2.4 Hz, 1.33H), 7.43 (t, J=7.6 Hz, 1.33H), 7.25~7.19 (m, 1H), 6.49 (td, J=8.4, 2.5 Hz, 1H), 6.13 (d, J=2.2 Hz, 0.66H), 6.08 (d, J=2.4 Hz, 0.33H), 4.92 (d, J=7.0 Hz, 0.33H), 4.79 (dd, J=10.6, 7.0 Hz, 0.66H), 3.20~3.05 (m, 4H), 0.91 (s, 2.0H), 0.89 (s, 1.0H); ESI-HRMS calcd for C29H34NO2 428. 2584, found 428. 2577.
6-萘甲酰基-3-四氢吡咯基-1, 3, 5(10)-三烯-17-酮-雌甾 (4n): 1:1混合物, 浅绿色固体; 1H NMR (400 MHz, CDCl3) δ: 8.41~8.30 (m, 0.5H), 8.23~8.14 (m, 0.5H), 7.97 (dd, J=8.2, 2.5 Hz, 1H), 7.93~7.85 (m, 1H), 7.74 (t, J=7.0 Hz, 1H), 7.61~7.43 (m, 3H), 7.25~7.19 (m, 1H), 6.53 (dd, J=8.6, 2.5 Hz, 0.5H), 6.48 (dd, J=8.6, 2.4 Hz, 0.5H), 6.29~6.20 (m, 1H), 4.89 (dd, J=10.6, 7.2 Hz, 0.5H), 4.75 (d, J=6.9 Hz, 0.5H), 3.23~2.96 (m, 4H), 0.88 (s, 1.5H), 0.81 (s, 1.5H); ESI-HRMS calcd for C33H36NO2 478.2735, found 478.2741.
辅助材料 (Supporting Information)化合物3, 4a~4n的核磁共振图谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
(a) Singh, S. M.; Gauthier, S.; Labrie, F. Curr. Med. Chem. 2000, 7 (2), 211.
(b) Labrie, F.; Belanger, A.; Cusan, L.; Labrie, C.; Simard, J.; LuuThe, V.; Diamond, P.; Gomez, J. L.; Candas, B. Endocr.-Relat. Cancer1996, 3, 243. -
[2]
(a) Njar, V. C. O. Synthesis2000, 2019.
(b) Weidner, J. J.; Weintraub, P. M.; Schnettler, R. A.; Peet, N. P. Tetrahedron1997, 53, 6303.
(c) Coutts, I. G. C.; Southcott, M. R., J. Chem. Soc., Perkin. Trans. 11990, 767.
(d) Scherrer, R. A.; Beatty, H. R. J. Org. Chem. 1972, 37, 1681.
(e) Schon, U.; Messinger, J.; Buchholz, M.; Reinecker, U.; Thole, H.; Prabhu, M. K. S.; Konda, A. Tetrahedron Lett. 2005, 46, 7111.
(f) Zhang, X. Q.; Sui, Z. Tetrahedron Lett. 2003, 44, 3071.
(g) Radu, I. I.; Poirier, D.; Provencher, L. Tetrahedron Lett. 2002, 43, 7617. -
[3]
(a) Alvarez, F. S.; Ruiz, A. B. J. Org. Chem. 1965, 30, 2047.
(b) Gold, A. M.; Schwenk, E. J. Am. Chem. Soc. 1959, 81, 2198. -
[4]
(a) Jing, Y.; Xu, C.-G.; Ding, K.; Lin, J.-R.; Jin, R.-H.; Tian, W.-S. Tetrahedron Lett. 2010, 51, 3242.
(b) Zheng, D.-Q.; Jing, Y.; Zheng, B.-Y.; Ye, Y.-F.; Xu, S.; Tian, W.-S.; Ma, H.-Y.; Ding, K. Tetrahedron2016, 72, 2164.
(c) Yue, T.; Li, H.-P.; Ding, K. Tetrahedron Lett. 2016, 57, 4850. -
[5]
(a) Carey, F. A.; Sundberg, R. J. In Advanced Organic Chemistry, Part A: Structure and Mechanisms, 5th ed., Springer, New York, 2007, pp. 653~653.
(b) Carey, F. A.; Sundberg, R. J. In Advanced Organic Chemistry, Part B: Reactions and Synthesis, 5th ed., Springer, New York, 2007, pp. 46~55. -
[6]
(a) Burn, D.; Cooley, G.; Davies, M. T.; Ducker, J. W.; Ellis, B.; Feather, P.; Hiscock, A. K.; Kirk, D. N.; Leftwick, A. P.; Petrow, V.; Williamson, D. M. Tetrahedron1964, 20, 597.
(b) Liisberg, S.; Godtfredsen, W. O.; Vangedal, S. Tetrahedron1960, 9, 149.
(c) Fried, J. H.; Arth, G. E.; Sarett, L. H. J. Am. Chem. Soc. 1959, 81, 1235.
-
[1]
-
表 1 反应条件优化a
Table 1. 1 Optimization of reaction conditions

Entry 吡咯烷/equiv. 溶剂 温度/℃ 时间/h 产率/% 转化率b/% 1 3 4 1 2 MeOH 60 4 60 26 — 100 2 2c MeOH 60 20 24 31 98 3 2 Benzene 80 16 21 25 — 50 4 2 Dioxane 100 12 — 8 7 40 5 2 DMSO 100 12 — 8 44 55 6 2 EtOH 80 7 8 14 29 95 7 16 i-PrOH 80 16 — 10 63 100 8 4 i-PrOH 100 25 — — 70 100 a原料 (0.5 mmol), 溶剂 (5 mL); b分离收率; c19位羟基保护基为三甲基乙酰基 (Piv). 表 2 反应底物拓展a
Table 2. Scope of the substrates

Entry Compd. R t/h Yieldb/% (Conv./%) 1 1a Ac 8 70 2 1b CHO 20 — 3 1c C2H5CO 22 52 4 1d CH3(CH2)2CO 22 50 5 1e (CH3)2CHCO 22 51 6 1f CH3(CH2)3CO 22 59 7 1g (CH3)2CHCH2CO 22 52 8 1h CH3(CH2)8CO 22 59 9 1i Piv 22 0 (41) 10 1j CH2=CHCO 22 — 11 1k PhCH=CHCO 22 — 12 1l MeOCO 7 48 13 1m Bz 32 40 14 1n 1-Naphthoyl 22 25 (87) aSubstrate (0.5 mmol), pyrrolidine (2 mmol), i-PrOH (5 mL), 100 ℃; bisolated yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1129
- HTML全文浏览量: 131


 下载:
下载:




 下载:
下载:

