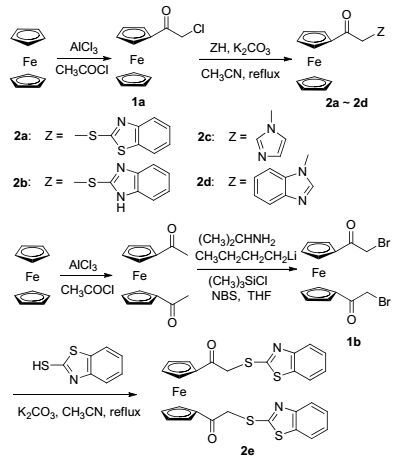
 图式 1
化合物2a~2e的合成
Scheme1.
Synthesis of compounds 2a~2e
图式 1
化合物2a~2e的合成
Scheme1.
Synthesis of compounds 2a~2e

Citation: Wu Xiaofang, Wu Pei, Li Jingyu, Lu Jing, Wang Jianchun. Synthesis of Novel Ferrocenyl Thiazole and Imidazole Derivatives and Its Selective Recognition to Fe3+[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1412-1416. doi: 10.6023/cjoc201611037

新型二茂铁噻唑和咪唑衍生物的合成及其对Fe3+的选择性识别
English
Synthesis of Novel Ferrocenyl Thiazole and Imidazole Derivatives and Its Selective Recognition to Fe3+
-
Key words:
- ferrocene
- / thiazole
- / imidazole
- / iron(Ⅲ) ion recognition
- / tautomerism
-
过渡金属Fe3+离子对生命过程至关重要, 生物体内很多酶以铁作为催化剂完成氧的新陈代谢和电子转移, 以及DNA和RNA的合成[1].在人体中Fe3+离子缺乏或过多都会引起严重的疾病; 因缺铁引起的萎黄病是广泛存在的农业生产问题, 它会导致农作物减产.因此, 迫切需要开展能够在环境和生物样本中检测Fe3+离子的化学传感器的研究.到目前为止, 很多主体分子被合成出来, 其中包括席夫碱[2, 3]、杯[4]吡咯[4]、三嗪[5]、萘二甲酰亚胺[6]、咔唑[7]、罗丹明B[8]、香豆醛[9]等衍生物.这些主体分子除了对Fe3+离子有识别功能之外, 大都对其它离子也有响应, 因此选择性受到影响.
二茂铁以其良好的热稳定性, 电化学性质和易于修饰等优势成为一类重要的主体分子.目前比较成功的例子大多是二茂铁与杂环体系直接相连, 如二茂铁与咪唑类[10, 11]、噻唑类[12]、吡嗪类[13]和三唑类[14]等杂环共轭体系相连, 可用于阴、阳离子和小分子的识别.然而, 这些二茂铁杂环共轭体系主体分子的选择性较差, 可以和多种离子同时作用, 高选择性的主体分子依然缺乏.
本文以二茂铁为原料, 经乙酰化, 卤代反应及缩合反应与不同杂环化合物反应得到5个新化合物2a~2e (Scheme 1), 经多种光谱方法确定其结构, 且得到其中3个化合物的X射线单晶衍射结构.研究了14种常见金属离子(Pb2+, Ni2+, Co2+, Sn4+, Cu2+, Mg2+, Zn2+, Fe3+, Ca2+, K+, Na+, Cr3+, Cd2+, Ag+)对主体分子2a~2e的紫外-可见光谱影响, 结果表明只有Fe3+对主体分子有响应, 并且可实现“裸眼”识别.
1 结果与讨论
1.1 分子的设计与合成
二茂铁杂环化合物作为主体分子应用于阳离子、阴离子和小分子识别的研究受到关注[15, 16].这类化合物中二茂铁作为显示单元, 而杂环化合物是络合单元.二茂铁共轭单元与杂环直接相连具有最好的效果, 但也存在选择性不高的问题.提高选择性的方法是改变主体分子的电子效应和空间结构, 我们尝试把羰基亚甲基引入到二茂铁共轭单元和杂环共轭单元之间, 切断了两个单元的共轭关系, 也构造了新的空间结构, 期望提高选择性.如Scheme 1, 将二茂铁通过酰化反应生成氯乙酰基二茂铁(1a), 随后分别与2-巯基苯并噻唑、2-巯基苯并咪唑、咪唑和苯并咪唑反应生成四个新化合物2a~2d.二茂铁经乙酰化反应生成1, 1'-二乙酰基二茂铁, 随后与丁基锂、NBS反应生成1, 1'-二(溴乙酰基)二茂铁(1b), 1b与2-巯基苯并噻唑反应生成2e.我们也尝试过用1b分别与2-巯基苯并咪唑、咪唑和苯并咪唑等杂环反应, 期待合成双取代衍生物, 但是均未获成功.可能的原因是1b在碱性条件下较活泼, 容易发生分子内消除反应生成不饱和[4]二茂铁环蕃[17](Eq. 1).
1.2 X射线单晶结构
图 1是2a, 2c, 2d的X射线单晶结构, 二茂铁的Fe—C键键长在正常范围之内, 两个茂环几乎平行.茂环与羰基所在平面的二面角在5°~10°之间, 由于亚甲基的引入, 茂环共轭单元与苯并噻唑、咪唑或苯并咪唑共轭单元没有共轭关系, 形成了一个倒U型的特殊三维结构.三个晶体结构的数据比较见表 1.
 表 1
2a, 2c和2d的X射线单晶结构数据比较
Table 1.
Data comparison of X-ray single crystal structures of 2a, 2c and 2d
表 1
2a, 2c和2d的X射线单晶结构数据比较
Table 1.
Data comparison of X-ray single crystal structures of 2a, 2c and 2d

1.3 不同金属阳离子对2a的紫外可见光谱响应
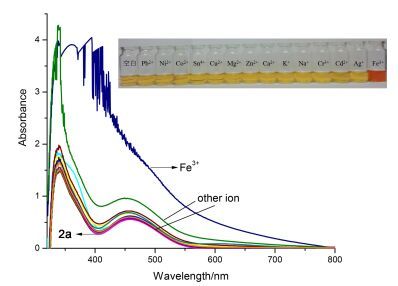
分别研究了2a~2e 5个主体分子对常见金属离子的紫外可见光谱响应.以2a为例, 在可见光区的最大吸收峰值为458 nm, 除Fe3+外, 其它金属离子对2a的最大吸收峰均无明显变化, 如图 2.并且肉眼可见只有加入Fe3+的溶液颜色变深变红, 久置后浑浊.
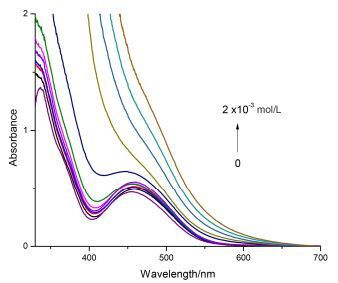
按照表 2所示浓度配置一系列Fe3+离子的溶液, 如图 3, 随着Fe3+的加入, 溶液颜色逐渐从黄色转为红色, 并且随着Fe3+浓度的增大, 溶液颜色逐渐加深. Fe3+对其它主体分子有相似的变化, 且2a变化最明显.
1.4 机理研究
2a的紫外可见谱显示当Fe3+加入时吸收峰发生红移.如图 3, 从浓度系列的实验数据看, 当主客体浓度达到1:1的时候, 主体分子在458 nm的吸收峰基本不可见, 而低于这个浓度则主体分子的峰都清晰可见, 说明主客体发生了1:1的配位反应, 使主体分子的结构发生了变化, 因而产生了一个明显的吸收峰位移.实验测定了该方法的检出限为5.083×10-5 mol/L.
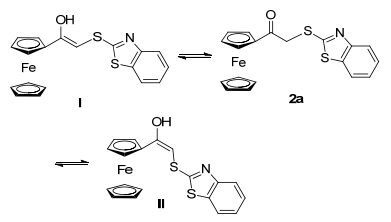
分别研究了2a的氘代氯仿、氘代四氢呋喃和氘代DMSO溶液中的核磁共振氢谱(图谱见辅助材料), 发现2a的氘代氯仿和氘代DMSO谱图均可很好地解释其酮式结构, 但2a的氘代四氢呋喃谱图变得非常复杂, 在δ 5.48附近出现了碳碳双键烯氢的信号, 且在δ 9.20和9.70附近出现了活泼氢的信号.说明2a在四氢呋喃(THF)中发生了结构的变化, 曾试图分离和纯化所生成的各个化合物, 却在蒸干熔剂之后重新得到了纯2a的酮式结构.因此我们认为2a在THF中存在着互变异构现象, 酮式结构与烯醇式结构I和Ⅱ存在着平衡(图 4).
进一步研究发现Fe3+的显色反应是一个三元体系, 即2a, THF和Fe3+同时存在下才显色, 用其它溶剂替换并不显色, Fe2+与2a和THF共存也不显色.用核磁共振氢谱研究Fe3+与2a在THF中的机理未获成功, 得到的氢谱为宽峰, 可能是体系中顺磁性物质存在的原因(图谱见辅助材料).
2 结论
本文设计合成了5个新的二茂铁噻唑和咪唑衍生物, 用光谱方法确认结构.单晶结构表明以羰基亚甲基相连的二茂铁与噻唑或咪唑共轭单元具有特殊的空间构型和电子效应, 在常见的14种常见阳离子中, 仅与Fe3+络合并显红色, 可用于Fe3+的裸眼识别.机理研究显示2a在四氢呋喃中存在着互变异构, 而且Fe3+的显色反应是一个三元体系.
3 实验部分
3.1 仪器与试剂
大多数的操作都是氮气保护的无水无氧条件下进行.溶剂四氢呋喃是用金属钾回流除水并蒸馏制得; 异丙胺、三甲基氯硅烷等使用之前用分子筛干燥.熔点用上海易测仪器设备有限公司的WRS-1B型数字熔点仪测定, 温度未校正; VARIAN NMRS 600 MHz型核磁共振仪(CDCl3为溶剂, TMS为内标); TENSOR 37型红外光谱仪(KBr压片); Waters MicYoMass QTof型质谱仪; UV-8000紫外-可见分光光度计; Waters公司的MicYoMass QTof质谱仪; AFC10/Saturn 724+单晶衍射仪.
3.2 实验方法
3.2.1 氯乙酰基二茂铁(1a)的合成
根据文献[18]合成.得紫色固体, 产率68.8%, m.p. 74~75 ℃.
3.2.3 目标化合物2a~2d的合成
取氯乙酰基二茂铁100 mg (0.381 mmol)溶于乙腈中, 再加入含212 mg (1.14 mmol) 2-巯基苯并噻唑的丙酮溶液, 再加入552 mg (0.381 mmol) K2CO3乙腈溶液, 加入干燥的5 Å分子筛, 加热回流. 4 h后, 过滤, 固体溶解于二氯甲烷中, 再依次用碱液、水洗后, 旋干, 粗产物经二氯甲烷与石油醚重结晶得2-(1H-苯并噻唑-2'-硫基)-1-二茂铁-1-乙酮(2a), 红色针状晶体, 产率69.0%. m.p. 183~184 ℃; 1H NMR (600 MHz, CDCl3) δ: 4.33 (s, 5H, Cp), 4.60 (t, J=1.9, 1.9 Hz, 2H, Cp), 4.73 (s, 2H, CH2), 4.93 (t, J=1.9, 1.9 Hz, 2H, Cp), 7.30 (ddd, J=8.3, 7.3, 1.2 Hz, 1H, Ph), 7.40 (ddd, J=8.2, 7.2, 1.2 Hz, 1H, Ph), 7.79~7.74 (m, 1H, Ph), 7.89~7.84 (m, 1H, Ph); 13C NMR (151 MHz, CDCl3) δ: 196.34, 165.70, 152.87, 135.57, 126.01, 124.35, 121.36, 121.10, 77.17, 72.87, 70.26, 69.69, 40.96; IR (KBr) ν: 3431, 3095, 2910, 1684, 1433, 1222, 1065, 995, 889, 822, 749, 4800 cm-1; ESI-MS m/z: 393.9 (M+H)+. HRMS calcd for C19H16FeNOS2 (M+H)+ 394.0023, found 394.0020.
化合物2b~2d按化合物2a方法合成.
2-(1H-苯并咪唑-2'-硫基)-1-二茂铁-1-乙酮(2b):橙色粉末, 产率67.8%. m.p. 180~181 ℃; 1H NMR (600 MHz, CDCl3) δ: 4.29 (s, 5H, Cp), 4.31 (s, 2H, CH2), 4.66 (t, J=1.9, 1.9 Hz, 2H, Cp), 4.89 (t, J=1.9, 1.9 Hz, 2H, Cp), 7.20~7.56 (m, 4H, Ph); 10.61 (s, 1H, NH); 13C NMR (151 MHz, CDCl3) δ: 200.34, 149.06, 137.66, 126.03, 122.52, 76.62, 73.70, 70.43, 69.96, 39.22; IR (KBr) ν: 3244, 31004, 2954, 1672, 1448, 1395, 1344, 1269, 1224, 1061, 8300, 7400, 487 cm-1; ESI-MS m/z: 377.1 (M+H)+. HRMS calcd for C19H17FeN2OS (M+H)+ 377.0411, found 377. 0409.
2-(1H-咪唑)-1-二茂铁-1-乙酮(2c):红棕色针状晶体, 产率70.1%. m.p. 158~159 ℃; 1H NMR (600 MHz, CDCl3) δ: 4.24 (s, 5H, Cp), 4.63 (t, J=1.9, 1.9 Hz, 2H, Cp), 4.82 (t, J=1.9, 1.9 Hz, 2H, Cp), 5.05 (s, 2H, CH2), 6.98 (s, 1H, Ph), 7.14 (s, 1H, Ph), 7.54 (s, 1H, Ph); 13C NMR (151 MHz, CDCl3) δ: 195.82, 129.59, 120.48, 75.66, 73.23, 70.14, 70.13, 69.17, 52.82; IR (KBr) ν: 3386, 3111, 2917, 1680, 1507, 1463, 1374, 1246, 1105, 1068, 889, 821, 7400, 657, 494 cm-1; ESI-MS m/z: 295.1 (M+H)+. HRMS calcd for C15H15FeN2O (M+H)+ 295.0534, found 295.0526.
2-(1H-苯并咪唑)-1-二茂铁-1-乙酮(2d):橙色针状晶体, 产率64.7%. m.p. 170~171 ℃; 1H NMR (600 MHz, CDCl3) δ: 4.25 (s, 5H, Cp), 4.65 (t, J=1.8, 1.8 Hz, 2H, Cp), 4.89 (t, J=1.8, 1.8 Hz, 2H, Cp), 5.27 (s, 2H, CH2), 7.86~7.28 (m, 4H, Ph), 8.06 (s, 1H, CH); 13C NMR (151 MHz, CDCl3) δ: 195.81, 123.29, 122.36, 120.57, 109.19, 75.60, 73.22, 700.16, 69.23, 50.71; IR (KBr) ν: 3424, 3095, 2917, 1680, 1500, 1374, 1246, 1173, 1068, 889, 830, 748, 606, 480 cm-1; ESI-MS m/z: 345.1 (M+ H)+. HRMS calcd for C19H17FeN2O (M+H)+ 345.0690, found 345.0685.
3.2.5 单晶结构测试
化合物2a (C19H15FeNOS2)为红色针状晶体, 分子晶体结构图如图 1(a) (CCDC: 1518698).单晶X射线测试表明化合物Mr=393.30, 晶体结构属于单斜晶系, P21/c空间群.晶胞参数a=6.270(15) Å, b=18.794(4) Å, c=14.269(3) Å, α=90.00°, β=101.195(3)°, γ=90.00°. V=1649.5(7) Å3, Z=4, Dc=1.584 Mg/m3, μ=1.17 mm-1, F(000)=808.光源: Mo Kα射线(λ=0.71073 nm), 测试温度293(2) K.最终偏离因子: R1=0.0363, wR2=0.0881.偏离因子: R1=0.0451, wR2=0.0828, GOF=1.050;精修方法:基于F2的全矩阵最小二乘法.全部氢原子通过理论加氢确定, 并在结构精修中采用各项同性热参数.
化合物2c (C15H14FeN2O)为红棕色针状晶体, 分子晶体图如图 1(b) (CCDC 1518699).单晶X射线测试表明化合物Mr=294.05, 晶体结构属于三斜晶系. P1空间群.晶胞参数a=7.4506(4) Å, b=11.0284(6) Å, c=16.0550(9)Å, α=81.879(3)°, β=80.590(4)°, γ=89.549(4)°. V=1288.25(12) Å3, Z=2, Dc=1.516 Mg/m3, μ=1.16 mm-1, F(000)=608.光源: Mo Kα射线(λ=0.71073 nm), 测试温度293(2) K.最终偏离因子: R1=0.0401, wR2=0.1070.偏离因子: R1=0.0501, wR2=0.1140, GOF=1.078;精修方法:基于F2的全矩阵最小二乘法.全部氢原子通过理论加氢确定, 并在结构精修中采用各项同性热参数.
化合物2d (C19H16FeN2O)为橙色针状晶体, 分子晶体图如图 1(c) (CCDC 1518656).单晶X射线测试表明化合物Mr=344.06, 晶体结构属于三斜晶系, P1空间群.晶胞参数a=9.7648(2) Å, b=11.5911(2) Å, c=15.1987(3)Å, α=101.5780(10)°, β=91.3020(10)°, γ=114.4800(10)°. V=1522.91(5)Å3, Z=2, Dc=1.501 Mg/m3, μ=1.00 mm-1, F(000)=712.光源: Mo Kα射线(λ=0.71073 nm), 测试温度293(2) K.最终偏离因子: R1=0.0360, wR2=0.0739.偏离因子: R1=0.0538, wR2=0.0823, GOF=1.029;精修方法:基于F2的全矩阵最小二乘法.全部氢原子通过理论加氢确定, 并在结构精修中采用各项同性热参数.
3.2.6 紫外-可见光谱的测定
以2a为例, 主体分子2a配成2.0×10-3 mol/L的THF溶液, 客体离子分别配成2.0×10-2 mol/L的水溶液备用.在含有2 mL主体溶液的一系列10 mL比色管中, 移入不同的客体(Pb2+, Ni2+, Co2+, Sn4+, Cu2+, Mg2+, Zn2+, Fe3+, Ca2+, K+, Na+, Cr3+, Cd2+, Ag+) 2 mL, 并用THF定容, 得到主体分子的浓度为4.0×10-4 mol/L, 客体离子浓度为4.0×10-3 mol/L.
在测定离子浓度梯度时保持主体分子浓度为4.0×10-4 mol/L, 配置一系列浓度的客体分子溶液, 所得客体离子浓度见表 2.
辅助材料(Supporting Information) 化合物2a, 2c, 2d单晶结构的主要键长键角, 目标化合物2a~2e的核磁氢谱、核磁碳谱谱图、红外光谱和高分辨质谱谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
3.2.4 目标化合物2e的合成
取1, 1'-二溴乙酰基二茂铁502.9 mg (1.03 mmol)溶于乙腈中, 再加入含345.1 mg (2.06 mmol) 2-巯基苯并噻唑的丙酮溶液, 再加入18.8 mg (1.03 mmol) K2CO3乙腈溶液, 加入干燥的5Å分子筛, 常温搅拌0.5 h后, 过滤, 固体溶解于二氯甲烷中, 再依次用碱液, 水洗后, 旋干.用二氯甲烷和石油醚(V:V=1:5) 重结晶, 得橙色块状晶体1, 1'-二茂铁二[(2-苯并噻唑-2-硫基)-1-乙酮] (2e), 446 mg, 产率72.1%. m.p. 183~184 ℃; 1H NMR (600 MHz, CDCl3) δ: 4.64 (s, 4H, CH2), 4.75 (t, J=1.9, 1.9 Hz, 4H, Cp), 5.08 (t, J=2.0, 2.0 Hz, 4H, Cp), 7.28~7.83 (m, 8H, Ph); 13C NMR (151 MHz, CDCl3) δ: 195.76, 165.40, 152.74, 135.57, 126.03, 124.40, 121.29, 121.11, 78.66, 74.67, 71.41, 40.74; IR (KBr) ν: 3445, 3080, 2910, 1680, 1456, 1418, 1298, 1232, 1075, 1008, 881, 830, 748, 480 cm-1; ESI-MS m/z: 601.0 (M+H)+. HRMS calcd for C28H20FeN2NaO2S4 (M+Na)+ 622.9655, found 622.96500.
3.2.2 1, 1'-二溴乙酰基二茂铁(1b)的合成
根据文献[19]合成.得深棕色固体, 产率62.3%, m.p. 84~85 ℃.
-
-
[1]
Umesh, F.; Sanjay, A.; Anil, K. Chem. Phys. Lett. 2013, 584, 165. doi: 10.1016/j.cplett.2013.08.029
-
[2]
Choi, Y. W.; Park, G. J.; Na, Y. J.; Jo, H. Y.; Lee, S. A. You, G. R.; Kim, C. Sens. Actuators, B 2014, 194, 343. doi: 10.1016/j.snb.2013.12.114
-
[3]
徐栋, 王鸣明, 曾瑞杰, 何森, 张玉, 王辉, 盛鸿婷, 应用化工, 2013, 42, 1712.Xu, D.; Wang, M.-M.; Zeng, R.-J.; He, S.-G.; Zhang, Y.; Wang, H.; Shen, H.-T. Appl. Chem. Ind. 2013, 42, 1712 (in Chinese).
-
[4]
Bhatt, K. D.; Makwana, B. A.; Vyas, D. J.; Mishra, D. R.; Jain, V. K. J. Lumin. 2014, 146, 450. doi: 10.1016/j.jlumin.2013.10.004
-
[5]
张华, 徐孝武, 吴芳英, 无机化学学报, 2013, 29, 2394.Zhang, H.; Wu, X.-X.; Wu, F.-Y. Chin. J. Inorg. Chem. 2013, 29, 2394 (in Chinese).
-
[6]
杜斌, 丁志军, 郭磊, 王普红, 李志军, 余建华, 光谱学与光谱分析, 2015, 35, 470.Du, B.; Ding, Z.-J.; Guo, L.; Wang, P.-H.; Li, Z.-J.; Yu, J.-H. Spectrosc. Spectral Anal. 2015, 35, 470 (in Chinese).
-
[7]
张仕禄, 赵波, 冉利, 秦大斌, 罗杰伟, 化学试剂, 2014, 36, 925.Zhang, S.-L.; Zhao, B.; Ran, L.; Qin, D.-B.; Luo, J.-W. Chem. Reag. 2014, 36, 925 (in Chinese).
-
[8]
苏娜, 杨美盼, 孟文斐, 杨秉勤, 有机化学, 2015, 35, 175. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344618.shtmlSu, N.; Yang, M.-P.; Meng, W.-F.; Yang, B.-Q. Chin. J. Org. Chem. 2015, 35, 175 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344618.shtml
-
[9]
Garcia-Beltran, O.; Cassels, B. K.; Perez, C.; Mena, N.; Nunez, M. T.; Martine, N. P.; Pavez, P.; Aliaga, M. E. Sensors 2014, 14, 1358. doi: 10.3390/s140101358
-
[10]
Maria, A.; Arturo, E.; Alberto, T.; Pedro, M. Org. Lett. 2011, 13, 2078. doi: 10.1021/ol2004935
-
[11]
Zapata, F.; Caballero, A.; Espinosa, A.; Tárraga, A.; Molina, P. J. Org. Chem. 2009, 74, 4787. doi: 10.1021/jo900533x
-
[12]
Caballero, A.; Lloveras, V.; Curiel, D. T.; Tarraga, A.; Espinosa, A.; Garcia, R.; Vidal-Gancedo, J.; Rovira, C.; Wurst, K.; Molina, P. Inorg. Chem. 2007, 46, 825. doi: 10.1021/ic061803b
-
[13]
Zapata, F.; Caballero, A.; Espinosa, A.; Tarraga, A.; Molina, P. Inorg. Chem. 2009, 48, 11566. doi: 10.1021/ic901234d
-
[14]
Romero, T.; Caballero, A.; Tárraga, A.; Molina, P. Org. Lett. 2009, 11, 3466. doi: 10.1021/ol901308z
-
[15]
卓继斌, 晏希泉, 王小雪, 谢莉莉, 袁耀锋, 有机化学, 2015, 35, 1090. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344763.shtmlZhuo, J.-B.; Yan, X.-Q.; Wang, X.-X.; Xie, L.-L.; Yuan, Y.-F. Chin. J. Org. Chem. 2015, 35, 1090 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344763.shtml
-
[16]
卓继斌, 万倩, 晏希泉, 谢莉莉, 袁耀锋, 高等学校化学学报, 2015, 36, 477.Zhuo, J.-B., Wan, Q., Yan, X.-Q., Xie, L.-L., Yuan, Y.-F. Chem. J. Chin. Univ. 2015, 36, 477 (in Chinese).
-
[17]
Molina, P.; Tarraga, A.; Curiel, D.; Velasco, M. D. J. Organomet. Chem. 2001, 637~639, 258.
-
[18]
Ferreira, A. P.; Ferreira da Silva, J. L.; Duarte, M. T.; Minas da Piedade, M. F.; Robalo, M. P.; Harjivan, S. G.; Marzano, C.; Gandin, V.; Marques, M. M. Organometallics 2009, 28, 5412. doi: 10.1021/om9003835
-
[19]
Tárraga, A.; Molina, P.; Curiel, D.; Velasco, M. D. Organometallics 2001, 20, 2145. doi: 10.1021/om000604b
-
[1]
-
表 1 2a, 2c和2d的X射线单晶结构数据比较
Table 1. Data comparison of X-ray single crystal structures of 2a, 2c and 2d

表 2 不同离子溶液的浓度
Table 2. Concentration of various metal ion

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 6
- 文章访问数: 2534
- HTML全文浏览量: 838



 下载:
下载:




 下载:
下载:

