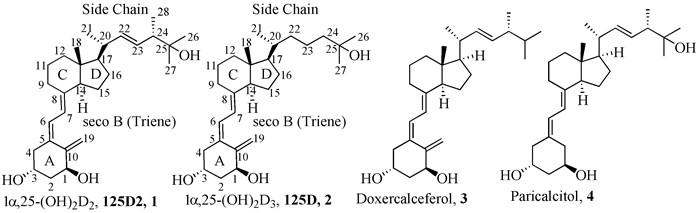
 图式1
1α, 25-二羟基维生素D2、1α, 25-二羟基维生素D3及其部分商品化类似物的结构
图式1.
The structure of 1α, 25-(OH)2-D2, 1α, 25-(OH)2-D3 and some commercial related analogues
图式1
1α, 25-二羟基维生素D2、1α, 25-二羟基维生素D3及其部分商品化类似物的结构
图式1.
The structure of 1α, 25-(OH)2-D2, 1α, 25-(OH)2-D3 and some commercial related analogues

Citation: Hu Daihua, Chen Wang. Advances in Syntheses and Biological Activities of Vitamin D2 Analogues[J]. Chemistry, 2017, 80(8): 715-724.

维生素D2类似物的合成及生物活性研究进展
English
Advances in Syntheses and Biological Activities of Vitamin D2 Analogues
-
Key words:
- 1α, 25-dihydroxyvitamin D2
- / Analogues
- / Doxercalciferol
- / Paricalcitol
- / Synthesis
- / Biological activities
-
维生素D2和维生素D3是对生物体最为重要的两种维生素D,二者结构差别在于维生素D2支链上C24位带有一个甲基、C22和C23之间连接键为双键,其余骨架结构完全一样。维生素D2的代谢与维生素D3类似,其在人体中并不能直接起作用,而是先被运送到肝脏中,在25-羟化酶作用下生成25-羟基维生素D2(25-OH-D2),然后经过血液循环运送到肾脏中生成具有生物活性的1α, 25-二羟基维生素D2(1α, 25-(OH)2-D2,125D2),125D2可直接作用于维生素D受体蛋白从而调节人体的新陈代谢[1]。
1α, 25-二羟基维生素D3(1α, 25-(OH)2-D3,125D)是维生素D中最具生理活性的代谢产物[2],125D2与125D活性很相似[3],其在小鼠中的抗骨质疏松活性也与125D相近[4]。目前125D已被用于治疗骨质疏松、肿瘤、艾滋病、牛皮癣等疾病,但是125D在治疗时产生的高钙血症(Hypercalcemic effects)不良副反应限制了其临床应用。从构效关系研究出发,研究者迄今已合成出三千多种维生素D3类似物,并在此领域有多篇综述报道[5]。维生素D2及其类似物一般比相应维生素D3类化合物副作用小[6],通过对其结构修饰已合成了大量维生素D2类似物,其中度骨化醇(Doxercalciferol)、帕立骨化醇(Paricalcitol)等代表性类似物(图式 1) 也已作为药物用于临床治疗各种疾病[5a]。本文以维生素D2的侧链结构特征为核心,重点综述了近年来度骨化醇及帕立骨化醇的合成新进展以及侧链修饰、19-去亚甲基、A环C3位修饰和九重氢同位素标记的维生素D2类似物的合成及生物活性研究,旨在为新型活性维生素D2类似物的合成及临床开发提供参考。
 图式1
1α, 25-二羟基维生素D2、1α, 25-二羟基维生素D3及其部分商品化类似物的结构
图式1.
The structure of 1α, 25-(OH)2-D2, 1α, 25-(OH)2-D3 and some commercial related analogues
图式1
1α, 25-二羟基维生素D2、1α, 25-二羟基维生素D3及其部分商品化类似物的结构
图式1.
The structure of 1α, 25-(OH)2-D2, 1α, 25-(OH)2-D3 and some commercial related analogues
1 1α-羟基类似物(度骨化醇)
研究发现,1α-羟基维生素D2(doxercalc-iferol,度骨化醇)在细胞内的毒性比1α-羟基维生素D3小10倍左右,且1α-羟基是维生素D2及其类似物的重要活性组成部分[7]。度骨化醇是由美国Bone Care International公司研制的首个用于继发性甲状旁腺功能亢进症(SHPT)的一种维生素D2类似物,已获美国食品药品管理局(FDA)批准上市,临床上已用于治疗骨质疏松症及SHPT等。度骨化醇治疗结肠癌、前列腺癌和乳腺癌的中期临床研究目前正在开展;最新研究还表明度骨化醇对骨髓增生异常综合症、慢性单核细胞性白血病等癌症也有一定的疗效[8]。
Anderson等[9]以维生素D2为原料,先用二氧化硫保护共轭双键,然后用TBSCl保护C1位羟基,再脱去二氧化硫,用二氧化硒和吗琳氮氧化物在C1位羟基化后再将羟基保护,得到关键中间体9,再经连续光异构化法合成度骨化醇,总收率为10%。刘亚楠[10]也以9为原料,经过光催化双键异构、脱羟基保护两步反应合成了度骨化醇,产率为74.25%(式(1))。
Sun等[8]以维生素D2为原料,经过酯化保护、环合、氧化、开环、异构化5步反应生成度骨化醇,总收率6.23%(式(2))。该合成方法避开光照等复杂反应条件,采用简便的Diels-Alder反应,周期短,操作简便、安全,产率较高,是对度骨化醇新的工业化生产方法的有益探索。
2 侧链修饰类似物
2.1 侧链单不饱和双键类似物
对于125D而言,结构中进行5E, 7E结构修饰降低了高血钙副反应[11],且可抑制Lewis肺癌肿瘤生长而对钙离子水平无影响[12]。为进一步研究类似结构修饰对125D2的活性影响,Nadkarni等[13]合成了22S-羟基-C22-饱和类似物20(PRI-1730) 以及5E, 7E-C22-饱和及不饱和双键类似物26a、26b和27a、27b(PRI-1731、PRI-1733、PRI-1732及PRI-1734)(式(3)、(4))。
Piotrowska等[14]测定了125D、20、26a、26b和27a、27b六种系列合成类似物(见式(4))诱导维生素D受体(VDR)正A375和VDR负SK-MEL 188b人类恶性黑色素瘤细胞系的分化活性,结果表明,125D2抑制A375细胞增殖所需的剂量比125D低数倍。构效关系研究表明,5, 6-反式双键修饰可增加抗增殖活性,但不作为单点修饰;而在天然及5, 6-反式双键系列类似物侧链中引入22位羟基,抗增殖活性明显降低。
2.2 侧链多不饱和双键类似物
2.2.1 22E, 24E-双不饱和双键类似物
Chodyński等[15]将28与侧链醛29通过Julia烯化反应合成了(24E)-(1S)-24-去氢系列侧链不饱和类似物33a~33d(PRI-1906、PRI-1907、PRI-1908及PRI-1909)(式(5)),并测定了合成化合物对T47D和MCF-7两种人类乳腺癌细胞以及HL-60和WEHI-3两种人类及老鼠白血病细胞的抗增殖活性。结果表明,33b的抗增殖活性最强,对于不同的细胞株,33b的活性是125D的3~150倍(表 1);Wietrzyk等[16]应用大鼠乳腺癌16/C模型,测定了PRI-1906、PRI-1907的体内细胞毒性、高血钙活性和抗肿瘤活性。在连续5d皮下注射后,125D、PRI-1906、PRI-1907的LD50(半数致死量)值分别为7.8、10.0和2.4 μg/kg/d,血清中钙水平分别增加40%、23%和63%。同时比较PRI-1906与125D和1α, 24-二羟基维生素D3(他卡西醇,Tacalcitol)的抗肿瘤活性,结果显示125D在测试第八天仍对肿瘤细胞显示较好的抑制作用。PRI-1906在1和5 μg/kg/d剂量下均抑制肿瘤生长,而他卡西醇只在5 μg/kg/d剂量下抑制肿瘤生长,表明PRI-1906、PRI-1907在乳腺癌的联合治疗中是很好的候选化合物;Baurska等[17]通过测定对人类急性髓性白血病(AML)细胞体外和体内的分化活性,研究了PRI-1906、PRI-1907、PRI-1908及PRI-1909四种类似物的构效关系。结果表明,侧链延长一个碳原子(PRI-1906) 或两个碳原子(PRI-1907) 对细胞分化活性与125D相当或有所提高;然而继续增加碳原子个数,活性降低;在从AML患者中提取的胚细胞中也具有类似规律。他们同时测定了类似物在HL60细胞株中对CYP24A1基因的激活表达能力,结果表明,PRI-1906对CYP24A1基因的激活表达能力与125D相近,而PRI-1907比125D弱。此外,PRI-1906和PRI-1907均可中等程度抑制PC-3前列腺癌细胞增殖,并显著激活CYP24A1 mRNA的表达。
 表 1
维生素D类似物33a~33d对人和鼠白血病细胞(HL-60和WEHI-3) 及人类乳腺癌细胞(T47D和MCF-7细胞株)的体外抑制活性
Table 1.
Inhibitory doses in vitro of vitamin D analogues 33a~33d against the human and mouse leukemia (HL-60 and WEHI-3), and human breast carcinoma (T47D and MCF-7 cell lines)
表 1
维生素D类似物33a~33d对人和鼠白血病细胞(HL-60和WEHI-3) 及人类乳腺癌细胞(T47D和MCF-7细胞株)的体外抑制活性
Table 1.
Inhibitory doses in vitro of vitamin D analogues 33a~33d against the human and mouse leukemia (HL-60 and WEHI-3), and human breast carcinoma (T47D and MCF-7 cell lines)
Analogue Inhibitory dose/(nmol/L) ID50 ID40, T47D ID30, MCF-7 HL-60 WEHI-3 125D 15.0±1.14 0.43±0.2 275.0±1.1 114.0±1.1 33a(PRI-1906) 2.2±0.50* 0.28±0.3 819.0±3.1 39.0±1.4* 33b(PRI-1907) 0.1±0.02* 0.16±0.1 35.0±2.1* 39.0±1.3* 33c(PRI-1908) 15.0±3.00 11.0±2.3 -b 137.0±1.2 33d(PRI-1909) -a 47.0±1.8 -c -d * 类似物和骨化三醇之间的统计学显着性差异(P < 0.05);a:最大生长抑制率43%;b:最大生长抑制率为37%;c:最大生长抑制率为20%;d:最大生长抑制率为25%。 2.2.2 22E, 24Z-双不饱和双键类似物
Bolla等[18]合成了22E, 24Z-双不饱和双键类似物37a、37b(PRI-1916和PRI-1917)(式(6)),并测定了其对人类全长VDR的亲和活性。结果显示,其活性均比125D低,且24Z-甲基异构体的亲和活性比24E的高,而24Z-乙基类似物的活性则比24E的低,表明C25位末端烷基显著影响亲和活性。他们检测这些化合物对人类CYP24A1的代谢转化,结果显示37a、37b对CYP24A1的代谢转化率比125D2更低,表明它们可对目标组织具有长期的生物效应(表 2)。
 表 2
维生素D及其类似物的活性形式对人类CYP24A1基因的代谢转化
Table 2.
Metabolic conversion of active forms of vitamins D and of analogues by human CYP24A1
表 2
维生素D及其类似物的活性形式对人类CYP24A1基因的代谢转化
Table 2.
Metabolic conversion of active forms of vitamins D and of analogues by human CYP24A1
Compound 125D 125D2 33a 37a 33b 37b a Metabolic conversion/% 49 39 2.3 11 0.8 10 a至少2次独立实验的平均值 2.3 22位顺式异构体类似物
Gándara等[19]应用Julia-Kocienski成烯反应从Inhoffen-Lythgoe二醇38出发经10步反应合成了22Z-25-羟基类似物46,总收率33%(式(7));并从商品化醇21出发经5步反应以41%的总收率合成了(22Z)-1α, 25-二羟基维生素D2类似物50(式(8))。
Gándara等[20]通过关键步骤为Julia-Kocienski烯化的反应经五步合成了22Z-侧链-1α, 25-二羟基类似物53,总收率达44%(式(9))。测定了其在不同癌细胞株(人类头和颈鳞状癌细胞HN12、人类结肠癌细胞HCT116、小鼠乳腺癌细胞LM3、人类乳腺癌细胞T47D以及人类胶质瘤细胞T98G)的抗增殖活性及体内高血钙反应,结果表明,化合物对结肠、头和颈的鳞状细胞癌具有抗增殖作用,其体内高血钙反应与125D相当。
2.4 C24位取代侧链延长类似物
Vinhas等[21]从维生素D2出发,通过氧化膦55与酮(56)的Wittig-Horner偶联反应构建三烯体系,中间体57中C24位甲基或苯基通过铜盐作用下磷酸酯基团的反SN2取代立体选择性引入,经10步反应合成了两种C24位取代的侧链延长类似物54a、54b,总收率分别为9%和7%(式(10))。
3 19-去亚甲基类似物
3.1 1α, 25-二羟基-19-去亚甲基类似物(帕立骨化醇)
帕立骨化醇是雅培公司研发的一种维生素D2类似物。药理作用研究表明,帕立骨化醇在有效控制高血钙的同时可降低甲状旁腺激素水平,并抑制甲状旁腺增生;在肾脏疾病治疗中能够有效控制肾脏的炎症和纤维化;此外,帕立骨化醇能够抑制免疫介导的炎症反应,控制高血压、心力衰竭、心肌肥厚等心血管疾病,并抑制肿瘤细胞增殖[22]。
Wan等[23]以维生素D2为原料,通过7步反应和一次生物转化,以3.24%的总收率合成了帕立骨化醇。该法合成路线短,操作简便。通过化学合成获得1α-羟基-19-去甲维生素D2后,利用生物转化实现25位羟基化,所采用菌株为CGMCC 5098放线菌(式(11))。
Li等[24]从维生素D2出发经13步反应合成了帕立骨化醇(式(12)),该法具有如下优点:(1) C19位亚甲基通过臭氧化和自由基还原去除,该法比二羟基化、裂解、保护、还原的路线更高效;(2) 侧链部分通过臭氧化和Wittig反应获得,而不是通过臭氧化、Julia偶联和烯化反应得到;(3) 侧链和亚甲基的臭氧化为一锅法合成。该合成路线是帕立骨化醇合成中迄今为止最短的路线,其中首次用到选择性臭氧化,经过进一步修饰后可应用于实际生产。
Toyoda等[25]由25-羟基维生素D2出发,以高区域选择性和立体选择性合成了帕立骨化醇,关键步骤是烯烃中间体84的硼氢化,该中间体可以作为新型维生素D类似物合成的有用中间体(式(13))。
另外,也可以在合成过程中不保护25位羟基,而其他反应步骤和25位羟基保护的方法均相似,最终由25-羟基维生素D2经9步反应以3%的总产率合成帕立骨化醇(式(14))。
3.2 22Z-1α, 25-二羟基-19-去亚甲基类似物
Samala等[26]从奎宁酸出发在Julia-Lythgoe’s烯化反应条件下以高立体选择性合成了22Z-1α, 25-二羟基-19-去亚甲基类似物90,主要包括CD环官能化醛与苯并噻唑砜的Julia-Lythgoe’s Wittig-Horner偶联,以及通过氧化膦与Windaus-Grundmann’s酮的Horner-Wadsworth-Emmons反应构建A环和CD环的双烯体系两种合成路线。关键中间体为氧化膦89和苯并噻唑砜41(式(15))。
3.3 22E, 24E-19-去亚甲基类似物
Pietraszek等[27]在33a、33b的结构基础上,对A环进行19-去亚甲基修饰,应用汇聚法合成了两种双位点修饰类似物95a、95b(PRI-5201和PRI-5202)(式(16))。Nachliely等[28]测定了PRI-5201和PRI-5202对HL60、U937和MOLM-13人类急性髓性白血病(AML)细胞的诱导分化活性,并与前体化合物PRI-1906、PRI-1907以及125D进行比较。通过测定骨髓分化细胞表面标记物的表达,结果显示几种合成类似物的活性依次为PRI-5202 > PRI-1907 > PRI-5201 > PRI-1906≥125D。不同AML细胞株对PRI-5201和PRI-5202的敏感性是125D的3~15倍和13~50倍。所有供试化合物在0.25~1 nmol/L供试浓度下与迷迭香多酚鼠尾草酸协同作用时,前细胞分化活性显著增强并与125D活性相当,且不同种类细胞敏感性不同。双位点修饰125D类似物是比125D活性更强的髓样分化诱导剂,且与植物多酚联合作用时其活性增强。
4 A环C3位修饰类似物
4.1 3-氨基甲酸盐-25-羟基类似物
Grote等[29]首先将25-羟基维生素D2与氯甲酸对硝基苯酯反应生成3-对硝基苯碳酸盐,进而与胺作用以较高产率制备出Alexa Fluor标记的3-氨基甲酸盐-25-羟基维生素D2共轭物97(式(17))。
4.2 1α, 25-二羟基-3-差向异构类似物
鉴于1α, 25-羟基-3-差向维生素D3的高代谢稳定性及较高的生物活性,Sigüeiro等[30]首次由维生素D2出发,通过汇聚法经14步反应以7%的总收率合成了1α, 25-羟基-3-差向维生素D2类似物104(式(18))。该路线的关键步骤为三烯体系的构建,其中包括对烯醇-三氟甲磺酸酯通过Pd催化关环,进而与硼酸盐的Suzuki-Miyaura偶联。C24位甲基的引入是通过烯丙基氨基甲酸酯的SN2'亲核取代反应完成的。
4.3 C3位肟类衍生物和维生素D2载体纳米药物前体
李红亮[31]以维生素D2为原料,通过Oppenauer氧化以及肟化反应合成了维生素D在A环上的肟以及肟醚衍生物106a、106b和107a、107b。并以维生素D2为载体,经与金刚烷胺和维生素D2通过琥珀酸桥连,合成了具有潜在生物活性的纳米载体药物前体维生素D2-琥珀酸二酯缀合物109和维生素D2-琥珀酸-金刚烷胺缀合物110(式(19))。并由噻唑蓝(MTT)比色法测试了106a、106b和107a、107b四种类似物分别在不同浓度下对人肝癌细胞株(HepG2细胞)和人乳腺癌细胞株(MCF-7细胞)的抑制活性,发现它们均具有一定的抗癌活性,IC50值在2.95~240 nmol/L范围。
4.4 C3位糖苷类似物
刘亚楠[10]合成了维生素D2半乳糖苷113、维生素D2片段葡萄糖苷114和维生素D2片段半乳糖苷115a、115b四种C3位维生素D2糖苷类似物(式(20)),并采用MTT法测试其对人体肝癌细胞(HepG2细胞)和人体乳腺癌细胞(MCF-7) 的抗癌细胞增殖活性,结果表明,该类化合物对这两种癌细胞均具有较好的抑制活性,其中化合物115a对人体乳腺癌细胞的抑制能力最好,其IC50值为77nmol/L。
5 九重氢同位素标记类似物
氘化维生素D代谢物及其类似物作为同位素取代对照品,在维生素D代谢研究及维生素D和其代谢产物或类似物在血浆和组织中通过HPLC-MS进行定量的研究中非常有用。对于维生素D3而言,迄今为止氘化程度最高的是含有8个重氢原子的26, 26, 26, 27, 27, 27, 28, 28-d8-1α, 25-二羟基维生素D3[32]。Sigüeiro等[33]通过硼酸酯与烯醇三氟甲烷磺酸Pd(0) 催化偶联的汇聚法以9%的总收率合成了九重氢标记的类似物27, 27, 27, 26, 26, 26, 28, 28, 28-d9-1α, 25-二羟基维生素D2类似物116(式(21))。该化合物可用作生物样品LC-MS/MS分析的内标,也可用于动物及人类的代谢研究。
6 结语
从构效关系研究出发,多年来各国生物和化学家通过不懈努力对125D2结构进行改造,一方面对临床效果较好的度骨化醇及帕立骨化醇的合成路线不断改进优化,同时设计合成新型维生素D2类似物,并测定其对不同癌细胞的抗增殖和抑制活性,以及合成类似物对VDR的亲和活性、钙转运和钙动员活性,得到了一些具有潜在开发价值的维生素D2类似物。对于维生素D3类似物,迄今为止已合成三千多种,尤其近年来对其设计合成呈现新颖性和多元化,并得到了大量具有潜在开发价值的类似物[5f],这些研究也为125D2类似物的设计、合成及构效关系研究提供一定的借鉴和思路。相信在现有研究基础及不断努力下,可为新型药物的研发提供重要理论依据,同时也会大大降低成本,使活性维生素D2类药物的应用更加广泛,为人类的健康带来更大福音。
-
-
[1]
G Jones, H K Schnoes, H F De Luca. Biochemistry, 1975, 14(6):1250~1256. http://europepmc.org/abstract/med/1078978
-
[2]
H F DeLuca, L A Plum, M Clagett-Dame. J. Steroid. Biochem., 2007, 103(3):263~268. http://www.sciencedirect.com/science/article/pii/S0960076006003773
-
[3]
N Urushino, K Yasuda, S Ikushiro et al. Biochem. Biophys. Res. Commun., 2009, 384(2):144~148. http://europepmc.org/abstract/MED/19393625
-
[4]
G Jones, L A Baxter, H F De Luca et al. Biochemistry, 1976, 15(3):713~716. doi: 10.1007/BF00770319
-
[5]
(a)蔡祖恽. 有机化学, 2013, 33: 2244~2258; (b)汪永辉, 宋卫强, 刘苗等. 华西药学杂志, 2014, 29(4): 455~459; (c)文鹏, 赵梨, 吴坚等. 华西药学杂志, 2011, 26(1): 87~90; (d)俞银芳, 刘兆鹏. 中国药物化学杂志, 2006, 16(5): 311~315; (e) G H Posner, M Kahraman. Eur. J. Org. Chem. , 2003, 2003(20): 3889~3895; (f)胡代花, 陈旺, 王永吉. 化学进展, 2016, 28(6): 839~859.
-
[6]
M Chodyński, J Wietrzyk, E Marcinkowska et al. Steroids, 2002, 67(9):789~798. http://www.sciencedirect.com/science/article/pii/S0039128X02000387
-
[7]
Y Tachibana. Bull. Chem. Soc. Jpn., 1988, 61(11):3915~3918. http://ci.nii.ac.jp/naid/130001981653
-
[8]
孙博, 徐红贵, 文鹏等. 中国新药杂志, 2009, 18(13): 1243~1276. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zxyz200913023&dbname=CJFD&dbcode=CJFQ
-
[9]
B G Anderson, W E Bauta, Jr W R Cantrell. Org. Proc. Res. Dev., 2012, 16(5):967~975. doi: 10.1021/op200346g
-
[10]
刘亚楠. 南京理工大学硕士学位论文, 2015.
-
[11]
Y Ji, X Wang, R J Donnelly et al. J. Cell. Physiol., 2002, 191(2):198~207. http://www.ncbi.nlm.nih.gov/pubmed/12064463
-
[12]
B Filip, M Milczarek, J Wietrzyk et al. J. Steroid. Biochem., 2010, 121(1):399~402. http://www.ncbi.nlm.nih.gov/pubmed/20227499
-
[13]
S Nadkarni, M Chodynski, K Krajewski et al. J. Steroid. Biochem., 2016, 164:45~49. http://www.ncbi.nlm.nih.gov/pubmed/26316152
-
[14]
A Piotrowska, J Wierzbicka, S Nadkarni et al. Int. J. Mol. Sci., 2016, 17(1):76. http://pubmedcentralcanada.ca/pmcc/articles/PMC4730320/
-
[15]
M Chodyński, J Wietrzyk, E Marcinkowska et al. Steroids, 2002, 67(9):789~798. http://www.sciencedirect.com/science/article/pii/S0039128X02000387
-
[16]
J Wietrzyk, D Nevozhay, M Milczarek et al. Cancer. Chemoth. Pharm., 2008, 62(5):787~797. http://www.ncbi.nlm.nih.gov/pubmed/18188568
-
[17]
H Baurska, A Klopot, M Kielbinski et al. J. Steroid. Biochem., 2011, 126(1):46~54. http://europepmc.org/abstract/MED/21550403
-
[18]
N R Bolla, A Corcoran, K Yasuda et al. J. Steroid. Biochem., 2016, 164:50~55.
-
[19]
Z Gándara, M Pérez, X Pérez-García et al. Tetrahed. Lett., 2009, 50(34):4874~4877.
-
[20]
Z Gándara, M Pérez, D G Salomón et al. Bioorg. Med. Chem. Lett., 2012, 22(19):6276~6279.
-
[21]
S Vinhas, S Vázquez, J E Rodríguez-Borges et al. J. Steroid. Biochem., 2016 http://europepmc.org/abstract/MED/27473560
-
[22]
吴淑燕, 顾洒洒, 李晓莉等. 中国药学杂志, 2011, 46(22): 1700~1703. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zgyx201122003&dbname=CJFD&dbcode=CJFQ
-
[23]
万阳, 文鹏, 张攀等. 有机化学, 2012, 32: 1988~1992. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201210028&dbname=CJFD&dbcode=CJFQ
-
[24]
L Li, L Yue, J Xue et al. Chin. Sci. Bull., 2012, 57(14):1616~1619. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=jxtw201214004&dbname=CJFD&dbcode=CJFQ
-
[25]
A Toyoda, H Nagai, T Yamada et al. Tetrahedron, 2009, 65(48):10002~10008.
-
[26]
R Samala, S Sharma, M K Basu et al. Tetrahed. Lett., 2016, 57(12):1309~1312.
-
[27]
A Pietraszek, M Malińska, M Chodyński et al. Steroids, 2013, 78(10):1003~1014. http://europepmc.org/abstract/MED/5125025
-
[28]
M Nachliely, E Sharony, A Kutner et al. J. Steroid. Biochem., 2016, 164:59~65. http://europepmc.org/abstract/med/26365556
-
[29]
J Grote, S Gayda. Tetrahed. Lett., 2014, 55(43):5955~5959. http://www.sciencedirect.com/science/article/pii/S0040403914013161
-
[30]
R Sigüeiro, R Otero, P González-Berdullas et al. J. Steroid. Biochem., 2015, 148:31~33.
-
[31]
李红亮. 南京理工大学硕士学位论文, 2015.
-
[32]
R Bouillon, W H Okamura, A W Norman. Endocr. Rev., 1995, 16(2):200~257. http://onlinelibrary.wiley.com/resolve/reference/PMED?id=7781594
-
[33]
R Sigüeiro, A Álvarez, R Otero et al. J. Steroid. Biochem., 2014, 144:204~206.
-
[1]
-
表 1 维生素D类似物33a~33d对人和鼠白血病细胞(HL-60和WEHI-3) 及人类乳腺癌细胞(T47D和MCF-7细胞株)的体外抑制活性
Table 1. Inhibitory doses in vitro of vitamin D analogues 33a~33d against the human and mouse leukemia (HL-60 and WEHI-3), and human breast carcinoma (T47D and MCF-7 cell lines)
Analogue Inhibitory dose/(nmol/L) ID50 ID40, T47D ID30, MCF-7 HL-60 WEHI-3 125D 15.0±1.14 0.43±0.2 275.0±1.1 114.0±1.1 33a(PRI-1906) 2.2±0.50* 0.28±0.3 819.0±3.1 39.0±1.4* 33b(PRI-1907) 0.1±0.02* 0.16±0.1 35.0±2.1* 39.0±1.3* 33c(PRI-1908) 15.0±3.00 11.0±2.3 -b 137.0±1.2 33d(PRI-1909) -a 47.0±1.8 -c -d * 类似物和骨化三醇之间的统计学显着性差异(P < 0.05);a:最大生长抑制率43%;b:最大生长抑制率为37%;c:最大生长抑制率为20%;d:最大生长抑制率为25%。 表 2 维生素D及其类似物的活性形式对人类CYP24A1基因的代谢转化
Table 2. Metabolic conversion of active forms of vitamins D and of analogues by human CYP24A1
Compound 125D 125D2 33a 37a 33b 37b a Metabolic conversion/% 49 39 2.3 11 0.8 10 a至少2次独立实验的平均值 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 16
- 文章访问数: 2686
- HTML全文浏览量: 291


 下载:
下载:
 下载:
下载:

