
Citation: Jia Kanyan, Jiang Zhijiang, Yu Jingbo, Hong Zikun, Su Weike. An Efficient Synthesis of 2-Vinyl Furans/Thiophenes: Oxidative Heck Coupling under High-Speed Ball-Milling Conditions[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1473-1478. doi: 10.6023/cjoc201612047

一种2-烯基呋喃/噻吩的高效合成方法:高速球磨条件下的氧化Heck偶联反应
English
An Efficient Synthesis of 2-Vinyl Furans/Thiophenes: Oxidative Heck Coupling under High-Speed Ball-Milling Conditions
-
Key words:
- high-speed ball-milling
- / oxidative Heck coupling
- / furan
- / thiophene
-
2-乙烯基呋喃/噻吩作为一类重要的杂芳骨架化合物能够用于制备一系列富有生物活性的功能产物[1].这类杂芳化合物通常采用经典的Wittig和Heck反应制备获得[2], 即采用呋喃醛、噻吩醛与Wittig试剂发生亲核加成或者由2-卤代呋喃/噻吩在Pd(Ⅱ)催化下与烯烃发生偶联.上述方法虽然较为成熟, 但反应原子经济性较低, 易生成副产物, 且反应成本较高, 限制其进一步应用拓展.
近年来, 随着C—H活化反应的快速发展, 氧化Heck偶联作为一种新型的C—C键高效构建方法逐渐取代了经典Wittig和Heck反应成为研究热点[3], 例如Fujiwara等[3a]曾以醋酸-醋酐为混合溶剂, Pd(OAc)2为催化剂, 1, 4-苯醌(p-BQ)与叔丁基过氧化氢为氧化剂在90 ℃条件下经过12~15 h反应合成了一系列脱氢Heck偶联产物; Zhao等[3d]以N, N-二甲基甲酰胺(DMF)为溶剂, Pd(OAc)2为催化剂, 醋酸银为氧化剂, 吡啶为添加剂在120 ℃条件下反应12 h得到了多种2-烯基呋喃/噻吩类化合物.近期, Le Bras课题组[4]同样以呋喃、噻吩等杂化合物为底物, Pd(OAc)2为催化剂, 二甲基亚砜(DMSO)为溶剂, 氧气为氧化剂在常温下反应24~48 h实现了2-烯基杂芳化合物的制备, 并对反应机理进行深入研究.
然而, 在大力提倡绿色反应技术方法的今天, 如何提升反应效率、避免或减少环境不友好溶剂的使用成为各类有机反应突破研究瓶颈的新兴方向.高速球磨(HSBM)作为一种重要的机械化学反应方式, 因其反应条件温和、效率高等优势已经成功应用于多类无溶剂或微溶剂有机化学反应[5].另外, 基于高速球磨在C—H活化反应中所取得的研究进展[6]及本课题组前期的研究基础[7], 为了进一步拓展高速球磨在C—H活化反应中的应用, 本工作设计将微溶剂辅助的机械研磨技术应用于杂芳化合物的氧化Heck反应, 从而快速、高效地获得一系列2-烯基呋喃/噻吩衍生物(Eq. 1).
1 结果与讨论
1.1 反应条件优化
首先, 以2-甲基呋喃(1a, 0.5 mmol)和丙烯酸乙酯(2a, 0.5 mmol)为模板反应底物, Pd(OAc)2 (10 mol%)为催化剂, 未活化的MnO2 (1 mmol)为氧化剂, 微量HOAc (30 μL)为辅助溶剂在30 Hz频率下进行机械研磨, 反应45 min后获得目标偶联产物, 收率为65%(表 1, Entry 1).为了进一步提升反应收率, 对催化剂、氧化剂的种类及用量进行优化.从表 1中可知, 不同的Pd(Ⅱ)催化剂对反应收率的影响不明显(表 1, Entries 1~5), 在PdCl2和PdI2催化下未得到笔者前期研究报道中类似的β, β-双呋喃丙烯酸酯产物[7].且增加2-甲基呋喃(1a)的投料量(表 1, Entry 6), 反应仍能产生β, β-双呋喃丙烯酸酯.随后, 对不同的氧化剂进行筛选(表 1, Entries 7~11), 发现无机金属盐中Cu(OAc)2•H2O的反应效果最佳, 收率可达93%, 而醌类氧化剂, 如对苯醌(BQ)和二氯二氰基苯醌(DDQ), 并未像传统溶液反应中一样表现出良好的反应效果.此外, 还筛选了辅助溶剂的种类, 其中HOAc参与的氧化Heck反应收率最高(表 1, Entries 13~16).进一步降低催化剂及氧化剂的用量, 反应收率并没有明显下降(表 1, Entries 17~20).因此, 优选的机械球磨反应条件为Pd(OAc)2 (5 mol%), Cu(OAc)2•H2O (1.0 equiv.), HOAc (η=0.16 mL/mg).

1.2 底物适用性研究
基于上述优选的反应条件, 进一步考察高速球磨(HSBM)条件下底物的适用范围(表 2). 2-甲基呋喃与丙烯酸酯反应能够以高收率获得相应的偶联产物3aa, 3ab, 而丙烯酰胺2c参与的反应, 产物收率并不理想, 这可能与烯烃底物的反应活性有关.随后, 进一步尝试以氧化体系中稳定性较差且活性较低的芳乙烯为底物[8], 拓展反应的适用性.实验发现, 在研磨条件下各反应均能顺利进行, 以中等至较高收率制备得到一系列
偶联产物3ad~3al, 且反应过程中未有明显的烯烃聚合副产物形成.各类芳乙烯底物中, 含吸电子基的苯乙烯2h~2l反应效果较好; 含供电子基的苯乙烯2e~2g反应活性略有下降.另外, 以呋喃1b为反应底物时, 仅得到单烯基偶联化合物3ba, 未见2, 5-二烯基偶联产物形成.此外, 噻吩类底物同样能够在优选的反应条件下较好的完成反应.值得一提的是, 以2-溴噻吩为反应底物时, 并未检测到传统的Heck偶联产物.
1.3 反应机理研究及探讨
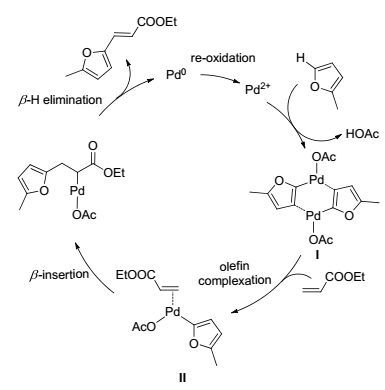
基于笔者前期对氧化Heck反应机理的研究[7]以及对上述实验结果的总结分析, 推测呋喃/噻吩底物在机械球磨条件下的氧化Heck偶联反应机理(Scheme 1).首先, 过渡金属Pd(Ⅱ)插入2-甲基呋喃的2位C—H键形成双分子配合物I.随后, 在醋酸根离子的参与下, 烯烃与Pd(Ⅱ)进行配位形成中间体Ⅱ, 再经β插入与β-H消除反应得到目标产物3aa, 并释放Pd(0).最后, Pd(0) 在Cu(OAc)2•H2O的作用下重新氧化成Pd(Ⅱ), 使反应循环继续.
2 结论
报道了一种在微溶剂辅助球磨条件下的高效氧化Heck偶联反应, 用于制备系列2-烯基噻吩/呋喃衍生物.反应有效避免了高沸点难处理溶剂的使用, 在较短的时间内(45 min)即可以良好的产率获得反式偶联产物.该反应进一步拓宽了机械研磨技术在C—H活化反应中的应用范围.对该反应的应用及反应机理的深入研究目前正在进行中.
3 实验部分
3.1 仪器与试剂
使用振动混合球磨仪MM 400 (Retsch GmbH, Hann, Germany)进行反应, 50 mL不锈钢研磨罐为反应容器; 不锈钢研磨球直径12 mm.数字熔点仪型号为Buchi B-540;核磁共振1H NMR及13C NMR的仪器型号为Varian 400型核磁共振仪, 分别采用400 MHz及100 MHz进行, TMS为内标, CDCl3作溶剂; 质谱MS (ESI, EI)在Finnigan Trace DSQ型质谱仪上测定; 高分辨质谱(HRMS)在Agilent 6210 TOF LC/MS型质谱仪上测定.所有试剂, 如没有特殊说明, 均为市售, 未经处理直接使用.采用硅胶GF254(青岛海洋化工厂)与羧甲基纤维素钠(CMC)自制检测用薄层硅胶板, 活化后使用.产品纯化采用柱层析分离, 层析柱填料为100~200目硅胶(青岛海洋化工厂).
3.2 化合物3的合成方法
将底物1 (0.5 mmol), 2 (0.5 mmol), Cu(OAc)2•H2O (0.5 mmol), Pd(OAc)2 (5 mol%), HOAc (30 μL)和硅胶(0.45 g)一起加入不锈钢球磨罐中, 再加入2颗直径1.4 cm不锈钢球, 然后将盖紧的球磨罐置于球磨机上进行机械研磨.反应完毕, 将球磨罐中的所有固体刮出, 溶解于50 mL分析级乙酸乙酯中.后经过抽滤, 得到的有机相用25 mL饱和食盐水洗, 分液收集有机相, 水相用乙酸乙酯再萃取3次, 每次20 mL, 再将收集的有机相合并, 用无水硫酸钠干燥, 然后将有机相旋干, 通过柱层析分离纯化[洗脱液: V(正己烷):V(乙酸乙酯)=40:1) 得到目标产物.
(E)-2-甲基-5-乙氧羰基乙烯基呋喃(3aa)[3a]:浅黄色液体, 82.8 mg, 收率92%. 1H NMR (400 MHz, CDCl3) δ: 7.33 (d, J=16.0 Hz, 1H), 6.47 (d, J=4.0 Hz, 1H), 6.21 (d, J=16.0 Hz, 1H), 6.05 (d, J=4.0 Hz, 1H), 4.22 (q, J=7.2 Hz, 2H), 2.33 (s, 3H), 1.31 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 166.5, 154.6, 148.9, 130.5, 115.9, 113.7, 108.4, 60.4, 14.9, 14.4; MS (ESI) m/z: 181.0 ([M+H]+).
(E)-2-甲基-5-丁氧羰基乙烯基呋喃(3ab)[9]:无色液体, 93.6 mg, 收率90%. 1H NMR (400 MHz, CDCl3) δ: 7.24 (d, J=16.0 Hz, 1H), 6.43 (d, J=2.8 Hz, 1H), 6.15 (d, J=16.0 Hz, 1H), 6.03 (d, J=3.2 Hz, 1H), 2.32 (s, 3H), 1.50 (s, 9H); 13C NMR (100 MHz, CDCl3) δ: 165.8, 154.2, 149.0, 129.6, 115.8, 115.3, 108.3, 80.0, 28.6, 14.3; MS (ESI) m/z: 209.3 ([M+H]+).
(E)-2-甲基-5-哌啶羰基乙烯基呋喃(3ac):浅黄色液体, 57.3 mg, 收率52%. 1H NMR (400 MHz, CDCl3) δ: 7.39, 7.36 (d, J=15.0, 15.0 Hz, 1H), 6.72, 6.62 (d, J=15.0, 15.0 Hz, 1H), 6.42~6.38 (m, 1H), 6.04~6.01 (m, 1H), 3.71~3.35 (m, 4H), 2.33 (s, 3H), 1.69~1.56 (m, 3H), 1.30~1.12 (m, 4H); 13C NMR (100 MHz, CDCl3) δ: 164.8, 153.8, 150.0, 129.0, 114.6, 112.9, 108.2, 46.7, 43.2, 26.6, 25.6, 24.6, 13.7; IR (KBr) ν: 3000, 2936, 2855, 1648, 1607, 1429, 1254, 1212, 1180, 1020, 967 cm-1; HMRS (ESI) calcd for C13H17NO2 ([M+H]+) 220.1332, found 220.1335.
(E)-2-乙氧羰基乙烯基呋喃(3ba)[10]:无色液体, 56.1 mg, 收率67%. 1H NMR (400 MHz, CDCl3) δ: 7.50~7.43 [m, 2H, including 7.41 (d, J=16.0 Hz, 1H)], 6.58 (d, J=3.2 Hz, 1H), 6.44 (s, 1H), 6.30 (d, J=16.0 Hz, 1H), 4.23 (q, J=7.2 Hz, 2H), 1.31 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 166.7, 150.7, 144.4, 130.7, 115.8, 114.4, 112.0, 60.3, 14.3; MS (ESI) m/z: 166.9 ([M+H]+).
(E)-2-乙氧羰基乙烯基苯并呋喃(3ca):白色晶体, 83.3 mg, 收率77%. m.p. 72~74 ℃ (lit[11]. 78~79 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.89~7.81 (m, 2H), 7.77 (d, J=16.0 Hz, 1H), 7.52 (d, J=8.0 Hz, 1H), 7.40~7.29 (m, 2H), 4.28 (q, J=7.2 Hz, 2H), 1.36 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 166.2, 155.4, 147.0, 133.8, 124.9, 123.3, 120.6, 118.1, 111.7, 60.6, 14.9; MS (ESI) m/z: 217.0 ([M+H]+).
(E)-2-甲基-5-苯乙烯基呋喃(3ad):白色晶体, 72.8 mg, 收率79%. m.p. 57~58 ℃ (lit[4b]. 59~61 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.42 (d, J=8.0 Hz, 2H), 7.30 (t, J=8.0 Hz, 2H), 7.20 (d, J=8.0 Hz, 1H), 6.94 (d, J=16.0 Hz, 1H), 6.81 (d, J=16.0 Hz, 1H), 6.21 (s, 1H), 5.99 (s, 1H), 2.34 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 151.6, 151.0, 136.8, 128.1, 126.7, 125.7, 125.0, 116.3, 109.6, 107.5, 14.3; MS (ESI) m/z: 185.2 ([M+H]+).
(E)-2-甲基-5-(4-甲基苯乙烯基)呋喃(3ae):白色晶体, 67.7 mg, 收率68%. m.p. 76~78 ℃ (lit[4b]. 75~77 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.31 (d, J=8.0 Hz, 2H), 7.10 (d, J=8.0 Hz, 2H), 6.91 (d, J=16.0 Hz, 1H), 6.75 (d, J=16.0 Hz, 1H), 6.18 (d, J=4.0 Hz, 1H), 5.97 (s, 1H), 2.33 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 151.8, 136.9, 134.4, 129.2 (2C), 128.5, 125.9 (2C), 125.3, 115.7, 109.3, 107.6, 21.3, 13.9; MS (ESI) m/z: 199.2 ([M+H]+).
(E)-2-甲基-5-(3-甲基苯乙烯基)呋喃(3af):浅黄色晶体, 70.5 mg, 收率71%. m.p. 69~70 ℃ (lit[4b]. 69~70 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.32 (d, J=8.0 Hz, 2H), 7.11 (d, J=8.0 Hz, 2H), 6.91 (d, J=16.0 Hz, 1H), 6.76 (d, J=16.0 Hz, 1H), 6.19 (d, J=4.0 Hz, 1H), 5.98 (s, 1H), 2.34 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 151.8, 151.7, 136.9, 134.4, 129.2 (2C), 125.9 (2C), 125.3, 115.7, 109.3, 107.6, 21.3, 13.9; MS (ESI) m/z: 199.1 ([M+H]+).
(E)-2-甲基-5-(4-甲氧基苯乙烯基)呋喃(3ag):浅黄色液体, 63.5 mg, 收率59%. 1H NMR (400 MHz, CDCl3) δ: 7.28 (d, J=8.0 Hz, 2H), 6.87~6.73 [m, 3H, including 6.78 (d, J=16.0 Hz, 1H)], 6.60 (d, J=16.0 Hz, 1H), 6.09 (d, J=4.0 Hz, 1H), 5.90 (d, J=4.0 Hz, 1H), 3.72 (s, 3H), 2.26 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 158.8, 151.8, 151.6, 130.0, 127.2 (2C), 125.0, 114.8, 114.0 (2C), 108.9, 107.6, 55.3, 13.9; IR (KBr) ν: 3033, 2963, 2933, 1604, 1506, 1462, 1245, 1032, 956, 810 cm-1; HRMS (ESI) calcd for C14H14O2Na ([M+Na]+) 237.0886, found 237.0879.
(E)-2-甲基-5-(4-氯苯乙烯基)呋喃(3ah)[4b]:白色晶体, 82.4 mg, 收率75%. m.p. 91~93 ℃ (lit[4b]. 89~91 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.32 (d, J=8.0 Hz, 2H), 7.25 (d, J=8.0 Hz, 2H), 6.86 (d, J=16.0 Hz, 1H), 6.75 (d, J=16.0 Hz, 1H), 6.22 (d, J=4.0 Hz, 1H), 5.99 (d, J=4.0 Hz, 1H), 2.33 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 152.3, 151.2, 135.7, 132.5, 128.6 (2C), 127.1 (2C), 123.9, 117.1, 110.3, 107.8, 13.9; MS (ESI) m/z: 219.2 ([M+H]+).
(E)-2-甲基-5-(4-溴苯乙烯基)呋喃(3ai)[12]:浅黄色液体, 106.7 mg, 收率81%. 1H NMR (400 MHz, CDCl3) δ: 7.41 (d, J=8.0 Hz, 2H), 7.26 (d, J=8.0 Hz, 2H), 7.09 (d, J=16.0 Hz, 1H), 6.83 (d, J=4.0 Hz, 1H), 6.67 (d, J=16.0 Hz, 1H), 6.64~6.60 (m, 1H), 2.47 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 140.2, 139.5, 136.0, 131.5 (2C), 127.4 (2C), 126.7, 125.7, 125.5, 122.7, 120.7, 15.8; MS (ESI) m/z: 295.2 ([M+Na]+).
(E)-2-甲基-5-(3-溴苯乙烯基)呋喃(3aj):浅黄色液体, 104.2 mg, 收率79%. 1H NMR (400 MHz, CDCl3) δ: 7.57 (s, 1H), 7.35~7.28 (m, 2H), 7.16 (t, J=8.0 Hz, 1H), 6.85 (d, J=16.0 Hz, 1H), 6.79 (d, J=16.0 Hz, 1H), 6.25 (s, 1H), 6.00 (s, 1H), 2.35 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 151.1, 139.4, 129.9, 129.8 (2C), 128.7, 124.6 (2C), 123.6, 117.8, 110.8, 107.9, 13.9; IR (KBr) ν: 3057, 2921, 2852, 1590, 1636, 1475, 1020, 953, 886, 782 cm-1; HMRS (ESI) calcd for C13H11BrNaO ([M+Na]+) 284.9885, found 284.9896.
(E)-2-甲基-5-(2-溴苯乙烯基)呋喃(3ak):浅黄色液体, 85.3 mg, 收率65%. 1H NMR (400 MHz, CDCl3) δ: 7.54 (t, J=8.0 Hz, 2H), 7.31~7.16 [m, 3H, including (7.26, d, J=16.0 Hz, 1H)], 7.09~7.00 (m, 1H), 6.75 (d, J=16.0 Hz, 1H), 6.28 (d, J=4.0 Hz, 1H), 6.00 (s, 1H), 2.35 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 152.7, 151.4, 143.5, 137.5, 137.1, 133.0, 128.2, 127.3, 126.0, 123.9, 119.2, 110.8, 107.9, 13.9; IR (KBr) ν: 3056, 2920, 2851, 1632, 1588, 1462, 1021, 954, 748 cm-1; HRMS (ESI) calcd for C13H11BrNaO ([M+Na]+) 284.9885, found 284.9880.
(E)-2-甲基-5-(4-氰基苯乙烯基)呋喃(3al):白色晶体, 89.1 mg, 收率85%. m.p. 97~98 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.58 (d, J=8.0 Hz, 2H), 7.48 (d, J=8.0 Hz, 2H), 6.97~6.83 (brm, 2H), 6.33 (d, J=2.8 Hz, 1H), 6.04 (d, J=2.8 Hz, 1H), 2.36 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 153.4, 150.9, 141.9, 132.3 (2C), 126.3 (2C), 123.3, 119.8, 118.9, 112.1, 110.1, 108.2, 13.9; IR (KBr) ν: 3053, 2922, 2224, 1634, 1600, 1497, 1274, 961, 819 cm-1; HRMS (ESI) calcd for C14H11NNaO ([M+Na]+) 232.0733, found 232.0740.
(E)-2-甲基-5-乙氧羰基乙烯基噻吩(3da)[3c]:无色油状物, 83.4 mg, 收率85%. 1H NMR (400 MHz, CDCl3) δ: 7.67 (d, J=16.0 Hz, 1H), 7.03 (d, J=4.0 Hz, 1H), 6.69 (d, J=4.0 Hz, 1H), 6.08 (d, J=16.0 Hz, 1H), 4.22 (q, J=7.2 Hz, 2H), 2.49 (s, 3H), 1.31 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 166.2, 143.2, 137.0, 136.8, 131.0, 126.0, 115.2, 60.4, 16.3, 14.9; MS (ESI) m/z: 197.1 ([M+H]+).
(E)-2-甲基-5-苯乙烯基噻吩(3dd)[13]:白色晶体, 73.4 mg, 收率73%. m.p. 85~86 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.41 (d, J=8.0 Hz, 2H), 7.30 (t, J=8.0 Hz, 2H), 7.22~7.17 (m, 1H), 7.12 (d, J=16.0 Hz, 1H), 6.82 (d, J=3.2 Hz, 1H), 6.76 (d, J=16.0 Hz, 1H), 6.62 (d, J=3.2 Hz, 1H), 2.47 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 140.4, 138.7, 136.7, 128.1, 126.8, 126.6, 125.9, 125.7, 125.3, 121.7, 16.1; MS (ESI) m/z: 201.1 ([M+H]+).
(E)-2-甲基-5-(4-溴苯乙烯基)噻吩(3di)[12]:浅黄色液体, 106.2 mg, 收率76%. 1H NMR (400 MHz, CDCl3) δ: 7.42 (d, J=8.0 Hz, 2H), 7.28 (d, J=8.0 Hz, 2H), 6.86 (d, J=16.0 Hz, 1H), 6.78 (d, J=16.0 Hz, 1H), 6.24 (d, J=4.0 Hz, 1H), 6.03~5.96 (m, 1H), 2.34 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 152.3, 151.2, 136.1, 131.5 (2C), 127.4 (2C), 123.9 (2C), 120.6, 117.1, 110.4, 107.8, 13.9; MS (ESI) m/z: 279.0 ([M+H]+).
(E)-2-乙氧羰基乙烯基噻吩(3ea)[14]:无色液体, 65.3 mg, 收率72%. 1H NMR (400 MHz, CDCl3) δ: 7.76 (d, J=16.0 Hz, 1H), 7.34 (d, J=4.8 Hz, 1H), 7.23 (d, J=3.6 Hz, 1H), 7.06~7.00 (m, 1H), 4.24 (q, J=7.2 Hz, 2H), 1.33 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 166.6, 139.4, 136.8, 130.6, 128.2, 127.9, 117.0, 60.5, 14.5; MS (ESI) m/z: 183.0 ([M+H]+).
(E)-2-乙氧羰基乙烯基苯并噻吩(3fa):白色晶体, 74.5 mg, 收率64%. m.p. 51~52 ℃ (lit[15]. 48~50 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.84 (d, J=16.0 Hz, 1H), 7.42 (s, 1H), 7.37~7.28 (m, 2H), 6.28 (d, J=16.0 Hz, 1H), 4.26 (q, J=8.0 Hz, 2H), 1.34 (t, J=8.0 Hz, 3H); 13C NMR(100 MHz, CDCl3) δ: 166.2, 140.0, 139.4, 137.4, 136.1, 128.4, 126.0, 124.2, 122.3, 119.4, 60.7, 14.4; MS (ESI) m/z: 233.1 ([M+H]+).
(E)-2-溴-5-乙氧羰基乙烯基噻吩(3ga)[16]:浅黄色液体, 115.1 mg, 收率88%. 1H NMR (400 MHz, CDCl3) δ: 7.62 (d, J=16.0 Hz, 1H), 7.02~6.93 (m, 2H), 6.10 (d, J=16.0 Hz, 1H), 4.23 (q, J=7.2 Hz, 2H), 1.32 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 165.6, 140.5, 135.5, 130.5 (2C), 117.0, 115.4, 60.7, 14.8; MS (ESI) m/z: 261.9 ([M+H]+).
辅助材料(Supporting Information) 所合成的化合物3aa~3da等20个化合物的原始氢谱及碳谱谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Paquette, L. A.; Efremov, I. J. Am. Chem. Soc. 2001, 123, 4492.(b) Reiter, M.; Torssell, S.; Lee, S.; MacMillan, D. W. C. Chem. Sci. 2010, 1, 37.(c) Pisani, L.; Barletta, M.; Soto-Otero, R.; Nicolotti, O.; Mendez-Alvarez, E.; Catto, M.; Introcaso, A.; Stefanachi, A.; Cellamare, S.; Altomare, C.; Carotti, A. J. Med. Chem. 2013, 56, 2651.(d) Simonetti, S. O.; Larghi, E. L.; Bracca, A. B. J.; Kaufman, T. S. Nat. Prod. Rep. 2013, 30, 941.
-
[2]
(a) Berthiol, F.; Feuerstein, M.; Doucet, H.; Santelli, M. Tetrahedron Lett. 2002, 43, 5625.(b) Pankova, A. S.; Sorokina, M. V.; Kuznetsov, M. A. Tetrahedron Lett. 2015, 56, 5381.(c) Škorića, I.; Flegara, I.; Marinić, Ž.; Šindler-Kulyk, M. Tetrahedron 2006, 62, 7396.(d) Liu, W.-D.; Wang, D.-F.; Duan, Y.-J.; Zhang, Y.-H.; Bian, F.-L. Tetrahedron Lett. 2015, 56, 1784.
-
[3]
(a) Jia, C.-G.; Lu, W.-J.; Kitamura, T.; Fujiwara, Y. Org. Lett. 1999, 1, 2097.(b) Yokota, T.; Tani, M.; Sakaguchi, S.; Ishii, Y. J. Am. Chem. Soc. 2003, 125, 1476.(c) Tani, M.; Sakaguchi, S.; Ishii, Y. J. Org. Chem. 2004, 69, 1221.(d) Zhao, J.; Huang, L.; Cheng, K.; Zhang, Y. Tetrahedron Lett. 2009, 50, 2758.(e) Su, Y.-J.; Jiao, N. Curr. Org. Chem. 2011, 15, 3362
-
[4]
(a) Thiery, E.; Harakat, D.; Le Bras, J.; Muzart, J. Organometallics 2008, 27, 3996.
(b) Aouf, C.; Thiery, E.; Le Bras, J.; Muzart, J. Org. Lett. 2009, 11, 4096.
(c) Vasseur, A.; Harakat, D.; Muzart, J.; Le Bras, J. J. Org. Chem. 2012, 77, 5751.
(d) Vasseur, A.; Harakat, D.; Muzart, J.; Le Bras, J. Adv. Synth. Catal. 2013, 355, 59. -
[5]
(a) Wang, G.-W. Chem. Soc. Rev. 2013, 42, 7668.
(b) Hernández, J. G.; Friščić, T. Tetrahedron Lett. 2015, 56, 4253. -
[6]
(a) Hermann, G. N.; Becker, P.; Bolm, C. Angew. Chem., Int. Ed. 2015, 54, 7414.
(b) Hernández, J. G.; Bolm, C. Chem. Commun. 2015, 51, 12582.
(c) Hermann, G. N.; Becker, P.; Bolm, C. Angew. Chem., Int. Ed. 2016, 55, 3781.
(d) Lou, S.-J.; Mao, Y.-J.; Xu, D.-Q.; He, J.-Q.; Chen, Q.; Xu, Z.-Y. ACS Catal. 2016, 6, 3890. -
[7]
Jia, K.-Y.; Yu, J.-B.; Jiang, Z.-J.; Su. W.-K. J. Org. Chem. 2016, 81, 6049. doi: 10.1021/acs.joc.6b01138
-
[8]
Cornell, C. N.; Sigman, M. S. Inorg. Chem. 2007, 46, 1903. doi: 10.1021/ic061858d
-
[9]
Hashmi, A. S. K.; Hamzic, M.; Rominger, F.; Bats, J. W. Chem. Eur. J. 2009, 15, 13318. doi: 10.1002/chem.200901695
-
[10]
Shearouse, W. C.; Mac, J. Green Chem. 2012, 14, 2771. doi: 10.1039/c2gc35669d
-
[11]
Maillard, J.; Langlois, M.; Tri, V. V.; Guillonneau, C.; Legeai, J.; Benharkate, M.; Blozovski, M. Eur. J. Med. Chem. 1983, 18, 353.
-
[12]
Vasseur, A.; Muzart, J.; Le Bras, J. Chem. Eur. J. 2011, 17, 12556. doi: 10.1002/chem.201101992
-
[13]
Tominaga, Y.; Tedjamulia, M. L.; Castle, R. N.; Lee, M. L. J. Heterocycl. Chem. 1983, 20, 487. doi: 10.1002/jhet.v20:2
-
[14]
Hyotanishi, M.; Isomura, Y.; Yamamoto, H.; Kawasaki, H.; Obora, Y. Chem. Commun. 2011, 47, 5750. doi: 10.1039/c1cc11487e
-
[15]
Matsunaga, N.; Kaku, T.; Itoh, F.; Tanaka, T.; Hara, T.; Miki, H.; Iwasaki, M.; Aono, T.; Yamaoka, M.; Kusaka, M. Bioorg. Med. Chem. 2004, 12, 2251. doi: 10.1016/j.bmc.2004.02.007
-
[16]
Miller, R. E.; Nord, F. F. J. Org. Chem. 1950, 15, 89. doi: 10.1021/jo01147a015
-
[1]
-
表 1 反应条件优化a
Table 1. Optimization of reaction conditions

表 2 钯催化的氧化Heck反应a, b
Table 2. Palladium-catalyzed oxidative Heck reaction

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 6
- 文章访问数: 958
- HTML全文浏览量: 135


 下载:
下载:
 下载:
下载:

