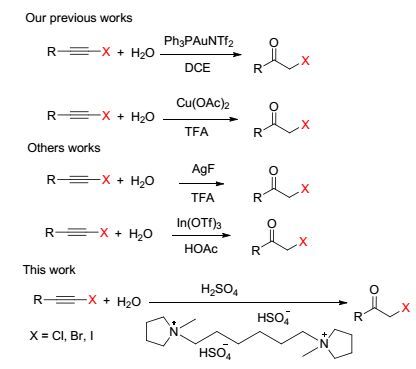
 图 1
卤代炔烃水解的几种方法
Figure Figure1.
Methods for hydration of haloalkynes
图 1
卤代炔烃水解的几种方法
Figure Figure1.
Methods for hydration of haloalkynes

Citation: Fu Wenqiang, Tan Ping, Deng Wei, Xiang Jiannan. Efficient Hydrolysis of Haloalkynes to α-Haloketones in Ionic Liquid[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1501-1505. doi: 10.6023/cjoc201610031

离子液体中卤代炔烃高效水解制取α-卤代甲基酮的研究
English
Efficient Hydrolysis of Haloalkynes to α-Haloketones in Ionic Liquid
-
Key words:
- ionic liquid
- / haloalkynes
- / hydration
- / α-haloketones
- / recyclable
-
由于α-卤代甲基酮在构建具有生物活性的杂环化合物[1]和天然产物[2]方面具有广泛的应用, 而引起人们关注.除此之外, 一些α-卤代甲基酮本身就具有生物活性, 常常应用于药物或者辅助药物, 例如酶抑制剂[3].传统的关于制得α-卤代甲基酮报道的方法有很多, 大多是利用卤素或者相关卤代试剂与烯烃、酮等发生卤化反应[4].然而, 这些反应都具有一定的局限性.例如, 使用到有毒和腐蚀性极强的卤素单质、反应时间长、条件苛刻、易形成过卤化物等.为了克服这些问题, 本课题组开创了利用Au[5]、Cu[6]等金属催化剂催化卤代炔烃水解制得α-卤代甲基酮的新方法(图 1).随之使用金属催化剂如Ag[7a]、In[7b]催化卤代炔烃水解的方法得到发展.虽然上述反应有各自的优点, 但是金属催化剂价格昂贵, 不便于回收, 对环境造成污染等弊端显得十分突出.因此发展一种新的成本低廉、绿色无污染制取α-卤代甲基酮的方法很有必要.
离子液体反应体系在有机合成方面具有许多的优良性能而被广泛关注[8]. 2011年, Wong等[9]报道了一种新型离子液体反应体系对水解反应具有很好的催化促进作用.因此, 作者合成了该新型离子液体, 研究了卤代炔烃在该新型离子液体水解反应及反应体系的循环使用情况, 创建了一种在离子液体反应体系中卤代炔烃水解生成α-卤代甲基酮的新方法.该方法具有反应效率高、时间短、条件温和、不需要加入金属催化剂等优点, 同时, 该催化反应体系可循环使用, 绿色经济无污染.
1 结果与讨论
参考Wong的方法, 合成了这种离子液1•(HSO4)2 (Eq. 1).
用离子液体1•(HSO4)2作为反应介质, 以苯乙炔溴(1a)为模型底物对反应的条件进行了优化, 通过对温度、硫酸加入量、反应物配比等条件的筛选, 确定了反应的最优条件, 实验结果见表 1.
从表 1可知, 最初0.5 mmol苯乙炔溴、0.5 mmol H2O加入到3.5 mmol的离子液体1•(HSO4)2中, 加入7.5 mmol H2SO4在室温下反应2 h得到α-溴代甲基酮(2a)的收率为23%.首先探索了温度对反应收率的影响, 当反应体系的温度从室温升高至40、70 ℃(表 1, Entries 2, 3) 反应收率在70 ℃时最高达到68%;温度继续升高至90 ℃(表 1, Entry 4), 产率反而降低, 这是因为温度过高, 反应物水会蒸发冷凝在反应瓶口附近, 影响反应收率.随后考察了硫酸量对反应收率的影响(表 1, Entries 5~8), 当没有硫酸加入时, 该反应不能发生; 随着加入H2SO4量的增加, 反应收率增加, 发现当加至8 equiv. (表 1, Entry 8), 反应收率达69%不再随之上升.最后对反应底物苯乙炔溴(1a)与H2O的配比研究发现:当1a与H2O为1:2 (物质的量比)时, 反应收率高达93%.TLC监测反应时间, 发现2 h, 可完成反应.通过上述对反应体系的优化, 最佳反应条件是在离子液体中70 ℃, 反应物及硫酸配比为1a:H2O:H2SO4=1:2:8(物质的量比).
在最佳反应条件下, 探索了这种反应体系的可循环性, 10 mmol苯乙炔溴、20 mmol H2O加入到70 mmol的离子液体1•(HSO4)2中, 加入80 mmol H2SO4进行反应.反应结束冷却至室温, 反应产物用乙酸乙酯萃取用于反应收率计算, 离子液体-H2SO4体系真空干燥24 h后直接用于下一次循环.在下一次循环中, 只需加入10 mmol苯乙炔溴、20 mmol H2O在相同条件下进行反应.通过5次实验, 每次循环中反应产率都在90%以上.因此, 这种反应体系十分稳定, 可在催化卤代炔烃水解反应中循环使用.
在最优的反应条件下, 选用不同的卤代炔烃进行了底物适用性的研究, 实验结果如表 3.实验结果表明, 该反应体系具有广泛的底物适用性.无论在苯环上的取代基是供电子基团(如2c, 89%)还是吸电子基团(如2f, 88%), 无论在对位(如2b, 93%)、间位(如2m, 91%)、邻位(如2o, 90%), 反应都具有极高的收率, 也说明该反应中苯环上取代基的电子效应和空间效应对该反应的影响不大.同时, 脂肪类及杂环类卤代炔烃, 同样适用于该反应体系(如2u, 2v, 2w).另外, 我们发现不仅苯乙炔溴可以发生该反应, 苯乙炔氯(2s, 94%)、苯乙炔碘(2t, 85%)同样可以以较高的反应收率获得相应的产物, 且卤素原子吸电子能力越强, 相应产物产率越高.
2 结论
本文发展了一种新的α-卤代甲基酮的制备方法.在离子液体-硫酸反应体系中卤代炔烃与水以1:2的物质的量比, 85%~94%的收率生成α-卤代甲基酮.该方法不需要使用金属催化剂, 原料便宜易得, 反应条件温和(70 ℃), 反应效率高、时间短(2 h).此外, 该反应催化体系可循环使用, 具有经济环保等优点.
3 实验部分
3.1 仪器与试剂
所有原料均购于百灵威科技有限公司、萨恩-安耐吉化学技术(上海)有限公司等, 未进一步处理. 1H NMR (400 MHz)和13C NMR (100 MHz)使用Brucker ARX 400 FT NMR (CDCl3为溶剂, TMS为内标物)型核磁共振仪测定. SGW-1 X-4显微熔点仪测定熔点.柱层析用硅胶200~300目.
3.2 实验方法
卤代炔烃水解的一般方法
在干燥的10 mL圆底烧瓶中加入离子液体1•(HSO4)2 (1.55 g, 3.5 mmol), H2SO4 (0.39 g, 4.0 mmol), H2O (18 mg, 1.0 mmol)以及0.5 mmol卤代苯乙炔, 置于70 ℃油浴锅中搅拌反应, 薄层色谱(TLC)监测反应进度, 2 h反应结束.待冷却至室温后, 用5 mL乙酸乙酯萃取三次, 收集有机相旋转蒸发除去乙酸乙酯后经柱层析[乙酸乙酯/石油醚]纯化分离得到产物.
离子液体催化体系循环方法
在干燥的100 mL圆底烧瓶中加入离子液体1•(HSO4)2 (31.0 g, 70 mmol), 1a (1.81 g, 10 mmol), H2O (360 mg, 20 mmol), H2SO4 (7.84 g, 80 mmol), 置于70 ℃油浴锅中搅拌反应, 薄层色谱(TLC)监测反应进度, 反应结束待冷却至室温后, 用50 mL乙酸乙酯萃取产物三次用于反应收率计算, 收集离子液体-H2SO4体系并于真空干燥箱中, 60 ℃、-0.09 MPa(相对真空度), 真空干燥24 h, 充分干燥后直接用于下一次循环.
α-溴代苯乙酮(2a)[6]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 90.5 mg, 收率91%.无色晶体, m.p. 50~51 ℃ (lit.[10] 50~51 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.91 (d, J=7.2 Hz, 2H), 7.56~7.52 (m, 1H), 7.44~7.40 (m, 2H), 4.38 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 191.3, 134.0, 133.9, 128.9, 128.8, 30.9.
α-溴代-4-甲基苯乙酮(2b)[11]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 99.0 mg, 收率93%.无色晶体, m.p. 51~52 ℃ (lit.[10] 50~51 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.81 (d, J=8.4 Hz, 2H), 7.22 (d, J=8.0 Hz, 2H), 4.35 (s, 2H), 2.36 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 190.9, 145.0, 131.3, 129.5, 129.0, 31.0, 21.7.
α-溴代-4-甲氧基苯乙酮(2c)[12]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 101.9 mg, 收率89%.无色晶体, m.p. 73~74℃ (lit.[5] 73~74 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.89 (d, J=8.8 Hz, 2H), 6.88 (d, J=8.8 Hz, 2H), 4.32 (s, 2H), 3.81 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 189.9, 164.1, 131.3, 126.9, 114.0, 55.5, 30.7.
α-溴代-4-苯基苯乙酮(2d)[6]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 123.8 mg, 收率90%.无色晶体, m.p. 126~127 ℃ (lit.[13] 126.3~127 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.99 (d, J=7.6 Hz, 2H), 7.64 (d, J=7.6 Hz, 2H), 7.56 (d, J=7.2 Hz, 2H), 7.42~7.39 (m, 2H), 7.36~7.32 (m, 1H), 4.40 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 190.9, 146.6, 139.5, 132.6, 129.5, 129.0, 128.5, 127.4, 127.3, 30.8.
α-溴代-4-乙酰氧基苯乙酮(2e)[14]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 111.8 mg, 收率87%.无色晶体, m.p. 66~67 ℃ (lit.[15] 67 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.96 (d, J=8.4 Hz, 2H), 7.16 (d, J=8.4 Hz, 2H), 4.36 (s, 2H), 2.26 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 190.1, 168.7, 154.9, 131.4, 130.6, 122.1, 30.6, 21.1.
α-溴代-4-氟苯乙酮(2f)[11]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 95.5 mg, 收率88%.无色晶体, m.p. 49~50 ℃ (lit.[5] 49~50 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.99~7.90 (m, 2H), 7.12~7.08 (m, 2H), 4.34 (s, 2H); 13C NMR (100 MHz, CDCl3)δ: 189.8, 131.8, 131.7, 130.9, 130.3, 116.2, 116.0, 30.4.
α-溴代-4-氯苯乙酮(2g)[7a]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 103.7 mg, 收率89%.无色晶体, m.p. 96~97 ℃ (lit.[15] 96~97 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.86 (d, J=8.4 Hz, 2H), 7.40 (d, J=8.4 Hz, 2H), 4.33 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 190.2, 140.5, 132.2, 130.4, 129.2, 30.3.
α-溴代-4-碘苯乙酮(2h)[16]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 143.0 mg, 收率88%.无色晶体, m.p. 113~114 ℃ (lit.[17] 113.5 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.80 (d, J=8.0 Hz, 2H), 7.62 (d, J=8.0 Hz, 2H), 4.32 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 190.7, 138.2, 133.1, 130.2, 102.2, 30.3.
α-溴代-4-三氟甲基苯乙酮(2i)[7a]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 114.8 mg, 收率86%.无色油状物; 1H NMR (400 MHz, CDCl3) δ: 8.03 (d, J=8.0 Hz, 2H), 7.70 (d, J=8.0 Hz, 2H), 4.38 (s, 2H); 13C NMR (101 MHz, CDCl3) δ: 190.4, 136.6, 135.3, 135.0, 129.3, 125.9, 30.3.
α-溴代-4-硝基苯乙酮(2j)[7a]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 106.1 mg, 收率87%.无色晶体, m.p. 95~97℃ (lit.[18] 98 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.35 (d, J=8.4 Hz, 2H), 8.17 (d, J=8.4 Hz, 2H), 4.47 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 189.9, 150.7, 138.3, 130.1, 124.0, 30.1.
α-溴代-4-氰基苯乙酮(2k)[7a]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 96.3 mg, 收率86%.淡黄色固体, m.p. 92~93 ℃ (lit.[19] 92~94 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.02 (d, J=7.6 Hz, 2H), 7.74 (d, J=8.0 Hz, 2H), 4.37 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 190.1, 136.9, 132.7, 129.4, 117.6, 117.1, 30.0.
α-溴代-3-溴苯乙酮(2l)[14]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 122.3 mg, 收率88%.无色晶体, m.p. 51~52 ℃ (lit.[5] 51~52 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.03 (s, 1H), 7.82 (d, J=7.6 Hz, 1H), 7.66 (d, J=8.0 Hz, 1H), 7.32~7.28 (m, 1H), 4.34 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 190.0, 136.7, 135.6, 131.8, 130.4, 127.4, 123.1, 30.5.
α-溴代-3-甲基苯乙酮(2m)[11]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 96.9 mg, 收率91%.无色晶体, m.p. 47~48 ℃ (lit.[5] 47~48 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.70 (d, J=11.2 Hz, 2H), 7.36~7.28 (m, 2H), 4.37 (s, 2H), 2.35 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 191.4, 138.8, 134.7, 134.0, 129.3, 128.7, 126.1, 31.0, 21.3.
α-溴代-3-羟基苯乙酮(2n)[7b]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 95.7 mg, 收率89%.淡黄色油状物; 1H NMR (400 MHz, CDCl3) δ: 7.43 (d, J=7.6 Hz, 2H), 7.30~7.26 (m, 1H), 7.07 (d, J=7.2 Hz, 1H), 6.79 (s, 1H), 4.39 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 192.1, 156.5, 135.2, 130.2, 121.7, 121.3, 115.3, 31.2.
α-溴代-2-甲基苯乙酮(2o)[11]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 95.9 mg, 收率90%.淡黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.60 (d, J=8.0 Hz, 1H), 7.38~7.34 (m, 1H), 7.23 (d, J=7.2 Hz, 2H), 4.35 (s, 2H), 2.46 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 194.2, 139.7, 134.4, 132.3, 132.3, 130.0, 125.8, 33.7, 21.4.
α-溴代-2-氯苯乙酮(2p)[6]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 106.0 mg, 收率91%.淡黄色油状物; 1H NMR (400 MHz, CDCl3) δ: 7.50 (d, J=7.6 Hz, 1H), 7.38 (d, J=4.0 Hz, 2H), 7.32~7.27 (m, 1H), 4.45 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 194.0, 136.2, 132.7, 131.3, 130.6, 130.2, 127.1, 34.5.
2-溴-2-萘乙酮(2q)[7a]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 112.0 mg, 收率90%.淡黄色油状物; 1H NMR (400 MHz, CDCl3) δ: 8.43 (s, 1H), 7.96~7.89 (m, 2H), 7.87~7.78 (m, 2H), 7.57~7.48 (m, 2H), 4.51 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 191.3, 135.9, 132.4, 131.3, 131.0, 129.7, 129.0, 128.8, 127.8, 127.1, 124.1, 30.9.
1-(1, 3-苯并氧)2-溴乙酮(2r)[20]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 106.9 mg, 收率88%.白色固体, m.p. 86~87 ℃ (lit.[20] 88 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.51 (d, J=8.4 Hz, 1H), 7.38 (s, 1H), 6.80 (d, J=8.4 Hz, 1H), 5.99 (s, 2H), 4.30 (s, 2H).13C NMR (100 MHz, CDCl3)δ: 189.5, 152.5, 148.4, 128.6, 125.6, 108.6, 108.1, 102.1, 30.5.
α-氯代苯乙酮(2s)[6]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 72.4 mg, 收率94%.无色晶体, m.p. 56~58 ℃ (lit.[5] 57~58 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.95 (d, J=7.2 Hz, 2H), 7.63~7.59 (m, 1H), 7.51~7.47 (m, 2H), 4.72 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 191.1, 134.2, 134.0, 128.9, 128.5, 46.1.
α-碘代苯乙酮(2t)[7b]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 104.5 mg, 收率85%.无色油状物; 1H NMR (400 MHz, CDCl3) δ: 7.91 (d, J=7.6 Hz, 2H), 7.54~7.50 (m, 1H), 7.43~7.39 (m, 2H), 4.29 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 192.8, 133.8, 133.428, 129.0, 128.8.
1-溴-6-乙酰氧基-2-己酮(2u)[7b]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 105.5 mg, 收率89%.无色油状物; 1H NMR (400 MHz, CDCl3) δ: 4.00 (t, J=6.0 Hz, 2H), 3.83 (s, 2H), 2.64 (t, J=6.8 Hz, 2H), 1.98 (s, 3H), 1.63~1.59 (m, 4H); 13C NMR (100 MHz, CDCl3) δ: 201.6, 171.1, 63.8, 39.0, 34.1, 27.7, 20.9, 20.1.
2-溴-1-环己基乙酮(2v)[7b]:展开剂: V(乙酸乙酯):V(石油醚)=1:40, 89.2 mg, 收率87%.无色油状物; 1H NMR (400 MHz, CDCl3) δ: 3.92 (s, 2H), 2.64 (t, J=11.2 Hz, 1H), 1.81 (d, J=13.2 Hz, 2H), 1.73 (d, J=12.4 Hz, 2H), 1.61 (d, J=10.4 Hz, 1H), 1.36~1.16 (m, 5H).
3-溴乙酰基噻吩(2w)[6]:展开剂: V(乙酸乙酯):V(石油醚)=1:20, 87.1 mg, 收率85%.无色晶体, m.p. 62~63 ℃ (lit.[5] 62~63 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.11 (s, 1H), 7.51 (d, J=5.2 Hz, 1H), 7.31~7.29 (m, 1H), 4.27 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 185.5, 138.7, 133.8, 127.3, 126.9, 31.6.
辅助材料(Supporting Information) 化合物原始核磁共振谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Erian, A. W.; Sherif, S. M.; Gaber, H. M. Molecules 2003, 8, 793.
(b) Zhang, H.; Wei, Q.; Wei, S.; Qu, J.; Wang, B. Eur. J. Org. Chem. 2016, 3373. -
[2]
De Kimpe, N.; Verhé, R. The Chemistry of α-Haloketones, α-Haloaldehydes and α-Haloimines, Ed.: Patai, S., Wiley, Chichester, UK, 1988, pp. 1~119.
-
[3]
(a) Ostrowski, T.; Golankiewicz, B.; De Clercq, E.; Andrei, G.; Snoeck, R. Eur. J. Med. Chem. 2009, 44, 3313.
(b) Conde, S.; Pérez, D. I.; Martínez, A.; Perez, C.; Moreno, F. J. J. Med. Chem. 2003, 46, 4631. -
[4]
(a) Morton, H. E.; Leanna, M. R. Tetrahedron Lett. 1993, 34, 4481.
(b) Patil, R. D.; Joshi, G.; Adimurthy, S.; Ranu, B. C. Tetrahedron Lett. 2009, 50, 2529.
(c) Tanemura, K.; Suzuki, T.; Nishida, Y.; Satsumabayashi, K.; Horaguchi, T. Chem. Commun. 2004, 470.
(d) Meshram, H. M.; Reddy, P. N.; Vishnu, P.; Sadashiv, K.; Yadav, J. S. Tetrahedron Lett. 2006, 47, 991.
(e) Pravst, I.; Zupan, M.; Stavber, S. Tetrahedron 2008, 64, 5191.
(f) Kosower, E. M.; Wu, G. S. J. Org. Chem. 1963, 28, 633.
(g) Kajigaeshi, S.; Kakinami, T.; Moriwaki, M.; Fujisaki, S.; Maeno, K.; Okamoto, T. Synthesis 1988, 545.
(h) Dieter, R. K.; Nice, L. E.; Velu, S. E. Tetrahedron Lett. 1996, 37, 2377. -
[5]
Xie, L.; Wu, Y.; Yi, W.; Zhu, L.; Xiang, J.; He, W. J. Org. Chem. 2013, 78, 9190. doi: 10.1021/jo401437w
-
[6]
Zou, H.; He, W.; Dong, Q.; Wang, R.; Yi, N.; Jiang, J.; Peng, D.; He, W. Eur. J. Org.Chem. 2016, 116.
-
[7]
(a) Chen, Z.; Ye, D.; Ye, M.; Zhou, Z.; Li, S.; Liu, L. Tetrahedron Lett. 2014, 55, 1373.
(b) Zeng, M.; Huang, R.; Li, W.; Liu, X.; He, F.; Zhang, Y.; Xiao, F. Tetrahedron Lett. 2016, 72, 3818. -
[8]
(a) Olivier-Bourbigou, H.; Magna, L.; Morvan, D. Appl. Catal. A: Gen. 2010, 373, 1.
(b) Hu, Y.; Guo, Z.; Lue, B. M.; Xu, X. J. Agric. Food Chem. 2009, 57, 3845.
(c) Tzani, A.; Douka, A.; Papadopoulos, A.; Pavlatou, E. A.; Voutsas, E.; Detsi, A. ACS Sustainable Chem. Eng. 2013, 1, 1180. -
[9]
Wong, W.; Ho, K.; Lee, L.; Lam, K.; Zhou, Z.; Chan, T.; Wong, K. ACS Catal. 2011, 1, 116. doi: 10.1021/cs100016h
-
[10]
Wei, Q. L.; Zhang, S. S.; Gao, J.; Li, W. H.; Xu, L. Z.; Yu, Z. G. Bioorg. Med. Chem. 2006, 14, 7146. doi: 10.1016/j.bmc.2006.06.065
-
[11]
Reddy Bodireddy, M.; Gangi, R. N. C. Synth. Commun. 2013, 43, 2603. doi: 10.1080/00397911.2012.725264
-
[12]
Guan, X.; AlMisbaa, Z.; Huang, K. Arabian J. Chem. 2015, 8, 892. doi: 10.1016/j.arabjc.2014.01.024
-
[13]
Sugiura, A.; Kepner, R. E.; Webb, A. D. J. Org. Chem. 1962, 27, 773. doi: 10.1021/jo01050a020
-
[14]
Jiang, Q.; Sheng, W.; Guo, C. Green Chem. 2013, 15, 2175 doi: 10.1039/c3gc40515j
-
[15]
Rosenmund, K. W. Chem. Ber. 1957, 90, 1922. doi: 10.1002/(ISSN)1099-0682
-
[16]
Lapointe, D.; Markiewicz, T.; Whipp, C. J.; Toderian, A.; Fagnou, K. J. Org. Chem. 2011, 76, 749. doi: 10.1021/jo102081a
-
[17]
Judefind, W. L. J. Am. Chem. Soc. 1920, 42, 1043. doi: 10.1021/ja01450a019
-
[18]
Arrieta, A. Synth. Commun. 1984, 14, 939. doi: 10.1080/00397918408063764
-
[19]
Suzuki, M. Yakugaku Zasshi 1952, 72, 305. doi: 10.1248/yakushi1947.72.3_305
-
[20]
Antunes, H.; Fardelone, L. C.; Rodrigues, J. A. R.; Moran, P. J. S. Tetrahedron: Asymmetry 2004, 15, 2615. doi: 10.1016/j.tetasy.2004.07.029
-
[1]
-
表 1 反应条件筛选a
Table 1. Screening of the reaction conditions

表 3 反应适用性研究a, b
Table 3. Reaction scope

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 4
- 文章访问数: 1327
- HTML全文浏览量: 203


 下载:
下载:
 下载:
下载:

