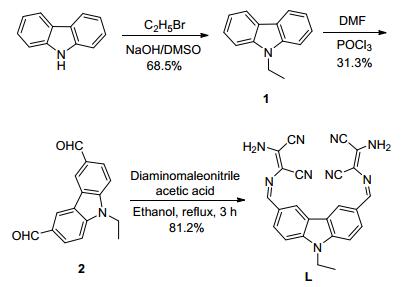
 图 图式1
探针L的合成路线
Figure 图式1.
Synthetic route of probe L
图 图式1
探针L的合成路线
Figure 图式1.
Synthetic route of probe L

Citation: Li Yingjun, Li Jiyang, Xu Yongting, Jin Kun, Cao Xin. Highly Selective Naked-Eye and Fluorescence Probe for Cu2+ Based on Carbazole Schiff-Base[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 896-901. doi: 10.6023/cjoc201611014

基于咔唑-席夫碱的高选择性裸眼和荧光识别Cu2+的探针
English
Highly Selective Naked-Eye and Fluorescence Probe for Cu2+ Based on Carbazole Schiff-Base
-
Key words:
- carbazole
- / Schiff base
- / naked-eye recognition
- / Cu2+ fluorescence probe
-
Cu2+在环境、生物和化学领域起着重要的作用, 是人体中含量仅低于锌和铁的过渡金属元素[1~5].当其在人体中过量时, 可导致一系列的神经变性疾病, 如门克斯综合症[6]、阿尔茨海默氏症[7]、威尔逊氏症和帕金森症[8, 9].因铜的广泛应用, 所以它也是一个重要的金属污染物[6].根据世界卫生组织 (WHO) 规定, 饮用水中可接受Cu2+的最大含量为20 μmol/L[10~12].由于Cu2+的动态平衡对生理学和病理学的重要性, 以及Cu2+对环境污染, 所以近年来检测Cu2+已备受人们的关注.
利用荧光化学传感器检测金属离子正逐渐成为环境监测和生物科学的研究热点, 因为这类传感器具有灵敏度高、选择性强、容易制造的优点.所以, 开发检测过渡金属离子和重金属离子的荧光化学传感器是化学、环境科学和生物科学一个活跃且令人着迷的研究领域[13].咔唑类化合物因其具有良好的共平面性、强的分子内电荷转移、良好的溶解性、稳定性、结构修饰简便等许多优点, 咔唑基团常被用作荧光团.咔唑类化合物在荧光探针方面具有重要的应用价值, 近几年来已成为\研究热点[14~20].席夫碱是一类重要的被广泛探索的有机化合物之一.由于其合成成本低、容易合成并具有巨大的应用, 因而激发了研究人员将席夫碱作为化学传感器用于选择性检测有毒金属离子的研究[4, 21].虽然许多席夫碱类化合物已被用作检测各种金属离子的探针[22~34], 但咔唑-席夫碱作为检测Cu2+的荧光探针研究报道很少[16, 35].基于上述思路, 本文以咔唑为起始原料合成了目标化合物L (Scheme 1), 期望目标化合物L在离子识别方面具有潜在的应用价值.
1 结果与讨论
1.1 裸眼识别
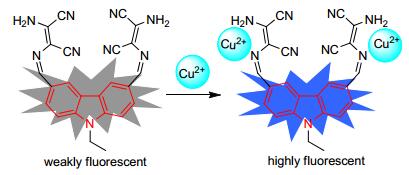
向探针L的CH3CN溶液 (1.0×10-5 mol/L) 中分别加入1.0 equiv.不同的阳离子, 然后在日光下和紫外灯照射下 (λ=365 nm) 观察溶液颜色的变化情况.如图 1所示, 向探针L的CH3CN溶液加入Cu2+后, 在日光下观察发现, 溶液的颜色由黄色变成无色, 而加入其它金属离子后溶液的颜色无明显变化; 在紫外灯照射下 (λ= 365 nm) 观察发现, 加入Cu2+后溶液发蓝光, 加入其它金属离子后溶液无明显发光变化.这表明探针L与Cu2+具有较强的作用力.探针L可以裸眼识别Cu2+, 是识别Cu2+的化学传感器.
1.2 探针L的光谱性能研究
1.2.5 探针L与Cu2+的络合方式
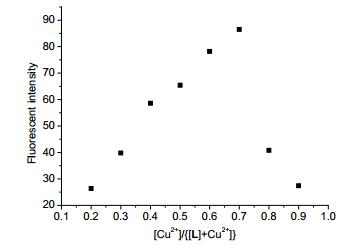
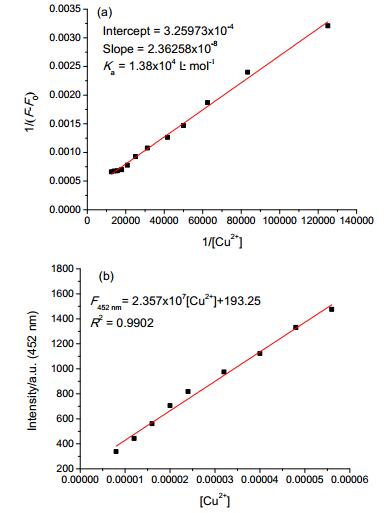
为了进一步研究探针L与Cu2+之间的络合比, 采用等物质的量连续变化法 (Job’s Plot)[36, 37]计算两者的络合比.随着Cu2+摩尔分数的不断改变, 体系的荧光强度在452 nm处随之变化, 如图 7所示.当Cu2+摩尔分数为0.7时, 探针L与Cu2+形成的络合物在452 nm处出现的荧光强度最大.由此表明, 探针L与Cu2+的络合比为1:2.由实验结果可知, 探针L与Cu2+的络合方式如图 8所示.
1.2.2 时间响应光谱
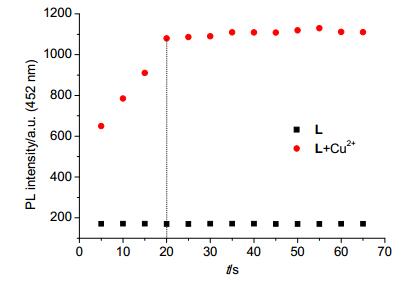
通过荧光光谱研究了探针L对Cu2+的响应时间 (图 3).实验结果表明, 在70 s内受体分子L的荧光强度变化很小, 这表明受体分子L的荧光强度不受时间的影响; 而加入Cu2+后, 在20 s内体系的荧光强度逐渐增强, 20 s后荧光强度逐渐趋于平稳, 这表明探针L对Cu2+的响应时间为20 s.
1.2.4 不同浓度的Cu2+对探针L荧光光谱的影响
在CH3CN溶液中, 保持探针L的浓度不变 (1.0× 10-5 mol/L), 测定了在不同Cu2+浓度条件下探针L荧光发射光谱 (图 5).荧光光谱显示, 随着Cu2+浓度的逐渐增大, 在452 nm处的最大荧光发射强度不断增强, 当Cu2+浓度为探针L浓度的8.0 equiv.时, 荧光发射强度基本保持不变, 说明反应体系已经达到饱和.实验结果显示, 探针L在452 nm处的荧光强度与Cu2+浓度有较好的线性关系, 表明探针L与Cu2+很好的结合.经过拟合得到线性回归方程: y=2.36258×10-8x+3.25973× 10 - 4, R2 = 0.9953, 并通过计算得到络合常数Ka = 1.38×104 L/mol (图 6a), 以探针L的8次荧光强度相对标准偏差计算得出, 探针L对Cu2+的最低检测限为2.34×10-7 mol/L (图 6b).所得结果低于WHO所规定的饮用水中Cu2+的最大含量 (20 μmol/L).探针L可以用于定量检测饮用水中Cu2+浓度.
1.2.3 共存离子的影响
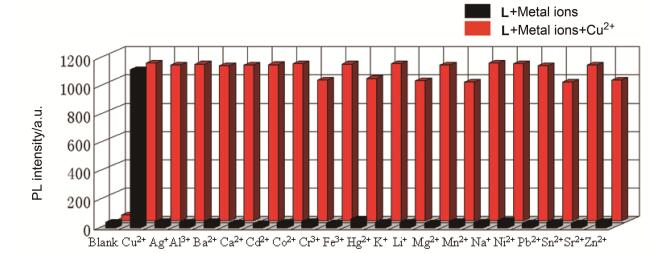
为了进一步探究其它金属离子和Cu2 +共存时对Cu2+测定的影响, 进行了干扰实验的研究.当在探针L的CH3CN溶液中 (1.0×10-5 mol/L) 分别加入2.0 equiv.的其它金属离子后发现荧光强度无明显变化, 但随后再分别加入1.0 equiv.的Cu2+后, 荧光强度明显增强 (图 4).实验结果表明, 在其它干扰离子存在时, 向探针L的CH3CN溶液中加入Cu2+后荧光强度基本保持不变.由此说明, 探针L对Cu2+的识别具有较强的抗干扰能力, 是一个有着高选择性的荧光增强型探针.
1.2.6 探针L的应用
为了研究探针L的实际应用价值, 我们设计了一个简单的实验, 即测试饮用水中Cu2+的含量.将0.1 mL探针L的乙腈溶液 (1.0×10-3 mol/L) 分别加入到饮用水-乙腈和二次蒸馏水-乙腈溶液中 (10 mL, V:V=1:1), 然后测试其荧光光谱.将所得的IF数值代入上述所得的回归方程y=2.36258×10-8x+3.25973×10-4, 即得出饮用水中Cu2+含量是2.36×10-6 mol/L, 该数值低于WHO所规定的饮用水中Cu2+的最大含量 (20 μmol/L).利用等离子体发射光谱 (ICP) 测定相同饮用水样品中Cu2+的含量为5.636×10-6 mol/L.显然, 两种方法测定的Cu2+含量具有相同的数量级.实验结果表明, 探针L在检测环境水中Cu2+方面具有潜在的应用价值.
1.2.1 探针L对阳离子的选择性识别
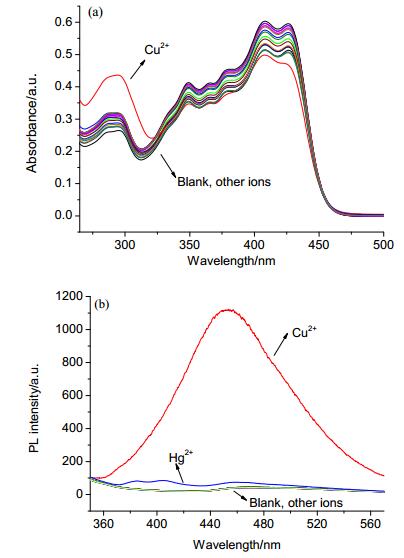
为了研究探针L对金属离子的识别性能, 选择Ag+、Al3+、Ba2+、Ca2+、Cd2+、Co2+、Cr3+、Cu2+、Fe3+、Hg2+、K +、Li+、Mg2+、Mn2+、Na+、Ni2+、Pb2+、Sn2+、Sr2+和Zn2+作为研究对象, 并利用紫外-可见吸收光谱和荧光光谱进行识别性能的研究.紫外吸收光谱 (图 2a) 实验结果表明, 当加入Cu2+之后在298 nm处的吸收峰明显增强, 而未加入离子或加入其它金属离子时, 探针L的紫外吸收光谱无明显变化.荧光光谱 (图 2b) 实验结果表明, 当加入Cu2+之后, 在452 nm处的荧光强度明显增强, 而未加入离子或加入其它金属离子时, 探针L的荧光强度很弱.由此说明, 目标化合物L是对Cu2+具有高选择性的探针.
2 结论
本文利用简单的合成方法制备出了一个新型的基于咔唑-席夫碱衍生物L.实验结果表明, 探针L对Cu2+具有较强的选择性, 可高选择性裸眼和荧光识别Cu2+.探针L与Cu2+形成1:2的配合物, 具有较低的检测限 (2.34×10-7 mol/L), 且低于WHO规定的饮用水中Cu2+的最大含量 (20 μmol/L).表明探针L在检测环境水中Cu2+方面具有潜在的应用价值.同时探针化合物L自身稳定性强、合成方法简单、产率较高, 是一种可行性高的探针.
3 实验部分
3.1 仪器与试剂
X-5显微熔点测定仪 (温度计未经校正); 德国TENSOR 27型FT-IR红外光谱仪, KBr压片; 德国BRUKER 500 MHz核磁共振仪, CDCl3/DMSO-d6为溶剂, TMS为内标; 德国Elementar公司Vario EL型元素分析仪; 美国Perkin Elmer Lambda 35紫外-可见分光光度计; 日本HITACHI F-7000荧光光谱仪; 美国Prodigy XP型全谱直读等离子发射光谱仪.所用药品均为试剂公司购买的分析纯试剂.
3.2 探针N-乙基-3, 6-双 (二氨基马来腈) 咔唑席夫碱 (L) 的合成
中间体化合物1参照文献[38]方法合成, 中间体化合物2参照文献[39]方法合成.化合物1和2的波谱数据与文献[40]一致.在50 mL干燥的圆底烧瓶中依次加入0.25 g (1 mmol) 中间体化合物2、0.22 g (2 mmol) 二氨基马来腈、20 mL无水乙醇和几滴冰醋酸, 加热回流3 h, 薄层色谱 (TLC) 监测反应进程.反应完成后, 将反应混合物冷却至室温, 抽滤, 用乙醇重结晶后即得到0.36 g探针化合物L, 黄色粉末状固体, 产率81.2%. m.p.>270 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 8.78 (s, 2H), 8.42 (s, 2H), 8.23 (d, J=8.5 Hz, 2H), 7.77 (brs, 4H), 7.73 (d, J=9.0 Hz, 2 H), 4.54 (q, J=7.0 Hz, 2H), 1.38 (t, J= 7.5 Hz, 3H); 13C NMR (DMSO-d6, 125 MHz) δ: 157.67, 144.12, 130.03, 129.55, 129.10, 127.47, 124.55, 116.55, 115.76, 112.04, 105.44, 39.50, 15.74; IR (KBr) v: 3459, 3330, 3160, 3055, 2954, 2871, 2231, 2203, 1608, 1602, 1594, 1487, 1375, 1347. Anal. calcd for C32H29N5O2: C 66.81, H 3.97, N 29.22; found C 67.05, H 3.82, N 29.43.
3.3 荧光光谱测定方法
以DMSO为溶剂, 将化合物L配置成5.0×10-3 mol/L的储备溶液, 然后移取一定的体积再用CH3CN稀释成1.0×10-5 mol/L的待测溶液; 以二次蒸馏水为溶剂, 配制5.0×10-3 mol/L的金属离子溶液[Pb (NO3)2、CuSO4•5H2O、CoCl2•6H2O、Sr (NO3)2、BaCl2•2H2O、ZnSO4•7H2O、NiSO4•6H2O、3CdSO4•8H2O、CaCl2、KNO3、MnSO4•H2O、MgSO4•H2O、SnCl2•2H2O、Fe (NO3)2•9H2O、Hg (NO3)2、Al2(SO4)3•18H2O、NaCl、LiClO4•3H2O、AgNO3], 以留备用.荧光光谱的测定均在室温条件下进行.
测试条件:室温, 样品池为1 cm×1 cm×4 cm石英比色皿, 激发夹缝宽度为5.0, 发射夹缝宽度为5.0, 激发波长λex为298 nm, 于320~580 nm范围内测试荧光.
辅助材料 (Supporting Information) 探针L的1H NMR和13C NMR谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
Liu, W. Y.; Li, H. Y.; Lü, H. S.; Zhao, B. X.; Miao, J. Y. Spectrochim. Acta, Part A 2012, 95, 658. doi: 10.1016/j.saa.2012.04.073
-
[2]
Li, W.; Zhang, Y.; Gan, X. P.; Yang, M. D.; Mie, B.; Fang, M.; Zhang, Q. Y.; Yu, J. H.; Wu, J. Y.; Tian, Y. P.; Zhou, H. P. Sens. Actuators, B: Chem. 2015, 206, 240.
-
[3]
Qin, J. C.; Yang, Z. Y. J. Photochem. Photobiol., A 2016, 324, 152. doi: 10.1016/j.jphotochem.2016.03.029
-
[4]
Zhang, C. H.; Gao, B. Z.; Zhang, Q. Y.; Zhang, G. M.; Shuang, S. M.; Dong, C. Talanta 2016, 154, 278. doi: 10.1016/j.talanta.2016.03.067
-
[5]
Na, Y. J.; Choi, Y. W.; Yun, J. Y.; Park, K. M.; Chang, P. S.; Kim, C. Spectrochim. Acta, Part A 2015, 136, 1649. doi: 10.1016/j.saa.2014.10.060
-
[6]
An, R. B.; Zhang, D. T.; Chen, Y.; Cui, Y. Z. Sens. Actuators, B: Chem. 2016, 222, 48. doi: 10.1016/j.snb.2015.08.035
-
[7]
Yu, H.; Lee, J. Y.; Angupillai, S.; Wang, S.; Feng, S. H.; Matsumoto, S.; Son, Y. A. Photochem. Photobiol., A 2015, 151, 48. doi: 10.1016/j.jphotobiol.2015.07.001
-
[8]
Dusek, P.; Roos, P. M.; Litwin, T.; Schneider, S. A.; Flaten, T. P.; Aaseth, J. J. Trace Elem. Med. Biol. 2015, 31, 193. doi: 10.1016/j.jtemb.2014.05.007
-
[9]
Razi, S. S.; Srivastava, P.; Ali R.; Gupta, R. C.; Dwivedi, S. K.; Misra, A. Sens. Actuators, B: Chem. 2015, 209, 162. doi: 10.1016/j.snb.2014.11.082
-
[10]
Xiong, J. J.; Huang, P. C.; Zhou, X.; Wu, F. Y. Sens. Actuators, B: Chem. 2016, 232, 673. doi: 10.1016/j.snb.2016.04.004
-
[11]
Li, S.; Zhang, D.; Xie, X. Y.; Ma, S. G.; Liu, Y.; Xu, Z. H.; Gao, Y. F.; Ye, Y. Sens. Actuators, B: Chem. 2016, 224, 661. doi: 10.1016/j.snb.2015.10.086
-
[12]
Tian, M. Z.; Hu, M. M.; Fan, J. L.; Peng, X. J., Wang, J. Y.; Sun, S. G.; Zhang R. Bioorg. Med. Chem. Lett. 2013, 23, 2916. doi: 10.1016/j.bmcl.2013.03.052
-
[13]
Zhu, W. J.; Yang, L. L.; Fang, M.; Wu, Z. Y.; Zhang, Q.; Yin, F. F.; Huang, Q.; Li C. J Fluoresc. 2015, 158, 38.
-
[14]
Danjou, P. E.; Lyskawa, J.; Delattre, F.; Becuwe, M., Woisel, P.; Ruellan, S.; Fourmentin, S.; Dennina, F. C. Sens. Actuators, B: Chem. 2012, 171~172, 1022.
-
[15]
Zhang, J.; Cui, H. L.; Hojo, M.; Shuang, S. M.; Dong, C. Bioorg. Med. Chem. Lett. 2012, 22, 343. doi: 10.1016/j.bmcl.2011.11.004
-
[16]
Yang, L. L.; Zhu, W. J.; Fang, M.; Zhang, Q.; Li, C. Spectrochim. Acta, Part A 2013, 109, 186. doi: 10.1016/j.saa.2013.02.043
-
[17]
Sharma, S.; Pradeep, C. P.; Dhir, A. Mater. Sci. Eng., C 2014, 43, 418. doi: 10.1016/j.msec.2014.07.041
-
[18]
Feng, G. L.; Geng, L. J.; Wang, T.; Li, J. Y.; Yun, X. D.; Wang, Y. Q.; Li, Y., Xie, D. Y. J Fluoresc. 2015, 167, 65.
-
[19]
Feng, Y.; Li, D. X.; Wang, Q.; Wang, S. X.; Meng, X. M.; Shao, Z. L.; Zhu, M. Z.; Wang, X. Sens. Actuators, B: Chem. 2016, 225, 572. doi: 10.1016/j.snb.2015.11.081
-
[20]
Li, D. X.; Sun, X.; Huang, J. M.; Wang, Q.; Feng, Y.; Chen, M.; Meng, X. M.; Zhu, M. Z.; Wang, X. Dyes Pigm. 2016, 125, 185. doi: 10.1016/j.dyepig.2015.10.016
-
[21]
Kundu, A.; Hariharan, P. S.; Prabakaran, K.; Anthony, S. P. Sens. Actuators, B: Chem. 2015, 206, 524. doi: 10.1016/j.snb.2014.09.099
-
[22]
Gou, C.; Qin, S. H.; Wu, H. Q.; Wang, Y.; Luo, J.; Liu, X. Y. Inorg. Chem. 2011, 14, 1622.
-
[23]
Chen, H. H.; Guan, R. F.; Cao, D. X.; Liu, Z. Q.; Sun, Y. H.; Ma, L.; Wang, K. N.; Shan, Y. Y. Mater. Lett. 2014, 122, 70. doi: 10.1016/j.matlet.2014.01.139
-
[24]
Wang, W. G.; Li, R.; Song, T. W.; Zhang, C. J.; Zhao, Y. Spectrochim. Acta, Part A 2016, 164, 133. doi: 10.1016/j.saa.2016.04.016
-
[25]
Velmathi, S.; Reena, V.; Suganya, S.; Anandan, S. J Fluoresc. 2012, 22, 155. doi: 10.1007/s10895-011-0942-z
-
[26]
Liu, G.; Shao, J. J Fluoresc. 2012, 22, 397. doi: 10.1007/s10895-011-0972-6
-
[27]
Ye, W. P.; Wang, S. X.; Meng, X. M.; Feng, Y.; Sheng, H. T.; Shao, Z. L.; Zhu, M. Z.; Guo, Q. X. Dyes Pigm. 2014, 101, 30. doi: 10.1016/j.dyepig.2013.09.013
-
[28]
Wang, L. Y.; Yang, L. L.; Cao, D. J Fluoresc. 2014, 24, 1347. doi: 10.1007/s10895-014-1421-0
-
[29]
Kim, H.; Rao, B. A.; Jeong, J. W.; Mallick, S.; Kang, S. M.; Choi, J. S.; Lee, C. S.; Son, Y. A. Sens. Actuators, B: Chem. 2015, 210, 173. doi: 10.1016/j.snb.2014.12.100
-
[30]
Hammud, H. H.; Shazly, S. E.; Sonji, G.; Sonji, N.; Bouhadir, K. H. Spectrochim. Acta, Part A 2015, 150, 94. doi: 10.1016/j.saa.2015.05.038
-
[31]
Bu, J.; Duan, H. D.; Wang, X. J.; Xu, T.; Meng, X.; Qin, D. W. Res. Chem. Intermed. 2015, 41, 2767. doi: 10.1007/s11164-013-1385-8
-
[32]
Zhu, W. J.; Yang, L. L.; Fang, M.; Wu, Z. Y.; Zhang, Q.; Yin, F. F.; Huang, Q.; Li, C. J. Lumin. 2015, 158, 38. doi: 10.1016/j.jlumin.2014.09.020
-
[33]
Liu, W.; Wu, G. Y.; Gu, X. M.; Yuan, X. S.; Li, J. Y.; Wang, H. B. J. Fluoresc. 2015, 25, 557. doi: 10.1007/s10895-015-1534-0
-
[34]
Thangavel, S.; Rajamanikandan, R.; Friedrich, H. B.; Ilanchelian, M.; Omondi, B. Polyhedron 2016, 107, 124. doi: 10.1016/j.poly.2016.01.017
-
[35]
Sharma, S.; Pradeep, C. P.; Dhir, A. Mater. Sci. Eng., C 2014, 43, 418. doi: 10.1016/j.msec.2014.07.041
-
[36]
侯淑华, 曲忠国, 钟克利, 边延江, 汤立军, 有机化学, 2016, 36, 768. http://sioc-journal.cn/Jwk_yjhx/CN/volumn/home.shtmlHou, S. H.; Qu, Z. G.; Zhong, K. L.; Bian, Y. J.; Tang, L. J. Chin. J. Org. Chem. 2016, 36, 768 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/volumn/home.shtml
-
[37]
Meng, W. F.; Yang, M. P.; Li, B.; Cheng, Z.; Yang, B. Q. Tetrahedron 2014, 70, 8577. doi: 10.1016/j.tet.2014.09.061
-
[38]
Jagadeeswari, S.; Paramaguru, G.; Thennarasu, S.; Renganathan, R. J. Mol. Struct. 2014, 1060, 191. doi: 10.1016/j.molstruc.2013.12.017
-
[39]
Ramkumar, S.; Manoharan, S.; Anandan, S. Dyes Pigm. 2012, 94, 503. doi: 10.1016/j.dyepig.2012.02.016
-
[40]
Budreckiene, R.; Buika, G.; Grazulevicius, J. V.; Jankauskas, V.; Staniskiene, B. J. Photochem. Photobiol., A 2006, 181, 257. doi: 10.1016/j.jphotochem.2005.12.006
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1117
- HTML全文浏览量: 64




 下载:
下载:








 下载:
下载:

