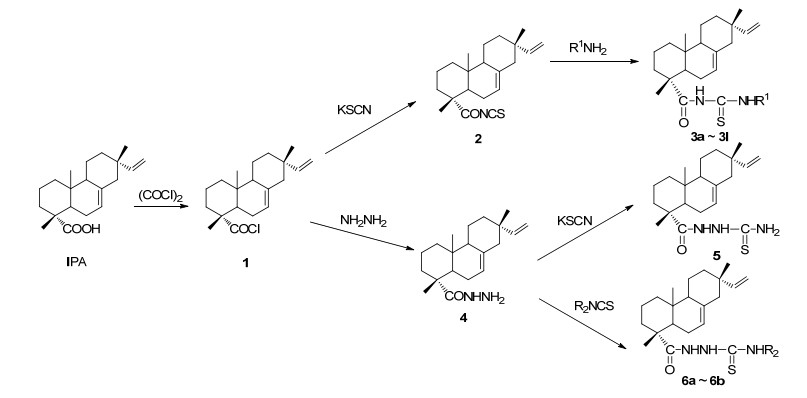
 图 图式 1
异海松酰 (胺) 基硫脲衍生物的合成
Figure 图式 1.
Synthesis of isopimaric acylthiourea derivatives
图 图式 1
异海松酰 (胺) 基硫脲衍生物的合成
Figure 图式 1.
Synthesis of isopimaric acylthiourea derivatives

Citation: Liu Juanjuan, Lu Yanju, Wang Jing, Bi Liangwu, Zhao Zhendong. Synthesis and Bioactivity Evaluation of Acylthiourea Derivatives Based on Isopimaric Acid[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 731-738. doi: 10.6023/cjoc201610017

异海松酰 (胺) 基硫脲类衍生物的合成及其生物活性评价
English
Synthesis and Bioactivity Evaluation of Acylthiourea Derivatives Based on Isopimaric Acid
-
异海松酸 (Isopimaric acid, IPA) 是来源于天然产物松香中的一种重要的海松酸型二萜树脂酸, 其本身表现出多种优良的生物活性.关于异海松酸的生物活性研究报道较多的是其活化大型钙离子激活的钾离子 (BK) 通道的活性[1, 2].进一步研究表明, 异海松酸作为BK通道的活化剂可以调控初级成骨细胞的生长和矿化[3], 并降低小鼠听觉神经网络自发活动的多动症和改善患阿尔茨海默病小鼠的认知功能, 从而对神经活性多动症和阿尔茨海默病具有潜在的治疗效果[4, 5].其次, 异海松酸对结核病毒具有显著的疗效[6], 并对爱博斯坦-巴尔病毒也显示出抑制效果[7].此外, 异海松酸对12-O-佛波酯-13-醋酸 (TPA) 诱导的鸟氨酸脱羧酶 (一种促进癌症发生的酶)[8]、5-脂氧酶 (5-LOX, 一种催化产生炎症的媒介)[9]、鼠尾草种子发芽[10]、棉红铃虫幼虫生长[11]及多种细菌、真菌[12, 13]等具有明显的抑制作用, 并对舞毒蛾觅食表现出阻碍作用[14].因异海松酸本身具有广泛的生物活性, 且异海松酸的化学结构中含有可反应的官能团羧基及双键, 因此可将其作为化工中间体或以其骨架结构作为药理活性中心, 开发具有生物活性的新型异海松酸类衍生物.
酰基硫脲和酰胺基硫脲化合物是两类重要的硫脲类衍生物, 也是重要的有机硫化合物.这两类硫脲类衍生物都具有广泛的生物活性, 如植物生长调节[15]、抗病毒[16]、抗菌[17, 18]和抗癌[19, 20]等, 因此备受研究者关注, 成为医药和农药领域研究的热点.
本文在异海松酸的生物活性基础上, 根据活性叠加原理, 通过活性亚结构拼接的方法, 将同样具有生物活性的硫脲结构引入到异海松酸分子中, 同时为了研究构效关系, 设计合成了15种未见报道的具有不同取代基和取代位置的酰 (胺) 基硫脲衍生物3a~3l, 5和6a~6b, 以期寻找更广谱、高效、低毒的异海松酸类生物活性制剂.合成的15种目标化合物的化学结构经FT-IR, 1H NMR, 13C NMR和TOF-MS进行了分析鉴定, 并首次对这15种化合物对金黄色葡萄球菌、大肠杆菌和白色念珠菌的抑菌活性, 以及对人黑色素瘤 (A375) 和前列腺癌 (PC-3) 两种癌细胞的细胞毒活性进行了测试.目标化合物的合成路线如Scheme 1所示.
1 结果与讨论
1.1 波谱分析
目标化合物3a~3i, 5和6a~6b的FT-IR光谱图中, 出现在3135~3432 cm-1之间的较强的吸收峰为N—H伸缩振动吸收峰.吸收峰在1668~1679 cm-1的单峰为C=O的伸缩振动吸收峰, 在1637 cm-1附近的弱吸收峰为异海松基骨架上的C=C吸收峰, 在1242~1299和1134~1185 cm-1出现的强吸收峰为C=S吸收峰, 该峰也证实了目标产物酰胺的形成.另外, 化合物3e、3f和3g在643, 657和653 cm-1处出现了属于Ph—Br的吸收峰; 化合物3h和3i在652, 669和676 cm-1左右出现的中等强度的吸收峰是Ph—Cl的伸缩振动吸收峰; 化合物3j在1311和1512 cm-1出现的两个较强的单峰为Ph—NO2的伸缩振动吸收峰.
1H NMR谱图中, δ值在12.26~14.12和10.42~11.18的两个单峰归属于CONHCSNH和CONHCSNH上的质子峰, 因羰基氧与CONHCSNH上质子的氢键作用产生的去屏蔽效果, 使得CONHCSNH质子位移出现在低场[21].当R为噻唑基 (Th) 时, NH质子位移比R为苯基 (Ph) 时位移要大; Ph或Th上连有供电子取代基时, NH化学位移移向高场; 连有吸电子取代基时, 则NH化学位移移向低场[22].在化合物3a~3g中, 苯环上质子化学位移出现在δ 7.07~8.26.化合物3k和3l中, 噻唑环上质子位移出现在δ 7.30~8.63.异海松酸骨架上的CH=CH2和C=CH质子化学位移分别出现在δ5.84~5.87 (dd), 5.31~5.36 (brd), 4.95~4.99 (dd) 和4.88~4.92 (dd) 处, 与文献[23]报道一致; 三个CH3质子化学位移分别在δ 1.27、0.86和0.82附近; 异海松酸骨架上饱和氢化学位移在δ 2.00以下.此外, 在化合物3b~3d和3l中, δ 2.30~2.37出现的单峰为PhCH3和ThCH3的质子化学位移峰.
13C NMR谱图中, CSNH和CONH的碳原子的化学位移分别在δ 180.86~181.79和179.08~180.63处, 同样由于分子内氢键的作用使得CSNH的碳原子的化学位移出现在低位.苯环、噻唑环及异海松基骨架上不饱和碳的化学位移在δ 108.92~176.33处.异海松基骨架上饱和碳原子化学位移在δ 51.88以下.此外, 在化合物3b~3d和3l中, 还出现了PhCH3和ThCH3碳原子的化学位移, 分别在δ 21和11.53左右.
HRMS分析结果显示[M+Na]+、[M-H]+或元素分析的实测值与理论计算值均在合理的误差范围内, 说明实测值与理论值是相符的.
上述分析结果表明, 所合成的化合物与目标化合物的化学结构一致.
1.2 抑菌活性
标题化合物对金黄色葡萄球菌、大肠杆菌和白色念珠菌的抑制活性结果如表 1所示.结果表明, 目标化合物对两种细菌 (金黄色葡萄球菌和大肠杆菌) 的抑制活性普遍低于母体化合物异海松酸, 没有达到预期的目的, 可能是由于合成的化合物的分子结构变大, 使得目标化合物难以穿透细菌细胞壁到达细胞膜, 从而降低其抑菌效果.但化合物3i和3l则对大肠杆菌表现出较强的抑制活性, 最低抑菌浓度均为15.63 μg/mL.除了化合物3c, 3f和6a抑制真菌白色念珠菌的活性与异海松酸相当, 其余化合物则都表现出高于异海松酸的抑菌活性, 这说
Compd. R1/R2 MIC/(μg•mL-1) Staphylococcus aureus Escherichia coli Candida albicans 3a Ph >500 >500 31.25 3b p-CH3C6H4 >500 >500 31.25 3c m-CH3C6H4 >500 >500 62.5 3d o-CH3C6H4 >500 >500 31.25 3e p-BrC6H4 >500 >500 31.25 3f m-BrC6H4 >500 >500 62.5 3g o-BrC6H4 >500 >500 31.25 3h p-ClC6H4 >500 >500 15.63 3i m-ClC6H4 >500 15.63 31.25 3j p-O2NC6H4 >500 >500 31.25 3k 
>500 >500 31.25 3l 
>500 15.63 7.81 5 125 125 31.25 6a Ph >500 500 62.5 6b p-FC6H4 125 125 15.63 异海松酸 31.25 125 62.5 表 1 异海松酰 (胺) 基硫脲衍生物的抑菌活性
Table 1. Antibacterial activity of isopimaric acylthiourea derivatives明硫脲结构的引入有利于提高母体化合物异海松酸对白色念珠菌的抑制活性.初步构效关系研究发现, 异海松酰基硫脲衍生物3a~3j苯环上取代基相同时, 邻对位取代化合物抑制白色念珠菌的活性大于间位取代, 且不受吸电子和供电子基团的影响, 说明苯环上邻对位取代更有利于增强化合物的抑菌活性; 苯环对位取代时, Cl原子取代对提高抑菌活性更为有利.异海松酰基硫脲衍生物3k~3l的噻唑环上无取代基的化合物3k对白色念珠菌的抑制活性略高于异海松酸; CH3取代化合物3l的抑菌活性有较大改善, 表现出最好的抑菌活性, 其最低抑菌浓度 (MIC) 值为7.81 μg/mL.异海松酰胺基硫脲衍生物5, 6a~6b中, 苯环上无取代基的化合物6a对白色念珠菌的抑制活性低于无苯环的化合物5; 而p-F取代的化合物6b的抑菌活性高于5, 说明苯环上取代基的引入对化合物抑制真菌的活性有重要影响.
1.3 抗癌活性
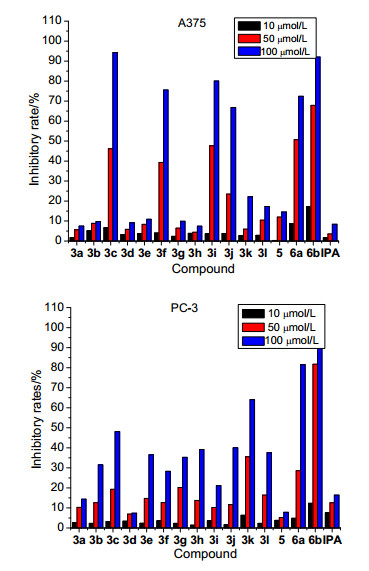
采用噻唑蓝 (MTT) 法测定了目标化合物对人体黑色素瘤 (A375) 和前列腺癌 (PC-3) 两种癌细胞的增殖抑制活性, 并与母体化合物异海松酸的抑制效果进行对比, 实验结果如图 1所示.由图 1可知, 母体化合物异海松酸在10 μmol/L时, 对两种癌细胞增殖几乎无抑制活性; 在50和100 μmol/L时, 对细胞增殖的抑制作用有所改善, 但仍然较弱.目标化合物在10 μmol/L时, 对两种癌细胞的增殖抑制作用也微乎其微, 与母体异海松酸差别不大; 在50 μmol/L时, 对细胞增殖的抑制作用增强, 其中部分化合物的抗癌活性有较大改善; 随着化合物浓度继续增加到100 μmol/L时, 化合物的细胞增殖抑制效果进一步提高, 多数化合物表现出高于异海松酸的抗癌活性, 如化合物3c, 3f, 3i~3l, 5, 6a和6b对A375细胞的增殖抑制作用高于异海松酸, 尤其3c和6b, 抑制率均达90%以上; 除3a, 3d和5外, 其余化合物对PC-3细胞的抑制效果均高于异海松酸, 尤其6b, 其抑制率也高于90%.上述分析说明, 目标化合物的抗癌活性与化合物剂量有关, 且硫脲结构的引入有利于提高异海松酸的抗癌活性.
因目标化合物在10 μmol/L时基本无抗癌活性, 50 μmol/L时抗癌活性有部分改善, 100 μmol/L时抗癌活性最好, 因此以100 μmol/L化合物对应的抗癌活性为依据对构效关系进行初步考察.由图 1可知, 异海松酰基硫脲衍生物3a~3l中苯环上无取代基的3a对A375细胞近乎无增殖抑制作用, 对PC-3细胞也仅表现出较弱的活性; 苯环上有取代基时, 部分化合物的细胞增殖抑制作用明显增强.对A375细胞而言, 化合物苯环上取代基相同 (CH3/Br/Cl) 时, 苯环间位取代对化合物的抗癌活性贡献较大, 是改善该类化合物抗癌活性的一个关键因素, 且不受供电子和吸电子基团的影响; 苯环对位和邻位取代的影响较小, 且基本无差别.化合物苯环间位为卤素时, 则抗癌活性3i (Cl)>3f(Br); 苯环对位为吸电子基团时, 则抗癌活性3j(NO2)>>3e (Br)>3h(Cl).对PC-3细胞而言, 苯环上CH3取代时, 化合物的抗癌活性3c(m-)>3b(p-)>3d(o-); Br/Cl取代时, 则抗癌活性3e(p-)≈3g(o-)>3(m-)/3h(p-)>3i(m-), 说明苯环上供电子基团取代时, 间位取代对活性起关键作用; 而吸电子基团取代时, 则对位和邻位取代起关键作用.化合物苯环对位为吸电子基团取代时, NO2、Cl和Br取代化合物的抗癌活性差别不大.异海松酰基硫脲化合物3k和3l对A375细胞的抑制作用较弱, 而对PC-3细胞的抑制作用明显, 且噻唑环上无取代基的化合物3k的抑制效果高于甲基取代化合物3l的效果.异海松酰胺基硫脲衍生物5, 6a和6b中不含苯环的化合物5对A375细胞具有较弱的抑制活性, 对PC-3细胞基本无抑制作用; 含有苯环的化合物6a和6b表现出较显著的抗癌活性, 且苯环对位上引入F原子的化合物6b的抗癌活性最好.
2 结论
本文以异海松酸为原料, 将具有生物活性的硫脲结构拼接到异海松酸结构上, 设计合成了15种未见报道的异海松酰 (胺) 基硫脲衍生物.初步抗菌活性表明, 绝大部分化合物对金黄色葡萄球菌和大肠杆菌的抑制效果较弱, 但化合物3i和3l对大肠杆菌表现出显著的抑制活性; 多数化合物对白色念珠菌的抑制活性高于异海松酸.抗癌实验表明, 部分化合物在50和100 μmol/L时对A375和PC-3癌细胞表现出明显的抑制效果.异海松酰基硫脲衍生物的苯环间位取代对化合物抑制A375癌细胞增殖起关键作用, 苯环对位NO2取代对提高化合物抑制PC-3细胞增殖的活性更为有利.另外, 异海松酰胺基硫脲衍生物结构中有引入芳基时抗癌活性增强.上述研究结果, 对指导下一步合成高活性的异海松酸衍生物具有一定的参考价值.
3 实验部分
3.1 仪器与试剂
上海申光仪器公司产WRS-1B型数字熔点仪 (Shanghai Shenguang Instrument, China), 使用前温度未经校正; 美国Thermo Scientific Nicolet IS10型傅里叶变换红外光谱仪, 采用KBr压片法; 德国Bruker Avance Ⅲ 500型核磁共振仪, TMS为内标, DMSO-d6为溶剂; 英国Waters Q-TOF MicroTM型质谱仪 (Waters, England); 美国PE公司PE-2400型元素分析仪; 江苏净化SW-CJ-1FD型超净工作台; 中国菲利普斯IX51型生物倒置显微镜; 美国Bio Tek Instruments EL-x800型酶标仪; 日本SANYO XD-101型CO2培养箱.
异海松酸, 参照专利方法制备[24]; MTT由Gibco公司购得; DMSO由Sigma公司购得; 人黑色素瘤细胞 (A375) 和前列腺癌细胞 (PC-3) 均由江苏凯基生物技术有限公司提供.其余所用试剂均为市售分析纯, 使用前未经处理.
3.2 实验方法
3.2.1 异海松酰基硫脲衍生物3a~3l的合成
将1 g (3.3 mmol) 异海松酸溶于10 mL二氯甲烷中, 冷却至0 ℃.然后, 将溶于10 mL二氯甲烷中的0.35 mL (4 mmol) 草酰氯滴加到上述溶液中.在N2保护下, 常温搅拌反应3 h.反应结束后, 将溶剂和过量的草酰氯减压旋蒸除去, 得到红棕色的异海松酰氯 (1).再将溶于10 mL乙腈中的异海松酰氯, 滴加到溶有0.32 g (3.3 mmol) KSCN的15 mL乙腈溶液中, 75 ℃回流反应2 h, 冷却至室温, 过滤除去KCl沉淀, 得到亮黄色的异海松酰基异硫氰酸酯 (2) 的乙腈溶液.随后, 向异海松酰基异硫氰酸酯的乙腈溶液中加入3 mmol的取代芳胺、取代噻唑胺, 回流反应, TLC跟踪反应进度, 待原料点消失停止反应, 脱除溶剂, 粗产物用乙醇重结晶或柱层析 (石油醚/乙醇酸乙酯) 提纯, 得到异海松酰基硫脲3a~3l纯品.
N-异海松酰基-N′-苯基硫脲 (3a):白色固体, 收率82.7%. m.p. 112.8~113.6 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 12.62 (s, CSNH), 10.48 (s, 1H, CONH), 7.64 (d, J=9.0 Hz, 2H, PhH), 7.41 (t, J=8.0 Hz, 1H, PhH), 7.26 (t, J=8.0 Hz, 2H, PhH), 5.84 (dd, J=11.0, 18.0 Hz, 1H, 15-H), 5.34 (brd, J=5.5 Hz, 1H, 7-H), 4.96 (dd, J=1.0, 17.5 Hz, 1H, 16-H), 4.89 (dd, J=1.5, 11.0 Hz, 1H, 16-H), 2.09 (dd, J=3.0, 13.5 Hz, 1H), 1.97~1.85 (m, 5H), 1.74 (d, J=13.5 Hz, 2H), 1.62~1.53 (m, 4H), 1.48~1.33 (m, 4H), 1.27 (s, 3H, 19-Me), 0.88 (s, 3H, 17-Me), 0.83 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 181.01, 179.80, 150.23, 138.35, 135.78, 129.08, 126.74, 124.86, 121.16, 110.24, 51.29, 47.84, 46.15, 44.06, 37.24, 36.83, 36.03, 35.21, 35.16, 24.94, 21.75, 19.94, 18.37, 17.16, 15.53; IR (KBr) ν: 3432, 3294, 1679, 1637, 1242, 1152 cm-1; HR (TOF) MS calcd for C27H36N2ONaS 459.2446, found 459.2454.
N-异海松酰基-N′-(4-甲基苯基) 硫脲 (3b):白色固体, 收率78.4%. m.p. 56.8~57.9 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 12.59 (s, CSNH), 10.46 (s, 1H, CONH), 7.49 (d, J=9.5 Hz, 1H, PhH), 7.23 (t, J=8.0 Hz, 2H, PhH), 5.87 (dd, J=11.0, 18.0 Hz, 1H, 15-H), 5.36 (brd, J=6.0 Hz, 1H, 7-H), 4.99 (dd, J=1.0, 17.5 Hz, 1H, 16-H), 4.92 (dd, J=1.5, 11.0 Hz, 1H, 16-H), 2.33 (s, 3H, PhMe), 2.12 (dd, J=4.0, 12.5 Hz, 1H), 1.99~1.87 (m, 5H), 1.76 (d, J=13.5 Hz, 2H), 1.64~1.49 (m, 4H), 1.43~1.33 (m, 4H), 1.30 (s, 3H, 19-Me), 0.91 (s, 3H, 17-Me), 0.86 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 180.99, 179.54, 150.20, 136.03, 135.75, 129.48, 124.34, 121.15, 110.19, 51.45, 48.03, 46.04, 43.82, 37.24, 36.88, 36.01, 35.18, 35.12, 24.92, 21.75, 21.03, 19.92, 18.26 17.18, 15.54; IR (KBr) ν: 3432, 1671, 1637, 1245, 1135 cm-1. Anal. calcd for C28H38N2OS: C 74.11, H 8.28, N 6.25; found C 74.62, H 8.50, N 6.22.
N-异海松酰基-N′-(3-甲基苯基) 硫脲 (3c):白色固体, 收率84.5%. m.p. 113.3~114.0 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 12.61 (s, CSNH), 10.42 (s, 1H, CONH), 7.64 (d, J=9.0 Hz, 2H, PhH), 7.43 (s, 1H, PhH), 7.28 (t, J=8.0 Hz, 1H, PhH), 7.07 (d, J=9.0 Hz, 1H, PhH), 5.84 (dd, J=11.0, 18.0 Hz, 1H, 15-H), 5.33 (brd, J=5.5 Hz, 1H, 7-H), 4.96 (dd, J=1.0, 17.5 Hz, 1H, 16-H), 4.89 (dd, J=1.5, 11.0 Hz, 1H, 16-H), 2.31 (s, 3H, Ph-Me), 2.08 (dd, J=3.5, 12.5 Hz, 1H), 1.97~1.85 (m, 5H), 1.74 (d, J=13.5 Hz, 2H), 1.62~1.53 (m, 4H), 1.48~1.33 (m, 4H), 1.27 (s, 3H, 19-Me), 0.88 (s, 3H, 17-Me), 0.83 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 181.01, 179.45, 150.22, 138.45, 138.22, 135.78, 128.81, 127.30, 125.01, 121.63, 121.24, 110.19, 51.39, 47.98, 45.99, 43.76, 37.16, 36.81, 35.94, 35.12, 35.09, 24.85, 21.68, 21.27, 19.86, 18.19, 17.11, 15.47; IR (KBr) ν: 3432, 1672, 1637, 1261, 1134 cm-1; HR (TOF) MS calcd for C28H37N2OS 449.2627, found 449.2637.
N-异海松酰基-N′-(2-甲基苯基) 硫脲 (3d):白色固体, 收率79.1%. m.p.>300 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 12.26 (s, CSNH), 10.53 (s, 1H, CONH), 7.55 (d, J=9.5 Hz, 1H, PhH), 7.29~7.27 (m, 1H, PhH), 7.24~7.18 (m, 2H, PhH), 5.85 (dd, J=11.0, 18.0 Hz, 1H, 15-H), 5.35 (brd, J=7.5 Hz, 1H, 7-H), 4.96 (dd, J=1.5, 17.5 Hz, 1H, 16-H), 4.89 (dd, J=2.0, 11.0 Hz, 1H, 16-H), 2.20 (s, 3H, PhMe), 2.11 (dd, J=4.5, 12.5 Hz, 1H), 1.99~1.84 (m, 5H), 1.74 (d, J=13.0 Hz, 2H), 1.62~1.52 (m, 4H), 1.48~1.30 (m, 4H), 1.28 (s, 3H, 19-Me), 0.89 (s, 3H, 17-Me), 0.83 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 180.98, 180.63, 150.28, 137.37, 135.85, 133.68, 130.79, 127.42, 127.02, 126.51, 121.24, 110.22, 51.41, 48.05, 46.01, 43.77, 37.20, 36.88, 36.01, 35.19, 35.16, 24.96, 21.76, 19.90, 18.27, 18.06, 17.22, 15.52; IR (KBr) ν: 3427, 3135, 1668, 1639, 1248, 1146 cm-1; HR (TOF) MS calcd for C28H38N2ONaS 473.2586, found 473.2591.
N-异海松酰基-N′-(4-溴苯基) 硫脲 (3e):淡黄色固体, 收率82.4%. m.p. 56.8~57.9 ℃; 1H NMR (CDCl3, 500 MHz) δ: 12.67 (s, CSNH), 8.67 (s, 1H, CONH), 7.65 (d, J=8.5 Hz, 2H, PhH), 7.55 (d, J=8.5 Hz, 2H, PhH), 5.88 (dd, J=11.0, 17.5 Hz, 1H, 15-H), 5.37 (brd, J=4.0 Hz, 1H, 7-H), 4.50 (dd, J=1.0, 17.5 Hz, 1H, 16-H), 4.93 (dd, J=1.0, 10.5 Hz, 1H, 16-H), 2.11~1.90 (m, 6H), 1.85~1.79 (m, 2H), 1.73~1.61 (m, 6H), 1.56~1.45 (m, 2H), 1.43 (s, 3H, 19-Me), 0.99 (s, 3H, 17-Me), 0.91 (s, 3H, 20-Me); 13C NMR (CDCl3, 125 MHz) δ: 180.08, 178.27, 150.09, 136.72, 136.11, 131.94, 125.35, 120.30, 119.85, 109.44, 52.11, 47.81, 46.01, 45.76, 38.53, 37.17, 36.77, 35.99, 35.30, 25.08, 21.54, 20.02, 17.97, 17.12, 15.34; IR (KBr) ν: 3430, 1672, 1637, 1244, 1136 cm-1. Anal. calcd for C27H35BrN2OS: C 63.75, H 6.80, N 5.17; found C 62.90, H 6.84, N 5.43.
N-异海松酰基-N'-(3-溴苯基) 硫脲 (3f):淡黄色固体, 收率75.9%. m.p. 68.7~70.2 ℃; 1H NMR (CDCl3, 500 MHz) δ: 12.71 (s, CSNH), 8.67 (s, 1H, CONH), 7.99 (s, 1H, PhH), 7.56 (d, J=9.5 Hz, 1H, PhH), 7.67 (d, J=8.5 Hz, 2H, PhH), 7.42 (t, J=2.5 Hz, 1H, PhH), 5.88 (dd, J=11.0, 17.5 Hz, 1H, 15-H), 5.37 (brd, J=4.0 Hz, 1H, 7-H), 5.00 (dd, J=1.0, 17.5 Hz, 1H, 16-H), 4.93 (dd, J=1.0, 10.5 Hz, 1H, 16-H), 2.10~1.90 (m, 6H), 1.85~1.79 (m, 2H), 1.73~1.61 (m, 6H), 1.59~1.45 (m, 2H), 1.43 (s, 3H, 19-Me), 0.99 (s, 3H, 17-Me), 0.91 (s, 3H, 20-Me); 13C NMR (CDCl3, 125 MHz) δ: 180.10, 178.33, 150.16, 138.91, 136.99, 130.05, 129.67, 126.68, 122.35, 122.24, 120.30, 109.45, 52.10, 47.82, 46.01, 45.76, 38.52, 37.16, 36.77, 36.00, 35.30, 25.08, 21.54, 20.02, 17.97, 17.12, 15.35; IR (KBr) ν: 3429, 1672, 1637, 1243, 1136 cm-1. Anal. calcd for C27H35BrN2OS: C 62.75, H 6.79, N 5.50; found C 62.90, H 6.84, N, 5.43.
N-异海松酰基-N′-(2-溴苯基) 硫脲 (3g):淡黄色固体, 收率78.5%. m.p. 80.2~81.5 ℃; 1H NMR (CDCl3, 500 MHz) δ: 12.61 (s, CSNH), 8.75 (s, 1H, CONH), 8.28 (d, J=8.0 Hz, 1H, PhH), 7.68 (d, J=8.0 Hz, 1H, PhH), 7.42 (t, J=8.0 Hz, 2H, PhH), 7.20 (t, J=8.0 Hz, 1H, PhH), 5.88 (dd, J=10.5, 17.5 Hz, 1H, 15-H), 5.37 (brd, J=3.5 Hz, 1H, 7-H), 5.00 (dd, J=1.0, 17.5 Hz, 1H, 16-H), 4.93 (dd, J=1.0, 11.0 Hz, 1H, 16-H), 2.12~1.93 (m, 6H), 1.89~1.83 (m, 2H), 1.76~1.62 (m, 6H), 1.60~1.48 (m, 2H), 1.45 (s, 3H, 19-Me), 1.00 (s, 3H, 17-Me), 0.92 (s, 3H, 20-Me); 13C NMR (CDCl3, 125 MHz) δ: 179.57, 179.09, 150.13, 136.54, 135.97, 132.90, 128.12, 127.47, 127.03, 120.40, 118.50, 109.42, 52.00, 47.82, 46.00, 45.74, 38.49, 37.14, 36.76, 36.02, 35.32, 25.08, 21.55, 20.00, 17.99, 17.16, 15.33; IR (KBr) ν: 3429, 1672, 1637, 1243, 1136 cm-1. Anal. calcd for C27H35BrN2OS: C 63.07, H 6.63, N 5.37; found C 62.90, H 6.84, N 5.43.
N-异海松酰基-N′-(4-氯苯基) 硫脲 (3h):淡黄色固体, 收率76.3%. m.p. 57.2~58.6 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 12.58 (s, CSNH), 10.57 (s, 1H, CONH), 7.67 (d, J=8.5 Hz, 2H, PhH), 7.45 (d, J=8.5 Hz, 2H, PhH), 5.84 (dd, J=11.0, 17.5 Hz, 1H, 15-H), 5.33 (brd, J=4.0 Hz, 1H, 7-H), 4.96 (dd, J=1.0, 17.5 Hz, 1H, 16-H), 4.89 (dd, J=1.5, 11.0 Hz, 1H, 16-H), 2.09 (dd, J=3.5, 12.0 Hz, 1H), 1.96~1.84 (m, 5H), 1.73 (d, J=12.5 Hz, 2H), 1.61~1.53 (m, 4H), 1.48~1.31 (m, 4H), 1.27 (s, 3H, 19-Me), 0.88 (s, 3H, 17-Me), 0.83 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 180.95, 180.00, 150.27, 137.42, 135.73, 130.66, 128.94, 126.70, 121.37, 110.05, 51.28, 47.82, 45.89, 43.78, 37.19, 36.88, 35.99, 35.18, 35.07, 24.78, 21.73, 19.87, 18.01, 17.29, 15.46; IR (KBr) ν: 3430, 1672, 1637, 1244, 1136 cm-1. Anal. calcd for C27H35Cl-N2OS: C 68.53, H 7.44, N 5.93; found C 68.84, H 7.49, N 5.95.
N-异海松酰基-N′-(3-氯苯基) 硫脲 (3i):淡黄色固体, 收率74.6%. m.p. 47.5~48.6 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 12.68 (s, CSNH), 10.63 (s, 1H, CONH), 7.93 (s, 1H, PhH), 7.56 (d, J=10 Hz, 1H, PhH), 7.45 (t, J=8.5 Hz, 2H, PhH), 7.34~7.32 (m, 1H, PhH), 5.87 (dd, J=11.0, 18.0 Hz, 1H, 15-H), 5.36 (brd, J=6.0 Hz, 1H, 7-H), 4.98 (dd, J=1.5, 17.5 Hz, 1H, 16-H), 4.91 (dd, J=1.5, 11.0 Hz, 1H, 16-H), 2.12 (dd, J=4.0, 12.0 Hz, 1H), 1.99~1.87 (m, 5H), 1.76 (d, J=13.5 Hz, 2H), 1.64~1.56 (m, 4H), 1.51~1.33 (m, 4H), 1.30 (s, 3H, 19-Me), 0.91 (s, 3H, 17-Me), 0.86 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 180.86, 180.05, 150.26, 139.84, 135.82, 133.11, 130.45, 126.51, 124.54, 123.56, 121.30, 110.18, 51.45, 48.07, 46.04, 43.73, 37.20, 36.87, 36.01, 35.17, 35.07, 24.99, 21.75, 19.92, 18.25, 17.19, 15.53; IR (KBr) ν: 3429, 1672, 1637, 1243, 1136 cm-1. Anal. calcd for C27H35Cl-N2OS: C 69.25, H 7.47, N 5.10; found C 68.84, H 7.49, N, 5.95.
N-异海松酰基-N′-(4-硝基苯基) 硫脲 (3j):棕色固体, 收率76.8%. m.p. 74.3~75.2 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 12.92 (s, CSNH), 10.76 (s, 1H, CONH), 8.26 (d, J=9.5 Hz, 2H, PhH), 8.04 (d, J=9.5 Hz, 2H, PhH), 5.84 (dd, J=11.0, 18.0 Hz, 1H, 15-H), 5.33 (brd, J=5.5 Hz, 1H, 7-H), 4.96 (dd, J=1.5, 17.5 Hz, 1H, 16-H), 4.89 (dd, J=1.0, 10.5 Hz, 1H, 16-H), 2.11 (dd, J=4.0, 12.5 Hz, 1H), 1.96~1.84 (m, 5H), 1.74 (d, J=13.5 Hz), 1.62~1.54 (m, 4H), 1.48~1.31 (m, 4H), 1.28 (s, 3H, 19-Me), 0.88 (s, 3H, 17-Me), 0.83 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 180.96, 179.96, 150.27, 144.85, 144.39, 135.83, 124.65, 124.62, 121.30, 110.20, 51.45, 48.14, 46.05, 43.67, 37.15, 36.88, 35.99, 35.18, 34.99, 24.89, 21.74, 19.91, 18.23, 17.20, 15.54 cm-1; IR (KBr) ν: 3427, 1676, 1637, 1253, 1137. HR (TOF) MS calcd for C27H34N3O3S 480.2321, found 480.2309.
N-异海松酰基-N′-噻唑基硫脲 (3k):白色固体, 收率60.7%. m.p. 67.1~68.0 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 14.12 (s, CSNH), 11.18 (s, 1H, CONH), 7.63 (d, J=4.0 Hz, 1H, Th-H), 7.33 (d, J=4.0 Hz, 1H, Th-H), 5.84 (dd, J=11.0, 18.0 Hz, 1H, 15-H), 5.32 (brd, J=6.5 Hz, 1H, 7-H), 4.96 (dd, J=1.5, 17.5 Hz, 1H, 16-H), 4.88 (dd, J=1.5, 11.0 Hz, 1H, 16-H), 2.10 (dd, J=4.0, 12.5 Hz, 1H), 1.96~1.85 (m, 5H), 1.74 (d, J=13.0 Hz, 2H), 1.61~1.51 (m, 4H), 1.48~1.30 (m, 4H), 1.27 (s, 3H, 19-Me), 0.88 (s, 3H, 17-Me), 0.83 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 181.79, 179.28, 172.39, 150.27, 135.76, 121.33, 115.13, 110.21, 108.92, 51.45, 48.14, 46.05, 43.67, 37.15, 36.88, 35.99, 35.18, 34.99, 24.89, 21.74, 19.91, 18.23, 17.20, 15.54 cm-1; IR (KBr) ν: 3431, 1671, 1638, 1299, 1185. HR (TOF) MS calcd for C24H33-N3ONaS2 466.1947, found 466.1955.
N-异海松酰基-N′-(5-甲基噻唑基) 硫脲 (3l):白色固体, 收率69.3%. m.p. 70.5~71.6 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 13.98 (s, CSNH), 11.09 (s, 1H, CONH), 7.30 (s, 1H, Th-H), 5.84 (dd, J=10.5, 17.5 Hz, 1H, 15-H), 5.31 (brd, J=6.5 Hz, 1H, 7-H), 4.95 (dd, J=1.5, 17.5 Hz, 1H, 16-H), 4.88 (dd, J=1.5, 10.5 Hz, 1H, 16-H), 2.37 (s, 3H, Th-Me), 2.09 (dd, J=3.5, 12.5 Hz, 1H, 9-H), 1.95~1.84 (m, 5H), 1.73 (d, J=13.0 Hz, 2H), 1.60~1.53 (m, 4H), 1.48~1.30 (m, 4H), 1.26 (s, 3H, 19-Me), 0.87 (s, 3H, 17-Me), 0.82 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 181.73, 179.96, 176.33, 150.30, 135.80, 128.06, 121.33, 112.52, 110.23, 51.45, 48.35, 46.05, 43.62, 37.14, 36.89, 36.03, 35.20, 34.90, 24.87, 21.76, 19.93, 18.17, 17.18, 15.53, 11.53 cm-1. IR (KBr) ν: 3432, 1675, 1637, 1296, 1184. HR (TOF) MS calcd for C25H35N3ONaS2 480.2119, found 480.2110.
3.2.2 异海松酰肼 (4) 的合成
将溶有3.3 mmol化合物1缓慢滴加到含0.18 mL (3 mmol) 水合肼、0.5 mL (3.6 mmol) 三乙胺和10 mL四氢呋喃的混合溶液中, 常温反应2 h.反应结束后, 过滤除去沉淀, 收集有机层, 减压蒸除溶剂, 得白色固体, 不经处理, 直接用于下一步反应.
3.2.3 N-异海松酰胺基氨基硫脲 (5) 的合成
将0.36 g (3.6 mmol) KSCN加入到上述合成化合物4和30 mL 5%的盐酸混合溶液中, 回流反应过夜.反应结束, 过滤收集产生的固体.粗品经无水乙醇重结晶两次, 得0.72 g白色针状结晶5, 收率64.1%. m.p. 208.4~209.5 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 9.16 (s, 1H, CSNH), 5.86 (dd, J=10.5, 17.5 Hz, 1H, H-15), 5.34 (brd, J=6.5 Hz, 1H, H-7), 4.98 (dd, J=1.5, 17.5 Hz, 1H, H-16), 4.91 (dd, J=1.2, 11.0 Hz, 1H, H-16), 1.97~1.85 (m, 4H), 1.80~1.72 (m, 2H), 1.57~1.34 (m, 8H), 1.23 (s, 3H, 19-Me), 1.14~0.97 (m, 2H), 0.89 (s, 3H, 17-Me), 0.86 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 177.29, 177.25, 150.40, 135.21, 122.04, 110.16, 51.89, 46.08, 45.55, 45.41, 38.70, 36.98, 36.89, 35.99, 35.11, 24.51, 21.79, 19.97, 18.18, 17.53, 15.61; IR (KBr) ν: 3313, 3087, 1678, 1637, 1233, 1153 cm-1. HR (TOF) MS calcd for C21H33N3ONaS [M+Na]+ 398.2248, found 398.2242.
3.2.4 N-异海松酰胺基-N'-(4-取代苯基) 硫脲 (6a~6b) 的合成
将3.3 mmol 4-取代苯基异硫氰酸和10 mL乙腈滴加到上述合成的化合物4和10 mL无水乙腈的混合溶液溶液中, 回流反应4 h.减压蒸除溶剂, 粗品经层析柱提纯[V(石油醚):V(乙酸乙酯)=6:1], 得化合物6a~6b.
N-异海松酰胺基-N'-苯基硫脲 (6a):淡绿色固体, 收率70.85%. m.p. 135.3~136.2 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 9.63 (s, 1H, CONH), 9.49 (s, 1H, NHCSNH), 9.16 (s, 1H, NHCSNH), 7.50 (d, J=6.5 Hz, 2H, PhH), 7.37 (t, J=8.0 Hz, 2H, PhH), 7.18 (t, J=7.0 Hz, 1H, PhH), 5.86 (dd, J=10.5, 1H, 17.5 Hz, H-15), 5.66 (s, 2H, PhH), 5.32 (brd, J=4.5 Hz, 1H, H-7), 4.98 (dd, J=1.5, 17.5 Hz, 1H, H-16), 4.91 (dd, J=1.2, 11.0 Hz, 1H, H-16), 1.97~1.88 (m, 5H), 1.83~1.74 (m, 5H), 1.62~1.47 (m, 4H), 1.32 (s, 3H, 19-Me), 1.23~1.10 (m, 2H), 0.90 (s, 3H, 17-Me), 0.86 (s, 3H, 20-Me); 13C NMR (DMSO-d6, 125 MHz) δ: 177.25, 177.12, 150.34, 139.64, 135.41, 135.17, 128.66, 125.04, 121.66, 110.15, 51.94, 46.02, 45.74, 45.53, 38.71, 36.88, 36.68, 35.97, 35.16, 24.77, 21.76, 19.98, 18.02, 17.49, 15.61; IR (KBr) ν: 3285, 3079, 1636, 1237, 1152 cm-1. HR (TOF) MS calcd for C27H37N3ONaS [M+Na]+ 474.2562, found 474.2555.
N-异海松酰胺基-N'-(4-氟苯基) 硫脲 (6b):白色固体, 收率72.63%. m.p. 112.3~113.9 ℃; 1H NMR (CDCl3, 500 MHz) δ: 10.79 (s, 1H, CONH), 10.26 (s, 1H, NHCSNH), 9.21 (s, 1H, NHCSNH), 7.44 (d, J=8.0 Hz, 2H, PhH), 7.40 (d, J=9.0 Hz, 2H, PhH), 5.86 (dd, J=11.0, 17.5 Hz, 1H, H-15), 5.27 (brd, J=5.0 Hz, 1H, H-7), 5.00 (dd, J=1.0, 17.5 Hz, 1H, H-16), 4.94 (dd, J=1.0, 11.0 Hz, 1H, H-16), 2.03~1.75 (m, 7H), 1.67~1.60 (m, 7H), 1.45 (s, 3H, 19-Me), 1.33~1.29 (m, 2H), 0.93 (s, 3H, 17-Me), 0.86 (s, 3H, 20-Me); 13C NMR (CDCl3, 125 MHz) δ: 176.10, 173.04, 150.08, 136.23, 135.84, 131.93, 129.23, 126.73, 120.26, 109.40, 51.82, 46.20, 45.90, 45.83, 38.52, 37.39, 36.66, 35.77, 35.03, 24.86, 21.44, 19.86, 17.76, 16.50, 15.32; IR (KBr) ν: 3293, 3082, 1639, 1235, 1149 cm-1. HR (TOF) MS calcd for C27H36FN3ONaS [M+Na]+492.2461, found 492.2471.
3.2.5 抑菌活性测试
采用二倍稀释法[25]测定了目标化合物金黄色葡萄球菌、大肠杆菌和白色念珠菌的抑菌活性.待测化合物溶解在DMSO中, 配制成浓度为2000 μg/mL的母液备用. 96孔板每孔加入灭菌肉汤75 μL, 在第1和第2孔中分别加入75 μL的母液, 混匀后从第1孔中取出75 μL弃去, 第2孔中吸取75 μL到第3孔, 混匀后再取75 μL到第4孔, 以此类推稀释至第11孔, 第12孔不加药物, 作为阴性对照.将对数生长期的供试菌株溶于无菌水中, 配制浓度约为105 CFU/mL的菌悬液. 96孔板中每孔加入75 μL菌悬液, 混匀后于37 ℃下培养24 h.观察细菌生长情况, 以肉汤透明清亮代表无细菌生长, 肉汤浑浊代表有细菌生长, 将能抑制细菌生长的有效组分最高以菌种不生长的最低浓度为该样品对该菌种的最小抑菌浓度 (MIC).
3.2.6 抗癌活性测试
采用MTT法[26]初步测定了目标化合物对A375和PC-3两种癌细胞的体外细胞毒活性进行了测试.待测化合物首先溶解在DMSO中, 配制成浓度为100 mmol/L的溶液, 再用培养液和10%的牛血清进行稀释, 得到待测化合物浓度分别为10, 50和100 μmol/L的溶液待用 (最终DMSO含量<1%).将两种癌细胞经常规消化、计数, 配制成浓度为4.5×104个/mL的细胞悬浮液, 然后接种到96孔板中 (100 μL/孔), 置于37 ℃, 5%的CO2氛围中培养24 h.再将上述配制好的不同浓度的待测化合物溶液加入到96孔板中 (100 μL/孔), 同时设对照组, 每孔3个复孔. 96孔细胞培养板置于37 ℃, 5%的CO2氛围中培养72 h后, 每孔加入20 μL (5 mg/mL) 溶液, 继续培养4 h, 弃去上清液, 每孔加入150 μL DMSO溶解, 摇床震荡10 min混匀, 用酶标仪测定490 nm处的吸光值 (OD).根据如下公式计算样品的抑制率:
辅助材料(Supporting Information)化合物3a~3l、5和6a~6b化合物的氢谱、碳谱和高分辨质谱图.这些材料可以免费从本刊网站 (http://siocjournal.cn) 上下载.
-
-
[1]
Rabergh, C. M. I.; Lilius, H.; Eriksson, J. E.; Isomaa, B. Aquat. Toxicol. 1999, 46, 55. doi: 10.1016/S0166-445X(98)00115-5
-
[2]
Nikinmaa, M.; Wickström, C.; Lilius, H.; Isomaa, B.; Rabergh, C. Environ. Toxicol. Chem. 1999, 18, 993. doi: 10.1002/etc.v18:5
-
[3]
Henney, N. C.; Li, B.; Elford, C.; Campbell, A. Am. J. Physiol. Cell Physiol. 2009, 297, C1397. doi: 10.1152/ajpcell.00311.2009
-
[4]
Wu, C.; Gopal, K. V.; Lukas, T. J.; Gross, G. W.; Moore, E. J. Eur. J. Pharmacology 2014, 732, 68. doi: 10.1016/j.ejphar.2014.03.017
-
[5]
Wang, L.; Kang, H.-C.; Li, Y.-Z.; Shui, Y.; Yamamoto, R.; Sugai, T.; Kato, N. Neuropharmacol. 2015, 92, 8. doi: 10.1016/j.neuropharm.2014.12.033
-
[6]
Sharma, S.; Nagar, V.; Mehta, B. K. Fitoterapia 1993, 64, 476.
-
[7]
Tanaka, R.; Tokuda, H.; Ezaki, Y. Phytomedicine 2008, 15, 985. doi: 10.1016/j.phymed.2008.02.020
-
[8]
Chang, L. C.; Song, L. L.; Park, E. J.; Luyengi, L.; Lee, K. J.; Farnsworth, N. R.; Pezzuto, J. M.; Kinqhorn, A. D. J. Nat. Prod. 2000, 63, 1235. doi: 10.1021/np0001575
-
[9]
Adamczyk, S.; Adamczyk, B.; Kitunen, V.; Smolander, A. Soil Biol. Biochem. 2015, 87, 59. doi: 10.1016/j.soilbio.2015.04.006
-
[10]
Bisio, A.; Fraternale, D.; Damonte, G.; Millo, E.; Lanteri, A. P.; Russo, E.; Romussi, G.; Parodi, B.; Ricci, D.; De Tommasi, N. Nat. Prod. Commun. 2009, 4, 1621.
-
[11]
Elliger, C. A.; Zinkel, D. F.; Chan, B. G.; Waiss, A. C., Jr. Experientia 1976, 32, 1364. doi: 10.1007/BF01937376
-
[12]
Perez Gutierrez, R. M.; Garcia, B. E. J. Asian Nat. Prod. Res. 2011, 13, 934. doi: 10.1080/10286020.2011.601744
-
[13]
Cheng, S.-S.; Chang, S.-T. Wood Sci. Technol. 2014, 48, 831. doi: 10.1007/s00226-014-0644-1
-
[14]
Xie, Y. S.; Isman, M. B.; Yi, F.; Wong, A. J. Chem. Ecol. 1993, 19, 1075. doi: 10.1007/BF00987370
-
[15]
龚银香, 王子云, 张正文, 陈传兵, 汪炎钢, 有机化学, 2006, 26, 360. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract335600.shtmlGong, Y.-X.; Wang, Z.-Y.; Zhang, Z.-W.; Chen, C.-B.; Wang, Y.-G. Chin. J. Org. Chem. 2006, 26, 360 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract335600.shtml
-
[16]
邹霞娟, 金桂玉, 杨昭, 高等学校化学学报, 2002, 23, 403.Zou, X.-J.; Jin, G.-Y.; Yang, Z. Chem. J. Chin. Univ. 2002, 23, 403 (in Chinese).
-
[17]
苏桂发, 霍丽妮, 覃江克, 潘成学, 关一富, 应用化学, 2008, 25, 803.Su, G.-F.; Huo, L.-N.; Qin, J.-K.; Pan, C.-X.; Guan, Y.-F. Chin. J. Appl. Chem. 2008, 25, 803 (in Chinese).
-
[18]
Elkholy, S. S.; Salem, H. A.; Eweis, M.; Elsabee, M. Z. Int. J. Biol. Macromol. 2014, 70, 199. doi: 10.1016/j.ijbiomac.2014.05.068
-
[19]
Plutín, A. M.; Mocelo, R.; Alvarez, A.; Ramos, R.; Castellano, E. E.; Cominetti, M. R.; Graminha, A. E.; Ferreira, A. G.; Batista, A. A. J. Inorg. Biochem. 2014, 134, 76. doi: 10.1016/j.jinorgbio.2014.01.022
-
[20]
Koca, İ.; Özgür, A.; Coşkun, K. A.; Tutar, Y. Bioorg. Med. Chem. 2013, 21, 3859. doi: 10.1016/j.bmc.2013.04.021
-
[21]
汪焱钢, 卢冰熙, 叶文法, 赵新筠, 杨军, 有机化学, 2002, 22, 862. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract326771.shtmlWang, Y.-G.; Lu, B.-X.; Ye, W.-F.; Zhao, X.-Y.; Yang, J. Chin. J. Org. Chem. 2002, 22, 862 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract326771.shtml
-
[22]
苏桂发, 霍丽妮, 陈睿, 赵丰丽, 关一富, 化学学报, 2008, 66, 2717.Su, G.-F.; Huo, L.-N.; Chen, R.; Zhao, F.-L.; Guan, Y.-F. Acta Chim. Sinica 2008, 66, 2717 (in Chinese).
-
[23]
Ulubelen, A.; Oksüz, S.; Topcu, G.; Gören, A. C.; Bozok-Johansson, C.; Celik, C.; Kökdil, G.; Voelter, W. Nat. Pro. Lett. 2001, 15, 307. doi: 10.1080/10575630108041297
-
[24]
Zhao, Z.-D.; Li, X.-D.; Bi, L.-W.; Chen, Y.-X.; Gu, Y.; Li, D.-M.; Wang, J. J. CN 101302151, 2008[Chem. Abstr. 2008, 150, 5919].
-
[25]
Hilliard, N. J.; Duffy, L. B.; Crabb, D. M.; Waites, K. B. J. Microbiol. Methods 2005, 60, 285. doi: 10.1016/j.mimet.2004.10.007
-
[26]
Liu, Z.-J.; Wu, S.-S.; Wang, Y.; Li, R.-J.; Wang, J.; Wang, L.-H.; Zhao, Y.-F.; Gong, P. Eur. J. Med. Chem. 2014, 87, 782. doi: 10.1016/j.ejmech.2014.10.022
-
[1]
-
表 1 异海松酰 (胺) 基硫脲衍生物的抑菌活性
Table 1. Antibacterial activity of isopimaric acylthiourea derivatives
Compd. R1/R2 MIC/(μg•mL-1) Staphylococcus aureus Escherichia coli Candida albicans 3a Ph >500 >500 31.25 3b p-CH3C6H4 >500 >500 31.25 3c m-CH3C6H4 >500 >500 62.5 3d o-CH3C6H4 >500 >500 31.25 3e p-BrC6H4 >500 >500 31.25 3f m-BrC6H4 >500 >500 62.5 3g o-BrC6H4 >500 >500 31.25 3h p-ClC6H4 >500 >500 15.63 3i m-ClC6H4 >500 15.63 31.25 3j p-O2NC6H4 >500 >500 31.25 3k 
>500 >500 31.25 3l 
>500 15.63 7.81 5 125 125 31.25 6a Ph >500 500 62.5 6b p-FC6H4 125 125 15.63 异海松酸 31.25 125 62.5 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 4
- 文章访问数: 1607
- HTML全文浏览量: 692


 下载:
下载:

 下载:
下载:

