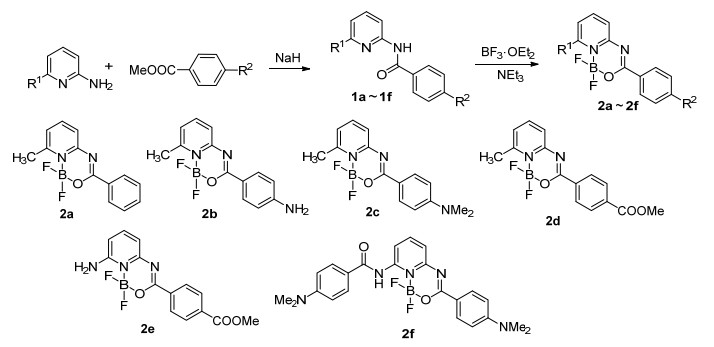
 图 图式 1
化合物2a~2f的合成路线和结构
Figure 图式 1.
Synthetic routes and chemical structures of 2a~2f
图 图式 1
化合物2a~2f的合成路线和结构
Figure 图式 1.
Synthetic routes and chemical structures of 2a~2f

Citation: Wu Yunying, Gou Gaozhang, Wu Xianxue, Yang Lijun, Fu Wenfu. Synthesis and Spectroscopic Properties of N, O-Chelated Pyridine-BF2 Complexes[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 704-710. doi: 10.6023/cjoc201607013

新型N, O-配位吡啶氟硼化合物的合成及其光谱性质
English
Synthesis and Spectroscopic Properties of N, O-Chelated Pyridine-BF2 Complexes
-
Key words:
- N, O-chelated
- / pyridine
- / fluorine-boron compound
- / ICT
- / spectroscopic properties
-
二吡咯甲川络合氟化硼衍生物 (BODIPYs) 由于具有高的荧光量子产率、高的光化学稳定性、特征的紫外吸收和荧光发射光谱, 被广泛应用于很多领域, 如细胞成像、分子探针、太阳能电池等[1].目前, 除了经典的二吡咯甲川氟硼化合物外, 还有基于二吡啶甲川[2]、二元酮[3]、亚酞菁[4]、偶氮苯[5]、吡嗪[6]、喹啉[7]、喹喔啉[8]、苯并噻唑[9]等为母体的有机氟硼化合物.众所周知, 大的Stokes位移和摩尔消光系数有利于荧光检测和分析[10].然而, 通常BODIPYs衍生物较小的Stokes位移 (<20 nm) 促进荧光的自吸收, 使得荧光强度减弱, 进而限制其应用[11].文献已报道, 取代基对氟硼化合物的光谱性质具有明显的影响, 利用不同的取代基能实现对其光谱性质的调节[12].因此, 我们设计并合成基于吡啶为母体的不同取代基的新型N, O-配位吡啶氟硼化合物.合成以氨基吡啶衍生物与苯甲酸甲酯衍生物为原料, 通过两步简单而高效的反应得到新型吡啶氟硼化合物2a~2f.为得到具有大Stokes位移的氟硼化合物, 引入具有强给电子能力的NMe2基, 使整个分子形成了D-π-A体系, 呈现出良好的光物理性能[13].通过紫外和荧光光谱研究目标化合物2a~2f的光谱性质 (溶剂效应、HBF4滴定、量子产率等), 结果表明取代基对光谱性质具有明显的影响, 含给电子基的化合物2b, 2c, 2e, 2f存在分子内电荷转移 (ICT), 相关结论通过密度泛函理论计算加以验证.新型吡啶氟硼化合物2a~2f的合成路线及结构见Scheme 1.
1 结果与讨论
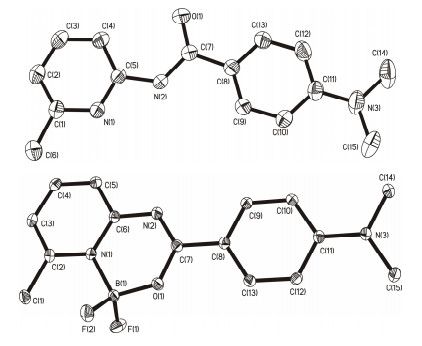
1.1 晶体结构
在室温条件下, 利用自然挥发或溶剂扩散分别得到6个化合物1c, 2a, 2b, 2c, 2e和2f的晶体, 其中化合物1c, 2a为无色晶体, 化合物2b, 2c, 2e和2f为浅黄色或黄色晶体.详细的晶体数据和晶体结构见辅助材料.化合物2a, 2b, 2c, 2e和2f中B (Ⅲ) 中心的四面体均呈现一定的扭曲, 整个分子是非共平面的, 吡啶环与苯环间存在一定的夹角, 分别为2.17°, 1.83°, 4.62°, 14.48°, 6.41°, 且化合物2f中由于未配位苯酰胺基的自由转动, 使整个分子的共平面性更差.从配体1c到配合物2c最显著的差异为对应酰胺键的键参数 (图 2), 化合物2c中C (7)—O (1) 键长为1.325(2) Å, 明显长于对应的配体1c[1.226(2) Å], 更接近于典型的C—O单键 (1.34Å).同时, 化合物2c中C (7)—N (2) 键具有典型的C=N双键的特性, 键长为1.300(2) Å, 小于配体1c中的键长1.370(3) Å.可见, 化合物2c确实形成新的B (1)—N (1) 键 (配位键) 和B (1)—O (1) 键 (共价键), 键长分别为1.590(2) 和1.448(2) Å, 硼原子周围键角范围为109.09(1)°到110.34(1)°.该结果与我们之前报道的典型N, O-配位-1, 8-萘啶氟硼化合物相似, 具有相似的成键形式[14].也就是说, 硼原子通过与氮原子和氧原子的配位作用螯合形成一个新的六元环.此外, 从配体到对应的氟硼化合物的红外分析证实, 酰胺键的特征吸收峰消失, 说明配体转化为氟硼化合物的过程中存在酮式到烯醇式的构型转变.
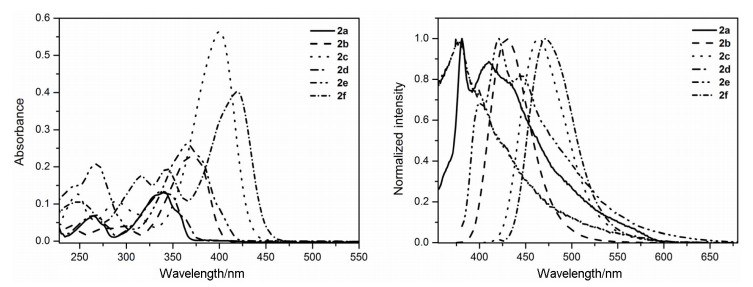
1.2 化合物2a~2f的紫外吸收光谱
化合物2a~2f测试浓度均为1.0×10-5 mol•L-1, 溶剂为CH2Cl2, 紫外吸收光谱如图 3所示.化合物2a~2f的最大吸收波长分别为340, 368, 400, 337, 365, 418 nm, 引起化合物间最大吸收波长差异的主要原因是取代基的不同使得分子的电子结构不同.化合物2c和2f相对于化合物2a和2d来说具有强给电子基 (NMe2), 然而当结构中同时含有富电子的给电子基 (D) 和能接受电子的部分 (A), 能使化合物形成D-π-A体系, 引起分子内电荷转移 (ICT) 进而导致吸收光谱的红移.同样, 化合物2b含给电子基 (NH2) 使其吸收光谱发生相应的红移.但对于同样含NH2的化合物2e而言, 其吸收光谱的红移可能是由于吡啶环上给电子基 (NH2) 与苯环对位吸电子基 (COOMe) 形成D-π-A体系, 进而存在一定的ICT.此外, 化合物2a~2f的摩尔消光系数 (ε) 分别为17050, 28760, 51980, 14380, 25250, 40750 L•mol-1•cm-1, 含强给电子基 (NMe2) 的化合物2c和2f具有较大的ε, 而含吸电子基 (COOMe) 的化合物2d呈现出最小的ε, 详见表 1.
Compd. λabsa/nm [ε/(L•mol-1•cm-1)] λemb/nm (Φ) Stokes shift/nm λemc/nm 2a 340 (17050), 264 381, 409 (<0.01) 41 408 2b 368 (28760), 300 430 (0.63) 62 472 2c 400 (51980), 289 464 (0.46) 64 485 2d 347, 337 (14380), 269 379 (<0.01) 32 407 2e 365 (25250), 268 400, 421, 446 (<0.01) 35 472, 499 2f 418 (40750), 341, 314 472 (0.20) 54 531 aε=molar extinction coefficient. Φ=fluorescence quantum yield, calculated using quinine sulfate as a standard (Φ=0.546 in 0.5 mol•L-1 H2SO4); bIn dichloromethane solution; cIn solid state. 表 1 298 K时化合物2a~2f的光学性质a
Table 1. Optical properties of complexes2a~2f at 298 K此外, 测试化合物2a~2f在不同溶剂中的溶剂效应, 浓度均为1.0×10-5 mol•L-1.化合物2a~2f均对溶剂具有一定的依赖性, 尤其是化合物2b, 2c, 2e和2f.这4个化合物在非极性溶剂正己烷中, 最大吸收峰附近出现肩峰, 呈现精细结构.然而, 在极性溶剂中为无精细结构的宽峰, 尤其是化合物2c在正己烷中最大吸收峰为395 nm且有389 nm的肩峰, 而在二氯甲烷中则最大吸收峰为400 nm的宽峰.
1.3 化合物2a~2f的荧光发射光谱
化合物2a~2f测试浓度均为1.0×10-5 mol•L-1, 溶剂为CH2Cl2, 荧光发射光谱的测定都以对应的最大吸收波长作为激发波长如图 3所示, 化合物2b, 2c和2f的发射光谱呈一个宽峰, 无精细结构, 而其他三个化合物的发射光谱均具有一定的精细结构如表 1所示, 在CH2Cl2溶液中, 化合物2a~2f的最大荧光发射波长分别为409, 430, 464, 379, 421, 472 nm.有趣的是, 化合物2b, 2c和2f的荧光量子产率为0.63, 0.46, 0.20, 而化合物2a, 2d和2e则几乎没有荧光.化合物2a~2f都具有较大的Stokes位移分别为41, 62, 64, 32, 35, 54 nm.此外, 化合物2a~2f固体均有一定的荧光, 最大荧光发射波长分别为408, 472, 485, 407, 499, 531 nm, 化合物2a, 2d和2e的固体荧光发射光谱具有一定的精细结构, 这一现象与溶液具有一致的特征.可见, 荧光性质和Stokes位移的差异在一定程度上也反映化合物2b, 2c, 2e和2f存在分子内电荷转移.
同样, 测试化合物2a~2f在不同溶剂中的溶剂效应, 浓度均为1.0×10-5 mol•L-1, 化合物2b, 2c, 2e和2f的溶液随着溶剂极性的增加, 发射光谱红移, 且荧光强度降低, 也说明存在分子内电荷转移[15].这一推测是基于极性溶剂有利于激发态电荷分离形态的稳定, 故促进电荷的转移, 进而引起发射光谱的红移; 同时, 溶剂极性的增加会增强氢键结合能力而降低对应量子产率, 荧光减弱[16].另一方面, Stokes位移随溶剂极性的增加而增大也证明存在ICT.相应地, 化合物2a, 2d在不同极性的溶剂中荧光强度变化不明显, 且Stokes位移随溶剂极性增加未表现出明显的变化, 此二者中不存在ICT效应.
1.4 HBF4滴定
为进一步说明光谱性质的不同是由于ICT引起的, 对化合物2c进行非水溶液酸碱滴定, 测试随着H+滴入的紫外吸收和荧光发射光谱变化.据文献所知, 氢键或质子化作用无论与分子内的电子给体或电子受体部分结合, 均对分子内电荷转移有着明显的影响[16].一般给电子基形成的分子内氢键与ICT相互竞争, 使荧光强度降低[17].化合物2c测试浓度为1.0×10-5 mol•L-1, 溶剂为CH2Cl2, 滴定所用酸为HBF4的CH2Cl2溶液, 紫外吸收和荧光光谱的实验结果与预期结果一致, 在化合物2c中含有可被H+质子化的NMe2基, 随着HBF4的滴入吸收光谱红移, 最大吸收波长从400 nm红移至425 nm, 且荧光强度明显减弱直至荧光消失.此外, 当加入的HBF4的量与被滴定物2c中NMe2基的量相等后, 光谱均不再有明显变化, 这说明H+与化合物2c的NMe2基是按计量比 (1:1) 进行反应.有趣的是, 将有机碱 (三乙胺) 加入到质子化后的2c溶液中, 其紫外吸收和荧光光谱均恢复到未加酸时的状态, 这说明质子化过程在一定程度上是可逆的[18].可逆的酸碱滴定过程进一步证实化合物2c存在分子内电荷转移.
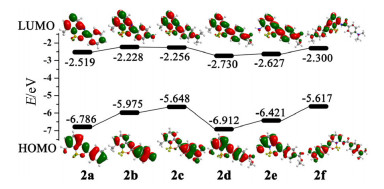
1.5 理论计算
为更好的解释实验观察到化合物2a~2f的光谱性质, 采用密度泛函方法 (DFT)[19], 结合TD-DFT (SCRF (PCM/Bader)-B3LYP/6-311++G (d, p)) 基组, 优化得到的化合物2a~2f的基态分子结构, 并计算6个化合物在CH2Cl2溶液中的最大吸收波长、前线分子轨道能量、振子强度和能隙 (eV) 等, 理论计算的最大吸收波长与实验所测结果相吻合. 图 4为化合物2a~2f分子在B3LYP/ 6-31+G*方法计算的分子轨道能级图及其对应的HOMO和LUMO.可见, 化合物2a和2d的HOMO和LUMO上的电子密度分布于整个分子.化合物2b, 2c和2f的HOMO分别主要集中于4-氨基苯基和4-(N, N-二甲氨基) 苯基部分, 而其LUMO主要集中于吡啶氟硼核部分, 说明化合物2b, 2c和2f中有利于实现电荷从给体[4-氨基苯基和4-(N, N-二甲氨基) 苯基]到受体 (吡啶氟硼核部分) 上的转移, 即计算结果表明化合物2b, 2c和2f存在ICT效应[20].同样, 化合物2e的HOMO分别主要集中于氨基吡啶环部分, 其LUMO集中于甲酯基部分, 说明也存在一定的ICT效应.
2 结论
利用简单高效的方法设计并合成了一类新型N, O-配位吡啶氟硼化合物2a~2f, 其结构通过核磁共振谱、质谱和红外光谱进行表征, X单晶衍射分析确定了1个配体和5个配合物的晶体结构, 并对其光谱性质进行实验和理论计算研究.实验结果表明, 苯环和吡啶环上的取代基及其位置对氟硼化合物光谱性质具有明显的影响, 强给电子基的引入使化合物形成D-π-A体系, 引起分子内电荷转移, 尤其是化合物2b, 2c, 2f表现出良好的光学性质, 如较大的Stokes位移、大的摩尔消光系数、高的荧光量子产率.相关实验结果得到密度泛函理论计算的支持, 计算所得最大吸收波长与实验结果相吻合, 前线分子轨道分析表明化合物2b, 2c, 2e, 2f存在ICT效应.可见, 这种改变不同取代基进行氟硼化合物光谱性质调节的策略可以用来设计合成新型的荧光材料.此外, 酸碱滴定实验表明, 化合物2c可作为高灵敏度的酸碱敏感材料.
3 实验部分
3.1 仪器与试剂
Bruker AvanceⅡ 400或Bruker DRX-500核磁共振仪 (内标为TMS); APEXⅡ型和FT-ICR型质谱仪; FT-MS型高分辨质谱仪; Hitachi U-3010紫外可见分光光度计 (1×1 cm2石英比色皿); Hitachi F-4500荧光光谱仪 (液体用1×1 cm2石英比色皿, 固体用石英管); Nicolet 170SX傅里叶变换红外光谱仪 (KBr压片); WRX-4显微熔点仪; Rigaku R-AXIS RAPID IP或Bruke SMART CCD X射线单晶衍射仪.
层析柱硅胶为青岛海洋生产200~300目, 湿法装柱.用于化学反应和提纯过程中的溶剂均为分析纯, 无水反应所用的除水溶剂均按文献的方法处理[21], 其他合成所用的试剂均为市售产品, 使用前未处理.
3.2 实验方法
3.2.2 化合物2a~2f的合成
以化合物2c为例, 将化合物1c(153 mg, 0.60 mmol) 溶于50 mL除水的CH2Cl2中, 加入三乙胺 (2 mL, 15 mmol) 搅拌10 min, 再滴加入三氟化硼乙醚 (2 mL, 16 mmol), 室温搅拌反应24 h.待反应结束后, 用CH2Cl2稀释, 少量水洗涤, 有机相用无水Na2SO4干燥, 过滤, 旋干溶剂.粗产品进行硅胶柱层析[V(CH2Cl2):V(石油醚, 60~90 ℃)=1:4], 旋干洗脱剂后得到化合物2c.相同的方法得到其他目标化合物2a, 2b, 2d, 2e和2f.
8-甲基-3-苯基-1H-吡啶[1, 2-c][1, 3, 5, 2]氧杂氮杂-1, 1-二氟化硼 (2a):白色固体粉末, m.p. 155.1~155.9 ℃, 产率83%. 1H NMR (500 MHz, CDCl3) δ: 8.38 (d, J=7.2 Hz, ArH, 2H), 7.95 (t, J=7.9 Hz, Pyridine-H, 1H), 7.60 (t, J=7.4 Hz, ArH, 1H), 7.51 (t, J=7.7 Hz, ArH, 2H), 7.40 (d, J=8.3 Hz, Pyridine-H, 1H), 7.19 (d, J=7.5 Hz, Pyridine-H, 1H), 2.88 (s, CH3, 3H); 13C NMR (126 MHz, CDCl3) δ: 163.9, 155.4, 152.9, 143.0, 133.0, 132.3, 129.5, 128.4, 122.7, 121.6, 21.5; 19F NMR (471 MHz, CDCl3) δ: -130.50 (d, J=15.5 Hz, 1F), -130.57 (d, J=15.5 Hz, 1F); FT-IR (KBr) ν: 3065, 2926, 2850, 1612, 1582, 1547, 1498, 1477, 1453, 1425, 1370, 1261, 1171, 1139, 1117, 1073, 1028, 1015, 917, 793, 712 cm-1; ESI-MS m/z: 260.9 [M+1]+. HR-ESI-MS calcd for C13H11BF2N2O 260.09325, found 260.10491.
3-(4-氨基苯基)-8-甲基-1H-吡啶[1, 2-c][1, 3, 5, 2]氧杂氮杂-1, 1-二氟化硼 (2b):黄色固体粉末, m.p. 188.4~189.0 ℃, 产率75%. 1H NMR (400 MHz, CDCl3) δ: 8.17 (d, J=8.0 Hz, ArH, 2H), 7.84 (t, J=7.6 Hz, Pyridine-H, 1H), 7.26 (d, Pyridine-H, 1H), 7.05 (d, J=6.7 Hz, Pyridine-H, 1H), 6.69 (d, J=7.9 Hz, ArH, 2H), 4.13 (br s, NH2, 2H), 2.81 (s, CH3, 3H); 13C NMR (126 MHz, CDCl3) δ: 164.2, 156.0, 152.4, 151.2, 142.5, 131.8, 121.4, 121.1, 114.2, 114.0, 21.4; 19F NMR (471 MHz, CDCl3) δ: -131.25 (d, J=15.5 Hz, 1F), -131.31 (d, J=15.5 Hz, 1F); FT-IR (KBr) ν: 3458, 3323, 3223, 1646, 1624, 1608, 1587, 1538, 1514, 1471, 1443, 1419, 1365, 1327, 1258, 1173, 1143, 1116, 1078, 1018, 841, 798, 747, 698; ESI-MS m/z: 273.9 [M-1]+. HR-ESI-MS calcd for C13H12BF2N3O 275.10415, found 275.11515.
3-[4-(二甲基氨基) 苯基]-8-甲基-1H-吡啶[1, 2-c][1, 3, 5, 2]氧杂氮杂-1, 1-二氟化硼 (2c):黄色固体粉末, m.p. 202.4~203.3 ℃, 产率87%. 1H NMR (400 MHz, CDCl3) δ: 8.24 (d, J=9.1 Hz, ArH, 2H), 7.83 (t, J=8.2 Hz, Pyridine-H, 1H), 7.27 (d, J=7.4 Hz, Pyridine-H, 1H), 7.03 (d, J=7.4 Hz, Pyridine-H, 1H), 6.71 (d, J=9.1 Hz, ArH, 2H), 3.10 (s, CH3, 6H), 2.82 (s, CH3, 3H); 13C NMR (101 MHz, CDCl3) δ: 165.5, 157.2, 154.8, 153.3, 143.5, 132.6, 122.2, 122.1, 199.9, 112.0, 41.2, 22.5; 19F NMR (376 MHz, CDCl3) δ: -131.38 (d, J=15.0 Hz, 1F), -131.47 (d, J=15.4 Hz, 1F); FT-IR (KBr) ν: 3449, 2922, 2855, 1590, 1512, 1471, 1435, 1373, 1260, 1195, 1113, 1073, 1012, 941, 806, 749, 698; ESI-MS m/z: 304.2 [M+1]+. HR-ESI-MS calcd for C15H16BF2N3O [M+1]+ 304.13545, found 304.14320..
3-[4-(甲氧基羰基) 苯基]-8-甲基-1H-吡啶[1, 2-c][1, 3, 5, 2]氧杂氮杂-1, 1-二氟化硼 (2d):白色固体粉末, m.p. 188.6~189.2 ℃, 产率80%. 1H NMR (400 MHz, CDCl3) δ: 8.41 (d, J=8.5 Hz, ArH, 2H), 8.13 (d, J=8.5 Hz, ArH, 2H), 7.96 (t, J=7.9 Hz, Pyridine-H, 1H), 7.41 (d, J=8.2 Hz, Pyridine-H, 1H), 7.21 (d, J=7.5 Hz, Pyridine-H, 1H), 3.96 (s, CH3, 3H), 2.86 (s, CH3, 3H); 13C NMR (101 MHz, CDCl3) δ: 166.6, 162.9, 155.2, 153.3, 143.4, 136.4, 133.9, 129.6, 129.5, 123.5, 121.9, 52.5, 21.6; 19F NMR (376 MHz, CDCl3) δ: -130.18 (1F, d, J=13.9 Hz), -130.26 (1F, d, J=14.3 Hz); FT-IR (KBr) ν: 2997, 2956, 1726, 1621, 1604, 1539, 1472, 1424, 1283, 1263, 1195, 1142, 1118, 1105, 1068, 1026, 1016, 912, 807, 725; ESI-MS m/z: 319.1 [M+1]+, 341.1 [M+22]+. HR-ESI-MS calcd for C14H13BF2N2O3 [M+1]+ 319.09873, found 319.10658.
8-氨基-3-[4-(甲氧基羰基) 苯基]-1H-吡啶[1, 2-c][1, 3, 5, 2]氧杂氮杂-1, 1-二氟化硼 (2e):淡黄色固体粉末, m.p. 229.2~230.0 ℃, 产率74%. 1H NMR (400 MHz, DMSO) δ: 8.27 (d, J=8.5 Hz, ArH, 2H), 8.10 (d, J=8.6 Hz, ArH, 2H), 7.85 (dd, J=8.5, 7.8 Hz, Pyridine-H, 1H), 7.41 (br s, NH2, 2H), 6.79 (d, J=8.6 Hz, Pyridine-H, 1H), 6.68 (d, J=7.5 Hz, Pyridine-H, 1H), 3.90 (s, CH3, 3H); 13C NMR (101 MHz, DMSO) δ: 166.4, 159.1, 155.2, 149.5, 144.2, 137.0, 133.5, 130.1, 129.2, 110.4, 109.3, 53.0; 19F NMR (376 MHz, DMSO) δ: -134.50 (d, J=18.2 Hz, 1F), -134.60 (d, J=17.7 Hz, 1F); FT-IR (KBr)ν: 3489, 3371, 3255, 2928, 1713, 1655, 1614, 1556, 1501, 1446, 1359, 1292, 1187, 1109, 1067, 1032, 933, 811, 786, 721; ESI-MS m/z: 320.1 [M+1]+; HR-ESI-MS calcd for C14H12BF2N3O3 [M+1]+ 320.09398, found 320.10191.
8-[4-(二甲基氨基) 苯甲酰胺基]-3-[4-(二甲基氨基) 苯基]-1H-吡啶[1, 2-c][1, 3, 5, 2]氧杂氮杂-1, 1-二氟化硼 (2f):黄色固体粉末, m.p. 214.7~215.5 ℃, 产率83%. 1H NMR (400 MHz, CDCl3) δ: 9.72 (t, J=8.72 Hz, NH, 1H), 8.44 (d, J=8.3 Hz, Pyridine-H, 1H), 8.13 (d, J=9.1 Hz, ArH, 2H), 7.87 (t, J=8.2 Hz, Pyridine-H, 1H), 7.83 (d, J=9.0 Hz, ArH, 2H), 7.02 (d, J=8.0 Hz, Pyridine-H, 1H), 6.67 (d, J=9.0 Hz, ArH, 2H), 6.63 (d, J=9.0 Hz, ArH, 2H), 3.02 (s, CH3, 6H), 3.01 (s, CH3, 6H); 13C NMR (101 MHz, CDCl3) δ: 165.9, 164.4, 154.8, 154.7, 154.5, 147.0, 145.2, 132.6, 130.4, 120.7, 119.6, 117.9, 112.4, 112.0, 111.5, 41.2, 41.2; 19F NMR (376 MHz, CDCl3) δ: -130.80 (d, J=17.3 Hz, 1F), -130.91 (d, J=16.9 Hz, 1F); FT-IR (KBr) ν: 3435, 2980, 2892, 1682, 1608, 1521, 1470, 1408, 1286, 1168, 1096, 945, 809, 756, 690; ESI-MS m/z: 452.4 [M+1]+. HR-ESI-MS calcd for C23H24BF2-N5O2 [M+1]+ 452.19911, found 452.20694.
辅助材料 (Supporting Information)详细的实验内容, 红外光谱, 晶体数据, 附加的光谱数据, 理论计算数据和核磁谱图这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.1 化合物1a~1f的合成
以化合物1c为例, 将NaH (0.8 g) 溶于70 mL除水的四氢呋喃 (THF) 中, 加入2-氨基-6-甲基吡啶 (1.08 g, 0.01 mol)、4-二甲氨基苯甲酸甲酯 (1.79 g, 0.01 mol), 80 ℃加热回流24 h.待反应结束后, 真空旋干溶剂.在冰水浴条件下, 将10 mL饱和NH4Cl溶液慢慢加入到粗产品中, 过滤, 干燥.干燥后, 粗产品进行硅胶柱层析[V(CH2Cl2):V(MeOH)=200:1], 旋干洗脱剂得到化合物1c.用相同的方法得到其他相应配体1a, 1b, 1d, 1e和1f.
N-(6-甲基-2-吡啶) 苯甲酰胺 (1a):白色固体粉末, m.p. 86.4~87.1 ℃, 产率54%. 1H NMR (500 MHz, CDCl3) δ:8.61 (br s, NH, 1H), 8.22 (d, J=8.3 Hz, Pyridine-H, 1H), 7.96 (d, J=7.3 Hz, ArH, 2H), 7.67 (t, J=7.9 Hz, Pyridine-H, 1H), 7.59 (t, J=7.4 Hz, ArH, 1H), 7.51 (t, J=7.5 Hz, ArH, 2H), 6.96 (d, J=7.5 Hz, Pyridine-H, 1H), 2.49 (s, CH3, 3H); FT-IR (KBr) ν: 3227, 3192, 3051, 2924, 2854, 1682, 1674, 1606, 1578, 1530, 1456, 1398, 1305, 1277, 1163, 1130, 789, 721, 696 cm-1.
4-氨基-N-(6-甲基-2-吡啶) 苯甲酰胺 (1b):白色固体粉末, m.p. 160.6~161.4 ℃; 产率42%. 1H NMR (400 MHz, CDCl3) δ: 8.40 (br s, NH, 1H), 8.17 (d, J=8.3 Hz, Pyridine-H, 1H), 7.76 (d, J=8.6 Hz, ArH, 2H), 7.62 (t, J=7.9 Hz, Pyridine-H, 1H), 6.89 (d, J=7.4 Hz, Pyridine-H, 1H), 6.70 (d, J=8.6 Hz, ArH, 2H), 4.08 (br s, NH2, 2H), 2.46 (s, CH3, 3H); FT-IR (KBr) ν: 3455, 3350, 3104, 3036, 2922, 1667, 1617, 1599, 1579, 1458, 1446, 1394, 1297, 1272, 1245, 1185, 1155, 894, 845, 794, 761, 682 cm-1.
4-(二甲基氨基)-N-(6-甲基-2-吡啶) 苯甲酰胺 (1c):白色固体粉末, m.p. 135.2~135.8 ℃, 产率65%. 1H NMR (400 MHz, CDCl3) δ: 8.43 (br s, NH, 1H), 8.19 (d, J=8.0 Hz, Pyridine-H, 1H), 7.84 (d, J=9.0 Hz, ArH, 2H), 7.61 (t, J=8.0 Hz, Pyridine-H, 1H), 6.88 (d, J=8.0 Hz, Pyridine-H, 1H), 6.70 (d, J=9.0 Hz, Ar-H, 2H), 3.05 (s, CH3, 6H), 2.47 (s, CH3, 3H); FT-IR (KBr) ν: 3486, 3190, 3022, 2908, 2855, 1663, 1604, 1525, 1453, 1371, 1301, 1195, 794, 756, 690 cm-1.
4-[N-(6-甲基-2-吡啶) 氨基甲酰基]苯甲酸甲酯 (1d):无色固态, m.p. 95.9~96.6 ℃, 产率44%. 1H NMR (400 MHz, CDCl3) δ: 8.55 (br s, NH, 1H), 8.17 (m, ArH, Pyridine-H, 3H), 7.99 (d, J=8.3 Hz, ArH, 2H), 7.66 (t, J=7.9 Hz, Pyridine-H, 1H), 6.96 (d, J=7.5 Hz, Pyridine-H, 1H), 3.96 (s, 3H), 2.48 (s, 3H); FT-IR (KBr) ν: 3390, 3062, 2958, 2925, 1710, 1676, 1599, 1577, 1528, 1455, 1403, 1392, 1309, 1282, 1268, 1236, 1125, 1109, 791, 730 cm-1.
4-[N-(6-氨基-2-吡啶) 氨基甲酰基]苯甲酸甲酯 (1e):白色固体粉末, m.p. 131.7~132.5 ℃, 产率39%. 1H NMR (400 MHz, CDCl3) δ: 8.25 (br s, NH, 1H), 8.15 (d, J=8.4 Hz, Ar-H, 2H), 7.95 (d, J=8.4 Hz, ArH, 2H), 7.70 (d, J=7.9 Hz, Pyridine-H, 1H), 7.52 (t, J=7.9 Hz, Pyridine-H, 1H), 6.31 (d, J=8.0 Hz, Pyridine-H, 1H), 4.34 (br s, NH2, 2H), 3.96 (s, CH3, 3H); FT-IR (KBr) ν: 3455, 3363, 3236, 3058, 2953, 2925, 2852, 1723, 1655, 1641, 1610, 1540, 1463, 1360, 1313, 1288, 1128, 1112, 1019, 787, 726 cm-1.
N, N'-(2, 6-吡啶) 双[4-(二甲氨基) 苯甲酰胺](1f):白色固体粉末, m.p. 224.4~225.3 ℃, 产率57%. 1H NMR (400 MHz, CDCl3) δ: 8.12 (br s, NH, 2H), 8.00 (d, J=8.1 Hz, Pyridine-H, 2H), 7.75 (d, J=8.8 Hz, ArH, 4H), 7.70 (t, J=8.1 Hz, Pyridine-H, 1H), 6.65 (d, J=9.0 Hz, ArH, 4H), 2.99 (s, CH3, 12H); FT-IR (KBr) ν: 3438, 3136, 2906, 2859, 2806, 1657, 1605, 1499, 1444, 1375, 1298, 1260, 1198, 945, 799, 759, 693 cm-1.
-
-
[1]
(a) Loudet, A. ; Burgess, K. Chem. Rev. 2007, 107, 4891.
(b) Ulrich, G. ; Ziessel, R. ; Harriman, A. Angew. Chem. , Int. Ed. 2008, 47, 1184.
(c) Frath D. ; Massue J. ; Ulrich G. ; Ziessel R. Angew. Chem. 2014, 126, 2322.
(d) Wu, G. F. ; Xu, Q. L. ; Guo, L. E. ; Zang, T. N. ; Tan, R. ; Tao, S. T. ; Ji, J. F. ; Hao, R. T. ; Zhang, J. F. ; Zhou, Y. Tetrahedron Lett. 2015, 56, 5034.
(e) He, Y. , Feng, R. K. ; Yi, Y. R. ; Liu, Z. X. Chin. J. Org. Chem. 2014, 34, 2236 (in Chinese).
(何源, 冯若昆, 易云瑞, 刘占祥, 有机化学, 2014, 34, 2236. ) -
[2]
Kubota, Y.; Tsuzuki, T.; Funabiki, K.; Ebihara, M.; Matsui, M. Org. Lett. 2010, 12, 4010. doi: 10.1021/ol101612z
-
[3]
(a) Nagai, A.; Kokado, K.; Nagata, Y.; Arita, M.; Chujo, Y. J. Org. Chem.2008, 73, 8605.
(b) Poon, C.T.; Lam, W. H.; Wong, H. L.; Yam, V. W. W. J. Am. Chem. Soc. 2010, 132, 13992. -
[4]
(a) Claessens, C. G.; González-Rodŕguez, D.; Torres, T. Chem. Rev.2002, 102, 835.
(b) Zhu, H.; Shimizu, S.; Kobayashi, N. Angew. Chem., Int. Ed. 2010, 49, 8000. -
[5]
(a) Yoshino, J.; Furuta, A.; Kambe, T.; Itoi, H.; Kano, N.; Kawashima, T.; Ito, Y.; Asashima, M.Chem.-Eur. J.2010, 16, 5026.
(b) Yoshino, J.; Kano, N.; Kawashima, T. Chem. Commun. 2007, 6, 559. -
[6]
Kubota, Y.; Hara, H.; Tanaka, S.; Funabiki, K.; Matsui, M. Org. Lett. 2011, 13, 6544. doi: 10.1021/ol202819w
-
[7]
Yang, Y.; Hughes, R. P.; Aprahamian, I. J. Am. Chem. Soc. 2014, 136, 13190. doi: 10.1021/ja508125n
-
[8]
Liao, C. W.; Rao, M. R.; Sun, S. S. Chem. Commun. 2015, 51, 2656. doi: 10.1039/C4CC08958H
-
[9]
Wang, X. Q.; Liu, Q. S.; Yan, H.; Liu, Z. P.; Yao, M. G.; Zhang, Q. F.; Gong, S. W.; He, W. J. Chem. Commun. 2015, 51, 7497. doi: 10.1039/C5CC01902H
-
[10]
(a) Cosgrave, L.; Devocelle, M.; Forster, R. J.; Keyes, T. E. Chem. Commun.2010, 46, 103.
(b) Zhang, D.; Wen, Y.; Xiao, Y.; Yu, G.; Liu, Y.; Qian, X. Chem. Commun.2008, 4777. -
[11]
(a) Hepp, A.; Uirich, G.; Schmechel, R.; von Seggern, H.; Ziessel, R. Synth. Met.2004, 146, 11.
(b) Qu, X.; Liu, Q.; Ji, X.; Chen, H.; Zhou, Z.; Shen, Z. Chem. Commun.2012, 48, 4600. -
[12]
Martin, A.; Long, C.; Forster, R. J.; Keyes, T. E. Chem. Commun. 2012, 48, 5617. doi: 10.1039/c2cc31150j
-
[13]
(a) Grabowski, Z. R.; Rotkiewicz, K.; Rettig, W. Chem. Rev.2003, 103, 3899.
(b) Seo, J.; Kim, S.; Park, S. Y. J. Am. Chem. Soc.2004, 126, 11154.
(c) Zhao, G. J.; Chen, R. K.; Sun, M. T.; Liu, J. Y.; Li, G. Y.; Gao, Y. L.; Han, K. L.; Yang, X. C.; Sun, L. Chem.-Eur. J.2008, 14, 6935.
(d) Araneda, J. F.; Piers, W. E.; Heyne, B.; Parvez, M.; McDonald, R. Angew. Chem., Int. Ed. 2011, 50, 12214. -
[14]
(a) Wu, Y. Y.; Chen, Y.; Gou, G. Z.; Mu, W. H.; Lv, X. J.; Du, M. L.; Fu, W. F. Org. Lett. 2012, 14: 5226.
(b) Wu, Y. Y.; Chen, Y.; Mu, W. H.; Lv, X. J.; Fu, W. F. J. Photochem. Photobiol. A 2013, 72, 73. -
[15]
Chakraborty, A.; Kar, S.; Guchhait, N. Chem. Phys. 2006, 320, 75. doi: 10.1016/j.chemphys.2005.06.031
-
[16]
Chipem, F. A. S.; Mishra, A.; Krishnamoorthy, G. Phys. Chem. Chem. Phys. 2012, 14, 8775. doi: 10.1039/c2cp23879a
-
[17]
Singh, T. S.; Mitra, S. J. Lumin. 2007, 127, 508. doi: 10.1016/j.jlumin.2007.03.001
-
[18]
孙静波, 张恭贺, 贾小宇, 薛鹏冲, 贾俊辉, 卢然, 化学学报, 2016, 74, 165. doi: 10.6023/A15090628Sun, J. B.; Zhang, G. H.; Jia, X. Y.; Xue, P. C.; Jia, J. H.; Lu, R. Acta Chim. Sinica 2016, 74, 165 (in Chinese). doi: 10.6023/A15090628
-
[19]
Frisch, M. J.; Trucks, G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Scalmani, G.; Barone, V.; Mennucci, B.; Petersson, G. A.; Nakatsuj, H.; Caricato, M.; Li, X.; Hratchian, H. P.; Izmaylov, A. F.; Bloino, J.; Zheng, G.; Sonnenberg, J. L.; Hada, M.; Ehara, M.; Toyota, K.; Fukuda, R.; Hasegawa, J.; Ishida, M.; Nakajima, T.; Honda, Y.; Kitao, O.; Nakai, H.; Vreven, T.; Montgomery, Jr. J. A.; Peralta, J. E.; Ogliaro, F.; Bearpark, M.; Heyd, J. J.; Brothers, E.; Kudin, K. N.; Staroverov, V. N.; Keith, T.; Kobayashi, R.; Normand, J.; Raghavachari, K.; Rendell, A.; Burant, J. C.; Iyengar, S. S.; Tomasi, J.; Cossi, M.; Rega, N.; Millam, J. M.; Klene M.; Knox J. E.; Cross J. B.; Bakken V.; Adamo C.; Jaramillo J.; Gomperts, R.; Stratmann, R. E.; Yazyev, O.; Austin, A. J.; Cammi, R.; Pomelli, C.; Ochterski, J. W.; Martin, R. L.; Morokuma, K.; Zakrzewski, V. G.; Voth, G. A.; Salvador, P.; Dannenberg, J. J.; Dapprich, S.; Daniels, A. D.; Farkas, O.; Foresman, J. B.; Ortiz, J. V.; Cioslowski, J.; Fox, D. J. Gaussian 09, Revision B.01, Gaussian, Inc., Wallingford CT, 2010.
-
[20]
巫友雄, 任泓扬, 吴义芳, 王炳喜, 化学学报, 2015, 73, 53. doi: 10.6023/A14110795Wu, Y. X.; Ren, H. Y.; Wu, Y. F.; Wang, B. X. Acta Chim. Sinica 2015, 73, 53 (in Chinese). doi: 10.6023/A14110795
-
[21]
Armarego, W. L. F.; Chai, C. L. L. Purification of Laboratory Chemicals, 5nd ed., Butterworth-Heinemann Press, Oxford, 2003.
-
[1]
-
图 3 298 K下浓度为1.0×10-5 mol•L-1时化合物2a~2f在二氯甲烷中的紫外-可见吸收和荧光发射光谱
Figure 3 UV-vis absorption and fluorescence emission spectra of 2a~2f in dichloromethane measured at a concentration of 1.0×10-5 mol•L-1 at 298 K
λex=340 nm for 2a, 368 nm for 2b, 400 nm for 2c, 336 nm for 2d, 365 nm for 2e, and 418 nm for 2f
表 1 298 K时化合物2a~2f的光学性质a
Table 1. Optical properties of complexes2a~2f at 298 K
Compd. λabsa/nm [ε/(L•mol-1•cm-1)] λemb/nm (Φ) Stokes shift/nm λemc/nm 2a 340 (17050), 264 381, 409 (<0.01) 41 408 2b 368 (28760), 300 430 (0.63) 62 472 2c 400 (51980), 289 464 (0.46) 64 485 2d 347, 337 (14380), 269 379 (<0.01) 32 407 2e 365 (25250), 268 400, 421, 446 (<0.01) 35 472, 499 2f 418 (40750), 341, 314 472 (0.20) 54 531 aε=molar extinction coefficient. Φ=fluorescence quantum yield, calculated using quinine sulfate as a standard (Φ=0.546 in 0.5 mol•L-1 H2SO4); bIn dichloromethane solution; cIn solid state. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 13
- 文章访问数: 1324
- HTML全文浏览量: 129


 下载:
下载:



 下载:
下载:

