 图 1
从烯胺酮出发合成2H-氮杂丙烯啶方法
Figure 1.
Methods for the synthesis of 2H-azirines from enaminone.
图 1
从烯胺酮出发合成2H-氮杂丙烯啶方法
Figure 1.
Methods for the synthesis of 2H-azirines from enaminone.

Citation: Yang Kun, Duan Xiyan, Li Junbo, Liu Pu, Guo Xuming, Li Jun, Zhou Huiyun, Liu Ning, Liu Jianwei, Wang Shuangshuang, Li Huixian, Du Yazhen, Ma Junying. Copper-Promoted Oxidative Cyclization/Migration of Enaminone for Synthesis of Functionalized 2H-Azirines[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 1040-1045. doi: 10.6023/cjoc201611025

铜试剂介导下烯胺酮的氧化环化/迁移合成取代的2H-氮杂丙烯啶的方法
English
Copper-Promoted Oxidative Cyclization/Migration of Enaminone for Synthesis of Functionalized 2H-Azirines
-
Key words:
- copper-promoted
- / 2H-azirines
- / enaminone
- / oxidative cyclization/migration
-
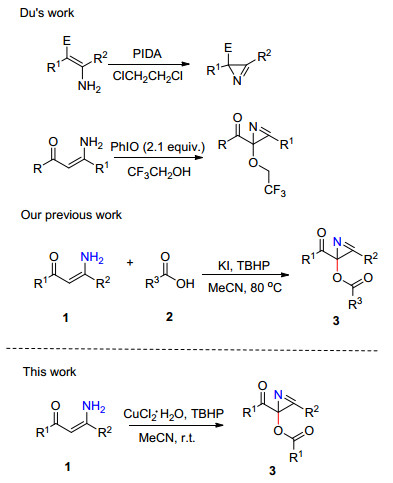
构筑杂环化合物是有机化学和药物化学领域中非常重要的研究方向[1].作为最小的不饱和氮杂环, 2H-氮杂丙烯啶常见于天然产物[2]、合成中间体以及药物分子中[3].更重要的是, 2H-氮杂丙烯啶经常被用于合成多种多样的杂环以及其它有用的中间体[4].这些特点驱使着化学家发展更多的2H-氮杂丙烯啶的新合成策略[5a~5f].此外, 我们小组最近报道了2-酰氧基-2H-氮杂丙烯啶可作为有用的中间体和酸进行取代反应[5g].而该反应预示着2-酰氧基-2H-氮杂丙烯啶能够和不同亲核试剂反应得到2位取代的2H-氮杂丙烯啶.
通过文献调研可知2H-氮杂丙烯啶的合成策略主要有[6]: Neber反应; 乙烯基叠氮化合物的加热或光照条件下的重排反应; 从α-溴代酮肟出发, 经过磷叶立德合成; 利用伯氨为起始原料, 在钯催化下得到2H-氮杂丙烯啶; 从异噁唑出发, 在光照低温条件下得到目标产物; 利用异丙基苯基酮与二甲基肼合成2H-氮杂丙烯啶.
和传统的合成策略相比, 直接通过烯胺酮中间体的丙烯啶化反应被视为一种构筑2H-氮杂丙烯啶结构单元的有趣和高效的合成方法[2, 7]. Du及其合作者[2, 7]发展了高价碘介导的烯胺中间体的的丙烯啶化反应构筑2位取代的2H-氮杂丙烯啶 (图 1).最近, 我们课题组[8]报道了一种通过KI/TBHP (叔丁基过氧化氢) 介导下烯胺酮和羧酸的氧化交叉偶联高效构筑取代的2H-氮杂丙烯啶的方法 (图 1).然而, 为了得到2位取代的2H-氮杂丙烯啶, 大部分上述方法都要借助于偶联反应或者直接使用已经存在取代基的底物..据我们所知, 还没有仅从简单、未取代的烯胺酮出发, 没有其它反应物参与下直接一步构筑2-苯酰氧基-2H-氮杂丙烯啶的报道.本文报道了一种通过CuCl2·H2O/TBHP介导下烯胺酮的氧化环化/迁移构筑2位取代的2H-氮杂丙烯啶的新方法 (图 1).本文报道的合成策略要不同于上述两种反应途径.
1 结果与讨论
由于其易得的性质, 化合物1a被选为初始底物来筛选反应条件 (表 1).我们最初致力于铜试剂的筛选.筛选一系列铜试剂发现, Cu (NO3)2, CuSO4, Cu (acac)2, CuCO3, CuO以及CuCl得不到目标产物2a(表 1, Entries 1~6).当尝试铜试剂CuCl2·H2O时, 却能够以71%的产率得到产物2a(表 1, Entry 7).然而, 使用铜试剂CuBr2作为反应的催化剂时, 2a的产率急剧下降 (表 1, Entry 8).同样对其它过氧化物包括二叔丁基过氧化物 (DTBP), H2O2进行筛选, 这些过氧化物能够以较低的产率 (15%~35%) 得到产物2a(表 1, Entries 9~10).筛选其它一系列溶剂包括N, N-二甲基甲酰胺 (DMF)、四氢呋喃 (THF)、1, 4-二氧六环、甲苯、EtOH以及二氯乙烷 (DCE), 发现这些溶剂不如乙腈有效 (Entries 11~16).反应体系中仅有TBHP参与, 并不能得到目标产物 (表 1, Entry 17).

Entry Catalyst (equiv.) Oxidant (equiv.) Solvent Yieldb/% 1 Cu (NO3)2 (1) TBHP (2) CH3CN nd 2 CuSO4 (1) TBHP (2) CH3CN nd 3 Cu (acac)2 (1) TBHP (2) CH3CN nd 4 CuCO3 (1) TBHP (2) CH3CN nd 5 CuO (1) TBHP (2) CH3CN nd 6 CuCl (1) TBHP (2) CH3CN nd 7 CuCl2·H2O (1) TBHP (2) CH3CN 71 8 CuBr2 (1) TBHP (2) CH3CN 40 9 CuCl2·H2O (1) DTBP (2) CH3CN 15 10 CuCl2·H2O (1) H2O2 (2) CH3CN 35 11 CuCl2·H2O (1) TBHP (2) DMF nd 12 CuCl2·H2O (1) TBHP (2) THF nd 13 CuCl2·H2O (1) TBHP (2) 1, 4-Dioxane 20 14 CuCl2·H2O (1) TBHP (2) Toluene nd 15 CuCl2·H2O (1) TBHP (2) EtOH Trace 16 CuCl2·H2O (1) TBHP (2) DCE nd 17 — TBHP (2) CH3CN nd a Reaction conditions: the substrates 1a (1 mmol) was reacted with catalysts and oxidants in solvent (10 mL) for 30 min unless otherwise stated. nd=no detected. b Isolated yields. 表 1 反应条件的优化a
Table 1. Optimization of the reaction conditions得到优化的反应条件后, 首先研究了烯胺酮化合物对该反应的适用度 (表 2).结果表明, 当R2为苯基时, R1为含有甲基的苯环时, 反应能够以较高的产率得到产物2b (表 2, Entry 2).当R1中的苯环上有卤素F和Cl取代时, 该类底物同样适用于本反应 (2c~2d)(表 2, Entries 3~4).当R1为苯基、R2可以为含有吸电子或者给电子的苯基 (含有对甲氧基、对氯或者对溴的苯基) 时, 反应能够顺利进行并且能够以较低或者中等产率得到相应的产物2e~2g(表 2, Entries 5~7).当R1为萘基时, 反应同样顺利进行并且能够以中等产率得到产物2h (56%) (表 2, Entry 8).
 表 2 反应适用范围的研究a
表 2 反应适用范围的研究a
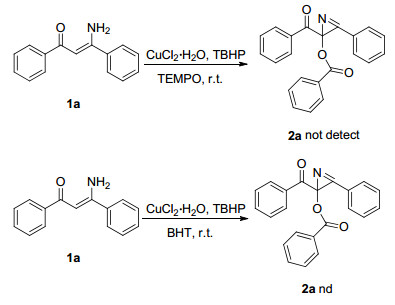
Table 2. Investigation of the scope of the procedure为了研究反应机理, 我们做了一些控制实验.由于铜盐和过氧化物的组合被视为自由基引发剂的最常见来源, 本反应可能涉及到自由基机制[9].为了验证这一假设, 自由基捕捉剂2, 6-二叔丁基-4-甲基苯酚 (BHT) 在标准条件下加入以后, 仅发现未反应的烯胺酮1a.当自由基捕捉剂2, 2, 6, 6-四甲基哌啶-1-氧化物 (TEMPO) 在标准条件下加入反应体系中, 并没有检测出目标产物.这个反应结果证实了反应历程为自由基机制 (Scheme 1).
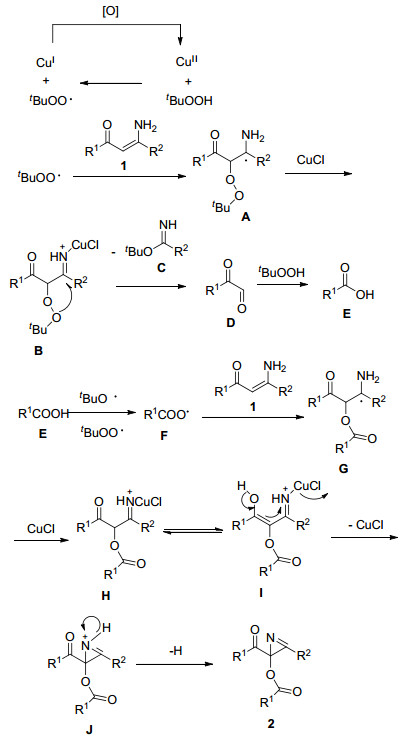
基于文献报道以及我们的控制实验, 提出了一个可能的反应机制 (Scheme 2). TBHP产生的叔丁氧基自由基首先和烯胺酮1反应得到自由基A.中间体A又可以通过去质子化得到亚胺离子中间体B.然后中间体B通过α-碳的碳碳键裂解得到中间体D.这一历程类似于1, 3-二羰基化合物及其衍生物在双氧水以及四丁基碘化胺作用下通过氧化裂解得到酸类化合物的反应[10].通过TBHP氧化中间体D可以得到相应的羧酸E.通过TBHP而引发产生的酸自由基F可以和烯胺酮1反应得到中间体G[8].紧接着中间体G可以去质子化得到中间体H, 中间体H异构化得到烯醇异构体I.中间体I发生2位碳原子分子内进攻氮原子得到中间体J.最后, 中间体J发生去质子化得到目标产物2.
2 结论
总之, 成功发展了通过铜试剂促进的烯胺酮的氧化环化/迁移反应来合成2-苯酰氧基-2H-氮杂丙烯啶的方法.进一步的扩展反应底物以及发展反应应用正在进行中.
3 实验部分
3.1 仪器与试剂
Bruker AVANCE Ⅲ 400 MHz核磁共振谱仪 (以CDCl3为溶剂, TMS为内标); X-4型数字显示熔点测定仪 (温度计未校正); 柱色谱硅胶GF254(青岛海洋化工有限公司, 化学纯).其余所用试剂为化学纯或分析纯.其他试剂均为市售分析纯.
3.2 实验方法
3.2.1 取代的2H-氮杂丙烯啶的合成
将一水合氯化铜CuCl2·H2O (1 mmol) 和叔丁基过氧化氢 (2 mmol) 加入乙腈 (10 mL) 中, 然后加入烯胺酮1 (1 mmol).反应混合物在室温下搅拌直至起始原料消耗完全 (约30 min), 将乙酸乙酯 (20 mL) 加入反应体系中.用饱和硫代硫酸钠洗涤有机相, 合并的有机相用无水硫酸钠干燥, 过滤然后减压浓缩.通过柱层析纯化反应粗品得到目标产物.
2-苯甲酰基-3-苯基-2H-氮杂丙烯啶基-苯甲酸酯 (2a)[8]: 121 mg, 黄色油状液体, 产率71%. 1H NMR (CDCl3, 400 MHz) δ: 8.20~8.18 (m, 2H), 8.04 (t, J=6.8 Hz, 4H), 7.69~7.66 (m, 1H), 7.60 (t, J=6.8 Hz, 2H), 7.55 (t, J=7.6 Hz, 1H), 7.51~7.47 (m, 1H), 7.42~7.38 (m, 4H); 13C NMR (100 MHz, CDCl3) δ: 193.88, 166.98, 165.97, 135.13, 134.59, 133.69, 132.92, 131.06 (2C), 129.89 (2C), 129.37 (2C), 128.82 (2C), 128.45, 128.40 (2C), 128.37 (2C), 121.35, 70.03. HRMS (ESI) calcd for C22H16NO3 [M+H]+ 342.1130, found 342.1133.
4-甲基苯甲酰基-3-苯基-2H-氮杂丙烯啶-4-甲基苯甲酸酯 (2b): 136 mg, 黄色油状液体, 产率74%. 1H NMR (CDCl3, 400 MHz) δ: 8.18 (d, J=7.5 Hz, 2H), 7.97 (d, J=7.9 Hz, 2H), 7.92 (d, J=7.9 Hz, 2H), 7.66 (d, J=7.1 Hz, 1H), 7.60 (t, J=7.4 Hz, 2H), 7.20 (d, J=5.5 Hz, 4H), 2.38 (s, 3H), 2.34 (s, 3H); 13C NMR (CDCl3, 100 MHz) δ: 193.40, 167.26, 166.01, 144.58, 143.87, 134.47, 132.56, 131.11 (2C), 130.02 (2C), 129.35 (2C), 129.16 (2C), 129.13 (4C), 125.85, 121.63, 69.99, 21.67, 21.62; HRMS (ESI) calcd for C24H20NO3[M+H]+ 370.1443, found 370.1436.
4-氟苯甲酰基-3-苯基-2H-氮杂丙烯啶-2-基苯甲酸酯 (2c): 97 mg, 黄色油状液体, 产率51%. 1H NMR (CDCl3, 400 MHz) δ: 8.17 (d, J=7.1 Hz, 2H), 8.05 (dt, J=7.5, 5.5 Hz, 4H), 7.69 (t, J=7.4 Hz, 1H), 7.62 (t, J=7.4 Hz, 2H), 7.09 (dd, J=14.5, 8.5 Hz, 4H); 13C NMR (CDCl3, 100 MHz) δ: 192.10, 167.51, 167.23, 166.81, 164.99 (JC-F=3.6 Hz), 164.27, 134.79, 132.69, 132.60, 131.75 (2C), 131.66 (2C), 131.15 (2C), 129.49 (2C), 115.85 (JC-F=7.3 Hz, 2C), 115.63 (JC-F=7.1 Hz, 2C), 70.07; HRMS (ESI) calcd for C22H14F2NO3[M+H]+ 378.0942, found 378.0944.
4-氯苯甲酰基-3-苯基-2H-氮杂丙烯啶-4-氯苯甲酸酯 (2d): 106 mg, 黄色油状液体, 产率52%. 1H NMR (CDCl3, 400 MHz) δ: 8.16 (d, J=7.2 Hz, 2H), 7.95 (dd, J=8.3, 5.6 Hz, 4H), 7.70 (t, J=7.4 Hz, 1H), 7.62 (t, J=7.5 Hz, 2H), 7.39 (t, J=9.2 Hz, 4H); 13C NMR (CDCl3, 100 MHz) δ: 192.46, 167.04, 165.17, 140.48, 139.54, 134.87, 133.35, 131.35 (2C), 131.18 (2C), 130.34 (2C), 129.52 (2C), 128.92 (2C), 128.84 (2C), 126.85, 121.14, 70.11; HRMS (ESI) calcd for C22H14Cl2NO3 [M+H]+ 410.0351, found 410.0341.
2-苯甲酰基-3-(4-甲氧基苯基)-2H-氮杂丙烯啶-苯甲酸酯 (2e): 70 mg, 黄色油状液体, 产率38%. 1H NMR (CDCl3, 400 MHz) δ: 8.14 (d, J=8.9 Hz, 2H), 8.07~7.95 (m, 4H), 7.54 (d, J=7.4 Hz, 1H), 7.46 (d, J=7.4 Hz, 1H), 7.39 (dt, J=15.7, 7.7 Hz, 4H), 7.09 (d, J=8.9 Hz, 2H), 3.89 (s, 3H); 13C NMR (CDCl3, 100 MHz) δ: 194.21, 166.13, 165.52, 164.69, 135.29, 133.61, 133.39 (2C), 132.78, 129.93 (2C), 128.83 (2C), 128.67, 128.39 (2C), 128.33 (2C), 114.99 (2C), 113.52, 70.13, 55.61; HRMS (ESI) calcd for C23H18NO4[M+H]+ 372.1236, found 372.1228.
2-苯甲酰基-3-(4-氯苯基)-2H-氮杂丙烯啶-苯甲酸酯 (2f): 105 mg, 黄色油状液体, 产率56%. 1H NMR (CDCl3, 400 MHz) δ: 8.14 (d, J=8.4 Hz, 2H), 8.03 (t, J=7.2 Hz, 4H), 7.59 (d, J=8.4 Hz, 2H), 7.57~7.52 (m, 1H), 7.50 (d, J=7.3 Hz, 1H), 7.41 (t, J=7.6 Hz, 4H); 13C NMR (CDCl3, 100 MHz) δ: 193.76, 166.77, 166.00, 141.21, 135.04, 133.83, 133.10, 132.35 (2C), 129.98 (2C), 129.89 (2C), 128.95 (2C), 128.49 (2C), 128.46 (2C), 128.40, 120.01, 70.00; HRMS (ESI) calcd for C22H15ClNO3 [M+H]+ 376.0741, found 376.0742.
2-苯甲酰基-3-(4-溴苯基)-2H-氮杂丙烯啶-苯甲酸酯 (2g): 67 mg, 黄色油状液体, 产率32%. 1H NMR (CDCl3, 400 MHz) δ: 8.11~7.96 (m, 6H), 7.76 (d, J=8.4 Hz, 2H), 7.57 (s, 1H), 7.50 (d, J=7.5 Hz, 1H), 7.42 (t, J=7.6 Hz, 4H); 13C NMR (CDCl3, 100 MHz) δ: 193.77, 166.97, 166.01, 161.55, 135.02, 133.86, 133.14, 132.90 (2C), 132.40 (2C), 130.00 (2C), 128.97 (2C), 128.51 (2C), 128.49 (2C), 128.38, 120.43, 69.96. HRMS (ESI) calcd for C22H15BrNO3[M+H]+ 420.0235, found 420.0222.
2-(2-萘甲酰基)-3-苯基-2H-氮杂丙烯啶2-萘甲酸酯 (2h): 123 mg, 黄色油状液体, 产率56%. 1H NMR (CDCl3, 400 MHz) δ: 8.68 (s, 1H), 8.63 (s, 1H), 8.25 (d, J=7.5 Hz, 2H), 8.09 (d, J=8.6 Hz, 1H), 8.02 (d, J=8.6 Hz, 1H), 7.90~7.78 (m, 6H), 7.68 (d, J=6.9 Hz, 1H), 7.63 (t, J=7.3 Hz, 2H), 7.58~7.48 (m, 4H); 13C NMR (CDCl3, 100 MHz) δ: 193.77, 167.44, 166.26, 135.79, 135.37, 134.66, 132.47, 132.29, 132.25, 131.96, 131.23 (2C), 130.84, 129.54, 129.46 (2C), 129.41, 128.67, 128.52, 128.36, 128.32, 127.72, 127.70, 126.79, 126.74, 125.72, 125.09, 124.62, 121.57, 70.40. HRMS (ESI) calcd for C30H20NO3[M+H]+ 442.1443, found 442.1432.
辅助材料 (Supporting Information)化合物的氢谱、碳谱和高分辨质谱数据.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
(a) Singh, R.; Kissling, R. M.; Letellier, M.-A.; Nolan, S. P. Tsang, W. C. P.; Zheng, N.; Buchwald S. L. J. Am. Chem. Soc. 2005, 127, 14560.
(b) Brown, E. G. Ring Nitrogen and Key Biomolecules, Kluwer, Boston, MA, 1998.
(c) Li, J.-J.; Corey, E. J. Name Reactions in Heterocyclic Chemistry, Wiley-Interscience, Hoboken, NJ, 2005. -
[2]
Sun, X.; Lyu, Y.; Zhang-Negrerie, D.; Du, Y.; Zhao, K. Org. Lett. 2013, 15, 6222. doi: 10.1021/ol4030716
-
[3]
For selected examples, see: (a) Xin, Z.; Gøgsig, T. M.; Lindhardt, A. T.; Skrydstrup, T. Org. Lett. 2012, 14, 284.
(b) Nahmany, M.; Melman, A. Org. Lett. 2001, 3, 3733.
(c) Kim, S.; Lee, J. I. J. Org. Chem. 1984, 49, 1712.
(d) Masamune, S.; Hayase, Y.; Schilling, W.; Chan, W. K.; Bates, G. S. J. Am. Chem. Soc. 1977, 99, 6756.
(e) Takimoto, S.; Inanaga, J.; Katsuki, T.; Yamagughi, M. Bull. Chem. Soc. Jpn. 1976, 49, 2335.
(f) Rossi, R. A.; de Rossi, R. H. J. Org. Chem. 1974, 39, 855.
(g) Kaiser, E. M.; Woodruff, R. A. J. Org. Chem. 1970, 35, 1198.
(h) Parish, R. C.; Stock, L. M. J. Org. Chem. 1965, 30, 927.
(i) Zhu, Y.; Wei, Y. RSC Adv. 2013, 3, 13668.
(j) Zhang, H.; Shi, R.; Ding, A.; Lu, L.; Chen, B.; Lei, A. Angew. Chem., Int. Ed. 2012, 51, 12542.
(k) Li, X.; Zou, D.; Zhu, H.; Wang, Y.; Li, J.; Wu, Y.; Wu, Y. Org. Lett. 2014, 16, 1836.
(l) Katritzky, A. R.; Wang, M.; Wilkerson, C. R.; Yang, H. J. Org. Chem. 2003, 68, 9105.
(m) Alonso-Cruz, C. R.; Kennedy, A. R.; Rodríguez, M. S.; Suárez, E. J. Org. Chem. 2008, 73, 4116. -
[4]
(a) Jin, L.; Wu, Y.; Zhao, X. J. Org. Chem. 2015, 80, 3547.
(b) Loy, N. S. Y.; Singh, A.; Xu, X.; Park, C.-M. Angew. Chem., Int. Ed. 2013, 52, 2212.
(c) Prechter, A.; Henrion, G.; Bel, P. F.; Gagosz, F. Angew. Chem., Int. Ed. 2014, 53, 4959.
(d) Candito, D. A.; Lautens, M. Org. Lett. 2010, 12, 3312.
(e) Jana, S.; Clements, M. D.; Sharp, B. K.; Zheng, N. Org. Lett. 2010, 12, 3736.
(f) Zhu, L.; Yu, Y.; Mao, Z.; Huang, X. Org. Lett. 2015, 17, 30.
(g) Liu, X.; Cheng, R.; Zhao, F.; Zhang-Negrerie, D.; Du, Y.; Zhao, K. Org. Lett. 2012, 14, 5480.
(h) Loy, N. S. Y.; Kim, S.; Park, C.-M. Org. Lett. 2015, 17, 395. -
[5]
(a) Katritzky, A. R.; Wang, M.; Wilkerson, C. R.; Yang, H. J. Org. Chem. 2003, 68, 9105.
(b) Alonso-Cruz, C. R.; Kennedy, A. R.; Rodríguez, M. S.; Suárez, E. J. Org. Chem. 2008, 73, 4116.
(c) Alonso-Cruz, C. R.; Kennedy, A. R.; Rodríguez, M. S.; Suárez, E. Org. Lett. 2003, 5, 3729.
(d) Knoll, W.; Mieusset, J.-L.; Arion, V. B.; Brecker, L.; Brinker, U. H.; Org. Lett. 2010, 12, 2366.
(e) Davis, F. A.; Reddy, G. V.; Liu, H. J. Am. Chem. Soc. 1995, 117, 3651.
(f) Moerdyk, J. P.; Bielawski, C. W. J. Am. Chem. Soc. 2012, 134, 6116.
(g) Duan X.; Yang, K.; Liu, J.; Kong, X.; Liang, J.; Zhou, D.; Zhou, H.; Zhang, Y.; Liu, N.; Feng, S.; Gu, G.; Lu, J.; Song, N.; Zhang, D.; Ma J. Adv. Synth. Catal. 2016, 358, 3161. -
[6]
(a) Palacios, F.; Ochoa de Retana, A. M.; Martinez de Marigorta, E.; Manuel de los Santos, J. Org. Prep. Proced. Int. 2002, 34, 219.
(b) Palacios, F.; Ochoa de Retana, A. M.; Martinez de Marigorta, E.; Manuel de los Santos, J. Eur. J. Org. Chem. 2001, 13, 2401.
(c) Melo, P.; Rocha G. Curr. Org. Chem. 2004, 1, 275.
(d) Katritzky, A. R.; Wang, M.; Wilkerson, C. R.; Yang, H. J. Org. Chem. 2003, 68, 9105.
(e) Hassner A.; Alexanian V. J. Org. Chem. 1979, 44, 3861.
(f) Atkinson R. S.; Kelly B. J. J. Chem. Soc., Chem. Commun. 1989, 836.
(g) Nunes, C. M.; Reva, I.; Pinho e Melo, T. M. V. D.; Fausto, R. J. Org. Chem. 2012, 77, 8723.
(h) Leonard, N. J.; Zwanenburg B. J. Am. Chem. Soc. 1967, 89, 4456. -
[7]
Li, X.; Du, Y.; Liang, Z.; Li, X.; Pan, Y.; Zhao, K. Org. Lett. 2009, 11, 2643. doi: 10.1021/ol9006663
-
[8]
Duan, X.; Kong, X.; Zhao, X.; Yang, K.; Zhou, H.; Zhou, D.; Zhang, Y.; Liu, J.; Ma, J.; Liu, N.; Wang, Z. Tetrahedron Lett. 2016, 57, 1446. doi: 10.1016/j.tetlet.2016.02.060
-
[9]
(a) Wang, J.; Liu, C.; Yuan, J.; Lei A. Angew. Chem., Int. Ed. 2013, 52, 2256.
(b) Rout, S. K.; Guin, S.; Ali, W.; Gogoi, A.; Patel, B. K. Org. Lett. 2014, 16, 3086. -
[10]
(a) Yuan, Y.; Ji, X.; Zhao, D. Eur. J. Org. Chem. 2010, 5274.
(b) Stepovik, L. P.; Gulenova, M. V.; Kalacheva, I. A.; Potkina, A. Y. Russ. J. Gen. Chem. 2011, 81, 550.
-
[1]
-
表 1 反应条件的优化a
Table 1. Optimization of the reaction conditions

Entry Catalyst (equiv.) Oxidant (equiv.) Solvent Yieldb/% 1 Cu (NO3)2 (1) TBHP (2) CH3CN nd 2 CuSO4 (1) TBHP (2) CH3CN nd 3 Cu (acac)2 (1) TBHP (2) CH3CN nd 4 CuCO3 (1) TBHP (2) CH3CN nd 5 CuO (1) TBHP (2) CH3CN nd 6 CuCl (1) TBHP (2) CH3CN nd 7 CuCl2·H2O (1) TBHP (2) CH3CN 71 8 CuBr2 (1) TBHP (2) CH3CN 40 9 CuCl2·H2O (1) DTBP (2) CH3CN 15 10 CuCl2·H2O (1) H2O2 (2) CH3CN 35 11 CuCl2·H2O (1) TBHP (2) DMF nd 12 CuCl2·H2O (1) TBHP (2) THF nd 13 CuCl2·H2O (1) TBHP (2) 1, 4-Dioxane 20 14 CuCl2·H2O (1) TBHP (2) Toluene nd 15 CuCl2·H2O (1) TBHP (2) EtOH Trace 16 CuCl2·H2O (1) TBHP (2) DCE nd 17 — TBHP (2) CH3CN nd a Reaction conditions: the substrates 1a (1 mmol) was reacted with catalysts and oxidants in solvent (10 mL) for 30 min unless otherwise stated. nd=no detected. b Isolated yields. 表 2 反应适用范围的研究a
Table 2. Investigation of the scope of the procedure

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 4
- 文章访问数: 1214
- HTML全文浏览量: 121


 下载:
下载:


 下载:
下载:

