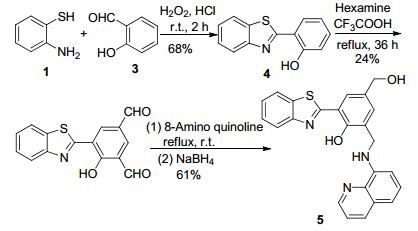
 图式1
探针5的合成
Scheme1.
Synthesis of probe 5
图式1
探针5的合成
Scheme1.
Synthesis of probe 5

Citation: Jiang Kai, Cao Liang, Hao Zhifeng, Chen Meiyan, Cheng Jieluan, Li Xiao, Xiao Ping, Chen Liang, Wang Zhaoyang. Research Progress in Design, Synthesis and Application of Benzothiazole-Based Fluorescent Probes[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2221-2236. doi: 10.6023/cjoc201703041

苯并噻唑基荧光探针的设计、合成与应用研究进展
English
Research Progress in Design, Synthesis and Application of Benzothiazole-Based Fluorescent Probes
-
Key words:
- benzothiazole
- / fluorescent probe
- / design and synthesis
- / detecting application
- / progress
-
苯并噻唑类化合物长期以来备受科学家们的关注, 尤其在生物制药[1, 2]和医疗诊断[3]领域有重要应用.其实, 就苯并噻唑基团而言, 由于刚性的平面结构与离域的大π键的存在, 使苯并噻唑类化合物荧光量子产率较高, 近年来在光电材料[4]和荧光探针[5~7]制备方面受到重视, 特别是其结构中含有的N、S原子可与金属配位等作用[8, 9], 使它们在荧光探针方面的应用得到了迅猛的发展[9, 10].鉴于此, 本文对近期苯并噻唑基荧光探针的设计、合成与应用情况方面的进展进行了综述.
1 应用于金属阳离子的检测
金属离子含量超标对生态环境造成严重的污染, 给人体健康带来巨大的危害.因此, 设计、合成可应用于金属离子检测的荧光探针受到人们的重视.目前, 有很多文献报道了基于苯并噻唑化合物的荧光探针分子用于检测Hg2+, Cu2+, Fe3+, Zn2+等金属离子[11].
1.1 检测汞离子
利用苯并噻唑基荧光探针检测Hg2+, 是近年来荧光探针研究领域的热点之一[12, 13].例如, Ju等[14]以2-氨基苯硫酚(1)为原料, 设计、合成了探针2 (Eq. 1), 当其中具有特殊配位作用的大环选择性地固定Hg2+时, 引起原本由苯并噻唑基团提供的416 nm处特征发射峰对应的淡黄色荧光猝灭, 故能实现对Hg2+的专一识别.
Sahana等[15]也将苯并噻唑基团作为荧光团引入探针分子, 以1和水杨醛3等为原料, 经多步反应合成了“turn on”型探针分子5 (Scheme 1).其中, NH、酚羟基和喹啉基团上N原子与Hg2+配位, 在较宽pH范围的缓冲溶液体系内形成了具有黄色荧光的金属配合物, 而且可在Hela细胞内实现对Hg2+的检测.
不仅能够利用苯并噻唑基团充当特征荧光团的功能设计探针分子, 还可利用其提供配位原子的特点设计、合成探针[16~18].例如, 梅群波等[19]合成了一系列基于2-噻吩基苯并噻唑的探针分子(如化合物6), 它们都能与Hg2+发生配位作用.当探针6以1:1配位时(Eq. 2), 在可见光下观察到溶液由无色变为黄色, 故可实现可见光下的裸眼识别.不仅如此, 其荧光光谱也呈现着比率型的变化, 最大发射波长从468 nm红移至567 nm, 荧光颜色由蓝变黄, 检测限低达3.98×10-6 mol•L-1.
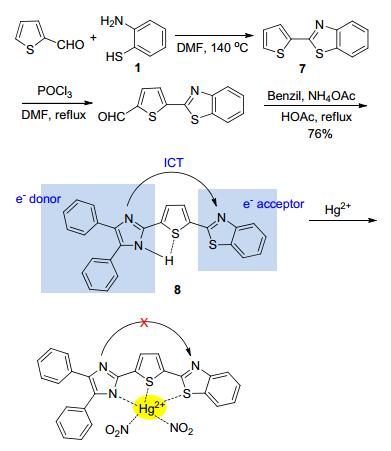
把富电子基团与苯并噻唑基团相连, 也是构建荧光探针的一种手段.例如, Razi等[20]以化合物1为原料, 首先合成了中间体7, 再进一步通过多步反应, 得到D-π-A型探针分子8 (Scheme 2).由于分子内存在着由咪唑基团到苯并噻唑基团的分子内电荷转移(ICT)现象, 当其与Hg2+以1:1形成配合物后, 配位作用使得ICT机制受阻, 探针8上的电荷分布发生变化, 荧光发射峰蓝移28 nm, 荧光量子产率从0.24提高至0.61.因此, 这种仅对Hg2+的螯合增强荧光(CHEF)效应使探针8可以选择性地检测Hg2+.
有别于上述探针分子基于与Hg2+发生配位作用形成配合物从而改变荧光性质的原理, 反应型Hg2+探针则是通过与Hg2+的反应, 改变自身结构, 使原有荧光性质发生变化来达到检测的目的[21].其中, 多数反应型探针都是基于常见的激发态分子内质子转移(ESIPT)机制设计的[22].
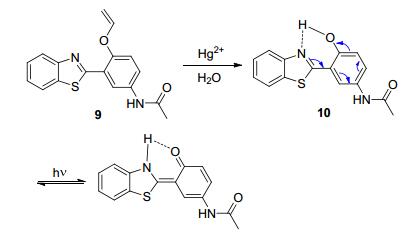
例如, Ahn等[23]把乙烯醚基团引入到苯并噻唑基苯上, 可得到探针9, 其与二价汞盐发生羟汞化反应而水解, 生成类似典型的ESIPT型荧光探针结构2-(2-羟基苯基)-苯并噻唑(HBT)的化合物10.在365 nm激发波长的激发下时, 10的苯酚结构互变为具有更长发射波长和更强荧光的醌式结构(Scheme 3).由于是经羟汞化而水解的特殊反应机理, 该探针具有良好的选择性.
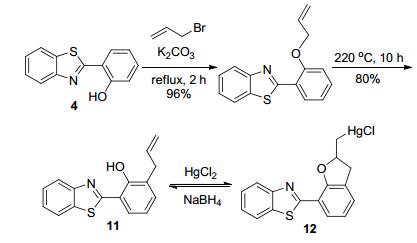
在国内, 刘伟生课题组[24]则将烯丙基接入到2-苯并噻唑基苯酚(4)成醚, 经Claisen重排后得到了反应型探针分子11 (Scheme 4).往含有0.5% CH3CN的11的磷酸盐缓冲溶液(PBS)加入HgCl2, 化合物12的生成阻止了ESIPT过程的发生, 导致荧光光谱发生变化, 溶液荧光颜色由绿变蓝.但是, 随着硼氢化钠的加入, 化合物12可回到原来探针11的结构, 使荧光颜色复原, 故能实现可逆检测.
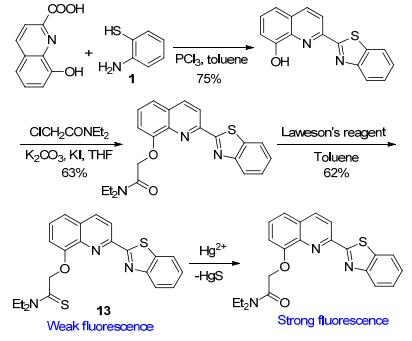
除此之外, Chang等[25]根据仅汞离子可催化硫代酰胺水解为酰胺的反应特点, 设计合成了脱HgS的另一类反应型Hg2+探针分子13 (Scheme 5), 其对Ni2+, Cu2+, Cd2+等其它过渡金属均无响应, 显示出对Hg2+具有良好的选择性.
1.2 检测铜离子
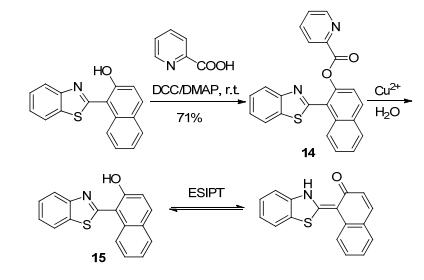
Cu2+的检测一直受到关注[26], 用于检测Cu2+的苯并噻唑基探针也常被报道[27, 28].其中, 较为常见的是涉及HBT结构的ESIPT型荧光探针[21].例如, Tang等[29]合成了的反应型探针14, 利用Cu2+对化合物14的催化水解作用, 可生成ESIPT型结构的分子15 (Scheme 6), 其对Cu2+检测限达1.34×10-6 mol•L-1, 低于美国国家环境保护局饮用水中2×10-5 mol•L-1的Cu2+浓度限度要求.
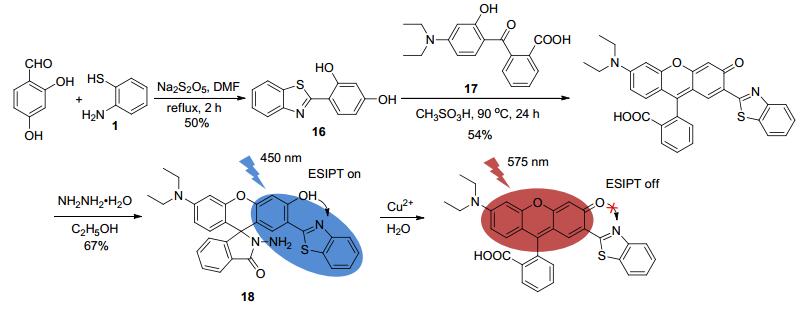
罗丹明类化合物常被设计成荧光探针, 当其结构改造中引入HBT结构时, 亦可应用于Cu2+的检测[30].例如, 杨小峰等[31]先合成了HBT类化合物16, 再将其与2-(4-二乙基氨基-2-羟基苯甲酰基)-苯甲酸(17)反应, 最终可得到具有HBT结构的罗丹明类探针18, 其能发出HBT的特征荧光, 且仅Cu2+的加入会催化18发生水解、开环反应, 使ESIPT型荧光机制消失, 呈现出罗丹明类化合物的特征荧光, 即荧光发射峰从450 nm红移至575 nm (Scheme 7), 故18可作为选择性检测Cu2+的比率型荧光探针.
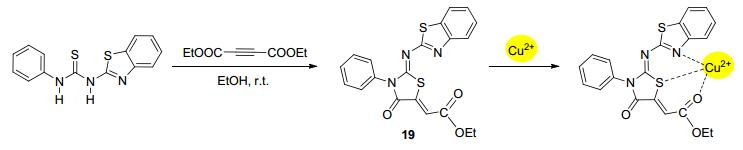
电荷转移机理广泛被应用于金属离子的检测当中[32](包括ICT机理[20, 33]).因此, 基于电荷转移机理的探针分子原本在溶液中能发出一定颜色的荧光, 当其与Cu2+配位形成配合物后, 电荷发生转移, 溶液荧光猝灭或者颜色改变, 籍此可以实现对Cu2+的检测.例如, Wagh等[34]设计的探针分子19 (Scheme 8)在体积比为1:1的甲醇水体系中随着Cu2+的加入, 电荷从Cu2+转移到19上, 存在显著的荧光猝灭响应.
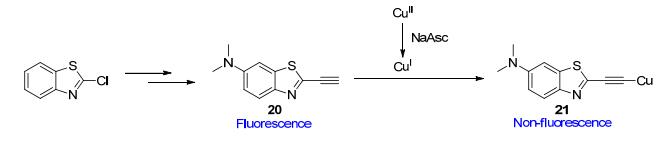
Tung等[35]则依据炔类化合物与一价铜反应生成了炔铜化合物21的原理设计并合成了用于间接检测Cu2+的反应型荧光探针20 (Scheme 9).在含有还原剂抗坏血酸钠(NaAsc)和探针20的水溶液中滴加Cu2+, 荧光发生明显的猝灭, 但其它+2价金属离子(如Ni2+, Mn2+, Mg2+等)的加入则没有引起溶液荧光的变化.
1.3 检测铁离子
苯并噻唑基荧光探针用于Fe3+的检测, 已有文献报道[36], 而且一般是通过与金属离子的配位引起荧光变化的[37].例如, 刘相课题组[38]通过亲核取代反应构建醚键的方式, 将两个HBT结构同时接在噁二唑环的两侧, 合成了具有4个亚胺N配位原子的探针分子22 (Eq. 3), 其与Fe3+发生配位作用后, 触发CHEF效应, 荧光量子产率从0.073提高到了0.13, 荧光光谱发生红移并增强约103倍, 检测限为6.04×10-8 mol•L-1.
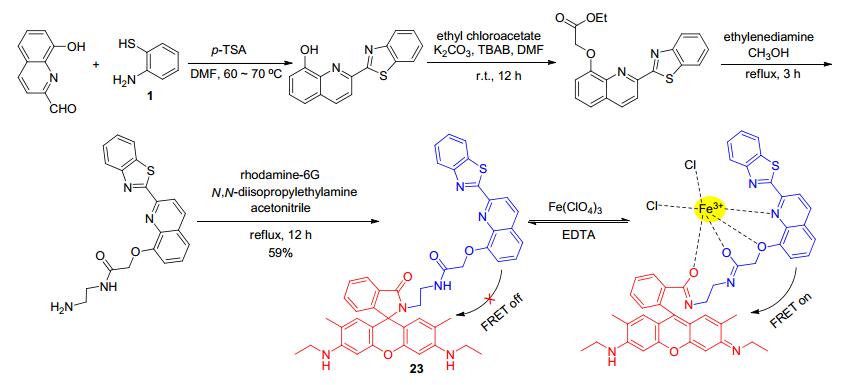
在检测Fe3+时, 能够排除Fe2+的干扰是很有意义的. Das等[39]基于荧光共振能量转移(FRET)原理设计合成了比率型探针分子23 (Scheme 10).其中, 苯并噻唑基喹啉作为能量供体, 通过合适长度(1×10-9~10× 10-9 m)的桥联基团与能量受体基团罗丹明-6G结合.区别于包括Fe2+在内的其它生物、环境上常见的金属离子, 探针23仅在加入Fe3+后发生荧光光谱的变化, 颜色由蓝色转变为黄绿色, 可见光下则是由无色变为橘黄色, 故该探针能够选择性地可视化识别Fe3+.
1.4 检测锌离子
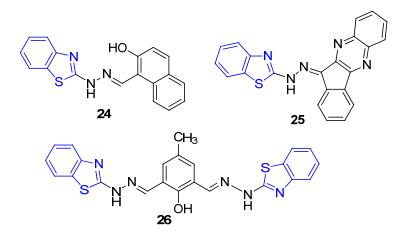
苯并噻唑基荧光探针也可以检测Zn2+, 并且也是基于配位作用[40], 特别是利用多个N原子配位作用所产生的CHEF效应, 这方面Das等[41~43]做了系列工作, 合成了“turn on”型Zn2+荧光探针24~26 (图 1).无一例外的是, 由于分子中C=N容易异构化, 使这些探针有光致电子转移(PET)效应产生, 导致其荧光微弱, 但在其与Zn2+配位形成配合物后, C=N的异构化过程被抑制, 分子结构被固定, 从而抑制了PET过程, 使荧光增强.不仅如此, 这些探针还显示出良好的选择性与纳摩尔浓度级别的检测限.
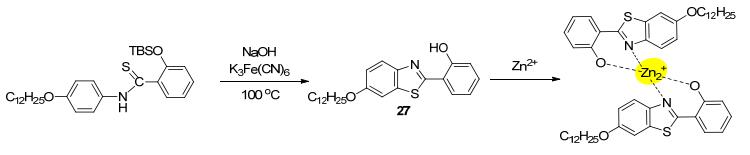
如果在功能化的苯并噻唑基团上引入长链结构, 其与Zn2+配位后可使探针分子具有自组装的能力, 有望根据聚集诱导发光(AIE)效应检测Zn2+, 如宋波等[44]设计合成了含长链烷氧链的HBT型探针分子27 (Scheme 11).通过动态光散射研究与原子力显微镜观察, 发现探针27本身在乙醇中不会发生聚集, 但Zn2+加入后, 形成的配合物分子发生自组装而聚集, 365 nm光照下荧光强度明显增加, 而其它+2价金属离子(Pb2+, Co2+, Ni2+等)无此AIE效应, 故27可高选择性地检测Zn2+.
1.5 检测其它金属阳离子
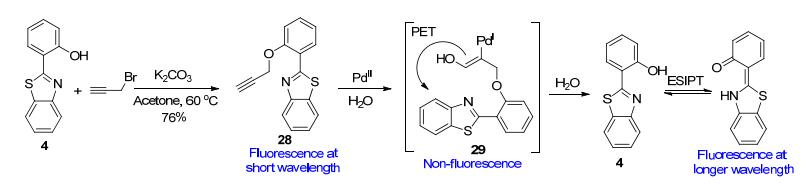
除了应用于上述的几种常见金属离子的检测外, 还有一些文献报道了苯并噻唑基探针用于钯、铅等其它重金属离子的检测[40].例如, Kumar等[45]把HBT分子4炔丙基化, 构建了基于Pd2+与炔烃发生加成反应的反应型苯并噻唑基荧光探针28 (Scheme 12).在探针28的4-羟乙基哌嗪乙磺酸(HEPES)缓冲溶液中, 随着氯化钯的逐渐加入, 原本在372 nm处的荧光发射峰逐渐减弱, 至最终消失.这一过程, 正是探针28与二价钯发生加成反应, 生成可诱发PET效应的烯烃中间体29的过程.但是, 经过一段时间后, 水解作用的去炔丙基化, 使中间体29回到HBT分子4的形态, 触发ESIPT机制, 从而在472 nm处形成新的发射峰, 呈现出肉眼可见的蓝色荧光.
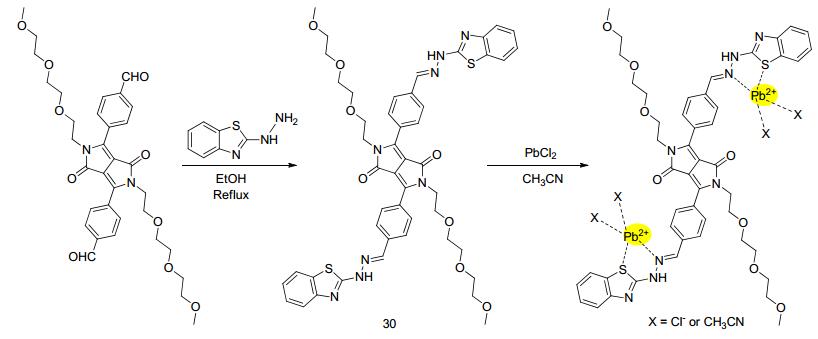
铅作为一种毒性较大的重金属, 对环境和生命体的破坏最严重.因此, 杨晓凤课题组[46]充分利用苯并噻唑基团可同时作为配体和荧光团的双重特点, 设计合成了“turn on”型探针30 (Scheme 13), 其与Pb2+以1:2配位后, 在585 nm处的橙黄色荧光显著增强, 对Pb2+的检测限可达2.3×10-10 mol•L-1.值得注意的是, 探针30具有良好的细胞通透性, 使其被成功应用于活细胞内Pb2+的检测.
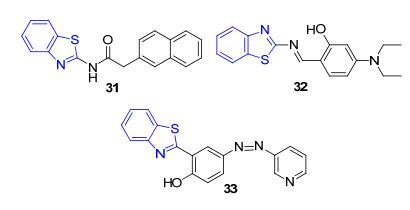
同样地, 在用于检测Ag+, Al3+, Ni2+等金属离子的苯并噻唑基探针31[47], 32[48], 33[49](图 2)中, 苯并噻唑基团的引入不仅使共轭结构得以延长, 荧光性能增强, 还为探针提供了S和N这两种常见的配位原子作为配位点, 使探针能够与不同的金属离子发生配位作用, 从而改变荧光信号, 达到检测金属离子的目的.
2 应用于阴离子的检测
2.1 检测氟离子
氟是人体内必不可少的微量元素之一, 可以防止牙齿疾病以及骨质疏松症[50].但是, 过量的氟离子会引起人体的氟中毒、尿石病, 甚至是癌症[51].因此, 设计并合成应用于检测氟离子的探针意义重大.鉴于苯并噻唑发色团良好的荧光性能[52], 不少含有苯并噻唑基团的氟离子荧光探针也相继被合成, 其中包括反应型探针[53]和氢键型探针[54]
苯并噻唑基氢键型探针更为常见, 其中酚羟基上的活泼氢是常见的F-结合位点[52].例如, Kocyigit等[55]构建的探针34 (Eq. 4), 其可与F-作用形成氢键, 并逐渐发生去质子化, 使氧原子上的电荷密度增加, 促进了ICT效应.此时, 最大发射峰逐渐增强并红移至598 nm处, 呈现肉眼可见的粉色荧光.值得注意的是, 交替加入F-与Ca2+, 还可实现对F-的可逆循环检测.
利用杂环化合物中N—H作为F-的结合位点, 是设计氟离子荧光探针的常见手段[56, 57], 当然也在苯并噻唑基的荧光探针中有所体现.例如, Razi等[58]合成的ICT型荧光探针8, 亦可用于检测F-, 且检测限达到5.1× 10-8mol•L-1.随着F-的加入, 探针8原本位于495 nm处的强蓝绿色荧光显著猝灭, 位于608 nm处的暗橙红色荧光产生.这是由于咪唑基团上的N—H与F-形成氢键并逐渐发生去质子化, 使得原本从电子供体咪唑基团到电子受体苯并噻唑基团的ICT效应进一步增强(Eq. 5).值得一提的是, CO2的加入使得8与F-的溶液恢复到原来的蓝绿色荧光, 这也令探针8具备检测CO2的性能.
含有苯并噻唑基的反应型F-探针, 较常见的是基于硅氧键的断裂[59].例如, Goswami等[60]将HBT型化合物15与叔丁基二甲基氯硅烷(TBDMS-Cl)反应, 将羟基保护起来, 制备了探针分子35 (Scheme 14).由于TBDMS基团的保护作用, ESIPT过程被抑制, 35在CH3CN-HEPES混合体系中只有微弱的荧光.当F-加入后, 去保护作用再生成化合物15, 使ESIPT过程恢复, 探针35原本在407 nm处的最大荧光发射峰红移至477 nm, 荧光量子产率提高至原来的55倍.
2.2 检测其它阴离子
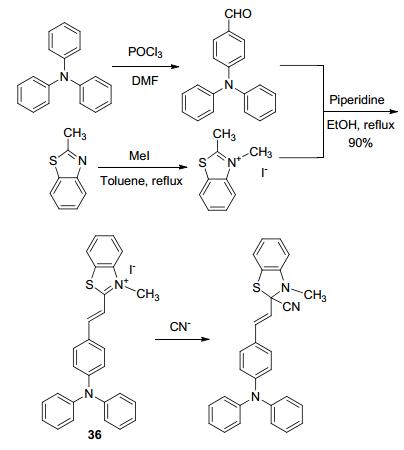
氰化物是一类剧毒的物质, 对环境和生命体有巨大的危害[47].因此, CN-的检测也一直受到关注.其中, 常见的检测原理是利用CN-与探针结构中的双键加成生成引起光谱变化的新化合物[61].例如, Goswami等[62]合成了探针36 (Scheme 15), CN-可与其发生亲核加成反应, 使电子的大离域现象被中断, 导致吸收光谱的变化和溶液颜色的改变.探针36对AcO-, F-, Cl-等其它阴离子无响应, 具有良好的选择性.
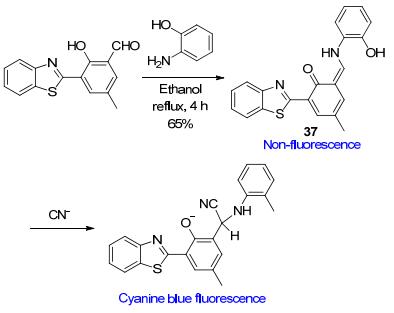
汤立军等[63]设计合成了CN-探针37 (Scheme 16), 其结构中含有可与CN-作用的碳碳双键反应位点.探针37原本几乎没有荧光, 但当60 equiv.的CN-加入到其二甲亚砜(DMSO)-H2O溶液中时, 加成反应使大共轭结构被破坏, 位于487 nm处的荧光显著增强, 溶液颜色变为青蓝色.探针37对CN-的检测限为3.94×10-7 mol•L-1, 并且可用于CN-的试纸检测.
ClO-是也一种常见的阴离子, 因其高浓度情况下对人体造成的刺激与危害, 设计用于检测ClO-的荧光探针具有重要意义.因此, 赵宝祥等[64]合成了苯并噻唑基肼修饰的罗丹明类探针38 (Eq. 6).在38的MeCN-H2O溶液中滴加ClO-后, 在575 nm处荧光光谱有最大发射峰产生并逐渐增强, 裸眼可观察到由无色到红色的荧光颜色变化, 对ClO-的检测限为1.06×10-9 mol•L-1.
3 应用于含硫化合物的检测
3.1 检测二氧化硫与亚硫酸盐
二氧化硫是大气污染物之一, 人体内摄入过量的二氧化硫会导致低血压、腹泻等急性症状[65].由于SO2在水中溶解后可形成H2SO3, 因此多数SO2荧光探针都是把被测物SO2看作SO32-或HSO3-来设计合成的.科研工作者经常利用SO32-或HSO3-能够与活性双键发生加成反应的特点来构建二氧化硫与亚硫酸盐荧光探针[66].
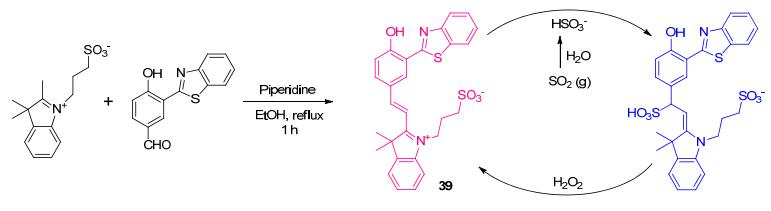
王素华课题组[67]设计合成了基于1, 4-加成反应的比率型SO2荧光探针39, 其结构中同时含有花菁基团与HBT结构(Scheme 17).对比研究表明, HBT结构中苯并噻唑基团不仅提升了39的荧光量子产率, 还使发射光谱带红移, 并呈现出了第二个发射光谱带.在39的PBS缓冲液中加入HSO3-后, 位于590 nm处的发射峰减弱, 同时位于450 nm处的发射峰增强, 紫外灯下荧光颜色由玫瑰红变为蓝色.这一荧光变化的现象归因于HSO3-与花菁基团中的不饱和键所发生的1, 4-加成反应破坏了花菁染料共轭结构.不仅如此, 生成的1, 4-加成产物在随后H2O2的作用下可被氧化回到原来的探针39, 使39具有可逆的氧化还原活性, 能实现HSO3-的循环检测.由于SO2与HSO3-能够在水溶液中迅速达到平衡, 将溶解了SO2的乙醇加进39的PBS缓冲液中, 也可得到与检测HSO3-时相似变化的荧光光谱, 即探针39可应用于气态SO2的检测.
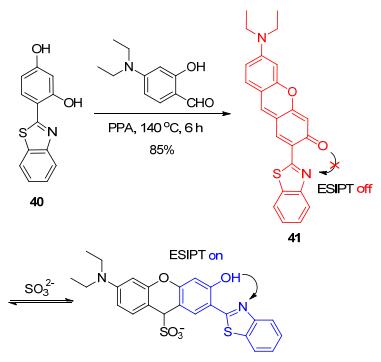
类似地, 杨小峰课题组[68]以HBT型化合物40为原料, 合成了含有活性C=C双键的比率型SO32-荧光探针41 (Scheme 18).探针41本身在578 nm处有最大的发射峰, 但仅在加入亚硫酸盐后, 荧光光谱蓝移125 nm, 在453 nm处产生新的发射峰, 荧光变为蓝色.这是因为SO32-与探针41的加成反应激活了HBT结构的ESIPT效应, 产生了HBT结构的特征荧光.这种明显的荧光颜色变化还可在人的肝星状细胞内观察到, 因此探针41能实现活细胞内SO32-的检测.
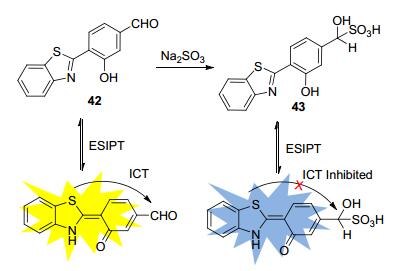
C=O是常见的亲核加成反应官能团, 也可籍此设计出SO2荧光探针.例如, 宋相志课题组[69]将醛基引入HBT型化合物中, 合成了探针42.由于醛基的吸电子作用, 探针42自身具有ICT效应.但当其缓冲溶液中加入SO32-后, 对醛基的加成反应生成了化合物43, ICT效应被抑制, 仅存在ESIPT过程, 故荧光发射峰蓝移, 荧光颜色在几秒钟内由黄色变为蓝色(Scheme 19), 探针42可实现比率型快速检测SO32-.
3.2 硫化氢与硫酚
硫化氢是剧毒物质, 且越来越多的证据显示阿尔茨海默病、糖尿病、肝硬化等严重疾病的产生与人体内非正常的H2S浓度密切相关[70].因此, 用于检测H2S的苯并噻唑基探针逐渐成为人们关注的焦点[71].其中, 不少探针都是基于HS-还原叠氮基团的反应机理设计的[72].
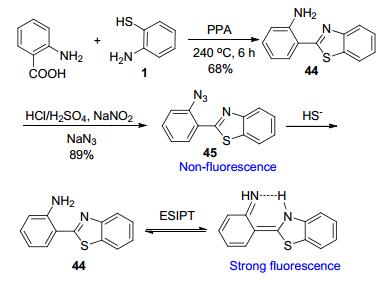
郭炜课题组[73]首先合成了类似HBT的前体化合物44, 然后再经过Sandmeyer反应引入叠氮基团, 得到几乎没有荧光的探针45 (Scheme 20).当往45的PBS溶液中滴加NaHS(通常用作H2S供体)时, 450 nm处产生最大发射峰, 并且其强度随着NaHS浓度增加而增加, 最终达到原来强度的1150倍, 荧光量子产率由0.0064提升至0.41.这是由于探针结构中的叠氮基团被HS-还原为氨基, 生成了化合物44, 激活了ESIPT机制, 使荧光增强.不仅如此, 探针45仅对H2S产生荧光增强的信号, 且检测限达到了7.8×10-8 mol•L-1, 故H2S探针45具有很高的选择性和灵敏度.
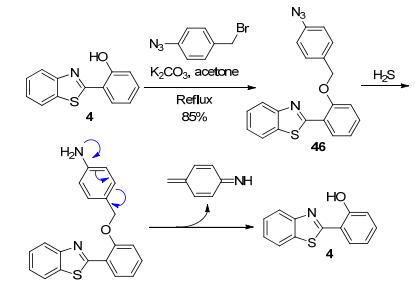
同样地, 常希俊等[74]基于HBT型化合物4构建了比率型H2S探针分子46 (Scheme 21). 46的PBS溶液在370 nm处有最大的荧光发射峰, 但与H2S作用后, 探针46中的叠氮基团被还原为氨基, 随后发生分子内
1, 6-消除, 使氨基苄基离去, 进而释放出HBT结构, 导致原来370 nm处的发射峰强度降低, 并伴随着465 nm处新发射峰的产生, 两处的峰值比随H2S的浓度呈现良好的线性关系.除此之外, 探针46还能适应较宽pH值范围的检测环境, 也具有较低的细胞毒性, 能成功实现活细胞内对H2S的检测.最近, 汤立军等[75]也基于该机理设计合成了此类H2S探针.
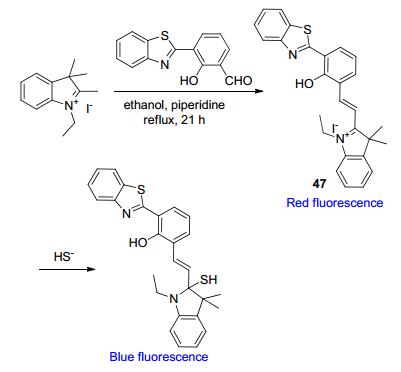
HS-还可与探针中的双键发生亲核加成反应, 据此原理设计的苯并噻唑基荧光探针也有报道[76].例如, Goswami等[77]将苯并噻唑荧光团与含有活性C=N双键的花菁基团相连, 合成了比率型H2S荧光探针47 (Scheme 22).该探针与H2S反应后, 裸眼可见其CH3CN-H2O溶液由粉色变为黄色.与此同时, 其荧光光谱位于585 nm处的最大发射峰蓝移至440 nm处, 且强度增加为原来的104倍, 原因是HS-与47发生亲核加成后, π共轭结构消失, 探针自身存在的ICT效应被终止.另外, 探针47对H2S的检测具有较高选择性, 其它阴离子或亲核试剂(F-, HSO3-, NH3, NH2OH等)均对47无响应.
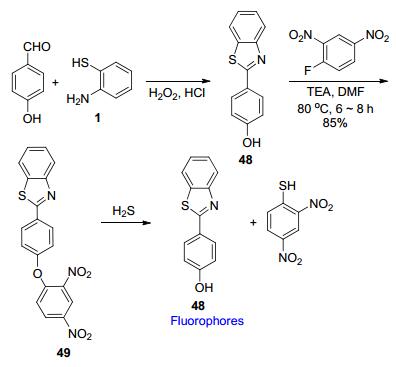
不仅可以利用亲核加成反应构建荧光探针, 也可以利用HS-, RS-等与探针分子发生亲核取代反应时释放出荧光团的性质来构建苯并噻唑基荧光探针[78].例如, 刘毅等[79]以苯并噻唑基苯酚48为荧光团, 与2, 4-二硝基氟苯反应构建醚键而引入亲核反应位点, 制备了荧光探针49 (Scheme 23).该探针对H2S不仅具有出色的选择性, 而且还能实现在活体细胞与组织内成像检测.
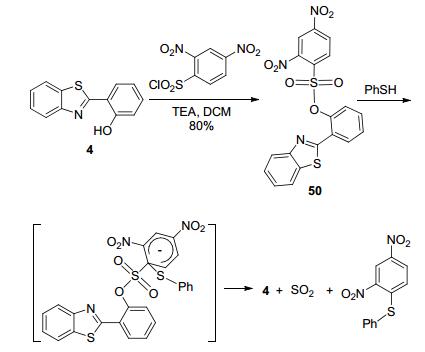
类似的, RS-的亲核取代作用机理还常见于硫酚探针设计中[80].例如, 山东大学李敏勇等[81]在HBT结构上引入2, 4-二硝基苯磺酰基(DNs), 制备了探针50 (Scheme 24).在50的DMF-PBS体系中加入苯硫酚后, 荧光光谱在450 nm处出现最大发射峰并逐渐增强.这是由于探针50与苯硫酚发生了亲核取代反应, 释放了HBT荧光团所致.
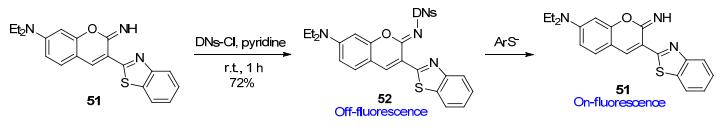
在国外, Talukdar等[82]以亚氨基香豆素和苯并噻唑相连构建荧光团51, 在此基础上引入吸电子的DNs作为反应位点, 设计了荧光探针52.当PhS-亲核进攻52时, 其与DNs基团作用后释放出荧光团结构51 (Scheme 25), 而硫醇则无“off-on”荧光响应, 故探针52可实现对硫酚的专一检测.与不含苯并噻唑基的类似探针相比, 苯并噻唑基团的引入有利于荧光团具有更强的荧光强度和更长的荧光波长.
3.3 检测生物巯基化合物
苯并噻唑类分子作为探针应用于生物分子的检测也有报道[83~85].其中, 由于半胱氨酸(Cys)、谷胱甘肽(GSH)等生物巯基化合物在生化途径中扮演着重要的角色, 故对其体内检测很受关注[86], 并且通常是基于上述的RS-亲核取代检测机理设计的苯并噻唑基探针[87].
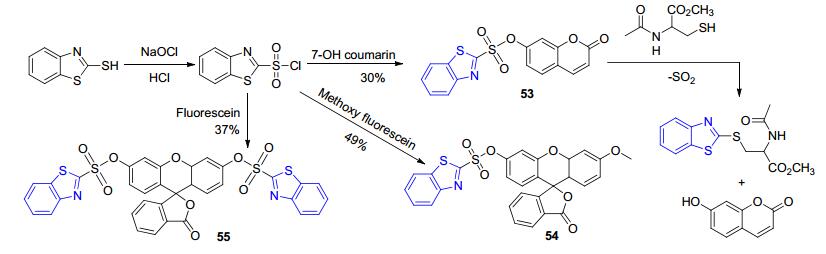
例如, 叶勇课题组[88]设计合成了系列苯并噻唑基荧光探针53~55 (Scheme 26).其中, 具有两个反应中心的探针55与Cys类化合物作用时产生的荧光最强.但是, 与前面的“off-on”探针不同的是, 这些化合物中苯并噻唑基团的作用是充当了生物巯基化合物的载体.
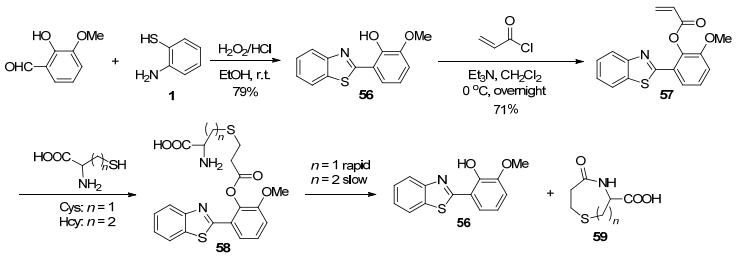
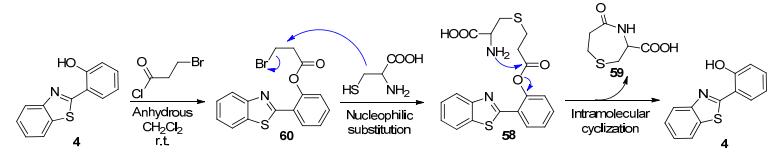
将酚羟基形成的酯键作为反应位点, 是构建生物分子探针的重要方法之一[89, 90].例如, 杨小峰课题组[91]基于HBT结构化合物56设计合成了丙烯酸酯类探针57, 当其遇到Cys、同型半胱氨酸(Hcy)等含巯基的氨基酸时, 先发生加成反应生成化合物58, 接着58中的氨基进行分子内的环合反应生成了化合物59, 同时释放出56而启动了ESIPT效应, 使58在377 nm处特征荧光红移至487 nm处(Scheme 27).由于Cys, Hcy生成的内酰胺59的结构与动力学过程不同, 使二者的荧光变化过程有明显的速度差异, 故57可同时高效地鉴别Cys和Hcy.Churchill等[92]利用类似的检测机理, 以不同的合成路线, 也构建了Cys荧光探针60 (Scheme 28).
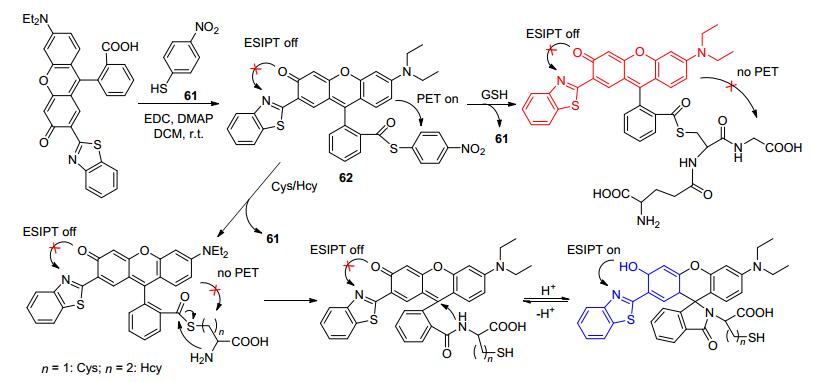
利用Cys (Hcy)这种含巯基的氨基酸特殊的胺解作用, 也可构建能用于选择性区别GSH与Cys (Hcy)的苯并噻唑基荧光探针.例如, 杨小峰等[93]基于罗丹明类结构合成了荧光探针62 (Scheme 29), 其与GSH, Cys, Hcy均能发生交换反应, 对硝基硫酚61离去后, PET抑制效应被解除.对GSH检测时, 在587 nm处有荧光最大发射峰.但是, 对Cys, Hcy检测时由于分子内胺解、环化反应的发生而启动了ESIPT效应, 最大发射峰红移至454 nm处.这两种明显不同的荧光响应令62能有效地鉴别GSH与Cys(包括Hcy).
4 应用于其它物种的检测
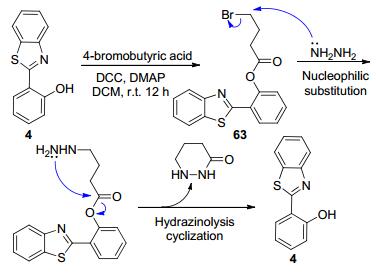
除上述的各种应用外, 苯并噻唑基荧光探针还可以检测其它物种[36].例如, Goswami等[94]设计合成了用于检测肼类化合物的苯并噻唑基荧光探针63, 其检测机理也是基于亲核取代启动的分子内环化与消去反应, 最终导致HBT荧光团释放而产生比率型荧光变化(Scheme 30).
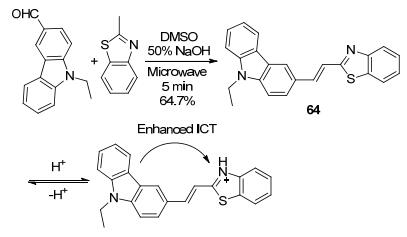
利用苯并噻唑基荧光探针检测pH的报道也相对较多[95].其中, 这些探针通常具有比苯并噻唑更大的共轭结构[96].利用2-甲基苯并噻唑与芳香醛的缩合反应, 是延长π共轭结构获得更大的共轭体系的方法之一[97], 如比率型pH荧光探针64的合成(Scheme 31)[98].随着乙腈/水(V:V=1:1) 体系pH值从7到1逐渐减小, 64的最大荧光发射峰从496 nm处红移至583 nm, 荧光颜色由蓝色变为橙色.在该过程中, 苯并噻唑基团上的N原子发生了质子化, 导致从咔唑基团到苯并噻唑基团的ICT效应增强, 由此产生荧光波长红移的现象.除此以外, 64还成功实现了大肠杆菌中pH成像, 证实了其在强酸性的微生态环境中可有效检测pH[98].
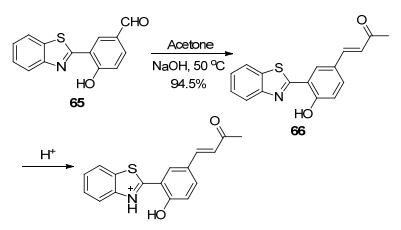
事实上, 苯并噻唑基团上的N原子作为质子化位点, 是大多数苯并噻唑基pH荧光探针的作用机理[99].王素华课题组[100]基于HBT结构化合物65与丙酮的缩合反应制备的探针66 (Scheme 32), 其在酸性环境下由于苯并噻唑上N的质子化作用, ICT效应增强, 荧光光谱中原本在中性环境下位于515 nm的最大发射波长红移至565 nm处, 且荧光量子产率也从0.063提高至0.25.
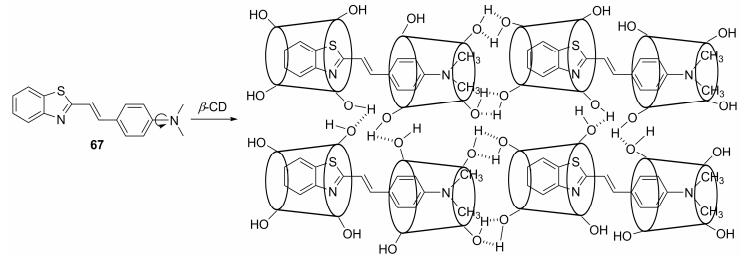
Saha等[101]对缩合反应得到的反-2-(4-二甲胺基苯乙烯基)苯并噻唑探针分子67 (Scheme 33)有较多的研究, 其可应用于多方面的检测.由于结构中存在可自由旋转的二甲胺基, 探针67自身的荧光较弱.但在其甲醇溶液中加入2.5 mmol•L-1的β-环糊精(β-CD)后, 荧光增强并达到最大值.这是因为β-CD与67的自组装作用形成了杆状的纳米管(Scheme 33), 从而阻止了二甲胺基的自由旋转[102].利用类似的原理, 探针67还可实现对DNA[103]和Brij表面活性剂[104]等的荧光检测.
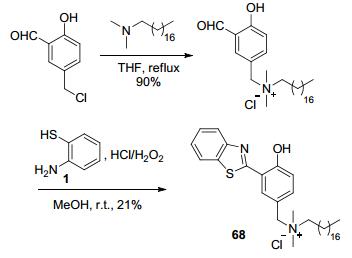
同样基于限制自由旋转的荧光增强机制, 唐本忠课题组[105]构建了亲水性的阳离子型探针68 (Scheme 34).作为结构改造后HBT型化合物, 68遇到阴离子表面活性剂十二烷基苯磺酸钠后, 通过协同的静电与疏水作用在水中形成阴阳离子聚集物, 聚集物内分子间堆积有效地限制了68分子内运动, 使被抑制的ESIPT机制得以恢复, 产生AIE效应, 故荧光光谱在510 nm处产生最大发射峰, 荧光量子产率从0.002提高至0.5.
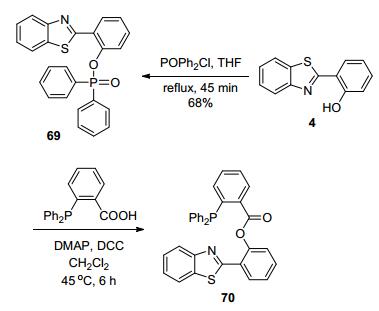
对HBT型化合物进行结构修饰, 也可合成检测其它物种的荧光探针.例如, 基于HBT型化合物4, 通过引入含磷基团, 还可以构建用于检测超氧化物[106]、硝酰基化合物[107]等的苯并噻唑基荧光探针, 如化合物69和70 (Scheme 35), 它们的荧光检测机制都是经过反应最终释放出HBT荧光团.
5 结束语
由于荧光探针发展迅速, 针对不同检测对象的探针每年大量涌现[108], 苯并噻唑基荧光探针也渗透到了金属阳离子、阴离子、含硫化合物、生物分子等检测的领域.这归结于苯并噻唑类化合物以下几个特点: (1) 合成简便、原料易得; (2) 具有大共轭体系, 荧光性能突出, 常被视为荧光团引入探针结构; (3) 结构中含杂原子, 能提供与被测物结合的作用位点; (4) 细胞毒性小, 能够广泛应用于活细胞内检测.总之, 苯并噻唑基荧光探针顺应了当今荧光探针绿色合成、性能优良、适用范围广的发展趋势, 应用前景十分广阔.
展望未来, 尽管目前在生物医学和生命科学等前沿学科的研究领域已有一些具有较好检测效果的苯并噻唑基荧光探针被设计、合成出来[109~111], 但在公共安全与环境保护等层面, 针对三硝基苯酚(PA)、三硝基甲苯(TNT)等硝基芳香爆炸物的荧光检测[112], 目前仍鲜有苯并噻唑基荧光探针的报道[36].同时, 对多种金属离子同时检测的报道也不多[11, 20, 34, 40].因此, 把握苯并噻唑的结构特点与优势, 进一步指导设计、合成应用于更多不同检测对象荧光探针, 特别是能够进行同时检测, 仍是极富挑战但有章可循的研究工作.
-
-
[1]
Rouf, A.; Tanyeli, C. Eur. J. Med. Chem. 2015, 97, 911. doi: 10.1016/j.ejmech.2014.10.058
-
[2]
Adzal, O.; Akhtar, M. S.; Kumar, S.; Ali, M. R.; Jaggi, M.; Bawa, S. Eur. J. Med. Chem. 2016, 121, 318. doi: 10.1016/j.ejmech.2016.05.038
-
[3]
Kamal, A.; Syed, M. A. H.; Mohammed, S. M. Expert Opin. Ther. Pat. 2015, 25, 335. doi: 10.1517/13543776.2014.999764
-
[4]
Zhao, L. X.; Wang, X. Y.; Li, X. D.; Zhang, W. J.; Liu, X. H.; Zhu, Y. J.; Wang, H.-Q.; Fang, J. F. Sol. Energy Mater. Sol. Cells 2016, 157, 79. doi: 10.1016/j.solmat.2016.05.026
-
[5]
Abou-Zied, O. K. RSC Adv. 2013, 3, 8747. doi: 10.1039/c3ra40907d
-
[6]
Goswami, S.; Das, A. K.; Aich, K.; Manna, A. Tetrahedron Lett. 2013, 54, 4215. doi: 10.1016/j.tetlet.2013.05.119
-
[7]
Guan, L.; Li, A. Y.; Song, Y. Y.; Yan, M. Q.; Gao, D. F.; Zhang, X. H.; Li, B.; Wang, L. Y. J. Org. Chem. 2016, 81, 6303. doi: 10.1021/acs.joc.6b00928
-
[8]
Kartha, K. K.; Sandeep, A.; Prave Liu, D.; Ren, H. C.; Deng, L. J.; Zhang, T. ACS Appl. Mater. Interfaces 2013, 5, 4937. doi: 10.1021/am400672y
-
[9]
Carrington, S. J.; Chakraborty, I.; Bernard, J. M. L.; Mascharak, P. K. Inorg. Chem. 2016, 55, 7852. doi: 10.1021/acs.inorgchem.6b00511
-
[10]
Aich, K.; Goswami, S.; Das, S.; Mukhopadhyay, C. D.; Quah, C. K.; Fun, H.-K. Inorg. Chem. 2015, 54, 7309. doi: 10.1021/acs.inorgchem.5b00784
-
[11]
侯淑华, 曲忠国, 钟克利, 边延江, 汤立军, 有机化学, 2016, 36, 768. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345444.shtmlHou, S. H.; Qu, Z. G.; Zhong, K. L.; Bian, Y. J.; Tang, L. J. Chin. J. Org. Chem. 2016, 36, 768(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345444.shtml
-
[12]
Lee, J. H.; Lee, J. H.; Kim, S. K.; Jung, J. H. Supramol. Chem. 2015, 27, 690. doi: 10.1080/10610278.2015.1075537
-
[13]
Maity, S. B.; Bharadwaj, P. K. J. Lumin. 2015, 161, 76. doi: 10.1016/j.jlumin.2014.12.064
-
[14]
Ju, H.; Chang, D. J.; Kim, S.; Ryu, H.; Lee, E.; Park, I.-H.; Jung, J.H.; Ikeda, M.; Habata, Y.; Lee, S. S. Inorg. Chem. 2016, 55, 7448. doi: 10.1021/acs.inorgchem.6b00690
-
[15]
Sahana, S.; Mishra, G.; Sivakumar, S.; Bharadwaj, P. K. Dalton Trans. 2015, 44, 20139. doi: 10.1039/C5DT03719K
-
[16]
Bae, J.-S.; Gwon, S.-Y.; Son, Y.-A.; Kim, S.-H. Dyes Pigm. 2009, 83, 324. doi: 10.1016/j.dyepig.2009.05.010
-
[17]
Singh, A.; Singh, A.; Singh, N.; Jang, D. O. Tetrahedron 2016, 72, 3535. doi: 10.1016/j.tet.2016.04.082
-
[18]
Erdemir, S.; Malkondu, S.; Alici, O. Color. Technol. 2015, 131, 32. doi: 10.1111/cote.2015.131.issue-1
-
[19]
Mei, Q. B.; Tian, R. Q.; Shi, Y. J.; Hua, Q. F.; Chen, C.; Tong, B. H. New J. Chem. 2016, 40, 2333. doi: 10.1039/C5NJ02259B
-
[20]
Razi, S. S.; Ali, R.; Gupta, R. C.; Dwivedi, S. K.; Shama, G.; Koch, B.; Misra, A. J. Photochem. Photobiol. A 2016, 324, 106. doi: 10.1016/j.jphotochem.2016.03.015
-
[21]
Gu, B.; Huang, L. Y.; Su, W.; Duan, X. L.; Li, H. T.; Yao, S. Z. Anal. Chim. Acta 2017, 954, 97. doi: 10.1016/j.aca.2016.11.044
-
[22]
Zhang, D.; Liu, J. H.; Yin, H. Y.; Wang, H. Q.; Li, S. F.; Wang, M.; Li, M.; Zhou, L.; Zhang, J. F. J. Fluoresc. 2016, 26, 1367. doi: 10.1007/s10895-016-1826-z
-
[23]
Santra, M.; Roy, B.; Ahn, K. H. Org. Lett. 2011, 13, 3422. doi: 10.1021/ol2011693
-
[24]
Luo, W. F.; Jiang, H. E.; Zhang, K. M.; Liu, W.; Tang, X. L.; Dou, W.; Ju, Z. H.; Li, Z. Q.; Liu, W. S. J. Mater. Chem. B 2015, 3, 3459. doi: 10.1039/C5TB00203F
-
[25]
Song, K. C.; Kim, J. S.; Park, S. M.; Chuang, K.-C.; Ahn, S.; Chang, S.-K. Org. Lett. 2006, 8, 3413. doi: 10.1021/ol060788b
-
[26]
Wang, K. N.; Feng W. J.; Wang, Y. B.; Cao, D. X.; Guan, R. F.; Yu, X. Y.; Wu, Q. Q. Inorg. Chem. Commun. 2016, 71, 102. doi: 10.1016/j.inoche.2016.07.013
-
[27]
Ghosh, K.; Kar, D. J. Inclusion Phenom. Macrocyclic Chem. 2013, 77, 67. doi: 10.1007/s10847-012-0217-6
-
[28]
Erdemir, S.; Tavakci, B.; Tabakci, M. Sens. Actuators, B 2016, 228, 109. doi: 10.1016/j.snb.2016.01.017
-
[29]
Tang, L. J.; He, P.; Zhong, K. L.; Hou, S. H.; Bian, Y. J. Spectrochim. Acta, Part A 2016, 169, 246. doi: 10.1016/j.saa.2016.06.045
-
[30]
Fan, C. L.; Luo, S. X.; Liu, R. RSC Adv. 2015, 5, 65321. doi: 10.1039/C5RA11212E
-
[31]
Wen, H.; Huang, Q.; Yang, X.-F.; Li, H. Chem. Commun. 2013, 49, 4956. doi: 10.1039/c3cc41343h
-
[32]
Santana, D. M.; Garcia-Bueno, R.; Garcia, G.; Piernas, M. J.; Perez, J.; Garcia, L.; Lopez-Garcia, I. Polyhedron 2013, 61, 161. doi: 10.1016/j.poly.2013.05.047
-
[33]
Xu, Z. C.; Xiao, Y.; Qian, X. H.; Cui, J. N.; Cui, D. W. Org. Lett. 2005, 7, 889. doi: 10.1021/ol0473445
-
[34]
Wagh, Y. B.; Kuwar, A.; Sahoo, S. K.; Gallucci, J.; Dalal, D. S. RSC Adv. 2015, 5, 45528. doi: 10.1039/C5RA03146J
-
[35]
Qi, J. J.; Han, M. S.; Tung, C.-H. Bioorg. Med. Chem. Lett. 2012, 22, 1747. doi: 10.1016/j.bmcl.2011.12.140
-
[36]
Arockiam, J. B.; Ayyanar, S. Sens. Actuators, B 2017, 242, 535. doi: 10.1016/j.snb.2016.11.086
-
[37]
Erdemir, S.; Ozcan, K. Talanta 2016, 158, 63. doi: 10.1016/j.talanta.2016.05.017
-
[38]
Liu, S.-D.; Zhang, L.-W.; Liu, X. New J. Chem. 2013, 37, 821. doi: 10.1039/c2nj40978j
-
[39]
Das, S.; Aich, K.; Goswami, S.; Quah, C. K.; Fun, H.-K. New J. Chem. 2016, 40, 6414. doi: 10.1039/C5NJ03598H
-
[40]
Nas, A.; Dilber, G.; Durmus, M.; Kantekin, H. Spectrochim. Acta, Part A 2015, 135, 55. doi: 10.1016/j.saa.2014.06.135
-
[41]
Gogoi, A.; Samanta, S.; Das, G. Sens. Actuators, B 2014, 202, 788. doi: 10.1016/j.snb.2014.06.012
-
[42]
Gogoi, A.; Das, G. RSC Adv. 2014, 4, 55689. doi: 10.1039/C4RA10556G
-
[43]
Gogoi, A.; Mukherjee, S.; Ramesh, A.; Das, G. RSC Adv. 2015, 5, 63634. doi: 10.1039/C5RA09150K
-
[44]
Jin, Y. Z.; Wang, S.; Zhang, Y. J.; Song, B. Sens. Actuators, B 2016, 225, 167. doi: 10.1016/j.snb.2015.11.039
-
[45]
Kumar, M.; Kumar, N.; Bhalla, V. RSC Adv. 2013, 3, 1097. doi: 10.1039/C2RA22869F
-
[46]
Yang, X. F.; Zhang, Y.; Li, Y. X.; Liu, X. L.; Mao, J. X.; Yuan, Y.; Cui, Y.; Sun, G. X.; Zhang, G. Y. RSC Adv. 2016, 6, 52004. doi: 10.1039/C6RA07378F
-
[47]
Zhang, X. Y.; Chen, S. S.; Jin, S. H.; Lu, X. X.; Li, L. J.; Chen, X.; Shu, Q. H. Sens. Actuators, B 2016, 237, 367. doi: 10.1016/j.snb.2016.06.115
-
[48]
Patil, R.; Moirangthem, A.; Butcher, R.; Singh, N.; Basu, A.; Tayade, K.; Fegade, U.; Hundiwale, D.; Kuwar, A. Dalton Trans. 2014, 43, 2895. doi: 10.1039/C3DT52770K
-
[49]
Dhaka, G.; Kaur, N.; Singh, J. Supramol. Chem. 2015, 27, 654. doi: 10.1080/10610278.2015.1068314
-
[50]
张惠敏, 吴彦城, 尤佳宜, 曹梁, 丁沙, 蒋凯, 汪朝阳, 有机化学, 2016, 36, 2559. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345638.shtmlZhang, H. M.; Wu, Y. C.; You, J. Y.; Cao, L.; Ding, S.; Jiang, K.; Wang, Z. Y. Chin. J. Org. Chem. 2016, 36, 2559(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345638.shtml
-
[51]
Liu, S. D.; Zhang, L. W.; Zhou, P. P.; Zan, W. Y.; Yao, X. J.; Yang, J. J.; Yang, Y. RSC Adv. 2015, 5, 19983. doi: 10.1039/C4RA13532F
-
[52]
Zhang, X.; Liu, J. Y. Dyes Pigm. 2016, 125, 80. doi: 10.1016/j.dyepig.2015.10.002
-
[53]
Shi, H. P.; Yang, J. W.; Dong, X. Q.; Fang, L.; Dong, C.; Choi, M. M F. Synth. Met. 2013, 179, 42. doi: 10.1016/j.synthmet.2013.07.013
-
[54]
Dhaka, G.; Singh, J.; Kaur, N. Inorg. Chim. Acta 2016, 450, 380. doi: 10.1016/j.ica.2016.06.032
-
[55]
Erdemir, S.; Kocyigit, O. Sens. Actuators, B 2015, 221, 900. doi: 10.1016/j.snb.2015.07.028
-
[56]
Wu, Y. C.; Huo, J. P.; Cao, L.; Ding, S.; Wang, L. Y.; Cao, D. R.; Wang, Z. Y. Sens. Actuators, B 2016, 237, 865. doi: 10.1016/j.snb.2016.07.028
-
[57]
Wu, Y. C.; You, J. Y.; Jiang, K.; Xie, J. C.; Li, S. L.; Cao, D. R.; Wang, Z. Y. Dyes Pigm. 2017, 140, 47. doi: 10.1016/j.dyepig.2017.01.025
-
[58]
Razi, S. S.; Gupta, R. C.; Ali, R.; Dwivedi, S. K.; Srivastava, P.; Misra, A. Sens. Actuators, B 2016, 236, 520. doi: 10.1016/j.snb.2016.06.016
-
[59]
Hu, W.; Zeng, L. Y.; Wang, Y. Y.; Liu, Z. H.; Ye, X. X.; Li, C. Y. Analyst 2016, 141, 5450. doi: 10.1039/C6AN00905K
-
[60]
Goswami, S.; Das, A. K.; Manna, A.; Maity, A. K.; Fun, H. K.; Quah, C. K.; Saha, P. Tetrahedron Lett. 2014, 55, 2633. doi: 10.1016/j.tetlet.2014.03.003
-
[61]
Vidya, B.; Iniya, M.; Sivaraman, G.; Sumesh, R. V.; Cheliappa, D. Sens. Actuators, B 2017, 242, 434. doi: 10.1016/j.snb.2016.11.076
-
[62]
Goswami, S.; Manna, A.; Paul, S.; Aich, K.; Das, A. K.; Chakraborty, S. Tetrahedron Lett. 2013, 54, 1785. doi: 10.1016/j.tetlet.2012.12.092
-
[63]
Tang, L. J.; Zou, Y. H.; Zhong, K. L.; Bian, Y. J. RSC Adv. 2016, 6, 48351. doi: 10.1039/C6RA07909A
-
[64]
Tang, Z.; Ding, X.-L.; Liu, Y.; Zhao, Z.-M.; Zhao, B.-X. RSC Adv. 2015, 5, 99664. doi: 10.1039/C5RA20188H
-
[65]
Chen, S.; Hou, P.; Wang, J. X.; Song, X. Z. RSC Adv. 2012, 2, 10869. doi: 10.1039/c2ra21471g
-
[66]
王姣亮, 龙立平, 谢丹, 应用化学, 2016, 33, 841. doi: 10.11944/j.issn.1000-0518.2016.07.150348Wang, J. L.; Long, L. P.; Xie, D. Chin. J. Appl. Chem. 2016, 33, 841(in Chinese). doi: 10.11944/j.issn.1000-0518.2016.07.150348
-
[67]
Zhang, Y. J.; Guan, L. M.; Yu, H.; Yan, Y. H.; Du, L. B.; Liu, Y.; Sun, M. T.; Huang, D. J.; Wang, S. H. Anal. Chem. 2016, 88, 4426. doi: 10.1021/acs.analchem.6b00061
-
[68]
Geng, L. H.; Yang, X. F.; Zhong, Y. G.; Li, Z.; Li, H. Dyes Pigm. 2015, 120, 213. doi: 10.1016/j.dyepig.2015.04.016
-
[69]
Liu, X. J.; Yang, Q. W.; Chen, W. Q.; Mo, L. N.; Chen, S.; Kang, J.; Song, X. Z. Org. Biomol. Chem. 2015, 13, 8663. doi: 10.1039/C5OB00765H
-
[70]
Zhang, H. T.; Xie, Y. S.; Wang, P.; Chen, G. C.; Liu, R. C.; Lam, Y. W.; Hu, Y.; Zhu, Q.; Sun, H. Y. Talanta 2015, 135, 149. doi: 10.1016/j.talanta.2014.12.044
-
[71]
范方禄, 靖金球, 陈雪梅, 有机化学, 2014, 34, 2178. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344480.shtmlFan, F. L.; Jing, J. Q.; Chen, X. M. Chin. J. Org. Chem. 2014, 34, 2178(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344480.shtml
-
[72]
Das, S. K.; Lim, C. S.; Yang, S. Y.; Han, J. H.; Cho, B. R. Chem. Commun. 2012, 48, 8395. doi: 10.1039/c2cc33909a
-
[73]
Zhang, J. Y.; Guo, W. Chem. Commun. 2014, 50, 4214. doi: 10.1039/C3CC49605H
-
[74]
Jiang, Y.; Wu, Q.; Chang, X.-J. Talanta 2014, 121, 122. doi: 10.1016/j.talanta.2014.01.001
-
[75]
何平, 汤立军, 钟克利, 侯淑华, 燕小梅, 有机化学, 2017, 37, 423. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345756.shtmlHe, P.; Tang, L. J.; Zhong, K. L.; Hou, S. H.; Yan, X. M. Chin. J. Org. Chem. 2017, 37, 423(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345756.shtml
-
[76]
Garcia-Beltran, O.; Santos, J. G.; Fuentealba, S.; De la Torre, P.; Pavez, P.; Mena, N.; Nunez, M. T.; Aliaga, M. E. Tetrahedron Lett. 2015, 56, 2437. doi: 10.1016/j.tetlet.2015.03.083
-
[77]
Paul, S.; Goswami, S.; Das Mukhopadhyay, C. New J. Chem. 2015, 39, 8940. doi: 10.1039/C5NJ01297J
-
[78]
Huang, Q.; Yang, X.-F.; Li, H. Dyes Pigm. 2013, 99, 871. doi: 10.1016/j.dyepig.2013.07.033
-
[79]
Liu, Y.; Ding, Y.; Huang, J.; Zhang, X. F.; Fang, T. Y.; Zhang, Y. Y.; Zheng, X.; Yang, X. Dyes Pigm. 2017, 138, 112. doi: 10.1016/j.dyepig.2016.11.038
-
[80]
Khandare, D. G.; Banerjee, M.; Gupta, R.; Kumar, N.; Ganguly, A.; Singh, D.; Chatterjee, A. RSC Adv. 2016, 6, 52790. doi: 10.1039/C6RA07046A
-
[81]
Sun, W.; Li, W.-H.; Li, J.; Zhang, J.; Du, L.-P.; Li, M. Y. Tetrahedron Lett. 2012, 53, 2332. doi: 10.1016/j.tetlet.2012.02.098
-
[82]
Kand, D.; Mandal, P. S.; Datar, A.; Talukdar, P. Dyes Pigm. 2014, 106, 25. doi: 10.1016/j.dyepig.2014.02.001
-
[83]
陈秀英, 郭琳, 郑昌戈, 高海燕, 安文, 应用化学, 2012, 29, 892. http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htmChen, X. Y.; Guo, L.; Zheng, C. G.; Gao, H. Y.; An, W. Chin. J. Appl. Chem. 2012, 29, 892(in Chinese). http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htm
-
[84]
Chen, S.; Li, H. M.; Hou, P. Tetrahedron 2017, 73, 589. doi: 10.1016/j.tet.2016.12.049
-
[85]
Rothweiler, U.; Stensen, W.; Brandsdal, B. O.; Isaksson, J.; Leeson, F. A.; Engh, R. A.; Svendsen, J. S. M. J. Med. Chem. 2016, 59, 9814. doi: 10.1021/acs.jmedchem.6b01086
-
[86]
Kovalska, V. B.; Losytskyy, M. Y.; Tolmachev, O. I.; Slominskii, Y. L.; Segers-Nolten, G. M. J.; Subramaniam, V.; Yarmoluk, S. M. J. Fluoresc. 2012, 22, 1441. doi: 10.1007/s10895-012-1081-x
-
[87]
Ren, X. T.; Wang, F.; Lv, J.; Wei, T. W.; Zhang, W.; Wang, Y.; Chen, X. Q. Dyes Pigm. 2016, 129, 156. doi: 10.1016/j.dyepig.2016.02.027
-
[88]
Zhang, D.; Chen, W.; Kang, J.-M.; Ye, Y.; Zhao, Y.-F.; Xian, M. Org. Biomol. Chem. 2014, 12, 6837. doi: 10.1039/C4OB01031K
-
[89]
Liu, Z. M.; Feng, L.; Ge, G. B.; Lv, X.; Hou, J.; Cao, Y. F.; Cui, J. N.; Yang, L. Biosens. Bioelectron. 2014, 57, 30. doi: 10.1016/j.bios.2014.01.049
-
[90]
Kim, T.; Kim, H.; Choi, Y.; Kim, Y. Chem. Commun. 2011, 47, 9825. doi: 10.1039/c1cc13819g
-
[91]
Yang, X. F.; Guo, Y. X.; Strongin, R. M. Angew. Chem., Int. Ed. 2011, 50, 10690. doi: 10.1002/anie.201103759
-
[92]
Kim, Y.; Choi, M.; Seo, S.; Manjare, S. T.; Jon, S.; Churchill, D. G. RSC Adv. 2014, 4, 64183. doi: 10.1039/C4RA12981D
-
[93]
Yang, X. F.; Huang, Q.; Zhong, Y. G.; Li, Z.; Li, H.; Lowry, M.; Escobedo, J. O.; Strongin, R. M. Chem. Sci. 2014, 5, 2177. doi: 10.1039/c4sc00308j
-
[94]
Goswami, S.; Das, S.; Aich, K.; Pakhira, B.; Panja, S.; Mukherjee, S. K.; Sarkart, S. Org. Lett. 2013, 15, 5412. doi: 10.1021/ol4026759
-
[95]
Patil, V. S.; Padalkar, V. S.; Tathe, A. B.; Sekar, N. Dyes Pigm. 2013, 98, 507. doi: 10.1016/j.dyepig.2013.03.019
-
[96]
Liu, Z. P.; Zhang, C. L.; He, W. J.; Qian, F.; Yang, X. L.; Gao, X.; Guo, Z. J. New J. Chem. 2010, 34, 656. doi: 10.1039/b9nj00703b
-
[97]
Zhan, Y.; Zhao, J. Y.; Yang, P.; Ye, W. J. RSC Adv. 2016, 6, 92144. doi: 10.1039/C6RA19791D
-
[98]
Chao, J. B.; Liu, Y. H.; Sun, J. Y.; Fan, L.; Zhang, Y. B.; Tong, H. B.; Li, Z. Q. Sens. Actuators, B 2015, 221, 427. doi: 10.1016/j.snb.2015.06.087
-
[99]
Liu, X. D.; Xu, Y.; Sun, R.; Xu, Y. J.; Lu, J. M.; Ge, J. F. Analyst 2013, 138, 6542. doi: 10.1039/c3an01033c
-
[100]
Sun, M. T.; Du, L. B.; Yu, H.; Zhang, K.; Liu, Y.; Wang, S. H. Talanta 2017, 162, 180. doi: 10.1016/j.talanta.2016.10.012
-
[101]
Muthusubramanian, S.; Saha, S. K. J. Lumin. 2012, 132, 2166. doi: 10.1016/j.jlumin.2012.03.053
-
[102]
Sowmiya, M.; Purkayastha, P.; Tiwari, A. K.; Jaffer, S. S.; Saha, S. K. J. Photochem. Photobiol., A 2009, 205, 186. doi: 10.1016/j.jphotochem.2009.05.002
-
[103]
Tokar, V. P.; Losytskyy, M. Y.; Ohulchanskyy, T. Y.; Kryvorotenko, D. V.; Kovalska, V. B.; Balanda, A. O.; Dmytruk, I. M.; Prokopets, V. M.; Yarmoluk, S. M. J. Fluoresc. 2010, 20, 865. doi: 10.1007/s10895-010-0630-4
-
[104]
Sowmiya, M.; Tiwari, A. K.; Saha, S. K. J. Colloid Interface Sci. 2010, 344, 97. doi: 10.1016/j.jcis.2009.12.021
-
[105]
Gao. M.; Wang, L. C.; Chen, J. J.; Li, S. W.; Lu, G. H.; Wang, L.; Wang, Y. J.; Ren, L.; Qin, A. J.; Tang, B. Z. Chem. Eur. J. 2016, 22, 5107. doi: 10.1002/chem.201505202
-
[106]
Murale, D. P.; Kim, H.; Choi, W. S.; Churchill, D. G. Org. Lett. 2013, 15, 3946. doi: 10.1021/ol4017222
-
[107]
Liu, C. Y.; Cao, Z. M.; Wang, Z. H.; Jia, P.; Liu, J.; Wang, Z. K.; Han, B. J.; Huang, X.; Li, X.; Zhu, B C. Sens. Actuators, B 2015, 220, 727. doi: 10.1016/j.snb.2015.06.013
-
[108]
吴彦城, 尤嘉宜, 关丽涛, 石杰, 曹梁, 汪朝阳, 有机化学, 2015, 35, 2465. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345201.shtmlWu, Y. C.; You, J. Y.; Guan, L. T.; Shi, J.; Cao, L.; Wang, Z. Y. Chin. J. Org. Chem. 2015, 35, 2465(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345201.shtml
-
[109]
Mora, A. K.; Murudkar, S.; Alamelu, A.; Singh, P. K.; Chattopadhyay, S.; Nath, S. Chem. Eur. J. 2016, 22, 16505. doi: 10.1002/chem.201602981
-
[110]
Rajasekhar, K.; Narayanaswamy, N.; Murugan, N. A.; Kuang, G. L.; Argen, H.; Govindaraju, T. Sci. Rep. 2016, 6, 23668. doi: 10.1038/srep23668
-
[111]
Liu, Q. S.; Zhang, C. L.; Wang, X. Q.; Gong, S. W.; He, W. J.; Liu, Z. P. Chem. Asian J. 2016, 11, 202. doi: 10.1002/asia.v11.2
-
[112]
曹梁, 吴彦城, 丁沙, 李铭冰, 谢芬, 马志晗, 汪朝阳, 有机化学, 2016, 36, 2053. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345567.shtmlCao, L.; Xiong, J. F.; Wu, Y. C.; Li, M. B.; Xie, F.; Ma, Z. H.; Wang, Z. Y. Chin. J. Org. Chem. 2016, 36, 2053(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345567.shtml
-
[1]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 47
- 文章访问数: 3946
- HTML全文浏览量: 1149



 下载:
下载:




































 下载:
下载:

