 图式 1
目标分子P1的合成路线
Scheme1.
Synthetic route of P1
图式 1
目标分子P1的合成路线
Scheme1.
Synthetic route of P1

Citation: Li Chuntao, Wang Mengmeng, Zhu Qian, Cao Qianyong. A New Methoxy Poly(ethylene glycol)-anchored Anthracene for Fluorescence Sensing of Hg2+and Subsequent of Cysteine in Pure Aqueous Solution[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1443-1449. doi: 10.6023/cjoc201612056

聚乙二醇单甲醚修饰蒽化合物纯水相荧光识别Hg2+及半胱氨酸
English
A New Methoxy Poly(ethylene glycol)-anchored Anthracene for Fluorescence Sensing of Hg2+and Subsequent of Cysteine in Pure Aqueous Solution
-
Key words:
- PEG
- / fluorescence
- / Cys recognition
- / anthracene
- / Hg2+
-
半胱氨酸(Cys)是人体中广泛存在的一种巯基氨基酸, 是蛋白质和酶的重要组成部分, 在生理过程中起着重要的作用[1~3]. Cys在人体中血浆中的含量, 能够间接地反映出人体的健康水平, 一些疾病如阿尔兹海默症、心血管疾病、神经管缺陷、炎性肠病、骨质疏松等与之含量息息相关[4~7].因此, 对Cys的快速灵敏检测与识别具有重要的意义.
目前为止, 测试Cys的方法主要为高效液相色谱、电化学、电感耦合等离子质谱[8~11].虽然这些仪器检测灵敏度高, 但是由于其仪器昂贵、操作复杂、测试繁琐等缺点, 限制了其进一步的应用发展.荧光化学传感器作为一种新型的传感方法, 因其方法简单、灵敏度高、高效及生物组织在线监测等优点, 成为近年来分析研究者的研究热点[12~17].
由于巯基氨基酸具有强的亲核性及与金属离子配位性特点, 一些基于金属配合物取代配位反应[18~20]、迈克尔加成反应[21, 22]、二硫键的断裂反应[23~25]及与醛的环化反应[24]的巯基氨基酸荧光化学传感器已经有相关文献报道.但这些传感器主要局限于有机物小分子, 聚合物分子荧光识别巯基氨基酸的例子还鲜有文献报道.相比于有机小分子, 聚合物分子常具有光信号放大效应、好的水溶性及易器件化等优点, 在实际应用中具有更广泛的前景[26~30].
两亲性高分子聚乙二醇(Polyethylene glycol, PEG)由于具有良好的水溶性与生物相容性, 及对生物体低毒无副作用等优点, 在有机分子改性方面得到了广泛运用[31~33].近年来基于PEG修饰高分子荧光化学传感器已有相关文献报道.在此我们报道一种新的PEG修饰水溶性高分子荧光化学传感器P1, 在纯水溶液中, P1能够荧光猝灭识别Hg2+, 并形成稳定的1:1型络合物P1-Hg2+ (Eq. 1)[34~37]. Hg2+是一种有毒重金属离子, 对环境及生物体产生很大危害, 基于识别的荧光化学传感器已有大量报道.有意思的是, 这种在位生成的P1-Hg2+配合物可荧光增强识别Cys.当Cys存在时, 由于Cys与Hg2+强的亲和作用强于P1生成Cys-Hg2+络合物而置换出自由P1分子, 从而使得荧光恢复.
1 结果与讨论
1.1 合成与结构表征
聚合物分子P1的合成方法见Scheme 1.以蒽为初始原料, 首先根据文献方法合成10-叠氮甲基-9-蒽甲醛(1)[38], 然后与炔基取代二甲基吡啶胺(2) “Click”反应得到化合物3.化合物3经还原得到化合物4, 再与碘代聚乙二醇单甲醚(5)反应得到P1.聚合物P1及其前体4的结构通过1H NMR和FT-IR得到证实.
1.2 P1对Hg2+的荧光识别研究
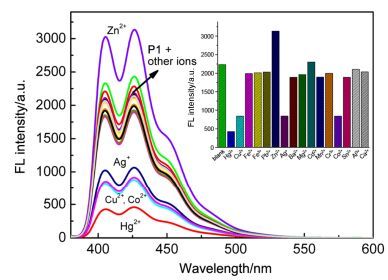
在纯水相4-羟乙基哌嗪乙磺酸(HEPES, 10 mmol/L, pH=7.4) 缓冲体系中, 首先研究了P1对不同金属离子(Na+, Ca2+, Mg2+, Ba2+, Co2+, Fe2+, Al3+, Cr3+, Ag+, Cu2+, Ni2+, Zn2+, Cd2+, Hg2+和Pb2+)的荧光识别能力.如图 1所示, 受体分子P1在401、425及450 nm处有强的蒽单分子发射峰.当滴加2倍量不同金属离子时, P1对一些过渡金属离子都有一定的荧光响应.如滴加Cu2+, Co2+, Ag+和Hg2+表现出荧光猝灭响应, 而滴加Zn2+有一定的荧光增强响应.这说明受体分子与金属离子有强的配位作用, 可归因为受体分子P1中4个N原子(两个吡啶N原子, 胺N原子及三位三唑环N原子)与金属离子螯合效应的结果.二(2-吡啶甲基)胺(DPA)及其衍生物是一个强的多齿配体, 其对选择性重金属离子及过渡金属离子常有强的配位作用.基于DPA修饰的荧光化学传感器对顺磁性(Cu2+, Co2+)及重金属离子(Ag+和Hg2+)常为荧光猝灭响应, 而对Zn2+则为配位荧光增强响应[39].
鉴于滴加Hg2+时荧光响应最大, 其荧光猝灭率达到85%, 因此我们详细研究了滴加Hg2+时受体P1的荧光变化.如图 2所示, 在HEPES (10 mmol/L, pH 7.4) 缓冲溶液中, 随着Hg2+的不断加入, P1基于蒽的单分子发射峰逐渐减弱, 当滴加约一倍量时达到饱和, 表明P1与Hg2+形成了1:1型配合物.滴加Hg2+导致P1荧光猝灭的原因是由于荧光团蒽与Hg2+之间的发生了光诱导电子转移(PET)过程, 导致蒽荧光淬灭.这一作用过程在一些文献已经有相关报道[40].根据P1与Hg2+的荧光滴定数据, 通过Benesi-Hildebrand公式线性拟合, 算得P1-Hg2+络合物的稳定常数为3.36×105 L/mol.
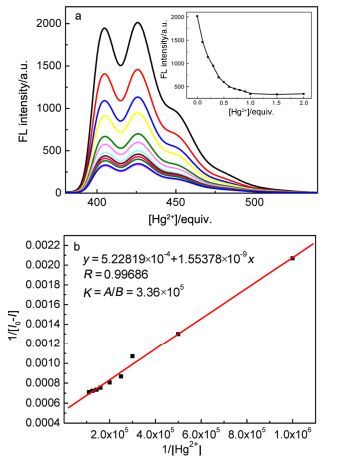 图 2
(a)在HEPES (10 mmol/L, pH=7.4) 溶液P1 (1.0×10-5 mol/L, 激发波长370 nm)中对滴加不同倍量的Hg2+ 荧光发射变化图和(b) P1在425 nm荧光强度与Hg2+ 量BenesiHildebrand线性拟合
Figure Figure2.
(a) Emission spectra of 1 (1.0×10-5 mol/L, λex =370 nm) upon addition various amount of Hg2+ in HEPES (10 mmol/L, pH 7.4) solution and (b) the Benesi-Hildebrand plot of P1-Hg2+ by the emission data
图 2
(a)在HEPES (10 mmol/L, pH=7.4) 溶液P1 (1.0×10-5 mol/L, 激发波长370 nm)中对滴加不同倍量的Hg2+ 荧光发射变化图和(b) P1在425 nm荧光强度与Hg2+ 量BenesiHildebrand线性拟合
Figure Figure2.
(a) Emission spectra of 1 (1.0×10-5 mol/L, λex =370 nm) upon addition various amount of Hg2+ in HEPES (10 mmol/L, pH 7.4) solution and (b) the Benesi-Hildebrand plot of P1-Hg2+ by the emission data
1.3 P1-Hg2+对Cys识别性质研究
由于Hg2+对S原子具有很好的亲和性, 一些Hg2+金属有机配和物已被广泛用于识别巯基氨基酸[41~45].基于此, 本文研究了P1-Hg2+络合物对不同氨基酸识别能力.从图 3可看出, 在HEPES (10 mmol/L, pH=7.4) 溶液中, 当分别滴加10倍量不同氨基酸(Ala、Cys、Glu、Gly、His、Leu、Met、Phe、Ser、Trp、Arg、Thr、Asp)时, 仅Cys表现出明显的荧光增强响应, 而加入其他氨基酸时P1-Hg2+的荧光变化则较少.这种荧光变化可能是因为Cys与Hg2+较P1及其他氨基酸有更强的配位能力, 发生了P1-Hg2++Cys→P1+Cys-Hg2+置换反应, 从而使得P1的荧光恢复.
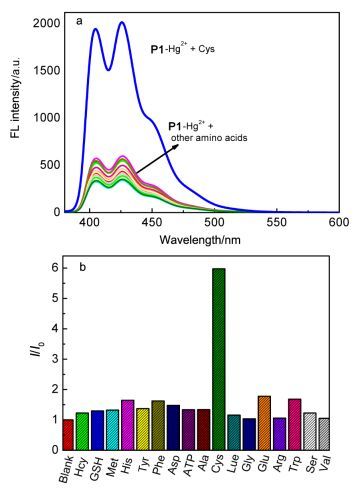 图 3
HEPES (10 mmol/L, pH=7.4) 溶液中P1-Hg2+ (1.0×10‒5 mol/L, λex =370 nm)滴加不同的氨基酸的荧光发射光谱(a)及在425 nm滴加不同胺基酸荧光强度柱状图(b)
Figure Figure3.
Fluorescence spectra of P1-Hg2+ (1.0×10‒5 mol/L, λex =370 nm) upon the addition of 10 equiv. of various amino acids in HEPES (10 mmol/L, pH=7.4) solution (a) and the bar graph of relative fluorescence I/I0 of P1-Hg2+ at 425 nm upon the addition of amino acids (b)
图 3
HEPES (10 mmol/L, pH=7.4) 溶液中P1-Hg2+ (1.0×10‒5 mol/L, λex =370 nm)滴加不同的氨基酸的荧光发射光谱(a)及在425 nm滴加不同胺基酸荧光强度柱状图(b)
Figure Figure3.
Fluorescence spectra of P1-Hg2+ (1.0×10‒5 mol/L, λex =370 nm) upon the addition of 10 equiv. of various amino acids in HEPES (10 mmol/L, pH=7.4) solution (a) and the bar graph of relative fluorescence I/I0 of P1-Hg2+ at 425 nm upon the addition of amino acids (b)
P1-Hg2+中滴加Cys荧光变化见图 4.随着Cys浓度的逐渐增加, P1的荧光强度开始变化并不大.当Cys浓度达到0.3 equiv.时, P1-Hg2+的荧光强度变化加速, 当滴加约1.0 equiv. Cys时荧光增强变化趋于饱和, 其荧光增强系数I/I0达到6左右.这种非线性S型荧光响应变化在文献中也有相关报道[46].同时, 根据荧光滴定曲线可看出, P1-Hg2+荧光强度变化与Cys浓度在0.4~0.7 equiv.间有很好的线性关系(R2=0.9868).
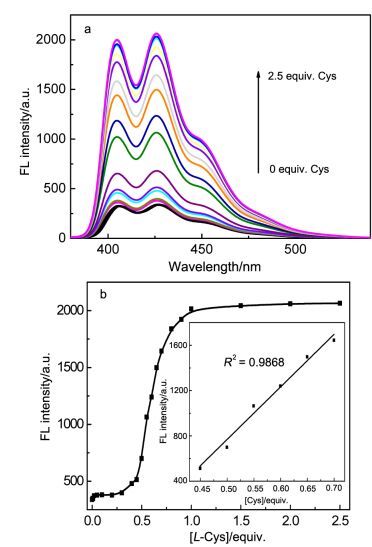 图 4
(a) HEPES (10 mmol/L, pH 7.4) 溶液中P1-Hg2+ (1.0× 10-5 mol/L)滴加不同量Cys (0~2.5 equiv.)的荧光变化图及(b) P1-Hg2+ 在425 nm处荧光强度与滴加Cys当量变化图
Figure Figure4.
(a) Emission spectra of P1-Hg2+ (1.0×10-5 mol/L, λex=370 nm) upon addition various amount of Cys in HEPES solution and (b) the emission intensity of P1-Hg2+ at 425 nm versus the equiv. of Cys
图 4
(a) HEPES (10 mmol/L, pH 7.4) 溶液中P1-Hg2+ (1.0× 10-5 mol/L)滴加不同量Cys (0~2.5 equiv.)的荧光变化图及(b) P1-Hg2+ 在425 nm处荧光强度与滴加Cys当量变化图
Figure Figure4.
(a) Emission spectra of P1-Hg2+ (1.0×10-5 mol/L, λex=370 nm) upon addition various amount of Cys in HEPES solution and (b) the emission intensity of P1-Hg2+ at 425 nm versus the equiv. of Cys
1.4 pH及其他共存胺基酸对P1-Hg2+识别Cys的影响
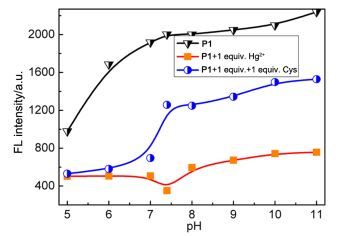
P1-Hg2+在不同pH值环境水溶液中对Cys荧光识别能力影响见图 5.从图中可看出, P1-Hg2+在弱碱性条件对Cys有很好的能力, 而在酸性条件下识别能力减弱.这可能是因为Cys在碱性条件时以羧酸盐的形式存在, 羧酸盐与S原子通过螯合作用较P1对Hg2+有更好的配位能力, 从而与Hg2配位置换出P1.
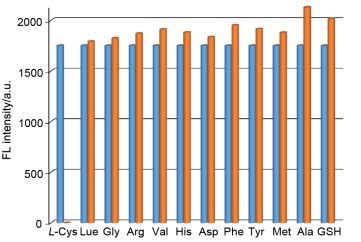
作为一个好的传感材料, 应该具有良好的抗其他共存离子的干扰能力.因此文章进一步研究了P1-Hg2+对Cys与其他氨基酸的竞争性实验.如图 6所示, 当其他背景的氨基酸存在时对P1-Hg2+络合物识别Cys的荧光信号没有发生明显的变化.这表明P1-Hg2+在HEPES (10 mmol/L, pH 7.4) 体系条件下对Cys有很好的选择性.
1.5 识别机理研究
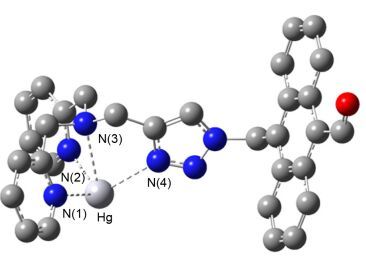
P1-Hg2+对Cys荧光响应可能发生了如Eq. 1所示配体转换反应.为了证实该机理, 我们以前体化合物3为模型通过密度泛函理论(DFT)计算及1H NMR滴定研究了其与Hg2+的结合模式. DFT计算3-Hg2+络合物的最优构型见图 7.从图中可看出, 受体分子3中的两个吡啶环N原子[N(1) 与N(2)], 三级胺N(3) 原子及三唑环N(4) 原子与中心Hg2+参与了配位, 其中Hg与吡啶环N原子距离为2.50 Å, 与N(3) 距离为2.68 Å, 而与三唑环N(4) 原子距离为2.46 Å.从Hg—N距离可看出, 三唑环中N原子配位能力较其他N原子配位能力更强.
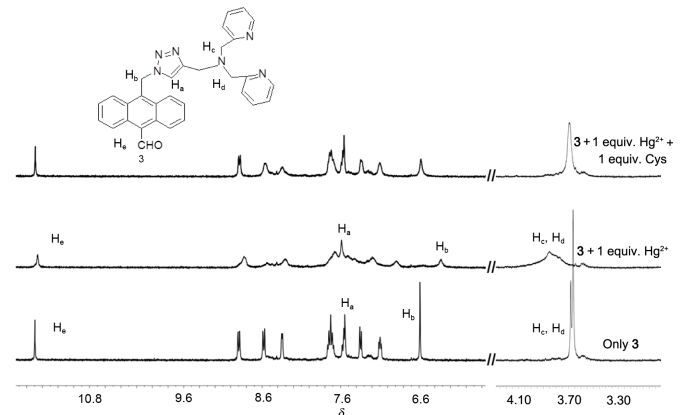
为了进一步证实该反应机理, 我们通过核磁滴定的数据进一步证实上述机理.受体分子3滴加Hg2+及Cys前后1H NMR变化见图 8.在氘代乙腈中, 随着Hg2+的滴加, 3中三唑环质子Ha (Δδ=-0.04) 及与胺基吡啶环相邻的亚甲基Hc和Hd (Δδ=-0.21) 发生了低场方向移动, 表明三唑中的N原子, 三级胺及吡啶环中的N原子都参与了与汞离子的配位, 与DFT计算结果相一致.当配体与金属离子配位时, 由于配体中配位原子吸电子增强, 导致其邻位质子发生低场方向移动.同时从图 8中还可看出, 当3与Hg2+发生配位时, 一些蒽环上的质子及其相连的亚甲基上的Hb发生了一定的高场方向移动, 这可能因为与金属离子配位降低了受体分子柔性的结果.当3-Hg2+络合物滴加等当量Cys, 其1H NMR谱与受体3基本相同, 表明发生了如Eq. 1所示P1-Hg2++Cys→P1+Cys-Hg2+的置换反应.
2 结论
以2, 2-二甲基吡啶胺、10-叠氮化蒽-9-甲醛、聚乙二醇单甲醚为原料, 通过Click反应合成了一种聚乙二醇修饰荧光化合物P1.在纯水溶液中, 当滴加选择性的金属离子如Cu2+, Ag+, Hg2+, Co2+和Zn2+时, P1的荧光发生了荧光猝灭或增强响应, 且对Hg2+的荧光识别能力最强.同时, P1-Hg2+配合物对Cys表现出独特荧光增强响应, 且不受其他氨基酸的干扰. DFT及1H NMR滴定表明, 受体分子中四个N原子与中心离子Hg2+发生了络合作用, 当滴定Cys时发生了配体置换反应而导致荧光恢复.目前文献报道基于Cys的荧光传感器虽然很多, 但在纯水溶液中的例子尚不多.本文水溶性高分子负载有机受体将为新型Cys荧光化学传感器的设计合成提供了一种新思路.
3 实验部分
3.1 仪器与试剂
核磁共振仪(德国Bruker公司, Bruker Vance 400 MHz, TMS为内标)、紫外可见光谱(HITACHI U-3010型紫外可见分光光度计)、荧光光谱(Hitachi F-4500型荧光光谱仪).
聚乙二醇单甲醚(平均分子量1900)、蒽、二甲基吡啶胺等试剂及药品购于国药集团化学试剂公司. 10-叠氮甲基-9-蒽甲醛(1)、炔基取代二甲基吡啶胺(2)及碘代聚乙二醇单甲醚(5)按文献方法合成.无水溶剂按文献方法纯化制备, 其他试剂均为分析纯, 使用前未作进一步纯化.本实验所用缓冲体系为HEPES (10 mmol/L, pH=7.4) 溶液, 测试样品浓度为10 µmol/L, 滴定所用金属离子(Sn2+、Mn2+、Mg2+、Ba2+、Hg2+、Cu2+、Cr3+、Zn2+、Fe2+、Co2+、Cd2+、Ag+等)均为高氯酸盐.
3.2 10-{4-[(双吡啶-2-甲基氨基)甲基][1, 2, 3]三唑-1-甲基}蒽-9-甲醛(3) 的合成
在氮气保护下, 将化合物1 (261.3 mg, 1.0 mmol)和化合物2 (237.3 mg, 1.0 mmol)溶于5 mL N, N-二甲基甲酰胺溶液中, 然后向其溶液中加入CuSO4•H2O (50 mg, 0.2 mmol)和NaVc (65 mg, 0.2 mmol), 室温下搅拌4 h.反应完成后, 向反应瓶中加入20 mL去离子水, 二氯甲烷萃取, 无水硫酸钠干燥, 旋干, CH2Cl2/MeOH (V/V=98:2) 为洗脱剂硅胶柱分离, 得黄色液体360 mg, 产率72%. 1H NMR (400 MHz, CDCl3)δ: 8.52 (d, J=8.6 Hz, 2H), 8.33 (s, 4H), 7.62~7.52 (m, 4H), 7.48 (t, J=7.6 Hz, 2H), 7.33 (d, J=7.5 Hz, 2H), 7.08 (s, 1H), 7.04~6.94 (m, 2H), 6.47 (s, 2H), 5.70 (s, 2H), 3.65 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 148.8, 136.4, 128.5, 127.7, 124.5, 123.9, 123.2, 121.9, 77.3, 77.0, 76.7, 59.6, 29.7. Anal. calcd for C31H26N6O: C 74.68, H 5.26, N 16.86; found C 74.46, H 5.43, N 16.71.
3.3 10-{4-[(双吡啶-2-甲基氨基)甲基][1, 2, 3]三唑-1-甲基}蒽-9-甲醇(4) 的合成
在氮气保护下, 向50 mL无水乙醇中室温加入化合物3 (250 mg, 0.5 mmol), 溶液冰浴冷却至0 ℃加入NaBH4 (37 mg, 1.0 mmol), 室温搅拌4 h.反应完成后加入盐酸溶液调节pH至中性, 二氯甲烷萃取, 无水硫酸钠干燥, 旋干, CH2Cl2/MeOH (V/V=98/2) 为洗脱剂硅胶柱分离得到淡黄色固体100 mg, 产率39.84%. m.p. 156~157 ℃; 1H NMR (400 MHz, CDCl3) δ: 11.43 (d, J=3.3 Hz, 1H), 8.80 (d, J=8.0 Hz, 2H), 8.38 (d, J=4.1 Hz, 1H), 8.36 (d, J=6.1 Hz, 1H), 8.32 (t, J=9.7 Hz, 2H), 7.70~7.55 (m, 4H), 7.46 (d, J=10.5, Hz, 2H), 7.31 (d, J=7.1 Hz, 2H), 7.17 (s, 1H), 6.99 (s, 2H), 6.45 (t, J=8.3 Hz, 2H), 3.71 (d, J=25.7 Hz, 6H); 13C NMR (100 MHz, CDCl3) δ: 163.5, 155.7, 149.8, 149.2, 136.9, 22.9, 122.6, 122.1, 52.9, 47.7, 29.7. Anal. calcd for C31H28N6O: C 74.38, H 5.64, N 16.79; found C 74.06, H 5.81, N 16.62.
3.4 P1的合成
在氮气保护条件下, 将化合物4 (100 mg, 0.2 mmol)溶于20 mL除水THF中, 在冰浴条件下加NaH (7.8 mg, 0.3 mmol), 反应0.5 h后, 将5 (402 mg, 0.2 mmol)溶于10 mL THF中, 逐渐滴加到反应瓶中, 室温搅拌过夜.反应完成后, 旋干溶剂, 在冰乙醚溶液中析出固体, 重复3次, 得到目标产物P1. 1H NMR (400 MHz, CDCl3) δ: 3.36 (s, CH3O), 3.45 (d, J=4.2 Hz, CH2C5H4N), 3.62 (s, CH2CH2O), 5.43 (s, CH2C2N3H), 6.51~8.55 (anthracene, pyridine). IR (KBr) v: 2890, 1972, 1600, 1340, 1269, 1240, 1062, 956, 838 cm-1.
3.5 荧光滴定测试
采用Hitachi F-4500型荧光光谱仪.首先将聚合物受体P1配制成10 µmol/L溶液, 随后将不同量金属离子分别滴加到P1溶液中, 测定P1对不同金属离子荧光响应.当测定P1-Hg2+对不同氨基酸识别能力实验时, 首先将1 equiv. Hg2+加入到P1溶液中形成稳定的P1-Hg2+配合物, 再加入不同氨基酸测定其荧光变化.在滴定试验中, 金属离子及氨基酸都配制成1.0×10-3 mol/L, 使用微型移液器加入.由于加入金属离子或氨基酸体积较少, 可认为受体分子的浓度基本不变.
辅助材料(Supporting Information) 化合物3, 4及P1的1H NMR、13C NMR、IR图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Ball, R. O.; Courtney-Martin, G.; Pencharz, P. B. J. Nutr. 2006, 136, 1682.
-
[2]
Osman, L. P.; Mitchell, S. C.; Waring, R. H. Sulfur Rep. 1997, 20, 155. doi: 10.1080/01961779708047918
-
[3]
Yang, Y.; Huo, F.; Yin, C.; Chao, J.; Zhang, Y. Dyes Pigm. 2015, 114, 105. doi: 10.1016/j.dyepig.2014.11.004
-
[4]
Seshadri, S.; Beiser, A. Selhub, J. P.; Jacques, F. I.; Rosenberg, R. B.; D'Agostino, P. W.; Wolf, P. A. N. Engl. J. Med. 2002, 346, 476. doi: 10.1056/NEJMoa011613
-
[5]
Shahrokhian, S. Anal. Chem. 2001, 73, 5972. doi: 10.1021/ac010541m
-
[6]
Refsum, H.; Ueland, P. M.; Nygard, O.; Vollset, S. E. Annu. Rev. Med. 1998, 49, 31. doi: 10.1146/annurev.med.49.1.31
-
[7]
Lee, H. Y.; Choi, Y. P.; Kim, S.; Yoon, T.; Guo, Z. Q.; Lee, S.; Swamy, K. M. K.; Kim, G.; Lee, J. Y.; Shin, I.; Yoon, J. Chem. Commun. 2014, 50, 6967. doi: 10.1039/c4cc00243a
-
[8]
Ivanov, A. R.; Nazimov, I. V.; Baratova, L. A. J. Chromatogr. A 2000, 870, 433. doi: 10.1016/S0021-9673(99)00947-4
-
[9]
Wen, M.; Liu, H.; Zhang, F.; Zhu, Y.; Liu, D.; Tian, Y.; Wu, Q. Chem. Commun. 2009, 4530.
-
[10]
Xu, K.; Zhang, Y.; Tang, B.; Laskin, J.; Roach, P. J.; Chen, H. Anal. Chem. 2010, 82, 6926. doi: 10.1021/ac1011602
-
[11]
Seiwert, B.; Karst, U. Anal. Chem. 2007, 79, 7131. doi: 10.1021/ac071016b
-
[12]
吴彦城, 尤嘉宜, 关丽涛, 石杰, 曹梁, 汪朝阳, 有机化学, 2015, 35, 2465. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345201.shtmlWu, Y. C.; You, J. Y.; Guang, L. T.; Shi, J.; Cao, L.; Wang, Z. Y. Chin. J. Org. Chem. 2015, 35, 2465 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345201.shtml
-
[13]
Roubinet, B.; Renard, P. Y.; Romieu, A. Dyes Pigm. 2014, 110, 270. doi: 10.1016/j.dyepig.2014.02.004
-
[14]
Ali, F.; Taye, N. A. A. H.; Gonnade, R. G.; Chattopadhyay, S.; Das, A. Chem. Commun. 2015, 51, 16932. doi: 10.1039/C5CC07450A
-
[15]
Chen, C.; Liu, W.; Xu, C.; Liu, W. Biosens. Bioelectron. 2015, 71, 68. doi: 10.1016/j.bios.2015.04.016
-
[16]
Wu, J.; Sheng, R.; Liu, W.; Wang, P.; Ma, J.; Zhang, H.; Zhuang, X. Inorg. Chem. 2011, 50, 6543. doi: 10.1021/ic200181p
-
[17]
张崇洋, 孟玉珠, 匡金志, 徐岚, 化学学报, 2015, 73, 409.Zhang, C. Y.; Meng, Y. Z.; Kuang, J. Z.; Xu, L. Acta Chim. Sin. 2015, 73, 409 (in Chinese).
-
[18]
Xue, S.; Lu, L.; Wang, Q.; Zhang, S.; Zhang, M.; Shi, G. Talanta 2016, 51, 208.
-
[19]
Reddy G, U.; Agarwalla, H.; Taye, N.; Ghorai, S.; Chattopadhyay, S.; Das, A. Chem. Commun. 2014, 50, 9899. doi: 10.1039/C4CC04214J
-
[20]
de Silva, A. P.; Gunaratne, H. Q. N.; Gunnlaugsson, T. Tetrahedron Lett. 1998, 39, 5077. doi: 10.1016/S0040-4039(98)00909-5
-
[21]
Matsumoto, T.; Urano, Y.; Shoda, T. Org. Lett. 2007, 9, 3375. doi: 10.1021/ol071352e
-
[22]
Gao, B.; Cui, K.; Pan, Y.; Zhang, G.; Zhou, Y.; Zhang, C.; Shuang, S.; Dong, C. RSC Adv. 2016, 6, 43028. doi: 10.1039/C6RA04564B
-
[23]
Kong, F.; Liang, Z.; Luan, D.; Liu, X.; Xu, K.; Tang, B. Anal. Chem. 2016, 88, 6450. doi: 10.1021/acs.analchem.6b01135
-
[24]
Rusin, O.; Luce, N. N. S.; Agbaria, R. A.; Escobedo, J. O.; Jiang, S.; Warner, I. M.; Strongin, R. M. J. Am. Chem. Soc. 2004, 126, 438. doi: 10.1021/ja036297t
-
[25]
Niu, L.; Chen, Y.; Zheng, H.; Wu, L.; Tungbc, C.; Yang, Q. Chem. Soc. Rev. 2015, 44, 6143. doi: 10.1039/C5CS00152H
-
[26]
Chen, X.; Zhou, Y.; Peng X.; Yoon, J. Chem. Soc. Rev. 2010, 39, 2120. doi: 10.1039/b925092a
-
[27]
Kaur, N.; Kaur. P.; Singh, K. RSC Adv. 2014, 4, 29340. doi: 10.1039/C4RA04486J
-
[28]
Zeng, G.; Li, J.; Liang, H.; Yuan, Y.; Li, X.; Yin, C.; Yang, Z.; Fan, Q.L.; Lu, X. M.; Huang, W. Chin. J. Chem. 2015, 33, 881. doi: 10.1002/cjoc.v33.8
-
[29]
You, G. R.; Lee, S. Y.; Lee, J. J.; Kim, Y. S.; Kim, C. RSC Adv. 2016, 6, 4212. doi: 10.1039/C5RA25138A
-
[30]
Deible, C. R.; Petrosko, P.; Johnson, P. C.; Beckman, E. J. Biomaterials 1998, 19, 1885. doi: 10.1016/S0142-9612(98)00098-2
-
[31]
Suggs, L. J.; Shive, M. S.; Garcia, C. A. J. Biomed. Mater. Res. 1999, 46, 22. doi: 10.1002/(ISSN)1097-4636
-
[32]
Greenwald, R. B. J. Controlled Release 2001, 74, 159. doi: 10.1016/S0168-3659(01)00331-5
-
[33]
Wu, Li.; Zhong, W.; Xu, B.; Wei Z.; Liu, X. Dalton Trans. 2015, 44, 8013. doi: 10.1039/C5DT00575B
-
[34]
Nolan, E. M.; Lippard, S. J. Chem. Rev. 2008, 108, 3443. doi: 10.1021/cr068000q
-
[35]
Yang, Y.; Zhao, Q.; Feng, W.; Li, F. Chem. Rev. 2013, 113, 192. doi: 10.1021/cr2004103
-
[36]
Ge, J.-Z.; Zou, Y.; Yan, Y.-H.; Lin, S.; Zhao, X.-F.; Cao, Q.-Y. J. Photochem. Photobiol., A: Chem. 2016, 315, 67. doi: 10.1016/j.jphotochem.2015.09.011
-
[37]
Cao, Q.-Y.; Han, Y.-M.; Wang, H.-M.; Xie, Y. Dyes Pigm. 2013, 99, 798. doi: 10.1016/j.dyepig.2013.07.005
-
[38]
Xie, F.; Sivakumar, K.; Zeng, Q.; Bruckman, M. A.; Hodges, B.; Wang Q. Tetrahedron 2008, 64, 2906. doi: 10.1016/j.tet.2008.01.080
-
[39]
Xu, Z.; Yoon, J.; Spring, D. R. Chem. Soc. Rev. 2010, 39, 1996. doi: 10.1039/b916287a
-
[40]
Gorochovceva, N.; Makuska, R. Eur. Polym. J. 2004, 40, 685. doi: 10.1016/j.eurpolymj.2003.12.005
-
[41]
Wang, J.; Liu, H.; Tong, Z.; Hab, C. S. Coord. Chem. Rev. 2015, 303, 139. doi: 10.1016/j.ccr.2015.05.008
-
[42]
Zhou, L.; Lin, Y.; Huang, Z.; Ren, J.; Qu, X. Chem. Commun. 2012, 48, 1147. doi: 10.1039/C2CC16791C
-
[43]
Kaur, N.; Kaur P.; Singh, K. RSC Adv. 2014, 4, 29340. doi: 10.1039/C4RA04486J
-
[44]
Zhu, H.; Lin, Y.; Wang, G.; Chen, Y.; Lin, X. Fu, N. Sens. Actuators B: Chem. 2014, 198, 201. doi: 10.1016/j.snb.2014.03.021
-
[45]
Ji, W.; Ji, Y.; Jin, Q.; Tong Q.; Tang, X. Analyst 2015, 140, 4379. doi: 10.1039/C5AN00549C
-
[46]
Lin, Q.; Huang, Y.; Fan, J.; Wang, R.; Fu, N. Talanta 2013, 114, 66. doi: 10.1016/j.talanta.2013.04.006
-
[1]
-
图 2 (a)在HEPES (10 mmol/L, pH=7.4) 溶液P1 (1.0×10-5 mol/L, 激发波长370 nm)中对滴加不同倍量的Hg2+ 荧光发射变化图和(b) P1在425 nm荧光强度与Hg2+ 量BenesiHildebrand线性拟合
Figure 2 (a) Emission spectra of 1 (1.0×10-5 mol/L, λex =370 nm) upon addition various amount of Hg2+ in HEPES (10 mmol/L, pH 7.4) solution and (b) the Benesi-Hildebrand plot of P1-Hg2+ by the emission data
Inset: the emission intensity of P1 at 425 nm vs the equivalence of Hg2+
图 3 HEPES (10 mmol/L, pH=7.4) 溶液中P1-Hg2+ (1.0×10‒5 mol/L, λex =370 nm)滴加不同的氨基酸的荧光发射光谱(a)及在425 nm滴加不同胺基酸荧光强度柱状图(b)
Figure 3 Fluorescence spectra of P1-Hg2+ (1.0×10‒5 mol/L, λex =370 nm) upon the addition of 10 equiv. of various amino acids in HEPES (10 mmol/L, pH=7.4) solution (a) and the bar graph of relative fluorescence I/I0 of P1-Hg2+ at 425 nm upon the addition of amino acids (b)
图 4 (a) HEPES (10 mmol/L, pH 7.4) 溶液中P1-Hg2+ (1.0× 10-5 mol/L)滴加不同量Cys (0~2.5 equiv.)的荧光变化图及(b) P1-Hg2+ 在425 nm处荧光强度与滴加Cys当量变化图
Figure 4 (a) Emission spectra of P1-Hg2+ (1.0×10-5 mol/L, λex=370 nm) upon addition various amount of Cys in HEPES solution and (b) the emission intensity of P1-Hg2+ at 425 nm versus the equiv. of Cys
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 2
- 文章访问数: 1711
- HTML全文浏览量: 553


 下载:
下载:







 下载:
下载:

