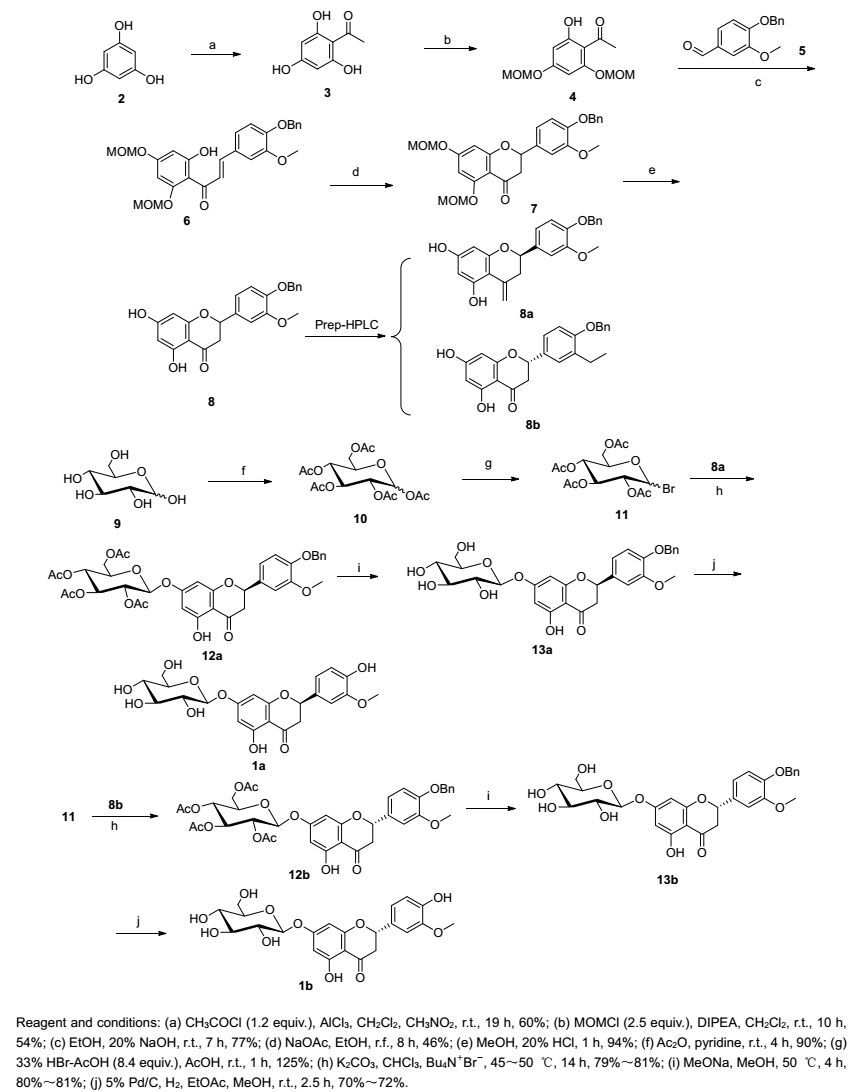
 图式1
高圣草素-7-O-β-D-葡萄糖苷(1b)及其非对映异构体(1a)的合成路线
Scheme1.
Synthesis of homoeriodictyol-7-O-β-D-glycoside (1b) and its diastereoisomer (1a)
图式1
高圣草素-7-O-β-D-葡萄糖苷(1b)及其非对映异构体(1a)的合成路线
Scheme1.
Synthesis of homoeriodictyol-7-O-β-D-glycoside (1b) and its diastereoisomer (1a)

Citation: Kang Manman, Ma Zhilong, Liu Biao, Pan Deng, Li Jianqi. Synthesis of Homoeriodictyol-7-O-β-D-glycoside and Its Diastereoisomer[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1516-1522. doi: 10.6023/cjoc201612012

高圣草素-7-O-β-D-葡萄糖苷及其非对映异构体的合成
-
关键词:
- 槲寄生
- / 高圣草素-7-O-β-D-葡萄糖苷
- / 非对映异构体
- / 合成
English
Synthesis of Homoeriodictyol-7-O-β-D-glycoside and Its Diastereoisomer
-
Key words:
- visci herba
- / homoeriodictyol-7-O-β-D-glycoside
- / diastereoisomer
- / synthesis
-
槲寄生学名Viscum Coloratum (Kom) Nakai, 产于我国黑龙江、山西、四川等地, 是常用的中药材, 早在2300年前的“神农本草经”中已有记录, 中华人民共和国药典收录并公布了槲寄生草药的鉴别和含量测定方法.
槲寄生性味苦甘、平缓、入肝肾经兼入心脾二经, 功能补肝肾、除风湿、强筋骨、安胎下乳.其活性成分黄酮苷具有抗氧化、抑制血小板聚集、抗血栓形成和抗心律失常等广泛的药理活性[1].其中高圣草素-7-O-β-D-葡萄糖苷[2]不仅对治疗冠心病心绞痛具有一定的疗效[3], 临床研究也展现出良好的抗冠心病心绞痛效果, 而且对丙肝NS3蛋白亦具有一定的抑制活性[4].
槲寄生为寄生类植物, 因产地和宿主不同, 高圣草素-7-O-β-D-葡萄糖苷的含量在48.6~736.8 μg/g之间[5], 提取率不足万分之七, 难以大量获取.本文首次实现了高圣草素-7-O-β-D-葡萄糖苷的合成, 为进一步研究其药理活性奠定物质基础, 并为合成其他槲寄生黄酮苷类化合物及其衍生物提供参考.
1 结果与讨论
以价廉易得的间苯三酚为起始原料(Scheme 1), 经傅克酰基化得到2, 4, 6-三羟基苯乙酮(3)[6], 后处理以活性炭吸附纯化后重结晶.选择氯甲基甲醚为羟基保护基[7], 可选择性保护化合物3中的2, 4位羟基得到化合物4, 4与4-苄氧基-3-甲氧基-苯甲醛(5)在20% NaOH催化下进行羟醛缩合制备6[8], 后处理以20% HCl酸化, 产品沉淀析出.
 图式1
高圣草素-7-O-β-D-葡萄糖苷(1b)及其非对映异构体(1a)的合成路线
Scheme1.
Synthesis of homoeriodictyol-7-O-β-D-glycoside (1b) and its diastereoisomer (1a)
图式1
高圣草素-7-O-β-D-葡萄糖苷(1b)及其非对映异构体(1a)的合成路线
Scheme1.
Synthesis of homoeriodictyol-7-O-β-D-glycoside (1b) and its diastereoisomer (1a)
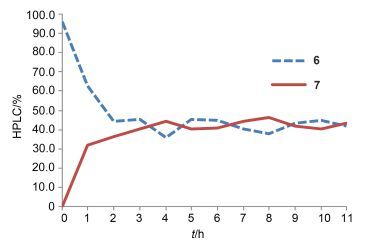
化合物6分子内Michael加成制备7是本实验的关键步骤[9], 此反应为可逆反应, 尝试多种实验条件(如表 1所示)收率均难以提高, 控制无水乙酸钠和无水乙醇条件不变, 反应在8 h左右收率达到最高, 延长反应时间收率不再增加(如图 1所示); 控制无水乙酸钠和反应时间不变, 使用不同的溶剂进行反应, 除无水乙醇和无水甲醇外其他溶剂均不反应, 且乙醇作溶剂的收率明显高于甲醇; 控制无水乙醇和反应时间不变, 使用不同的碱进行反应, 除无水乙酸钠外其他碱条件下反应均不进行.最终选择无水乙酸钠作为碱、无水乙醇为溶剂, 将温度设置于80 ℃, 反应8 h, 可有效制备化合物7.化合物7在20% HCl中脱MOM保护得到化合物8[10].
 表 1
化合物6分子内Michael加成反应条件筛选
Table 1.
Condition screenings of intramolecular michael addition of compound 6
表 1
化合物6分子内Michael加成反应条件筛选
Table 1.
Condition screenings of intramolecular michael addition of compound 6

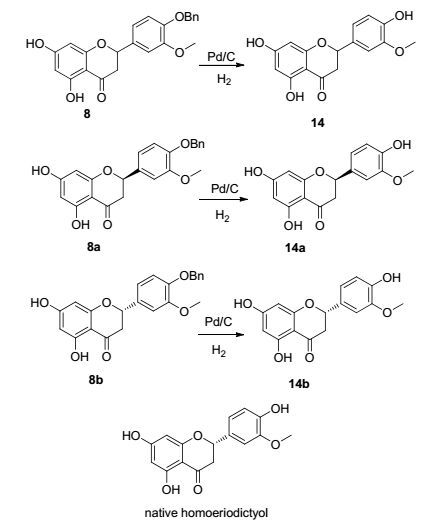
化合物8含1个手性中心, 为一对消旋体, 经手性制备HPLC分离可得到对映体8a及8b, 经Pd/C催化氢化脱除苄基分别得化合物14, 14a, 14b, 如Scheme 2所示.将这三个化合物与通过提取得到的天然高圣草素分别进行手性高效液相色谱(HPLC)分析, 发现化合物14b和天然高圣草素保留时间相同, 说明化合物8b的绝对构型与天然高圣草素一致, 为S型.
以D-葡萄糖为原料, 经全乙酰化得到10, 10与33% HBr-AcOH溶液反应得11[11], 11稳定性差, 宜立即与化合物8b进行糖苷化反应制备12b. 12b在甲醇钠/甲醇条件下脱乙酰基保护得13b, 13b经5% Pd/C催化常压氢化脱苄基得目标化合物1b[12], 1a的合成方法与1b相同.12a, 12b的合成未见文献报道, 我们依照参考文献中相似化合物的合成方法进行合成, 收率79%~81%, 高于文献收率58.9%. 12a, 12b脱乙酰基保护后的13a, 13b可以在反应体系中析出, 无需柱层析.13a, 13b催化氢化后可直接得到1a, 1b的固体.
本文采用核磁共振氢谱中糖的端基质子的偶合常数来判断苷键的构型[12], 糖的六元环中, β型糖的H1, H2之间的偶合常数J=7~10 Hz, 而α 型糖的H1, H2之间的偶合常数J=2~6 Hz.化合物12a, 12b, 13a, 13b, 1a, 1b端基质子的化学位移分别为δ 5.25, 5.25, 4.97, 4.95, 4.96, 4.96, 其偶合常数J依次为8.8, 9.1, 7.5, 7.5, 7.5, 7.5 Hz, 可以判断高圣草素-7-O-β-D-葡萄糖苷及其非对映异构体和中间体的糖苷键均为β构型.核磁共振氢谱解析中未发现α构型苷键的信号.
2 结论
以价廉易得的间苯三酚、D-葡萄糖为原料, 经10步反应首次合成天然产物高圣草素-7-O-β-D-葡萄糖苷及其非对映异构体, 总收率5.2 %(以间苯三酚计).高圣草素-7-O-β-D-葡萄糖苷及其非对映异构体和中间体经HRMS和NMR确证结构.该合成方法较之从植物中提取高圣草素-7-O-β-D-葡萄糖苷具有原料易得、操作简单、可大量制备等优点, 可为深入研究其药理活性及结构改造奠定物质基础.
3 实验部分
3.1 仪器与试剂
熔点采用上海精密科学仪器有限公司制造WRR型熔点仪测定; 核磁共振谱采用Unity INOVA 400或600型核磁共振仪测定; 质谱采用Agilent 1946BESI-MS型质谱仪测定; 旋转蒸发仪为Bucher型; 柱层析用硅胶(200~300目, 青岛胜海精细化工有限公司); 所用试剂均为分析纯.
3.2 实验方法
3.2.14 (2S)-7-(β-D-吡喃葡糖氧基)-2, 3-二氢-5-羟基-2-(4-羟基-3-甲氧基苯基)-4H-1-苯并吡喃-4-酮(1b)的合成
1b的合成方法同1a, 以13b为原料, 得白色固体1b[12] 0.51 g, 收率70%. m.p. 165~170 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 12.03 (s, 1H, OH), 9.15 (s, 1H, OH), 7.10 (d, J=1.9 Hz, 1H, ArH), 6.90 (dd, J=8.2, 1.9 Hz, 1H, ArH), 6.79 (d, J=8.1 Hz, 1H, ArH), 6.16 (dd, J=2.1, 1.0 Hz, 1H, ArH), 6.14~6.11 (m, 1H, ArH), 5.48 (dd, J=12.8, 2.7 Hz, 1H, 2-H), 5.33 (d, J=4.5 Hz, 1H, OH), 5.08 (s, 1H, OH), 5.01 (d, J=4.5 Hz, 1H, OH), 4.96 (dd, J=10.4, 7.5 Hz, 1H, 1''-H), 4.53 (dd, J=10.1, 5.1 Hz, 1H, OH), 3.78 (s, 3H, OCH3), 3.65 (d, J=7.1 Hz, 1H, 2''-H), 3.49~3.08 (m, 6H, 3''-H and 4''-H and 5''-H and 6''-CH2 and 3-H), 2.73 (dd, J=17.2, 3.0 Hz, 1H, 3-H); 13C NMR (DMSO-d6, 150 MHz) δ: 197.72, 165.70, 163.37, 163.24, 148.05, 147.54, 129.63, 120.28, 115.67, 111.76, 103.71, 99.98, 97.02, 95.95, 79.41, 77.55, 76.80, 73.50, 69.99, 61.05, 56.20, 42.61; HRMS calcd for C22H24O11 464.1319, found 464.1322.
辅助材料(Supporting Information) 中间体及终产物的HRMS和NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
3.2.9 (2R)-7-(β-2, 3, 4, 6-四乙酸酯-D-葡萄糖氧基)-2, 3-二氢-5-羟基-2-(4-苄氧基-3-甲氧基苯基)-4H-1-苯并吡喃-4-酮(12a)的合成
将8a (1.32 g, 3.37 mmol), 11 (2.89 g, 7.05 mmol)和四正丁基溴化铵(0.31 g, 0.96 mmol)溶于氯仿50 mL, 加入0.25 mol/L K2CO3水溶液50 mL, 45 ℃避光反应14 h.冷却至室温, 分液, 水相用氯仿50 mL萃取, 合并有机相, 无水硫酸钠干燥, 减压除去溶剂, 硅胶柱层析分离[洗脱剂: V(石油醚):V(乙酸乙酯)=3:1], 得黄色油状物, 用甲醇重结晶得白色固体12a[12]1.62 g, 收率79%. m.p. 135~138 ℃; 1H NMR (400 MHz, CDCl3) δ: 11.93 (s, 1H, OH), 7.44 (d, J=7.1 Hz, 2H, ArH), 7.37 (t, J=7.3 Hz, 2H, ArH), 7.31 (t, J=7.2 Hz, 1H, ArH), 6.98 (s, 1H, ArH), 6.90 (s, 2H, ArH), 6.15 (d, J=2.3 Hz, 1H, ArH), 6.12 (d, J=2.2 Hz, 1H, ArH), 5.34 (dd, J=13.0, 2.9 Hz, 1H, 2-H), 5.25 (dd, J=16.5, 8.8 Hz, 2H, 1''-H and 2''-H), 5.18 (s, 2H, OCH2Ar), 5.11 (d, J=7.5 Hz, 2H, 3''-H and 4''-H), 4.25 (dd, J=12.3, 5.9 Hz, 1H, 6''-CH2), 4.17 (dd, J=12.3, 2.3 Hz, 1H, 6''-CH2), 3.92 (s, 3H, OCH3), 3.86 (ddd, J=10.0, 5.8, 2.4 Hz, 1H, 5''-H), 3.10 (dd, J=17.2, 13.1 Hz, 1H, 3-H), 2.81 (dd, J=17.2, 2.9 Hz, 1H, 3-H), 2.06 (s, 3H, OCOCH3), 2.05 (s, 3H, OCOCH3), 2.04 (s, 3H, OCOCH3), 2.03 (s, 3H, OCOCH3); 13C NMR (CDCl3, 150 MHz) δ: 196.40, 170.59, 170.16, 169.38, 169.15, 164.44, 164.01, 162.81, 149.99, 148.80, 136.84, 130.93, 128.62, 127.98, 127.23, 109.99, 104.41, 97.82, 97.41, 96.30, 79.40, 72.58, 72.42, 71.06, 70.87, 68.16, 61.84, 56.16, 43.41, 20.57; HRMS calcd for C37H38O15 722.2211, found 722.2216.
3.2.7 1, 2, 3, 4, 6-五乙酸酯-D-葡萄糖(10)的合成
将D-葡萄糖(9)(10.03 g, 55.72 mmol)溶于吡啶100 mL, 加入乙酸酐100 mL, 室温搅拌4 h.加入乙酸乙酯200 mL稀释, 分别用20%盐酸、饱和碳酸氢钠水溶液、饱和氯化钠水溶液各200 mL洗涤, 无水硫酸钠干燥, 减压除去溶剂, 乙醇重结晶得白色粉末10 19.66 g, 收率90 %. m.p. 130~132 ℃; 1H NMR (CDCl3, 600 MHz) δ: 5.66 (d, J=8.3 Hz, 1H, 1-H), 5.19 (t, J=9.5 Hz, 1H, 2-H), 5.05 (dd, J=13.9, 5.7 Hz, 2H, 3-H and 4-H), 4.22 (dd, J=12.5, 4.5 Hz, 1H, 6-H), 4.04 (dd, J=12.5, 2.0 Hz, 1H, 6-H), 3.79 (ddd, J=10.1, 4.4, 2.1 Hz, 1H, 5-H), 2.04 (s, 3H, OCOCH3), 2.01 (s, 3H, OCOCH3), 1.96 (s, 6H, OCOCH3), 1.94 (s, 3H, OCOCH3); 13C NMR (CDCl3, 150 MHz)δ: 170.45, 169.95, 169.28, 169.11, 168.82, 91.63, 72.71, 72.64, 70.20, 67.73, 61.41, 20.69, 20.59, 20.46, 20.44; HRMS calcd for C16H22O11 390.1162, found 390.1158.
3.2.8 1-溴-2, 3, 4, 6-四乙酸酯-D-葡萄糖(11)的合成
将10 (5.09 g, 13.05 mmol)溶于冰醋酸30 mL, 加入33%溴化氢醋酸溶液(20 mL, 0.11 mol), 室温搅拌1 h.加入二氯甲烷100 mL稀释, 分别用冷水、饱和碳酸氢钠水溶液、水各100 mL洗涤, 无水硫酸钠干燥, 减压除去溶剂得糖浆状浓缩物11[11] 6.70 g, 收率125%. 11性质不稳定, 不经分离纯化直接用于下一步合成.
3.2.12 (2S)-7-(β-D-吡喃葡糖氧基)-2, 3-二氢-5-羟基-2-(4-苄氧基-3-甲氧基苯基)-4H-1-苯并吡喃-4-酮(13b)的合成
13b的合成方法同13a.以12b为原料, 得白色固体13b[12]0.80 g, 收率80%. m.p. 232~234 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 12.04 (s, 1H, OH), 7.46~7.42 (m, 2H, ArH), 7.41~7.36 (m, 2H, ArH), 7.38~7.32 (m, J=7.2, 1H, ArH), 7.16 (d, J=1.8 Hz, 1H, ArH), 7.05 (d, J=8.4 Hz, 1H, ArH), 7.00 (dd, J=8.3, 1.8 Hz, 1H, ArH), 6.18 (d, J=2.2 Hz, 1H, ArH), 6.13 (d, J=2.2 Hz, 1H, ArH), 5.53 (dd, J=12.7, 2.8 Hz, 1H, 2-H), 5.32 (d, J=4.4 Hz, 1H, OH), 5.10~5.08 (m, 3H, OCH2Ar and OH), 5.01 (s, 1H, OH), 4.95 (d, J=7.5 Hz, 1H, 1''-H), 4.53 (t, J=5.5 Hz, 1H, OH), 3.79 (s, 3H, OCH3), 3.66 (dd, J=11.0, 4.4 Hz, 1H, 2''-H), 3.48~3.07 (m, 6H, 3''-H and 4''-H and 5''-H and 6''-CH2 and 3-H), 2.77 (dd, J=17.2, 3.0 Hz, 1H, 3-H); 13C NMR (DMSO-d6, 150 MHz) δ: 197.56, 165.82, 163.41, 163.13, 149.62, 148.55, 137.54, 131.62, 128.89, 128.32, 128.20, 119.81, 113.85, 111.53, 103.73, 100.14, 97.08, 95.99, 79.19, 77.59, 76.80, 73.50, 70.38, 69.99, 61.06, 56.19, 42.62; HRMS calcd for C29H30O11 554.1788, found 554.1783.
3.2.11 (2R)-7-(β-D-吡喃葡糖氧基)-2, 3-二氢-5-羟基-2-(4-苄氧基-3-甲氧基苯基)-4H-1-苯并吡喃-4-酮(13a)的合成
将12a (1.20 g, 1.66 mmol)溶于甲醇150 mL, 加入30%甲醇钠/甲醇溶液(0.95 g, 0.52 mmol), 50 ℃加热4 h.体系中有白色固体析出, 停止加热, 冷却至室温, 过滤, 得白色固体13a[12]0.75 g, 收率81%. m.p. 230~233 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 12.05 (s, 1H, OH), 7.48~7.44 (m, 2H, ArH), 7.43~7.38 (m, 2H, ArH), 7.37~7.31 (m, 1H, ArH), 7.18 (d, J=1.9 Hz, 1H, ArH), 7.07 (d, J=8.4 Hz, 1H, ArH), 7.02 (dd, J=8.3, 1.8 Hz, 1H, ArH), 6.20 (d, J=2.2 Hz, 1H, ArH), 6.15 (d, J=2.2 Hz, 1H, ArH), 5.55 (dd, J=12.7, 2.9 Hz, 1H, 2-H), 5.34 (d, J=4.9 Hz, 1H, OH), 5.12 (s, 2H, OCH2Ar), 5.09 (d, J=4.7 Hz, 1H, OH), 5.02 (d, J=5.2 Hz, 1H, OH), 4.97 (d, J=7.5 Hz, 1H, 1''-H), 4.55 (t, J=5.6 Hz, 1H, OH), 3.81 (s, 3H, OCH3), 3.68 (dd, J=10.2, 5.2 Hz, 1H, 2''-H), 3.46 -3.15 (m, 6H, 3''-H and 4''-H and 5''-H and 6''-CH2 and 3-H), 2.79 (dd, J=17.2, 3.0 Hz, 1H, 3-H); 13C NMR (DMSO-d6, 150 MHz) δ: 197.56, 165.82, 163.41, 163.13, 149.62, 148.55, 137.54, 131.62, 128.89, 128.32, 128.20, 119.81, 113.85, 111.53, 103.73, 100.14, 97.08, 95.99, 79.19, 77.59, 76.80, 73.50, 70.38, 69.99, 61.06, 56.19, 42.62; HRMS calcd for C29H30O11 554.1788, found 554.1783.
3.2.5 2-[4-(苄氧基)-3-甲氧基苯基]-5, 7-二羟基吡喃-4-酮(8)的合成
将7 (4.40 g, 9.16 mmol)溶于甲醇50 mL, 缓慢滴加20%盐酸20 mL, 加热回流1 h.冷却至室温, 固体析出, 转移至冰水浴搅拌30 min, 过滤, 干燥得淡黄色固体8[10] 3.32 g, 收率94 %. m.p. 182~185 ℃; 1H NMR (CDCl3, 400 MHz) δ: 12.05 (s, 1H, OH), 7.44 (d, J=7.3 Hz, 2H, ArH), 7.37 (t, J=7.3 Hz, 2H, ArH), 7.31 (t, J=7.2 Hz, 1H, ArH), 7.00 (s, 1H, ArH), 6.90 (d, J=0.9 Hz, 2H, ArH), 6.00 (d, J=2.3 Hz, 1H, ArH), 5.98 (d, J=2.3 Hz, 1H, ArH), 5.54 (s, 1H, OH), 5.34 (dd, J=13.0, 2.9 Hz, 1H, 2-H), 5.18 (s, 2H, OCH2Ar), 3.93 (s, 3H, OCH3), 3.10 (dd, J=17.2, 13.1 Hz, 1H, 3-H), 2.79 (dd, J=17.2, 3.0 Hz, 1H, 3-H); 13C NMR (CDCl3, 150 MHz) δ: 195.91, 164.47, 164.39, 163.18, 149.96, 148.72, 136.87, 131.23, 128.61, 127.96, 127.24, 118.82, 113.92, 110.03, 103.23, 96.74, 95.45, 79.22, 71.08, 56.15, 43.28; HRMS calcd for C23H20O6 392.1260, found 392.1258.
3.2.3 3-[4-(苄氧基)-3-甲氧基苯基]-1-[2-羟基-4, 6-双(甲氧基甲氧基)苯基]丙-2-烯-1-酮(6)的合成
将4 (39.01 g, 0.15 mol)和5 (37.40 g, 0.15 mol)溶于乙醇800 mL, 加入20%氢氧化钠水溶液500 mL, 室温搅拌7 h.滴加20%的盐酸至黄色颗粒状固体产生, 粗品经乙醇重结晶得黄色针状结晶6[8]55.50 g, 收率77%. m.p. 110~112 ℃; 1H NMR (CDCl3, 600 MHz) δ: 13.89 (s, 1H, OH), 7.83 (d, J=15.5 Hz, 1H, β-CH=), 7.75 (d, J=15.5 Hz, 1H, α-CH=), 7.44 (d, J=7.4 Hz, 2H, ArH), 7.38 (t, J=7.5 Hz, 2H, ArH), 7.32 (t, J=7.3 Hz, 1H, ArH), 7.16 (d, J=1.8 Hz, 1H, ArH), 7.14 (dd, J=8.3, 1.9 Hz, 1H, ArH), 6.90 (d, J=8.3 Hz, 1H, ArH), 6.32 (d, J=2.3 Hz, 1H, ArH), 6.22 (d, J=2.3 Hz, 1H, ArH), 5.28 (s, 2H, OCH2O), 5.21 (s, 2H, OCH2O), 5.19 (s, 2H, OCH2Ar), 3.93 (s, 3H, OCH3), 3.53 (s, 3H, OCH3), 3.48 (s, 3H, OCH3); 13C NMR (CDCl3, 150 MHz) δ: 192.74, 167.34, 163.34, 159.79, 150.37, 149.80, 142.81, 136.62, 128.89, 128.66, 128.05, 127.22, 125.40, 122.60, 97.60, 95.33, 94.75, 94.10, 70.93, 56.97, 56.47, 55.96; HRMS calcd for C27H28O8 480.1784, found 480.1784.
3.2.13 (2R)-7-(β-D-吡喃葡糖氧基)-2, 3-二氢-5-羟基-2-(4-羟基-3-甲氧基苯基)-4H-1-苯并吡喃-4-酮(1a)的合成
将13a (0.75 g, 1.35 mmol)溶于100 mL乙酸乙酯和100 mL甲醇的混合溶剂中, 加入5% Pd/C (0.75 g), 通入氢气, 室温氢解2.5 h.过滤, 减压除去溶剂得白色固体, 乙酸乙酯/正庚烷重结晶得白色无定形粉末1a[12] 0.45 g, 收率72%. m.p. 150~156 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 12.04 (s, 1H, OH), 9.15 (s, 1H, OH), 7.10 (d, J=1.8 Hz, 1H, ArH), 6.90 (dd, J=8.2, 1.9 Hz, 1H, ArH), 6.79 (d, J=8.1 Hz, 1H, ArH), 6.17~6.15 (m, 1H, ArH), 6.13 (t, J=1.8 Hz, 1H, ArH), 5.48 (dd, J=12.9, 2.7 Hz, 1H, 2-H), 5.32 (d, J=4.6 Hz, 1H, OH), 5.08 (d, J=3.8 Hz, 1H, OH), 5.01 (d, J=4.7 Hz, 1H, OH), 4.96 (dd, J=10.4, 7.5 Hz, 1H, 1''-H), 4.59~4.48 (m, 1H, OH), 3.78 (s, 3H, OCH3), 3.66 (d, J=7.2 Hz, 1H, 2''-H), 3.48~3.08 (m, 6H, 3''-H and 4''-H and 5''-H and 6''-CH2 and 3-H), 2.73 (dd, J=17.2, 2.9 Hz, 1H, 3-H); 13C NMR (DMSO-d6, 150 MHz) δ: 197.72, 165.70, 163.37, 163.24, 148.05, 147.54, 129.63, 120.28, 115.67, 111.76, 103.71, 99.98, 97.02, 95.95, 79.41, 77.55, 76.80, 73.50, 69.99, 61.05, 56.20, 42.61; HRMS calcd for C22H24O11 464.1319, found 464.1322.
3.2.10 (2S)-7-(β-2, 3, 4, 6-四乙酸酯-D-葡萄糖氧基)-2, 3-二氢-5-羟基-2-(4-苄氧基-3-甲氧基苯基)-4H-1-苯并吡喃-4-酮(12b)的合成
12b的合成方法同12a.以8b为原料, 得白色固体12b[12] 1.70 g, 收率81%. m.p. 133~137 ℃; 1H NMR (400 MHz, CDCl3) δ: 11.93 (s, 1H, OH), 7.44 (d, J=7.1 Hz, 2H, ArH), 7.37 (t, J=7.3 Hz, 2H, ArH), 7.31 (t, J=7.2 Hz, 1H, ArH), 6.98 (s, 1H, ArH), 6.90 (s, 2H, ArH), 6.15 (d, J=2.2 Hz, 1H, ArH), 6.12 (d, J=2.2 Hz, 1H, ArH), 5.33 (dd, J=13.1, 3.0 Hz, 1H, 2-H), 5.25 (dd, J=16.0, 9.1 Hz, 2H, 1''-H and 2''-H), 5.18 (s, 2H, OCH2Ar), 5.14 (d, J=10.1 Hz, 1H, 4''-H), 5.12~5.09 (m, 1H, 3''-H), 4.24 (dd, J=12.3, 5.9 Hz, 1H, 6''-CH2), 4.17 (dd, J=12.3, 2.3 Hz, 1H, 6''-CH2), 3.92 (d, J=2.4 Hz, 3H, OCH3), 3.87 (ddd, J=9.9, 5.8, 2.3 Hz, 1H, 5''-H), 3.11 (dd, J=17.2, 13.1 Hz, 1H, 3-H), 2.81 (dd, J=17.2, 2.9 Hz, 1H, 3-H), 2.06 (s, 0.5H, OCOCH3), 2.05 (s, 3H, OCOCH3), 2.04 (s, 3H, OCOCH3), 2.04 (s, 2.5H, OCOCH3), 2.03 (s, 3H, OCOCH3); 13C NMR (CDCl3, 150 MHz) δ: 196.40, 170.59, 170.16, 169.38, 169.15, 164.44, 164.01, 162.81, 149.99, 148.80, 136.84, 130.93, 128.62, 127.98, 127.23, 109.99, 104.41, 97.82, 97.41, 96.30, 79.40, 72.58, 72.42, 71.06, 70.87, 68.16, 61.84, 56.16, 43.41, 20.57; HRMS calcd for C37H38O15 722.2211, found 722.2216.
3.2.2 2, 4-甲氧甲氧基-6-羟基-苯乙酮(4)的合成
将3 (54.55 g, 0.32mol)溶于二氯甲烷500 mL, 冰水浴下加入N, N-二异丙基乙胺(DIPEA) 160 mL, 缓慢滴加氯甲基甲醚(62 mL, 0.82 mol), 升至室温反应10 h.加入饱和氯化铵水溶液500 mL淬灭, 二氯甲烷萃取(500 mL×2), 合并有机相, 无水硫酸钠干燥, 减压蒸除溶剂得棕褐色油状物, 硅胶柱层析分离[洗脱剂: V(石油醚):V(乙酸乙酯)=20:1]得白色固体4[7]46.71 g, 收率54%. m.p. 43~45 ℃; 1H NMR (CDCl3, 600 MHz) δ: 13.69 (s, 1H, OH), 6.22 (d, J=2.3 Hz, 2H, ArH), 5.23 (s, 2H, OCH2O), 5.14 (s, 2H, OCH2O), 3.50 (s, 3H, OCH3), 3.44 (s, 3H, OCH3), 2.62 (s, 3H, COCH3); 13C NMR (CDCl3, 150 MHz) δ: 203.18, 166.81, 163.46, 160.37, 106.91, 97.12, 94.50, 94.00, 56.68, 56.39, 32.94; HRMS calcd for C12H16O6 256.0947, found 256.0952.
3.2.6 (2R)2-[4-(苄氧基)-3-甲氧基苯基]-5, 7-二羟基吡喃-4-酮(8a)和(2S)2-[4-(苄氧基)-3-甲氧基苯基]-5, 7-二羟基吡喃-4-酮(8b)的手性制备
手性色谱分析条件:色谱柱CHIRALPAK IG (0.46 cm I.D.×15 cm), 进样量10.0 μL, 流动相MeOH/HOAc [V/V=100/0.1], 流速1.0 mL/min, 检测波长UV 285 nm, 柱温35 ℃.
手性色谱制备条件:色谱柱CHIRALPAK AD (5.0 cm I.D.×25 cm), 流动相V(MeOH)/V(ACN)/V(HOAc)=80/200/ 0.1, 流速60 mL/min, 检测波长UV 280 nm, 柱温35 ℃.
8 (20.39 g)经手性制备分别得到对映体8a (8.89 g), 收率44%. m.p. 190~192 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 12.15 (s, 1H, OH), 10.80 (s, 1H, OH), 7.45 (d, J=7.0 Hz, 2H, ArH), 7.39 (t, J=7.3 Hz, 2H, ArH), 7.36~7.30 (m, 1H, ArH), 7.16 (d, J=1.8 Hz, 1H, ArH), 7.05 (d, J=8.3 Hz, 1H, ArH), 7.00 (dd, J=8.3, 1.7 Hz, 1H, ArH), 5.91 (dd, J=7.8, 2.1 Hz, 2H, ArH), 5.48 (dd, J=12.8, 2.9 Hz, 1H, 2-H), 5.10 (s, 2H, OCH2Ar), 3.80 (s, 3H, OCH3), 3.47~3.19 (m, 1H, 3-H), 2.72 (dd, J=17.1, 3.0 Hz, 1H, 3-H); 13C NMR (DMSO-d6, 100 MHz) δ: 196.70, 167.15, 163.97, 163.30, 149.60, 148.47, 137.55, 131.87, 128.88, 128.31, 128.20, 119.66, 113.82, 111.42, 102.24, 96.35, 95.51, 78.95, 70.39, 56.16, 42.57; HRMS calcd for C23H20O6 392.1260, found 392.1264.
8b (8.96 g):收率44%. m.p. 187~189 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 12.15 (s, 1H, OH), 10.80 (s, 1H, OH), 7.45 (d, J=7.2 Hz, 2H, ArH), 7.39 (t, J=7.3 Hz, 2H, ArH), 7.33 (t, J=7.1 Hz, 1H, ArH), 7.16 (s, 1H, ArH), 7.05 (d, J=8.3 Hz, 1H, ArH), 7.01 (d, J=8.0 Hz, 1H, ArH), 5.91 (dd, J=7.6, 2.0 Hz, 2H, ArH), 5.48 (dd, J=12.7, 2.8 Hz, 1H, 2-H), 5.10 (s, 2H, OCH2Ar), 3.80 (s, 3H, OCH3), 3.44~3.20 (m, 1H, 3-H), 2.72 (dd, J=17.1, 2.8 Hz, 1H, 3-H); 13C NMR (101 MHz, DMSO-d6) δ: 196.69, 167.15, 163.97, 163.30, 149.60, 148.47, 137.54, 131.87, 128.88, 128.31, 128.20, 119.66, 113.82, 111.41, 102.24, 96.35, 95.51, 78.95, 70.39, 56.16, 42.57; HRMS calcd for C23H20O6 392.1260, found 392.1264.
3.2.4 2-[4-(苄氧基)-3-甲氧基苯基]-5, 7-双(甲氧基甲氧基)苯并二氢吡喃-4-酮(7)的合成
将6 (10.09 g, 0.02 mol)和无水乙酸钠(8.04 g, 0.08 mol)溶于乙醇400 mL中, 加入水40 mL, 加热回流8 h.冷却至室温, 有大量原料析出, 回收原料6 4.04 g.加入200 mL水淬灭反应, 二氯甲烷萃取(300 mL×2), 合并有机相, 无水硫酸钠干燥, 减压蒸除溶剂得黄色油状物, 硅胶柱层析分离[洗脱剂: V(石油醚):V(乙酸乙酯)=3:1], 得白色固体7[9] 4.40 g, 收率46%. m.p. 100~103 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.44 (d, J=7.3 Hz, 2H, ArH), 7.37 (t, J=7.4 Hz, 2H, ArH), 7.30 (t, J=7.2 Hz, 1H, ArH), 7.00 (s, 1H, ArH), 6.93~6.87 (m, 2H, ArH), 6.43 (d, J=2.2 Hz, 1H, ArH), 6.39 (d, J=2.2 Hz, 1H, ArH), 5.33 (dd, J=13.3, 2.6 Hz, 1H, 2-H), 5.30~5.25 (m, 2H, OCH2O), 5.17 (d, J=4.0 Hz, 4H, OCH2O, OCH2Ar), 3.93 (s, 3H, OCH3), 3.53 (s, 3H, OCH3), 3.47 (s, 3H, OCH3), 3.02 (dd, J=16.5, 13.4 Hz, 1H, 3-H), 2.76 (dd, J=16.5, 2.7 Hz, 1H, 3-H); 13C NMR (CDCl3, 150 MHz) δ: 189.24, 164.50, 163.25, 159.58, 149.91, 148.52, 136.97, 131.73, 128.58, 127.90, 127.24, 118.70, 113.95, 109.98, 107.37, 98.18, 97.46, 95.07, 94.10, 79.08, 71.07, 56.55, 56.46, 56.12, 45.73; HRMS calcd for C27H28O8 480.1784, found 480.1780.
3.2.1 2, 4, 6-三羟基苯乙酮(3)的合成
将间苯三酚(2)(100.09 g, 0.80 mol)、无水三氯化铝(426.71 g, 3.20 mol)和二氯甲烷500 mL依次加入反应容器中, 室温搅拌下缓慢滴加硝基甲烷500 mL, 滴毕继续搅拌30 min, 滴加乙酰氯(70 mL, 0.98 mol), 反应19 h.将反应液倾入冰水2000 mL中, 乙酸乙酯萃取(1000 mL×2), 合并有机相, 饱和食盐水1000 mL洗涤, 无水硫酸钠干燥.减压蒸除溶剂得土黄色固体, 加入水4000 mL加热溶解, 加入活性炭10.14 g回流10 min, 趁热过滤, 冷却后析出淡黄色针状结晶, 转移至冰水浴搅拌30 min, 过滤、水洗, 滤饼烘干得淡黄色固体3[6]80.64 g, 收率60%. m.p. 215~217 ℃; 1H NMR (DMSO-d6, 600 MHz) δ: 12.20 (s, 2H, OH), 10.34 (s, 1H, OH), 5.79 (s, 2H, ArH), 2.53 (s, 3H, COCH3); 13C NMR (DMSO-d6, 150 MHz) δ: 202.92, 165.22, 164.76, 104.50, 94.99, 32.79; HRMS calcd for C8H8O4 168.0423, found 168.0417.
-
-
[1]
曹朵, 翁志洁, 李建其, 杨培明, 何泉泉, 成亮, 孔德云, 中草药, 2015, 46, 1562. doi: 10.7501/j.issn.0253-2670.2015.10.027Cao, D.; Weng, Z.-J.; Li, J.-Q.; Yang, P.-M.; He, Q.-Q.; Cheng, L.; Kong, D.-Y. Chin. Tradit. Herb. Drugs 2015, 46, 1562 (in Chinese). doi: 10.7501/j.issn.0253-2670.2015.10.027
-
[2]
上海槲寄生研究协作组, 中国医药工业杂志, 1977, 3, 39.Shanghai Viscum Group. Chin. J. Pharm. 1977, 3, 39 (in Chinese).
-
[3]
孔德云, 罗思齐, 李惠庭, 雷兴翰, 药学学报, 1988, 23, 593.Kong, D.-Y.; Luo, S.-Q.; Li, H.-T.; Lei, X.-H. Acta Pharm. Sin. 1988, 23, 593 (in Chinese).
-
[4]
Yang, L.-Y.; Lin, J.; Zhou, B.; Liu, Y.-G.; Zhu, B.-Q. Nat. Prod. Res. 2016, 25, 1.
-
[5]
赵云丽, 马铭研, 高晓霞, 刘涛, 于志国, 毕开顺, 色谱, 2006, 24, 479. doi: 10.3321/j.issn:1000-8713.2006.05.012Zhao, Y.-L.; Ma, M.-Y.; Gao, X.-X.; Liu, T.; Yu, Z.-G.; Bi, K.-S. Chin. J. Chromatogr. 2006, 24, 479 (in Chinese). doi: 10.3321/j.issn:1000-8713.2006.05.012
-
[6]
Wu, L.; Luo, J.; Zhang, Y.-L.; Zhu, M.-D.; Wang, X.-B.; Luo, J.-G.; Yang, M.-H.; Yu, B.-Y.; Yao, H.-Q.; Dai, Y.; Guo, Q.-L.; Chen, Y.-J.; Sun, H.-B.; Kong, L.-Y. Tetrahedron Lett. 2015, 56, 229. doi: 10.1016/j.tetlet.2014.11.075
-
[7]
Zhang, B.-X.; Duan, D.-Z.; Ge, C.-P.; Yao, J.; Liu, Y.-P.; Li, X.-M.; Fang, J.-G. J. Med. Chem. 2015, 58, 1795. doi: 10.1021/jm5016507
-
[8]
Van, S. N.; Dong, L.-P.; Wang, S.-C.; Wang, Q.-A. Eur. J. Org. Chem. 2015, 10, 2297
-
[9]
Chao, S.-W.; Su, M.-Y.; Chiou, L.-C.; Chen, L.-C.; Chang, C.-I; Huang, W.-J. J. Nat. Prod. 2015, 78, 1969. doi: 10.1021/acs.jnatprod.5b00324
-
[10]
Yang, J.-H.; Zuo, W.-B.; Guo, D.-D.; Luo, J.-S.; Huang, W.-Q. Chin. Chem. Lett. 2012, 23, 1375. doi: 10.1016/j.cclet.2012.10.012
-
[11]
Zalihe, H.; Benjamin, C.; Allison, M. H.; Jason, Q. D. G.; Ian, E. W.; Spencer, J. W. Carbohydr. Res. 2010, 345, 2079. doi: 10.1016/j.carres.2010.07.029
-
[12]
蔡双莲, 吴峥, 吴进, 汪秋安, 单杨, 有机化学, 2012, 32, 560. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341121.shtmlCai, S.-L.; Wu, Z.; Wu, J.; Wang, Q.-A.; Shan, Y. Chin. J. Org. Chem. 2012, 32, 560 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341121.shtml
-
[13]
汪秋安, 吴峥, 刘莉, 邹亮华, 罗茗, 有机化学, 2010, 30, 1682. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract339373.shtmlWang, Q.-A.; Wu, Z.; Liu, L.; Zou, L.-H.; Luo, M. Chin. J. Org. Chem. 2010, 30, 1682 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract339373.shtml
-
[1]
-
表 1 化合物6分子内Michael加成反应条件筛选
Table 1. Condition screenings of intramolecular michael addition of compound 6

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 2011
- HTML全文浏览量: 446


 下载:
下载:


 下载:
下载:

