 图式 1
1-溴代炔烃的合成
Scheme1.
Synthesis of 1-bromo-alkynes
图式 1
1-溴代炔烃的合成
Scheme1.
Synthesis of 1-bromo-alkynes

Citation: Zhao Ming, Ji Yuan. Progress on Synthetic Applications of 1, 1-Dibromo-1-alkenes[J]. Chinese Journal of Organic Chemistry, 2018, 38(2): 401-415. doi: 10.6023/cjoc201708034

1, 1-二溴-1-烯烃在有机合成中的研究进展
-
关键词:
- 1, 1-二溴-1-烯烃
- / 碳-溴键
- / 交叉偶联
- / 烯烃
- / 稠环化合物
English
Progress on Synthetic Applications of 1, 1-Dibromo-1-alkenes
-
Key words:
- 1, 1-dibromo-1-alkene
- / C-Br bond
- / cross coupling
- / alkenes
- / fused aromatic compounds
-
1, 1-二溴-1-烯烃同时具有碳-碳双键和两个活泼的碳-溴键, 其中反式C—Br键的活性较高; 其独特的分子结构特征使其能通过多种偶联反应来制备多取代烯烃和稠环化合物等. 1, 1-二溴-1-烯烃在碱性介质中可以原位生成溴代炔烃和端炔, 使其可以作为末端炔烃的前体来合成内炔、炔胺和炔醚等, 且比后者更具成本优势.此外, 1, 1-二溴-1-烯烃也可以通过串联反应合成吲哚、唑类以及其他含杂原子稠环化合物等.
1, 1-二溴-1-烯烃在有机合成中被广泛研究, 亦因其合成过程简单. Wittig[1]反应是制备1, 1-二溴-1-烯烃最经典且常用的手段(Eq. 1).该方法使用CBr4和PPh3在0 ℃的CH2Cl2溶剂中搅拌生成磷叶立德, 再加入醛即可制得1, 1-二溴-1-烯烃, 且产率较高. Lautens课题组[2]使用P(Oi-Pr)3代替PPh3, 更适用于具有空间位阻的底物酮.此外, Yan等[3]使用CHBr3/Mg/TiCl4体系将二溴甲烯化反应应用于烯醇化且空间位阻较大的酮(Eq. 2).此外, Nenajdenko[4]、Taylor[5]和Marciniec等[6]分别报道了制备1, 1-二溴-1-烯烃的其他方法.
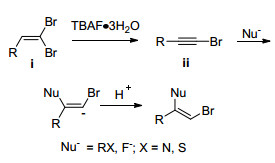
1 溴代炔烃和端炔的合成
1.1 溴代炔烃的合成
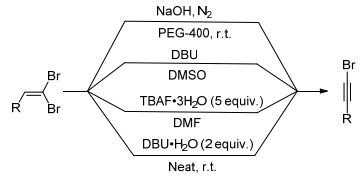
末端炔烃的溴代反应是制备溴代炔烃的传统方法.本文将介绍几种由1, 1-二溴-1-烯烃经消除反应制备溴代炔烃的方法. 1986年, Alper等[7]使用NaOH/PEG-400体系促使1, 1-二溴-1-烯烃在室温下脱除一分子HBr, 得到溴代炔烃. 1994年, Ratovelomanam等[8]报道了1, 8-二氮杂二环十一碳-7-烯/二甲亚砜(DBU/DMSO)体系下的消除反应, 5~25 min即可生成溴代炔烃; 但此体系需要的碱量很大, 为底物的100倍. 2009年, Mori课题组[9]报道了TBAF·3H2O作为一种高效的碱促进二溴烯烃的消除. 2017年, Sharma等[10]使用新鲜制备的DBU·H2O在无溶剂条件下实现了溴代炔烃的合成(Scheme 1).
1.2 末端炔烃的合成
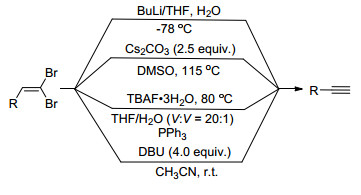
Corey-Fuchs[1a]反应是由醛合成末端炔烃的重要方法:醛与Wittig试剂反应生成1, 1-二溴-1-烯烃; 后者在BuLi的作用下发生消除和还原反应生成末端炔烃. 2010年, 本课题组[11]报道了Cs2CO3促进的1, 1-二溴-1-烯烃合成末端炔烃的方法(Scheme 2).该反应避免使用活泼的BuLi, 且产率很高. 2015年, Liu等[12]报道了TBAF·3H2O促使的末端炔烃的合成.该反应在THF/ H2O混合溶剂中进行, 产率高达67%~94%.同年, Doddi等[13]发现DBU在CH3CN中可将二溴烯烃转化为末端炔烃.该反应在室温下进行, 不仅适用于芳环和杂环取代的1, 1-二溴-1-烯烃, 而且适用于有机金属试剂和共轭烯烃.
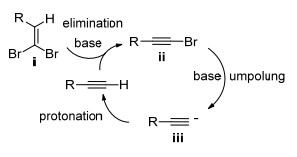
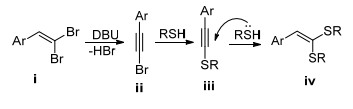
碱促进的制备末端炔烃的反应可能的机理如Scheme 3所示:二溴烯烃底物ⅰ在碱的作用下消除一分子HBr生成溴代炔烃ⅱ; 中间体ⅱ继续发生脱溴反应生成炔负离子ⅲ; 后者夺取反应介质中的质子生成目标产物末端炔烃.
2 溴代烯烃的合成
2.1 Z-溴代烯烃的合成
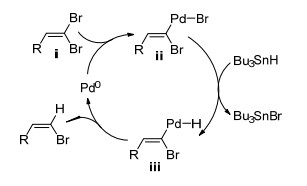
Z-烯烃属于动力学产物, 具有热力学不稳定性. Z-溴代烯烃和有机金属试剂可以通过偶联反应选择性地合成Z-烯烃. 1998年, Uenishi等[14]报道了Pd(PPh3)4催化1, 1-二溴-1-烯烃的选择性还原以制备Z-溴代烯烃(Eq. 3).
该反应使用Bu3SnH为还原剂, 适用于杂环、脂肪烯烃、共轭烯烃和共轭烯炔等底物.反应机理如Scheme 4所示:零价钯对反式C—Br键进行选择性地氧化加成, 生成中间体ⅱ; ⅱ与有机锡发生转金属化生成中间体ⅲ; ⅲ还原消除给出最终产物(Z)-1-溴-1-烯烃.
2001年, Figadère等[15]报道了Fe(Ⅲ)催化下2-芳基-1, 1-二溴-1-烯烃的还原以制备Z-溴代烯烃(Eq. 4).该方法使用Grignard试剂作还原剂, 产率最高为84%.
2011年, Xu等[16]发现1, 1-二溴-1-烯烃与硫醇或胺在TBAF·3H2O作用下得到对应的Z-2-溴乙烯基硫醚或胺(Eq. 5).该反应无需添加金属催化剂, 生成硫醚的产率明显高于胺. 2016年, Zhao课题组[17]报道了2-溴-1-氟乙烯基苯化合物的合成(Eq. 6).该方法使用TBAF·3H2O作为F源, 主要生成Z-型产物(Z/E>70/1).
由TBAF·3H2O促进的还原机理如Scheme 5所示:二溴烯烃ⅰ在碱性条件下脱除一分子HBr生成溴代烯烃ⅱ; 后者与亲核试剂发生加成而后经质子化生成Z-溴代烯烃.
2.2 E-溴代烯烃的合成
1981年, Hirao等[18]报道了1, 1-二溴-1-乙烯在亚磷酸二甲酯/三乙胺体系下发生选择性还原, 得到(E)-β-溴代苯乙烯(Eq. 7). 2001年, Ranu等[19]报道了铟催化二溴烯烃的还原, 但E-溴代烯烃产物的选择性不高(Eq. 8).随后, Kuang课题组[20]用(EtO)2P(O)H/EtONa/EtOH还原体系, 在微波诱导下选择性地合成出一系列(E)-β-溴代烯烃.
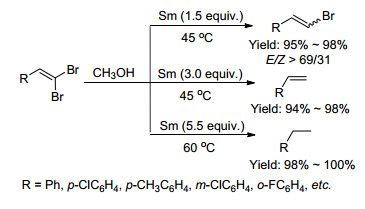
2003年, Wang等[21]报道了在甲醇溶剂中放射性元素钐促进的二溴烯烃的化学选择性还原(Scheme 6).他们发现通过控制钐的用量, 可以分别合成出E-溴代烯烃、烯烃和烷烃. 2004年, Aoyama等[22]用LiAlH4-EtOAc (V: V=1: 1)还原体系合成出E-溴代烯烃.该反应对芳基底物具有很好的选择性, 而对烷基底物的选择性较差(Eq. 9).同年, Lu等[23]用三氟甲基取代的1, 1-二溴-1-烯烃为底物, 使用BuLi作为催化剂, 控制地合成出E-溴代烯烃.
3 C—C键的构建
过渡金属催化的偶联反应是构建C—C键和拓展有机分子骨架的主要手段.二溴烯烃中包含一对C—Br键, 使其能和多种有机金属试剂发生交叉偶联生成多取代烯烃和稠环化合物.此外, 二溴烯烃在碱性条件下作为溴代炔烃和末端炔烃的前体, 能用于合成内炔化合物.
3.1 多取代烯烃的合成
1999年, Shen课题组[24]报道了Pd2(dba)3催化1, 1-二溴-1-烯烃与有机锡试剂的Stille[25]偶联反应, 合成出(Z)-1-芳(烯)基-1-溴代烯烃(Eq. 10).随后, 此课题组使用芳基硼酸[26]作为偶联试剂, 通过Suzuki-Miyaura反应[27]得到类似产物(Eq. 11). 2008年, Riveiros等[28]报道了Pd催化二溴烯烃与有机铟试剂发生偶联反应分别合成了Z-溴代烯烃和三取代烯烃(Eqs. 12, 13).
2004年, Kabalka等[29]报道了1, 1-二溴-1-烯烃与炔基三氟硼酸钾盐发生Suzuki-Miyaura偶联生成交叉共轭的烯二炔化合物(Eq. 14). 2006年, Ramana等[30]报道了使用二溴亚甲基芴与芳基硼酸发生双侧的Suzuki-Miyaura偶联反应, 生成二芳基亚甲基芴, 产率为44%~88% (Eq. 15). 2010年, Chen等[31]利用合成的非对称"钳钯"配合物催化1, 1-二溴-1-烯烃在水相和空气中发生Suzuki-Miyaura偶联反应, 制备出一系列多取代烯烃.此外, Oh[32]、Mao[33]和Voyer等[34]也分别报道了Pd催化下1, 1-二溴-1-烯烃与芳基硼酸的偶联反应以合成多取代烯烃.
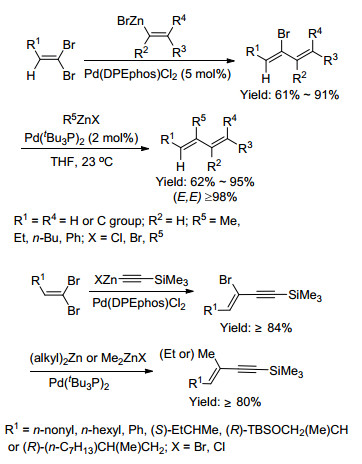
2000年, Ogasawara等[35]报道了Pd催化下2-苯基-1, 1-二溴-1-烯烃与乙烯基氯化锌的反应, 合成出2-溴-1, 3-二烯(Eq. 16). 2004年, Negishi等[36, 37]将二溴烯烃与两种有机锌试剂发生串联的交叉偶联反应, 立体选择性地合成了反式共轭烯烃和共轭烯炔(Scheme 7).
2007年, Uenishi等[38]报道了1, 1-二溴-1-烯烃与格氏试剂反应制备出1, 1-二(三甲基硅甲基)乙烯化合物, 产率高达88~98%(Eq. 17).
3.2 内炔的合成
内炔化合物是一种重要的有机合成原料和中间体, 由二溴烯烃制备内炔具有一定的成本优势且操作简便.此外, 溴代炔烃亦可以与杂环上C—H键通过偶联反应合成出多种类型的炔烃. 1999年, Shen课题组[24]首先报道了Pd催化1, 1-二溴-1-烯烃与有机锡试剂发生Stille[25]偶联反应, 随后消除一分子HBr得到内炔(Eq. 18). 2004年, Yan等[39]使用Ni/KF/Al2O3/CuI体系, 通过微波辐射, 在无溶剂条件下实现了由1, 1-二溴-1-烯烃与碘苯或硝基溴苯发生类Sonogashira反应合成内炔(Eq. 19).
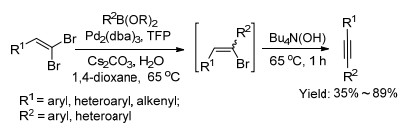
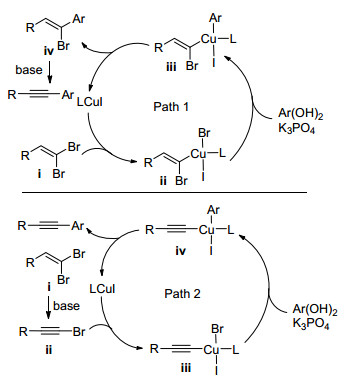
2008年, Chelucci等[40]受到Shen等[26]的启发, 研究了Pd催化1, 1-二溴-1-烯烃与有机硼试剂"一锅法"合成内炔的方法(Scheme 8).该反应经历两个过程: (1)二溴烯烃与硼酸酯发生Suzuki-Miyaura偶联反应生成1-溴-1-烯烃; (2)溴代烯烃发生消除反应生成内炔.随后, Schmidt等[41]也报道了Pd(OAc)2和咪唑盐体系催化下芳基硼酸经串联反应制备内炔的方法. 2012年, Tan课题组[42]首次报道了使用经济易得的CuI催化1, 1-二溴-1-烯烃通过Suzuki-Miyaura偶联制备内炔的方法(Eq. 20).该反应使用8-羟基喹啉为配体, K3PO4为碱, 在乙醇中得到产物, 产率在75%以上.此外, Mao等[43]也报道了CuI催化1, 1-二溴-1-烯烃与有机硼酸反应生成内炔类化合物的方法.
铜催化的制备内炔的反应机理如Scheme 9所示.在Path 1中, 二溴烯烃ⅰ在CuI的催化下先与有机硼试剂发生单侧Suzuki-Miyaura偶联反应得到中间产物ⅳ; ⅳ在碱性环境中脱除一分子HBr得到内炔.在Path 2中, 二溴烯烃ⅰ发生消除反应生成溴代炔烃ⅱ; 后者在一价铜的催化下发生Suzuki-Miyaura偶联生成内炔.
2010年, Rao课题组[44]使用三芳基铋与1, 1-二溴-1-烯烃反应得到内炔(Eq. 21).该反应适用于烷基、芳基、杂环芳基取代的二溴烯烃, 且反应速度较快, 产率为60%~88%.此后, 此课题组[45]将此体系拓展到二溴代1, 3-二烯化合物, 在Pd的催化下合成出多种共轭烯炔.
2015年, Berciano等[46]报道了铜催化下杂环化合物的C—H键活化, 以1, 1-二溴-1-烯烃作为炔烃的前体, 通过偶联反应得到内炔(Eq. 22).该方法适用底物范围广, 包括噁唑、苯并噁唑、苯并噻唑、1, 2, 4-三唑和N-苄基-6-氯嘌呤.随后, Piguel等[47]首次报道使用二溴烯烃与3H-咪唑并[4, 5-b]吡啶化合物发生C2直接炔基化生成2-炔基-3H-咪唑并[4, 5-b]吡啶及其衍生物(Eq. 23).产物结构极具药物分子设计价值, 但此反应不适合用于氰基取代基的二溴烯烃.
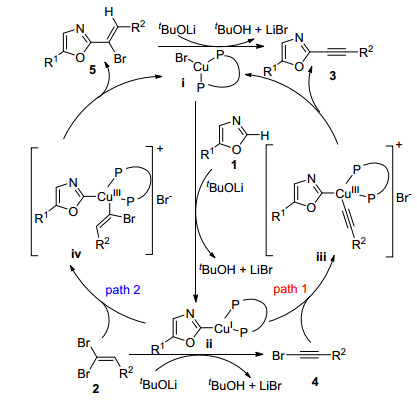
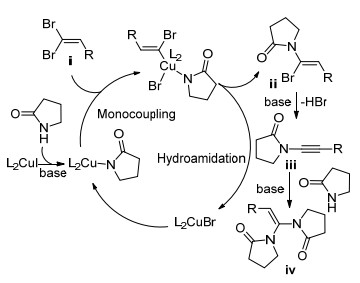
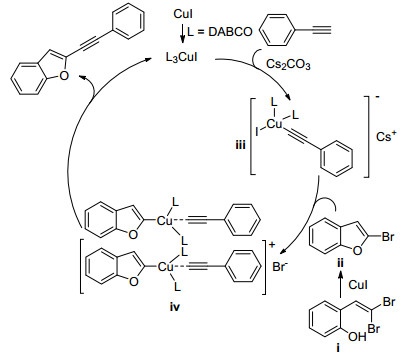
Berciano等[46]报道的唑类与二溴烯烃的偶联反应机理如Scheme 10所示:噁唑在碱性条件下发生去质子化, 同时与CuBr作用生成配合物ⅱ; ⅱ与炔溴(path 1)或二溴烯烃(path 2)发生氧化加成生成Cu(Ⅲ)络合物ⅲ或ⅳ.随后, ⅲ经过还原消除给出目标产物3, 同时实现Cu(Ⅰ)催化剂的再生.在path 2中, 中间体ⅳ发生还原消除生成三取代的烯烃5; 5发生反式氢-溴键的消除生成目标产物3.由于烯烃5从未被成功地分离出来, 而1, 1-二溴-1-烯烃在碱性条件下易于生成溴代炔烃, 噁唑的直接炔基化反应很可能是通过path 1进行的.
2012年, Das等[48]报道了1, 3, 4-噁二唑α位C—H键活化, 与1, 1-二溴-1-烯烃反应直接生成内炔(Eq. 24).该反应使用PEG-400为溶剂, CuBr为催化剂, 产率高达73%~86%. 2014年, Shen等[49]报道了钯催化下2-芳基-1, 1-二溴-1-烯烃与中氮茚C3位的偶联反应(Eq. 25).
3.3 1, 3-二炔的合成
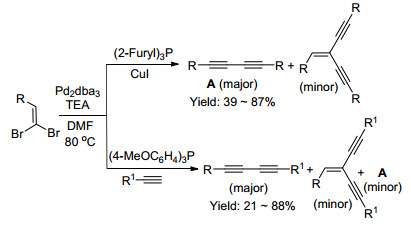
2000年, Shen课题组[50]报道了Pd催化合成1, 3-二炔的方法(Scheme 11).在合成对称1, 3-二炔时需要添加缺电子的三呋喃基膦配体, 并加入CuI促进反应.不对称的1, 3-二炔的合成(Sonogashira[51]偶联反应)则需使用富电子的膦配体. 2001年, Lee等[52]报道了钯和铜协同催化的2-芳基-1, 1-二溴-1-烯烃与包含羟基的端炔发生偶联以制备不对称的1, 3-二炔.此外, Rao课题组[53]报道了Pd催化下二溴烯烃的自偶联反应.
2005年, Yan等[54]报道了tBuOK促进的1, 1-二溴-1-烯烃通过自偶联生成对称1, 3-二炔的方法(Eq. 26). 2010年, Evano等[55]使用CuI和N, N-二甲基乙烷-1, 2-二胺催化体系合成出对称1, 3-二炔, 且反应适用于共轭烯烃(Eq. 27). Kuang课题组[56]也报道了类似的CuI催化的制备1, 3-二炔的方法.
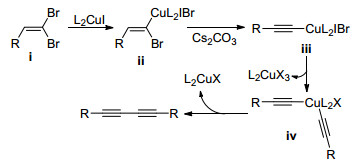
Evano等[55]认为铜催化的二溴烯烃自偶联反应的机理如Scheme 12所示: CuI首先插入1, 1-二溴-1-烯烃ⅰ上活性较高的反式C—Br键产生中间体ⅱ; 在高度偶极的溶剂如DMF中, Cs2CO3会促使中间体ⅱ消除HBr生成炔基铜ⅲ; 此后, 两分子炔基铜之间进行配体交换生成二炔基铜中间体ⅳ; ⅳ经还原消除生成最终产物对称1, 3-二炔.
2013年, Fu等[57]开发了一种CuI催化的高效制备不对称1, 3-二炔的方法(Eq. 28).反应使用1, 1-二溴-1-烯烃与炔基羧酸钾, 经脱羧和偶联反应高选择性的制备了一系列不对称的1, 3-二炔.
3.4 成环反应
2010年, Wu等[58]报道了Pd催化下1-(2, 2-二溴乙烯基)-2-炔基苯与芳基硼酸经串联反应制备1-亚甲基茚的方法(Eq. 29).该反应在室温下进行, 且产率较高.随后, Lautens课题组[59]报道了邻位烯基取代的2-芳基-1, 1-二溴烯烃与芳基硼酸发生串联的Suzuki-Miyaura偶联和Heck反应, 专一地合成出亚甲基茚(Eq. 30).文中指出二溴烯烃所连芳环上含有富电子时产率更高; 配体的选择也对反应的选择性起着至关重要的作用. 2011年, Lautens课题组[60]将类似的串联反应引入到噻吩环, 制备出含硫稠环化合物(Eq. 31).
4 C—N偶联和环化反应
4.1 炔胺的合成
2009年, Evano课题组[61]报道了CuI催化1, 1-二溴-1-烯烃参与的合成炔酰胺的方法(Eq. 32).该反应使用酰胺作为亲核试剂, 适用于芳香族、脂肪族和乙烯基取代的二溴烯烃.随后, 此课题组[61b, 62]报道了二溴烯烃与过量的酰胺反应高效地合成出缺电子的乙烯酮缩胺(Eq. 33).
Evano等合成炔酰胺或乙烯酮缩胺的反应机理如Scheme 13所示:二溴烯烃ⅰ发生单侧C—N键偶联选择性地生成中间体ⅱ; ⅱ在碱性条件下脱除一分子HBr生成炔酰胺ⅲ; 内酰胺对ⅲ进行区域选择性加氢酰胺化生成乙烯酮缩胺ⅳ.
2011年, Das等[63]首次报道了1, 1-二溴-1-烯烃与咪唑或吡唑发生的C—N键偶联反应, 得到杂芳基内炔, 产率为66%~85% (Eq. 34).随后, Shang等[64]报道了一种简单高效的CuI催化(苯并)咪唑与二溴烯烃反应合成N-炔基咪唑类化合物的方法, 拓展了咪唑内炔的合成.
4.2 成环反应
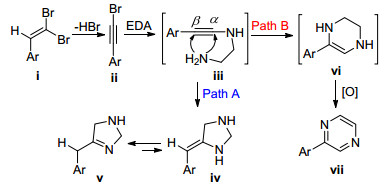
含氮杂环化合物种类繁多, 且通常具有生物活性. 1, 1-二溴-1-烯烃分子内含有两个C—Br键, 使其易于发生C—N偶联反应从而合成含氮杂环. 2004年, Kim等[65]报道了在乙二胺(EDA)溶剂中使用2-芳基-1, 1-二溴-1-烯烃制备2-芳甲基咪唑啉的方法(Eq. 35).文中指出, 当溴代烯烃底物芳环上含有吸电子基时产率更高.
此反应的机理如Scheme 14所示: 1, 1-二溴烯烃ⅰ在胺的作用下脱除一分子HBr生成溴代炔烃ⅱ; 后者继续与EDA反应生成炔胺ⅲ; 中间体ⅲ经分子内的5-exo闭环生成ⅳ(Path A); ⅳ经异构化生成最终产物咪唑啉ⅴ.在Path B中, ⅲ通过6-endo闭环生成四氢吡嗪ⅵ, 其在空气中被氧化成稳定的副产物吡嗪vii.
2006年, Lautens课题组[66]利用2-芳基-1, 1-二溴烯烃分子内的偶联反应和分子间的Heck反应合成了2-取代吲哚(Eq. 36). 2008年, 此课题组[67]报道了使用Pd(OAc)2/S-Phos/K3PO4·H2O催化体系将邻二溴乙烯基苯胺与有机硼反应得到2, 3-二取代吲哚化合物(Eq. 37).同年, Alper等[68]报道了Pd催化下二溴烯烃在碱N, N-二异丙基乙胺(DIPEA)的作用下与CO合成2-羧酸吲哚化合物(Eq. 38).此外, Shen课题组[69]报道了邻二溴乙烯基苯胺发生分子内环化生成2-溴代吲哚.
2008年, Shen课题组[70]报道了DABCO/NMP体系中1, 1-二溴-1-烯烃与邻苯二胺制备苯并咪唑的新方法(Eq. 39).随后, 此课题组使用2-氨基苯酚[71]或2-氨甲基吡啶[72]来代替邻苯二胺, 分别合成出苯并噁唑(Eq. 40)和咪唑并[1, 5-a]吡啶化合物(Eq. 41).
2008年, Xu等[73]利用1, 1-二溴-1-烯烃的结构特点, 通过消除、酰胺加成和偶联的串联反应, 一锅法合成了(Z)-3-芳基亚甲基异吲哚啉-1-酮(Eq. 42). 2009年, Taylor等[74]报道了β, β-二溴乙烯基酮通过肼缩合和Suzuki-Miyaura偶联的串联反应一锅法制备出1, 3, 5-三取代吡唑(Scheme 15).
2010年, Bao等[75]报道了一锅法制备嘧啶并[1, 6-a]吲哚-1-(2H)-酮的方法(Eq. 43).该反应经历了溴代烯烃与异氰酸酯的亲核加成、C—N偶联和C—H键活化, 产率为61%~87%.随后, 此课题组[76]使用相同的催化体系合成了不对称2, 2'-二吲哚及其衍生物(Eq. 44).
2010年, Chen等[77]报道了CuI催化的1, 1-二溴-1-烯烃与2-巯基咪唑反应制备咪唑并[2, 1-b]噻唑衍生物的方法(Eq. 45).该反应适用范围广, 产率高.然而, 当R为烷基时会同时得到2-和3-取代产物.
2014年, Perumal等[78]报道了CuI催化1, 1-二溴乙酰苯胺与磺酰胺合成2-氨基吲哚、四氢吲哚并[1, 2-a]喹唑啉和吲哚并[1, 2-a]喹唑啉的方法(Scheme 16).该反应条件温和, 底物适用性好, 产率高.最近, Ghorai等[79]还报道了二溴烯烃与活化的氮丙啶开环反应后再进行C—N成环反应得到咪唑并吲哚的合成路线.
5 C—O/C—S键的构建
5.1 C—O键的构建
二溴烯烃分子中包含的C—Br键可以通过水解和偶联反应等制备羰基化合物和烯(炔)基醚. 1986年, Alper等[7]利用零价Pd催化1, 1-二溴-1-烯烃在PEG-400中发生双C—Br键的水解反应合成羧酸(Eq. 46). 2002年, Shen课题组[80]使用二溴烯烃与脂肪胺在DMF/H2O溶剂中合成酰胺(Eq. 47).随后, Xu等[81]报道了二溴烯烃与芳基伯胺在Pd(OAc)2/Xantphos催化体系下酰胺化和水解串联反应, "一锅法"制备出N-芳基酰胺化合物(Eq. 48).该方法适用多种二溴烯烃底物, 对各种基团都有很好的兼容性.
2003年, Lei等[82]报道了1, 1-二溴-1-烯烃在近临界水中和Zn粉的反应, 在275 ℃下得到甲基酮, 产率为48%~88% (Eq. 49). 2011年, 本课题组[83]报道了2-芳基-1, 1-二溴-1-烯烃与醋酸钾在FeCl3/acac催化体系下合成α-乙酰氧基芳基乙酮(Eq. 50).
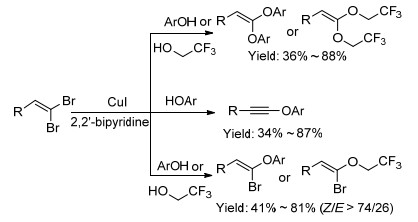
2012年, Evano课题组[61b, 84]使用CuI/2, 2'-联吡啶催化体系控制合成出烯酮缩醛、炔醚和溴代烯基醚(Scheme 17).该方法首次使用酚或三氟乙醇选择性地合成出溴代乙烯基醚, 产率为41~81%, 且产物以顺式为主.
5.2 C—S键的构建
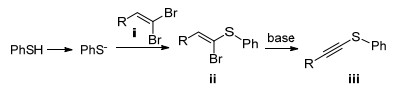
1979年, Murahashi等[85]报道了1, 1-二溴-1-烯烃与PhSLi在Pd(PPh3)4的催化下合成1, 1-二苯基2-苯乙烯基硫醚, 产率为96% (Eq. 51). 1986年, Cristau等[86]使用Ni催化剂实现了烯基硫醚的制备(Eq. 52). 2011年, Kuang课题组[87]报道了DBU/DMSO体系中二溴烯烃和硫酚反应制备二芳基乙烯基硫醚(Eq. 53).此反应在室温下进行, 产率可达63%~96%.
Kuang等[87]提出的机理如Scheme 18所示:在碱性环境下, 二溴烯烃ⅰ发生消除反应生成溴代炔烃ⅱ; 硫酚和ⅱ发生亲核取代反应生成中间体ⅲ; 硫酚对ⅲ进行亲核加成给出目标产物ⅳⅳ.
2012年, Pan等[88]报道了Cs2CO3/DMSO体促进的1, 1-二溴-1-烯烃与硫酚反应制备炔基硫醚, 产物的产率为38%~86% (Eq. 54).
其可能的反应机理Scheme 19所示:硫酚在碱性条件下生成的酚硫负离子进攻二溴烯烃ⅰ生成中间体ⅱ; ⅱ脱除一分子HBr得到最终产物ⅲ.
2017年, Perin等[89]报道了1-(2, 2-二溴乙烯基)-2-丁基硒基苯作为炔烃前体与苯硫酚反应生成1-(2-硫基乙炔基)-2-丁基硒基苯的反应过程, 产率73%~93% (Eq. 55). 1-(2-硫基乙炔基)-2-丁基硒基苯在I2作用下会发生自身成环生成苯并[b]硒酚类, 这是一种具有药物活性和有机半导体性质的新材料.
5.3 成环反应
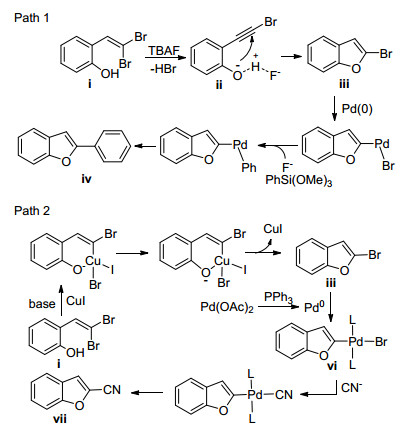
2009年, Lautens课题组[90]报道了2-(2, 2-二溴乙烯基)苯(硫)酚在CuI催化下发生分子内Ullmann反应生成2-溴苯并呋喃(噻吩), 收率较高(Eq. 56). 2011年, Wang课题组[91]使用类似底物实现了四丁基氟化铵(TBAF)促进的2-溴苯并噻吩(呋喃)的合成(Eq. 57).该方法条件温和, 无需添加过渡金属催化剂, 且产率极高.随后, 此课题组[92]又分别用硅烷和K4[Fe(CN)6]合成出2-苯基苯并呋喃(噻吩)(Eq. 58)和2-氰基苯并呋喃(噻吩)(Eq. 59).
Wang等[92]提出的合成2-取代苯并呋喃的反应机理如Scheme 20.在机理1中, 底物ⅰ在TBAF的存在下发生消除生成溴代炔烃ⅱ; 酚羟基对三键加成得到2-溴苯并呋喃ⅲ; ⅲ与苯基(三甲氧基)硅烷发生偶联反应, 通过氧化加成、转金属化和还原消除过程得到目标产物2-苯基苯并呋喃ⅳ.在机理2中, 底物ⅰ在CuI和碱的作用下发生分子内的Ullmann偶联生成2-溴代苯并呋喃ⅲ; 零价Pd与ⅲ发生氧化加成给出中间体ⅵ; ⅵ与CN-进行配体交换之后还原消除生成2-氰基苯并呋喃ⅶ.
2011年, Lan等[93]通过1, 1-二溴-1-烯烃分子内的C—X (X=S、O)偶联和唑类C—H键活化"一锅法"合成了杂芳基唑类化合物, 产率为56%~92% (Eq. 60).同年, Fan等[94]在Shen[71]和Mori[9]启发下发现TBAF·3H2O相比DABCO促进二溴烯烃发生脱除(HBr)反应的效果更好, 并将其应用于2-苄基苯并噁唑(噻唑)的合成(Eq. 61). Fan等[94]发现相同的反应体系在RuCl3催化作用下在空气中可以生成2-苯并噁唑(噻唑)芳基酮; 文中指出当R1为吸电子基时产物的产率更高(Eq. 62).
2013年, Liu等[95]报道了2-(2, 2-二溴乙烯基)苯酚和苯乙炔在CuI的催化下反应得到2-炔基苯并呋喃, 产率最高为90% (Eq. 63).此反应的机理如Scheme 21所示:二溴烯烃ⅰ在CuI和碱的作用下发生分子内的偶联反应生成2-溴代苯并呋喃ⅱ; 同时, 苯乙炔与CuI作用生成炔基铜ⅲ; ⅱ与ⅲ发生氧化加成形成Cu(Ⅲ)络合物ⅳ; 后者发生还原消除得到目标产物.
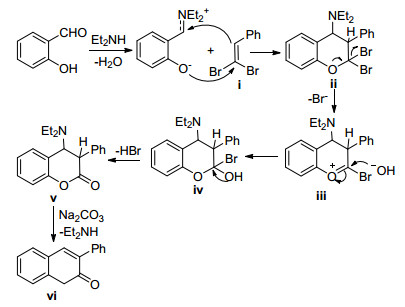
2014年, Zhuo等[96]首次使用2-芳基-1, 1-二溴-1-烯烃合成出香豆素化合物(Eq. 64).该研究发现, 混合碱体系Na2CO3/Et2NH可以有效促进底物与水杨醛快速反应.文中的机理如Scheme 22所示:水杨醛与二溴烯烃ⅰ在胺的作用下发生亲核加成生成中间体ⅱ; 后者消除一分子HBr产生中间体ⅲ; 亲核试剂OH-对ⅲ进行加成形成醚ⅳ; ⅳ在碱的存在下发生相继的两次消除反应形成目标产物ⅵ.
6 C—M的构建
6.1 C—P键的构建
2000年, Hayes等[97]最先报道了以1, 1-二溴-1-烯烃为原料合成炔基磷酸酯的方法.反应使用Pd(OAc)2/ dppf催化体系实现了C(sp)—P键的构建(Eq. 65). 2014年, Liu等[98]报道了Cs2CO3促进的炔基磷酸酯的制备方法(Eq. 66).该反应无需添加过渡金属催化剂, 适用底物范围广且产物产率高.
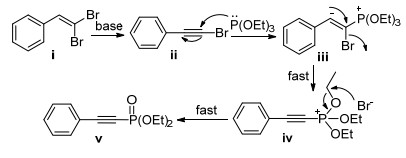
Liu等[98]提出的反应机理如Scheme 23所示:二溴烯烃i在Cs2CO3的作用下消除一分子HBr生成溴代炔烃ⅱ; 磷酸酯与ⅱ发生亲核加成生成季鏻盐ⅲ; 后者发生重排形成炔基鏻ⅳ; 反应体系中产生的Br-与季鏻盐ⅳ发生Michaelis-Arbuzov反应生成最终产物ⅴ.
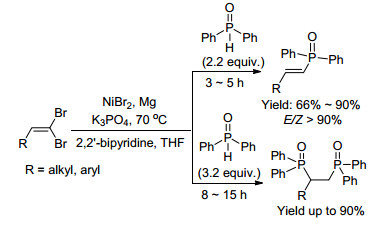
2011年, Evano课题组[99]以1, 1-二溴-1-烯烃与亚磷酸二异丙基酯为原料, 在CuI/DMEDA的催化作用下, 立体选择性地制备出E-烯基磷酸酯(Eq. 67). 2013年, Liu等[100]报道了在Ni-Mg双组份催化体系下, 控制性地合成了E-烯基氧膦或双膦氧化物(Scheme 24).
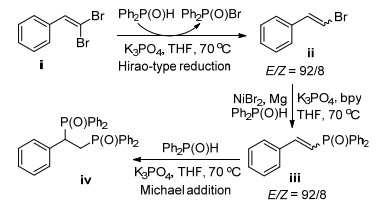
Liu等[100]认为合成磷化物的机理如Scheme 25所示, 反应首先经历了二溴烯烃ⅰ的Hirao-type还原生成E-溴代烯烃ⅱ; 后者与二苯基氧膦在Ni的催化下发生C-P偶联生成E-烯基氧膦ⅲ.过量的二苯基氧膦和ⅲ继续发生Micheal加成, 得到双(烷基二苯基)氧膦ⅳ.
6.2 C—B/Si/Se的构建
2001年, Hata等[101]报道了BuLi促进的1, 1-二溴-1-烯烃与双(频哪醇合)二硼或(二甲基苯基硅)-硼烷反应, 得到烯基硼(硅)试剂, 拓展了二溴烯烃在偶联反应中的应用(Eq. 68).
1986年, Cristau等[86]报道了(bipy)2NiBr2催化的1, 1-二溴-1-烯烃与苯硒酚钠盐反应得到1, 1-二苯硒醚-1-烯烃化合物, 产率高达70%~89% (Eq. 69). 2016年, Webber等[102]报道了NaBH4促进的的E-1-溴-1-芳硒-1-烯烃和1, 1-二苯硒醚-1-烯烃的选择性合成(Eq. 70).
7 展望
1, 1-二溴-1-烯烃已被广泛应用于合成烯烃、炔烃, 以及通过串联反应制备吲哚、苯并呋喃、苯并噻吩和唑类等稠环化合物.因其分子中存在两个活性不同的C—Br键, 二溴烯烃在多取代烯烃的立体选择性合成中也取得了较大进展.然而, 前期对于脂肪二溴烯烃的研究较少, 期望未来的工作致力于使用二溴烯烃构建更多样的环状化合物, 包括更具挑战性的单环化合物.此外, 通过分子内或分子间C—S(Se)键的形成来合成有机半导体目前还未被涉猎.由二溴烯烃制备有机金属试剂进而扩展其合成应用也是需要解决的一个研究方向.
-
-
[1]
(a) Corey, E. J. ; Fuchs, P. L. Tetrahedron Lett. 1972, 13, 3769.
(b) Desai, N. B. ; Mckelvie, N. ; Ramirez, F. J. Am. Chem. Soc. 1962, 84, 1745. -
[2]
Fang, Y. Q.; Lifchits, O.; Lautens, M. Synlett 2008, 413.
-
[3]
Bhorge, Y. R.; Chang, C. T.; Chang, S. H.; Yan, T. H. Eur. J. Org. Chem. 2012, 2012, 4805. doi: 10.1002/ejoc.v2012.25
-
[4]
Korotchenko, V. N.; Shastin, A. V.; Nenajdenko, V. G.; Balenkova, E. S. Org. Biomol. Chem. 2003, 1, 1906. doi: 10.1039/b303221c
-
[5]
Raw, S. A.; Reid, M.; Roman, E.; Taylor, R. J. K. Synlett 2004, 819.
-
[6]
Pawluc, P.; Hreczycho, G.; Walkowiak, J.; Marciniec, B. Synlett 2007, 2061.
-
[7]
Li, P.; Alper, H. J. Org. Chem. 1986, 51, 4354. doi: 10.1021/jo00373a005
-
[8]
Ratovelomana, V.; Rollin, Y.; Gebehenne, C.; Gosmini, C.; Perichon, J. Tetrahedron Lett. 1994, 35, 4777. doi: 10.1016/S0040-4039(00)76965-6
-
[9]
Okutani, M.; Mori, Y. J. Org. Chem. 2008, 74, 442.
-
[10]
Krishna Moodapelly, S.; Sharma, G. V. M.; Ramana Doddi, V. Adv. Synth. Catal. 2017, 359, 1535. doi: 10.1002/adsc.v359.9
-
[11]
Zhao, M.; Kuang, C. X.; Yang, Q.; Cheng, X. Z. Tetrahedron Lett. 2011, 52, 992. doi: 10.1016/j.tetlet.2010.12.071
-
[12]
Liu, S. H.; Chen, X. B.; Hu, Y. W.; Yuan, L. Q.; Chen, S. H.; Wu, P.; Wang, W.; Zhang, S. L.; Zhang, W. Adv. Synth. Catal. 2015, 357, 553. doi: 10.1002/adsc.201400782
-
[13]
Morri, A. K.; Thummala, Y.; Doddi, V. R. Org. Lett. 2015, 17, 4640. doi: 10.1021/acs.orglett.5b02398
-
[14]
Uenishi, J. I.; Kawahama, R.; Yonemitsu, O.; Tsuji, J. J. Org. Chem. 1998, 63, 8965. doi: 10.1021/jo9812781
-
[15]
Fakhfakh, M. A.; Franck, X.; Hocquemiller, R.; Figadère, B. J. Organomet. Chem. 2001, 624, 131. doi: 10.1016/S0022-328X(00)00934-7
-
[16]
Xu, H.; Gu, S.; Chen, W.; Li, D.; Dou, J. J. Org. Chem. 2011, 76, 2448. doi: 10.1021/jo2000176
-
[17]
Zhao, M.; Ming, L.; Tang, J.; Zhao, X. Org. Lett. 2016, 18, 416. doi: 10.1021/acs.orglett.5b03448
-
[18]
Hirao, T.; Masunaga, T.; Ohshiro, Y.; Agawa, T. J. Org. Chem. 1981, 46, 3745. doi: 10.1021/jo00331a039
-
[19]
Ranu, B. C.; Samanta, S.; Guchhait, S. K. J. Org. Chem. 2001, 66, 4102. doi: 10.1021/jo0102314
-
[20]
Kuang, C. X.; Senboku, H.; Tokuda, M. Tetrahedron 2002, 58, 1491. doi: 10.1016/S0040-4020(02)00013-3
-
[21]
Wang, L.; Li, P. H.; Xie, Y. Y.; Ding, Y. B. Synlett 2003, 1137.
-
[22]
Horibe, H.; Kondo, K.; Okuno, H.; Aoyama, T. Synthesis-Stuttgart 2004, 986.
-
[23]
Li, Y. H.; Lu, L.; Zhao, X. M. Org. Lett. 2004, 6, 4467. doi: 10.1021/ol0482341
-
[24]
Shen, W.; Wang, L. J. Org. Chem. 1999, 64, 8873. doi: 10.1021/jo991116k
-
[25]
Stille, J. K. Angew. Chem., Int. Ed. 1986, 25, 508. doi: 10.1002/(ISSN)1521-3773
-
[26]
Shen, W. Synlett 2000, 737. http://www.ncbi.nlm.nih.gov/pubmed/10914975
-
[27]
Miyaura, N.; Suzuki, A. Chem. Rev. 1995, 95, 2457. doi: 10.1021/cr00039a007
-
[28]
Riveiros, R.; Saya, L.; Sestelo, J. P.; Sarandeses, L. A. Eur. J. Org. Chem. 2008, 1959.
-
[29]
Kabalka, G. W.; Dong, G.; Venkataiah, B. Tetrahedron Lett. 2005, 46, 763. doi: 10.1016/j.tetlet.2004.12.021
-
[30]
Ramana, C.; Kishore Reddy, B.; Nageswara Reddy, C.; Gonnade, R.; Gurjar, M. Synlett 2007, 127.
-
[31]
Gu, S.; Xu, H.; Zhang, N.; Chen, W. Chem. Asian J. 2010, 5, 1677. doi: 10.1002/asia.v5:7
-
[32]
Oh, C. H.; Lim, Y. M. Bull. Korea Chem. Soc. 2002, 23, 663. doi: 10.5012/bkcs.2002.23.5.663
-
[33]
Zhu, Y.; Sun, P.; Yang, H. L.; Lu, L. H.; Yan, H.; Creus, M.; Mao, J. C. Eur. J. Org. Chem. 2012, 4831. doi: 10.1002/ejoc.201200577/full
-
[34]
Voyer, N.; Cardinal, S. Synthesis 2016, 48, 1202. doi: 10.1055/s-00000084
-
[35]
Ogasawara, M.; Ikeda, H.; Hayashi, T. Angew. Chem. 2000, 112, 1084. doi: 10.1002/(ISSN)1521-3757
-
[36]
Zeng, X.; Qian, M.; Hu, Q.; Negishi, E. -I. Angew. Chem., Int. Ed. 2004, 43, 2259. doi: 10.1002/(ISSN)1521-3773
-
[37]
Shi, J.; Zeng, X.; Negishi, E. -I. Org. Lett. 2003, 5, 1825. doi: 10.1021/ol030017x
-
[38]
Uenishi, J.; Iwamoto, T.; Ohmi, M. Tetrahedron Lett. 2007, 48, 1237. doi: 10.1016/j.tetlet.2006.12.044
-
[39]
Yan, J. C.; Wang, Z. Y.; Wang, L. J. Chem. Res., Synop. 2004, 71.
-
[40]
(a) Chelucci, G. ; Capitta, F. ; Baldino, S. Tetrahedron 2008, 64, 10250.
(b) Chelucci, G. ; Capitta, F. ; Baldino, S. ; Pinna, G. A. Tetrahedron Lett. 2007, 48, 6514. -
[41]
Rahimi, A.; Schmidt, A. Synthesis-Stuttgart 2010, 2621.
-
[42]
Liu, J. D.; Dai, F. L.; Yang, Z. Y.; Wang, S. Z.; Xie, K.; Wang, A. W.; Chen, X.; Tan, Z. Tetrahedron Lett. 2012, 53, 5678. doi: 10.1016/j.tetlet.2012.08.044
-
[43]
Yan, H.; Lu, L.; Sun, P.; Zhu, Y.; Yang, H.; Liu, D.; Rong, G.; Mao, J. RSC Adv. 2013, 3, 377. doi: 10.1039/C2RA21577B
-
[44]
Rao, M. L.; Jadhav, D. N.; Dasgupta, P. Org. Lett. 2010, 12, 2048. doi: 10.1021/ol1004164
-
[45]
Rao, M. L. N.; Dasgupta, P.; Murty, V. N. RSC Adv. 2015, 5, 24834. doi: 10.1039/C5RA01544H
-
[46]
Berciano, B. P.; Lebrequier, S.; Besselievre, F.; Piguel, S. Org. Lett. 2010, 12, 4038. doi: 10.1021/ol1016433
-
[47]
Aziz, J.; Baladi, T.; Piguel, S. J. Org. Chem. 2016, 81, 4122. doi: 10.1021/acs.joc.6b00406
-
[48]
Reddy, G. C.; Balasubramanyam, P.; Salvanna, N.; Das, B. Eur. J. Org. Chem. 2012, 471. doi: 10.1002/ejoc.201101542
-
[49]
Shen, C.; Yang, Y. Z.; Liu, Z. X.; Zhang, Y. H. Synth. Commun. 2014, 44, 1970. doi: 10.1080/00397911.2014.882004
-
[50]
Shen, W.; Thomas, S. A. Org. Lett. 2000, 2, 2857. doi: 10.1021/ol006282p
-
[51]
Sonogashira, K.; Tohda, Y.; Hagihara, N. Tetrahedron Lett. 1975, 50, 4467.
-
[52]
Lee, H. B.; Huh, D. H.; Oh, J. S.; Min, G. H.; Kim, B. H.; Lee, D. H.; Hwang, J. K.; Kim, Y. G. Tetrahedron 2001, 57, 8283. doi: 10.1016/S0040-4020(01)00829-8
-
[53]
Rao, M. L. N.; Dasgupta, P.; Ramakrishna, B. S.; Murty, V. N. Tetrahedron Lett. 2014, 55, 3529. doi: 10.1016/j.tetlet.2014.04.092
-
[54]
Yan, J. C.; Wang, L. Synth. Commun. 2005, 35, 2333. doi: 10.1080/00397910500187191
-
[55]
Coste, A.; Couty, F.; Evano, G. Synthesis-Stuttgart 2010, 1500.
-
[56]
Jin, H.; Kuang, C. X. Chin. J. Chem. 2011, 29, 592. doi: 10.1002/cjoc.201190128
-
[57]
Huang, Z.; Shang, R.; Zhang, Z. R.; Tan, X. D.; Xiao, X.; Fu, Y. J. Org. Chem. 2013, 78, 4551. doi: 10.1021/jo400616r
-
[58]
Ye, S.; Yang, X.; Wu, J. Chem. Commun. 2010, 46, 2950. doi: 10.1039/b926763h
-
[59]
Bryan, C. S.; Lautens, M. Org. Lett. 2010, 12, 2754. doi: 10.1021/ol100844v
-
[60]
Nicolaus, N.; Franke, P. T.; Lautens, M. Org. Lett. 2011, 13, 4236. doi: 10.1021/ol201585a
-
[61]
(a) Coste, A. ; Karthikeyan, G. ; Couty, F. ; Evano, G. Angew. Chem., Int. Ed. 2009, 48, 4381.
(b) Jouvin, K. ; Coste, A. ; Bayle, A. ; Legrand, F. ; Karthikeyan, G. ; Tadiparthi, K. ; Evano, G. Organometallics 2012, 31, 7933. -
[62]
Coste, A.; Couty, F.; Evano, G. Org. Lett. 2009, 11, 4454. doi: 10.1021/ol901831s
-
[63]
Das, B.; Salvanna, N.; Reddy, G. C.; Balasubramanyam, P. Tetra-hedron Lett. 2011, 52, 6497. doi: 10.1016/j.tetlet.2011.09.117
-
[64]
Wang, M. G.; Wu, J.; Shang, Z. C. Synlett 2012, 23, 589. doi: 10.1055/s-0031-1290340
-
[65]
Huh, D. H.; Ryu, H.; Kim, Y. G. Tetrahedron 2004, 60, 9857. doi: 10.1016/j.tet.2004.08.035
-
[66]
Fayol, A.; Fang, Y. Q.; Lautens, M. Org. Lett. 2006, 8, 4203. doi: 10.1021/ol061374l
-
[67]
Fang, Y. Q.; Lautens, M. J. Org. Chem. 2008, 73, 538. doi: 10.1021/jo701987r
-
[68]
Vieira, T. O.; Meaney, L. A.; Shi, Y. L.; Alper, H. Org. Lett. 2008, 10, 4899. doi: 10.1021/ol801985q
-
[69]
Jiang, B. S.; Tao, K. M.; Shen, W.; Zhang, J. C. Tetrahedron Lett. 2010, 51, 6342. doi: 10.1016/j.tetlet.2010.09.129
-
[70]
Shen, W.; Kohn, T.; Fu, Z.; Jiao, X.; Lai, S. J.; Schmitt, M. Tetrahedron Lett. 2008, 49, 7284. doi: 10.1016/j.tetlet.2008.10.030
-
[71]
Tao, K. M.; Zheng, J. L.; Liu, Z. G.; Shen, W.; Zhang, J. C. Tetrahedron Lett. 2010, 51, 3246. doi: 10.1016/j.tetlet.2010.04.071
-
[72]
Zhang, A. M.; Zheng, X. L.; Fan, J. F.; Shen, W. Tetrahedron Lett. 2010, 51, 828. doi: 10.1016/j.tetlet.2009.12.013
-
[73]
Sun, C.; Xu, B. J. Org. Chem. 2008, 73, 7361. doi: 10.1021/jo801219j
-
[74]
Taylor, R.; Beltrán-Rodil, S.; Edwards, M.; Pugh, D.; Reid, M. Synlett 2009, 602.
-
[75]
Wang, Z. J.; Yang, J. G.; Yang, F.; Bao, W. Org. Lett. 2010, 12, 3034. doi: 10.1021/ol101041e
-
[76]
Wang, Z. J.; Yang, F.; Lv, X.; Bao, W. J. Org. Chem. 2011, 76, 967. doi: 10.1021/jo101899a
-
[77]
Xu, H. ; Zhang, Y. ; Huang, J. Q. ; Chen, W. Z. Org. Lett. 2010, 12, 3704.
-
[78]
Kiruthika, S. E.; Perumal, P. T. Org. Lett. 2014, 16, 484. doi: 10.1021/ol403365t
-
[79]
Sayyad, M.; Wani, I. A.; Tiwari, D. P.; Ghorai, M. K. Eur. J. Org. Chem. 2017, 2017, 2369.
-
[80]
Shen, W.; Kunzer, A. Org. Lett. 2002, 4, 1315. doi: 10.1021/ol025608m
-
[81]
Ye, W.; Mo, J.; Zhao, T.; Xu, B. Chem. Commun. (Camb.) 2009, 45, 3246. http://europepmc.org/abstract/MED/19587928
-
[82]
Wang, L.; Li, P. H.; Yan, J. C.; Wu, Z. Z. Tetrahedron Lett. 2003, 44, 4685. doi: 10.1016/S0040-4039(03)01084-0
-
[83]
Zhao, M.; Kuang, C. X.; Cheng, X. Z.; Yang, Q. Chin. Chem. Lett. 2011, 22, 571. doi: 10.1016/j.cclet.2010.11.022
-
[84]
Jouvin, K.; Bayle, A.; Legrand, F.; Evano, G. Org. Lett. 2012, 14, 1652. doi: 10.1021/ol300491d
-
[85]
Murahashi, S. I.; Yamamura, M.; Yanagisawa, K. I.; Mita, N.; Kondo, K. J. Org. Chem. 1979, 44, 2408. doi: 10.1021/jo01328a016
-
[86]
Cristau, H. J.; Chabaud, B.; Labaudiniere, R.; Christol, H. J. Org. Chem. 1986, 51, 875. doi: 10.1021/jo00356a024
-
[87]
Jin, H.; Yang, Y. W.; Kuang, C. X.; Yang, Q. Synlett 2011, 2886.
-
[88]
Ni, Z.; Wang, S.; Mao, H.; Pan, Y. Tetrahedron Lett. 2012, 53, 3907. doi: 10.1016/j.tetlet.2012.05.072
-
[89]
Perin, G.; Roehrs, J. A.; Hellwig, P. S.; Stach, G.; Barcellos, T.; Lenard o, E. J.; Jacob, R. G.; Luz, E. Q. ChemistrySelect 2017, 2, 4561. doi: 10.1002/slct.201700948
-
[90]
Newman, S. G.; Aureggi, V.; Bryan, C. S.; Lautens, M. Chem. Commun. 2009, 5236.
-
[91]
Chen, W.; Zhang, Y.; Zhang, L.; Wang, M.; Wang, L. Chem Commun. 2011, 47, 10476. doi: 10.1039/c1cc13967c
-
[92]
(a) Liu, J. ; Chen, W. ; Ji, Y. ; Wang, L. Adv. Synth. Catal. 2012, 354, 1585.
(b) Zhou, W. ; Chen, W. ; Wang, L. Org. Biomol. Chem. 2012, 10, 4172. -
[93]
Qin, X.; Cong, X.; Zhao, D.; You, J.; Lan, J. Chem. Commun. 2011, 47, 5611. doi: 10.1039/c1cc10572h
-
[94]
Fan, X. S.; He, Y.; Zhang, X. Y.; Guo, S. G.; Wang, Y. Y. Tetrahedron 2011, 67, 6369. doi: 10.1016/j.tet.2011.05.111
-
[95]
Liu, J. M.; Zhang, N. F.; Yue, Y. Y.; Wang, D.; Zhang, Y. L.; Zhang, X.; Zhuo, K. L. RSC Adv. 2013, 3, 3865. doi: 10.1039/c3ra00093a
-
[96]
Liu, J.; Zhang, X.; Shi, L.; Liu, M.; Yue, Y.; Li, F.; Zhuo, K. Chem. Commun. 2014, 50, 9887. doi: 10.1039/C4CC04377D
-
[97]
Lera, M.; Hayes, C. J. Org. Lett. 2000, 2, 3873. doi: 10.1021/ol0066173
-
[98]
Wang, Y.; Gan, J.; Liu, L.; Yuan, H.; Gao, Y.; Liu, Y.; Zhao, Y. J. Org. Chem. 2014, 79, 3678. doi: 10.1021/jo500312n
-
[99]
Evano, G.; Tadiparthi, K.; Couty, F. Chem. Commun. 2011, 47, 179. doi: 10.1039/C0CC01617A
-
[100]
Liu, L.; Wang, Y. L.; Zeng, Z. P.; Xu, P. X.; Gao, Y. X.; Yin, Y. W.; Zhao, Y. F. Adv. Synth. Catal. 2013, 355, 659. doi: 10.1002/adsc.201200853
-
[101]
Hata, T.; Kitagawa, H.; Masai, H.; Kurahashi, T.; Shimizu, M.; Hiyama, T. Angew. Chem., Int. Ed. 2001, 40, 790. doi: 10.1002/1521-3773(20010216)40:4<>1.0.CO;2-X
-
[102]
Webber, R.; Peglow, T. J.; Nobre, P. C.; Barcellos, A. M.; Roehrs, J. A.; Schumacher, R. F.; Perin, G. Tetrahedron Lett. 2016, 57, 4128. doi: 10.1016/j.tetlet.2016.07.018
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 22
- 文章访问数: 3129
- HTML全文浏览量: 692


 下载:
下载:
























 下载:
下载:

