 图1
γ-Al2O3和ZnAl-LDHs/γ-Al2O3的XRD谱图
Figure1.
XRD patterns of γ-Al2O3 and ZnAl-LDHs/γ-Al2O3
图1
γ-Al2O3和ZnAl-LDHs/γ-Al2O3的XRD谱图
Figure1.
XRD patterns of γ-Al2O3 and ZnAl-LDHs/γ-Al2O3

Citation: YANG Shu-qian, HE Jian-ping, ZHANG Na, SUI Xiao-wei, ZHANG Lei, YANG Zhan-xu. Effect of rare-earth element modification on the performance of Cu/ZnAl catalysts derived from hydrotalcite precursor in methanol steam reforming[J]. Journal of Fuel Chemistry and Technology, 2018, 46(2): 179-188.

稀土掺杂改性对Cu/ZnAl水滑石衍生催化剂甲醇水蒸气重整制氢性能的影响
English
Effect of rare-earth element modification on the performance of Cu/ZnAl catalysts derived from hydrotalcite precursor in methanol steam reforming
-
Key words:
- rare-earth
- / hydrotalcite
- / Cu/ZnAl
- / methanol steam reforming
- / hydrogen
- / carbon monoxide
-
氢因其在地球上储量丰富、燃烧热值高,且燃烧后不产生任何污染,十分有利于环境保护,故被看作21世纪理想的洁净新能源[1, 2]。目前,制氢的途径较多,主要分为三大类:化学制氢法、生物制氢法、电解水制氢法。其中,化学制氢技术相对成熟。液体燃料甲醇因具有较高的C/H比,不含C-C键,不含硫且价格低廉等特点成为制氢原料的首选。另外,相比于传统的低温或者高压下存储H2的方式,液体甲醇更容易储存和运输。甲醇制氢一般有三种方式,即甲醇水蒸气重整、甲醇部分氧化重整和甲醇自热重整,其中,甲醇水蒸气重整制氢反应条件温和,重整尾气中氢含量较高,CO含量较低,被公认为是最有效的制氢方式[3-6]。但甲醇水蒸气重整是个复杂的、非稳态的氧化还原反应体系,寻找一种高活性、稳定性、耐热性好、抗积炭能力强的催化剂尤为重要。目前,用于重整反应体系的Cu基催化剂的报道很多[7-11],其中,CuO-ZnO/Al2O3催化剂最为常见,催化剂中CuO的含量一般在30%-50%。为了有效地提高Cu基催化剂的利用率和催化活性,不同Cu基催化剂的制备方法被广泛研究[12-15]。其中, 水滑石类化合物作为一种层状结构的新型无机功能材料受到越来越多的关注,Hammoud等[16]采用了共沉淀法制备了锌铝水滑石,然后通过浸渍法将焙烧后的锌铝水滑石浸渍到硝酸铜溶液中,结果表明,当Cu含量为10%时,催化剂在甲醇水蒸气重整反应体系中表现出了较高的催化活性。稀土元素因其独特的电子构型,可形成多个配位体的络合前驱物,是理想的催化和助催化材料,因此,近年来通过添加稀土助剂的方式来提高甲醇水蒸气重整制氢Cu基催化剂的性能。Cai等[17]通过添加稀土La2O3对CuO-ZnO/Al2O3催化剂进行改性,结果表明,添加La2O3助剂后,催化剂的低温活性和稳定性得到明显提高。Patel等[18]通过添加稀土CeO2来改善CuO-ZnO/Al2O3催化剂的催化性能,结果表明,Ce的添加降低了重整尾气中CO的含量,改善了催化剂的稳定性。Trovarelli等[19]报道了CeO2作为优良的稀土助剂主要是通过Ce4+和Ce3+之间的还原/氧化的高效循环实现的,且CeO2易形成表面缺陷,有一定的储放氧能力,另外,Ce的添加具有促进活性组分的均匀分散,提高热稳定性以及改善催化剂的整体性能等优点。本课题组前期研究表明[20],焙烧原位合成法制备的锌铝水滑石后能得到高机械强度和大比表面积的复合金属氧化物,将其用于甲醇水蒸气重整制氢反应过程中起到了良好的催化性能。本研究在本课题组前期研究的基础上,通过掺杂不同稀土助剂进一步改善催化剂的结构和性能,着重探讨了掺杂稀土助剂对Cu/ZnAl催化剂在甲醇水蒸气重整制氢反应性能的影响,并对催化剂的结构和性质进行了研究和分析,以建立起催化剂的结构和性能之间的关系,为甲醇水蒸气重整制氢催化剂的设计提供理论依据。
1 实验部分
1.1 催化剂的制备
采用表面原位合成法在γ-Al2O3上合成锌铝水滑石,将5.0 g γ-Al2O3加入150 mL Zn(NO3)2·6H2O(0.1 mol/L)和NH4NO3(0.1 mol/L)配成的混合溶液的三口烧瓶中,由氨水(5%,质量分数)溶液调节pH值至7.0-8.0,然后在70 ℃下搅拌24 h。将氨水和NH4NO3加入去离子水中配置洗涤液,调节洗涤液的pH值与反应结束后反应体系pH值基本一致。然后用该洗涤液洗涤样品5-7次,并使湿样在空气中老化1 h,再用去离子水洗涤到中性,放入烘箱于70 ℃干燥24 h,得到ZnAl-LDHs/γ-Al2O3,然后在马弗炉中400 ℃焙烧4 h得到复合金属氧化物,记为γ-Al@MMO。
取一定量的γ-Al@MMO作为载体,采用顺次浸渍法先浸渍质量分数为10%的Cu(NO3)2·3H2O(按铜元素计)溶液,之后放入烘箱中110 ℃干燥12 h,然后放在马弗炉中500 ℃焙烧3 h得Cu/γ-Al@MMO,命名为Cu/ZnAl。接着以Cu/ZnAl为催化前驱体浸渍到质量分数为4%的稀土硝酸盐(按稀土元素计)M(NO3)3·6H2O(M=Y、La、Ce、Gd、Sm)溶液中,之后放入烘箱中110 ℃干燥12 h,最后放在马弗炉中500 ℃焙烧3 h,研磨至120目,压片成型,粉碎成40-80目的催化剂,命名为M/Cu/ZnAl(M=Y、La、Ce、Sm、Gd)。
1.2 催化剂的表征
X射线衍射(XRD)分析在德国Bruker公司的AXS-D8型X射线衍射仪上进行。实验中测试条件:Cu Kα1靶,入射波长λ=0.154 nm,管电压40 kV,管电流40 mA,3°-70°扫描。CuO的平均粒径由Scherrer公式计算。
样品的形貌特征由日本Hitachi公司SU8010型扫描电子显微镜测得,EDS能谱分析由德国Bruker公司的XFlash Detector 5030型能谱仪分析测定。
采用美国康塔仪器公司NOVA 2200E型自动比表面积和孔隙度分析仪测定样品的N2吸附-脱附等温线,由BET法计算比表面积,BJH法计算孔容。
H2-TPR实验在美国Quantachrome公司的Chem BET Pulsar型化学吸附仪上进行,50 mg催化剂在氩气流动下以10 ℃/min升温至300 ℃预处理1 h以除去吸附的杂质、水分等,之后冷却至室温,调平基线,切换成5% H2-Ar混合气,以10 ℃/min升温至800 ℃,TCD检测耗氢量。
N2O滴定实验装置,样品用量及预处理同H2-TPR。样品预处理结束后直接切换成5% H2-Ar混合气,在500 ℃还原90 min,还原后将反应器温度降低到90 ℃,然后通入5.01% N2O-Ar混合气1 h,之后在切换成5% H2-Ar温度以10 ℃/min由90 ℃升温到400 ℃进行第二次H2-TPR实验。假设N2O只与表面的CuO反应转化为Cu+,经过两次H2-TPR实验可测出样品中表面铜原子数、Cu比表面积和分散度。
X射线光电子能谱(XPS)分析在赛默飞Thermo Escalab 250光电子能谱仪上进行。采用Al Kα射线激发源,电子结合能(BE)值采用样品的污染碳(C 1s =284.6 eV)作为内标物,校正样品表面的荷电效应。
1.3 催化剂的评价
催化剂的活性评价在实验室自行搭建的固定床装置上进行,取2 mL催化剂,用5% H2-N2混合气在280 ℃条件下将催化剂预还原2 h,然后切换成N2降温至室温,关闭N2,再由微量泵打入甲醇和水的混合溶液(水/甲醇物质的量比为1.2)调节至反应温度进行反应,重整气经过冷凝器和干燥器脱去甲醇和水,最后进入SP1000(北分瑞利)气相色谱在线分析。
式中,FR为标况下的重整尾气流量(mL/min),F为液体进料量(mL/min),ρ为混合液密度(g/mL),w为水醇物质的量比,mcat为所用催化剂质量(kg),cCO、cCO2、cH2分别为尾气中CO、CO2、H2的含量,mcat为所用催化剂的质量(kg)。
2 结果与讨论
2.1 晶体结构分析
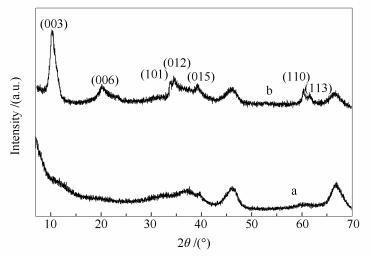
图 1为γ-Al2O3载体和ZnAl水滑石的XRD谱图。对比γ-Al2O3载体的特征衍射峰,ZnAl-LDHs/γ-Al2O3在10.3°、20.3°、34.5°和60.3°出现了典型的水滑石晶体结构的(003)、(006)、(012)、(110)特征衍射峰[21]。说明在γ-Al2O3的表面合成了锌铝水滑石型催化材料。
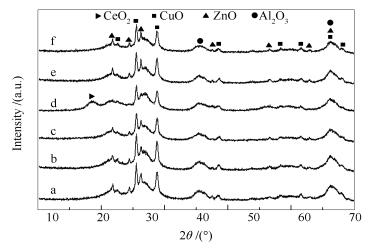
图 2为Cu/ZnAl催化剂和掺杂稀土改性的M/Cu/ZnAl催化剂的XRD谱图。由图 2可知,掺杂稀土Ce助剂的催化剂出现了明显的CeO2的特征衍射峰,这可能是因为掺杂稀土Ce的催化剂中CeO2的结晶度较好,进而形成了良好的晶型,或者是因为掺杂稀土Ce的催化剂可以暴露出更多的CeO2表面所造成的。而掺杂稀土助剂Y、La、Sm和Gd的催化剂没有出现对应稀土氧化物的特征峰,这可能是因为掺杂稀土La、Y、Sm和Gd的催化剂中稀土氧化物的结晶度较差,以无定型形式存在或者稀土氧化物在催化剂中分散较好所造成的。另外,通过Scherrer公式计算的CuO晶粒粒径见表 1,对比Cu/ZnAl催化剂,掺杂稀土助剂后,使得催化剂中的活性组分CuO晶粒粒径变小。
 表 1
催化剂的物化性质及其催化甲醇水蒸气重整反应中氢气产率
Table 1.
Textural properties of the M/Cn/ZnAl catalysts modified with various rare earth elements and their hydrogen production rate in the methanol steam reforming
表 1
催化剂的物化性质及其催化甲醇水蒸气重整反应中氢气产率
Table 1.
Textural properties of the M/Cn/ZnAl catalysts modified with various rare earth elements and their hydrogen production rate in the methanol steam reforming
Catalyst ABET
/(m2·g-1)Pore volume
v/(cm3·g-1)CuO crystallite
size d/nmCu surface area
A/(m2·g-1)Cu dispersion
/%YcH2/
(mL·kgcat-1·s-1)Cu/ZnAl 147.0 0.47 34 5.9 10.32 446.2 Y/Cu/ZnAl 101.9 0.39 25 5.3 10.15 414.8 La/Cu/ZnAl 105.5 0.37 24 5.3 10.05 424.4 Ce/Cu/ZnAl 109.6 0.41 23 6.3 11.49 810.7 Sm/Cu/ZnAl 106.0 0.37 25 6.1 11.53 568.5 Gd/Cu/ZnAl 107.6 0.40 24 5.9 11.15 457.3 note: the Cu surface area was measured by N2O chemisorption and Cu dispersion was determined as the ratio of the surface copper amount to the total copper content in the catalysts; The hydrogen production rate (YH2) was obtained by methanol steam reforming under atmospheric pressure, 240 ℃, water methanol molar ratio of 1.2 and GHSV of 800 h-1; no carrier gas was used 2.2 SEM-EDS分析
γ-Al2O3和ZnAl-LDHs/γ-Al2O3的形貌由扫描电子显微镜(SEM)得到,由图 3(a)可知,γ-Al2O3有均匀的多孔结构。图 3(b)为ZnAl-LDHs/γ-Al2O3的扫描电镜照片。图 4为掺杂稀土改性的M/Cu/ZnAl催化剂SEM-EDS照片。
由图 3(b)可知,一些具有层状结构的不规则颗粒,均匀地分散在γ-Al2O3的表面,很有可能是典型的水滑石的特征形貌,这与XRD所述的水滑石的特征谱图一致,进一步说明在γ-Al2O3的表面合成了锌铝水滑石型催化材料。
从图 4 SEM照片中可以看出,掺杂不同稀土助剂的催化剂形貌并没有明显区别。另外,从EDS照片中可以看出稀土元素在催化剂中均匀分散。
2.3 表面性质分析
Cu/ZnAl催化剂和掺杂稀土改性的M/Cu/ZnAl催化剂的物化性质及在甲醇水蒸气重整反应中的产氢速率结果见表 1。由表 1可知,掺杂稀土助剂后,催化剂的比表面积和孔体积都减小,这可能是由于载体的部分孔道被掺杂的稀土助剂占据的原因[22]。
另外,从Cu比表面积和产氢速率可以看出,Cu比表面积越大,相应的产氢速率越快。Ce/Cu/ZnAl催化剂的Cu比表面积最大,为6.3 m2/g,对应的产氢速率最快,为810.7 mL/(kgcat·s)。其次为Sm/Cu/ZnAl催化剂,Cu比表面积为6.1 m2/g,其对应的产氢速率为568.5 mL/(kgcat·s),Y/Cu/ZnAl催化剂的Cu比表面积最小,为5.3 m2/g,其对应的产氢速率最慢,为414.8 mL/(kgcat·s),这和本课题组前期研究结果一致[20, 23, 24]。
从Cu比表面积可以说明,掺杂不同稀土助剂对催化剂的活性组分的分散情况影响显著,掺杂稀土Ce、Sm、Gd元素,有利于改善Cu/ZnAl催化剂活性组分的分散,Cu比表面积增大,进而使得催化活性提高。而掺杂稀土Y和La元素,使得Cu/ZnAl催化剂的活性组分分散度降低,Cu比表面积减小,催化活性降低。
2.4 H2-TPR分析
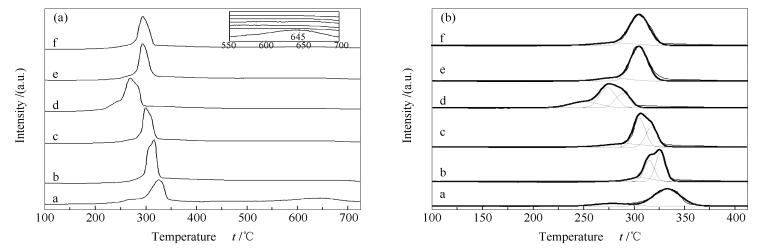
图 5为Cu/ZnAl催化剂和掺杂稀土改性的M/Cu/ZnAl催化剂的H2-TPR谱图。
由图 5(a)可知,Cu/ZnAl催化剂在645 ℃存在一个高温还原峰,这可能是因为有一些Cu(Ⅱ)物种进入到氧化锌或者锌铝氧化物的晶格当中很难被还原出来[16]造成的。但掺杂稀土助剂后,该高温还原峰消失,说明掺杂稀土助剂能阻碍Cu(Ⅱ)物种进入到氧化锌或者锌铝氧化物的晶格当中, 从而有利于催化剂中氧化铜的还原。另外,由图 5(b)可知,掺杂不同稀土助剂改性的催化剂都出现了两个或三个还原峰,分别对应不同的氧化铜物种的还原。Gd/Cu/ZnAl和Sm/Cu/ZnAl催化剂出现了两个还原峰,即低温还原峰和高温还原峰,分别对应表相氧化铜的还原和体相氧化铜的还原。Y/Cu/ZnAl、La/Cu/ZnAl和Ce/Cu/ZnAl催化剂出现了三个还原峰,第一个低温还原峰对应Cu-Y、Cu-La和Cu-Ce作用较强的CuO的还原,第二个还原峰对应Cu-Y、Cu-La和Cu-Ce作用较弱的CuO的还原, 第三个还原峰对应体相氧化铜的还原[25, 26]。经高斯函数拟合后的各个催化剂的还原温度见表 2,对比Cu/ZnAl催化剂发现,Ce/Cu/ZnAl、Sm/Cu/ZnAl和Gd/Cu/ZnAl三个催化剂的还原峰向低温方向移动,而Y/Cu/ZnAl和La/Cu/ZnAl催化剂的第一个低温还原峰向高温方向移动,本课题组前期研究表明,催化剂的还原性能直接影响到催化剂的活性,并且还原温度越低,催化剂活性越好[20, 23, 24],这可能就是Ce/Cu/ZnAl、Sm/Cu/ZnAl和Gd/Cu/ZnAl催化剂的活性高于Cu/ZnAl催化剂的原因。在所制备的催化剂中,Ce/Cu/ZnAl催化剂的还原温度最低,这可能就是Ce/Cu/ZnAl催化剂活性最好的原因之一。
Catalyst Peak position t/ ℃ peak 1 peak 2 peak 3 Cu/ZnAl 266 324 - Y/Cu/ZnAl 293 305 315 La/Cu/ZnAl 279 297 309 Ce/Cu/ZnAl 242 266 281 Sm/Cu/ZnAl 266 297 - Gd/Cu/ZnAl 266 297 - 2.5 XPS分析
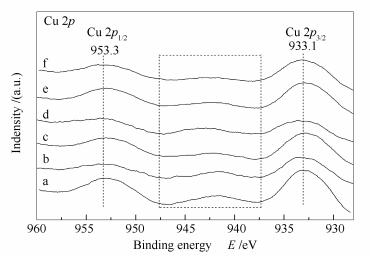
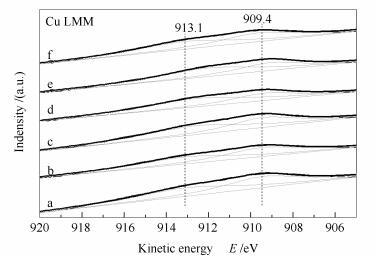
应用X射线光电子能谱分析仪对Cu/ZnAl催化剂和掺杂稀土改性的M/Cu/ZnAl催化剂的表面物种价态和电子特性进行了研究。图 6和图 7分别为Cu/ZnAl催化剂和掺杂稀土改性的M/Cu/ZnAl催化剂的Cu 2p X射线光电子能谱和Cu俄歇电子能谱。图 6中,953.3 eV处的特征峰对应Cu 2p1/2的电子结合能,936-948 eV处的特征峰为Cu 2p的卫星峰(satellite peak),933.1 eV处的特征峰对应Cu 2p3/2的电子结合能[27]。由图 6可知,所有催化剂在936-948 eV处出现了明显的Cu 2p的卫星峰,Cu 2p卫星峰的出现是由于Cu2+离子中价层轨道电子与溢出的光电子相互作用而产生的电荷震荡,这是Cu2+离子的电子能谱特征峰[28],说明催化剂表面存在CuO物种,这与XRD结果相吻合。但Cu2+离子的Cu 2p3/2的电子结合能应在934.9 eV[29],而本研究所制备的催化剂的Cu 2p3/2的电子结合能出现在933.1 eV,向低结合能方向移动,这表明催化剂表面还可能存在其他铜物种,可能为Cu+和(或)Cu0。由于Cu+和Cu0的Cu 2p谱峰位与峰型均相似,仅从Cu 2p谱图无法判断,因此,为了进一步分辨表面铜物种,故加入了Cu LMM俄歇电子能谱(图 7)。Cu0的俄歇电子动能为918.6 eV,比Cu2+和Cu+的俄歇电子动能都高。因此,图 7中的两个特征峰913.1和909.4 eV归属为Cu+离子的俄歇电子峰[27],说明在催化剂表面存在Cu+离子而没有Cu0离子。但XRD谱图中,并未出现Cu2O的衍射峰,这可能是因为Cu+物种在催化剂表面高度分散的原因,或者Cu+ 物种存在于负载金属与载体的界面处的原因[30]。Cu+离子的出现说明氧化铜与氧化锌或者稀土氧化物发生了较强的相互作用,使得Cu2+离子转化为Cu+离子。
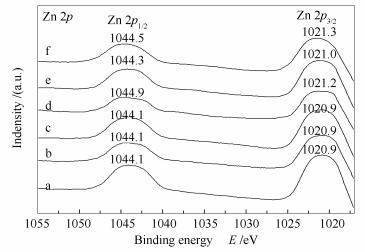
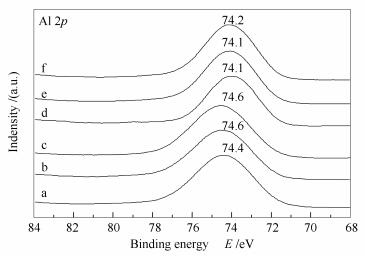
图 8为Cu/ZnAl催化剂和掺杂稀土改性的M/Cu/ZnAl催化剂的Zn 2p X射线光电子能谱。由图 8可知,掺杂稀土Y和La元素后,Zn 2p的结合能没有改变,而掺杂稀土Ce、Sm和Gd元素后,Zn 2p结合能向高结合能方向移动,说明Ce、Sm、Gd与ZnO发生了相互作用,使得Zn电子云密度减小,结合能增大。由于Ce、Sm、Gd与ZnO发生了相互作用,使得ZnO在催化剂表面均匀分散,进而使得ZnO晶粒减小,分散度增加,这与XRD结果相一致。图 9为Cu/ZnAl催化剂和掺杂稀土改性的M/Cu/ZnAl催化剂的Al 2p X射线光电子能谱,74.5 eV附近的特征峰为Al3+离子的能谱特征峰[31]。由图 9可知,掺杂稀土元素后,Al3+离子结合能发生了位移,说明稀土元素与载体Al2O3发生了相互作用。
图 10为Cu/ZnAl催化剂和掺杂稀土改性的M/Cu/ZnAl催化剂的O 1s X射线光电子能谱。图 10中,530.1-530.6 eV处的特征峰对应晶格氧(O2-)的电子结合能,531.4-531.6 eV处的特征峰对应表面吸附氧(O2)和(或)羟基(-OH)中氧的结合能, 532.4-532.7 eV处的特征峰对应表面吸附的分子水和(或)表面吸附的碳酸盐中氧的结合能[32, 33]。吸附氧的存在有利于甲醇水蒸气反应和水汽变换反应的进行,进而提高了催化活性[28]。
2.6 催化剂的性能
图 11为Cu/ZnAl催化剂和掺杂稀土改性的M/Cu/ZnAl催化剂对甲醇水蒸气重整制氢反应催化活性的影响。在反应温度为220-260 ℃,水醇比为1.2,甲醇气体空速为800 h-1时,甲醇水蒸气重整热力学平衡转化率基本接近100%。另外,所有催化剂活性随反应温度的变化都表现出相同的趋势,随反应温度的升高,甲醇转化率逐渐增大,这主要是由于甲醇水蒸气重整制氢反应为吸热反应,反应温度的升高,有利于重整反应的发生。
由图 11还可知,掺杂不同稀土助剂对Cu/ZnAl催化剂催化性能影响很大,催化活性顺序为Ce/Cu/ZnAl>Sm/Cu/ZnAl>Gd/Cu/ZnAl>Cu/ZnAl>La/Cu/ZnAl>Y/Cu/ZnAl。Ce/Cu/ZnAl催化剂的催化活性最好,在250 ℃时,甲醇转化率达到100%。Y/Cu/ZnAl催化活性最差,在250 ℃时,甲醇转化率仅为59.7%。这种差别主要与催化剂的Cu比表面积和还原性质有关。由表 1和表 2可知,Ce/Cu/ZnAl催化剂的Cu比表面积最大,还原温度最低,因此,其催化活性最佳。比较Gd/Cu/ZnAl和Sm/Cu/ZnAl催化剂可以发现,两者还原温度相同(表 2),但Sm/Cu/ZnAl催化剂的Cu比表面积略高于Gd/Cu/ZnAl催化剂(表 1),因此Sm/Cu/ZnAl催化活性高于Gd/Cu/ZnAl。另外,比较Y/Cu/ZnAl和La/Cu/ZnAl催化剂可以发现,Y/Cu/ZnAl和La/Cu/ZnAl催化剂的Cu比表面积相同,但La/Cu/ZnAl催化剂还原温度较低,因此, La/Cu/ZnAl催化剂活性较高。总而言之,对于甲醇水蒸气重整制氢反应铜基催化剂而言,催化剂的活性与Cu比表面积和催化剂还原性质有直接关系,Cu比表面积越大,还原温度越低,催化活性越好。
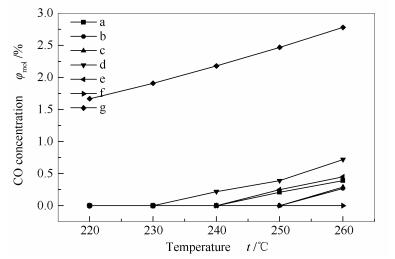
甲醇水蒸气重整后产生的CO是造成质子膜电池Pt电极中毒的主要原因,因此, 首先需要对重整尾气中的CO进行净化,使其含量低于1.0×10-5。当重整尾气CO含量过高时,自然会增加后续处理过程,因此, 重整尾气中的CO含量是催化剂性能的重要指标。图 12为掺杂不同稀土改性的Cu/ZnAl催化剂对重整反应过程中CO含量的影响。由图 12可知,反应温度为230 ℃以下时,所有催化剂催化甲醇水蒸气重整后尾气中的CO含量都小于0.1% (SP1000色谱TCD检测范围)。为了进一步比较掺杂不同稀土助剂对催化剂性能的整体影响,甲醇转化率大致相同时考察了催化剂的CO选择性和所需的反应温度,见表 3。由表 3可知,在所有催化剂中,Gd/Cu/ZnAl催化剂表现最好的CO选择性,在反应温度为260 ℃,甲醇转化率为81%,重整尾气中的CO含量小于0.1% (SP1000色谱TCD检测范围)。其次为Ce/Cu/ZnAl催化剂,在反应温度为240 ℃,甲醇转化率为92%,重整尾气的CO选择性为0.9%。综合考虑甲醇转化率和CO选择性,在本研究所制备的催化剂中,Ce/Cu/ZnAl催化剂在甲醇水蒸气重整反应中表现出最佳的性能。
Catalyst Methanol conversion
x/%Selectivity to CO
s/%Temperature
t/ ℃Cu/ZnAl 79 1.6 260 Y/Cu/ZnAl 76 1.1 260 La/Cu/ZnAl 77 1.2 260 Ce/Cu/ZnAl 92 0.9 240 Sm/Cu/ZnAl 83 1.0 250 Gd/Cu/ZnAl 81 0 260 3 结论
采用表面原位合成法在γ-Al2O3表面合成了锌铝水滑石,再通过顺次浸渍法制备了一系列掺杂稀土改性的M(M=Y、La、Ce、Sm、Gd)/Cu/ZnAl催化材料,并探讨了掺杂稀土改性对Cu/ZnAl催化剂的结构和性能影响。实验结果表明,催化剂的活性主要与铜比表面积和催化剂的还原性质相关。与Cu/ZnAl催化剂相对比,通过掺杂稀土Ce、Sm、Gd元素,增大了Cu比表面积,降低了催化剂的还原温度,进而提高了催化剂的催化活性,而掺杂稀土Y、La元素,减小了Cu比表面积,提高了催化剂的低温还原温度,从而使得催化剂活性降低。其中,Ce/Cu/ZnAl催化剂表现出最佳的催化活性,在反应温度为250 ℃,水醇物质的量比为1.2,甲醇气体空速为800 h-1时,甲醇转化率达到100%,CO含量为0.39%,相比Cu/ZnAl催化剂,甲醇转化率提高了近40%。
-
-
[1]
JACOBSON M Z, COLELLA W G, GOLDEN D. Cleaning the air and improving health with hydrogen fuel-cell vehicles[J]. Science, 2005, 308(5730): 1901-1905. doi: 10.1126/science.1109157
-
[2]
FIHRI A, ARTERO V, RAZAVET M, BAFFERT C, LEIBL W, FONTECAVE M. Cobaloxime-based photocatalytic devices for hydrogen production[J]. Angew Chem Int Ed, 2008, 47(3): 564-567.
-
[3]
KUC J, NEUMANN M, ARMBRUSTER M, YOON S, ZHANG Y, ERNI R, WEIDENKAFF A, MATAM S K. Methanol steam reforming catalysts derived by reduction of perovskite-type oxides LaCo1-x-yPdx ZnyO3±δ[J]. Catal Sci Technol, 2016, 6: 1455-1468. doi: 10.1039/C5CY01410G
-
[4]
MA Y, GUAN G, PHANTHONG P, LI X, CAO J, HAO X, WANG Z, ABUDULA A. Steam reforming of methanol for hydrogen production over nanostructured wire-like molybdenum carbide catalyst[J]. Int J Hydrogen Energy, 2014, 39(33): 18803-18811. doi: 10.1016/j.ijhydene.2014.09.062
-
[5]
SA S, SILVA H, BRANDAO L, SOUSA J M, MENDES A. Catalysts for methanol steam reforming-A review[J]. Appl Catal B:Environ, 2010, 99(1/2): 43-57.
-
[6]
张磊, 潘立卫, 倪长军, 赵生生, 王树东, 胡永康, 王安杰, 蒋凯. 甲醇水蒸气重整制氢反应条件的优化[J]. 燃料化学学报, 2013,41,(1): 116-122. ZHANG Lei, PAN Li-wei, NI Chang-jun, ZHAO Sheng-sheng, WANG Shu-dong, HU Yong-kang, WANG An-jie, JIANG Kai. Optimization of methanol steam reforming for hydrogen[J]. J Fuel Chem Technol, 2013, 41(1): 116-122.
-
[7]
KIM W, MOHAIDEEN K K, SEO D J, YOON L Y. Methanol-steam reforming reaction over Cu-Al-based catalysts derived from layered double hydroxides[J]. Int J Hydrogen Energy, 2017, 42(4): 2081-2087. doi: 10.1016/j.ijhydene.2016.11.014
-
[8]
ZHOU J J, ZHANG Y, WU G S, MAO D S, LU G Z. Influence of the component interaction over Cu/ZrO2 catalysts induced with fractionated precipitation method on the catalytic performance for methanol steam reforming[J]. RSC Adv, 2016, 6: 30176-30183. doi: 10.1039/C5RA24163D
-
[9]
DAS D, LLORCA J, DOMINGUEZ M, COLUSSI S, TROVARELLI A, GAYEN A. Methanol steam reforming behavior of copper impregnated over CeO2-ZrO2 derived from a surfactant assisted coprecipitation route[J]. Int J Hydrogen Energy, 2015, 40(33): 10463-10479. doi: 10.1016/j.ijhydene.2015.06.130
-
[10]
LYTKINA A A, ZHILYAEVA N A, ERMILOVA M M, OREKHOVA N V, YAROSLAVTSEO A B. Influence of the support structure and composition of Ni-Cu-based catalysts on hydrogen production by methanol steam reforming[J]. Int J Hydrogen Energy, 2015, 40(31): 9677-9684. doi: 10.1016/j.ijhydene.2015.05.094
-
[11]
HUANG Y H, WANG S F, TSAI A P, KAMEOKA S. Catalysts prepared from copper-nickel ferrites for the steam reforming of methanol[J]. J Power Sources, 2015, 281: 138-145.
-
[12]
BUSCA G, COSTANTINO U, MARMOTTINI F, MONTANARI T, PATRONO P, PINZARI F, RAMIS G. Methanol steam reforming over ex-hydrotalcite Cu-Zn-Al catalysts[J]. Appl Catal A:Gen, 2006, 310: 70-78. doi: 10.1016/j.apcata.2006.05.028
-
[13]
YAO C Z, WANG L C, LIU Y M, WU G S, CAO Y, DAI W L, FAN K N. Effect of preparation method on the hydrogen production from methanol steam reforming over binary Cu/ZrO2 catalysts[J]. Appl Catal A:Gen, 2006, 297(2): 151-158. doi: 10.1016/j.apcata.2005.09.002
-
[14]
PATEL S, PANT K K. Influence of preparation method on performance of Cu(Zn)(Zr) -alumina catalysts for the hydrogen production via steam reforming of methanol[J]. Porous Mater, 2006, 13(3): 373-378.
-
[15]
SHEN J P, SONG C S. Influence of preparation method on performance of Cu/Zn-based catalysts for low-temperature steam reforming and oxidative steam reforming of methanol for H2 production for fuel cells[J]. Catal Today, 2002, 77(1): 89-98.
-
[16]
HAMMOUD D, GENNEQUIN C, ABOUKAIS A, AAD E A. Steam reforming of methanol over x% Cu/Zn-Al 400500 based catalysts for production of hydrogen:Preparation by adopting memory effect of hydrotalcite and behavior evaluation[J]. Int J Hydrogen Energy, 2015, 40(2): 1283-1297. doi: 10.1016/j.ijhydene.2014.09.080
-
[17]
CAI Y C, LIU S W, XU X L, LI S B. team reforming of methanol over CuO-ZnO-La2O3-Al2O3 catalyst[J]. Mol Catal, 2002, 2(15): 152-154.
-
[18]
PATEL S, PANT K K. Activity and stability enhancement of copper-alumina catalysts using cerium and zinc promoters for the selective production of hydrogen via steam reforming of methanol[J]. J Power Sources, 2006, 159(1): 139-143. doi: 10.1016/j.jpowsour.2006.04.008
-
[19]
TROVARELLI A. Catalytic properties of ceria and CeO2-containing materials[J]. Catal Rev Sci Eng, 1996, 38(4): 439-520. doi: 10.1080/01614949608006464
-
[20]
HE J P, YANG Z X, ZHANG L, LI Y, PAN L W. Cu supported on ZnAl-LDHs precursor prepared by in-situ synthesis method on γ-Al2O3 as catalytic material with high catalytic activity for methanol steam reforming[J]. Int J Hydrogen Energy, 2017, 42(15): 9930-9937. doi: 10.1016/j.ijhydene.2017.01.229
-
[21]
XIE R F, FAN G L, YANG L, LI F. Solvent-free oxidation of ethylbenzene over hierarchical flower-like core-shell structured Co-based mixed metal oxides with significantly enhanced catalytic performance[J]. Catal Sci Technol, 2015, 5(1): 540-548.
-
[22]
AGARWAL V, PATEL S, PANT K K. H2 production by steam reforming of methanol over Cu/ZnO/Al2O3 catalysts:Transient deactivation kinetics modeling[J]. Appl Catal A:Gen, 2005, 279(1): 155-164.
-
[23]
ZHANG L, PAN L W, NI C J, SUN T J, ZHAO S S, WANG S D, WANG A J, HU Y K. CeO2-ZrO2-promoted CuO/ZnO catalyst for methanol steam reforming[J]. Int J Hydrogen Energy, 2013, 38(11): 4397-4406. doi: 10.1016/j.ijhydene.2013.01.053
-
[24]
ZHANG L, PAN L W, NI C J, SUN T J, WANG S D, WANG A J, HU Y K, ZHAO S S. Effect of precipitation aging time on the performance of CuO/ZnO/CeO2-ZrO2 for methanol steam reforming[J]. J Fuel Chem Technol, 2013, 41(7): 883-888. doi: 10.1016/S1872-5813(13)60038-9
-
[25]
HURST N W, GENTRY S J, JONES A, MCNICOL B D. Temperature programmed reduction[J]. Catal Rev Sci Eng, 1982, 24(2): 233-309. doi: 10.1080/03602458208079654
-
[26]
SHIM J O, NA H S, JHA A, JANG W J, JEONG D W, NAH I W, JEON B H, ROH H S. Effect of preparation method on the oxygen vacancy concentration of CeO2-promoted Cu/γ-Al2O3 catalysts for HTS reactions[J]. Chem Eng J, 2016, 306: 908-915. doi: 10.1016/j.cej.2016.08.030
-
[27]
WANG C, CHENG Q P, WANG X L, MA K, BAI X Q, TAN S R, TIAN Y, TONG D, ZHENG L R, ZHANG J, LI X G. Enhanced catalytic performance for CO preferential oxidation over CuO catalysts supported on highly defective CeO2 nanocrystals[J]. Appl Surf Sci, 2017, 422: 932-943. doi: 10.1016/j.apsusc.2017.06.017
-
[28]
张磊, 雷俊腾, 田园, 胡鑫, 白金, 刘丹, 杨义, 潘立卫. 前驱体和沉淀剂浓度对CuO/ZnO/CeO2-ZrO2甲醇水蒸气重整制氢催化剂性能的影响[J]. 燃料化学学报, 2015,43,(11): 1366-1374. doi: 10.3969/j.issn.0253-2409.2015.11.012ZHANG Lei, LEI Jun-teng, TIAN Yuan, HU Xin, BAI Jin, LIU Dan, YANG Yi, PAN Li-wei. Effect of precursor and precipitant concentration on the performance of CuO/ZnO/CeO2-ZrO2 catalyst for methanol steam reforming[J]. J Fuel Chem Technol, 2015, 43(11): 1366-1374. doi: 10.3969/j.issn.0253-2409.2015.11.012
-
[29]
DAS D, LLORCA J, DOMINGUEZ M, COLUSSI S, TROVARELLI A, GAYEN A. Methanol steam reforming behavior of copper impregnated over CeO2-ZrO2 derived from a surfactant assisted coprecipitation route[J]. Int J Hydrogen Energy, 2015, 40(33): 10463-10479.
-
[30]
张国强, 郭天玉, 郑华艳, 李忠. 焙烧温度对CuCe/Ac催化剂甲醇氧化羰基化性能的影响[J]. 燃料化学学报, 2016,44,(6): 674-679. ZHANG Guo-qiang, GUO Tian-yu, ZHENG Hua-yan, LI Zhong. Effect of calcination temperature on catalytic performance of CuCe/Ac catalysts for oxidative carbonylation of methanol[J]. J Fuel Chem Technol, 2016, 44(6): 674-679.
-
[31]
XIAO S, ZHANG Y F, GAO P, ZHONG L S, LI X P, ZHANG Z Z, WANG H, WEI W, SUN Y H. Highly efficient cu-based catalysts via hydrotalcite-like precursors for CO2 hydrogenation to methanol[J]. Catal Today, 2017, 281: 327-336. doi: 10.1016/j.cattod.2016.02.004
-
[32]
LIU L J, YAO Z J, DENG Y, GAO F, LIU B, DONG L. Nanoscale ceria on the activity of CuO/CeO2 for NO reduction by CO[J]. ChemCatChem, 2011, 3(6): 978-989.
-
[33]
LIANG F L, YU Y, ZHOU W, XU X Y, ZHU Z H. Highly defective CeO2 as a promoter for efficient and stable water oxidation[J]. J Mater Chem A, 2015, 3(2): 634-640. doi: 10.1039/C4TA05770H
-
[1]
-
图 12 反应温度对催化剂CO浓度的影响
Figure 12 CO molar concentrations in the gaseous products as a function of the reaction temperature for the methanol steam reforming at a water/methanol molar ratio of 1.2 and GHSV of 800 h-1
a: Cu/ZnAl; b: Y/Cu/ZnAl; c: La/Cu/ZnAl; d: Ce/Cu/ZnAl; e: Sm/Cu/ZnAl; f: Gd/Cu/ZnAl; g: equil
表 1 催化剂的物化性质及其催化甲醇水蒸气重整反应中氢气产率
Table 1. Textural properties of the M/Cn/ZnAl catalysts modified with various rare earth elements and their hydrogen production rate in the methanol steam reforming
Catalyst ABET
/(m2·g-1)Pore volume
v/(cm3·g-1)CuO crystallite
size d/nmCu surface area
A/(m2·g-1)Cu dispersion
/%YcH2/
(mL·kgcat-1·s-1)Cu/ZnAl 147.0 0.47 34 5.9 10.32 446.2 Y/Cu/ZnAl 101.9 0.39 25 5.3 10.15 414.8 La/Cu/ZnAl 105.5 0.37 24 5.3 10.05 424.4 Ce/Cu/ZnAl 109.6 0.41 23 6.3 11.49 810.7 Sm/Cu/ZnAl 106.0 0.37 25 6.1 11.53 568.5 Gd/Cu/ZnAl 107.6 0.40 24 5.9 11.15 457.3 note: the Cu surface area was measured by N2O chemisorption and Cu dispersion was determined as the ratio of the surface copper amount to the total copper content in the catalysts; The hydrogen production rate (YH2) was obtained by methanol steam reforming under atmospheric pressure, 240 ℃, water methanol molar ratio of 1.2 and GHSV of 800 h-1; no carrier gas was used 表 2 高斯拟合后还原峰位置
Table 2. Positions of the reduction peak by a Gauss fit of the H2-TPR profiles
Catalyst Peak position t/ ℃ peak 1 peak 2 peak 3 Cu/ZnAl 266 324 - Y/Cu/ZnAl 293 305 315 La/Cu/ZnAl 279 297 309 Ce/Cu/ZnAl 242 266 281 Sm/Cu/ZnAl 266 297 - Gd/Cu/ZnAl 266 297 - 表 3 CO的选择性
Table 3. Selectivity to CO over various catalysts
Catalyst Methanol conversion
x/%Selectivity to CO
s/%Temperature
t/ ℃Cu/ZnAl 79 1.6 260 Y/Cu/ZnAl 76 1.1 260 La/Cu/ZnAl 77 1.2 260 Ce/Cu/ZnAl 92 0.9 240 Sm/Cu/ZnAl 83 1.0 250 Gd/Cu/ZnAl 81 0 260 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 6
- 文章访问数: 2335
- HTML全文浏览量: 358






 下载:
下载:











 下载:
下载:

