 图式 1
3-芳基-4-羟基香豆素衍生物的合成
Scheme1.
Synthesis of 3-aryl-4-hydroxy coumarin derivatives
图式 1
3-芳基-4-羟基香豆素衍生物的合成
Scheme1.
Synthesis of 3-aryl-4-hydroxy coumarin derivatives

Citation: Liu Shuainan, Yuan Jinwei, Qu Lingbo. Progress in the Synthesis of Arylated Coumarin Derivatives[J]. Chinese Journal of Organic Chemistry, 2018, 38(2): 316-327. doi: 10.6023/cjoc201708058

香豆素芳基化衍生物合成的研究进展
English
Progress in the Synthesis of Arylated Coumarin Derivatives
-
Key words:
- coumarin
- / transition-metal catalyst
- / arylation
- / synthesis
- / research progress
-
香豆素是一类重要的有机杂环化合物, 具有抗凝血、抗菌、抗炎、抗艾滋病病毒(HIV)和抗癌等生物活性[1~3].由于其分子内有C=C双键、C=O双键及內酯结构, 该类化合物具有很强的荧光, 因此该类化合物在荧光探针、染料和光学材料方面具有重要的应用[4].近年来, 为了进一步提高香豆素的应用范围和价值, 人们对香豆素进行了多种功能化修饰, 包括膦酰化[5, 6]、硝化[7, 8]、卤化[9, 10]、芳甲酰化[11~14]、磺酰化[15]、亚磺酰胺化[16]、烷基化[17, 18]和芳基化[19]等.其中, 芳基化香豆素衍生物是一类重要的具有较高生物活性的药物分子, 通过其衍生得到大量的目标药物分子可以作为单胺氧化酶B (MAO-B)抑制剂、辣根过氧化物酶(HRP)抑制剂和艾滋病病毒I (HIV-I)转录酶抑制剂, 都具有较好的效果[19]; 此外, 芳基化香豆素衍生物具有较强的荧光, 在复杂生物体系中能够用作荧光标记物[20~22].因此, 芳基化香豆素衍生物的合成方法受到人们的广泛关注.
目前, 香豆素的直接芳基化反应已经出现较多的研究和报道, 然而对于芳基化香豆素衍生物的合成方法综述并未见到相关的报道.为了更好地了解该领域的最新动态, 本文根据香豆素发生直接芳基化位置的不同和芳基化试剂的不同进行分类, 对近年来香豆素直接芳基化反应的最新研究进展进行综述.
1 3-芳基香豆素衍生物的合成
1.1 以芳基硼酸酯或芳基硼酸为芳基源
2001年, Bäuerle等[23]以3-溴香豆素衍生物与芳基硼酸酯为原料, 在Pd(PPh3)4催化下, 通过Suzuki偶联反应, 合成了一系列3-芳基香豆素衍生物, 产率为67%~97% (Eq. 1).其中香豆素的空间位阻效应对反应影响不大.该反应体系的底物适用范围较广, 含有供电子基、吸电子基的芳基硼酸酯都能很好的反应, 杂环芳基硼酸酯也具有较好的兼容性.此外, 产物的光学性质研究表明, 此类化合物具有较好的荧光特性.
2011年, Matos等[24]报道了以3-氯香豆素衍生物与取代芳基硼酸为原料, 在醋酸钯和配体的作用下, 通过Suzuki偶联反应成功合成一系列3-芳基香豆素衍生物, 产率为55%~65% (Eq. 2).该催化体系具有很好的官能团兼容性, 能够兼容羟基、氨基、卤基等官能团.
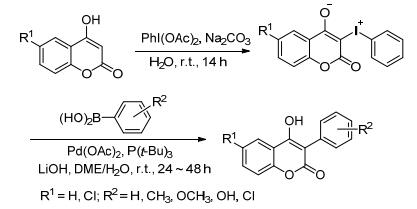
Serra课题组[25~27]和Zhu课题组[28]分别以4-羟基香豆素为原料, 首先在Na2CO3碱性条件下与二醋酸碘苯反应得到3位取代的内盐; 然后以Pd(OAc)2为催化剂, P(t-Bu)3为配体, 在碱性条件下反应24~48 h, 得到3-芳基-4-羟基香豆素衍生物(Scheme 1).其活性研究表明, 该类化合物具有中等强度的杀锥虫活性和较好的抗氧化活性, 另外, 可以作为单胺氧化酶抑制剂使用.该方法需要二步完成, 使用Pd(OAc)2为催化剂和P(t-Bu)3为配体, 且反应时间较长.
2012年, Blagg等[29]报道了以3-溴香豆素衍生物与取代芳基硼酸为反应底物, 在Pd(Ⅱ)催化下, 碳酸钾为碱, 在二氧六环溶剂中通过Suzuki偶联反应, 合成了系列3-芳基香豆素衍生物, 产率为39%~78% (Eq. 3).该类化合物的抗恶性肿瘤增殖活性实验表明, 对SKBr3和MCF-7等胸腺癌细胞具有一定的抑制作用, 且3-位芳基上有吸电子基团时抑制活性高于供电子基团.
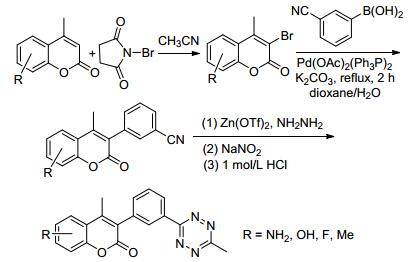
2014年, Weissleder等[30]报道了以4-甲基香豆素衍生物为原料, 首先与N-溴代丁二酰亚胺(NBS)进行溴代反应得到4-甲基-3-溴香豆素衍生物; 然后与间氰基苯硼酸在Pd(OAc)2为催化剂, Ph3P为配体的作用下发生Suzuki偶联反应, 得到4-甲基-3-芳基香豆素衍生物; 最后再与肼发生环合反应, 得到一系列含有多氮杂环的3-芳基香豆素衍生物(Scheme 2).该类化合物具有较强的荧光特性, 可以用来作为荧光探针, 在生物、医药方面具有重要的用途.
以芳基硼酸或芳基硼酸酯为原料, 利用贵金属催化的香豆素的芳基化反应虽然已经取得重要的研究进展, 但是相比较钯等贵金属催化剂, 发展廉价且低毒的其它过渡金属催化剂来实现该反应无疑会极大地降低成本. 2014年, Das等[31]报道了在循环利用的纳米晶铁酸镍催化下, 3-溴香豆素与取代芳基硼酸反应, 得到3-芳基香豆素衍生物(Eq. 4), 该催化体系还能适用于杂环化合物的C—N和C—O键的构建.该反应具有催化剂廉价易得, 能够重复循环利用等优点.
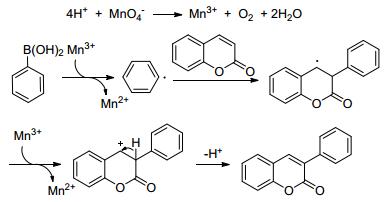
2016年, 本课题组[19]报道了以香豆素为底物, 利用芳基硼酸为芳基源, 在KMnO4/AcOH介质中80 ℃条件下反应0.5 h, 合成了25个3-芳基香豆素衍生物(Eq. 5);该合成方法不仅适用于3-芳基香豆素衍生物的合成, 而且能够用于合成喹啉酮芳香杂环化合物的芳基化.该反应体系具有反应条件温和, 反应时间短, 产率高等优点.此外, 该反应体系具有较好的官能团兼容性, 能够兼容羟基、氰基、卤基、醛基等官能团, 且底物的位阻效应影响较小.通过控制实验, 对该反应的反应机理进行了研究, 反应机理是: KMnO4与AcOH反应生成Mn3+; 苯硼酸被Mn3+氧化成苯基自由基; 然后苯基自由基进攻香豆素的3-位碳原子, 生成中间体碳自由基; 该碳自由基在Mn3+作用下, 生成中间体碳正离子; 最后中间体碳正离子脱去一个质子, 生成目标产物3-芳基香豆素(Scheme 3).
1.2 以卤代芳烃为芳基源
2010年, Baumgartner等[32]报道了以4-羟基香豆素和芳基碘为原料, 在KOBu-t作用下, 在DMSO溶剂中, 通过光照, 利用光诱导的自由基反应合成系列3-芳基-4-羟基香豆素衍生物, 产率为27%~79% (Eq. 6).该方法虽然反应条件比较温和, 原料也廉价易得, 但是反应使用到强碱KOBu-t, 且底物的适用范围有限, 反应产率不够理想.
同年, Pereira等[33]报道了以香豆素与取代碘苯为原料, Pd(PPh3)4为催化剂, MeCO2Ag为碱, 在N, N-二甲基甲酰胺(DMF)溶剂中80 ℃反应72 h, 通过Heck偶联反应选择性合成了系列的3-芳基香豆素衍生物(Eq. 7).该反应的优点是具有明显的立体选择性, 但是反应时间较长, 且需要使用金属钯催化剂.
2012年, Messaoudi等[34]报道了以3-羧基香豆素或3-羧基喹啉酮与取代碘苯为原料, 在PdBr2和Ag2CO3双金属催化剂作用下, DPEPhos为配体, 150 ℃的微波辅助下反应1 h, 得到了脱羧偶联产物3-芳基香豆素或3-芳基喹啉酮衍生物(Eq. 8).该方法具有底物适用范围广、产率高等优点, 但是需要使用钯和银双金属催化剂和不易获得的配体, 反应温度高, 且需要微波辅助来完成.
2013年, Alami等[35]报道了以香豆素-3-甲酸与取代碘苯为底物, PdBr2为催化剂, 三苯基砷为配体, Ag2CO3为氧化剂, 甲苯与DMF为混合溶剂, 微波作用下150 ℃反应2 h, 通过脱羧偶联反应得到系列3-芳基香豆素衍生物, 产率为64%~88% (Eq. 9).该反应需要香豆素-3-甲酸为底物, 原料贵且不易得到, 使用PdBr2为催化剂, 反应温度较高, 底物适用范围也很有限.
同年, Jafarpour等[36]报道了以香豆素-3-甲酸与取代碘苯为原料, PdCl2为催化剂, Ag2CO3为氧化剂, DMSO为溶剂, 在120 ℃温度下反应5 h, 通过脱羧偶联反应得到系列3-芳基香豆素衍生物, 产率为25%~92% (Eq. 10).该反应中虽然不需要配体, 产率也较高, 但是需要预官能团化的香豆素-3-甲酸为底物, 原料贵且不易得到, 且该反应需要PdCl2为催化剂.
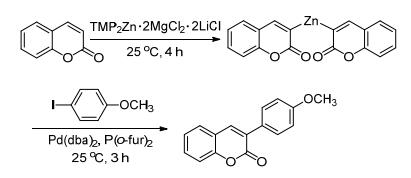
Knochel等[37, 38]报道了使用TMP2Zn·2MgCl2·2LiCl作为锌酸化试剂, 与香豆素反应生成香豆素的锌化试剂; 然后在Pd(dba)2催化下与对甲氧基碘苯反应, 得到香豆素的3-芳基化衍生物(Scheme 4).另外, 利用该方法, 可以实现对其它芳香(杂环)化合物进行芳基化或酰化等反应.
2014年, Yakushiji等[39]报道了以4-羟基香豆素与取代碘苯为底物, Pd(OAc)2为催化剂, 2-联苯基二环己基膦为配体, Ag2CO3为氧化剂, 间硝基苯甲酸为辅助剂, 在六氟异丙醇中反应2 h得到系列3-芳基-4-羟基香豆素衍生物, 产率为24%~66% (Eq. 11).该反应需要使用Pd(OAc)2作为催化剂, 底物适用范围有限, 且反应产率不高.
2015年, McGlacken等[40]报道了以4-取代香豆素衍生物为原料, 三(二亚苄基丙酮)二钯[Pd2(dba)3]为催化剂, PPh3为配体, 特戊酸(PivOH)为辅助剂, Na2CO3为碱, 在N-甲基吡咯烷酮(NMP)溶剂中130 ℃反应2 h, 通过分子内的偶联反应, 得到一系列3-芳基香豆素衍生物, 产率为34%~85% (Eq. 12).该方法反应温度较高, 使用金属钯为催化剂, 反应产率适中.
1.3 以芳基肼为芳基源
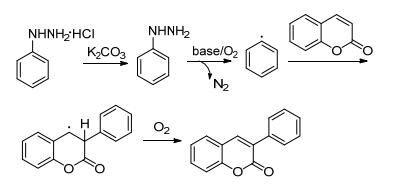
芳基肼类化合物是一种重要的有机化合物, 该化合物廉价易得, 在不同的氧化条件下, 都可以脱去肼基生成相对应的芳基自由基, 因此对于芳基化反应来说, 芳基肼是一种重要的芳基源. 2016年, Yadav等[41]发现以香豆素与芳基肼盐酸盐为反应底物, 在K2CO3作用下, 在DMSO溶剂中室温下反应4~24 h合成了系列3-芳基香豆素衍生物, 产率为20%~85% (Eq. 13), 具有供电子基团的芳基肼产率明显高于带有吸电子基团的芳基肼.该反应可能的机理是:芳基肼盐酸盐首先在碱作用下生成芳基肼; 在碱和空气中氧气的作用下芳基肼脱去氮气, 生成中间体芳基自由基; 自由基与香豆素的3位反应得到一个中间体碳自由基; 最后在氧气的作用下, 生成目标产物3-芳基香豆素(Scheme 5).
同年, 本课题组[42]报道了利用芳基肼为芳基源, 使用KMnO4为氧化剂, 在乙腈溶剂中与香豆素在80 ℃下反应3 h, 合成了24个3-芳基香豆素衍生物(Eq. 14).该方法反应条件温和, 反应时间短, 产率高; 且反应体系的底物兼容性好, 能够兼容卤基、醛基、氰基、三氟甲基、氨基和羟基等官能团.研究机理研究表明该反应是一个自由基反应.
1.4 以芳基磺酰氯或芳基亚磺酸钠为芳基源
2013年, Jafarpour等[43]报道了以香豆素与芳基磺酰氯或芳基亚磺酸钠为原料, 氯化钯和醋酸铜或氯化铜为催化剂, 二氧六环为溶剂, 在80~100 ℃的温度下反应24 h, 得到系列的3-芳基香豆素衍生物, 产率为47%~87% (Eq. 15).该反应的机理是:首先通过氧化加成反应, 金属钯与芳基磺酰氯反应生成中间体A; A通过脱去SO2生成芳基氯化钯B; 钯(Ⅱ)通过对香豆素3位碳氢键的活化, 生成中间体C, C与B经过一个金属转移反应得到二芳基金属钯化合物D; 最后, D通过一个还原消除反应得到目标产物3-芳基香豆素衍生物(Scheme 6).
1.5 以芳基重氮盐为芳基化试剂
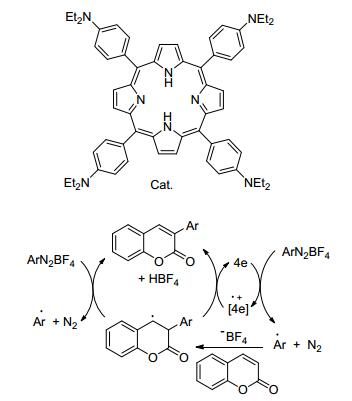
2015年, Kanai等[44]报道了使用催化量的卟啉衍生物为催化剂, 以取代香豆素与取代的四氟硼酸芳基重氮盐为原料, 通过Meerwein芳基化反应, 选择性对香豆素的3位进行了芳基化, 产率达36%~78% (Eq. 16).该方法具有底物适用范围广、反应条件温和环境友好等优点.该反应的机理研究表明, 这个反应是一个自由基反应历程(Scheme 7).
近年来, 光催化反应在有机合成中得到广泛的应用.由于该方法具有反应条件温和、试剂清洁、反应温度低、不需要基团保护和缩短合成路线等优点, 符合绿色化学和可持续发展的需要, 可见光催化化学已经成为有机合成方法学领域最重要的研究方向之一, 在天然产物、医药和材料等合成中受到有机化学家的重视.可见光催化一般以催化量的Ru, Ir, Au等过渡金属的络合物[45~47], 或有机小分子染料为光敏剂激发产生高活性的自由基[48], 从而在大多数情况下避免使用当量氧化剂、还原剂或自由基引发剂, 因此可实现诸多经典化学反应在更温和的条件下进行.
2012年König等[49]发现以芳基烯、炔或共轭烯香豆素与四氟硼酸芳基重氮盐为原料, 在光引发剂[Ru(bpy)3]2+催化下, 在DMSO溶剂中采用蓝光照射, 合成了系列芳基化的衍生物(Eq. 17).该合成方法反应条件温和, 底物适用范围广, 产率高等优点. 2013年, König等[50]报道了又以四氟硼酸芳基重氮盐作为芳基源, 在光引发剂[Ru(bpy)3]2+催化下, 对链接有香豆素母体的纤维素聚合物成功实现了芳基化(Eq. 18).
2017年, Gryko等[51]报道了利用卟啉衍生物H2T-(F5P)P为催化剂, 在455 nm的LED灯照射下, 以香豆素与芳基重氮盐为原料, 在DMSO溶剂中反应, 合成了2种3-芳基香豆素衍生物, 产率分别为71%和73% (Eq. 19).该方法具有反应条件温和、无金属催化剂、产率高等优点.
1.6 以芳烃为芳基化试剂
在香豆素的3位芳基化研究中, 以芳烃作为芳基源是最具挑战性的底物之一. 1990年, Matsuura等[52]发现以3-溴香豆素与芳烃或杂环芳烃为底物, 在乙腈或乙腈-丙酮的混合溶剂中, 室温下用光照射30~55 h, 成功合成系列的3-芳基香豆素衍生物, 部分化合物的结构通过单晶结构进行了证实, 目标化合物的产率为48%~87% (Eq. 20).该合成方法条件温和、环境友好、符合绿色化学的理念, 但是反应时间较长.
2013年, Jafarpour等[53]报道了以香豆素与取代芳烃为原料, 在醋酸钯催化下, 三氟乙酸酐(TFAA)为溶剂, 在120 ℃温度下反应16 h得到系列的3-芳基香豆素衍生物, 产率51%~91% (Eq. 21).该反应具有原子利用率高等优点, 但是不足之处是反应温度高, 反应时间长底物适用范围有限.
2014年, You研究小组[54]发现以取代芳烃为芳基源, 香豆素或醌类化合物为反应底物, Pd(OAc)2为催化剂, (NH4)2S2O8为氧化剂, 在室温下反应24 h, 合成了一系列3-芳基香豆素衍生物和芳基化醌类衍生物, 产率为74%~79% (Eq. 22).该合成方法反应条件温和, 原料廉价易得, 反应产率高.
1.7 以金属有机化合物为芳基源
金属有机化合物芳基醋酸铅(Ⅳ)是一种有用的芳基化试剂, 这种试剂性质类似芳基铋化合物, 能够作为芳基阳离子的等价物对一定结构的碳原子有效进行芳基化[55]. Barton等[56~58]报道了以4-羟基香豆素和芳基醋酸铅为反应底物, 在吡啶作用下, 合成了3-芳基4-羟基香豆素衍生物, 产率为40%~97% (Eq. 23).该反应虽然反应条件比较温和, 但是使用到重金属铅的有机物为芳基源.
1.8 以其它芳基化合物为芳基源
2016年, Hirano等[59]报道了以2-吡啶酮或香豆素为原料, 分别与二苯基碘三氟甲磺酸盐在光催化剂Ir(ppy)3作用下, 通过蓝色LEDs照射发生光化学反应, 得到目标产物3-芳基2-吡啶酮或3-芳基香豆素(Eq. 24).该反应使用芳基碘(Ⅲ)试剂作为芳基化试剂, 表现出极好的区域选择性.
2 4-芳基化香豆素衍生物的合成
在香豆素的芳基化反应中, 常见的是对香豆素的3位进行芳基化, 对香豆素的4位进行芳基化报道较少, 如何有效地控制来实现对香豆素进行选择性芳基化是极其重要的科学问题.最近, 通过对香豆素进行预官能团化或特定的催化剂和配体为解决以上问题提供了一条新的途径.
2.1 以芳基硼酸为芳基源
2004年, Hu等[60]报道了以香豆素-4-磺酸酯和芳基硼酸为原料, Ni(COD)2为催化剂, PCy3为配体, K3PO4为碱, 在THF溶剂中室温下反应4 h, 合成10个4-芳基香豆素衍生物, 产率达到84%~94% (Eq. 25).此外, 该方法可以用于其它芳香杂化磺酸酯的芳基化.
2009年, Wu等[61]以4-羟基香豆素和芳基硼酸为反应底物, 在PdCl2催化下, 同时加入TsCl和Na2CO3, 在四氢呋喃和水的混合溶剂中, 通过一锅煮的方法在60 ℃下反应12 h, 合成了17个4-芳基香豆素衍生物, 产率为52%~98% (Eq. 26).该方法反应条件比较温和, 且利用一锅煮的方法避免了中间产物的分离, 也具有较好的底物兼容性, 卤基、氰基、三氟甲基等官能团都能够兼容.
同年, Doi等[62]使用N-杂环卡宾Ni复合物为催化剂, 香豆素-4-磺酸酯与芳基硼酸为反应底物, K3PO4为碱, 在DME溶剂中120 ℃温度下反应2~12 h, 通过Suzuki-Miyaura偶联反应, 合成了7个4-芳基香豆素衍生物, 产率40%~90% (Eq. 27).此外, 该方法还可以用于其它芳基磺酸酯的芳基化.
2011年, Hu等[63]报道了以香豆素-4-磺酸酯和芳基硼酸为原料, Ni(PCy3)2Br2为催化剂, K3PO4为碱, 在THF和H2O的混合溶剂中室温下反应10 h, 合成5个4-芳基香豆素衍生物, 产率达到88%~97% (Eq. 28).该方法具有反应条件温和, 催化剂廉价易得, 反应产率高等优点.
同年, Kwong等[64]以香豆素-4-磺酸酯和芳基硼酸为原料, Pd(OAc)2为催化剂, CM-phos为配体, K3PO4为碱, 在t-BuOH溶剂中50 ℃温度下反应2 h, 合成3个4-芳基香豆素衍生物, 产率达到75%~97% (Eq. 29).此外, 该方法可以用于其它芳香杂化磺酸酯和烯基磺酸酯的芳基化.
2012年, Serrano等[65]首先合成出金属钯的二聚体复合物, 并得到其晶体结构, 对其晶体结构和光学特性进行了研究.此外, 利用该二聚体金属钯复合物为催化剂, 以香豆素-4-磺酸酯和芳基硼酸为原料, Na2CO3为碱, 在THF溶剂中80 ℃反应14 h, 合成4个4-芳基香豆素衍生物, 产率达到61%~84% (Eq. 30).
同年, Li和Jafarpour等[66, 67]报道了以香豆素与取代芳基硼酸为原料, 醋酸钯为催化剂, 邻二氮菲(phen)或硝基芳烃(phen-NO2)为配体, 氧气为氧化剂, 在80~100 ℃的DMF溶剂中通过Heck偶联反应24 h, 得到系列4-芳基香豆素衍生物, 产率为42%~97% (Eq. 31).该方法具有反应条件相对温和, 产率高等优点, 但是反应时间较长.
2012年, Duan等[66]以香豆素与芳基硼酸为原料, Pd(OAc)2为催化剂, Phen-NO2为配体, O2为氧化剂, 在DMF溶剂中80 ℃温度下反应24 h, 通过Heck偶联反应, 高选择性合成19个4-芳基香豆素衍生物, 产率为42%~97% (Eq. 32).该方法具有反应原料廉价易得, 反应条件相对温和, 底物适用范围广和区域选择性高等优点.
2013年, Kapdi等[68]报道了以4-卤代香豆素(或4-磺酸酯香豆素或4-羟基香豆素)与芳基硼酸为原料, 金属钯为催化剂, Na2CO3作为碱, 在THF溶剂中70 ℃反应3~24 h, 通过Suzuki-Miyaura反应合成了17个4-芳基香豆素衍生物, 产率为75%~98% (Eq. 33).该合成方法虽然产物产率较高, 但是反应需要提前制备金属钯的复合物, 且反应时间较长.
同年, Jafarpour等[69]报道了以香豆素-3-羧酸为原料, 与芳基硼酸在醋酸钯为催化剂, 邻二氮菲(phen)为配体, 氧气为氧化剂, 在100 ℃的DMF溶剂中通过Heck偶联反应24 h, 得到16个4-芳基香豆素衍生物, 产率为10%~80% (Eq. 34).该方法通过一步反应完成香豆素3位的脱羧和4位的芳基化, 具有高度的立体选择性.
Pale等[70, 71]以芳基硼酸为芳基源, 以香豆素-4-对硝基苯磺酸酯为反应底物, 在PdCl2(dppf)2催化下, K2CO3为碱, 在THF溶剂中反应, 得到6个4-芳基香豆素衍生物, 产率为87%~95% (Eq. 35).另外, 该方法还可以用于其它共轭烯烃的芳基化.该方法具有反应条件温和, 产率高等优点, 但是反应原料需要制备.
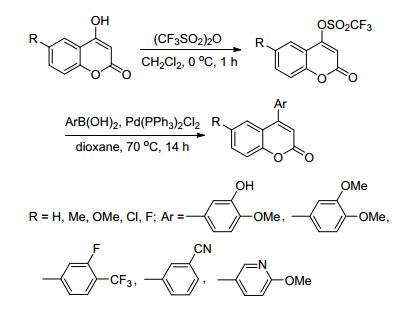
2017年, Chibale等[72]报道了以4-羟基香豆素为原料, 与三氟甲基磺酸酐反应得到香豆素-4-甲磺酸酯衍生物; 然后与芳基硼酸在Pd(PPh3)2Cl2催化下, 在二氧六环溶剂中70 ℃反应14 h, 得到26个4-芳基香豆素衍生物(Scheme 8).活性实验研究表明, 部分化合物对HT29D4、CA-4癌细胞等具有明显的抑制作用.
2.2 以芳烃为芳基源
2012年, Hong等[73]报道了以香豆素与取代芳烃为原料, 三氟醋酸钯为催化剂, 三甲基醋酸银为氧化剂, 三甲基醋酸铯为辅助剂, 在120 ℃的三甲基醋酸溶剂中反应6~12 h, 得到系列4-芳基香豆素衍生物, 产率41%~85% (Eq. 36).该方法具有原子利用率高, 底物适用范围广等优点.
2.3 以芳基金属化合物为芳基源
2001年, Yang等[74]报道了以香豆素-4-磷酸酯与有机金属试剂芳基卤化锌为反应底物, 在NiCl2(dppe)催化下, 在苯溶剂中25 ℃温度下反应, 得到12个4-芳基香豆素衍生物, 产率为75%~91% (Eq. 37).该反应条件比较温和, 产率较高, 但是使用到有机金属锌试剂, 且反应原料不易得到, 需要制备.
2010年, Rao等[75]使用PdCl2(PPh3)2为催化剂, K3PO4为碱, 4-溴香豆素或香豆素-4-磺酸酯为原料, 与有机金属试剂三芳基铋在N, N-二甲基乙酰胺(DMA)溶剂中90 ℃反应2 h, 合成了46个4-芳基香豆素衍生物, 产率为78%~98% (Eq. 38).该方法具有反应条件温和, 产率高的特点. 2014年, Rao等[76]又报道了以三芳基铋为芳基化试剂, 以4-氯香豆素为原料, 在PdCl2(PPh3)2催化下, KOAc为碱, 在DMA溶剂中90 ℃反应2 h, 合成了42个4-芳基香豆素衍生物, 产率为72%~85% (Eq. 39).
2010年, Wu等[77]以三芳基铟为芳基化试剂, 香豆素-4-磺酸酯为原料, 在Pd(OAc)2催化下, 在四氢呋喃(THF)溶剂中室温反应不到1 min, 能够高效合成4-芳基香豆素衍生物, 产率达到70%~98% (Eq. 40).该方法具有反应条件温和, 反应时间短而产率高等特点.
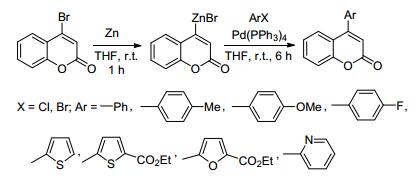
2011年, Kim等[78]报道了以4-溴香豆素为原料, 室温下首先与锌在THF中反应合成了香豆素-4-溴化锌衍生物; 然后与卤代(杂环)芳烃在Pd(PPh3)4催化下, 在THF中室温下反应6 h, 得到了8个4-芳基香豆素衍生物, 产率为75%~88% (Scheme 9).该反应条件比较温和, 产率高, 但是使用到有机金属锌试剂, 且需要多步来完成反应.
2.4 以芳基三氟硼酸钾为芳基源
2006年, Wu等[79]报道了以芳基三氟硼酸钾为芳基源, 香豆素-4-磺酸酯为反应底物, 在Pd(PPh3)4催化下, 碳酸铯作为碱, 在甲苯溶剂中, 80 ℃条件下反应12 h, 通过Suzuki-Miyaura偶联反应, 合成了13个4-芳基香豆素衍生物, 产率为40%~92% (Eq. 41).另外, Wu课题组[80]以相同的反应底物, 在RhCl(PPh3)3为催化剂, dppf为配体, K2HPO4作为碱的条件下, 得到了相同的产物(Eq. 42).
3 3, 4-二芳基化香豆素衍生物的合成
2007年, Wu等[81]以4-羟基香豆素为原料, 经过与N-溴代丁二酰亚胺(NBS)发生溴代反应, 与对甲基苯磺酰氯(TsCl)发生磺酰化反应后得到3-溴香豆素-4-对甲基苯磺酸酯; 然后再与取代芳基硼酸在催化剂Pd(PhCN)2Cl2的催化下进行选择性反应, 得到3-溴-4-芳基香豆素衍生物, 产率达66%~96%;在Pd(OAc)2为催化剂, PCy3为配体的作用下, 3-溴-4-芳基香豆素衍生物与芳基硼酸反应, 得到3, 4-二芳基香豆素衍生物, 产率为76%~87% (Scheme 10).该合成方法反应条件温和, 产率高, 但是需要多步反应, 且需要金属Pd作为催化剂.
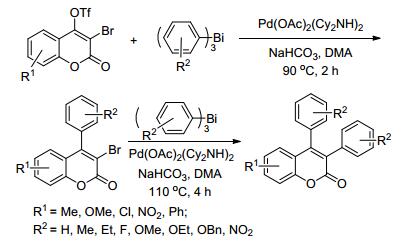
2015年, Rao等[82]使用Pd(OAc)2(Cy2NH)2为催化剂, NaHCO3为碱, 3-溴香豆素-4-磺酸酯为原料, 与有机金属试剂三芳基铋在DMA溶剂中90 ℃反应2 h, 合成了29个3-溴-4-芳基香豆素衍生物, 产率为36%~88%;使用上述催化体系, 3-溴-4-芳基香豆素与三芳基铋在DMA溶剂中110 ℃反应4 h, 可以得到3, 4-二芳基香豆素衍生物(Scheme 11).
4 展望
综上所述, 随着香豆素芳基化衍生物在医药、农药、生物及材料等领域应用范围越来越广泛, 有关其合成方法的报道也逐年增多.本文分别以香豆素进行芳基化的位置不同与使用的芳基化试剂不同进行分类, 对香豆素芳基化衍生物的合成方法进行了归纳和总结.文中所述合成方法各有其优缺点, 能够适用不同原料和条件下目标产物的合成.
近年来, 随着研究的不断深入, 一些高效、环境友好、绿色环保的合成方法如无催化剂、无溶剂或水为溶剂进行合成等逐步被发现, 这是香豆素芳基化衍生物合成方法发展的趋势, 符合绿色化学的理念.相信在接下来的时间里, 经过化学工作者的努力, 香豆素芳基化衍生物合成的新方法将会更加经济、绿色、高效和实用.
-
-
[1]
Sekino, E.; Kumamoto, T.; Tanaka, T.; Ikeda, T.; Ishikawa, T. J. Org. Chem. 2004, 69, 2760. doi: 10.1021/jo035753t
-
[2]
Anand, P.; Singh, B.; Singh, N. Bioorg. Med. Chem. 2012, 20, 1175. doi: 10.1016/j.bmc.2011.12.042
-
[3]
Musa, M. A.; Cooperwood, S.; Khan, M.; Omar, F. Curr. Med. Chem. 2008, 15, 2664. doi: 10.2174/092986708786242877
-
[4]
Ma, Y.; Luo, W.; Quinn, P. J. J. Med. Chem. 2004, 47, 6349. doi: 10.1021/jm049751s
-
[5]
Yuan, J. W.; Li, Y. Z.; Yang, L. R.; Mai, W. P.; Mao, P.; Xiao, Y. M.; Qu, L. B. Tetrahedron 2015, 71, 8178. doi: 10.1016/j.tet.2015.08.026
-
[6]
Mi, X.; Huang, M. M.; Zhang, J. Y.; Wang, C. Y.; Wu, Y. J. Org. Lett. 2013, 15, 6266. doi: 10.1021/ol4031167
-
[7]
Mashelkar, U. C.; Audi, A. A. J. Indian Chem. Soc. 2005, 82, 258. http://cat.inist.fr/?aModele=afficheN&cpsidt=16659176
-
[8]
Ganguly, N.; Sukai, A. K.; De, S. Synth. Commun. 2001, 31, 301. doi: 10.1081/SCC-100000214
-
[9]
Gavara, L.; Boisse, T.; Rigo, B.; Hénichart, J. P. Tetrahedron 2008, 64, 4999. doi: 10.1016/j.tet.2008.03.085
-
[10]
Thapliyal, P. C.; Singh, P. K.; Khanna, R. N. Synth. Commun. 1993, 23, 2821. doi: 10.1080/00397919308012602
-
[11]
Wang, H.; Zhou, S. L.; Guo, L. N.; Duan, X. H. Tetrahedron 2015, 71, 630. doi: 10.1016/j.tet.2014.12.029
-
[12]
Yuan, J. W.; Yin, Q. Y.; Yang, L. R.; Mai, W. P.; Mao, P.; Xiao, Y. M.; Qu, L. B. RSC Adv. 2015, 5, 88258. doi: 10.1039/C5RA16573C
-
[13]
Adib, M.; Rajai-Daryasarei, S.; Pashazadeh, R.; Tajik, M.; Mirzaei, P. Tetrahedron Lett. 2016, 57, 3701. doi: 10.1016/j.tetlet.2016.06.061
-
[14]
Jafarpour, F.; Abbasnia, M. J. Org. Chem. 2016, 81, 11982. doi: 10.1021/acs.joc.6b02051
-
[15]
Cremlyn, R. J.; Clowes, S. M. J. Chem. Soc. Pak. 1988, 10, 97.
-
[16]
刘明, 刘阳, 刘艾林, 张冬凯, 陈明桂, 吴长春, 华学文, 周莎, 李正名, 有机化学, 2016, 36, 1653. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=yjhx201607020Liu, M.; Liu, Y.; Liu, A. L.; Zhang, D. K.; Chen, M. G.; Wu, C. C.; Hua, X. W.; Zhou, S.; Li, Z. M. Chin. J. Org. Chem. 2016, 36, 1653(in Chinese). http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=yjhx201607020
-
[17]
Dian, L. Y.; Zhao, H.; Zhang-Negrerie, D.; Du, Y. F. Adv. Synth. Catal. 2016, 358, 2422. doi: 10.1002/adsc.201600349
-
[18]
Niu, B.; Zhao, W.; Ding, Y.; Bian, Z.; Pittman Jr, C. U.; Zhou, A.; Ge, H. J. Org. Chem. 2015, 80, 7251. doi: 10.1021/acs.joc.5b00800
-
[19]
Yuan, J. W.; Yang, L. R.; Yin, Q. Y.; Mao, P.; Qu, L. B. RSC Adv. 2016, 6, 35936. doi: 10.1039/C6RA04787D
-
[20]
Wang, C.; Wu, C.; Zhu, J.; Miller, R. H.; Wang, Y. J. Med. Chem. 2011, 54, 2331. doi: 10.1021/jm101489w
-
[21]
王少静, 李长伟, 李锦, 陈邦, 郭媛, 化学学报, 2017, 75, 383. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxxb201704007&dbname=CJFD&dbcode=CJFQWang, S. J.; Li, C. W.; Li, J.; Chen, B.; Guo, Y. Acta Chim. Sinica 2017, 75, 383(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxxb201704007&dbname=CJFD&dbcode=CJFQ
-
[22]
李长伟, 杨栋, 尹兵, 郭媛, 有机化学, 2016, 36, 787. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201604014&dbname=CJFD&dbcode=CJFQLi, C. W.; Yang, D.; Yin, B.; Guo, Y. Chin. J. Org. Chem. 2016, 36, 787(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201604014&dbname=CJFD&dbcode=CJFQ
-
[23]
Schiedel, M. S.; Briehn, C. A.; Bäuerle, P. Angew. Chem., Int. Ed. 2001, 40, 4677. doi: 10.1002/1521-3773(20011217)40:24<>1.0.CO;2-C
-
[24]
Matos, M. J.; Vazquez-Rodriguez, S.; Borges, F.; Santana, L.; Uriarte, E. Tetrahedron Lett. 2011, 52, 1225. doi: 10.1016/j.tetlet.2011.01.048
-
[25]
Pérez-Cruz, F.; Serra, S.; Delogu, G.; Lapier, M.; Maya, J. D.; Olea-Azar, C.; Santana, L.; Uriarte, E. Bioorg. Med. Chem. Lett. 2012, 22, 5569. doi: 10.1016/j.bmcl.2012.07.013
-
[26]
Serra, S.; Chicca, A.; Delogu, G.; Vázquez-Rodríguez, S.; Santana, L.; Uriarte, E.; Casu, L.; Gertsch, J. Bioorg. Med. Chem. Lett. 2012, 22, 5791. doi: 10.1016/j.bmcl.2012.07.099
-
[27]
Delogu, G. L.; Serra, S.; Quezada, E.; Uriarte, E.; Vilar, S.; Tatonetti, N. P.; Vi a, D. ChemMedChem 2014, 9, 1672. http://www.ncbi.nlm.nih.gov/pubmed/24782464
-
[28]
Zhu, Q.; Wu, J.; Fathi, R.; Yang, Z. Org. Lett. 2002, 4, 3333. doi: 10.1021/ol020159b
-
[29]
Zhao, H. P.; Yan, B.; Peterson, L. B.; Blagg, B. S. J. ACS Med. Chem. Lett. 2012, 3, 327. doi: 10.1021/ml300018e
-
[30]
Meimetis, L. G.; Carlson, J. C. T.; Giedt, R. J.; Kohler, R. H.; Weissleder, R. Angew. Chem., Int. Ed. 2014, 53, 7531. doi: 10.1002/anie.201403890
-
[31]
Paul, S.; Pradhan, K.; Ghosh, S.; De, S. K.; Das, A. R. Adv. Synth. Catal. 2014, 356, 1301. doi: 10.1002/adsc.v356.6
-
[32]
Rodríguez, S. A.; Baumgartner, M. T. Tetrahedron Lett. 2010, 51, 5322. doi: 10.1016/j.tetlet.2010.08.013
-
[33]
Martins, S.; Branco, P. S.; de la Torre, M. C.; Sierra, M. A.; Pereira, A. Synlett 2010, 2918. doi: 10.1055/s-0030-1259014
-
[34]
Messaoudi, S.; Brion, J. D.; Alami, M. Org. Lett. 2012, 14, 1496. doi: 10.1021/ol300235k
-
[35]
Carrër, A.; Brion, J. D.; Messaoudi, S.; Alami, M. Adv. Synth. Catal. 2013, 355, 2044. doi: 10.1002/adsc.v355.10
-
[36]
Jafarpour, F.; Zarei, S.; Barzegar, M.; Olia, A.; Jalalimanesh, N.; Rahiminejadan, S. J. Org. Chem. 2013, 78, 2957. doi: 10.1021/jo302778d
-
[37]
Unsinn, A.; Wunderlich, S. H.; Knochel, P. Adv. Synth. Catal. 2013, 355, 989. doi: 10.1002/adsc.201300049
-
[38]
Wunderlich, S. H.; Knochel, P. Angew. Chem., Int. Ed. 2007, 46, 7685. doi: 10.1002/(ISSN)1521-3773
-
[39]
Yakushiji, F.; Haramo, M.; Miyadera, Y.; Uchiyama, C.; Takayama, K.; Hayashi, Y. Tetrahedron Lett. 2014, 55, 3316. doi: 10.1016/j.tetlet.2014.04.041
-
[40]
Pardo, L. M.; Prendergast, A. M.; Nolan, M. T.; Muimhneacháin, E. Ó.; McGlacken, G. P. Eur. J. Org. Chem. 2015, 2015, 3540. doi: 10.1002/ejoc.v2015.16
-
[41]
Chauhan, P.; Ravi, M.; Singh, S.; Prajapati, P.; Yadav, P. P. RSC Adv. 2016, 6, 109. doi: 10.1039/C5RA20954D
-
[42]
Yuan, J. W.; Li, W. J.; Yang, L. R.; Mao, P.; Xiao, Y. M. Z. Naturforsch. B 2016, 71, 1115. http://www.degruyter.com/view/j/znb.ahead-of-print/znb-2016-0109/znb-2016-0109.xml
-
[43]
Jafarpour, F.; Barzegar, M.; Olia, A.; Hazrati, H. Adv. Synth. Catal. 2013, 355, 3407. doi: 10.1002/adsc.201300707
-
[44]
Kojima, M.; Oisaki, K.; Kanai, M. Chem. Commun. 2015, 51, 9718. doi: 10.1039/C5CC02349A
-
[45]
Tucker, J. W.; Stephenson, C. R. J. J. Org. Chem. 2012, 77, 1617. doi: 10.1021/jo202538x
-
[46]
Teegardin, K.; Day, J. I.; Chan, J.; Weaver, J. Org. Process Res. Dev. 2016, 20, 1156. doi: 10.1021/acs.oprd.6b00101
-
[47]
Skubi, K. L.; Blum, T. R.; Yoon, T. P. Chem. Rev. 2016, 116, 10035. doi: 10.1021/acs.chemrev.6b00018
-
[48]
Hari, D. P.; König, B. Org. Lett. 2011, 13, 3852. doi: 10.1021/ol201376v
-
[49]
Schroll, P.; Hari, D. P.; König, B. ChemistryOpen 2012, 1, 130. doi: 10.1002/open.201200011
-
[50]
Schroll, P.; Fehl, C.; Dankesreiter, S.; König, B. Org. Biomol. Chem. 2013, 11, 6510. doi: 10.1039/c3ob40990b
-
[51]
Rybicka-Jasińska, K.; König, B.; Gryko, D. Eur. J. Org. Chem. 2017, 2104.
-
[52]
Meng, J. B.; Shen, M. G.; Fu, D. C.; Gao, Z. H.; Wang, R. J.; Wang, H. G.; Matsuura, T. Synthesis 1990, 719. http://www.researchgate.net/publication/244564451_A_Photochemical_Synthesis_of_3-Arylcoumarins
-
[53]
Jafarpour, F.; Hazrati, H.; Mohasselyazdi, N.; Khoobi, M.; Shafiee, A. Chem. Commun. 2013, 49, 10935. doi: 10.1039/c3cc46959j
-
[54]
She, Z.; Shi, Y.; Huang, Y.; Cheng, Y.; Song, F.; You, J. Chem. Commun. 2014, 50, 13914. doi: 10.1039/C4CC05827E
-
[55]
Kozyrod, R. P.; Pinhey, J. T. Aust. J. Chem. 1985, 38, 1155. doi: 10.1071/CH9851155
-
[56]
Barton, D. H. R.; Donnelly, D. M. X.; Finet, J. P.; Guiry, P. J. Tetrahedron Lett. 1989, 30, 1539. doi: 10.1016/S0040-4039(00)99513-3
-
[57]
Barton, D. H. R.; Donnelly, D. M. X.; Finet, J. P.; Stenson, P. H. Tetrahedron 1988, 44, 6387. doi: 10.1016/S0040-4020(01)89826-4
-
[58]
Barton, D. H. R.; Donnelly, D. M. X.; Finet, J. P.; Guiry, P. J. J. Chem. Soc., Perkin Trans. 1 1992, 1365.
-
[59]
Najib, A.; Tabuchi, S.; Hirano, K.; Miura, M. Heterocycles 2016, 92, 1187. doi: 10.3987/COM-16-13459
-
[60]
Tang, Z. Y.; Hu, Q. S. Adv. Synth. Catal. 2004, 346, 1635. doi: 10.1002/adsc.200404150
-
[61]
Luo, Y.; Wu, J. Tetrahedron Lett. 2009, 50, 2103. doi: 10.1016/j.tetlet.2009.02.116
-
[62]
Kuroda, J. I.; Inamoto, K.; Hiroya, K.; Doi, T. Eur. J. Org. Chem. 2009, 2251. http://www.researchgate.net/publication/229940482_NHeterocyclic_Carbene_Derived_NickelPincer_Complexes_Efficient_and_Applicable_Catalysts_for_SuzukiMiyaura_Coupling_Reactions_of_ArylAlkenyl_Tosylates_and_Mesylates
-
[63]
Xing, C. H.; Lee, J. R.; Tang, Z. Y.; Zheng, J. R.; Hu, Q. S. Adv. Synth. Catal. 2011, 353, 2051. doi: 10.1002/adsc.v353.11/12
-
[64]
Wong, P. Y.; Chow, W. K.; Chung, K. H.; So, C. M.; Lau, C. P.; Kwong, F. Y. Chem. Commun. 2011, 47, 8328. doi: 10.1039/c1cc12240a
-
[65]
Santana, M. D.; García-Bueno, R.; García, G.; Sánchez, G.; García, J.; Kapdi, A. R.; Naik, M.; Pednekar, S.; Pérez, J.; García, L.; Pérez, E.; Serrano, J. L. Dalton Trans. 2012, 41, 3832. doi: 10.1039/c2dt12187e
-
[66]
Li, Y. M.; Qi, Z. S.; Wang, H. F.; Fu, X. M.; Duan, C. Y. J. Org. Chem. 2012, 77, 2053. doi: 10.1021/jo202577m
-
[67]
Khoobi, M.; Alipour, M.; Zarei, S.; Jafarpour, F.; Shafiee, A. Chem. Commun. 2012, 48, 2985. doi: 10.1039/c2cc18150a
-
[68]
Shah, P.; Santana, M. D.; García, J.; Serrano, J. L.; Naik, M.; Pednekar, S.; Kapdi, A. R. Tetrahedron 2013, 69, 1446. doi: 10.1016/j.tet.2012.12.030
-
[69]
Khoobi, M.; Molaverdi, F.; Alipour, M.; Jafarpour, F.; Foroumadi, A.; Shafiee, A. Tetrahedron 2013, 69, 11164. doi: 10.1016/j.tet.2013.10.089
-
[70]
Cheval, N. P.; Dikova, A.; Blanc, A.; Weibel, J. M.; Pale, P. Chem. -Eur. J. 2013, 19, 8765. doi: 10.1002/chem.v19.27
-
[71]
Dikova, A.; Cheval, N. P.; Blanc, A.; Weibel, J. M.; Pale, P. Adv. Synth. Catal. 2015, 357, 4093. doi: 10.1002/adsc.201500682
-
[72]
Mutai, P.; Breuzard, G.; Pagano, A.; Allegro, D.; Peyrot, V.; Chibale, K. Bioorg. Med. Chem. 2017, 25, 1652. doi: 10.1016/j.bmc.2017.01.035
-
[73]
Min, M.; Hong, S. Chem. Commun. 2012, 48, 9613. doi: 10.1039/c2cc34551j
-
[74]
Wu, J.; Yang, Z. J. Org. Chem. 2001, 66, 7875. doi: 10.1021/jo010452+
-
[75]
Rao, M. L. N.; Venkatesh, V.; Jadhav, D. N. Eur. J. Org. Chem. 2010, 3945. doi: 10.1002/ejoc.201000134/full
-
[76]
Rao, M. L. N.; Kumar, A. Tetrahedron 2014, 70, 6995. doi: 10.1016/j.tet.2014.07.059
-
[77]
Gao, W.; Luo, Y.; Ding, Q.; Peng, Y.; Wu, J. Tetrahedron Lett. 2010, 51, 136. doi: 10.1016/j.tetlet.2009.10.096
-
[78]
Rieke, R. D.; Kim, S. H. Tetrahedron Lett. 2011, 52, 3094. doi: 10.1016/j.tetlet.2011.03.151
-
[79]
Wu, J.; Zhang, L.; Xia, H. G. Tetrahedron Lett. 2006, 47, 1525. doi: 10.1016/j.tetlet.2006.01.020
-
[80]
Wu, J.; Zhang, L.; Luo, Y. Tetrahedron Lett. 2006, 47, 6747. doi: 10.1016/j.tetlet.2006.07.085
-
[81]
Zhang, L.; Meng, T.; Fan, R.; Wu, J. J. Org. Chem. 2007, 72, 7279. doi: 10.1021/jo071117+
-
[82]
Rao, M. L. N.; Kumar, A. Tetrahedron 2015, 71, 5137. doi: 10.1016/j.tet.2015.05.060
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 31
- 文章访问数: 3764
- HTML全文浏览量: 376




 下载:
下载:










 下载:
下载:

