 图1
含有喹啉环的生物碱和药物
Figure1.
Alkaloid and drug containing quinoline skeleton
图1
含有喹啉环的生物碱和药物
Figure1.
Alkaloid and drug containing quinoline skeleton

Citation: Wang Bin, Ye Wenbo, Yan Zicong, Wan Changfeng, Hou Haoqing, Wang Zhiyong. A New Catalyst-Free Synthesis of 2, 3-Dicarboxylic Ester Quinoline Derivatives[J]. Chinese Journal of Organic Chemistry, 2018, 38(2): 504-508. doi: 10.6023/cjoc201708054

一种新的无催化剂条件下的2, 3-喹啉二羧酸酯的合成
English
A New Catalyst-Free Synthesis of 2, 3-Dicarboxylic Ester Quinoline Derivatives
-
Key words:
- quinoline derivatives
- / catalyst-free
- / green synthesis
-
喹啉及其衍生物是一类非常重要的含氮杂环化合物, 在一些生物碱、药物当中含有喹啉环结构, 例如, 具有抗癌效果的喜树碱和抗疟疾药物氯喹化合物(图 1).许多小分子经喹琳环修饰后具有较强生理活性和药理活性, 它们具有抗病毒[1]、抗肿瘤[2]、抑制剂[3]、抗高血压[4, 5]和抗疟疾[6, 7]等活性.许多人工合成的新型喹啉衍生物, 还具有抗真菌及在体外存在抗氧化活性等生物学活性[8].由于喹啉化合物的结构特殊性, 被广泛运用于医疗保健、农业发展、化学助剂、添加剂、材料等领域.比较经典的合成喹啉的方法有Skraup法[9]、Combes法[10]、Friedlander法[11]等.近年来, 构建喹啉环的合成方法学仍有许多报道. Singh等[12]利用铟盐催化邻氨基酮类化合物与炔酯类化合物构建取代的喹啉环结构, 该反应具有较好的区域选择性和底物适应性. 2013年, Lee小组与Hajra小组[13]分别报道了铜催化的邻氨基二苯甲酮类化合物与炔酯的反应, 来合成相应的喹啉环结构化合物. Rao小组[14]利用纳米氧化铜催化邻氨基二苯甲酮与丁炔二酸酯来合成喹啉环结构.还有一些利用有机碱和贵金属盐等方法来催化邻氨基二苯芳酮与炔酯的反应来合成喹啉环结构的报道[15].
绿色有机合成是当前有机化学的研究热点, 有利于环境保护及可持续发展.国外的李朝军教授[16]发展了大量的绿色合成方法研究.国内也有很多研究小组从事于绿色化学的研究.例如, 王磊教授课题组[17]发展了大量无溶剂、无催化剂的合成方法学, 汪志勇教授课题组[18]发展了很多水相新反应和纳米催化反应.这些合成方法学具有环境友好、原子经济性高、后处理简便等特点, 符合绿色化学的发展要求.基于之前的工作, 我们在研究的过程中发现, 利用邻氨基二苯甲酮和丁炔二酸二酯作为反应原料, 用二甲基亚砜(DMSO)作为反应溶剂, 在无任何催化剂参与条件下, 能高效地合成2, 3-喹啉二羧酸酯衍生物.
1 结果与讨论
1.1 反应条件优化
反应开始时, 我们选用邻氨基二苯甲酮和丁炔二酸二甲酯作为模型反应底物来对反应条件进行筛选.通过查阅文献, 发现铜盐能够比较好地催化这个反应[14], 然后我们想是否银盐也能够催化这个反应, 所以选用了银盐, 包括醋酸银、硝酸银来作为催化剂, 在用DMSO作为反应溶剂条件下, 为了对照, 同时也进行了一个不加催化剂的反应, 每小时点板一次, 3 h后点板发现当不用催化剂时, 原料基本消失, 在原料下方有个很浓的产物点, 分离产率能够达到75%(表 1, Entry 3), 而加入醋酸银、硝酸银的体系有一部分原料没有转化完, 停止反应分别能够得到31%、25%的产率(表 1, Entries 1, 2).说明在无催化剂的条件下, 反应效果更好.然后对溶剂进行了优化, 包括甲苯、1, 4-二氧六环、1, 2-二氯乙烷、乙腈、N, N-二甲基乙酰胺(DMA)、乙醇(表 1, Entries 4~9).实验发现使用极性小的溶剂反应效果比较差, 而在极性大的溶剂如DMA和乙醇中反应效果要好一些, 但最好的还是在DMSO当中.然后在体系中加入0.3 g的粉末状的4 分子筛, 能够得到更好的效果(表 1, Entry 10).最后优化了一下反应温度, 发现在室温条件下, 基本没有反应发生(表 1, Entry 11).

Entry Catalyst Solvent Yield b 1 AgOAc DMSO 31 2 AgNO3 DMSO 25 3 DMSO 75 4 Toluene 23 5 1, 4-Dioxane 33 6 CH3CN 35 7 ClCH2CH2Cl 26 8 DMA 36 9 Ethanol 34 10c DMSO 81 11d DMSO 0 a Reaction conditions: 1a (1.0 equiv., 0.2 mmol), 2a (1.5 equiv., 0.3 mmol) solvent (1mL); b isolated yield; c 0.3 g 4 molecular sieve was added; d room temperature. 1.2 底物拓展
优化好条件后, 进行了底物拓展研究.当用丁炔二酸二甲酯和不同的邻氨基二苯甲酮衍生物反应时, 都能够得到比较好的反应产率(表 2, 3a~3c).例如, 当苯环上带有氯和溴原子时, 分别得到了87%和78%的收率.当邻氨基苯乙酮类衍生物作为底物时也能得到比较好的反应结果(表 2, 3d, 3e).例如, 当采用邻氨基苯乙酮作为反应原料时, 能够得到82%的收率.但是当苯环的邻位有取代基的时候(表 2, 3f~3g), 实验过程中发现反应比较慢, 这可能是空间位阻的原因.于是我们把温度提高到80 ℃, 反应时间延长到24 h, 反应效果有明显改善.随后我们选用了丙炔酸甲酯和邻氨基二苯甲酮反应, 发现基本没有目标产物生成(表 2, 3h).接下来把丁炔二酸二甲酯换成了丁炔二酸二乙酯和不同的邻氨基芳基酮类化合物反应, 实验过程中发现丁炔二酸二乙酯的反应活性不如丁炔二酸二甲酯的高, 把反应条件优化到80 ℃时, 延长反应时间到24 h, 才得到比较高的产率(表 2, 3i~3m).综合来看, 我们选用了邻氨基二苯甲酮、苯环上带卤素原子的邻氨基二苯甲酮以及邻氨基苯乙酮类化合物来和丁炔二酸二甲酯反应, 都能够得到中等以上的收率.




a Reaction conditions: 1 (1.0 equiv., 0.2 mmol), 2 (1.5 equiv., 0.3 mmol), DMSO (1 mL). The reaction was carried out at 50 ℃; b the reaction was carried out at 80 ℃ for 24 h. Isolated yield. 1.3 机理探究
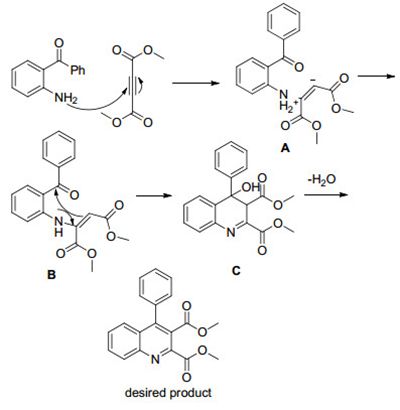
拓展完底物后, 我们对反应的机理做了一个初步的探索, 首先为了排除DMSO中可能的杂质对反应的影响, 做了一个对照实验, 用氘代的DMSO作为反应溶剂, 其它条件一样, 用邻氨基二苯甲酮和丁炔二酸二甲酯作为底物反应, 能够得到78%的收率, 说明该反应在DMSO中确实有比较好的效果, 可能的原因是DMSO对该反应有比较好的溶剂化效应.基于此, 提出了一种可能的反应机理(Scheme 1), 首先, 邻氨基二苯甲酮对丁炔二酸二甲酯进行一个Michael加成, 得到中间体A, 而DMSO可能会促进中间体A的生成和稳定中间体A.中间体A通过质子转移得到烯胺中间体B, 中间体B再进行一个分子内亲核加成得到中间体C, 最后再失去一分子水, 得到目标产物.
2 结论
综上所述, 发展了一种合成喹啉环的简单方法, 在无催化剂条件下通过邻氨基酮类化合物与丁炔二酸二酯发生加成反应得到喹啉环.而且, 该反应只有水是副产物.这个方法具有操作简单、反应条件温和、反应效率高等优点, 是对合成2, 3-喹啉二羧酸酯类化合物方法的有效补充.
3 实验部分
3.1 仪器与试剂
1H NMR和13H NMR谱: Mercury Plus 400型核磁共振仪(美国Varian公司), CDCl3为溶剂, TMS为内标.气相-质谱联用, 型号为Trace1300/ISQ.熔点仪型号为WRS-2.所用化学试剂均为市售化学纯或分析纯.柱层析硅胶(试剂级, 200~300目)购自青岛海洋化工有限公司, 直接使用.
3.2 实验方法
实验方法一:在室温下, 于10 mL的试管中, 加入邻氨基酮类化合物(0.2 mmol)和丁炔二酸二酯(0.3 mmol), 然后加入0.3 g粉末状的4 分子筛, 最后量取1 mL的DMSO溶剂. 50 ℃反应条件下搅拌.用薄层层析色谱法(TLC)监测.反应完全后, 加入适量水, 搅拌, 加入适量乙酸乙酯萃取, 水洗3次, 收集有机相, 旋蒸, 除去溶剂的粗产品运用柱层析色谱法进行分离提纯.
实验方法二:在室温下, 向10 mL的试管中加入邻氨基酮类化合物(0.2 mmol)和丁炔二酸二酯(0.3 mmol), 然后加入0.3 g粉末状的4 分子筛, 最后量取1 mL的DMSO溶剂.放入到80 ℃反应条件下搅拌.反应24 h后, 加入适量水, 搅拌, 加入适量乙酸乙酯萃取, 水洗3次, 收集有机相, 旋蒸, 除去溶剂的粗产品运用柱层层析色谱法进行分离提纯.
二甲基4-苯基喹啉-2, 3-二羧酸酯(3a):化合物通过实验方法一得到, 黄色固体. m.p. 127~129 ℃ (lit.[14] 129~130 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.30 (d, J=8.5 Hz, 1H), 7.79 (dd, J=8.3, 6.8 Hz, 1H), 7.61 (d, J=8.4 Hz, 1H), 7.58~7.53 (m, 1H), 7.47 (dd, J=4.6, 1.3 Hz, 3H), 7.39~7.31 (m, 2H), 4.04 (s, 3H), 3.61 (s, 3H); 13C NMR (400 MHz, CDCl3) δ: 167.59, 165.56, 148.08, 147.10, 144.97, 134.53, 131.03, 130.63, 129.34, 129.24, 128.83, 128.28, 127.63, 127.18, 126.64, 53.43, 52.44; GC-MS m/z: 321 (M+).
二甲基6-氯4-苯基喹啉-2, 3-二羧酸酯(3b):化合物通过实验方法一得到, 黄色固体, m.p. 159~161 ℃ (lit.[14] 162~164 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.10 (dd, J=9.0, 1.9 Hz, 1H), 7.80 (dt, J=9.0, 2.1 Hz, 1H), 7.69 (d, J=1.5 Hz, 1H), 7.44 (dd, J=3.9, 2.1 Hz, 3H), 7.31~7.23 (m, 2H), 3.98 (s, 3H), 3.55 (s, 3H); 13C NMR (400 MHz, CDCl3) δ: 166.18, 164.22, 146.19, 144.66, 144.19, 133.70, 132.78, 131.19, 128.26, 128.17, 127.78, 127.73, 127.50, 123.04, 52.51, 51.53; GC-MS m/z: 355 (M+).
二甲基6-溴4-苯基喹啉-2, 3-二羧酸酯(3c):化合物通过实验方法一得到, 黄色固体. m.p. 171~173 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.24 (d, J=9.0 Hz, 1H), 7.74 (dd, J=9.0, 2.3 Hz, 1H), 7.57 (d, J=2.2 Hz, 1H), 7.55~7.48 (m, 3H), 7.38~7.31 (m, 2H), 4.05 (s, 3H), 3.62 (s, 3H); 13C NMR (400 MHz, CDCl3) δ: 167.23, 165.23, 147.28, 145.47, 145.09, 135.63, 133.83, 132.18, 129.26, 129.17, 128.83, 128.51, 128.43, 128.4, 125.40, 53.51, 52.54; GC-MS m/z: 399 (M+); HRMS (ESI) calcd for C19H15BrNO4 [M+H]+ 400.0179, found 400.0188.
二甲基4-甲基喹啉-2, 3-二羧酸酯(3d):化合物通过实验方法一得到, 黄色固体. m.p. 96~98 ℃ (lit.[14] 93~95 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.25 (d, J=8.4 Hz, 1H), 8.08 (d, J=8.4 Hz, 1H), 7.86~7.76 (m, 1H), 7.69 (t, J=7.3 Hz, 1H), 4.04 (s, 3H), 4.00 (s, 3H), 2.73 (s, 3H); 13C NMR (400 MHz, CDCl3) δ: 168.42, 165.76, 146.48, 145.19, 143.92, 131.17, 130.87, 129.13, 128.12, 127.29, 124.14, 53.37, 52.86, 15.59; GC-MS m/z: 259 (M+).
二甲基6-溴-4-甲基喹啉-2, 3-二羧酸酯(3e):化合物通过实验方法一得到, 黄色固体. m.p. 115~118 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.22 (d, J=2.0 Hz, 1H), 8.10 (d, J=9.0 Hz, 1H), 7.86 (dd, J=9.0, 2.1 Hz, 1H), 4.03 (s, 3H), 3.99 (s, 3H), 2.68 (s, 3H); 13C NMR (400 MHz, CDCl3) δ: 167.98, 165.43, 145.46, 145.05, 143.04, 134.47, 132.68, 129.29, 128.07, 126.69, 123.88, 53.46, 52.97; GC-MS m/z: 337 (M+); HRMS (ESI) calcd for C14H13Br-NO4 [M+H]+ 338.0022, found 338.0034
二甲基6-氯-4-(2-氯苯基)喹啉-2, 3-二羧酸酯(3f):化合物通过实验方法二得到, 黄色固体. m.p. 188~190 ℃ (lit.[15c] 190~192 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.20 (d, J=9.0 Hz, 1H), 7.69 (dd, J=9.0, 2.2 Hz, 1H), 7.49 (d, J=7.9 Hz, 1H), 7.43~7.38 (m, 1H), 7.34 (t, J=7.4 Hz, 1H), 7.29 (d, J=2.2 Hz, 1H), 7.24~7.19 (m, 1H), 3.99 (s, 3H), 3.56 (s, 3H); 13C NMR (400 MHz, CDCl3) δ: 166.65, 165.27, 145.87, 145.39, 144.92, 135.95, 133.52, 132.90, 132.42, 132.27, 130.96, 130.76, 129.82, 127.89, 127.67, 126.82, 124.98. 53.52, 52.62; GC-MS m/z: 389 (M+).
二甲基6-氯-4-(2-氟苯基)喹啉-2, 3-二羧酸酯(3g):化合物通过实验方法二得到, 黄色固体. m.p. 208~210 ℃ (lit.[15c] 210~212 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.21 (d, J=9.0 Hz, 1H), 7.71 (dd, J=9.0, 2.3 Hz, 1H), 7.55~7.40 (m, 3H), 7.23 (dd, J=6.3, 3.9 Hz, 2H), 3.99 (s, 3H), 3.59 (s, 3H); 13C NMR (400 MHz, CDCl3) δ: 166.68, 165.24, 145.7, 145.36, 141.82, 135.99, 132.42, 132.26, 131.67, 131.59, 131.15, 130.88, 128.84, 124.96, 124.35, 116.09, 115.88, 53.54, 52.67; GC-MS m/z: 373 (M+).
二乙基4-苯基喹啉-2, 3-二羧酸酯(3i):化合物通过实验方法二得到, 黄色固体. m.p. 94~96 ℃ (lit.[14] 95~97 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.31 (d, J=8.5 Hz, 1H), 7.79 (ddd, J=8.4, 6.7, 1.6 Hz, 1H), 7.61 (dd, J=8.4, 1.1 Hz, 1H), 7.60~7.52 (m, 1H), 7.49 (dd, J=6.4, 2.7 Hz, 3H), 7.42~7.32 (m, 2H), 4.52 (q, J=7.1 Hz, 2H), 4.08 (q, J=7.1 Hz, 2H), 1.45 (t, J=7.1 Hz, 3H), 0.98 (t, J=7.1 Hz, 3H); 13C NMR (400 MHz, CDCl3) δ: 167.10, 165.29, 147.97, 147.12, 145.96, 134.81, 130.89, 130.63, 129.42, 129.01, 128.72, 128.22, 127.53, 127.03, 126.59, 62.55, 61.52, 14.18, 13.60; GC-MS m/z: 349 (M+).
二乙基6-氯4-苯基喹啉-2, 3-二羧酸酯(3j):化合物通过实验方法二得到, 黄色固体. m.p. 153~155 ℃ (lit.[14] 154~155 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.26 (d, J=9.0 Hz, 1H), 7.78~7.72 (m, 1H), 7.57 (d, J=2.3 Hz, 1H), 7.55~7.47 (m, 3H), 7.40~7.31 (m, 2H), 4.52 (q, J=7.1 Hz, 2H), 4.09 (q, J=7.1 Hz, 2H), 1.45 (t, J=7.1 Hz, 3H), 0.98 (dd, J=9.3, 5.0 Hz, 3H); 13C NMR (400 MHz, CDCl3) δ: 166.75, 164.93, 147.17, 146.07, 145.50, 135.57, 134.09, 132.20, 131.98, 130.88, 129.35, 129.06, 128.84, 128.44, 125.36, 62.68, 61.67, 14.17, 13.58; GC-MS m/z: 383 (M+).
二乙基6-溴4-苯基喹啉-2, 3-二羧酸酯(3k):化合物通过实验方法二得到, 黄色固体. m.p.178~180 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.17 (d, J=9.0 Hz, 1H), 7.86 (dd, J=9.0, 2.1 Hz, 1H), 7.74 (d, J=2.1 Hz, 1H), 7.60~7.46 (m, 3H), 7.40~7.30 (m, 2H), 4.51 (q, J=7.1 Hz, 2H), 4.08 (q, J=7.1 Hz, 2H), 1.44 (t, J=7.1 Hz, 3H), 0.98 (t, J=7.1 Hz, 3H); 13C NMR (400 MHz, CDCl3) δ: 166.70, 164.95, 147.08, 146.17, 145.69, 134.55, 134.05, 132.22, 129.35, 129.07, 128.83, 128.69, 128.45, 127.91, 123.77, 62.68, 61.68, 14.16, 13.58; GC-MS m/z: 427 (M+); HRMS (ESI) calcd for C21H19BrNO4[M+H]+ 428.0492, found 428.0495.
二乙基4-甲基喹啉-2, 3-二羧酸酯(3l)[14]:化合物通过实验方法二得到, 黄色油状. 1H NMR (400 MHz, CDCl3) δ: 8.22 (d, J=2.0 Hz, 1H), 8.10 (d, J=9.0 Hz, 1H), 7.85 (dd, J=9.0, 2.1 Hz, 1H), 4.48 (dq, J=14.3, 7.1 Hz, 4H), 2.70 (s, 3H), 1.42 (dt, J=16.6, 7.1 Hz, 6H); 13C NMR (400 MHz, CDCl3) δ: 167.46, 165.15, 146.35, 145.07, 142.96, 134.29, 132.70, 129.24, 127.98, 126.65, 123.60, 62.60, 62.11, 15.52, 14.20, 14.04; GC-MS m/z: 287 (M+).
二乙基6-溴-4-甲基喹啉-2, 3-二羧酸酯(3m):化合物通过实验方法二得到, 黄色固体. m.p. 88~90 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.29~8.18 (m, 1H), 8.12~8.00 (m, 1H), 7.84~7.74 (m, 1H), 7.73~7.62 (m, 1H), 4.58~4.40 (m, 4H), 2.73 (dd, J=3.0, 1.3 Hz, 3H), 1.51~1.36 (m, 6H); 13C NMR (400 MHz, CDCl3) δ: 166.85, 164.47, 145.46, 145.09, 142.84, 130.14, 129.86, 127.90, 127.02, 126.15, 123.09, 61.45, 60.92, 14.47, 13.21, 13.05; GC-MS m/z: 365 (M+); HRMS (ESI) calcd for C16H17Br-NO4 [M+H]+ 366.0335, found 366.0345.
辅助材料(Supporting Information) 目标化合物(3a, 3b, 3c, 3d, 3e, 3f, 3g, 3i, 3j, 3k, 3l, 3m)的1H NMR和13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Chen, Y. L.; Chen, I. L.; Lu, C. M.; Tzeng, C. C.; Tsao, L. T.; Wang, J. P. Bioorg. Med. Chem. 2004, 12, 387. doi: 10.1016/j.bmc.2003.10.051
-
[2]
Nayyar, A.; Malde, A.; Jain, R.; Coutinho, E. Bioorg. Med. Chem. 2006, 14, 7302.
-
[3]
Narender, P.; Srinivas, U.; Ravinder, M.; Rao, B. A.; Ramesh, C.; Harakishore, K.; Gangadasu, B.; Murthy, U. S. N.; Rao, V. J. Bioorg. Med. Chem. 2006, 14, 4600. doi: 10.1016/j.bmc.2006.02.020
-
[4]
Baba, A.; Kawamura, N.; Makino, H.; Ohta, Y.; Taketomi, S.; Sohda, T. J. Med. Chem. 1996, 39, 5176. doi: 10.1021/jm9509408
-
[5]
Muruganantham, N.; Sivakumar, R.; Anbalagan, N.; Gunasekaran, V.; Leonard, J. T. Biol. Pharm. Bull. 2004, 27, 1683. doi: 10.1248/bpb.27.1683
-
[6]
Nayyar, A.; Malde, A.; Coutinho, E.; Jain, R. Bioorg. Med. Chem. 2006, 14, 7302. doi: 10.1016/j.bmc.2006.06.049
-
[7]
Pharmacopoeia Committee of the People's Republic of China Ministry of Health Pharmacopoeia of the People's Republic of China•Pharmacopoeia Annotation, Chemical Industry Press, Beijing, 1990, p. 963(in Chinese).
(中华人民共和国卫生部药典委员会, 中华人民共和国药典•药典注释, 化学工业出版社, 北京, 1990, p. 963. ) -
[8]
(a) Zouhiri, F. ; Danet, M. ; Benard, C. ; Normand-Bayle, M. ; Mouscadet, J. F. ; Leh, H. ; Thomas, C. M. ; Mbemba, G. ; d'Angelo, J. ; Desmaele, D.
(b) Du, D. ; Fang, J. Chin. J. Org. Chem. 2007, 27, 1318(in Chinese).
(杜鼎, 方建新, 有机化学, 2007, 27, 1318. ) -
[9]
(a) Manske, R. H. F. ; Kulka, M. Org. React. 1953, 7, 59.
(b) Ranu, B. C. ; Hajra, A. ; Dey, S. S. ; Jana, U. Tetrahedron 2003, 59, 813. -
[10]
Combes, A. Bull. Soc. Chim. Fr. 1888, 49, 89.
-
[11]
(a) Friedlander, P. Chem. Ber. 1882, 15, 2572.
(b) Marco-Contelles, J. ; Perez-Mayoral, E. ; Samadi, A. ; Carreiras, M. D. C. ; Soriano, E. Chem. Rev. 2009, 109, 2652. -
[12]
Chanda, T.; Verma, R. K.; Singh, M. S. Chem. -Asian J. 2012, 7, 778. doi: 10.1002/asia.v7.4
-
[13]
(a) Pandit, R. P. ; Lee, Y. R. RSC Adv. 2013, 3, 22039.
(b) Bagdi, A. K. ; Santra, S. ; Rahman, M. ; Majee, A. ; Hajra, A. RSC Adv. 2013, 3, 24034. -
[14]
Venkanna, A.; Swapn, K.; Rao, P. V. RSC Adv. 2014, 4, 15154. doi: 10.1039/c3ra47212d
-
[15]
(a) Patil, D. R. ; Salunkhe, S. M. ; Deshmukh, M. B. ; Anbhule, P. V. J. Heterocycl. Chem. 2011, 48, 1414.
(b) Zhou, W. ; Le, J. H. Chem. Commun. 2014, 50, 5583.
(c) Asghari, S. ; Qandalee, M. ; Naderi, Z. ; Sobhaninia, Z. Mol. Diversity 2010, 14, 569.
(d) Madhav, B. ; Murthy, S. N. ; Rao, K. R. ; Nageswar, Y. V. D. Helv. Chim. Acta 2010, 93, 257.
(e) Patil, D. R. ; Deshmukh, M. B. ; Salunkhe, S. M. ; Anbhule, P. V. J. Heterocycl. Chem. 2011, 48, 1342. -
[16]
(a) Basle, O. ; Li, C. J. Green Chem. 2007, 9, 1047.
(b) Li, C. J. Green Chem. 2002, 4, 1.
(c) Hudson, R. ; Li, C. J. ; Moores, A. Green Chem. 2012, 14, 622. -
[17]
(a) Zhang, X. ; Wang, L. Green Chem. 2012, 14, 2141.
(b) Zhang, X. ; Wang, M. ; Li, P. ; Wang, L. Chem. Commun. 2014, 50, 8006.
(c) Zhao, Q. ; Li, H. ; Wang, L. Org. Biomol. Chem. 2013, 11, 6772. -
[18]
(a) Yang, Y. ; Bao, Y. J. ; Guan, Q. Q. ; Sun, Q. ; Zha, Z. G. ; Wang, Z. Y. Green Chem. 2017, 19, 112.
(b) Yang, Y. ; Zhang, S. ; Tang, L. ; Hu, Y. B. ; Zha, Z. G. ; Wang, Z. Y. Green Chem. 2016, 18, 2609.
(c) Tang, L. ; Guo, X. F. ; Yang, Y. ; Zha, Z. G. ; Wang, Z. Y. Chem. Commun. 2014, 6145.
-
[1]
-
表 1 反应条件优化a
Table 1. Screening on the reaction conditions

Entry Catalyst Solvent Yield b 1 AgOAc DMSO 31 2 AgNO3 DMSO 25 3 DMSO 75 4 Toluene 23 5 1, 4-Dioxane 33 6 CH3CN 35 7 ClCH2CH2Cl 26 8 DMA 36 9 Ethanol 34 10c DMSO 81 11d DMSO 0 a Reaction conditions: 1a (1.0 equiv., 0.2 mmol), 2a (1.5 equiv., 0.3 mmol) solvent (1mL); b isolated yield; c 0.3 g 4 molecular sieve was added; d room temperature. 表 2 底物范围研究a
Table 2. Scope of substrates




a Reaction conditions: 1 (1.0 equiv., 0.2 mmol), 2 (1.5 equiv., 0.3 mmol), DMSO (1 mL). The reaction was carried out at 50 ℃; b the reaction was carried out at 80 ℃ for 24 h. Isolated yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 2253
- HTML全文浏览量: 477


 下载:
下载:

 下载:
下载:

