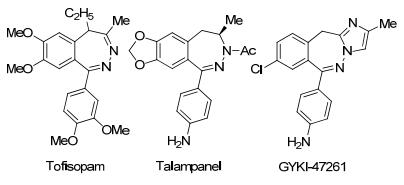
 图1
代表性的具有生物活性的2, 3-苯并二氮杂䓬类化合物
Figure1.
Representative bioactive 2, 3-benzodiazepines
图1
代表性的具有生物活性的2, 3-苯并二氮杂䓬类化合物
Figure1.
Representative bioactive 2, 3-benzodiazepines

Citation: Hu Hui, Hu Xiaoping, Chen Ming, Sun Ning, Liu Yuanhong. Gold-Catalyzed Ring Expansion Reaction: Highly Efficient Synthesis of Functionalized 2, 3-Benzodiazepine Scaffolds[J]. Chinese Journal of Organic Chemistry, 2018, 38(1): 190-199. doi: 10.6023/cjoc201708046

金催化的扩环反应:2, 3-苯并二氮杂䓬类化合物的高效合成
-
关键词:
- 金催化
- / 氧化
- / 扩环反应
- / 2, 3-苯并二氮杂䓬
English
Gold-Catalyzed Ring Expansion Reaction: Highly Efficient Synthesis of Functionalized 2, 3-Benzodiazepine Scaffolds
-
Key words:
- gold catalysis
- / oxidation
- / ring expansion
- / 2, 3-benzodiazepine
-
含有相邻两个氮原子结构的1, 2-二氮杂䓬及2, 3-苯并二氮杂䓬类化合物广泛存在于一些生物活性分子以及药物分子之中[1].例如, 2, 3-苯并二氮杂䓬类化合物Tofisopam是一种非镇静性的抗焦虑药物[2]; Talampanel是一种非竞争性的AMPA拮抗剂、抗惊厥药物, 在治疗癫痫、神经系统障碍方面具有一定的应用价值[3]; 含有咪唑环结构的GYKI-47261可以充当更加高效的AMPA拮抗剂, 针对由电击等引起的癫痫发作具有广谱的抗惊厥活性, 且对MPTP诱导的帕金森具有一定的神经保护作用[4](图 1).正是因为这些分子在药物方面的应用价值, 近年来二氮杂䓬类化合物的合成备受关注, 其中研究得比较多的是1, 4-二氮杂䓬[5]和1, 5-二氮杂䓬[6]的合成, 而邻二氮杂䓬[7]尤其是2, 3-苯并二氮杂䓬的合成方法较为少见. 2, 3-苯并二氮杂䓬的合成方法主要包括以下几种:酸促进的2-苯并吡喃鎓盐与肼的开环缩合反应[8a], 碱促进的苯炔与β-二酮的反应及后续与肼的缩合相串联的反应[8b], 从醛出发的四步合成法(1, 2-加成、PCC氧化、Wacker型氧化、缩合反应)[8c], 铑催化的腙与重氮酮酯的碳-氢键官能团化反应[[8d]等.这些方法存在步骤冗长、底物局限性大等缺点, 因此苯并二氮杂䓬类化合物的高效合成方法还有待进一步发展.
近年来随着均相金催化的迅猛发展, 金催化的串联环化反应已经成为构建碳环和杂环化合物的简捷高效的方法之一[9].其中, 利用金催化的扩环反应合成环状化合物尤其是一些具有中等环系大小的杂环化合物得到越来越多化学工作者的关注[10].最近, 我们课题组发展了金催化的2-炔基-1, 2-二氢吡啶类化合物在氮氧化物存在下的扩环反应, 经烯基或芳基的1, 2-迁移反应高效地合成了一系列具有潜在生物活性的七元氮杂䓬类化合物[11].在此基础上, 我们又成功地将该反应拓展到含有两个杂原子的杂环体系中如炔基取代的二氢苯并[d]噻唑、二氢苯并[d]咪唑、二氢苯并[d]噁唑等.利用这些五元杂环化合物在金催化剂和氮氧化物作用下的1, 2-杂原子迁移/扩环反应, 以良好至优秀的收率得到了结构丰富且具有潜在应用价值的六元含氮、氧或硫的杂环类衍生物[12].我们还开展了金催化的由醌衍生的炔丙醇在氮氧化物存在下的氧化/扩环反应, 合成了七元䓬酮及苯并䓬酮类化合物[13].利用类似的策略, 还实现了一系列常见的碳环和杂环化合物的扩环反应, 有效地合成了苯并氧杂䓬、取代的菲以及喹啉酮等化合物[13].在本工作中, 我们希望利用金催化的扩环反应这一研究策略高效地合成2, 3-苯并二氮杂䓬类化合物.如Scheme 1所示, 我们的设计思路是从常见易得的杂环化合物酞嗪出发, 经炔基化反应合成1-炔基-1, 2-二氢-2, 3-二氮杂萘1, 然后经金催化的涉及金卡宾中间体的扩环反应就可以一步高效地合成2, 3-苯并二氮杂䓬类化合物.实验结果表明, 利用上述研究策略可以很好地合成2, 3-苯并二氮杂䓬类化合物, 并且所得产物在路易斯酸存在下经后续转化反应可以构筑吡唑和多并环类化合物.接下来我们对该反应的研究结果进行详细报道.
1 结果与讨论
1.1 反应条件的优化
我们选取炔端为苯基取代的1-炔基-1, 2-二氢-2, 3-二氮杂萘(1a)作为模板底物进行反应的条件筛选, 实验结果见表 1.首先以PPh3AuNTf2为金催化剂, 2 equiv.的8-甲基喹啉氮氧化物(2a)为氧化剂, 甲苯为溶剂, 在50 ℃下对反应进行了初步的尝试, 发现反应2 h即以81%的良好收率得到2, 3-苯并二氮杂䓬类产物3a(表 1, Entry 1).随后考察了不同种类的氮氧化物对反应的影响.使用3, 5-二氯吡啶氮氧化物2b为氧化剂时, 反应时间明显延长, 22 h后仍有少量原料剩余(9%), 仅以35%的收率得到目标产物(表 1, Entry 2), 这可能是该氧化剂的亲核能力较低所导致的; 使用吡啶氮氧化物2c为氧化剂时, 反应3 h以47%的收率得到3a(表 1, Entry 3).根据上述实验结果, 我们确定以8-甲基喹啉氮氧化物(2a)作为反应的最优氧化剂.降低氧化剂2a的用量至1.2 equiv.时, 发现反应2 h仍以82%的良好收率得到目标产物(表 1, Entry 4).经过对溶剂的考察发现, 四氢呋喃(THF)、1, 2-二氯乙烷(DCE)作为溶剂时, 产物收率均有不同程度的降低, 分别以72%、64%的收率得到产物3a(表 1, Entries 5, 6).当降低反应温度至室温时, 收率略有下降(73%, 表 1, Entry 7).接下来我们对不同种类的金催化剂进行了筛选, 当使用含有大位阻磷配体的Johnphos(MeCN)AuSbF6 (catalyst A)作为催化剂时, 反应速率大幅降低, 延长反应时间至23 h也不能反应完全, 以52%的收率得到目标产物3a(表 1, Entry 8);我们也考察了金催化剂中配阴离子对反应的影响, 当以AgSbF6为助催化剂时, 反应3 h也能以75%的收率得到产物3a(表 1, Entry 9);以AgOTf为助催化剂时, 延长反应时间至10 h也能以73%的收率得到目标产物3a(表 1, Entry 10);对照实验表明, 单独加入PPh3AuCl作为催化剂时, 没有目标产物生成(表 1, Entry 11);当仅以AgNTf2为催化剂时, 只观察到极少量的产物3a(表 1, Entry 12);当以质子酸HNTf2为催化剂时, 没有目标产物生成, 最终以93%的收率回收原料1a(表 1, Entry 13).根据上述实验结果, 我们确定了该反应的最佳反应条件, 即以5 mol% PPh3AuNTf2为催化剂, 1.2 equiv.的8-甲基喹啉氮氧化物为氧化剂, 甲苯作为溶剂, 50 ℃下反应(表 1, Entry 4).

Entry Oxidant (equiv.) Catalyst (mol%) Solvent Temp./℃ Time/h Yielda/% 1 2a (2) PPh3AuNTf2 (5) Toluene 50 2 81 2 2b (2) PPh3AuNTf2 (5) Toluene 50 22 35 (9) 3 2c (2) PPh3AuNTf2 (5) Toluene 50 3 47 4 2a (1.2) PPh3AuNTf2 (5) Toluene 50 2 82 5 2a (1.2) PPh3AuNTf2 (5) THF 50 3 72 6 2a (1.2) PPh3AuNTf2 (5) DCE 50 3 64 7 2a (1.2) PPh3AuNTf2 (5) Toluene r.t. 3.5 73 8 2a (1.2) Catalyst A (5) Toluene 50 23 52 (19) 9 2a (1.2) PPh3AuCl/AgSbF6 (5) Toluene 50 3 75 10 2a (1.2) PPh3AuCl/AgOTf (5) Toluene 50 10 73 11 2a (1.2) PPh3AuCl (5) Toluene 50 13 -(90) 12 2a (1.2) AgNTf2 (5) Toluene 50 13 3 (85) 13 2a (1.2) HNTf2 (10) Toluene 50 13 -(93) aIsolated yields. [Substrate]=0.1 mol/L. The recovered yields of 1a are shown in parentheses. 1.2 底物普适性的考察
根据上述最佳反应条件, 我们考察了底物上的炔端取代基R1对反应的影响(表 2).首先, 我们探索了炔端取代基R1为芳基取代基时, 芳环上的取代基对反应的影响.当芳环上的取代基为弱吸电子的p-F、p-Cl时, 反应4~8 h后分别以69%、76%的良好收率得到3b和3c; 取代基为中等强度的吸电子基p-CO2Et时, 反应8 h, 可以63%的收率得到3d; 取代基为强吸电子的p-NO2时, 即使延长反应时间至9 h, 产物收率仍然较低, 仅以37%的收率得到3e.该反应中, 原料未能完全转化, 并伴有少量副产物生成, 表明硝基取代基对该反应体系不能很好地兼容.当芳环上的取代基为p-Me时, 可以67%的收率得到3f; 当芳环上含有强供电子取代基p-OMe时, 反应收率有所降低, 以58%的收率得到3g, 并伴有其它的副产物生成; 当芳环上的取代基为3, 4, 5-(OMe)3时, 能以68%的收率得到3h.当炔端取代基为杂芳基如2-噻吩基时, 反应也可以顺利进行, 以64%的收率得到3i, 表明该反应体系对杂环具有良好的兼容性.炔端为烯基的底物也可以顺利发生扩环反应, 如当炔端为环己烯基时, 可以68%的收率得到3j; 炔端为烷基的底物也可以较好地适用于该反应, 以79%~81%的高收率得到产物3k~3l.值得一提的是, 当底物上的炔端取代基为TMS时, 所得到的产物为脱除TMS基团的醛类化合物3m.上述苯并二氮杂䓬产物3的结构通过产物3c的X射线单晶衍射分析得以了确证.此外, 我们也研究了由单环哒嗪衍生的杂环-炔底物的适用性.发现当以6-(苯基乙炔基)哒嗪-1(6H)-甲基羧酸酯(1n)为底物时, 虽然反应也可以进行, 但无法分离得到干净的产物, 这可能是该产物稳定性较差所导致的.
1.3 产物的后续转化
为了展现苯并二氮杂䓬产物的应用价值, 我们将产物3a进行了后续转化反应.有意思的是, 当3a在50 mol% FeCl3的存在下在DCE中80 ℃反应6.5 h时可以得到缩环产物吡唑4.该反应可能是在体系中微量水的存在下首先发生亚胺片段的水解反应, 随后经双键异构化以及氨基对酮羰基的缩合反应得到产物4.由于在反应结束后会生成一分子水, 因此该反应仅需极少量的水就可以启动. FeCl3可能对亚胺水解以及缩合反应等步骤起到了一定的促进作用.当加入3 equiv.的FeCl3时, 反应路径发生了改变, 以单一的立体选择性得到桥头上含有氯原子的并环产物5.该反应可能首先发生Nazarov环化生成烯丙基碳正离子中间体, 随后来自FeCl3的氯原子充当亲核试剂从位阻较小的一面进攻该中间体, 经后续的1, 3-氢迁移以及氧化历程得到产物5 (Scheme 2).产物4和5的结构得到了X射线单晶衍射分析的确证.由此我们可以看出该苯并二氮杂䓬类化合物可以通过后续转化反应有效地构建其它杂环以及并环类分子.
1.4 可能的反应机理
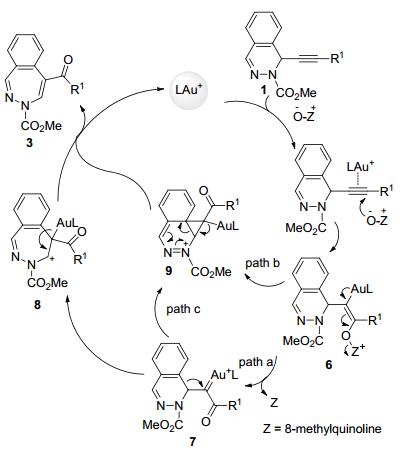
根据我们课题组之前的报道, 我们提出了如下反应机理(Scheme 3):首先, 金催化剂活化底物1中的碳碳叁键, 随后8-甲基喹啉氮氧化物作为亲核试剂高区域选择性地进攻靠近R1一端的炔碳得到烯基金中间体6, 金反馈电子使得8-甲基喹啉离去得到α-羰基金卡宾中间体7, 随后发生选择性的C—C键的1, 2-迁移反应(也可以视为1, 2-苯基迁移反应)生成碳正离子中间体8, 8经质子解反应生成产物3 (path a).此外, 中间体6中的烯基金也可能直接接受苯环的亲核进攻生成环丙基金中间体9, 9经三元环的开环反应生成目标产物(path b).中间体9也可以由苯环进攻金卡宾中间体得到(path c).在该反应中, 并未观测到1, 2-H和1, 2-N迁移反应.反应的高区域选择性可能是由底物1的电子效应所调控的, 即底物中含氮基团的诱导效应使得靠近R1一端的炔碳为电正性, 易于接受亲核试剂的进攻.
2 结论
研究了金催化的基于1-炔基-1, 2-二氢-2, 3-二氮杂萘类底物的氧化/扩环反应, 在8-甲基喹啉氮氧化物的存在下高效地合成了2, 3-苯并二氮杂䓬类化合物.该反应可能经历了α-羰基金卡宾的生成以及1, 2-苯基迁移反应.我们还研究了2, 3-苯并二氮杂䓬类产物在FeCl3存在下的转化反应, 发现随着FeCl3的用量的不同, 可以分别生成吡唑及多并环类产物.
3 实验部分
3.1 仪器与试剂
核磁共振谱在Varian XL-400 MHz与Agient-400 MHz核磁共振波谱仪上测定. 1H NMR化学位移采用TMS (δ=0.00)定标, 13C NMR化学位移采用CDCl3 (δ=77.00)定标.高分辨质谱使用Agilent Technologies 6224 TOF LC/MS质谱仪; 晶体结构由Bruker SMART型X射线单晶衍射仪测定; 熔点由SGW-4型显微熔点仪测定(温度计未校正); 红外谱图由Nicolet iS10型FT-IR测定.溶剂处理均在氩气氛围下进行.甲苯经钠-二苯甲酮回流处理, 二氯甲烷经氢化钙回流处理.所有反应均在氩气保护的无水无氧条件下进行. PPh3PAuCl[14]和PPh3AuNTf2[15]按文献方法制备. 8-甲基喹啉氮氧化物参照文献方法制备[16]. Johnphos(MeCN)-AuSbF6购自Aldrich, 2, 3-二氮杂萘购自安耐吉, 哒嗪购自TCI公司, 氯甲酸甲酯购自国药化学公司, 其它试剂和药品未经特别说明均从厂家购买直接使用.
3.2 实验方法
3.2.1 1-炔基-1, 2-二氢-2, 3-二氮杂萘底物1a~1n的合成
氩气氛围下, 向一干燥的、带有搅拌子的100 mL Schlenk管中加入苯乙炔(3.064 g, 30 mmol)和二氯甲烷(40 mL), 然后冰/水浴冷却至0 ℃, 随后依次加入CuI (0.952 g, 5 mmol)、二异丙基乙基胺(4.96 mL, 30 mmol)、2, 3-二氮杂萘(1.302 g, 10 mmol), 最后缓慢加入氯甲酸甲酯(4.73 mL, 60 mmol), 撤去冰水浴, 室温反应过夜.薄层色谱(TLC)检测反应完成后, 用水淬灭反应, 二氯甲烷萃取, 有机相分别用饱和氯化钠溶液和饱和氯化铵溶液洗涤(其余反应仅用饱和氯化钠溶液洗涤即可), 无水硫酸钠干燥.减压蒸去溶剂后, 粗产物用硅胶柱色谱分离[V(石油醚):V(乙酸乙酯)=5:1~3:1], 得到目标产物1-(苯乙炔基)-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1a), 淡黄色固体2.24 g, 产率77%. m.p. 107~109 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.79 (s, 1H), 7.50~7.46 (m, 1H), 7.41~7.37 (m, 1H), 7.34~7.29 (m, 4H), 7.23~7.20 (m, 3H), 6.46 (s, 1H), 3.96 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 154.4, 142.7, 132.0, 131.6, 130.7, 128.8, 128.4, 127.9, 126.1, 125.8, 123.0, 121.9, 85.5, 85.1, 53.9, 44.9; IR (neat) ν: 3034, 2951, 2854, 1741, 1709, 1454, 1442, 1363, 1308, 1288, 1239, 1221, 1143, 1127, 905, 850, 756, 691 cm-1; HRMS (ESI) calcd for C18H15N2O2 [M+H]+ 291.1128, found 291.1123.
化合物1b~1n的合成方法类似.
1-[(4-氟苯基)乙炔基]-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1b):使用1.5 equiv.的4-氟苯乙炔和3 equiv.的氯甲酸甲酯.淡黄色固体, 产率54%. m.p. 153~154 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.80 (s, 1H), 7.50 (t, J=8.0 Hz, 1H), 7.42 (t, J=7.6 Hz, 1H), 7.35~7.33 (m, 2H), 7.30~7.27 (m, 2H), 6.94~6.89 (m, 2H), 6.45 (s, 1H), 3.98 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 162.5 (1JC-F=248.3 Hz), 154.4, 142.7, 133.7 (3JC-F=8.9 Hz), 132.1, 130.7, 128.9, 126.2, 125.9, 123.1, 118.0 (4JC-F=3.0 Hz), 115.3 (2JC-F=22.3 Hz), 85.3, 84.1, 54.0, 44.9; IR (neat) ν: 3065, 3034, 2951, 2212, 1714, 1598, 1505, 1453, 1442, 1362, 1314, 1299, 1263, 1247, 1224, 1213, 1196, 1163, 1140, 1127, 1097, 982, 911, 898, 849, 839, 830, 789, 769, 761, 748 cm-1; HRMS (ESI) calcd for C18H14FN2O2 [M+H]+ 309.1034, found 309.1030.
1-[(4-氯苯基)乙炔基]-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1c):白色固体, 产率61%. m.p. 123~125 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.80 (s, 1H), 7.50 (t, J=7.6 Hz, 1H), 7.42 (t, J=7.6 Hz, 1H), 7.35~7.33 (d, J=7.6 Hz, 2H), 7.21 (dd, J=17.6, 8.4 Hz, 4H), 6.46 (s, 1H), 4.0 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 154.4, 142.8, 134.5, 133.0, 132.1, 130.6, 129.0, 128.3, 126.2, 126.0, 123.1, 120.5, 86.5, 84.0, 54.1, 45.0; IR (neat) ν: 3078, 3029, 2951, 2212, 1711, 1489, 1452, 1440, 1363, 1314, 1298, 1261, 1245, 1223, 1140, 1129, 1088, 1014, 912, 897, 849, 832, 823, 773, 761, 733 cm-1; HRMS (ESI) calcd for C18H14ClN2O2 [M+H]+ 325.0738, found 325.0734.
1-[(4-乙氧羰基苯基)乙炔基]-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1d):使用1.5 equiv.的4-乙炔基苯甲酸乙酯和3 equiv.的氯甲酸甲酯.浅黄色固体, 产率50%. m.p. 144~145 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.91 (d, J=7.2 Hz, 2H), 7.81 (s, 1H), 7.51 (t, J=7.6 Hz, 1H), 7.43 (t, J=7.2 Hz, 1H), 7.38~7.35 (m, 4H), 6.50 (s, 1H), 4.34 (dd, J=14.4, 7.2 Hz, 2H), 4.0 (s, 3H), 1.36 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 165.8, 154.4, 142.8, 132.1, 131.6, 130.4, 130.1, 129.08, 129.04, 126.5, 126.2, 125.9, 123.1, 88.3, 84.3, 61.0, 54.1, 44.9, 14.1; IR (neat) ν: 3042, 2942, 2360, 1717, 1700, 1605, 1454, 1444, 1405, 1368, 1318, 1289, 1261, 1225, 1176, 1145, 1123, 1103, 1093, 1025, 980, 956, 906, 896, 863, 850, 762, 723, 695, 662 cm-1; HRMS (ESI) calcd for C21H19N2O4 [M+H]+ 363.1339, found 363.1334.
1-[(4-硝基苯基)乙炔基]-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1e):使用1.5 equiv.的4-硝基苯乙炔和3 equiv.的氯甲酸甲酯.暗红色固体, 产率56%. m.p. 115~116 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.10 (d, J=8.4 Hz, 2H), 7.82 (s, 1H), 7.54 (t, J=7.2 Hz, 1H), 7.48~7.46 (m, 3H), 7.40~7.37 (m, 2H), 6.52 (s, 1H), 4.00 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 154.4, 147.1, 142.8, 132.5, 132.3, 129.9, 129.3, 128.8, 126.4, 126.0, 123.2, 123.1, 90.7, 83.1, 54.2, 44.9; IR (neat) ν: 3004, 2948, 2862, 1704, 1592, 1515, 1446, 1363, 1341, 1315, 1258, 1244, 1222, 1150, 1128, 911, 899, 851, 762, 749, 727, 686 cm-1; HRMS (ESI) calcd for C18H14N3O4 [M+H]+ 336.0979, found 336.0975.
1-[(4-甲苯基)乙炔基]-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1f):使用1.5 equiv.的4-甲基苯乙炔, 20 mol%的碘化亚铜和3 equiv.的氯甲酸甲酯.淡黄色固体, 产率57%. m.p. 128~130 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.79 (s, 1H), 7.50~7.46 (m, 1H), 7.41~7.38 (m, 1H), 7.33 (s, 2H), 7.20 (d, J=7.6 Hz, 2H), 7.01 (d, J=7.6 Hz, 2H), 6.45 (s, 1H), 3.96 (s, 3H), 2.27 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 154.5, 142.8, 138.6, 132.0, 131.6, 131.0, 128.8, 128.7, 126.1, 125.9, 123.1, 118.9, 85.3, 84.9, 54.0, 45.1, 21.3; IR (neat) ν: 2954, 2948, 2204, 1702, 1446, 1368, 1308, 1290, 1259, 1245, 1222, 1142, 1125, 1098, 981, 954, 910, 897, 870, 847, 816, 763, 680 cm-1; HRMS (ESI) calcd for C19H17N2O2 [M+H]+ 305.1285, found 305.1281.
1-[(4-甲氧基苯基)乙炔基]-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1g):使用1.5 equiv.的4-甲氧基苯乙炔和3 equiv.的氯甲酸甲酯.黄色固体, 产率82%. m.p. 155~156 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.80 (s, 1H), 7.48 (t, J=7.2 Hz, 1H), 7.40 (t, J=7.2 Hz, 1H), 7.30 (d, J=7.6 Hz, 2H), 7.24 (d, J=8.8 Hz, 2H), 6.74 (d, J=8.8 Hz, 2H), 6.44 (s, 1H), 3.97 (s, 3H), 3.74 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 159.6, 154.5, 142.8, 133.2, 132.0, 131.1, 128.8, 126.1, 125.9, 123.1, 114.0, 113.6, 85.1, 84.2, 55.1, 54.0, 45.0; IR (neat)ν: 3012, 2945, 2837, 2210, 1717, 1604, 1508, 1453, 1440, 1364, 1311, 1290, 1255, 1244, 1222, 1170, 1140, 1125, 1108, 1025, 911, 896, 848, 829, 811, 785, 762, 751 cm-1; HRMS (ESI) calcd for C19H17N2O3 [M+H]+ 321.1234, found 321.1229.
1-[(3, 4, 5-三甲氧基苯基)乙炔基]-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1h):白色固体, 产率77%. m.p. 143~145 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.82 (s, 1H), 7.52 (t, J=7.6 Hz, 1H), 7.43 (t, J=7.2 Hz, 1H), 7.37 (s, 1H), 7.35 (s, 1H), 6.56 (s, 2H), 6.46 (s, 1H), 3.98 (s, 3H), 3.80 (d, J=4.4 Hz, 9H); 13C NMR (100 MHz, CDCl3) δ: 154.5, 152.8, 142.9, 139.0, 132.1, 130.8, 128.9, 126.2, 126.0, 123.1, 116.9, 109.0, 85.0, 84.6, 60.8, 56.0, 54.1, 45.0; IR (film) ν: 3001, 2945, 2837, 1705, 1577, 1504, 1456, 1444, 1413, 1369, 1344, 1316, 1294, 1249, 1239, 1225, 1146, 1123, 1017, 1002, 919, 879, 848, 831, 764 cm-1; HRMS (ESI) calcd for C21H21N2O5 [M+H]+ 381.1445, found 381.144.
1-[(2-噻吩基)乙炔基]-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1i):深黄色固体, 产率83%. m.p. 113~115 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.79 (s, 1H), 7.50 (t, J=7.2 Hz, 1H), 7.42 (t, J=7.2 Hz, 1H), 7.34~7.33 (m, 2H), 7.19 (d, J=4.8 Hz, 1H), 7.113~7.105 (m, 1H), 6.89~6.88 (m, 1H), 6.48 (s, 1H), 3.97 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 154.4, 142.8, 132.7, 132.1, 130.5, 129.0, 127.5, 126.7, 126.2, 126.0, 123.1, 121.8, 89.3, 78.5, 54.1, 45.1; IR (neat) ν: 3087, 2951, 2210, 1705, 1441, 1372, 1360, 1307, 1288, 1247, 1222, 1190, 1141, 1126, 1095, 895, 849, 786, 764, 708, 676, 654 cm-1; HRMS (ESI) calcd for C16H13N2O2S[M+H]+ 297.0692, found 297.0689.
1-(环己烯基乙炔基)-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1j):淡黄色固体, 产率71%. m.p. 105~107 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.76 (s, 1H), 7.47 (t, J=7.2 Hz, 1H), 7.39 (t, J=7.2 Hz, 1H), 7.32~7.27 (m, 2H), 6.34 (s, 1H), 6.00 (s, 1H), 3.95 (s, 3H), 1.99 (s, 4H), 1.51 (d, J=3.6 Hz, 4H); 13C NMR (100 MHz, CDCl3) δ: 154.4, 142.7, 135.9, 131.9, 131.3, 128.7, 126.0, 125.8, 123.1, 119.7, 87.0, 82.8, 53.9, 45.0, 28.7, 25.4, 22.0, 21.2; IR (neat) ν: 3029, 2920, 2859, 1701, 1454, 1443, 1369, 1307, 1289, 1246, 1223, 1147, 1126, 906, 897, 850, 763 cm-1; HRMS (ESI) calcd for C18H19N2O2 [M+H]+ 295.1441, found 295.1436.
1-己炔基-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1k):深黄色固体, 产率69%. m.p. 44~46 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.75 (s, 1H), 7.47 (t, J=7.2 Hz, 1H), 7.38 (t, J=7.6 Hz, 1H), 7.31 (d, J=7.2 Hz, 1H), 7.26 (d, J=7.6 Hz, 1H), 6.20 (s, 1H), 3.95 (s, 3H), 2.07 (t, J=6.8 Hz, 2H). 1.40~1.33 (m, 2H), 1.31~1.22 (m, 2H), 0.82 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 154.4, 142.6, 131.8, 131.6, 128.5, 125.9, 125.6, 122.9, 86.2, 53.8, 44.6, 30.1, 21.6, 18.2, 13.3; IR (neat) ν: 2951, 2929, 2868, 1743, 1710, 1454, 1442, 1363, 1307, 1286, 1244, 1221, 1193, 1151, 1127, 1095, 911, 850, 764, 715, 658 cm-1; HRMS (ESI) calcd for C16H19N2O2 [M+H]+ 271.1441, found 271.1437.
1-(环丙基乙炔基)-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1l):白色固体, 产率70%. m.p. 115~117 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.75 (s, 1H), 7.47 (t, J=7.6 Hz, 1H), 7.39 (t, J=7.2 Hz, 1H), 7.30 (d, J=8.0 Hz, 1H), 7.25 (d, J=7.2 Hz, 1H), 6.17 (s, 1H), 3.90 (s, 3H), 1.12~1.11 (m, 1H), 0.66 (d, J=5.6 Hz, 2H), 0.57 (d, J=1.6 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 154.4, 142.7, 131.9, 131.5, 128.6, 126.0, 125.7, 123.0, 89.1, 71.9, 53.9, 44.6, 8.1, -0.6; IR (neat) ν: 3003, 2951, 2241, 2220, 1704, 1455, 1443, 1362, 1307, 1294, 1249, 1229, 1157, 1140, 1127, 1092, 1062, 1039, 915, 884, 876, 850, 811, 787, 763, 708, 654 cm-1; HRMS (ESI) calcd for C15H15N2O2 [M+H]+ 255.1128, found 255.1125.
1-[(三甲基硅基)乙炔基]-1, 2-二氢-2, 3-二氮杂萘-2(1H)-甲酸甲酯(1m):浅黄色固体, 产率50%. m.p. 144~146 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.71 (s, 1H), 7.44 (t, J=7.6 Hz, 1H), 7.36 (t, J=7.2 Hz, 1H), 7.28~7.23 (m, 2H), 6.19 (s, 1H), 3.91 (s, 3H), 0.02 (s, 9H); 13C NMR (100 MHz, CDCl3) δ: 154.3, 142.8, 132.0, 131.0, 128.8, 126.1, 126.0, 123.0, 101.1, 90.1, 54.0, 45.1, -0.4; IR (neat) ν: 2954, 2163, 1707, 1444, 1362, 1288, 1246, 1227, 1148, 1126, 1008, 967, 914, 901, 842, 788, 773, 762, 671 cm-1; HRMS (ESI) calcd for C15H19N2O2Si [M+H]+ 287.121, found 287.1205.
6-(苯基乙炔基)哒嗪-1(6H)-甲酸甲酯(1n):淡黄色固体, 产率76%, m.p. 76~78 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.39 (d, J=6.8 Hz, 2H), 7.30~7.26 (m, 3H), 7.23 (s, 1H), 6.29~6.26 (m, 1H), 6.00~5.97 (m, 1H), 5.88 (d, J=6.0 Hz, 1H), 3.93 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 154.5, 140.0, 131.7, 128.5, 128.1, 128.0, 121.9, 117.0, 84.8, 84.6, 53.9, 42.0; IR (neat) ν: 3040, 2948, 2362, 1702, 1557, 1492, 1441, 1383, 1360, 1340, 1306, 1268, 1193, 1178, 1120, 1030, 1019, 976, 961, 897, 811, 771, 760, 728, 697 cm-1; HRMS (ESI) calcd for C14H13N2O2 [M+H]+ 241.0972, found 241.0969.
3.2.2 化合物3的合成
向一干燥的25 mL Schlenk管中加入原料1a (87.1 mg, 0.3 mmol), 然后在氩气氛围下抽换氩气三次, 加入8-甲基喹啉氮氧化物(57.3 mg, 0.36 mmol)和甲苯(3 mL), 待完全溶解后加入PPh3AuNTf2 (11.1 mg, 0.015 mmol), 最后将反应管置于50 ℃油浴中, 2 h后TLC检测反应完全; 旋干溶剂后, 粗产品用硅胶柱色谱分离[V(石油醚):V(乙酸乙酯)=4:1], 得到黄色油状液体5-(苯甲酰基)-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3a) 74.9 mg, 产率82%. m.p. 98~99 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.90~7.86 (m, 3H), 7.59~7.56 (m, 1H), 7.49~7.45 (m, 2H), 7.37~7.24 (m, 3H), 7.17 (d, J=7.6 Hz, 1H), 7.09 (s, 1H), 3.89 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 195.3, 157.8, 155.1, 142.3, 137.4, 135.9, 133.1, 132.8, 131.1, 130.5, 130.0, 129.6, 128.6, 128.2, 54.3; IR (neat) ν: 3056, 2948, 2926, 2848, 1723, 1652, 1633, 1439, 1357, 1335, 1317, 1297, 1273, 1262, 1225, 1198, 1164, 973, 902, 872, 854, 815, 768, 726, 703, 672 cm-1; HRMS (ESI) calcd for C18H15N2O3 [M+H]+ 307.1077, found 307.1072.
以同样方法合成化合物3b~3m.
5-(4-氟苯甲酰基)-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3b):淡黄色固体, 收率69%. m.p. 145~146 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.93 (t, J=7.2 Hz, 2H), 7.86 (s, 1H), 7.37~7.30 (m, 2H), 7.25 (d, J=7.2 Hz, 1H), 7.17~7.12 (m, 3H), 7.06 (s, 1H), 3.90 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 193.8, 165.7 (1JC-F=253.3 Hz), 157.7, 155.1, 141.9, 135.8, 133.7 (4JC-F=2.8 Hz), 132.8, 132.3 (3JC-F=9.5 Hz), 131.2, 130.6, 130.0, 129.4, 128.3, 115.8 (2JC-F=21.9 Hz), 54.3; IR (neat) ν: 3065, 2954, 2854, 1720, 1655, 1629, 1595, 1504, 1439, 1353, 1329, 1293, 1259, 1228, 1198, 1155, 1103, 900, 873, 851, 762 cm-1; HRMS (ESI) calcd for C18H14FN2O3 [M+H]+ 325.0983, found 325.0979.
5-(4-氯苯甲酰基)-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3c):浅黄色固体, 产率76%. m.p. 146~147 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.84 (d, J=4.4 Hz, 2H), 7.82 (s, 1H), 7.45 (d, J=8.4 Hz, 2H), 7.37~7.30 (m, 2H), 7.25 (d, J=6.8 Hz, 1H), 7.12 (d, J=7.6 Hz, 1H), 7.07 (s, 1H), 3.90 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 194.0, 157.6, 155.0, 142.4, 139.5, 135.7, 135.6, 132.7, 131.1, 131.0, 130.6, 129.9, 129.2, 128.9, 128.3, 54.3; IR (neat) ν: 3065, 2951, 2856, 1721, 1655, 1630, 1586, 1439, 1353, 1329, 1261, 1227, 1198, 1174, 1103, 1090, 1013, 899, 872, 844, 764, 745 cm-1; HRMS (ESI) calcd for C18H14ClN2O3 [M+H]+ 341.0687, found 341.0683.
5-[(4-乙氧羰基)苯甲酰基]-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3d):浅黄色固体, 产率63%. 1H NMR (400 MHz, CDCl3) δ: 8.14 (d, J=8.0 Hz, 2H), 7.90 (d, J=7.6 Hz, 2H), 7.86 (s, 1H), 7.38~7.31 (m, 2H), 7.26 (d, J=6.8 Hz, 1H), 7.16 (d, J=7.6 Hz, 1H), 7.13 (s, 1H), 4.41 (dd, J=12.2 Hz, 7.0 Hz, 2H), 3.90 (s, 3H), 1.41 (t, J=7.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 194.7, 165.4, 157.6, 155.0, 143.6, 141.0, 135.4, 134.0, 132.6, 131.5, 130.1, 130.0, 129.2, 129.1, 128.3, 61.3, 54.3, 14.1; IR (neat) ν: 3056, 2959, 2923, 1717, 1658, 1629, 1440, 1353, 1329, 1272, 1198, 1104, 1018, 900, 875, 764, 734 cm-1; HRMS (ESI) calcd for C21H19N2O5[M+H]+ 379.1288, found 379.1284.
5-[(4-硝基)苯甲酰基]-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3e):淡黄色固体, 产率37%. m.p. 169~171 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.33 (d, J=8.0 Hz, 2H), 8.00 (d, J=8.0 Hz, 2H), 7.86 (s, 1H), 7.41~7.34 (m, 2H), 7.28 (d, J=6.0 Hz, 1H), 7.16 (d, J=5.6 Hz, 2H), 3.91 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 193.6, 157.6, 155.1, 150.1, 144.8, 142.8, 135.0, 132.7, 131.3, 130.8, 130.4, 130.2, 128.7, 123.8, 54.6; IR (neat) ν: 2959, 2920, 2848, 1712, 1660, 1631, 1519, 1438, 1346, 1328, 1297, 1265, 1223, 1172, 1098, 902, 858, 844, 833, 785, 772, 762, 730, 697, 673, 659 cm-1; HRMS (ESI) calcd for C18H14N3O5 [M+H]+ 352.0928, found 352.0923.
5-(4-甲苯甲酰基)-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3f):淡黄色固体, 产率67%. m.p. 126~128 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.85 (s, 1H), 7.81 (d, J=7.6 Hz, 2H), 7.34~7.26 (m, 5H), 7.15 (d, J=7.2 Hz, 1H), 7.04 (s, 1H), 3.90 (s, 3H), 2.42 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 195.0, 157.8, 155.2, 144.1, 141.5, 136.1, 134.8, 132.8, 131.1, 130.5, 129.9, 129.8, 129.3, 128.1, 54.2, 21.6; IR (neat) ν: 3062, 2956, 2920, 2845, 1707, 1646, 1627, 1602, 1440, 1379, 1357, 1338, 1292, 1276, 1264, 1196, 1175, 1112, 981, 919, 902, 873, 864, 840, 795, 762, 753, 723, 690, 666 cm-1; HRMS (ESI) calcd for C19H17N2O3 [M+H]+ 321.1234, found 321.1230.
5-[(4-甲氧基)苯甲酰基]-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3g):淡黄色液体, 产率58%. 1H NMR (400 MHz, CDCl3) δ: 7.92 (d, J=8.8 Hz, 2H), 7.86 (s, 1H), 7.34~7.24 (m, 3H), 7.12 (d, J=7.2 Hz, 1H), 6.99 (s, 1H), 6.96 (d, J=8.4 Hz, 2H), 3.90 (s, 3H), 3.87 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 193.8, 163.8, 157.8, 155.2, 140.2, 136.3, 132.9, 132.2, 131.1, 130.5, 130.0, 129.8, 128.1, 113.8, 55.4, 54.2; IR (neat)ν: 3059, 2951, 2834, 1720, 1647, 1595, 1572, 1508, 1439, 1352, 1310, 1253, 1198, 1165, 1103, 1023, 899, 871, 844, 760, 728, 693, 667 cm-1; HRMS (ESI) calcd for C19H17N2O4 [M+H]+ 337.1183, found 337.1178.
5-[(3, 4, 5-三甲氧基)苯甲酰基]-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3h):淡黄色固体, 产率68%. m.p. 139~141 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.87 (s, 1H), 7.40~7.32 (m, 2H), 7.28 (d, J=7.2 Hz, 1H), 7.23 (s, 2H), 7.13 (d, J=7.6 Hz, 1H), 7.09 (s, 1H), 3.95 (s, 3H). 3.91 (d, J=5.6 Hz, 9H); 13C NMR (100 MHz, CDCl3) δ: 194.0, 157.7, 155.1, 152.8, 142.5, 141.2, 136.0, 132.9, 132.0, 131.0, 130.4, 129.9, 129.6, 128.1, 107.1, 60.7, 56.0, 54.1; IR (neat) ν: 2951, 2931, 2843, 2357, 1713, 1644, 1581, 1438, 1412, 1357, 1320, 1251, 1233, 1210, 1194, 1164, 1126, 1107, 994, 876, 863, 764, 757, 740, 715, 704, 679 cm-1; HRMS (ESI) calcd for C21H21N2O6 [M+H]+ 397.1394, found 397.1389.
5-(2-噻吩甲酰基)-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3i):淡黄色固体, 产率64%. m.p. 156~158 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.85 (s, 1H), 7.77 (d, J=3.2 Hz, 1H), 7.73 (d, J=4.8 Hz, 1H), 7.38~7.30 (m, 2H), 7.27~7.20 (m, 3H), 7.15 (t, J=4.4 Hz, 1H), 3.92 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 186.7, 157.7, 155.2, 144.0, 139.9, 135.6, 135.2, 134.8, 133.0, 131.1, 130.6, 130.1, 129.8, 128.32, 128.25, 54.3; IR (neat) ν: 3095, 2954, 2362, 1710, 1625, 1436, 1410, 1355, 1342, 1282, 1239, 1193, 1173, 1112, 1065, 978, 920, 901, 872, 864, 829, 809, 769, 760, 747, 732, 717, 702, 680 cm-1; HRMS (ESI) calcd for C16H13N2O3S [M+H]+ 313.0641, found 313.0637.
5-环己烯基甲酰基-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3j):淡黄色液体, 产率68%. 1H NMR (400 MHz, CDCl3) δ: 7.82 (s, 1H), 7.35 (t, J=7.2 Hz, 1H), 7.29 (t, J=7.2 Hz, 1H), 7.23 (d, J=7.6 Hz, 1H), 7.10 (d, J=7.6 Hz, 1H), 6.98 (s, 1H), 6.83 (s, 1H), 3.90 (s, 3H), 2.35 (s, 2H), 2.30 (s, 2H), 1.70~1.67 (m, 4H); 13C NMR (100 MHz, CDCl3) δ: 196.2, 157.8, 155.3, 145.1, 139.8, 138.12, 138.09, 136.4, 132.9, 131.0, 130.4, 130.1, 129.2, 127.9, 54.1, 26.2, 23.4, 21.7, 21.4; IR (neat) ν: 2954, 2926, 2845, 1708, 1637, 1625, 1436, 1415, 1348, 1330, 1297, 1274, 1253, 1235, 1212, 1163, 1099, 981, 961, 937, 926, 901, 867, 854, 826, 778, 764, 744, 726, 705, 688, 662 cm-1; HRMS (ESI) calcd for C18H19N2O3 [M+H]+ 311.1390, found 311.1384.
5-戊酰基-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3k):淡黄色固体, 产率81%. m.p. 100~102 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.86 (s, 1H), 7.50 (s, 1H), 7.41 (t, J=7.6 Hz, 1H), 7.33~7.30 (m, 2H), 7.22 (d, J=7.2 Hz, 1H), 3.93 (s, 3H), 2.79 (t, J=7.2 Hz, 2H), 1.71~1.65 (m, 2H), 1.42~1.35 (m, 2H), 0.95 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 199.9, 158.3, 155.3, 143.1, 134.9, 132.7, 130.8, 130.5, 129.7, 127.9, 54.3, 39.1, 26.8, 22.3, 13.8; IR (neat) ν: 3070, 2945, 2923, 2859, 1709, 1682, 1632, 1443, 1357, 1330, 1296, 1266, 1202, 1185, 1150, 1103, 977, 921, 878, 865, 775, 768, 755, 700 cm-1; HRMS (ESI) calcd for C16H19N2O3 [M+H]+ 287.1390, found 287.1386.
5-环丙基甲酰基-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3l):淡黄色液体, 产率79%. 1H NMR (400 MHz, CDCl3) δ: 7.85 (s, 1H), 7.54 (s, 1H), 7.40 (t, J=7.2 Hz, 1H), 7.33~7.21 (m, 3H), 3.92 (s, 3H), 2.30 (d, J=2.4 Hz, 1H), 1.21 (d, J=2.4 Hz, 2H), 1.01 (t, J=7.8 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 200.2, 158.0, 155.3, 141.8, 135.0, 132.7, 131.3, 130.6, 130.5, 129.9, 127.9, 54.1, 19.0, 12.1; IR (neat) ν: 3059, 3004, 2951, 2851, 1720, 1661, 1626, 1439, 1352, 1320, 1288, 1256, 1201, 1146, 1102, 1082, 975, 954, 936, 891, 871, 849, 762, 737, 690 cm-1; HRMS (ESI) calcd for C15H15N2O3 [M+H]+ 271.1077, found 271.1074.
5-甲酰基-3H-苯并-2, 3-二氮杂䓬-3-甲酸甲酯(3m):黄色固体, 产率80%. m.p. 150~151 ℃; 1H NMR (400 MHz, CDCl3) δ: 9.57 (s, 1H), 7.71~7.70 (m, 2H), 7.42 (t, J=7.2 Hz, 1H), 7.34~7.27 (m, 2H), 7.16 (d, J=7.2 Hz, 1H), 3.97 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 189.9, 157.1, 153.7, 132.8, 131.7, 131.5, 130.9, 129.8, 128.6, 128.0, 54.8; IR (neat) ν: 2954, 2918, 2851, 2360, 1717, 1687, 1634, 1442, 1370, 1345, 1322, 1268, 1205, 756 cm-1; HRMS (ESI) calcd for C12H11N2O3 [M+H]+ 231.0764, found 231.0763.
3.2.3 产物的后续转化
吡唑4的合成:在手套箱中向Schlenk管中加入三氯化铁(16.2 mg, 0.1 mmol), 然后移出手套箱.在氩气氛围下, 再加入原料3a (61.3 mg, 0.2 mmol)和1, 2-二氯乙烷(2 mL). 80 ℃反应6.5 h, TLC检测反应完成.用水淬灭反应, 乙酸乙酯萃取, 无水硫酸钠干燥.减压蒸去溶剂后, 粗产物用硅胶柱色谱分离[V(石油醚):V(乙酸乙酯)=3:1], 得到淡黄色固体4-[(2-甲酰基)苯基]-3-苯基-1H-吡唑-1-甲酸甲酯(4) (39.8 mg), 产率65%. m.p. 141~142 ℃; 1H NMR (400 MHz, CDCl3) δ: 9.89 (s, 1H), 8.26 (s, 1H), 7.97 (d, J=7.6 Hz, 1H), 7.63 (d, J=7.2 Hz, 1H), 7.53 (d, J=7.6 Hz, 1H), 7.42~7.36 (m, 3H), 7.32~7.23 (m, 3H), 4.14 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 190.8, 154.8, 149.7, 134.6, 134.04, 134.02, 131.9, 131.7, 130.5, 129.1, 128.8, 128.5, 128.3, 128.2, 120.2, 55.2; IR (neat) ν: 3135, 3070, 2957, 2861, 1774, 1689, 1449, 1378, 1305, 1223, 1134, 991, 969, 835, 826, 816, 780, 761, 722, 710, 701 cm-1; HRMS (ESI) calcd for C18H15N2O3[M+H]+ 307.1077, found 307.1071.
多并环化合物5的合成:在手套箱中向Schlenk管中加入三氯化铁(97.3 mg, 0.6 mmol), 然后移出手套箱.氩气氛围下, 再加入原料3a (61.3 mg, 0.2 mmol)和1, 2-二氯乙烷(5 mL). 80 ℃反应1 h, TLC检测反应完成; 用水淬灭反应, 乙酸乙酯萃取, 无水硫酸钠干燥.减压蒸去溶剂后, 粗产品用硅胶柱色谱分离[V(石油醚):V(乙酸乙酯)=2:1], 得到淡黄色固体(7aS*, 12aR*)-12a-氯-12-氧代-12, 12a-二氢苯并[e]茚基[1, 2-c][1, 2]二氮杂䓬-7(7aH)-甲酸甲酯(5) (46.3 mg), 产率68%. m.p. 194.5~195.3 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.19 (d, J=8.4 Hz, 1H), 7.75~7.69 (m, 2H), 7.61 (s, 1H), 7.56~7.47 (m, 3H), 7.38 (d, J=7.6 Hz, 1H), 7.19 (d, J=7.6 Hz, 1H), 7.02 (s, 1H), 3.98 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 192.6, 156.8, 154.9, 145.4, 136.1, 136.0, 133.1, 132.5, 132.3, 131.6, 130.1, 129.7, 129.1, 125.8, 125.6, 76.7, 73.5, 54.6; IR (neat) ν: 2951, 2918, 2845, 2360, 2339, 1729, 1702, 1443, 1375, 1316, 1293, 1284, 1264, 1105, 1005, 913, 900, 763, 754, 733, 698, 677 cm-1; HRMS (ESI) calcd for C18H14ClN2O3 [M+H]+ 341.0687, found 341.0683.
-
-
[1]
(a) Pellow, S.; File, S. E. Pharmacol., Biochem. Behav. 1986, 24, 525.
(b) Chimirri, A.; De Sarro, G.; De Sarro, A.; Gitto, R.; Grasso, S.; Quartarone, S.; Zappalá, M.; Giusti, P.; Libri, V.; Constanti, A.; Chapman, A. G. J. Med. Chem. 1997, 40, 1258.
(c) Zappalá, M.; Grasso, S.; Micale, N.; Polimeni, S.; De Micheli, C. Mini-Rev. Med. Chem. 2001, 1, 243. -
[2]
Sólyyom, S.; Tarnawa, I. Curr. Pharm. Design 2002, 913.
-
[3]
Howes, J. F.; Bell, C. Neurotherapeutics 2007, 4, 126. doi: 10.1016/j.nurt.2006.11.001
-
[4]
Csuzdi, E.; Migléczi, K.; Hazai, I.; Berzsenyi, P.; Pallagi, I. Bioorg. Med. Chem. Lett. 2005, 15, 4662. doi: 10.1016/j.bmcl.2005.07.080
-
[5]
(a) Archer, G. A.; Sternbach, L. H. Chem. Rev. 1968, 68, 747.
(b) Bunin, B. A.; Ellman, J. A. J. Am. Chem. Soc. 1992, 114, 10997. -
[6]
(a) Cacchi, S.; Fabrizi, G.; Goggiamani, A.; Iazzetti, A. Org. Lett. 2016, 18, 3511.
(b) Guo, P.; Zeng, X.; Chen, S.; Luo, M. J. Organomet. Chem. 2014, 751, 438. -
[7]
(a) Snieckus, V.; Streith, J. Acc. Chem. Res. 1981, 14, 348.
(b) Sugimoto, K.; Hayashi, R.; Nemoto, H.; Toyooka, N.; Matsuya, Y. Org. Lett. 2012, 14, 3510.
(c) Guo, C.; Sahoo, B.; Daniliuc, C. G.; Glorius, F. J. Am. Chem. Soc. 2014, 136, 17402.
(d) Li, Z.; Yu, H.; Feng, Y.; Hou, Z.; Zhang, L.; Yang, W.; Wu, Y.; Xiao, Y.; Guo, H. RSC Adv. 2015, 5, 34481. -
[8]
(a) Horváth, E. J.; Horváth, K.; Hámori, T.; Fekete, M. I. K.; Sólyom, S.; Palkovits, M. Prog. Neurobiol. 2000, 60, 309.
(b) Okuma, K.; Tanabe, Y.; Nagahora, N.; Shioji, K. Bull. Chem. Soc. Jpn. 2015, 88, 1064.
(c) Chan, C.-K.; Tsai, Y.-L.; Chan, Y.-L.; Chang, M.-Y. J. Org. Chem. 2016, 81, 9836.
(d) Wang, J.; Wang, L.; Guo, S.; Zha, S.; Zhu, J. Org. Lett. 2017, 19, 3640. -
[9]
For recent reviews on gold-catalyzed reactions, see: (a) Dorel, R. ; Echavarren, A. M. Chem. Rev. 2015, 115, 9028.
(b) Wang, Y. ; Muratore, M. E. Echavarren, A. M. Chem. -Eur. J. 2015, 21, 7332.
(c) Pflä sterer, D. ; Hashmi, A. S. K. Chem. Soc. Rev. 2016, 45, 1331.
(d) Wu, W-T. ; Zhang, L. ; You, S-L. Acta Chim. Sinica 2017, 75, 419(in Chinese). (吴文挺, 张立明, 游书力, 化学学报, 2017, 75, 419. ) -
[10]
For recent papers, see:gold-catalyzed ring expansion reactions without oxidant:(a) Markham, J. P.; Staben, S. T.; Toste, F. D. J. Am. Chem. Soc. 2005, 127, 9708.
(b) Kleinbeck, F.; Toste, F. D. J. Am. Chem. Soc. 2009, 131, 9178.
(c) Barluenga, J.; Tudela, E.; Vicente, R.; Ballesteros, A.; Tomás, M. Angew. Chem., Int. Ed. 2011, 50, 2107.
Diphenylsulfoxide as the oxidant:(d) Witham, C. A.; Mauleόn, P.; Shapiro, N. D.; Sherry, B. D.; Toste, F. D. J. Am. Chem. Soc. 2007, 129, 5838.
(e) Li, G.; Zhang, L. Angew. Chem., Int. Ed. 2007, 46, 5156.
Quinoline/pyridine N-oxide as the oxidant:(f) Ye, L.; Cui, L.; Zhang, G.; Zhang, L. J. Am. Chem. Soc. 2010, 132, 3258.
(g) Vasu, D.; Hung, H.-H.; Bhunia, S.; Gawade, S. A.; Das, A.; Liu, R.-S. Angew. Chem., Int. Ed. 2011, 50, 6911.
(h) Qian, D.; Zhang, J. Chem. Commun. 2011, 47, 11152.
(i) Yuan, W.; Dong, X.; Wei, Y.; Shi, M. Chem.-Eur. J. 2012, 18, 10501.
Nitrone as the oxidant:(j) Yeom, H.-S.; Lee, J.-E.; Shin, S. Angew. Chem., Int. Ed. 2008, 47, 7040.
(k) Chen, D.; Song, G.; Jia, A.; Li, X. J. Org. Chem. 2011, 76, 8488. -
[11]
Chen. M.; Chen, Y.; Sun, N.; Zhao, J.; Liu, Y; Li, Y. Angew. Chem., Int. Ed. 2015, 54, 1200. doi: 10.1002/anie.201410056
-
[12]
Chen, M.; Sun, N.; Xu, W.; Zhao, J.; Wang, G.; Liu, Y. Chem.-Eur. J. 2015, 21, 18571. doi: 10.1002/chem.201504165
-
[13]
Zhao, J.; Liu, J.; Xie, X.; Li, S.; Liu, Y. Org. Lett. 2015, 17, 5926. doi: 10.1021/acs.orglett.5b03160
-
[14]
Braunstein, P.; Lehner, H.; Matt, D.; Burgess, K.; Ohlmeyer, M. J. Inorg. Synth. 1990, 27, 218.
-
[15]
Mézailles, N.; Ricard, L.; Gagosz, F. Org. Lett. 2005, 7, 4133. doi: 10.1021/ol0515917
-
[16]
Henrion, G.; E. J. Chavas, T.; Goff, X. L.; Gagosz, F. Angew. Chem., Int. Ed. 2013, 52, 6277. doi: 10.1002/anie.201301015
-
[1]
-
表 1 反应条件优化
Table 1. Optimization of reaction conditions

Entry Oxidant (equiv.) Catalyst (mol%) Solvent Temp./℃ Time/h Yielda/% 1 2a (2) PPh3AuNTf2 (5) Toluene 50 2 81 2 2b (2) PPh3AuNTf2 (5) Toluene 50 22 35 (9) 3 2c (2) PPh3AuNTf2 (5) Toluene 50 3 47 4 2a (1.2) PPh3AuNTf2 (5) Toluene 50 2 82 5 2a (1.2) PPh3AuNTf2 (5) THF 50 3 72 6 2a (1.2) PPh3AuNTf2 (5) DCE 50 3 64 7 2a (1.2) PPh3AuNTf2 (5) Toluene r.t. 3.5 73 8 2a (1.2) Catalyst A (5) Toluene 50 23 52 (19) 9 2a (1.2) PPh3AuCl/AgSbF6 (5) Toluene 50 3 75 10 2a (1.2) PPh3AuCl/AgOTf (5) Toluene 50 10 73 11 2a (1.2) PPh3AuCl (5) Toluene 50 13 -(90) 12 2a (1.2) AgNTf2 (5) Toluene 50 13 3 (85) 13 2a (1.2) HNTf2 (10) Toluene 50 13 -(93) aIsolated yields. [Substrate]=0.1 mol/L. The recovered yields of 1a are shown in parentheses. 表 2 反应底物拓展a
Table 2. Scope of the substrates





a Isolated yields. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 16
- 文章访问数: 2953
- HTML全文浏览量: 536




 下载:
下载:



 下载:
下载:

