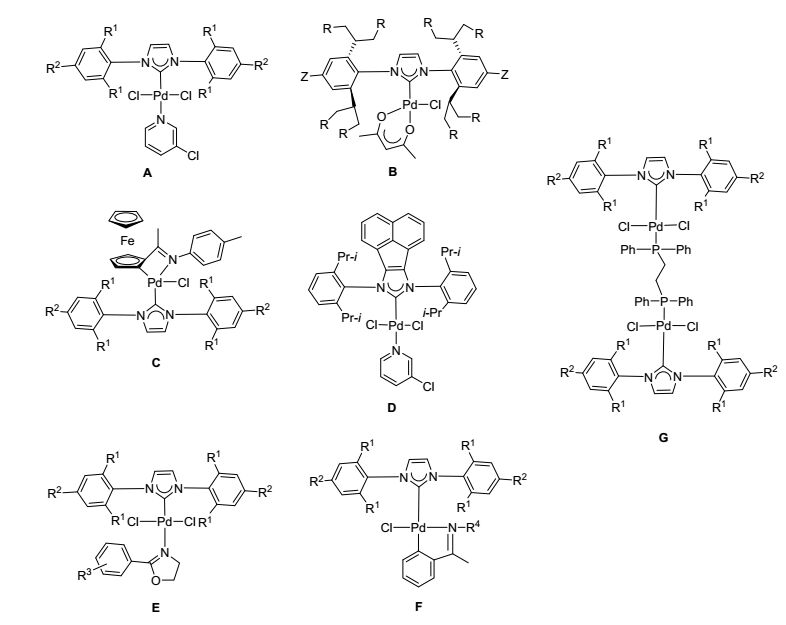
 图1
几种应用于Buchwald-Hartwig反应的典型氮杂环卡宾钯化合物
Figure1.
Selected N-heterocyclic carbene-palladium(Ⅱ) complexes for Buchwald-Hartwig amination reaction
图1
几种应用于Buchwald-Hartwig反应的典型氮杂环卡宾钯化合物
Figure1.
Selected N-heterocyclic carbene-palladium(Ⅱ) complexes for Buchwald-Hartwig amination reaction

Citation: Wang Tao, Xu Kai, Zhang An'an, Wang Wanli, Liu Lantao. Buchwald-Hartwig Amination of Aryl Chlorides Catalyzed by Trinuclear N-Heterocyclic Carbene-Palladium(Ⅱ) Complexes[J]. Chinese Journal of Organic Chemistry, 2018, 38(1): 259-265. doi: 10.6023/cjoc201708036

三核N-杂环卡宾-钯(Ⅱ)化合物催化芳基氯化物的Buchwald-Hartwig胺化反应研究
-
关键词:
- N-杂环卡宾
- / 三核钯化合物
- / Buchwald-Hartwig胺化反应
- / 芳基氯化合物
English
Buchwald-Hartwig Amination of Aryl Chlorides Catalyzed by Trinuclear N-Heterocyclic Carbene-Palladium(Ⅱ) Complexes
-
官能化芳胺衍生物普遍存在于生物活性物质及药物中, 也常常被应用于药物、农业杀虫剂、橡胶、染料、颜料等功能分子的合成[1], 因此官能化芳胺的合成方法学研究具有重要的学术意义和应用价值. 1983年Kosugi等报道了[P(o-tolyl)3]2PdCl2催化的溴代芳烃与三丁基锡胺的C—N键偶联反应来合成芳香胺衍生物.但是三叔丁基锡胺的毒性和较窄的底物适应范围限制了该方法在合成化学方面的应用. 1995年Buchwald[2]和Hartwig[3]课题组分别发现:在碱性条件下, 钯催化剂可以实现胺和溴代芳烃直接偶联反应(Buchwald-Hartwig胺化反应).这一突破引起了众多研究者的兴趣, 经过化学家们的不懈努力Buchwald-Hartwig胺化反应已经成为芳胺类衍生物最常用且最重要的合成方法之一[4].高效、底物适应范围广、反应条件温和的催化剂的设计合成仍是此类反应研究的重要内容.最近, 各种结构修饰的氮杂环卡宾-钯化合物被设计合成[5](图 1), 并作为一类非常高效的催化剂应用于Buchwald-Hartwig胺化反应.他们在催化反应活性较低、价格较便宜的芳基氯化物的Buchwald-Hartwig胺化反应时也能具有较好的催化性能.例如: Organ等[6]报道的Pd-PEPPSI-NHC (A), Nolan课题组[7]发展的[Pd(NHC)(acac)Cl] (B).国内一些研究小组在此研究领域也做了一系列工作:吴养洁研究小组[8]设计合成了一系列氮杂环卡宾-二茂铁亚胺环钯化合物C, 并将其应用于芳基氯化物的Buchwald-Hartwig胺化反应, 取得了较好的催化结果.涂涛等[9]在Pd-PEPPSI-NHC型催化剂的基础上, 通过改变氮杂环卡宾化合物合成了更加高效的钯催化剂D; 陆建梅[10]和曹育才[11]课题组通过改变辅助配体也相继报道了氮杂环卡宾钯化合物E、F, 并成功地用于催化Buchwald-Hartwig胺化反应.最近, 王磊研究小组[12]报道了有机膦配体桥连的双核氮杂环钯化合物G, 该类化合物在微波条件下实现了芳基氯化物与伯胺或仲胺的Buchwald-Hartwig反应(图 1).
 图1
几种应用于Buchwald-Hartwig反应的典型氮杂环卡宾钯化合物
Figure1.
Selected N-heterocyclic carbene-palladium(Ⅱ) complexes for Buchwald-Hartwig amination reaction
图1
几种应用于Buchwald-Hartwig反应的典型氮杂环卡宾钯化合物
Figure1.
Selected N-heterocyclic carbene-palladium(Ⅱ) complexes for Buchwald-Hartwig amination reaction
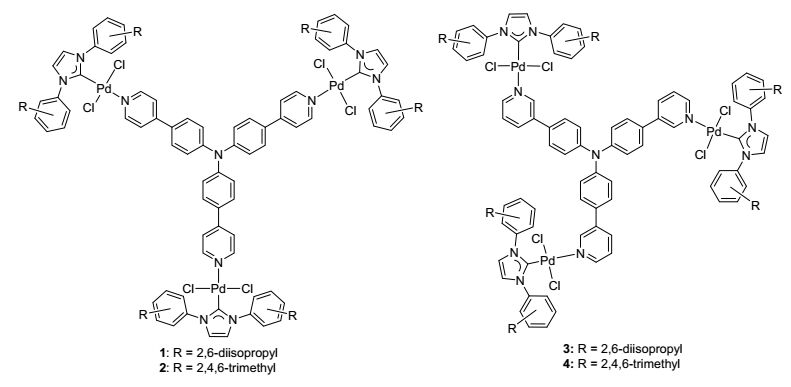
最近我们课题组也致力于新型氮杂环卡宾-钯(NHC-Pd)化合物的设计、合成及其催化应用研究. 2016年, 我们[13]设计合成了以苯并噁唑和苯并噻唑作为辅助配体的氮杂环卡宾-钯化合物, 并将其用于催化芳基以及苄基氯化合物与芳基硼酸的Suzuki-Miyaura偶联反应, 取得了较好的催化结果.该类氮杂环卡宾钯化合物也能催化芳基氯化物的Buchwald-Hartwig反应, 各种类型的伯胺或仲胺都能顺利地进行反应, 以中等较高的收率得到芳胺类衍生物.近期我们[14]把辅助配体更换为吖啶, 同样可以得到两种新型的氮杂环卡宾-钯化合物, 并表现出较好的催化活性.尽管单核氮杂环卡宾-钯化合物作为催化剂已经取得了令人可喜的研究结果, 但是对于具有三齿或多齿配位原子桥连的氮杂环卡宾-钯化合物的研究文献报道却很少.在前期研究工作的基础上, 我们成功制备了氮原子桥连的三核氮杂环卡宾钯化合物1~4(图 2), 并考察了其在C—C键交叉偶联反应中的催化活性[15].可喜的是, 在相同的反应条件下, 该类三核氮杂环卡宾钯化合物的催化效果明显优于与之类似的单核氮杂环卡宾钯化合物.因此, 为了进一步开发三核氮杂环卡宾钯化合物的催化潜力, 拓展其应用范围, 本文考察了其在C—N键交叉偶联反应中的催化活性, 以发展适用于Buchwald-Hartwig胺化反应的高效催化剂.
1 结果与讨论
1.1 反应条件考察
首先, 以氯苯(0.25 mmol)与吗啉(0.300 mmol)为模型反应底物, 三核氮杂环卡宾钯化合物1 (2.0 mol%), 甲苯(0.5 mL), 110 ℃条件下反应15 h, 考察了各种碱对反应结果的影响, 实验结果见表 1.碱的不同对该反应催化结果有着明显的影响[16](表 1, Entries 1~6).当使用NaOtBu时反应效果较好, 可以以95%的收率获得目标产品(表 1, Entry 2).接着我们把溶剂甲苯的用量改变为1.0 mL时, 目标产物的收率有所降低(表 1, Entry 7).减少催化剂的用量, 目标产物产率随之降低(表 1, Entry 8).其次, 我们考察了温度对Buchwald-Hartwig交叉偶联反应的影响, 降低温度不利于反应的发生(表 1, Entries 9~10).不同的溶剂(比如1, 4-二氧六环、四氢呋喃、乙二醇二甲醚)对反应也有影响, 结果发现甲苯是该反应较好的溶剂.我们还考察了催化剂结构对反应的影响, 结果发现使用三核氮杂环卡宾钯化合物2~4时目标产物的收率均没有提高(表 1, Entries 14~16).最后, 在相同的反应条件下, 我们考察了本课题组的单核氮杂环卡宾钯化合物Ⅰ~Ⅲ对芳胺类衍生物收率的影响.结果表明三核氮杂环卡宾钯化合物1是该反应体系较优的催化剂, 且催化活性明显高于类似的单核氮杂环卡宾钯化合物(表 1, Entry 2 vs Entries 17~19).

Entry Cat. Solvent Temperature/℃ Base Yieldb/% 1 1 Toluene 110 KOBu-t 57 2 1 Toluene 110 NaOBu-t 95 3 1 Toluene 110 Cs2CO3 10 4 1 Toluene 110 NaOH 44 5 1 Toluene 110 LiOBu-t Trace 6 1 Toluene 110 KOH 32 7c 1 Toluene 110 NaOBu-t 82 8d 1 Toluene 110 NaOBu-t 58 9 1 Toluene 100 NaOBu-t 82 10 1 Toluene 90 NaOBu-t 66 11 1 Dioxane 100 NaOBu-t 76 12 1 THF 80 NaOBu-t 52 13 1 DME 80 NaOBu-t 40 14 2 Toluene 110 NaOBu-t 83 15 3 Toluene 110 NaOBu-t 84 16 4 Toluene 110 NaOBu-t 80 17 I Toluene 110 NaOBu-t 70 18 Ⅱ Toluene 110 NaOBu-t 35 19 Ⅲ Toluene 110 NaOBu-t 65 aAll reactions were carried out using chlorobenzene (0.25 mmol), morpholine (0.30 mmol), base (1.3 equiv.), Cat. (2.0 mol%) in toluene (0.5 mL) at 110 ℃ for 15 h. bIsolated yields. cToluene (1.0 mL). dCat. (1.0 mol%). 1.2 芳基氯化物与仲胺的Buchwald-Hartwig胺化反应底物拓展
在上述优化的反应条件下, 首先研究了一系列芳基氯化物与仲胺吗啉的Buchwald-Hartwig胺化反应, 具体见表 2.实验结果表明此反应对芳基氯化物具有良好的官能团兼容性.芳基氯化物的苯环上无论是吸电子基团还是供电子基团, 反应都能顺利地进行, 以67%~99%的收率获得目标产物.特别地, 空间位阻大的芳基氯化物反而更有利于反应的进行: 1-氯-2-甲基苯与吗啉反应得到99%的分离收率(5d); 2-氯-1, 3-二甲基苯与吗啉反应也能得到几乎定量的收率(5h).这可能是因为芳基氯化物邻位取代基的存在大大减少了副产物季铵盐的生成.同时当使用2-氯吡啶和3-氯吡啶之类的杂芳基氯化物作为底物时, 收率在83%~88% (5j~5k), 证明了该催化体系对吡啶杂环类底物也有很好的兼容性.接下来我们还尝试了氯苯与哌啶或N-甲基苯胺等其他仲胺的反应, 仍能以中等的收率获得目标产物(5l~5m).
 表 2
芳基氯化物与仲胺的胺化反应底物拓展a, b
Table 2.
Substrate scope for the catalytic amination of aryl chlorides with secondary amines
表 2
芳基氯化物与仲胺的胺化反应底物拓展a, b
Table 2.
Substrate scope for the catalytic amination of aryl chlorides with secondary amines

1.3 芳基氯化物与伯胺的Buchwald-Hartwig胺化反应底物拓展
三核氮杂环卡宾钯化合物1用于催化芳基氯化物与仲胺的偶联反应表现出较好的催化活性和底物普适性.在上述实验的基础上, 我们继续探究芳基氯化物与伯胺的反应, 实验结果如表 3所示.首先, 考察了不同结构的芳基氯化物与苯胺的反应, 结果发现均能以较高的收率得到芳胺类衍生物(83%~99%, 6a~6g).尤其是对于大位阻的2-氯-1, 3-二甲基苯与苯胺的反应几乎定量完成(6e), 我们推测有可能是因为芳基氯化物的邻位取代基的存在有效地阻止了三级胺的形成.接着我们采用大位阻的2-氯-1, 3-二甲基苯作为芳基氯化物, 对于底物伯胺的适用范围也进行了研究, 通过改变芳胺的取代基种类及其空间位阻, 发现大部分的反应均能取得不错的结果.尤其是大位阻的芳胺, 比如邻甲基苯胺、2, 4, 6-三甲基苯胺、2, 6-二异丙基苯胺, 都取得了不错的结果, 产率为96%~99% (6h, 6j, 6k).但遗憾的是, 对于带有吸电子基的芳胺其催化结果较差(6l~6m), 对硝基苯胺与2-氯-1, 3-二甲基苯的反应只能观察到痕量的产物, 其原因可能是因为硝基的吸电子能力太强, 影响胺与钯活性中心配位[17].脂肪伯胺(例如环己胺、正丁胺)与2-氯-1, 3-二甲基苯反应得到中等的收率(6n~6o).当(S)-苯乙胺被用作反应底物时, 以60%的收率得到目标产物, 且在该催化体系下手性中心保持不变[9].总体而言, 三核氮杂环卡宾钯化合物1在本文优化的反应条件下可以作为一类高效的催化剂应用于芳基氯化物与仲胺或芳胺的Buchwald-Hartwig反应.
 表 3
芳基氯化物与伯胺的胺化反应底物拓展a, b
Table 3.
Substrate scope for the catalytic amination of aryl chlorides with primary amines
表 3
芳基氯化物与伯胺的胺化反应底物拓展a, b
Table 3.
Substrate scope for the catalytic amination of aryl chlorides with primary amines

2 结论
利用氮原子桥连的三核氮杂环卡宾钯化合物, 考察了其在芳基氯化物的Buchwald-Hartwig反应中的催化活性, 为芳胺类衍生物的构建提供了一种新方法.在优化的反应条件下, 氯代芳烃、氯代杂芳烃尤其是大位阻的氯代芳烃与仲胺、伯胺均能够很好地完成催化反应, 产率最高可达99%.另外, 实验结果还表明, 三核氮杂环卡宾钯化合物1的催化活性明显高于类似的单核氮杂环卡宾钯化合物.
3 实验部分
3.1 仪器与试剂
核磁共振氢谱1H NMR (400 MHz)和13C NMR (100 MHz)采用Bruker AV 400核磁共振仪测定, 所用溶剂为CDCl3, TMS为内标.柱层析使用200~300目硅胶, 展开剂为乙酸乙酯和石油醚(60~90 ℃).实验所用试剂均为市售分析纯试剂, 甲苯用钠加热回流至加入二苯甲酮后显蓝紫色后蒸出; 其余试剂均未进一步纯化处理.三核氮杂环卡宾钯(Ⅱ)化合物按照我们前期报道的方法合成[15].
3.2 实验方法
氮气气氛下, 15 mL Schlenk反应管加入0.25 mmol芳基氯化物, 0.30 mmol仲胺或伯胺, 0.325 mmol叔丁醇钠, 0.005 mmol三核氮杂环卡宾钯化合物, 再加入0.5 mL甲苯作为溶剂, 110 ℃条件下反应15 h.反应结束后, 停止加热、稀释溶解、旋蒸浓缩, 柱层析分离得到相应的目标产物.纯化的产物通过1H NMR光谱鉴定.
4-苯基吗啉(5a)[8~10]: 1H NMR (400 MHz, CDCl3) δ: 7.30~7.26 (m, 2H, ArH), 6.94~6.87 (m, 3H, ArH), 3.87 (t, J=4.5 Hz, 4H, CH2), 3.16 (t, J=4.6 Hz, 4H, CH2).
4-(对甲苯基)吗啉(5b)[8~10]: 1H NMR (400 MHz, CDCl3) δ: 7.08 (d, J=8.0 Hz, 2H, ArH), 6.83 (d, J=8.4 Hz, 2H, ArH), 3.85 (t, J=4.6 Hz, 4H, CH2), 3.10 (t, J=4.6 Hz, 4H, CH2), 2.27 (s, 3H, CH3).
4-(间甲苯基)吗啉(5c)[9~10]: 1H NMR (400 MHz, CDCl3) δ: 7.17 (s, 1H, ArH), 6.75~6.73 (m, 3H, ArH), 3.86 (s, 4H, CH2), 3.15 (s, 4H, CH2), 2.33 (s, 3H, CH3).
4-(邻甲苯基)吗啉(5d)[8~10]: 1H NMR (400 MHz, CDCl3) δ: 7.20~7.16 (m, 2H, ArH), 7.03~6.98 (m, 2H, ArH), 3.85 (s, 4H, CH2), 2.91 (s, 4H, CH2), 2.32 (s, 3H, CH3).
4-(4-甲氧基苯基)吗啉(5e)[9~10]: 1H NMR (400 MHz, CDCl3) δ: 6.90~6.84 (m, 4H, ArH), 3.86 (t, J=4.5 Hz, 4H, CH2), 3.77 (s, 3H, OMe), 3.05 (t, J=4.5 Hz, 4H, CH2).
4-(3-甲氧基苯基)吗啉(5f)[10]: 1H NMR (400 MHz, CDCl3) δ: 7.20~7.16 (m, 1H, ArH), 6.54~6.43 (m, 3H, ArH), 3.84 (t, J=4.7 Hz, 4H, CH2), 3.78 (s, 3H, OMe), 3.14 (t, J=4.7 Hz, 4H, CH2).
4-(2-甲氧基苯基)吗啉(5g)[10]: 1H NMR (400 MHz, CDCl3) δ: 7.02~6.87 (m, 3H, ArH), 3.90~3.87 (m, 7H, CH2and OMe), 3.08 (s, 4H, CH2).
4-(2, 6-二甲基苯基)吗啉(5h)[8~10]: 1H NMR (400 MHz, CDCl3) δ: 7.00~6.94 (m, 3H, ArH), 3.80 (t, J=4.2 Hz, 4H, CH2), 3.09 (t, J=4.1 Hz, 4H, CH2), 2.34 (s, 6H, CH3).
4-(4-硝基苯基)吗啉(5i)[9]: 1H NMR (400 MHz, CDCl3) δ: 8.15 (d, J=9.3 Hz, 2H, ArH), 6.84 (d, J=9.3 Hz, 2H, ArH), 3.87 (t, J=4.8 Hz, 4H, CH2), 3.38 (t, J=4.7 Hz, 4H, CH2).
4-(吡啶-2-基)吗啉(5j)[9~10]: 1H NMR (400 MHz, CDCl3) δ: 8.20 (d, J=3.1 Hz, 1H, ArH), 7.52~7.48 (m, 1H, ArH), 6.68~6.63 (m, 2H, ArH), 3.83 (t, J=4.7 Hz, 4H, CH2), 3.49 (t, J=4.7 Hz, 4H, CH2).
4-(吡啶-3-基)吗啉(5k)[13b]: 1H NMR (400 MHz, CDCl3) δ: 8.32 (s, 1H, ArH), 8.14 (s, 1H, ArH), 7.19 (s, 2H, ArH), 3.88 (t, J=4.7 Hz, 4H, CH2), 3.19 (t, J=4.6 Hz, 4H, CH2).
1-(邻甲苯基)哌啶(5l)[13b]: 1H NMR (400 MHz, CDCl3) δ: 7.16~7.13 (m, 2H, ArH), 7.00~6.92 (m, 2H, ArH), 2.83 (s, 4H, CH2), 2.30 (s, 3H, CH3), 1.70 (s, 4H, CH2), 1.56 (s, 2H, CH2)
N, 2-二甲基-N-苯基苯胺(5m)[13b]: 1H NMR (400 MHz, CDCl3) δ: 7.29~7.13 (m, 6H, ArH), 6.70 (t, J=6.8 Hz, 1H, ArH), 6.53 (d, J=7.8 Hz, 2H, ArH), 3.21 (s, 3H, CH3), 2.14 (s, 3H, CH3).
二苯胺(6a)[9~10]: 1H NMR (400 MHz, CDCl3) δ: 7.27~7.23 (m, 4H, ArH), 7.07~7.05 (m, 4H, ArH), 6.94~6.90 (m, 2H, ArH), 5.67 (br s, 1H, NH).
4-甲基-N-苯基苯胺(6b)[10~11]: 1H NMR (400 MHz, CDCl3) δ: 7.24~7.21 (m, 2H, ArH), 7.08~7.07 (m, 2H, ArH), 7.00~6.98 (m, 4H, ArH), 6.89~6.85 (m, 1H, ArH), 5.58 (br s, 1H, NH), 2.29 (s, 3H, CH3).
3-甲基-N-苯基苯胺(6c)[10]: 1H NMR (400 MHz, CDCl3) δ: 7.25~7.23 (m, 2H, ArH), 7.14~7.12 (m, 1H, ArH), 7.06~7.04 (m, 2H, ArH), 6.93~6.88 (m, 3H, ArH), 6.75~6.73 (m, 1H, ArH), 5.63 (br s, 1H, NH), 2.30 (s, 3H, CH3).
2-甲基-N-苯基苯胺(6d)[10~11]: 1H NMR (400 MHz, CDCl3) δ: 7.26~7.11 (m, 5H, ArH), 6.95~6.87 (m, 4H, ArH), 2.24 (s, 3H, CH3).
2, 6-二甲基-N-苯基苯胺(6e)[9-10]: 1H NMR (400 MHz, CDCl3) δ: 7.26~7.06 (m, 5H, ArH), 6.74 (t, J=7.2 Hz, 1H, ArH), 6.50 (d, J=7.6 Hz, 2H, ArH), 5.19 (br s, 1H, NH), 2.21 (s, 6H, CH3).
4-甲氧基-N-苯基苯胺(6f)[13b]: 1H NMR (400 MHz, CDCl3) δ: 7.24~7.19 (m, 2H, ArH), 7.07 (d, J=8.6 Hz, 2H, ArH), 6.91~6.81 (m, 5H, ArH), 5.49 (br s, 1H, NH), 3.79 (s, 3H, OMe).
3-甲氧基-N-苯基苯胺(6g)[13b]: 1H NMR (400 MHz, CDCl3) δ: 7.26 (t, J=7.8 Hz, 2H, ArH), 7.15 (t, J=7.9 Hz, 1H, ArH), 7.08 (d, J=7.5 Hz, 2H, ArH), 6.93 (t, J=7.3 Hz, 1H, ArH), 6.64 (d, J=7.0 Hz, 2H, ArH), 6.47 (d, J=7.3 Hz, 1H, ArH), 5.69 (br s, 1H, NH), 3.76 (s, 3H, OMe).
2, 6-二甲基-N-(邻甲苯基)苯胺(6h)[9]: 1H NMR (400 MHz, CDCl3) δ: 7.11~7.07 (m, 4H, ArH), 6.96 (s, 1H, ArH), 6.70 (s, 1H, ArH), 6.14 (d, J=7.5 Hz, 2H, ArH), 4.92 (br s, 1H, NH), 2.32 (s, 3H, CH3), 2.18 (s, 6H, CH3).
N-(4-甲氧基苯基)-2, 6-二甲基苯胺(6i)[9]: 1H NMR (400 MHz, CDCl3) δ: 7.02~6.95 (m, 3H, ArH), 6.66 (d, J=7.4 Hz, 2H, ArH), 6.40 (d, J=7.2 Hz, 2H, ArH), 4.94 (br s, 1H, NH), 3.65 (s, 3H, OMe), 2.11 (s, 6H, CH3).
N-(2, 6-二甲基苯基)-2, 4, 6-三甲基苯胺(6j)[9]: 1H NMR (400 MHz, CDCl3) δ: 6.95 (d, J=6.3 Hz, 2H, ArH), 6.80 (s, 3H, ArH), 4.71 (br s, 1H, NH), 2.25 (s, 3H, CH3), 1.99 (s, 12H, CH3).
N-(2, 6-二异丙基)-2, 6-二甲基苯胺(6k)[9, 11]: 1H NMR (400 MHz, CDCl3) δ: 7.11 (s, 3H, ArH), 6.92 (d, J=6.8 Hz, 2H, ArH), 6.71 (t, J=6.6 Hz, 1H, ArH), 4.78 (br s, 1H, NH), 3.16~3.13 (m, 2H, CH), 1.97 (s, 6H, CH3), 1.11 (d, J=6.3 Hz, 12H, CH3).
N-(4-氯苯基)-2, 6-二甲基苯胺(6l): 1H NMR (400 MHz, CDCl3) δ: 7.11 (s, 5H, ArH), 6.42 (d, J=6.8 Hz, 2H, ArH), 5.18 (br s, 1H, NH), 2.19 (s, 6H, CH3); 13C NMR (100 MHz, CDCl3) δ: 144.9, 137.8, 136.0, 129.1, 128.7, 126.1, 122.7, 114.5, 18.3.
N-环己基-2, 6-二甲基苯胺(6n)[9]: 1H NMR (400 MHz, CDCl3) δ: 6.97 (d, J=6.5 Hz, 2H, ArH), 6.78 (t, J=6.7 Hz, 1H, ArH), 2.95 (br s, 1H, NH), 2.26 (s, 6H, CH3), 1.97~1.94 (m, 2H, CH2), 1.72 (s, 2H, CH2), 1.63~1.61 (m, 1H, CH), 1.26~1.09 (m, 6H, CH2).
N-丁基-2, 6-二甲基苯胺(6o)[18]: 1H NMR (400 MHz, CDCl3) δ: 7.00 (d, J=6.7 Hz, 2H, ArH), 6.82 (d, J=6.9 Hz, 1H, ArH), 2.99 (t, J=6.5 Hz, 2H, CH2), 2.30 (s, 6H, CH3), 1.58~1.56 (m, 2H, CH2), 1.44~1.42 (m, 2H, CH2), 0.96 (t, J=6.7 Hz, 3H, CH3).
(S)-2, 6-二甲基-N-(1-苯乙基)苯胺(6p)[9]: [α]D20-85.9 (c 0.30, CHCl3); 1H NMR (400 MHz, CDCl3) δ: 7.29~7.23 (m, 5H, ArH), 6.94 (d, J=6.5 Hz, 2H, ArH), 6.78 (s, 1H, ArH), 4.31 (d, J=5.8 Hz, 1H, NH), 2.16 (s, 6H, CH3), 1.50 (d, J=5.5 Hz, 3H, CH3).
辅助材料(Supporting Information) 化合物5a~5m以及6a~6p的核磁共振谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Weissermel, K. ; Arpe, H. Industrial Organic Chemistry, Wiley-VCH, Weinheim, Germany, 1997.
(b) Liu, P. ; Li, S. -H. ; Li, L. -M. ; Wang, X. -Y. ; Yin, Y. -Q. ; Zhang, Y. -H. Chin. J. Prog. Chem. 2005, 63, 286 (in Chinese).
(刘浦, 李三华, 李利民, 王向宇, 殷元骐, 张玉华, 化学进展, 2005, 63, 286. ) -
[2]
Guram, A. S.; Rennels, R. A.; Buchwald, S. L. Angew. Chem., Int. Ed. 1995, 34, 1348. doi: 10.1002/(ISSN)1521-3773
-
[3]
Louie, J.; Hartwig, J. F. Tetrahedron Lett. 1995, 36, 3609. doi: 10.1016/0040-4039(95)00605-C
-
[4]
(a) Yang, J. C. ; Niu, D., Karsten, B. P. ; Lima, F. ; Buchwald, S. L. Angew. Chem. Int. Ed. 2016, 55, 2577.
(b) Nasr, A. ; Winkler, A. ; Tamm, M. Coord. Chem. Rev. 2016, 316, 68.
(c) Tang, Y. -Q. ; Lu, J. -M. ; Shao, L. -X. J. Am. Chem. Soc, 2011, 696, 3741.
(d) Jin, Z. ; Gu, X. P. ; Qiu, L. L. ; Wu, G. P. ; Song, H. B. ; Fang, J. X. J. Org. Chem. 2011, 696, 859.
(e) Fang, S. ; Lü, M. ; Long, Y. ; Yang, D. Chin. J. Org. Chem. 2011, 31, 1573 (in Chinese).
(方晒, 吕梅香, 龙玉华, 杨定乔, 有机化学, 2011, 31, 1573. )
(f) Jiang, L. ; Li, Z. -N. ; Zhao, D. -F. Chin. J. Org. Chem. 2010, 30, 200 (in Chinese).
(姜岚, 李争宁, 赵德峰, 有机化学, 2010, 30, 200. )
(g) Würtz, S. ; Lohre, C. ; Frö hlich, R. ; Bergander, K. ; Glorius, F. J. Am. Chem. Soc. 2009, 131, 8344.
(h) Nicolas, M. ; Steven P. N. Acc. Chem. Res. 2008, 41, 1440.
(i) Biscoe, M. R. ; Fors, B. P. ; Buchwald, S. L. J. Am. Chem. Soc. 2008, 130, 6686.
(j) Shi, J. -C. ; Cao, X. -H. ; Zheng, Y. ; Jia, L. Chin. J. Org. Chem. 2007, 27, 666 (in Chinese).
(施继成, 曹新华, 郑瑛, 贾莉, 有机化学, 2007, 27, 666. ) -
[5]
(a) Tang, Y. ; Yang, F. ; Nie, S. ; Wang, L. ; Luo, Z. ; Lu, H. Chin. J. Org. Chem. 2015, 35, 705 (in Chinese).
(唐演, 杨飞飞, 聂士鹏, 王林, 罗治斌, 陆鸿飞, 有机化学, 2015, 35, 705. )
(b) Budagumpi, S. ; Haque, R. A. ; Salman, A. W. Coord. Chem. Rev. 2012, 256, 1787.
(c) Fortman, G. C. ; Nolan, S. P. Chem. Soc. Rev. 2011, 40, 5151.
(d) Droge, T. ; Glorius, F. Angew. Chem., Int. Ed. 2010, 49, 6940.
(e) Diez-Gonzalez, S. ; Marion, N. ; Nolan, Steven P. Chem. Rev. 2009, 109, 3612. -
[6]
(a) Sharif, S.; Rucker, R. P.; Chandrasoma, N.; Mitchell, D.; Rodriguez, M. J.; Froese, R. D. J.; Organ, M. G. Angew. Chem., Int. Ed. 2015, 54, 9507.
(b) Pompeo, M.; Farmer, J. L.; Froese, R. D. J.; Organ, M. G. Angew. Chem., Int. Ed. 2014, 53, 3223. -
[7]
Duc, G. L.; Meiries, S.; Nolan, S. P. Organometallics 2013, 32, 7547. doi: 10.1021/om4010143
-
[8]
Li, J.; Cui, M.; Yu, A.; Wu, Y. J. Organomet. Chem. 2007, 692, 3732. doi: 10.1016/j.jorganchem.2007.05.022
-
[9]
Tu, T.; Fang, W.; Jiang, J. Chem. Commun. 2011, 47, 12358. doi: 10.1039/c1cc15503b
-
[10]
Huang, P.; Wang, Y.-X.; Yu, H.-F.; Lu, J.-M. Organometallics 2014, 33, 1587. doi: 10.1021/om401028d
-
[11]
王凡, 胡宇才, 沈安, 曹育才, 有机化学, 2001, 37, 2050. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201708017&dbname=CJFD&dbcode=CJFQWang, F.; Hu, Y.; Shen, A.; Cao, Y. Chin. J. Org. Chem. 2017, 37, 2050(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201708017&dbname=CJFD&dbcode=CJFQ
-
[12]
Yang, J.; Li, P.; Zhang, Y.; Wang, L. J. Organomet. Chem. 2014, 766, 73. doi: 10.1016/j.jorganchem.2014.05.001
-
[13]
(a) Wang, T.; Xie, H.; Liu, L.; Zhao, W.-X. J. Organomet. Chem. 2016, 804, 73.
(b) Wang, T.; Xu, K.; Liu, L.; Xie, H.; Li, Y.; Zhao, W.-X. Transitmet. Chem. 2016, 41, 525. -
[14]
王涛, 许凯, 孟团结, 张安安, 王红雨, 沈思思, 刘澜涛, 有机化学, 2001, 37, 1794. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201707018&dbname=CJFD&dbcode=CJFQWang, T.; Xu, K.; Meng, T.; Zhang, A.; Wang, H.; Shen, S.; Liu, L. Chin. J. Org. Chem. 2017, 37, 1794(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201707018&dbname=CJFD&dbcode=CJFQ
-
[15]
Wang, T.; Liu, L.; Xu, K.; Xie, H.; Shen, H.; Zhao, W-X. RSC Adv. 2016, 6, 100690. doi: 10.1039/C6RA20852E
-
[16]
欧阳昆冰, 席振峰, 化学学报, 2013, 71, 13.Ouyang, K.; Xi, Z. Acta Chim. Sinica 2013, 71, 13(in Chinese).
-
[17]
Bastug, G.; Nolan, S. P. Organometallics. 2014, 33, 1253. doi: 10.1021/om500026s
-
[18]
Ackermann, L.; Spatz, J. H.; Gschrei, C. J.; Born, R.; Althammer, A. Angew. Chem., Int. Ed. 2006, 45, 7627. doi: 10.1002/(ISSN)1521-3773
-
[1]
-
表 1 反应条件优化a
Table 1. Reaction conditions optimization

Entry Cat. Solvent Temperature/℃ Base Yieldb/% 1 1 Toluene 110 KOBu-t 57 2 1 Toluene 110 NaOBu-t 95 3 1 Toluene 110 Cs2CO3 10 4 1 Toluene 110 NaOH 44 5 1 Toluene 110 LiOBu-t Trace 6 1 Toluene 110 KOH 32 7c 1 Toluene 110 NaOBu-t 82 8d 1 Toluene 110 NaOBu-t 58 9 1 Toluene 100 NaOBu-t 82 10 1 Toluene 90 NaOBu-t 66 11 1 Dioxane 100 NaOBu-t 76 12 1 THF 80 NaOBu-t 52 13 1 DME 80 NaOBu-t 40 14 2 Toluene 110 NaOBu-t 83 15 3 Toluene 110 NaOBu-t 84 16 4 Toluene 110 NaOBu-t 80 17 I Toluene 110 NaOBu-t 70 18 Ⅱ Toluene 110 NaOBu-t 35 19 Ⅲ Toluene 110 NaOBu-t 65 aAll reactions were carried out using chlorobenzene (0.25 mmol), morpholine (0.30 mmol), base (1.3 equiv.), Cat. (2.0 mol%) in toluene (0.5 mL) at 110 ℃ for 15 h. bIsolated yields. cToluene (1.0 mL). dCat. (1.0 mol%). 表 2 芳基氯化物与仲胺的胺化反应底物拓展a, b
Table 2. Substrate scope for the catalytic amination of aryl chlorides with secondary amines

表 3 芳基氯化物与伯胺的胺化反应底物拓展a, b
Table 3. Substrate scope for the catalytic amination of aryl chlorides with primary amines

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 20
- 文章访问数: 3624
- HTML全文浏览量: 485


 下载:
下载:

 下载:
下载:

