
Citation: Lan Lixin, Xiao Jie, Xiao Huaiqiu, Yi Weiguo. Ultrasonic-Assisted Synthesis of 2-Sulfonyl Nitrogen Heterocyclic Compounds[J]. Chinese Journal of Organic Chemistry, 2018, 38(2): 492-497. doi: 10.6023/cjoc201707029

超声促进2-磺酰基氮杂环化合物的合成研究
English
Ultrasonic-Assisted Synthesis of 2-Sulfonyl Nitrogen Heterocyclic Compounds
-
碳-硫键结构广泛存在于天然产物及药物分子中, 特别是抗疟疾药物和抗菌药物[1].因此, 寻找简单高效的方法构建碳-硫键具有重要的研究意义.与传统的硫醇或二硫醚等含硫试剂通过偶联反应、取代反应以及加成反应等方法相比, 采用碳-氢键官能团化在结构中构筑碳-硫键具有显著的底物适用性及步骤经济性等优点[2].近年来, 许多简单、高效的基于碳-氢键官能团化构建碳-硫键的成果被报道[3~7], 但在芳环及杂芳环结构中区域选择性地构建碳-硫键依然是一个难题.通过诱导基实现区域选择性是个很好的解决方法.作为近年来的研究热点, 氮氧诱导基具有多个优点: (1)它可以作为内置氧化剂, 从而避免了外加氧化剂, 减少了环境污染; (2)它作为一个极性化学键, 可以加速C—H键活化历程; (3)氮氧化合物的氧原子易转移, 从而可以构筑多种多样的C—C, C—O和C—N键[8]. 2013年, 吴养洁小组[9]利用碘化亚铜催化喹啉氮氧化物和磺酰氯反应直接合成2-磺酰基喹啉化合物. 2016年, 何纯莲小组[10]报道了使用氧化剂氧化NaI原位生成亚碘酸作为活化剂, 一步合成2-磺酰基喹啉化合物.同年, 潘毅和韩建林合作[11]发展铜催化氧化亚磺酸钠与喹啉氮氧化物反应合成2-磺酰基喹啉化合物的新方法.尽管这些方法都可以很好地合成该化合物, 但是这些反应都需要使用过量的氧化剂, 且反应需要较高的温度.因此探索一种温和高效的2-磺酰基喹啉类化合物合成新方法具有重要意义.
近年来, 随着绿色化学的发展, 开发环境友好及原子经济性高的新反应成为挑战[12].作为遵循绿色化学理念的重要合成技术之一, 超声促进有机合成具有设备简单、无二次污染、能够显著缩短反应时间、提高反应收率等特点, 受到科研工作者深入的研究, 在环化反应[13]、缩合反应[14]、多组分反应[15]等多种反应中得到广泛应用.本文报道了一种以氮杂环氮氧化物为底物, 以亚磺酸为磺酰化试剂, 三吡咯烷基溴化鏻六氟磷酸盐(PyBroP)为活化剂, 三乙胺为碱, 在超声促进下一步制备2-苯磺酰基喹啉类化合物的方法.并利用核磁共振波谱、红外光谱及质谱等手段对目标化合物进行了表征, 并讨论了活化剂、碱、溶剂和反应温度等条件对反应的影响.
1 结果与讨论
1.1 反应条件的优化
为了得到优化的反应条件, 反应以6-甲基喹啉氮氧化物(1a)和苯亚磺酸(2a)为模板反应对偶联反应进行了探索, 考察了不同磷酸盐活化剂、碱、反应温度及反应时间对该反应的影响, 具体结果如表 1所示.

Entry Catalyst Base (equiv.) Solvent Temp/℃ Yield/% 1b PyBroP i-Pr2EtN (4) CH2Cl2 25 57 2 PyBroP i-Pr2EtN (4) CH2Cl2 25 72 3 BroP i-Pr2EtN (4) CH2Cl2 25 51 4 PyBoP i-Pr2EtN (4) CH2Cl2 25 — 5 BoP i-Pr2EtN (4) CH2Cl2 25 — 6 HBTU i-Pr2EtN (4) CH2Cl2 25 — 7 PyBroP Et3N (4) CH2Cl2 25 78 8 PyBroP Ph3N (4) CH2Cl2 25 44 9 PyBroP DBU (4) CH2Cl2 25 12 10 PyBroP K2CO3 (4) CH2Cl2 25 47 11 PyBroP Et3N (3) CH2Cl2 25 74 12 PyBroP Et3N (2) CH2Cl2 25 75 13 PyBroP Et3N (1.5) CH2Cl2 25 61 14 PyBroP Et3N (2) DCE 25 49 15 PyBroP Et3N (2) DMF 25 6 16 PyBroP Et3N (2) THF 25 84c 17 PyBroP Et3N (2) THF 45 82 18 PyBroP Et3N (2) THF 65 77 a Reaction conditions: 1a (0.1 mmol), 2a (0.15 mmol), PyBroP (0.15 mmol), base, solvent (1 mL), ultrasonic irradiation. NMR yield with diethyl phthalate as the internal reference; b Without ultrasound; c Isolated yield 81%. 在传统油浴加热条件下反应进行12 h, 获得了57%的核磁收率, 而采用超声辅助, 1 h后原料反应完全, 核磁收率72%(表 1, Entries 1, 2).可见, 超声辅助的反应条件不仅大大地缩短了反应时间, 而且提高了反应的产率, 故采用超声辅助下进行进一步的反应条件摸索.使用不同的磷酸盐活化剂, 对反应收率有着明显的影响(表 1, Entries 3~6).与模板反应采用的PyBroP相比, 当使用溴代三(二甲氨基)磷六氟磷酸盐(BroP)时反应核磁产率下降明显, 而六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(PyBoP)、苯并三氮唑-1-基氧基三(二甲基氨基)磷鎓六氟磷酸盐(BoP)及苯并三氮唑-四甲基脲六氟磷酸盐(HBTU)不能活化本反应, 故确定PyBroP作为该条件下的最佳的反应活化剂.
进一步考察反应中的添加碱(表 1, Entries 7~10).实验结果表明, 反应中使用Ph3N、1, 8-二氮杂二环十一碳-7-烯(DBU)和K2CO3等碱时, 反应的产率不够理想, 而Et3N和i-Pr2EtN对反应的促进作用较好, 最后选择更为廉价的Et3N作为反应的添加碱.此外, Et3N的用量对反应收率也有明显影响. Et3N用量降低至2 equiv.时, 反应核磁收率基本没有变化.当继续降低Et3N用量至1.5 equiv.时, 反应收率明显降低(表 1, Entries 11~13).
随后, 对反应的溶剂以及温度进行了进一步的优化.溶剂实验表明四氢呋喃(THF)是该催化反应的最佳溶剂(表 1, Entries 14~16).将反应置于45 ℃以及65 ℃条件下, 从实验数据可以看出, 提高反应温度后反应的核磁理论收率均会有所降低(表 1, Entries 17, 18).故认为温度为25 ℃是较为合适的反应温度.
综上所述, 确定了最优反应条件是1 equiv.的喹啉氮氧化物, 1.5 equiv.的苯亚磺酸, 1.5 equiv.的PyBroP, 2.0 equiv.的Et3N, THF作为反应溶剂, 25 ℃超声反应1 h.
1.2 反应底物普适性考察
在获得最优反应条件后, 进一步考察反应底物的适用范围.如表 2所示, 使用喹啉氮氧化物作为反应底物时, 获得了81%的收率(表 2, Entry 1).在喹啉氮氧化物的4位、8位引入甲基, 6位引入供电子基团(甲氧基)或吸电子基团(氯、溴)时, 都能以良好的收率获得相应的2-苯磺酰基喹啉产物(表 2, Entries 2~6).将反应物换成吡啶氮氧化物、异喹啉氮氧化物时, 反应均可以获得顺利进行(表 2, Entries 7~9).此外, 考察了不同取代基的苯亚磺酸对本反应的适用性, 由实验结果可知, 取代基是甲基、甲氧基, 还是氯、乙酰基, 反应均获得良好的收率(表 2, Entries 10~14).进一步考察反应底物适用性, 使用吡啶基亚磺酸及十二烷基亚磺酸时, 反应分别获得49%, 65%的收率(表 2, Entries 15, 16).

Entry Product Yield/% Entry Product Yield/% Entry Product Yield/% 1 
81 2 
83 3 
74 4 
70 5 
75 6 
80 7 
69 8 
72 9 
73 10 
81 11 
75 12 
76 13 
73 14 
72 15 
49 16 
65 a Reaction conditions: 1 (0.3 mmol), 2 (0.45 mmol), PyBroP (0.45 mmol), Et3N (0.60 mmol), solvent (3 mL), ultrasonic irradiation, 1 h; isolated yield. 1.3 反应过程推测
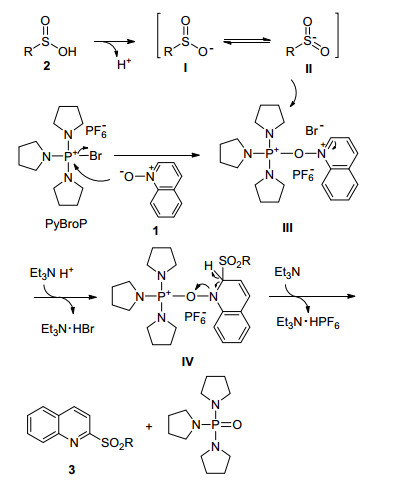
为了更加深入地了解反应过程, 进行了对照实验(Eqs. 1, 2).在反应标准条件下, 向反应中分别加入自由基捕获剂2, 2, 6, 6-四甲基哌啶氮氧化物(TEMPO)及2, 6-二叔丁基-4-甲基苯酚(BHT), 反应进行良好, 可知反应不是自由基历程.在上述实验结果的基础上, 参考文献报道[16~18], 提出了一种可能的反应机理.如Scheme 1所示, 首先亚磺酸2通过电离形成磺酰离子中间体Ⅱ, 而喹啉氮氧化物1亲核进攻磷盐PyBroP形成中间体Ⅲ, 随后在三乙胺的存在下磺酰离子中间体Ⅱ选择性进攻中间体Ⅲ的2位形成中间体Ⅳ, 中间体Ⅳ进一步脱去质子得到2-磺酰基氮杂环化合物3, 同时释放出三吡咯烷氧膦.
2 结论
本文发展了一种通过磷酸盐活化氮杂环氧化物, 超声促进高效合成2-磺酰基氮杂环化合物的新方法.研究结果表明:在超声促进下, 以三乙胺作碱, 以亚磺酸为磺酰化试剂, 氮杂环氧化物能够以中等到良好的反应产率一步制备2-磺酰基氮杂环化合物.该反应具有广泛的反应底物适用性, 为高效合成含有芳基磺酰类复杂化合物提供了一种新的途径.
3 实验部分
3.1 仪器与试剂
1H NMR (TMS内标)和13C NMR (TMS内标)使用Brucker ARX 400型核磁共振仪测定; 红外光谱用岛津仪器公司FD-5DX测定(波数单位是cm-1); 质谱用Thermo-Finnigan LCQ-Advantage型质谱仪(美国)测定, 测定模式为Ion source: APCI(大气压化学电离, 正离子模式); 熔点使用上海光学仪器厂SGWX-4型显微熔点仪, 使用时未校正; 超声使用天津奥特赛恩斯仪器有限公司AS30600BD型超声波清洗机.所有药品和试剂均为分析纯, 购自上海国药试剂公司.
3.2 实验方法
喹啉氮氧化物1参考文献[19]的方法的合成; 芳基亚磺酸化合物2参考文献[20]的方法的合成.
反应条件优化:在5 mL反应瓶中, 依次加入6-甲基喹啉氮氧化物(0.10 mmol)、苯亚磺酸(0.15 mmol)、磷酸盐(0.15 mmol)、碱及溶剂(1 mL), 置于超声清洗仪中反应, 超声频率40 KHz, 薄层色谱(TLC)监测反应进程.反应完毕后, 向反应混合物中加入内标(邻苯二甲酸二乙酯).减压除去溶剂, 残余物用氘代氯仿溶解, 使用核磁氢谱计算核磁理论收率.
合成2-磺酰基氮杂环化合物3: 在10 mL反应瓶中, 依次加入喹啉氮氧化物(0.3 mmol)、芳基亚磺酸(0.45 mmol)、磷酸盐(0.45 mmol)、碱(0.60 mmol)及溶剂(2 mL), 置于超声清洗仪中反应, 超声频率40 KHz, 薄层色谱(TLC)监测反应进程.反应完毕后, 反应混合液依次使用饱和碳酸氢钠水溶液、水、饱和食盐水洗涤.有机相使用无水硫酸钠干燥后, 减压除去溶剂, 残余物用淋洗液[V(正己烷):V(乙酸乙酯)=5:1]通过柱层析色谱进行分离得到产物3a~3o.产物经1H NRM, 13C NMR, IR, MS确定结构.
6-甲基-2-(苯磺酰基)喹啉(3a): 浅黄色固体, m.p. 151~153 ℃(文献值[10] 150~152 ℃); 1H NMR (400 MHz, CDCl3) δ: 2.52 (s, 3H), 7.50 (t, J=4.0 Hz, 2H), 7.56 (d, J=8.0 Hz, 1H), 7.58 (d, J=8.0 Hz, 2H), 8.03 (d, J=8.0 Hz, 1H), 8.11 (d, J=8.0 Hz, 2H), 8.14 (d, J=8.0 Hz, 1H), 8.23 (d, J=4.0 Hz, 1H); 13C NMR (100 MHz, CDCl3)δ: 21.8, 117.8, 126.4, 128.9, 129.0, 130.0, 133.4, 133.6, 137.8, 139.4, 139.7, 146.1, 157.1; IR (neat) ν: 3028, 2977, 1454, 1338, 1172, 1058, 972, 605 cm-1; GCMS (EI+) m/z: 283.1.
2-(苯磺酰基)喹啉(3b): 白色固体, m.p. 162~164 ℃(文献值[21] 160~161 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.44 (t, J=6.8 Hz, 2H), 7.51 (t, J=6.8 Hz, 1H), 7.56 (t, J=7.2 Hz, 1H), 7.70 (t, J=6.8 Hz, 1H), 7.79 (d, J=6.8 Hz, 1H), 8.06 (t, J=6.8 Hz, 3H), 8.12 (d, J=6.8 Hz, 1H), 8.28 (d, J=9.6 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 116.7, 126.7, 127.8, 128.0, 128.1, 128.2, 129.3, 129.9, 130.0, 132.7, 137.7, 138.1, 146.4, 157.0; IR (neat) ν: 3034, 1504, 1319, 1170, 624, 535 cm-1; GCMS (EI+) m/z: 269.1.
4-甲基-2-(苯磺酰基)喹啉(3c)[21]: 浅黄色油状液体. 1H NMR (400 MHz, CDCl3) δ: 2.70 (s, 3H), 7.43 (t, J=6.8 Hz, 2H), 7.50 (t, J=6.8 Hz, 1H), 7.56 (t, J=6.8 Hz, 1H), 7.66 (t, J=6.8 Hz, 1H), 7.91 (d, J=6.8 Hz, 1H), 7.95 (s, 1H), 8.05 (t, J=6.8 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 18.1, 117.1, 122.8, 127.7, 127.9, 127.9, 128.0, 129.5, 130.0, 132.6, 138.2, 146.1, 146.9, 156.6; IR (neat) ν: 3041, 2968, 1507, 1348, 1162, 1099, 686, 533 cm-1; GCMS (EI+) m/z: 283.1.
8-甲基-2-(苯磺酰基)喹啉(3d)[22]: 浅黄色油状液体. 1H NMR (400 MHz, CDCl3) δ: 2.56 (s, 3H), 7.54~7.39 (m, 5H), 7.59 (d, J=6.8 Hz, 1H), 8.10 (t, J=6.8 Hz, 3H), 8.24 (d, J=6.8 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 17.4, 116.7, 125.5, 128.8, 128.9, 129.0, 129.4, 130.9, 133.6, 138.4, 138.8, 138.9, 146.3, 157.1; IR (neat) ν: 3023, 2965, 1497, 1311, 1129, 1072, 635, 527 cm-1; GCMS (EI+) m/z: 283.1.
6-甲氧基-2-(苯磺酰基)喹啉(3e): 白色固体, m.p. 147~150 ℃(文献值[10] 146~148 ℃); 1H NMR (400 MHz, CDCl3) δ: 3.85 (s, 3H), 7.00 (s, 1H), 7.33 (d, J=6.8 Hz, 1H), 7.43 (t, J=3.2 Hz, 2H), 7.50 (d, J=6.8 Hz, 1H), 7.97 (d, J=6.8 Hz, 1H), 8.05 (t, J=6.8 Hz, 3H), 8.14 (d, J=9.6 Hz, 1H); 13C NMR (100 MHz, CDCl3)δ: 54.7, 103.5, 117.2, 123.3, 126.7, 127.8, 128.0, 128.3, 129.4, 130.8, 132.5, 135.8, 142.6, 158.8; IR (neat)ν: 3037, 2968, 1354, 1161, 1048, 967, 626 cm-1; GCMS (EI+) m/z: 299.1.
6-氯-2-(苯磺酰基)喹啉(3f): 黄色固体, m.p. 164~166 ℃(文献值[10] 163~164 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.47 (t, J=8.0 Hz, 2H), 7.55 (t, J=6.8 Hz, 1H), 7.64 (dd, J=9.6, 6.8 Hz, 1H), 7.79 (d, J=2.0 Hz, 1H), 8.02 (d, J=6.8 Hz, 1H), 8.06 (d, J=6.8 Hz, 2H), 8.14 (d, J=9.6 Hz, 1H), 8.19 (d, J=6.8 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 118.6, 126.3, 129.1, 129.2, 129.4, 131.9, 132.1, 133.9, 135.3, 137.8, 138.8, 145.8, 158.4; 19F NMR (376 MHz, CDCl3) δ: -63.1; IR (neat) ν: 3041, 2939, 1549, 1350, 1163, 982, 619 cm-1; GCMS (EI+) m/z: 303.0.
6-溴-2-(苯磺酰基)喹啉(3g)[22]: 黄色油状液体. 1H NMR (400 MHz, CDCl3) δ: 7.53 (t, J=8.0 Hz, 2H), 7.59 (t, J=8.0 Hz, 1H), 7.80 (dd, J=8.0 Hz, 5.6 Hz, 1H), 7.98 (d, J=12.0 Hz, 1H), 8.01 (s, 1H), 8.12 (d, J=8.0 Hz, 2H), 8.20 (d, J=4.0 Hz, 1H), 8.26 (d, J=8.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 118.6, 123.6, 129.1, 129.2, 129.7, 131.6, 133.9, 134.6, 137.7, 138.8, 145.9, 158.5; IR (neat) ν: 3021, 1551, 1329, 1153, 1044, 619 cm-1; GCMS (EI+) m/z: 347.0.
2-(苯磺酰基)吡啶(3h): 棕色固体, m.p. 152~154 ℃(文献值[21] 151~153 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.18 (d, J=3.2 Hz, 1H), 7.34 (d, J=6.8 Hz, 3H), 7.71 (d, J=6.8 Hz, 2H), 7.76 (t, J=6.8 Hz, 1H), 7.96 (t, J=6.8 Hz, 1H), 8.44 (d, J=3.2 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 117.3, 123.6, 123.8, 127.8, 128.1, 128.2, 130.1, 137.1, 148.7; IR (neat) ν: 3025, 2957, 1356, 1107, 1058, 668, 535 cm-1; GCMS (EI+) m/z: 219.0.
2-(对甲苯磺酰基)吡啶(3i): 棕色固体, m.p. 119~121 ℃(文献值[23] 118~119 ℃); 1H NMR (400 MHz, CDCl3) δ: 2.66 (s, 3H), 7.48~7.59 (m, 3H), 7.69 (d, J=8.0 Hz, 1H), 8.16~8.22 (m, 3H), 8.34 (d, J=8.8 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 17.4, 116.7, 125.5, 128.8, 129.0, 129.3, 130.8, 133.6, 138.7, 146.3; IR (neat) ν: 3021, 2960, 1348, 1214, 978, 702, 589 cm-1; GCMS (EI+) m/z: 233.1.
1-(苯基磺酰基)异喹啉(3j): 白色固体, m.p. 157~159 ℃(文献值[21] 156~158 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.47 (t, J=6.8 Hz, 2H), 7.56 (t, J=6.8 Hz, 1H), 7.69 (t, J=3.2 Hz, 3H), 7.81 (d, J=3.2 Hz, 1H), 8.01 (d, J=6.8 Hz, 2H), 8.33 (d, J=3.2 Hz, 1H), 9.07 (d, J=3.2 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 123.3, 124.0, 124.2, 126.5, 127.8, 128.1, 128.2, 130.1, 132.6, 136.7, 138.0, 139.5, 155.9; IR (neat) ν: 3037, 1316, 1299, 1149, 1071, 958, 609 cm-1; GCMS (EI+) m/z: 269.1.
6-甲基-2-(对甲苯磺酰基)喹啉(3k)[24]: 浅黄色油状液体. 1H NMR (400 MHz, CDCl3) δ: 2.40 (s, 3H), 2.55 (s, 3H), 7.33 (d, J=8.0 Hz, 2H), 7.61 (d, J=4.0 Hz, 2H), 8.03 (d, J=8.0 Hz, 2H), 8.07 (d, J=8.0 Hz, 1H), 8.15 (d, J=4.0 Hz, 1H), 8.26 (d, J=8.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 21.6, 21.8, 117.7, 126.4, 128.9, 129.0, 129.7, 130.0, 133.3, 136.4, 137.8, 139.6, 144.6, 146.1, 157.4; IR (neat) ν: 3032, 1361, 1128, 1019, 848, 616, 523 cm-1; GCMS (EI+) m/z: 297.1.
6-甲基-2-(3-甲苯磺酰基)喹啉(3l): 浅黄色固体, m.p. 145~146 ℃(文献值[10] 144~145 ℃); 1H NMR (400 MHz, CDCl3) δ: 2.39 (s, 3H), 2.53 (s, 3H), 7.36~7.40 (m, 2H), 7.55~7.60 (m, 2H), 7.90~7.93 (m, 2H), 8.06 (d, J=8.4 Hz, 1H), 8.14 (d, J=8.8 Hz, 1H), 8.24 (d, J=8.4 Hz, 1H); 13C NMR (100 MHz, CDCl3)δ: 21.2, 21.7, 117.8, 126.0, 126.3, 128.9, 129.0, 129.7, 129.9, 133.3, 134.4, 137.8, 139.1, 139.2, 139.6, 146.0, 157.1; IR (neat) ν: 3017, 1355, 1115, 902, 741, 526 cm-1; GCMS (EI+) m/z: 297.1.
6-甲基-2-(对甲氧基苯磺酰基)喹啉(3m)[24]: 浅黄色油状液体. 1H NMR (400 MHz, CDCl3) δ: 2.46 (s, 3H), 3.75 (s, 3H), 6.90 (d, J=6.8 Hz, 2H), 7.52 (d, J=6.8 Hz, 2H), 7.98 (d, J=6.8 Hz, 3H), 8.05 (d, J=6.8 Hz, 1H), 8.16 (d, J=6.8 Hz, 1H), ; 13C NMR (100 MHz, CDCl3) δ: 20.7, 54.6, 113.3, 116.6, 125.3, 127.8, 128.9, 129.6, 130.1, 132.2, 136.7, 138.4, 145.0, 156.6, 162.7; IR (neat) ν: 3025, 2969, 1389, 1148, 1021, 719, 643 cm-1; GCMS (EI+) m/z: 313.1.
6-甲基-2-(4-氯苯磺酰基)喹啉(3n): 棕色固体, m.p. 179~181 ℃(文献值[21] 178~180 ℃); 1H NMR (400 MHz, CDCl3) δ: 2.59 (s, 3H), 7.53 (d, J=8.0 Hz, 2H), 7.65 (d, J=4.0 Hz, 2H), 8.06 (d, J=4.0 Hz, 1H), 8.10 (d, J=8.0 Hz, 2H), 8.18 (d, J=8.0 Hz, 1H), 8.31 (d, J=8.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 21.8, 117.6, 126.4, 129.0, 129.3, 129.9, 130.5, 133.5, 137.7, 137.9, 139.9, 140.4, 146.1, 156.8; IR (neat) ν: 3034, 2955, 1311, 1152, 1033, 939, 617 cm-1; GCMS (EI+) m/z: 317.0.
6-甲基-2-(4-乙酰基苯磺酰基)喹啉(3o): 白色固体, m.p. 172~174 ℃(文献值[10] 170~172 ℃); 1H NMR (400 MHz, CDCl3) δ: 2.56 (s, 3H), 2.62 (s, 3H), 7.64 (t, J=6.8 Hz, 2H), 8.03 (d, J=6.8 Hz, 1H), 8.08 (d, J=6.8 Hz, 2H), 8.18 (d, J=6.8 Hz, 1H), 8.23 (d, J=6.8 Hz, 2H), 8.29 (d, J=6.8 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 20.8, 25.9, 116.7, 125.4, 125.5, 127.7, 128.3, 128.9, 131.2, 132.6, 136.9, 139.0, 139.6, 142.1, 155.5, 196.8; IR (neat) ν: 3041, 2972, 1322, 1246, 1155, 1041, 676 cm-1; GCMS (EI+) m/z: 325.1.
6-甲基-2-(3-吡啶磺酰基)喹啉(3p)[22]: 浅黄色油状液体. 1H NMR (400 MHz, CDCl3) δ: 2.48 (s, 3H), 7.42 (dd, J=8.0, 4.0 Hz, 1H), 7.56 (d, J=12.0 Hz, 2H), 7.94 (d, J=8.0 Hz, 1H), 8.12 (d, J=8.0 Hz, 1H), 8.23 (d, J=12.0 Hz, 1H), 8.36 (d, J=8.0 Hz, 1H), 8.74 (d, J=4.0 Hz, 1H), 9.25 (s, 1H); 13C NMR (100 MHz, CDCl3) δ: 20.8, 116.3, 122.6, 125.4, 128.0, 128.8, 132.6, 134.8, 135.7, 137.0, 139.1, 145.0, 148.9, 152.9., 155.4; IR (neat) ν: 3041, 2967, 1328, 1115, 1048, 872, 676, 535 cm-1; GCMS (EI+) m/z: 284.1.
6-甲基-2-(十二烷基磺酰基)喹啉(3q): 浅黄色固体, m.p. 167~169 ℃(文献值[10] 166~168 ℃); 1H NMR (400 MHz, CDCl3) δ: 0.78 (t, J=4.0 Hz, 3H), 1.13 (s, 16H), 1.37~1.26 (m, 2H), 1.57~1.48 (m, 1H), 1.88~1.81 (m, 1H), 2.95~2.87 (m, 1H), 3.14~3.06 (m, 1H), 7.54 (t, J=8.0 Hz, 1H), 7.71 (t, J=8.0 Hz, 1H), 7.82 (d, J=8.0 Hz, 1H), 8.02 (t, J=8.0 Hz, 2H), 8.32 (d, J=8.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 13.1, 20.9, 21.6, 27.6, 28.1, 28.3, 28.4, 28.5, 30.8, 53.9, 114.7, 126.7, 127.0 127.1, 128.2, 129.7, 137.2, 146.4, 164.0; IR (neat) ν: 3037, 2963, 1048, 881, 623, 546 cm-1; GCMS (EI+) m/z: 375.2.
辅助材料(Supporting Information) 产物3a~3q的1H NMR和13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Grassberger, M. A.; Turnowsky, F.; Hildebrandt, J. J. Med. Chem. 1984, 27, 947. doi: 10.1021/jm00374a003
-
[2]
刘云云, 熊进, 韦丽, 有机化学, 2017, 37, 1667. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201707005&dbname=CJFD&dbcode=CJFQLiu, Y. -Y.; Xiong, J.; Wei, L. Chin. J. Org. Chem. 2017, 37, 1667(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201707005&dbname=CJFD&dbcode=CJFQ
-
[3]
Du, Y.; Liu, Y. -Y. J. Chem. Res. 2016, 40, 579. doi: 10.3184/174751916X14733526548948
-
[4]
Wan, J. -P.; Zhong, S. -S.; Guo, Y. -H.; Li, W. Eur. J. Org. Chem. 2017, 30, 4401.
-
[5]
Wan, J. -P.; Zhong, S. -S.; Xie, L. -L; Cao, X. -J.; Liu, Y. -Y.; Li, W. Org. Lett. 2016, 18, 584. doi: 10.1021/acs.orglett.5b03608
-
[6]
Zhong, S. -S.; Liu, Y. -Y.; Cao, X. -J.; Wan, J. -P. ChemCatChem 2017, 9, 465. doi: 10.1002/cctc.v9.3
-
[7]
Gao, Y.; Li, W.; Liu, Y. -Y.; Wan, J. -P. Org. Biomol. Chem. 2017, 15, 4631. doi: 10.1039/C7OB00619E
-
[8]
Kokatla, H. P.; Yoo, E.; Salnnke, D. B. Org. Biomol. Chem. 2013, 11, 1179. doi: 10.1039/c2ob26705e
-
[9]
Wu, Z. -Y.; Song, H. -Y.; Cui, X. -L.; Pi, C.; Du, W. -W.; Wu, Y. -J. Org. Lett. 2013, 15, 1270. doi: 10.1021/ol400178k
-
[10]
Su, Y.; Zhou, X.; He, C.; Zhang, W.; Ling, X.; Xiao, X. J. Org. Chem. 2016, 81, 4981. doi: 10.1021/acs.joc.6b00475
-
[11]
Du, B.; Qian, P.; Wang, Y.; Mei, H.; Han, J.; Pan, Y. Org. Lett. 2016, 18, 4144. doi: 10.1021/acs.orglett.6b02289
-
[12]
Brink, G. T.; Arends, I. E.; Sheldon, R. Science 2000, 287, 1636. doi: 10.1126/science.287.5458.1636
-
[13]
林伟, 郑永祥, 黄志斌, 史达清, 有机化学, 2017, 37, 508. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201702025&dbname=CJFD&dbcode=CJFQLin, W.; Zheng, Y. -X.; Huang, Z. -B.; Shi, D. -Q. Chin. J. Org. Chem. 2017, 37, 508(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201702025&dbname=CJFD&dbcode=CJFQ
-
[14]
周冠, 梁国超, 钟一凡, 韩晓燕, 陈国锋, 宋亚丽, 有机化学, 2016, 36, 143. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201601011&dbname=CJFD&dbcode=CJFQZhou, G.; Liang, G. -C.; Zhong, Y. -F.; Han, X. -Y.; Chen, G. -F.; Song, Y. -L. Chin. J. Org. Chem. 2016, 36, 143(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201601011&dbname=CJFD&dbcode=CJFQ
-
[15]
曾鸿耀, 尹述凡, 李颖, 有机化学, 2007, 27, 528. doi: 10.3321/j.issn:0253-2786.2007.04.014Zeng, H. -Y.; Yin, S. -F; Li, Y. Chin. J. Org. Chem. 2007, 27, 528(in Chinese). doi: 10.3321/j.issn:0253-2786.2007.04.014
-
[16]
Lian, Y.; Coffey, S. B.; Li, Q.; Londregan, A. T. Org. Lett. 2016, 18, 1362. doi: 10.1021/acs.orglett.6b00295
-
[17]
Londregan, A. T.; Jennings, S.; Wei L. -Q. Org. Lett. 2011, 13, 1840. doi: 10.1021/ol200352g
-
[18]
Londregan, A. T.; Jennings, S.; Wei L. -Q. Org. Lett. 2010, 12, 5254. doi: 10.1021/ol102301u
-
[19]
Du, B. N.; Qian, P.; Wang, Y.; Mei, H. -B.; Han, J. -L.; Pan, Y. Org. Lett. 2016, 18, 4144. doi: 10.1021/acs.orglett.6b02289
-
[20]
Li, G.; Jia, C. Q.; Sun, K. Org. Lett. 2013, 15, 5198. doi: 10.1021/ol402324v
-
[21]
Sun, K.; Chen, X. -L.; Li, X.; Qu, L. -B.; Bi, W. -Z.; Chen, X.; Ma, H. -L.; Zhang, S. -T.; Han, B. -W.; Zhao, Y. -F.; Li, C. -J. Chem. Commun. 2015, 51, 12111. doi: 10.1039/C5CC04484G
-
[22]
Maloney, K. M.; Kuethe, J. T.; Linn, K. Org. Lett. 2011, 13, 102. doi: 10.1021/ol102629c
-
[23]
Richter, H.; Beckendorf, S.; Mancheno, O. G. Adv. Synth. Catal. 2011, 353, 295. doi: 10.1002/adsc.201000941
-
[24]
Wu, Z. -Y.; Song H. -Y; Cui, X. -L; Pi, C.; Du, W. -W.; Wu, Y. -J. Org. Lett. 2013, 15, 1270. doi: 10.1021/ol400178k
-
[1]
-
表 1 反应条件优化a
Table 1. Optimization of reaction condition

Entry Catalyst Base (equiv.) Solvent Temp/℃ Yield/% 1b PyBroP i-Pr2EtN (4) CH2Cl2 25 57 2 PyBroP i-Pr2EtN (4) CH2Cl2 25 72 3 BroP i-Pr2EtN (4) CH2Cl2 25 51 4 PyBoP i-Pr2EtN (4) CH2Cl2 25 — 5 BoP i-Pr2EtN (4) CH2Cl2 25 — 6 HBTU i-Pr2EtN (4) CH2Cl2 25 — 7 PyBroP Et3N (4) CH2Cl2 25 78 8 PyBroP Ph3N (4) CH2Cl2 25 44 9 PyBroP DBU (4) CH2Cl2 25 12 10 PyBroP K2CO3 (4) CH2Cl2 25 47 11 PyBroP Et3N (3) CH2Cl2 25 74 12 PyBroP Et3N (2) CH2Cl2 25 75 13 PyBroP Et3N (1.5) CH2Cl2 25 61 14 PyBroP Et3N (2) DCE 25 49 15 PyBroP Et3N (2) DMF 25 6 16 PyBroP Et3N (2) THF 25 84c 17 PyBroP Et3N (2) THF 45 82 18 PyBroP Et3N (2) THF 65 77 a Reaction conditions: 1a (0.1 mmol), 2a (0.15 mmol), PyBroP (0.15 mmol), base, solvent (1 mL), ultrasonic irradiation. NMR yield with diethyl phthalate as the internal reference; b Without ultrasound; c Isolated yield 81%. 表 2 反应的底物范围a
Table 2. Scope of the reaction

Entry Product Yield/% Entry Product Yield/% Entry Product Yield/% 1 
81 2 
83 3 
74 4 
70 5 
75 6 
80 7 
69 8 
72 9 
73 10 
81 11 
75 12 
76 13 
73 14 
72 15 
49 16 
65 a Reaction conditions: 1 (0.3 mmol), 2 (0.45 mmol), PyBroP (0.45 mmol), Et3N (0.60 mmol), solvent (3 mL), ultrasonic irradiation, 1 h; isolated yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 1152
- HTML全文浏览量: 178


 下载:
下载:
 下载:
下载:

