
Citation: He Bo, Wang Dawei, Yang Wenchao, Chen Qiong, Yang Guangfu. Advances in Research on 4-Hydroxyphenylpyruvate Dioxygenase (HPPD) Structure and Pyrazole-Containing Herbicides[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2895-2904. doi: 10.6023/cjoc201705031

对羟基苯丙酮酸双加氧酶(HPPD)的结构及其吡唑类除草剂的最新研究进展
-
关键词:
- 对羟基苯丙酮酸双加氧酶
- / 作用机制
- / 结合位点
- / 除草剂
English
Advances in Research on 4-Hydroxyphenylpyruvate Dioxygenase (HPPD) Structure and Pyrazole-Containing Herbicides
-
Key words:
- 4-hydroxyphenylpyruvate dioxygenase
- / mode of action
- / binding site
- / herbicide
-
20世纪90年代, 对羟基苯丙酮酸双加氧酶(4-hy-droxyphenylpyruvate dioxygenase, HPPD)首次被确定为除草剂作用靶标.以HPPD为靶标的除草剂具有高效、低毒、作物安全性高、不易产生抗性、环境相容性好以及对后茬作物安全等一系列优点[1]. HPPD是生物体内酪氨酸代谢过程中重要的酶, 它几乎存在于所有需氧生物体内.生物体内酪氨酸(Tyrosine)在酪氨酸氨基转移酶(Tyrosine aminotransferase, TAT)的作用下生成对羟基苯丙酮酸(p-hydroxyphenylpyruvic acid, HPPA), 在氧气的参与下HPPD能够将HPPA催化转化成尿黑酸(HGA).在植物体内, 尿黑酸(HGA)能够被进一步转化成质体醌和生育酚[2].生育酚是植物体内重要的抗氧化物质, 能有效地增强植物的抗逆性.质体醌是植物进行光合作用过程中关键的辅助因子, 促进植物体内类胡萝卜素等的合成.在植物体中高于60%的叶绿素都结合于捕光天线复合物上, 该复合物吸收太阳光能并将激发能传递给光合作用反应中心, 而类胡萝卜素是反应中心的叶绿素结合蛋白和天线系统的重要组成部分, 在植物光合作用中担负着光吸收辅助色素的重要功能, 具有吸收和传递电子的能力, 并在清除自由基方面起着重要的作用.因此, 一旦HPPD的活性被抑制, 植物体内酪氨酸正常代谢将被阻断, 导致在植物体内类胡萝卜素的缺乏, 从而诱导叶绿素光氧化作用减弱, 影响植物的光合作用, 促使植物产生白化症状而死亡[3~7].
结合最新的研究进展, 本文对目前已经报道的不同种属来源的HPPD的晶体结构、抑制剂小分子与靶标酶的结合模式及其在植物体内的代谢产物进行系统的总结, 同时对不同商品化吡唑类HPPD除草剂的优缺点进行对比分析, 并对这类除草剂的发展方向进行了介绍.
1 HPPD的结构、活性位点及其可能催化机理
1.1 HPPD的结构及活性位点
HPPD抑制剂作为除草剂的使用历史可以追溯到20世纪80年代初, 1980年日本三共制药有限公司首次将吡唑特投入到世界除草剂市场.当时并不知道吡唑特的作用靶标就是HPPD. HPPD真正被确定为除草剂作用的靶标是从20世纪90年代开始.随后, 人们不断地从老鼠[8]、猪[9]、兔[10]以及人的肝脏[11]、玉米[12]、胡萝卜[13]、拟南芥[14]、荧光假单胞菌[15]和链霉素[16]等体内提取或克隆HPPD.目前, 文献上已经报道的主要有14个HPPD或其复合物的晶体结构, 其中有12个晶体结构已经被蛋白质数据库(PDB)收录, 详细信息见表 1.拟南芥是植物界里面一个具有代表性的模式生物, 因此关于HPPD的晶体结构报道的最多的是拟南芥源HPPD (AtHPPD).其中大部分晶体结构是以二聚体的形式存在的.
种属 研究人员 公布时间 分辨率/Å 堆积体 PDB编号 RMSD(与5EC3相比)/Å 荧光假单胞菌 Serre, L. 1999 2.40 四聚体 1CJX 1.242 大鼠 Walsh, T. A.[14] 2004 2.15 二聚体 1SQI 0.425 拟南芥 Walsh, T. A.[14] 2004 1.90 单体 1TG5 0.945 拟南芥 Walsh, T. A.[14] 2004 1.80 单体 1TFZ 0.948 拟南芥 Walsh, T. A.[14] 2004 1.80 单体 1SQD 0.935 玉米 Fritze, I. M.[17] 2004 2.0 二聚体 1SP8 0.984 拟南芥 Fritze, I. M.[17] 2004 3.0 二聚体 1SP9 0.991 链霉菌 Moran, G. R.[18] 2004 2.50 二聚体 1T47 0.903 人 Pilka, E. S. 2009 1.75 单体 3ISQ 0.151 拟南芥 Yang, W. C. 2015 2.62 四聚体 5CTO 1.021 拟南芥 Yang, W. C. 2016 2.62 二聚体 5DHW 0.978 人 Yang, W. C. 2015 2.1 单体 5EC3 0 对比分析拟南芥源和人源的HPPD晶体结构[24](图 1)可以看出, 来自拟南芥源HPPD (AtHPPD)和人源HPPD (hHPPD)晶体结构具有高度的相似性, 每个单体都是由具有相似的拓扑结构域组成, 都存在着一种α/β折叠方式, 该折叠是由一个平行的和反平行的β链围绕着一个α螺旋所组成的结构.其活性位点位于一个扭曲打开的β折叠区, 由7个β折叠构成.在活性空腔内, 具有催化活性的Fe2+以六配位的形态存在, 与相邻的高度保守的氨基酸残基(一个谷氨酸和两个组氨酸)及一分子游离的水形成配位作用, 并和底物HPPA分子中的两个氧原子形成双齿螯合型配位键, 进而形成一个稳定的八面体结构, 发挥其生物催化功能.随后人们对于不同种属来源的HPPD的差异性也进行了深入研究.
2004年Walsh[14]及2013年Richard和Jane等[19]分别对不同种属来源的HPPD进行结构比对分析(表 2).通过对比分析, 植物与哺乳动物的HPPD氨基酸序列的同源性存在显著的差异性, 而同为植物界或者动物界的同源性比较高.哺乳纲的人和老鼠的氨基酸序列的同源性高达90%.同时, 在HPPD的活性空腔内, 对其52个具有生物活性的氨基酸残基位点进行对比分析, AtHPPD与哺乳纲的人、小鼠及猪的活性位点差异个数为13~14个, 而同为哺乳纲的人、小鼠及猪的活性位点的氨基酸残基差异个数只有1~2个.因此, 为后续开发具有高选择性、安全性的HPPD类除草剂提供了理论指导基础.
Arabidopisis Maize Rat Mouse Pig Human Arabidopisis 60% 32% 31% 30% 32% Maize 6 31% 30% 29% 31% Rat 13 13 96% 77% 90% Mouse 14 13 0 77% 90% Pig 14 14 1 1 Human 14 13 1 1 2 a百分数表示两个种属间HPPD氨基酸序列相似比, 其余数字表示两个种属间HPPD活性位点差异的个数. 结合计算化学方法[20], 分别选取AtHPPD (PDB编号: 1SQD), RnHPPD (PDB编号: 1SQI)以及hHPPD (PDB编号: 3ISQ)的晶体结构, 以HPPD催化中心Fe2+周围12 Å范围内的氨基酸作为活性位点的考虑范围进行序列比对(图 2).结果表明hHPPD与RnHPPD的活性腔序列相似性高达97%, AtHPPD与hHPPD和RnHPPD相比, 活性腔序列相似性都为66%, 图中虚线框中的氨基酸为催化中心Fe2+周围12 Å范围内的氨基酸残基, 灰色代表在三类种属HPPD活性腔中有差异的氨基酸残基位点, 共17个, 但是其中只有两个位点的氨基酸残基Met314和Lys400(以拟南芥1SQD为标准)是在结合位点附近, 通过序列比对其在RnHPPD (PDB ID: 1SQI)中的等位残基分别为Leu289和Ala361, 在hHPPD (PDB ID: 3ISQ)中的等位残基分别为不同种属来源的HPPD其活性位点氨基酸残基具有一定Leu289和Ala361.从氨基酸序列比对的结果分析, 的差异性.其可能会影响抑制剂与HPPD结合的稳定性, 导致抑制剂分子在不同种属来源的HPPD抑制活性的不同, 为后续设计选择性好、安全性高的抑制剂提供理论基础.
1.2 HPPD的可能催化机理
文献上已经报道了多种植物体内HPPD催化HPPA生成HGA的这一生物反应机制[21~23], 而普遍接受的是如Scheme 1所示的催化反应机理[24~27].
该机理包括羰基的脱除反应、芳香环的羟基化和取代基的迁移反应.在催化反应进行的时候, HPPA首先与HPPD的催化活性中心Fe2+进行配位形成一个六配位过渡态(step 1), 紧接着一分子氧插入到该过渡态中, 二价铁随后被氧化成了四价铁形成了过渡态(step 3).经过O—O键的断裂以及二氧化碳的脱除反应得到过渡态(step 4), step 4结构中的苯环是一个富电子的官能团, 它进攻高价铁中的氧原子形成step 5.四价铁随后被还原成二价铁, 再经过烷基的迁移反应、烯醇互变反应得到过渡态(step 7), step 7脱除尿黑酸完成了整个催化反应循环.在完成一个催化反应循环后, HPPD又继续进行下一个催化反应过程, 所得到的尿黑酸进入后续的生理转换过程中.
2 吡唑类HPPD除草剂的作用模式及研究历程
2.1 吡唑类HPPD除草剂的作用模式
HPPD广泛存在于自然界的各种需氧生物体中.从催化中心的结构上来讲, HPPD属于2-组氨酸-1-羧酸盐面三联体结构氧化酶大家族中的一员, 从在细胞中的位置上来讲, HPPD又属于细胞质酶.近年来人们也培养出了一些商品化的抑制剂与AtHPPD复合物的晶体结构. 2008年拜耳公司报道了磺酰草吡唑与AtHPPD复合物单晶[28].从所得到的AtHPPD-磺酰草吡唑复合晶体结构分析, 磺酰草吡唑与AtHPPD的结合力主要受两个方面的因素控制:一方面是磺酰草吡唑分子中的氧与二价铁之间的螯合作用力, 另一方面是磺酰草吡唑分子中的疏水基团与催化口袋之间的疏水作用力.
HPPD催化活性中心位于一个开口扭曲的螺旋状的β结构中, 该结构是由7个β折叠组成.晶体的每一个单体中都含有一个二价铁离子, 二价铁是以六配位的形式存在的, 其中2个组氨酸、一个谷氨酸以及一个水分子各占据一个配位键, 抑制剂分子中苯甲酰乙烯片段的2个氧原子各自与Fe2+形成一个配位键(图 3).磺酰草吡唑分子中N上的甲基朝向一个疏水性的小口袋之中, 这个口袋很小说明在吡唑环上不能引入体积过大的基团.磺酰草吡唑分子中的苯环结构能够与周围的2个苯丙氨酸形成三明治型的π-π堆积作用.由于苯环上间位的三氟甲基结构与周围疏水性氨基酸残基的距离小于4 Å, 它们之间会存在一个疏水相互作用力.在实验的过程中人们也发现AtHPPD中C-端螺旋结构会呈现出开关构象, 当处于开放的构象时则有利于底物进入到催化位点以及产物的释放; 而处于闭合的构象时则有利于保护催化反应免受溶剂的影响.
2.2 商品化的吡唑类HPPD除草剂
HPPD是继乙酰辅酶A羧化酶(ACCase)、乙酰乳酸合成酶(ALS)后的又一重要的除草剂作用靶标.由于其独特的作用机制可以有效防治多种抗性杂草.商品化的HPPD除草剂主要分为三酮类、吡唑类、异噁唑类(二酮腈).三酮类和异噁唑类已有相关的文献报道. 2016年新上市的HPPD除草剂环吡氟草酮和双唑草酮都属于吡唑类, 因此主要对吡唑类HPPD除草剂的研究现状进行总结.
20个世纪70年代, 日本三共制药公司报道了苄草唑(Pyrazolynate), 商品名为“Sanbird”.主要用于水稻田, 在3~4 kg ai/ha的剂量下对一年生或多年生的杂草具有较好的防效.苄草唑作为一种前药, 在水中分解释放出具有生物活性分子.通过植物的吸收传导, 到达作用靶点进而发挥药效.苄草唑在水中的半衰期与温度和pH相关, 尤其是在偏碱性的水中半衰期只有4.3 h (T=25 ℃), 在土壤中的降解时间DT50=8~10 d, 因此严重制约了苄草唑的药效.苄草唑的合成路线如Scheme 2所示, 2, 4-二氯苯甲酰酰氯Ⅱ-1b和吡唑醇Ⅱ-1a在Ca(OH)2作碱及异丙醇作溶剂的条件下得到化合物Ⅱ-1c. Ⅱ-1c再与对甲苯磺酰氯反应即能制备苄草唑.该合成路线便捷, 合成成本低廉, 在初期也有非常好的市场价值.
1984年, Kimura[29]首次报道了苄草酚(Pyrazoxyfen). 1985年, 日本石原产业株式会社正式将苄草酚推向市场, 商品名为“Paicer”.同样适用于水稻田, 在推荐剂量3 kg ai/ha下, 对灌溉田的阔叶杂草具有较宽的杀草谱.然而, 苄草酚对水稻的安全性受温度的影响.当气温低于35 ℃时, 对于移栽稻田和直播稻田的水稻不会产生毒副作用; 当气温高于35 ℃时, 则会对水稻产生短暂性药物毒性, 因此其在推广过程中受到了严重的限制.其合成路线与苄草唑类似(Scheme 2).
1987年, 日本三菱石油化工和RhÔne-Poulenc Agro (Bayer Crop Science)首次将吡草酮(Benzofenap)应用于商品化, 其商品名为“Yakawide”.由于结构的差异性, 相对于苄草酚, 吡草酮延长了其在土壤中的半衰期, 在同等剂量下吡草酮的药效时间可以增加至50 d, 而苄草酚的药效时间约为21~35 d; 同时吡草酮具有更好的作物选择性并且能够有效地避免高温致使其对水稻产生的短暂的药害现象.具体的合成路线如Scheme 2.
苯吡唑草酮(Topramezone)是由德国巴斯夫公司开发的玉米田除草剂. 2006年, 在北美洲和欧洲同时上市, 其商品名分别为“Impact”和“Clio”.在推荐使用剂量50~75 g ai/ha的条件下, 它能够有效的防治一年生玉米田中多种阔叶杂草和禾本科杂草, 相对于硝磺草酮、磺草酮, 其对狗尾草、马齿苋、马唐等杂草的防效几乎可以达到百分之百.同时, 与其他类的除草剂如二甲酚草胺、烟嘧磺隆制成混剂, 可有效拓宽杀草谱; 与三嗪类除草剂或麦草畏制成混剂几乎可以防治所有种属的阔叶杂草.目前, 苯吡唑草酮是玉米田最为安全、高效的HPPD类除草剂; 其几乎对所有品种的玉米都表现出高度安全性.工业可能的合成路线如Scheme 3, 以2, 3-二甲基硝基苯(Ⅱ-2a)为起始原料, 经过与亚硝酸丁酯反应得到安息香醛肟Ⅱ-2b, Ⅱ-2b经过氯化再与乙烯反应得到含异噁唑结构的中间体Ⅱ-2d.再经过后续的硝基还原反应、氨基甲硫基化、溴化、氧化以及偶联反应即能制备苯吡唑草酮[30].
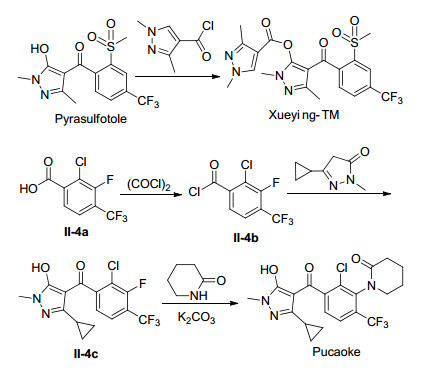
2000年, Aventis CropScience (Bayer CropScience)首次报道了磺酰草吡唑(Pyrasulfotole)[31]. 2008年, 拜耳公司在北美洲和澳大利亚同时将其推向市场, 其商品名分别是“Huskie”和“Velocity”.其作为苗后除草剂, 在25~50 g ai/ha的剂量下, 能够有效地防治常见的阔叶杂草, 如繁缕(Stellaria media)、藜属(Chenopodium album)、茄属植物(Solanum spp.)、苋属(Amaranthus spp.)和苘麻属(Abutilon theophrasti), 但对于部分的一年生禾本科杂草(狗尾草, Setaria viridis (L.) Beauv.)的防治效果并不理想.截止目前, 其还未见有交互抗性的例子报道.磺酰草吡唑是首个用于谷物田的HPPD类除草剂, 与安全剂(吡唑解草酯)制成混剂能够显著地提高作物抗药性, 使其几乎对所有品种的小麦、大麦和黑小麦表现出优异的作物安全性.磺酰草吡唑的工业化生产路线见Scheme 4, 以2-氯-4-三氟甲基苯甲酸钠盐(Ⅱ-3a)为起始原料, 经过硫甲基化、氧化、酰氯化、酯化、重排反应即可合成磺酰草吡唑.
2016年, 青岛清原抗性杂草防治有限公司发布了2个专利化合物——环吡氟草酮[32](Pucaoke, 商品名“普草克®”)和双唑草酮[33](Xueying-TM, 商品名“雪鹰TM”) (Scheme 5), 是国内首次将HPPD抑制剂类的新化合物引入到小麦田抗性禾本科和阔叶杂草的防治上, 很好地解决了乙酰乳酸合成酶(ALS)和乙酰辅酶A羧化酶(ACCase)抑制剂的抗性和多抗性问题, 尤其是环吡氟草酮是全球首次将HPPD抑制剂类化合物引入到小麦田抗性禾本科杂草的防治上.环吡氟草酮属于新型HPPD类除草剂, 可有效地防治大麦田一年生的多种单子叶和阔叶杂草, 与麦田常用的精噁唑禾草灵、炔草酯、唑啉草酯、三甲苯草酮、啶磺草胺、甲基二磺隆、氟唑磺隆、异丙隆等不存在交互抗性, 可以有效解决当年抗性及多抗性的看麦娘等禾本科杂草及部分阔叶杂草.双唑草酮对高粱田的阔叶杂草具有突出的防效, 且与当前麦田常用的双氟磺草胺、苯磺隆、苄嘧磺隆、噻吩磺隆等乙酰乳酸合成酶(acetolactate synthase, ALS)抑制剂类除草剂, 唑草酮、乙羧氟草醚等多酚氧化酶(Polyphenol oxidase, PPO)抑制剂类除草剂以及二甲四氯钠、2, 4-D等激素类除草剂不存在交互抗性, 可以有效解决抗性以及多抗性的播娘蒿、荠菜、野油菜、繁缕、牛繁缕、麦家公等阔叶杂草.
2.3 商品化吡唑类HPPD抑制剂的代谢机制
药物代谢是研究药物在生物体内的吸收、分布、生物转化和排泄等过程的特点和规律, 是药物研发产业链中的重要环节, 贯穿药物研究过程的始终.因此, 研究药物在生物体内的代谢过程和代谢产物, 对于开发新药具有重要的指导意义.目前, 已经商品化的吡唑类HPPD除草剂有7个, 从已有报道的文献来看, 对已经商品化的吡唑类除草剂, 主要研究在自然环境中的分解代谢, 而在生物体内的代谢机制和最终的代谢产物尚无明确的结论.
HPPD类除草剂从结构上来划分主要是吡唑类和三酮类.虽然吡唑环和1, 3-环已二酮互为生物电子等排体, 但是, 由于结构的差异性导致其在自然环境或生物体内的稳定性差异较大, 同时也影响植物的吸收传导.在实际应用研究中发现, 早期商品化的HPPD类除草剂苄草酯、苄草酚和吡草酮都是以前药的形式存在.其主要目的是优化原药的理化性质, 延长药物的半衰期, 提高药物利用度, 从而增强药物的活性, 降低毒副作用, 改善药物的作物安全性.
苄草唑、苄草酚和吡草酮都是用于防治水稻田中的杂草.由于其自身有一定的局限性, 例如半衰期短, 高温下对水稻具有一定的毒副作用等.早期的三类除草剂都是以前药的形式存在, 在土壤、水中缓慢水解并释放出具有生物活性的小分子Ⅱ-5a, Ⅱ-5b (Scheme 6)[34], 进而通过植物的根部吸收进入植物体内到达作用位点.由于不同种属间的差异性, 生物体内的环境不同, 其在生物体内的代谢产物也不完全相同.大部分水解生成苯甲酸类似物Ⅱ-5g, Ⅱ-5h, 苯甲酸类似物进而通过好氧降解和厌氧降解两种途径形成更为简单的代谢产物.用于玉米田中的除草剂苯吡唑草酮(Topramezone)在土壤中会被逐渐的分解代谢为羧酸衍生物Ⅱ-5c和吡唑类衍生物Ⅱ-5d和Ⅱ-5e而丧失药效[35].
2.4 经典型的吡唑类HPPD除草剂
近年来, 在商品化的除草剂基础上, 具有更高生物活性、更好作物选择性和更低使用剂量的新型HPPD抑制剂小分子不断被报道.以磺酰草吡唑为例, 都保留了分子中的苯甲酰烯醇结构, 分别对其吡唑环和芳环部分进行改造.对于吡唑环的优化主要包括两部分, 其一是对吡唑环上取代基的优化.从已经报道的HPPD晶体结构分析(图 1), 抑制剂分子中的烯醇结构与在催化活性空腔中的Fe2+形成双齿螯合作用, 吡唑环处于一个较小的疏水腔, 因此在吡唑环上引入过大或过多的取代基不利于提高其生物活性.其次是对吡唑环上羟基进行保护形成前药.前药在一定的程度上可以改善药物小分子在生物体内的吸收传导代谢, 从而提高抑制剂小分子对作物的选择性和安全性.如商品化的HPPD类除草剂苄草唑、苄草酚和吡草酮. 1999年日本石原产业株式会社报道的化合物Ⅲ-1a, Ⅲ-1b(图 4), 在63 g/ha的剂量下化合物Ⅲ-1b的除草活性明显优于化合物Ⅲ-1a, 因此对于吡唑环的修饰改造多集中于对羟基的保护.
报道最多的是对磺酰草吡唑芳环部分衍生物的合成.对取代芳环的研究, 2004年, 日本专利报道了一系列取代的二苯醚或二苯硫醚化合物, 在100 g/ha剂量下对部分杂草仍可达90%以上. 2006年德国巴斯夫股份公司(BASF)报道的苞卫(Topramezone, Ⅲ-2a)是目前应用于玉米田最为安全、高效的HPPD类除草剂, 具有较宽的杀草谱.尤其是对于一年生的禾本科杂草(狗尾草)和阔叶杂草(马齿苋), 具有非常好的防效.对于取代芳杂环的研究也是近年来的一个热点, 不断有新型的结构被报道出来. 2005年, 日本日产化学公司报道一类含有五元吡唑环结构的吡唑类化合物Ⅲ-3a, 所得到的大部分化合物均表现出了优良的除草效果. 2012年日本株式会社报道的吡啶酮类化合物Ⅲ-4a在1000 g/ha的剂量下对于部分杂草的防效达到100%.在2013年, KUMIAI公司又报道了含有嘧啶二酮结构[36]的化合物Ⅲ-4b, 所合成化合物同样也表现出了优良的除草活性. 2014年报道了含有三嗪酮结构化合物Ⅲ-4c, 该类化合物同样也表现出了广谱高效的除草效果.
苯并杂环的研究多集中在苯并五元环和苯并六元环的结构. 2001年, 德国巴斯夫股份公司的专利中包含一系列喹啉化合物Ⅲ-5b, 吡唑羰基部分在苯环的2, 3, 4, 5-位变换, 得到一系列类似物, 该系列衍生物在63~125 g/ha剂量下对杂草具有很好的抑制活性. 2014年我们课题组[37~39]报道的喹唑啉酮类的化合物Ⅲ-5a具有较好的作物选择性, 随后2015年他们[40]报道苯并咪唑类化合物Ⅲ-5c, 在处理剂量150 g/ha条件下, 部分化合物对苘麻、反枝苋、鳢肠、马唐、稗草的抑制活性达80%以上.在75 g/ha的剂量下, 对玉米、水稻和小麦表现出优良的作物安全性.
2.5 非经典型的吡唑类HPPD除草剂
近年来, 突破经典型HPPD抑制剂的分子结构模式, 在保留与Fe2+形成螯合作用的苯甲酰烯醇结构的基础上, 以生物电子等排原理为基础, 基于计算机辅助的药物碎片离子虚拟筛选的途径, 并结合活性亚结构拼接的方法, 对其吡唑环进行整体修饰改造. 2015年, 徐效华课题组[41]报道了一系列新型抑制剂小分子(图 5), 化合物Ⅳ-d在187.5 g/ha下, 对稗草具有一定的防效. 2009年, Matthias[42]根据电子等排原理设计合成了一类新型的铁螯合HPPD抑制剂, 如图 5所示的化合物Ⅳ-e, 在温室盆栽条件下却几乎没有除草活性.有趣的是这类化合物在酶水平上表现出了很好的抑制活性, 抑制常数IC50达到了36 nmol•L-1, 比对照药剂苞卫高出了近5倍.
2015年, 李正名教授课题组[43, 44]报道含吡唑环类衍生物Ⅳ-f, 部分化合物在1500 g/ha的剂量下对芸苔属植物(Brassica campestris)和反枝苋类植物(Amaranthus retroflexus)分别达到40.0%和22.1%的抑制效果.同时在苗前用药, 能够抑制对苋类植物的茎叶生长, 为后续开发新型HPPD类抑制剂具有重要的指导意义.
3 总结与展望
随着现代农药的大量不合理使用, 杂草的抗性问题越来越严重.为了克服这一现状, 寻找新的作用靶标和在现有的作用机制基础上开发更为高效的抑制剂小分子或具有反抗性的抑制剂小分子, 是现在农药发展的两个重要方向.以HPPD为靶标的除草剂具有高效、低毒, 作物安全性高及环境相容性好等优势.作为竞争性作用靶标, HPPD催化中心的Fe2+位于蛋白的C-末端区域处在一个较大的溶剂空腔结构中, 与相邻的两个组氨酸和一个谷氨酸形成配位键, 抑制剂分子中的苯甲酰烯醇部分的2个氧原子能够与HPPD催化中心的Fe2+行成双齿螯合的配位作用, 形成类似一个扭曲的三角双锥体结构.其次抑制剂分子中的苯甲酰烯醇片段的芳环与相邻的两个苯丙氨酸形成三明治型的π-π堆积作用, 这一点基本上是所有HPPD抑制剂所共有的特性.从靶标的三维结构、不同种属HPPD的差异性以及HPPD与抑制剂的相互作用机制等角度分析, HPPD活性位点的氨基酸残基具有高度保守型特点, 这将为后续HPPD类抑制剂分子的设计提供了理论基础, HPPD也将是未来除草剂开发的重要作用靶标.
-
-
[1]
Yang, G. F. Curr. Pharm. Des. 2014, 2, 0685. http://www.ncbi.nlm.nih.gov/pubmed/23688080
-
[2]
Hrens, H.; Lange, G.; Müller, T.; Rosinger, C.; Willms, L.; van Almsick, A. Angew. Chem., Int. Ed. 2013, 52, 9388. doi: 10.1002/anie.v52.36
-
[3]
Beaudegnies, R.; Edmunds, A. J. F.; Fraser, T. E. M.; Hall, R. G.; Hawkes, T. R.; Mitchell, G.; Schaetzer, J.; Wendeborn, S.; Wibley, J. Bioorg. Med. Chem. 2009, 17, 4134. doi: 10.1016/j.bmc.2009.03.015
-
[4]
周蕴赞, 李正名, 世界农药, 2013, 35, 1. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Zhou, Y. Y.; Li, Z. M. World Pestic. 2013, 35, 1(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[5]
尹振东, 张苈, 陈洪, 涂红, 王圆圆, 欧阳贵平, 辽宁化工, 2016, 45, 739.Yin, Z. D. ; Zhang, L. ; Chen, H. ; Wang, Y. Y. ; Ouyang, G. P. Liaoning Chem. Ind. 2016, 45, 739 (in Chinese).
-
[6]
邓红霞, 钱跃言, 陈亚萍, 浙江化工, 2012, 43, 1. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Deng, H. X.; Qian, Y. Y.; Chen, Y. P. Zhejiang Chem. Ind. 2012, 43, 1(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[7]
杨文超, 林红艳, 杨盛刚, 刘万年, 杨光富, 农药学学报, 2013, 15, 139. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Yang, W. C.; Lin, H. Y.; Yang, S. G.; Liu, W. N.; Yang, G. F. Chin. J. Pestic. Sci. 2013, 15, 139(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[8]
Lee, M. H.; Zhang, Z. H.; MacKinnon, C. H.; Baldwin, J. E.; Crouch, N. P. FEBS Lett. 1996, 393, 269. doi: 10.1016/0014-5793(96)00902-7
-
[9]
Ling, T.; Shiu, S.; Yang, D. Bioorg. Med. Chem. 1999, 7, 1459. doi: 10.1016/S0968-0896(99)00062-0
-
[10]
Ellis, M. K.; Whitfield, A. C.; Gowans, L. A.; Auton, T. R.; Provan, W. M.; Lock, E. A.; Lee, D. L.; Smith, L. L. Chem. Res. Toxicol. 1996, 9, 24. doi: 10.1021/tx950100w
-
[11]
Endo, F.; Awata, H.; Tanoue, A.; Ishiguro, M.; Eda, Y.; Ttani, K.; Matsuda, I. J. Biol. Chem. 1992, 267, 24235.
-
[12]
Barta, I. C.; Böger, P. Pest. Sci. 1996, 48, 109. doi: 10.1002/(SICI)1096-9063(199610)48:2<>1.0.CO;2-N
-
[13]
Garcia, I.; Rodgers, M.; Lenne, C.; Rolland, A.; Sailland, A.; Matringe, M. Biochem. J. 1997, 325, 761. doi: 10.1042/bj3250761
-
[14]
Yang, C.; Pflugrath, J. W.; Camper, D. L.; Foster, M. L.; Pernich, D. J.; Walsh, T. A. Biochemistry 2004, 43, 10414. doi: 10.1021/bi049323o
-
[15]
Ruetschi, U.; Odelhog, B.; Lindstedt, S.; Barros-soderling, J.; Persson, B.; Jornvall, H. Eur. J. Biochem. 1992, 205, 463. doi: 10.1111/ejb.1992.205.issue-2
-
[16]
Johnson-Winters, K.; Purpero, V. M.; Kavana, M.; Moran, G. R. Biochemistry 2005, 44, 7189. doi: 10.1021/bi047625k
-
[17]
Fritze, I. M.; Linden, L.; Freigang, J.; Auerbach, G.; Huber, R.; Steinbacher, S. Plant Physiol. 2004, 134, 1388. doi: 10.1104/pp.103.034082
-
[18]
Brownlee, J. M.; Johnson-Winters, K.; Harrison, D. H. T.; Moran, G. R. Biochemistry 2004, 43, 6370. doi: 10.1021/bi049317s
-
[19]
Richaed, W. L.; Jane, W. B. Crit. Rev. Toxicol. 2013, 43, 185. doi: 10.3109/10408444.2013.764279
-
[20]
林军, 李祖光, 邹建卫, 陆绍永, 化学学报, 2012, 70, 1309. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Lin, J.; Li, Z. G.; Zou, J. W.; Lu, S. Y. Acta Chim. Sinica 2012, 70, 1309(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[21]
Wójcik, A.; Broclawik, E.; Siegbahn, P. E. M.; Borowski, T. Biochemistry 2012, 51, 9570. doi: 10.1021/bi3010957
-
[22]
Neidig, M. L.; Decker, A.; Choroba, O. W.; Huang, F.; Kavana, M.; Moran, G. R.; Spencer, J. B.; Solomon, E. I. Proc. Natl. Acad. Sci.U. S. A. 2006, 103, 12966. doi: 10.1073/pnas.0605067103
-
[23]
Raspail, C.; Graindorge, M.; Moreau, Y.; Crouzy, S.; Lefebvre, B.; Robin, A. Y.; Dumas, R.; Matringe, M. J. Biol. Chem. 2011, 286, 26061. doi: 10.1074/jbc.M111.227595
-
[24]
Riggins, C. W.; Peng, Y.; Stewart, C. N.; Tranel, P. J. Pest Manag. Sci. 2010, 66, 1042. doi: 10.1002/ps.2006
-
[25]
Wójcik, A.; Broclawik, E.; Siegbahn, P. E. M.; Lundberg, M.; Moran, G.; Borowski, T. J. Am. Chem. Soc. 2014, 136, 14472. doi: 10.1021/ja506378u
-
[26]
Lin, J. F.; Sheih, Y. L.; Chang, T. C.; Chang, N. Y.; Chang, C. W.; Shen, C. P.; Lee, H. J. PLoS One 2013, 8, e69733. doi: 10.1371/journal.pone.0069733
-
[27]
Diebold, A. R.; Brown-Marshall, C. D.; Neidig, M. L.; Brownlee, J. M.; Moran, G. R.; Solomon, E. I. J. Am. Chem. Soc. 2011, 133, 18148. doi: 10.1021/ja202549q
-
[28]
王大伟, 博士论文, 华中师范大学, 武汉, 2015.Wang, D. W. Ph.D. Dissertation, Central China Normal University, Wuhan, 2015 (in Chinese).
-
[29]
Kimura, F. Jpn. Pestic. Inform. 1984, 45, 24.
-
[30]
Rene, L.; Michael, K.; Joachim, G.; Michael, R.; Von, D. W. US 20030149276, 2003 [Chem. Abstr. 2003, 136, 118263].
-
[31]
Schmitt, M.; van Almsick, A.; Preuss, R.; Willms, L.; Auler, T.; Bieringer, H.l; Thuerwaechter, F. WO 2001/074785, 2001 [Chem. Abstr. 2001, 135, 288780].
-
[32]
Lian, L.; Zheng, Y. R.; He, B.; Peng, X. G.; Jin, T.; Cui, Q. CN 105218449, 2016 [Chem. Abstr. 2016, 164, 175130].
-
[33]
Peng, X. G.; Jin, T.; Zhang, J. Y.; Zhao, D.; Cui, Q. CN 1568549, 2016 [Chem. Abstr. 2016, 165, 162543].
-
[34]
Yamaoka, K.; Nakagawa, M.; Ishida, M. J. Pestic. Sci. 1987, 12, 209. doi: 10.1584/jpestics.12.209
-
[35]
Wolf, J. K.; Termes, S. C. Fed. Regist. 2013, 78, 48068. http://www.ncbi.nlm.nih.gov/pubmed/24294636
-
[36]
Mikio, Y.; Yasumi, K.; Takashi, M.; Atsushi, N. JP 2013040141, 2013 [Chem. Abstr. 2013, 158, 381770].
-
[37]
Wang, D. W.; Lin, H. Y.; Cao, R. J.; Chen T.; Yang, S. G.; Chen, Q.; Yang, W. C.; Yang, G. F. J. Agric. Food Chem. 2015, 63, 5587. doi: 10.1021/acs.jafc.5b01530
-
[38]
王大伟, 林红艳, 曹润洁, 杨盛刚, 陈涛, 何波, 陈琼, 杨文超, 杨光富, 化学学报, 2015, 73, 29. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Wang, D. W.; Lin, H. Y.; Cao, R. J.; Yang, S. G.; Chen, T.; He, B.; Chen, Q.; Yang, W. C.; Yang, G. F. Acta Chim. Sinica 2015, 73, 29(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[39]
Xu, Y. L.; Lin, H. Y.; Cao, R. J.; Ming, Z. Z.; Yang, W. C.; Yang, G. F. Bioorg. Med. Chem. 2014, 22, 5194. doi: 10.1016/j.bmc.2014.08.011
-
[40]
Xu, Y. L.; Lin, H. Y.; Ruan, X.; Yang, S. G.; Hao, G. F.; Yang, W. C.; Yang, G. F. Eur. J. Med. Chem. 2015, 92, 427. doi: 10.1016/j.ejmech.2015.01.018
-
[41]
Lei, K.; Hua, X. W.; Tao, Y. Y.; Liu, Y.; Liu, N.; Ma, Y.; Li, Y. H.; Xu, X. H.; Kong, C. H. Bioorg. Med. Chem. 2016, 24, 92. doi: 10.1016/j.bmc.2015.11.032
-
[42]
Matthias, W. Bioorg. Med. Chem. 2009, 17, 4221. doi: 10.1016/j.bmc.2008.11.006
-
[43]
Wang, B. L.; Li, Q. N.; Zhan, Y. Z.; Xiong, L. X.; Yu, S. J.; Li, Z. M. Phosphorus Sulfur, Silicon Relat. Elem. 2014, 189, 483. doi: 10.1080/10426507.2013.829832
-
[44]
Wang, B. L.; Wu, J.; Liu, Q. X.; Li, Y. H.; Song, H. B.; Li, Z. M. Phosphorus Sulfur, Silicon Relat. Elem. 2015, 190, 66. doi: 10.1080/10426507.2014.919503
-
[1]
-
表 1 已经公布的HPPD的晶体结构信息
Table 1. Announced HPPD crystal structure information
种属 研究人员 公布时间 分辨率/Å 堆积体 PDB编号 RMSD(与5EC3相比)/Å 荧光假单胞菌 Serre, L. 1999 2.40 四聚体 1CJX 1.242 大鼠 Walsh, T. A.[14] 2004 2.15 二聚体 1SQI 0.425 拟南芥 Walsh, T. A.[14] 2004 1.90 单体 1TG5 0.945 拟南芥 Walsh, T. A.[14] 2004 1.80 单体 1TFZ 0.948 拟南芥 Walsh, T. A.[14] 2004 1.80 单体 1SQD 0.935 玉米 Fritze, I. M.[17] 2004 2.0 二聚体 1SP8 0.984 拟南芥 Fritze, I. M.[17] 2004 3.0 二聚体 1SP9 0.991 链霉菌 Moran, G. R.[18] 2004 2.50 二聚体 1T47 0.903 人 Pilka, E. S. 2009 1.75 单体 3ISQ 0.151 拟南芥 Yang, W. C. 2015 2.62 四聚体 5CTO 1.021 拟南芥 Yang, W. C. 2016 2.62 二聚体 5DHW 0.978 人 Yang, W. C. 2015 2.1 单体 5EC3 0 表 2 不同种属来源的HPPD氨基酸序列比对a
Table 2. Different species of HPPD amino acid sequence alignment
Arabidopisis Maize Rat Mouse Pig Human Arabidopisis 60% 32% 31% 30% 32% Maize 6 31% 30% 29% 31% Rat 13 13 96% 77% 90% Mouse 14 13 0 77% 90% Pig 14 14 1 1 Human 14 13 1 1 2 a百分数表示两个种属间HPPD氨基酸序列相似比, 其余数字表示两个种属间HPPD活性位点差异的个数. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 100
- 文章访问数: 8235
- HTML全文浏览量: 1495












 下载:
下载:










 下载:
下载:

