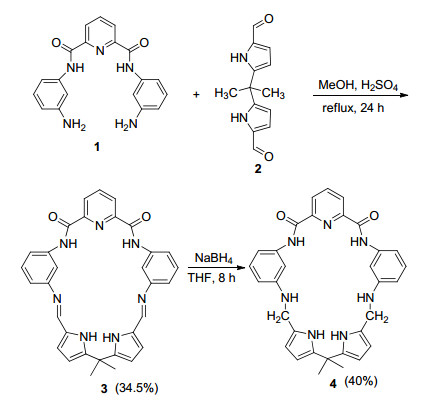
 图式 1
Schiff碱大环3及其还原产物4的合成路线
Scheme1.
Synthetic route of Schiff base macrocycle 3 and corresponding reduced macrocycle 4
图式 1
Schiff碱大环3及其还原产物4的合成路线
Scheme1.
Synthetic route of Schiff base macrocycle 3 and corresponding reduced macrocycle 4

Citation: Liu Xingli, Tang Zhenghe, Chen Dongmei, Zhang Wenlong, Chen Huaiyu, Zhu Chun, Zhu Bixue. Synthesis of 2, 6-Diamidopyridinedipyrromethane Macrocycles and Their Binding Properties for AcO-[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2911-2918. doi: 10.6023/cjoc201705016

含2, 6-吡啶二甲酰胺基和二甲基双吡咯甲烷单元的大环合成及其与醋酸根的键合性质
-
关键词:
- 2, 6-二甲酰胺吡啶
- / 二甲基双吡咯甲烷
- / 大环
- / AcO-
- / 氢键
English
Synthesis of 2, 6-Diamidopyridinedipyrromethane Macrocycles and Their Binding Properties for AcO-
-
Key words:
- 2, 6-diamidopyridine
- / dipyrromethane
- / macrocycle
- / AcO-
- / hydrogen bond
-
基于具有环状结构的有机配体能将环缘上的氢键供体(或受体)原子进行收敛排列, 使得大环与阴离子进行氢键作用的收敛能降低, 有利于提高大环主体与阴离子之间识别作用, 系列含酰胺、吡咯、脲基等结构单元的有机大环的设计、合成及其对阴离子识别研究不断受到研究者的青睐[1~11]. Sessler研究组[12~15]设计、合成了同时含2, 6-吡啶二甲酰胺基和双吡咯单元的环状化合物, 并在维持大环主体骨架结构基础上, 通过氧化、还原作用实现对环状骨架结构的刚、柔性调整, 达到对系列阴离子氢键识别作用的对比考察, 他们的研究结果表明, 大环骨架结构的刚、柔性微小变化, 对大环主体与阴离子的选择性识别性质有着重要影响.但通过针对类似结构环腔尺寸调整, 进一步考察大环骨架结构的刚、柔性变化, 对系列阴离子键合作用方面的研究一直未有文献报道; 同时, 迄今有关含2, 6-吡啶二甲酰胺基或含双吡咯单元的大环与阴离子识别研究的报道中, 主要着眼于主客体识别常数测定, 重点考察大环主体对阴离子识别能力, 而基于大环与客体之间识别作用过程的能量效应及反应热力学参数测定, 开展大环与阴离子识别作用的构效关系及作用过程的热力学本质方面的研究稀缺[16].近来, Gale等[17]对含亚胺基的一类大环及其对阴离子识别作用的研究进展进行了全面的综述.据此, 我们采用二胺前体N, N'-(3-胺基苯基)-2, 6-二甲酰胺吡啶(1)和5, 5-二甲基-1, 9-二甲酰基二吡咯甲烷(2)进行缩合, 得到环腔尺寸更大的[1+1] Schiff碱大环3, 进一步将3中Schiff碱C=N双键还原得到饱和大环4 (Scheme 1), 在此基础上, 将3和4分别用于对醋酸根键合作用的对比考察.
 图式 1
Schiff碱大环3及其还原产物4的合成路线
Scheme1.
Synthetic route of Schiff base macrocycle 3 and corresponding reduced macrocycle 4
图式 1
Schiff碱大环3及其还原产物4的合成路线
Scheme1.
Synthetic route of Schiff base macrocycle 3 and corresponding reduced macrocycle 4
1 结果与讨论
1.1 1H NMR和质谱
大环3的1H NMR谱表明, 在δ 12.22处出现两个甲酰胺(CONH)的质子峰, 在δ 11.11处出现两个吡咯环上的NH的质子峰, 在δ 8.39处出现2个Schiff碱CH=N质子峰, 吡啶环上处在取代基邻位的2个质子在δ 8.38处, 呈现为双重峰, 处在取代基间位的质子在δ 8.34处, 呈现为三重峰.在通过酰胺骨架与中央吡啶环相连的一对苯环上, 位于其取代基间位的2个苯环质子出现在δ 7.45处, 呈现为三重峰, 位于其代基邻位的6个质子分别呈现为三组峰, 其中夹在两个取代基之间的2个苯环质子在δ 7.50处, 呈现为单峰, 另外4个苯环质子在δ 8.32和7.08两处, 均呈现为双重峰.经由sp3杂化碳连接的两个吡咯环上的4个CH的质子分别出现在δ 6.57和6.07两处, 呈现为双重峰, 6个甲基质子在δ 1.75处, 呈现为单峰.对大环3进行质谱(FABMS)表征, 其分子离子峰m/z为542.2 [M+ H]+, 表明前体二胺1和二醛2按1:1的物质的量之比缩合形成了[1+1]的Schiff碱大环3.
还原大环4的1H NMR谱表明, 在δ 10.88处出现两个吡咯环上2个NH的质子峰, 在δ 10.29处出现两个甲酰胺(CONH)质子峰, 与文献[12]报道的结果类似.与Schiff碱大环3相比, 在大环4中吡咯环上的NH的质子和甲酰胺(CONH)质子的δ均显著向高场位移, 相应于Schiff碱大环3中2个CH=N质子峰消失, 源于该双键还原产生的结构单元(-CH2—NH-)中, 2个NH质子峰出现在δ 5.90处, 2个亚甲基质子出现在δ 4.12处.对大环4进行质谱(FABMS)表征(见辅助材料中S4)表明, 其分子离子峰[M+H]+m/z为546.2, 表征结果与4的单晶结构相吻合.
1.2 还原大环4的晶体结构描述
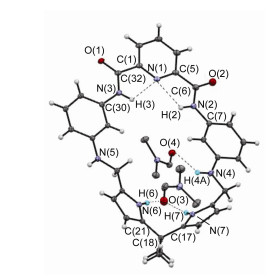
通过单晶培养和结构解析, 获得了饱和大环4的分子结构(图 1)和晶体学结构参数.大环4的晶体结构数据存于英国剑桥数据中心, CCDC: 1526843.
大环4的分子结构表明, 中央吡啶环与酰胺基连接的两个苯环之间的二面角分别为170.64°和176.01°, C(1)—C(32)—N(3)—C(30)和C(5)—C(6)—N(2)—C(7)原子间的扭曲角分别为178.63°和170.40°, 位于大环两侧、经由C—N单键连接的苯环与吡咯环之间的二面角分别为152.02°和117.85°, sp3杂化碳原子连接的两个吡咯环之间的二面角为109.54°, C(17)—C(18)—C(21)之间的夹角为110.5°, 整个大环分子骨架呈现为一稍微扭曲的非平面结构.位于中央吡啶环两臂的两个酰胺质子指向环内, 并同中央吡啶环上的氮原子形成分子内氢键作用, 两个吡咯环上的NH质子[H(6)和H(7)]则指向环外, 同时与1个N, N-二甲基甲酰胺(DMF)分子中O(3)发生氢键协同作用.位于大环骨架侧链上, 从Schiff碱C=N双键还原产生的2个亚胺质子取向1个朝向环内, 1个指向环外, 朝向环内的亚胺质子与另一个DMF分子中O(4)质子形成氢键作用, 两个DMF分子分别位于大环扭曲平面的上、下方.
1.3 大环与醋酸根阴离子键合作用考察
1.3.1 大环与AcO-作用体系的UV-Vis光谱
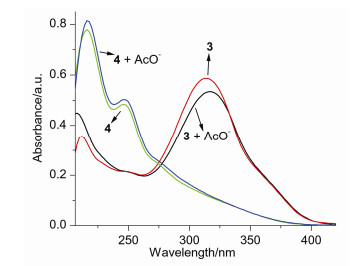
将大环3和4分别溶解在乙腈溶剂中(1.0×10-5 mol•L-1), UV-Vis光谱记录结果表明(图 2), Schiff碱大环3的λmax分别出现在212和312 nm两处, 同时在248 nm处呈现一肩峰, 饱和大环4的λmax分别出现在216和248 nm两处.在两个大环溶液中分别加入物质量相当于大环10倍(10 equiv.)的醋酸根阴离子(TBA+AcO-)后, 与相应的自由大环相比, 发现配合物的UV-Vis光谱位置和大小均发生明显改变, 表明大环与醋酸根阴离子之间产生了氢键作用.据此, 分别对大环3和4同AcO-之间的键合行为进行考察.
1.3.2 大环3和4分别与AcO-离子作用的键合比及键合常数
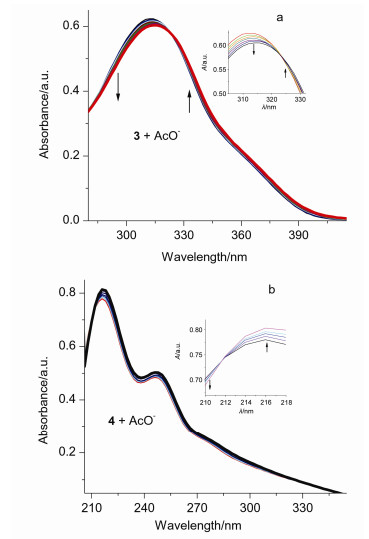
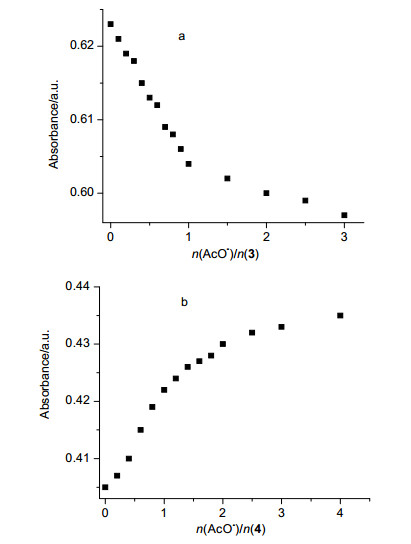
分别向浓度均为1.00×10-5 mol•L-1的Schiff碱大环3和还原大环4的乙腈溶液中, 滴加不同量的AcO-离子(0~5 equiv.), UV-Vis光谱滴定曲线如图 3.从图 3a可见, 随着AcO-离子加入量的不断增加, 大环3在312 nm处的最大吸收峰红移到315 nm, 并在323 nm处出现一等吸收点.从图 3b可见, 随着AcO-离子浓度的不断增加, 大环4在216, 246 nm处的吸收峰逐渐增强, 在211 nm处出现一等吸收点, 表明了Schiff碱大环3和饱和4均分别与AcO-形成了稳定的配合物.
首先采用摩尔比法测定了Schiff碱大环3、饱和大环4分别与AcO-作用的配位比.对3与AcO-作用体系, 用选择性较高的312 nm波长处, 不同AcO-浓度时作用体系吸光度A对大环3与AcO-的物质的量比n(AcO-)/n(3)作图(图 4a), 可见当大环3与AcO-配位键合物质的量比为1:1时, 体系吸光度值出现转折并趋向平缓, 表明3与AcO-形成了键合比为1:1的配合物.类似地, 对4与AcO-作用体系, 选用256 nm波长处, 不同AcO-浓度时作用体系吸光度A对大环4与AcO-的物质量比n(AcO-)/n(4)作图(图 4b), 可见当大环4与AcO-配位键合物质的量比为1:2时, 体系吸光度值出现转折并趋向平缓, 表明溶液中4与AcO-形成了键合比为1:2的配合物.
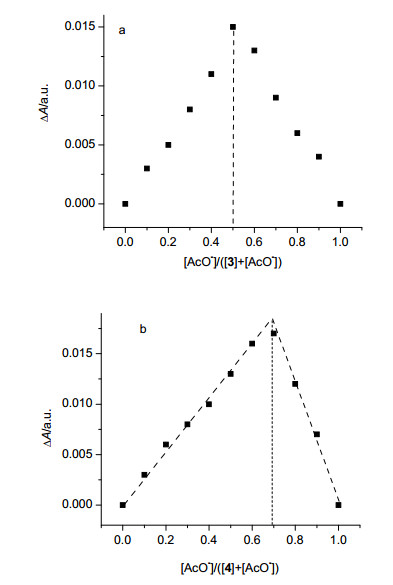
进一步采用Job法确定反应的键合比, 将大环3与醋酸根作用的各识别体系的ΔA对相应的浓度比[AcO-]/([3]+[AcO-])作图(图 5a), 图 5a表明大环3与AcO-形成1:1的配合物.将大环4与醋酸根作用的各识别体系的ΔA对相应的浓度比[AcO-]/([4]+[AcO-])作图(图 5b), 表明大环4与AcO-形成1:2的配合物, Job法获得结果与摩尔比法一致.
基于大环3和4与AcO-键合比分别具有1:1和1:2两种情形, 将按照文献[18]中所提供的方法进行平衡常数计算, 即当主客体为1:1键合时按照Eq. 1计算得到平衡常数Ka, 当主客体为1:2键合时按照Eq. 2式计算得到平衡常数Ka1和Ka2.
式中ΔAobs是在阴离子(客体)存在条件下配合物的吸光度与自由主体大环吸光度之差; [G]0和[H]0分别是客体和主体的初始浓度; Ka为主体大环分子和客体阴离子的结合常数; [G]为客体的浓度, Ka1和Ka2分别为第一、二级结合常数. εΔHG是配合物HG与自由主体的摩尔吸光系数之差; εΔHG2是配合物HG2与自由主体的摩尔吸光系数之差.经拟合得到Schiff碱大环3与AcO-的结合常数为5.16×105 L•mol-1, 饱和大环4与AcO-的结合常数为Ka1=4.41×103 L•mol-1, Ka2=5.32×105 L•mol-1.
1.3.3 等温量热滴定
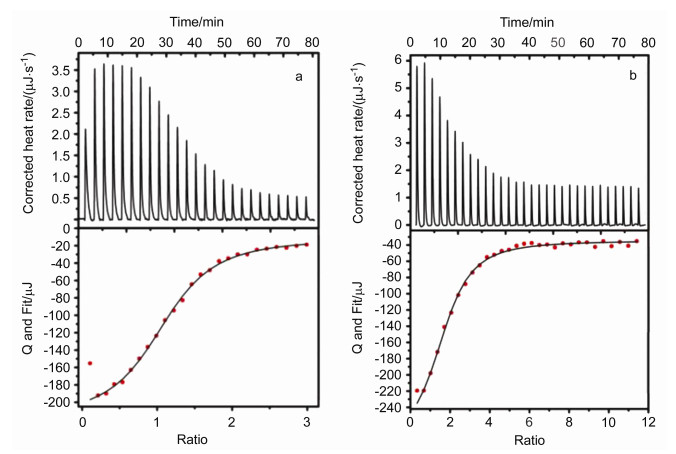
量热技术作为获取主客体识别体系中分子间相互作用能量信息的直接方法, 能够从实验上揭示分子间识别作用的热力学本质与起源, 据此进一步采用量热滴定技术获得Schiff碱大环3和饱和大环4分别与AcO-作用的等温量热曲线(图 6).从图 6可知大环3、4与AcO-反应均为放热过程, 所获得的相应体系的热力学参数列在表 1中.可见, 大环3、大环4与AcO-反应的键合比和键合常数与上述UV-Vis滴定结果基本吻合.两个反应体系的ΔrGm<0, 说明键合反应是自发的. Schiff碱大环3与AcO-作用过程的|ΔrHm|>|TΔrSm|, 说明大环3与AcO-之间的键合作用主要是由焓驱动的, 而对于饱和大环4, 其|ΔrHm|<|TΔrSm|, 说明主体大环4与AcO-键合作用过程主要是由熵驱动的[19], 这源于Schiff碱大环3骨架比还原大环4具有更强刚性结构, 在它们分别与AcO-进行键合作用过程中, 由大环4导致的熵贡献更大.
 表 1
大环3和4与AcO-键合作用的热力学参数
Table 1.
Thermodynamics parameters of the macrocycles 3 and 4 bonding interactions with AcO-
表 1
大环3和4与AcO-键合作用的热力学参数
Table 1.
Thermodynamics parameters of the macrocycles 3 and 4 bonding interactions with AcO-
主-客体系 键合比n Ka/(L•mol-1) ΔrHm/(kJ•mol-1) -TΔrSm/(kJ•mol-1) ΔrGm/(kJ•mol-1) 3+AcO- 1.14±0.02 8.53×104 -20.69±0.67 -7.46 -28.15±0.67 4+AcO- 1.75±0.07 4.62×104 -7.89±0.53 -17.33 -25.22±0.53 1.3.4 1H NMR滴定
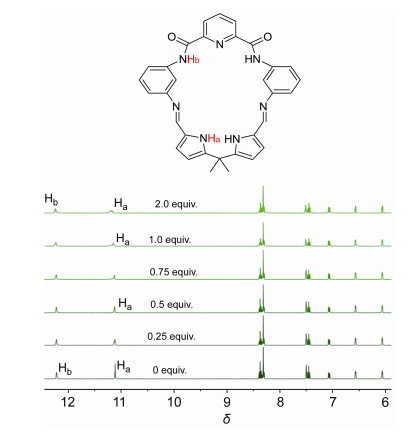
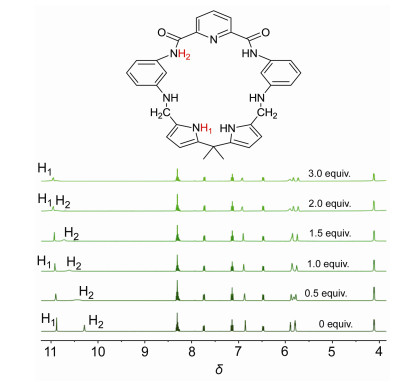
为了进一步阐释大环3、4分别与AcO-阴离子发生氢键作用键合位点, 采用核磁滴定技术, 在DMSO-d6溶液中, 考察了两个大环分别与AcO-作用过程的氢谱信号的变化, 结果如图 7和图 8.从图 7可见自由大环3的酰胺CONH和吡咯NH质子峰分别出现在δ 12.22和11.11两处, 随着AcO-浓度的逐渐增加, 酰胺质子δ(Hb)的位置和强度基本未变, 而吡咯环上的NH质子的δ(Ha)向低场位移δ 0.09, 峰形变宽并出现裂分, 表明AcO-与自由大环3中吡咯NH形成了氢键作用.结合UV-Vis、等温量热滴定(ITC)结果, 推测双吡咯单元中2个吡咯环上的NH质子分别与同一个AcO-中的两个氧原子发生氢键作用.从图 8可见, 经由Schiff碱大环3中两个Schiff碱C=N还原形成的自由大环4中, 酰胺CONH质子的δ(H2)出现在δ 10.29处, 吡咯环上NH质子的δ(H1)在δ 10.88处.随着AcO-浓度的逐渐增加, 大环4中吡咯NH质子的δ(H1)向低场位移了δ 0.08, 峰形稍微变宽, 且其强度逐渐减弱; 同时, 酰胺质子的δ(H2)向低场显著位移了δ 0.66, 峰形变宽, 强度逐渐减弱直至最后消失, 表明大环4中2, 6-吡啶二甲酰胺单元的两个酰胺质子、双吡咯单元中吡咯环上NH质子均参与了同AcO-的键合作用, 结合UV-Vis、ITC滴定结果, 大环4与AcO-形成1:2的配合物, 推测大环以2, 6-吡啶二甲酰胺单元中2个酰胺NH质子和双吡咯环上2个NH质子分别作为两个氢键作用中心, 分别同2个AcO-进行氢键作用.
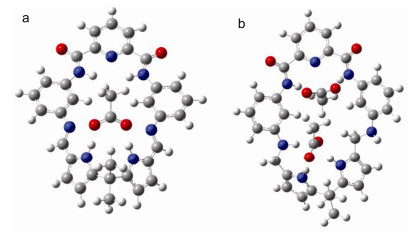
大环4在固态下的晶体结构表明, 位于双吡咯环上NH质子取向朝向环外, 而位于2, 6-吡啶二甲酰胺单元中两个酰胺质子则指向环内, 同时这2个酰胺NH质子与中央吡啶环上氮原子形成分子内氢键作用, 使得其与AcO-键合作用能力不如双吡咯环上NH质子, 在4与AcO-作用过程中, 大环首先以双吡咯环上NH质子同AcO-优先发生氢键作用, 随着AcO-浓度的逐渐增加, 第二个AcO-进一步与2, 6-吡啶二甲酰胺单元中两个酰胺NH质子进行氢键作用, 因此形成1:2的配合物.大环3比大环4具有更强的结构刚性, 双吡咯环上NH质子与AcO-优先发生氢键作用后, 由于空间位阻较大, 使得第二个AcO-再与2, 6-吡啶二甲酰胺单元中两个酰胺质子进行氢键作用受到限制, 导致大环3与AcO-仅形成1:1的配合物.我们进一步采用杂化密度泛函(B3LYP)[20, 21]方法, 对两个大环以及它们分别与醋酸根阴离子形成的主客体配合物结构进行全优化, 并对优化得到的结构进行频率计算, 确认其是势能面上的稳定点, 所有计算都在Gaussian 09软件包中完成.通过计算得到大环3和4与AcO-作用的结合能分别为-188.05和-225.16 kJ•mol-1, 并获得相应的主客体复合物能量最小化模型结构(图 9).
2 结论
通过Schiff碱大环3及其还原产物4对AcO-识别作用过程对比考察, 表明大环骨架刚性较强的Schiff碱大环3与AcO-键合作用仅形成1:1的配合物, 骨架较柔性的饱和大环4则能形成1:2的配合物; 等温量热滴定结果进一步揭示, 大环与AcO-的氢键作用过程中, 相对刚性的大环3以焓驱动为主, 更具柔性骨架的大环4则以熵驱动为主.显然, 大环骨架结构刚、柔性改变, 对其与AcO-作用行为具有重要影响, 研究结果对新型主体大环结构设计及其阴离子识别作用研究可以提供重要的参考与指导.
3 实验部分
3.1 仪器和试剂
Bio-Rad型傅立叶红外光谱仪(4000~400 cm-1); Ry-2型熔点仪(温度计未校正); JEOL ECX 400 MHz核磁共振仪; Vario EL Ⅲ型元素分析仪(德国); 岛津UV-1800紫外分光光度计(日本); MS (Angilent 1100)质谱仪; 晶体结构测定采用Bruker Smart Apex衍射仪; Nano等温滴定量热仪(Nono ITC, 美国TA仪器公司).实验中使用的试剂和药品均为市售分析纯.
3.2 Schiff碱大环3和4合成与表征
3.2.1 前体二胺1和前体二醛2的合成
前体二胺N, N'-(3-胺基苯基)-2, 6-二甲酰胺吡啶(1)按照文献[22]所报道的方法合成, 白色固体, 经真空干燥, 称量, 产率63%. m.p. 281~283 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.76 (s, 2H, NH), 8.2~8.36 (m, 3H, Py-H), 6.36~7.18 (m, 8H, ArH), 5.18 (s, 4H, NH2).
前体二醛5, 5-二甲基-1, 9-二甲酰基二吡咯甲烷(2)按照文献[5]所报道的方法合成, 产率60%, m.p.182~184 ℃.
3.2.2 Schiff碱大环化合物3的合成
在250 mL的三口瓶中, 向50 mL的甲醇中加入(0.0347 g, 0.1 mmol) N, N'-(3-胺基苯基)-2, 6-二甲酰胺吡啶(1), 搅拌溶解, 缓慢滴加5, 5-二甲基-1, 9-二甲酰基二吡咯甲烷(2) (0.0230 g, 0.1 mmol)的甲醇溶液30 mL, 滴加1~2滴浓H2SO4反应混合液中有沉淀生成, 回流反应24 h, 抽滤, 滤饼用甲醇洗涤3~5次, 经柱层析400目硅胶, 用二氯甲烷过柱, 收集第一带, 减压旋蒸除去溶剂, 得到黄色固体0.0201 g, 产率34.5%. m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 12.22 (s, 2H, CONH), 11.11 (s, 2H, pyrrole-NH), 8.39 (s, 2H, CH=N), 8.38 (d, J=8.0 Hz, 2H, pyH), 8.34 (t, J=7.2 Hz, 1H, pyH), 8.32 (d, J=7.6 Hz, 2H, ArH), 7.50 (s, 2H, ArH), 7.45 (t, J=8.4 Hz, 2H, ArH), 7.08 (d, J=6.8 Hz, 2H, ArH), 6.57 (d, J=5.6 Hz, 2H, pyrrole-H), 6.07 (d, J=6.0 Hz, 2H, pyrrole-H), 1.75 (s, 6H, CH3); 13C NMR (DMSO-d6, 100 MHz) δ: 161.5, 152.7, 151.1, 148.9, 145.3, 141.2, 139.2, 131.48, 130.7, 125.5, 117.4, 117.0, 115.7, 113.5, 106.6, 35.7, 28.0; IR (KBr) ν: 3371, 2968, 1683, 1618 cm-1; FABMS m/z: 542 [M+H]+. Anal. calcd for C32H27N7O2: C 70.96, H 5.02, N 18.10; found C 71.13, H 5.16, N 17.97.
3.2.3 Schiff碱大环化合物4的合成
称取Schiff碱大环3 (0.50 g, 0.92 mmol)溶解于50 mL四氢呋喃中, 在不断搅拌条件下, 分三次加入NaBH4 (0.15 g, 4.0 mmol), 常温反应8 h, 旋去大部分溶剂, 加入50 mL蒸馏水, 静置, 过滤, 经真空干燥得0.20 g浅黄色固体4, 产率40%. m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 10.88 (s, 2H, pyrrole-NH), 10.29 (s, 2H, CONH), 8.32 (d, J=8.4 Hz, 2H, pyH), 8.30 (t, J=6.8 Hz, 1H, pyH), 7.75 (d, J=8.0 Hz, 2H, ArH), 7.16 (t, J=8.0 Hz, 2H, ArH), 6.86 (s, 2H, ArH), 6.49 (d, J=7.2 Hz, 2H, ArH), 5.90 (t, J=6.4 Hz, 2H, ArNH), 5.81 (d, J=4.0 Hz, 2H, pyrrole-H), 5.79 (d, J=5.2 Hz, 2H, pyrrole-H), 4.12 (d, J=4.4 Hz, 4H, CH2), 1.57 (s, 6H, CH3); 13C NMR (DMSO-d6, 100 MHz) δ: 161.7, 149.7, 149.4, 140.8, 139.8, 139.5, 130.2, 127.9, 125.4, 108.3, 107.6, 106.6, 104.8, 102.8, 100.0, 35.5, 30.0; IR (KBr) ν: 3444, 2947, 1668, 1182 cm-1; FABMS m/z: 546 [M+H]+. Anal. calcd for C32H31N7O2: C 70.44, H 5.73, N 17.97; found C 70.63, H 5.56, N 17.68.
3.3 晶体结构测定
取少量固体4溶解于DMF溶剂中7 d后长出适合X射线单晶衍射测定的浅黄色块状晶体.选取大小适当的晶体, 用Bruker Smart Apex单晶衍射仪, 采用经石墨单色器单色化的Mo Kα射线(λ=0.071073 nm), 以φ-ω扫描方式收集单晶衍射数据.强度数据进行了经验吸收校正及LP校正.晶体结构由直接法解得, 对全部非氢原子坐标及其各向异性热参数进行了全矩阵最小二乘法修正, 所有计算用SHELX-97程序完成[23].
3.4 大环3和4与AcO-作用体系的UV-Vis光谱
分别移取1 mL浓度为1×10-4 mol•L-1的Schiff碱大环3和4的乙腈溶液于一系列10 mL容量瓶中, 分别加入1 mL、浓度均为1×10-3 mol•L-1的AcO-的TBA盐(TBA+AcO-)的乙腈溶液, 用乙腈稀释至刻度, 混匀、放置达体系吸光度稳定不变后, 室温下在200~600 nm范围内记录各反应体系的紫外-可见吸收光谱(乙腈作参比), 并通过摩尔比法确定配位反应的配位比.
进一步采用Job法对主客体配位比进行确定, 即在乙腈溶液中, 分别配置浓度均为1.00×10-4 mol•L-1大环3、4和AcO-离子的乙腈溶液作为操作液.固定各配位反应体系中反应物总浓度为2.00×10-5 mol•L-1的条件下, 配置系列大环3和AcO-离子、4和AcO-离子浓度比不同的反应体系, 待系列体系达反应平衡后, 测定系列体系的吸光度.
辅助材料(Supporting Information) Schiff碱大环4的晶体结构数据和Schiff碱大环3和4的1H NMR, 13C NMR和MS图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Zhou, H. J.; Zhao, Y. S.; Gao, G.; Li, S. Q.; Lan, J. B.; You, J. S. J. Am. Chem. Soc. 2013, 135, 14908. doi: 10.1021/ja406638b
-
[2]
刘阁, 邵杰, 化学学报, 2011, 69, 1070. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Liu, G.; Shao, J. Acta Chim. Sinica 2011, 69, 1070(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[3]
White, N. G.; Lovett, H. G.; Beer, P. D. RSC Adv. 2014, 4, 12133. doi: 10.1039/C4RA00615A
-
[4]
Iawa, H.; Nishino, S.; Sumita, M. Chem. Commun. 2015, 51, 8596. doi: 10.1039/C5CC01709B
-
[5]
Mahanta, S. P.; Kumar, B. S.; Baskaran, S.; Sivasankar, C.; Panda, P. K. Org. Lett. 2012, 2, 548. http://europepmc.org/abstract/MED/22206306
-
[6]
Kim, A.; Ali, R.; Park, S. H.; Kim, Y. H.; Park, J. S. Chem. Commun. 2016, 52, 11139. doi: 10.1039/C6CC04562F
-
[7]
蹇军友, 闫柏任, 潘顶伍, 谭赞, 吕新阳, 杜欢, 鲍小平, 有机化学, 2015, 35, 1069. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344767.shtmlJian, J. Y.; Yan, B. R.; Pan, D. W.; Tan, Z.; Lü, X. Y.; Du, H.; Bao, X. P. Chin. J. Org. Chem. 2015, 35, 1069(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344767.shtml
-
[8]
Kim, S. K.; Lynch, V. M.; Sessler, J. L. Org. Lett. 2014, 16, 6128. doi: 10.1021/ol502991t
-
[9]
王芳芳, 欧敏, 邓雅欣, 冉旭, 张奇龙, 朱必学, 有机化学, 2014, 34, 334. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract343641.shtmlWang, F. F.; Ou, M.; Deng, Y. X.; Ran, X.; Zhang, Q. L.; Zhu, B. X. Chin. J. Org. Chem. 2014, 34, 334(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract343641.shtml
-
[10]
张文龙, 陈冬梅, 刘兴丽, 黄超, 朱必学, 有机化学, 2017, 37, 474. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345743.shtmlZhang, W. L.; Chen, D. M.; Liu, X. L.; Huang, C.; Zhu, B. X. Chin. J. Org. Chem. 2017, 37, 474(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345743.shtml
-
[11]
Roznyatovskiy, V. V.; Lim, J. M.; Lynch, V. M.; Lee, B. S.; Kim, D.; Sessler, J. L. Org. Lett. 2011, 20, 5620. http://www.ncbi.nlm.nih.gov/pubmed/21141913
-
[12]
Sessler, J. L.; Katayev, E.; Pantos, G. D.; Scherbakov, P.; Reshetova, M. D.; Khrustlev, V. N.; Lynch, V. M.; Ustynyuk, Y. A. J. Am. Chem. Soc. 2005, 127, 11442. doi: 10.1021/ja0522938
-
[13]
Katayev, E. A.; Pantos, G. D.; Reshetova, M. D.; Khrustalev, V. N.; Lynch, V. M.; Ustynyuk, Y. A.; Sessler, J. L. Angew. Chem., Int. Ed. 2005, 44, 7386. doi: 10.1002/(ISSN)1521-3773
-
[14]
Sessler, J. L.; Katayev, E.; Pantos, G. D.; Ustynyuk, Y. A. Chem. Commun. 2004, 1276.
-
[15]
Sessler, J. L.; Roznyatovskiy, V.; Pantos, G. D.; Borisova, N. E.; Reshetova, M. D.; Lynch, V. M.; Khrustalev, V. N.; Ustynyuk, Y. A. Org. Lett. 2005, 23, 5277.
-
[16]
Evans, N. H.; Beer, P. D. Angew. Chem., Int. Ed. 2014, 53, 11716. doi: 10.1002/anie.201309937
-
[17]
Wenzel, M.; Hiscock, J. R.; Gale, P. A. Chem. Soc. Rev. 2012, 41, 480 doi: 10.1039/C1CS15257B
-
[18]
Thordarson, P. Chem. Soc. Rev. 2011, 40, 1305. doi: 10.1039/C0CS00062K
-
[19]
Yu, X.; Clegg, J. K.; Zhang, Y. Q.; Xue, S. F.; Tao, Z.; Zhu, Q. J.; Lindoy, L. F.; Wei, G. Polyhedron 2015, 91, 150. doi: 10.1016/j.poly.2015.02.032
-
[20]
Lee, C.; Yang, W. T.; Parr, R. G. Phys. Rev. B 1988, 37, 785. doi: 10.1103/PhysRevB.37.785
-
[21]
Becke, A. D. J. Chem. Phys. 1993, 98, 5648. doi: 10.1063/1.464913
-
[22]
张奇龙, 徐红, 席晓岚, 分子科学学报, 2011, 27, 402. doi: 10.3969/j.issn.1000-9035.2011.06.007Zhang, Q. L.; Xu, H.; Xi, X. L. J. Mol. Sci. 2011, 27, 402(in Chinese). doi: 10.3969/j.issn.1000-9035.2011.06.007
-
[23]
Sheldrick, G. M. SHELX-97, University of Göttingen, Germany, 1997.
-
[1]
-
表 1 大环3和4与AcO-键合作用的热力学参数
Table 1. Thermodynamics parameters of the macrocycles 3 and 4 bonding interactions with AcO-
主-客体系 键合比n Ka/(L•mol-1) ΔrHm/(kJ•mol-1) -TΔrSm/(kJ•mol-1) ΔrGm/(kJ•mol-1) 3+AcO- 1.14±0.02 8.53×104 -20.69±0.67 -7.46 -28.15±0.67 4+AcO- 1.75±0.07 4.62×104 -7.89±0.53 -17.33 -25.22±0.53 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 1
- 文章访问数: 1345
- HTML全文浏览量: 110


 下载:
下载:









 下载:
下载:

