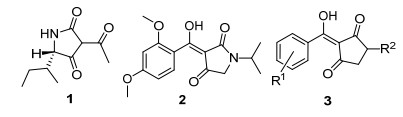
 图1
化合物1~3的结构式
Figure1.
Structures of compounds 1~3
图1
化合物1~3的结构式
Figure1.
Structures of compounds 1~3

Citation: Xu Haizhen, Xie Lifen, Han Tingfeng, He Jingli, Zhu Youquan. Synthesis, Herbicidal Activities of Novel Triketone Compounds Containing 4-Substituted Cyclopentane-1, 3-dione Moiety[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2717-2724. doi: 10.6023/cjoc201704039

新型含4-取代-1, 3-环戊二酮结构的三酮类化合物的合成与除草活性研究
-
关键词:
- 三酮
- / 4-取代-1, 3-环戊二酮
- / 合成
- / 除草活性
English
Synthesis, Herbicidal Activities of Novel Triketone Compounds Containing 4-Substituted Cyclopentane-1, 3-dione Moiety
-
Key words:
- triketone
- / 4-substituted cyclopentane-1, 3-dione
- / synthesis
- / herbicidal activity
-
许多商品化的对羟基苯基丙酮酸双氧化酶(HPPD)抑制剂在结构上通常具有以下特点: (1) 包含一个ββ′-二羰基甲烷结构单元, 其中一个羰基必须与取代苯环直接相连, 否则化合物的除草活性将大大降低甚至消失; (2) 上述结构必须能够烯醇化以保证其具有与对羟基苯基丙酮酸竞争HPPD活性中心Fe2+进行络合的能力, 达到抑制HPPD催化活性的目的, 使植物赖以生存的质体醌和生育酚合成受到抑制, 从而导致作物茎叶白化死亡[1~5].
本课题组基于商品化的HPPD抑制剂在结构上的特点, 通过对具有HPPD抑制活性的天然化合物1 (IC50=18 μmol•L-1)(图 1)[6, 7]结构修饰, 较为详细地研究了3-芳酰基吡咯烷-2, 4-二酮杂环化合物的构效关系[1, 8~12].结果发现, 在该类化合物苯环2-和4-位引入供电子基团更有利于除草活性的提高, 与已知HPPD抑制剂构效关系正好相反.和磺草酮相比, 部分化合物具有同等程度的除草活性, 其中化合物2 (图 1)在每公顷苗前使用量为187.5克时, 对稗草显示93%的防效.
根据药物代谢理论, 化合物2在植物体内可能发生水解开环从而导致活性的降低[13].我们拟以2为先导, 将氮原子修饰为碳原子(3) (图 1), 通过研究R1、R2以及与R2相连碳原子手性对生物活性的影响, 以期发现具有优良除草活性的化合物或先导化合物.
1 结果与讨论
1.1 目标化合物的合成
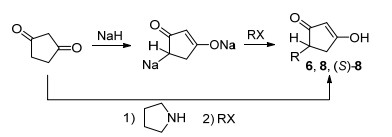
在设计合成4-取代环戊-1, 3-二酮[6, 8, (S)-8]时, 我们首先以环戊烷-1, 3-二酮为原料, 通过Scheme 1所示反应路线制备.经过多次尝试, 由于环戊二酮存在部分烯醇化, 导致反应复杂化, 无法获得目标产物.为避免烯醇化对反应的影响, 我们将环戊-1, 3-二酮在对甲苯磺酸存在下与异丁醇反应转化为烯醇醚4[14].然后用新鲜制备的二异丙氨基锂将中间体4转化为烯醇锂盐, 再与3-溴丙烯发生亲核取代反应形成中间体5, 经1 mol/L HCl酸解, 形成目标关键中间体6 (Scheme 2), 产率达到65%(文献值[15]为80%).但是当用碘代异丙烷制备中间体7时, 未观测到7的形成.这可能是由于二级卤代烷因空间位阻等原因反应性比烯丙基溴差导致反应未能发生.因此我们加入二乙基锌与烯醇锂反应生成更活泼的锌络合物, 与碘代异丙烷反应制备中间体7, 收率40%左右[16~18], 经1 mol/L HCl酸解, 得到中间体8 (Scheme 2).
为了获得手性纯中间体(S)-8, 我们用手性的薄荷醇对烯醇羟基进行醚化[11], 然后用制备中间体7相同的方法制备中间体10 (Scheme 2), 并获得成功.用1 mol/L HCl酸解制备中间体10时, 延长时间与升高温度均不能使反应完全, 可能是薄荷醇来保护羟基时位阻增大导致, 为此, 我们把盐酸的浓度增大至2 mol/L, 反应24 h后, 反应完全, 收率60%.
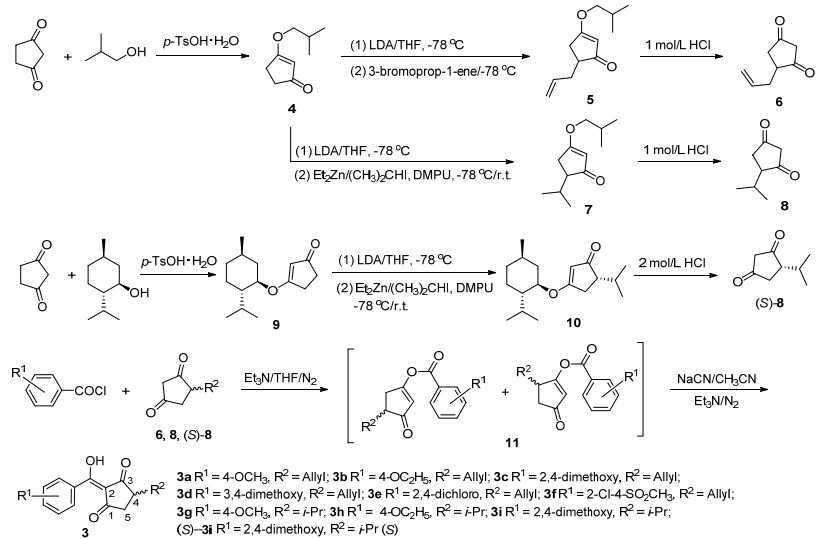
由于6, 8和(S)-8在与酰氯反应时生成的两种烯醇酯产物11, 氰化钠催化转位后的产物均是同一结构化合物, 因此酯化反应产物未经提纯直接用于目标产物的合成.中间体11在四氢呋喃中氮气保护下经氰化钠催化转位生成目标化合物3 (Scheme 2)[19].由于受到环戊-1, 3-二酮4-位取代基空间位阻的影响, 在转位过程中发生分解, 生成了相应的酸和4-取代环戊-1, 3-二酮, 导致目标化合物3收率整体偏低.由于目标化合物3环戊二酮结构的2-位的氢原子受相邻的三个羰基的影响, 与羰基发生烯醇化, 且受氘代试剂里面的水的快速氢交换影响, 导致观测不到羟基氢的信号.同时红外光谱在3400 cm-1左右的吸收峰进一步佐证了目标化合物分子结构中羟基的存在.说明化合物3主要是以烯醇式结构存在.
1.2 目标化合物的除草活性研究
油菜平皿法和稗草小杯法的生测结果表明(表 1):在生长抑制方面, 当在黑暗条件下, 测试对象是油菜时, 当苯环上为供电子基甲氧基时, 处于对位且单取代时活性优于双取代的[3a vs 3c, 3d; 3g vs 3i, (S)-3i]; 当为吸电子基时, 取代基为2-Cl-4-SO2CH3 (3f)时其活性优于2, 4-二氯(3e)的化合物; 取代基为甲氧基的化合物(3a, 3g)与为乙氧基的化合物(3b, 3h)对油菜生长抑制作用无明显区别; 手性中心对油菜生长抑制作用无明显区别[3i vs (S)-3i].在白化作用方面, 在光照下作用对象为稗草时, 许多这类化合物均表现出明显白化作用或褪绿现象, 这一结果也说明这类化合物和磺草酮具有类似的作用机理, 具有一定的HPPD抑制剂的特征.
 表 1
化合物3a~(S)-3i的除草活性(抑制率/%)a
Table 1.
Herbicidal activities (inhibition rate/%) of compounds 3a~(S)-3i
表 1
化合物3a~(S)-3i的除草活性(抑制率/%)a
Table 1.
Herbicidal activities (inhibition rate/%) of compounds 3a~(S)-3i
化合物 R1 R2 油菜 稗草 10 mg•L-1 100 mg•L-1 10 mg•L-1) 100 mg•L-1 3a 4-OCH3 Allyl 0 85.1 10.0 45.0*** 3b 4-OCH2CH3 Allyl 21.6 82.0 5.0 30.0*** 3c 2, 4-Dimethoxy Allyl 0 58.2 5.0 13.0** 3d 3, 4-Dimethoxy Allyl 46.4 52.2 5.0 10.0* 3e 2, 4-Dichloro Allyl 28.5 66.1 5.0* 10.0*** 3f 2-Cl-4-SO2CH3 Allyl 10 86.3 0 10.0* 3g 4-OCH3 Isopropyl 0 86.4 0 25.2* 3h 4-OCH2CH3 Isopropyl 9.1 90.0 12.8 46.0* 3i 2, 4-Dimethoxy Isopropyl 0 70.8 5.0 30.2* (S)-3i 2, 4-Dimethoxy Isopropyl (S) 0 68.4 0 17.8* a*轻微褪绿白化, **褪绿白化, ***白化. 随后我们对化合物3a~(S)-3i进行活体盆栽(土壤和茎叶)测试.从表 2中可以看出:在1500 g/ha使用剂量下, 部分化合物(3a, 3d, 3f)对油菜表现出很好的除草活性, 除草率可达到85 %以上; 当试材为苋菜时, 化合物3c, 3d和3f在土壤或茎叶处理时表现出80%以上的除草率; 当试材为马唐时, 化合物3d, 3i和(S)-3i在茎叶处理时表现出80%以上的除草率; 在五元环上引入取代基后, 手性化合物(3i)与消旋化合物(S)-3i的除草活性没有明显的区别.当化合物2分子中氮原子修饰为碳后, 化合物3i和(S)-3i与相应的吡咯烷酮类化合物2相比, 活性明显降低, 说明将氮原子修饰为碳原子后可能导致分子构象发生明显变化, 化合物与受体蛋白HPPD结合能力降低, 进而影响了化合物的除草活性.
 表 2
化合物3a~(S)-3i的除草活性(抑制率/%)
Table 2.
Herbicidal activities of compounds 3a~(S)-3i (inhibition rate/%)
表 2
化合物3a~(S)-3i的除草活性(抑制率/%)
Table 2.
Herbicidal activities of compounds 3a~(S)-3i (inhibition rate/%)
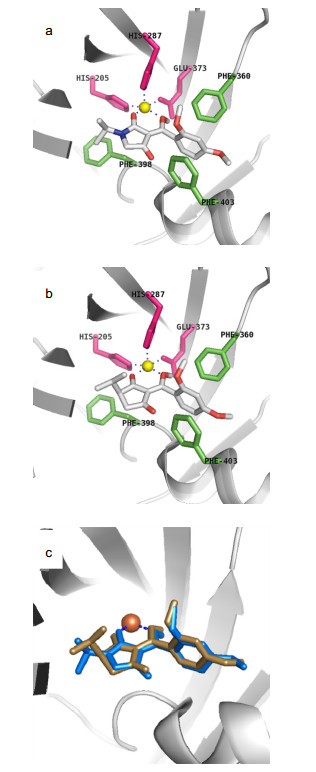
化合物 剂量/(g•ha-1) 油菜 苋菜 稗草 马唐 土壤 茎叶 土壤 茎叶 土壤 茎叶 土壤 茎叶 3a 1500 88.0 100.0 60.5 37.6 70.8 65.1 55.3 45.5 3b 1500 16.3 40.1 40.6 23.7 19.6 30.0 30.1 43.9 3c 1500 75.0 34.3 80.5 30.1 40.0 65.7 32.4 61.3 3d 1500 87.9 15.6 50.0 100 10.5 75.8 10.9 100 3e 1500 93.9 98.2 71.2 35.0 62.5 10.0 10.0 30.0 3f 1500 94.5 93.5 91.2 40.0 10.0 45.0 25.0 35.0 3g 1500 35.1 10.3 20.1 11.4 23.2 11.5 64.9 76.2 3h 1500 20.8 11.0 21.1 10.0 16.3 8.9 37.4 50.6 3i 1500 26.3 12.4 22.5 50.1 48.9 30.4 74.8 82.1 (S)-3i 1500 61.4 18.1 30.6 75.6 24.0 28.7 31.0 84.6 2[10] 750 — — — — 100 — 93 — 磺草酮 750 100 100 100 99.1 100 100 100 100 为此, 我们选取化合物(S)-3i和2与拟南芥中的HPPD利用Sybyl软件进行了授受体对接实验.对接结果显示化合物2[10]能与HPPD很好的键合并且五元环能很好的匹配(图 2a), 而当在C-4位引入异丙基时(S)-3i时, 五元环不能保持共平面, 呈信封式构象(图 2b), 且异丙基与残基HIS205相抵触, 这可能会影响其与HPPD活性中心的键合, 降低二者的结合能力, 进而影响其除草活性.进一步的分子叠加表明, 化合物(S)-3i中五元环和化合物2不处于相同的平面(图 2c).因此, 五元碳环上C-4位烷基的存在不能提高其除草活性.
2 结论
以1, 3-环戊二酮为原料, 经六步反应设计合成了一系列未见文献报道的含4-取代-1, 3-环戊二酮结构的三酮类化合物, 其结构经IR, 1H NMR及高分辨质谱确证, 并对该类化合物合成方法进行了探讨.初步生测结果表明, 部分化合物对油菜表现出明显的抑制活性, 在100 mg/L浓度下对油菜的抑制率达到80%以上; 在1500 g/ha施药量情况下, 部分化合物对油菜的土壤处理和茎叶处理均呈现出很好的防除效果, 抑制率达到90%以上.进一步的与HPPD受体的对接结果表明, 将氮原子修饰为碳原子导致构象发生变化, 影响了与受体的结合, 不利于除草活性的提高.
3 实验部分
3.1 仪器与试剂
Yanaco-Micro熔点仪, 温度计未校正; Shimadzu-IR435红外光谱仪, 溴化钾压片; Bruker 400MHz核磁共振仪, TMS为内标; BrukerMicroToF-QII高分辨质谱仪.实验用的试剂和原料均为分析纯或化学纯.
3.2 实验方法
3.2.1 3-异丁氧基环戊-2-烯酮(4)的合成
采用文献[14]方法进行合成.收率66.3%. 90~92 ℃/3 mmHg(文献值[10]:收率96.3%, 112 ℃/3 mmHg); 1H NMR (400 MHz, CDCl3) δ: 1.00 [d, J=6.8 Hz, 6H, CH(CH3)2), 1.99~2.16 [m, 1H, CH(CH3)2], 2.42~2.48 (m, 2H, CH2-cycl), 2.58~2.66 (m, 2H, CH2-cycl), 3.74 (d, J=6.5 Hz, 2H, OCH2), 5.28 (s, 1H, OC=CH).
3.2.2 3-(((1R, 2S, 5R)-2-异丙基-5-甲基环己基)氧)环戊-2-烯酮(9)的合成
采用文献[15]方法进行合成, 收率62.5%. m.p. 59~61 ℃; [α]D25-142.6 (c 1.0, CH2Cl2); 1H NMR (400 MHz, CDCl3) δ: 0.76 (d, J=7.0 Hz, 3H, CHCH3), 0.89~0.97 [m, 7H, CH(CH3)2], 1.06~1.24 (m, 2H, CH2-cycl.), 1.37~1.57 (m, 2H, CH2-cycl.), 1.71~1.82 (m, 2H, CH2-cycl.), 1.95~2.06 (m, 1H, CH-cycl.), 2.07~2.12 (m, 1H, CH-cycl.), 2.37~2.43 (m, 2H, CH2-cycl.), 2.51~2.69 (m, 2H, CH2-cycl.), 3.95 (td, J=10.7, 4.3 Hz, 1H, OCH), 5.29 (s, 1H, CH=C). HRMS (ESI) calcd for C15H24O2 [M+H+]: 237.1850; found 237.1846.
3.2.3 5-烯丙基-3-异丁氧基环戊-2-烯酮(5)的合成
采用文献[15]方法进行合成.收率64.5%(文献值[11]:收率79.6%). 1H NMR (400MHz, CDCl3) δ: 1.00 (d, J=6.6 Hz, 6H, CH(CH3)2), 2.03~2.27 (m, 2H, CH2=CHCH2), 2.24~2.48 (m, 1H, CH(CH3)2), 2.51~2.67 (m, 2H, OCCH2), 2.65~2.89 (m, 1H, CCHCH2), 3.74 (d, J=6.3 Hz, 2H, OCH2), 4.93~5.17 (m, 2H, CH2=CH), 5.24 (s, 1H, OC=CH), 5.66~5.91 (m, 1H, CH2=CH).
3.2.4 中间体7和10的合成
3-异丁氧基-5-异丙基环戊-2-烯酮(7):收率40.6%. 1H NMR (400 MHz, CDCl3) δ: 0.72~1.08 (m, 12H, 4CH3), 1.98~2.65 (m, 5H, CHCH2OCCH2CHCH), 3.74 (d, J=1.4 Hz, 2H, OCH2), 5.24 (s, 1H, OC=CH). HRMS (ESI) calcd for C12H20O2[M+H+]: 197.1537; found 197.1540.
(S)-5-异丙基-3-(((1R, 2S, 5R)-2-异丙基-5-甲基环己基)氧)环戊-2-烯酮(10):收率42.5%. [α]D25-163.2 (c 1.0, CH2Cl2); 1H NMR (400 MHz, CDCl3) δ: 0.68~1.01 (m, 15H, 5CH3), 0.91~1.01 (m, 1H, CH(CH3)2), 1.01~1.17 (m, 2H, CH2-cycl.), 1.40~1.62 (m, 2H, CH2-cycl.), 1.60~1.72 (d, J=12.2 Hz, 2H, CH2-cycl.), 1.87~1.99 (m, 5.1 Hz, 1H, CH-cycl.), 2.11~2.20 (m, 1H, CH-cycl.), 2.22~2.42 (m, 2H, CH2-cycl.), 2.43~2.63 (m, 2H, CH2-cycl.), 3.94 (td, J=10.7, 2.5 Hz, 1H, OCH), 5.27 (s, 1H, C=CH). HRMS (ESI) calcd for C18H30O2[M+H+]: 279.2319; found 279.2320
3.2.5 中间体6, 8和(S)-8的合成
采用文献[10]方法合成了中间体6, 8和(S)-8.
4-烯丙基环戊烷-1, 3-二酮(6):收率92.9%(文献值[14]:收率89.9%); 1H NMR (400 MHz, CDCl3) δ: 2.16~2.44 (m, 2H, CH2=CHCH2), 2.52~2.73 (m, 2H, CH2-cycl.), 2.73~2.94 (m, 1H, CH-cycl.), 4.97~5.18 (m, 2H, CH2=CH), 5.29 (s, 1H, C=CH), 5.63~5.86 (m, 1H, CH2=CH), 10.35 (br s, 1H, OH).
4-异丙基环戊烷-1, 3-二酮(8):收率98.3%. m.p. 97~99 ℃; 1H NMR (300 MHz, CDCl3) δ: 0.78 (d, J=6.8 Hz, 3H, CHCH3), 0.97 (d, J=6.9 Hz, 3H, CHCH3), 2.21~2.43 (m, 2H, CH2-cycl.), 2.47~2.56 [m, 1H, CH(CH3)2], 2.68~2.80 (m, 1H, CH-cycl.), 5.27 (s, 1H, C=CH), 11.65 (br s, 1H, OH). HRMS (ESI) calcd for C8H12O2 [M+H+]: 141.0911; found 141.0909
(S)-4-异丙基环戊烷-1, 3-二酮((S)-8):盐酸浓度为2 mol/L, 收率60%. [α]D25-17.6 (c 1.0, CH2Cl2); m.p. 100~102 ℃; 1H NMR (300 MHz, CDCl3) δ: 0.78 (d, J=6.8 Hz, 3H, CHCH3), 0.97 (d, J=6.9 Hz, 3H, CHCH3), 2.19~2.42 (m, 2H, CH2-cycl.), 2.41~2.61 [m, 1H, CH(CH3)2], 2.65~2.86 (m, 1H, CH-cycl.), 5.24 (s, 1H, C=CH), 10.67 (br s, 1H, OH).
3.2.6 中间体11的合成
采用文献[19, 20]方法合成.氮气保护下, 向25 mL两口烧瓶中加入中间体6, 8或(S)-8 (4 mmol)、THF (3 mL)、三乙胺(4.4 mmol), 搅拌下慢慢滴加取代苯甲酰氯(4 mmol)的THF (3 mL)溶液, 滴加完毕后室温搅拌1 h, 薄层色谱(TLC)检测反应完全, 加入10 mL水, 用乙酸乙酯(10 mL×3) 萃取, 合并有机层, 用无水硫酸钠干燥.抽滤, 真空减压旋出溶剂, 柱层析得到酯化产物11(两种异构体的混合物, 无需进一步分离).
4-烯丙基-3-氧代环戊-1-烯4-甲氧基苯甲酸酯和5-烯丙基-3-氧代环戊-1-烯4-甲氧基苯甲酸酯(11a):黄色粘稠液体, 收率91.7%. 1H NMR (300 MHz, CDCl3) δ: 2.01~3.22 (m, 5H, CCH2CHCH2), 3.74~3.87 (m, 3H, OCH3), 4.88~5.17 (m, 2H, CH2=CH), 5.52~5.82 (m, 1H, CH2=CH), 6.21 (s, 0.5H, 0.5C=CH), 6.30 (s, 0.5H, 0.5C=CH), 6.80~6.99 (m, 2H, ArH), 7.85~8.15 (m, 2H, ArH).
4-烯丙基-3-氧代环戊-1-烯4-乙氧基苯甲酸酯和5-烯丙基-3-氧代环戊-1-烯4-乙氧基苯甲酸酯(11b):黄色粘稠液体, 收率96.8%. 1H NMR (400 MHz, CDCl3) δ: 1.27~1.48 (m, 3H, OCH2CH3), 2.07~3.22 (m, 5H, CCH2CHCH2), 3.92~4.14 (m, 2H, OCH2CH3), 4.90~5.15 (m, 2H, CH2=CH), 5.50~5.85 (m, 1H, CH2=CH), 6.23 (s, 0.5H, 0.5C=CH), 6.32 (s, 0.5H, 0.5C=CH), 6.80~7.01 (m, 2H, ArH), 7.82~8.13 (m, 2H, ArH).
4-烯丙基-3-氧代环戊-1-烯2, 4-二甲氧基苯甲酸酯和5-烯丙基-3-氧代环戊-1-烯2, 4-二甲氧基苯甲酸酯(11c):黄色粘稠液体, 收率66.7%. 1H NMR (400 MHz, CDCl3) δ: 2.16~3.27 (m, 5H, CCH2CHCH2), 3.72~4.03 (m, 6H, 2OCH3), 5.03~5.26 (m, 2H, CH2=CH), 5.70~5.89 (m, 1H, CH2=CH), 6.30 (s, 0.5H, 0.5C=CH), 6.40 (s, 0.5H, 0.5C=CH), 6.52~6.63 (m, 2H, ArH), 7.93~8.13 (m, 1H, ArH).
4-烯丙基-3-氧代环戊-1-烯3, 4-二甲氧基苯甲酸酯和5-烯丙基-3-氧代环戊-1-烯3, 4-二甲氧基苯甲酸酯(11d):黄色固体, 收率76.9%. m.p. 60~62 ℃; 1H NMR (300 MHz, CDCl3) δ: 2.18~3.31 (m, 5H, CCH2CHCH2), 3.90~4.03 (m, 6H, 2OCH3), 5.01~5.34 (m, 2H, CH2=CH), 5.68~5.98 (m, 1H, CH2=CH), 6.33 (s, 0.5H, 0.5C=CH), 6.41 (s, 0.5H, 0.5C=CH), 6.90~7.00 (m, 1H, ArH), 7.55~7.62 (m, 1H, ArH), 7.72~7.90 (m, 1H, ArH).
4-烯丙基-3-氧代环戊-1-烯2, 4-二氯苯甲酸酯和5-烯丙基-3-氧代环戊-1-烯2, 4-二氯苯甲酸酯(11e):黄色粘稠液体, 收率75.2%. 1H NMR (400 MHz, CDCl3) δ: 2.15~3.32 (m, 5H, CCH2CHCH2), 5.03~5.23 (m, 2H, CH2=CH), 5.62~5.88 (m, 1H, CH2=CH), 6.34 (s, 0.5H, 0.5C=CH), 6.44 (s, 0.5H, 0.5C=CH), 7.36~7.49 (m, 1H, ArH), 7.49~7.62 (m, 1H, ArH), 7.91~8.02 (m, 1H, ArH).
4-烯丙基-3-氧代环戊-1-烯2-氯-4-甲磺酰基苯甲酸酯和5-烯丙基-3-氧代环戊-1-烯2-氯-4-甲磺酰基苯甲酸酯(11f):黄色粘稠液体, 收率80%. 1H NMR (400 MHz, CDCl3) δ: 2.15~3.21 (m, 5H, CCH2CHCH2), 3.02 (s, 3H, SO2CH3), 4.97~5.18 (m, 2H, CH2=CH), 5.55~5.80 (m, 1H, CH2=CH), 6.30 (s, 0.6H, 0.6C=CH), 6.39 (s, 0.4H, 0.4C=CH), 7.87~7.97 (m, 1H, ArH), 7.96~8.14 (m, 2H, ArH).
4-异丙基-3-氧代环戊-1-烯4-甲氧基苯甲酸酯和5-异丙基-3-氧代环戊-1-烯4-甲氧基苯甲酸酯(11g):黄色粘稠液体, 收率94.6%. 1H NMR (400 MHz, CDCl3) δ: 0.78~1.23 [m, 6H, CH(CH3)2], 2.21~3.34 (m, 4H, CCH2CHCH), 3.92 (s, 3H, OCH3), 6.31 (s, 0.47H, 0.47C=CH), 6.43 (s, 0.53H, 0.53C=CH), 6.85~7.08 (m, 2H, ArH), 7.94~8.24 (m, 2H, ArH).
4-异丙基-3-氧代环戊-1-烯4-乙氧基苯甲酸酯和5-异丙基-3-氧代环戊-1-烯4-乙氧基苯甲酸酯(11h):黄色粘稠液体, 收率78.3%. m.p. 45~47 ℃; 1H NMR (400 MHz, CDCl3) δ: 0.79~0.85 (m, 3H, CHCH3), 0.94~1.02 (m, 3H, CHCH3), 2.18~3.24 (m, 4H, CH3CHCHCH2), 4.13 (q, J=6.8 Hz, 3H, OCH2CH3), 6.31 (s, 0.45H, 0.45C=CH), 6.42 (s, 0.55H, 0.55C=CH), 6.88~7.06 (m, 2H, ArH), 8.00~8.15 (m, 2H, ArH).
4-异丙基-3-氧代环戊-1-烯2, 4-二甲氧基苯甲酸酯和5-异丙基-3-氧代环戊-1-烯2, 4-二甲氧基苯甲酸酯(11i):黄色粘稠液体, 收率90.9%. 1H NMR (400 MHz, CDCl3) δ: 0.79~1.04 [m, 6H, CH(CH3)2], 2.16~3.17 (m, 4H, CCH2CH-CH), 3.86~3.99 (m, 6H, 2OCH3), 6.27 (s, 0.5H, 0.5C=CH), 6.40 (s, 0.5H, 0.5C=CH), 6.48~6.63 (m, 2H, ArH), 7.86~8.05 (m, 1H, ArH).
4S-异丙基-3-氧代环戊-1-烯2, 4-二甲氧基苯甲酸酯和5S-异丙基-3-氧代环戊-1-烯2, 4-二甲氧基苯甲酸酯[(S)-11i]:黄色粘稠液体, 收率80%. [α]D25-5.8 (c 1.0, CH2Cl2); 1H NMR (400 MHz, CDCl3) δ: 0.77~1.07 (m, 6H, CH(CH3)2), 2.17~3.20 (m, 4H, CCH2CHCH), 3.86~4.05 (m, 6H, 2OCH3), 6.27 (s, 0.43H, 0.43C=CH), 6.40 (s, 0.57H, 0.57C=CH), 6.50~6.62 (m, 2H, ArH), 7.93~8.02 (m, 1H, ArH).
3.2.7 目标产物3的合成方法
氮气保护下, 向25 mL的圆底烧瓶中加入11 (2 mmol)、无水乙腈(3 mL)和氰化钠(2.2 mmol), 慢慢滴加入三乙胺(2.2 mmol), 室温搅拌12 h, 搅拌过程中反应液逐渐由澄清变浑浊.加入10 mL 1 mol/L的稀盐酸酸化, 用乙酸乙酯(10 mL×3) 萃取.合并有机层, 用无水硫酸钠干燥.抽滤, 真空减压旋出溶剂, 得到粗产品, 经柱层析得到目标化合物3a~(S)-3i[19].
(Z)-4-烯丙基-2-[(4-甲氧基苯基)(羟基)亚甲基]环戊烷-1, 3-二酮(3a):淡黄色液体, 收率35%. 1H NMR (400 MHz, CDCl3) δ: 2.27~2.32 (m, 1H, CH-cycl.), 2.38~2.66 (m, 2H, CH2CH=CH2), 2.70~3.02 (m, 2H, CH2-cycl.), 3.88 (s, 3H, OCH3), 4.98~5.26 (m, 2H, CH2=CH), 5.62~5.91 (m, 1H, CH2=CH), 6.91~6.99 (m, 2H, ArH), 8.20~8.27 (m, 2H, ArH); 13C NMR (101 MHz, CDCl3) δ: 189.72, 164.65, 134.37, 133.03, 126.35, 117.92, 113.46, 112.07, 55.54, 35.65; IR (KBr) v: 3453, 3078, 2982, 1697, 1601, 1512, 1427, 1410, 1260, 1175, 1025, 843, 763, 750 cm-1. HRMS (ESI) calcd for C16H16O4Na [M+Na+]: 295.0941; found 295.0942.
(Z)-4-烯丙基-2-[(4-乙氧基苯基)(羟基)亚甲基]环戊烷-1, 3-二酮(3b):淡黄色固体, 收率38%. m.p. 40~41 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.45 (t, J=6.8 Hz, 3H, OCH2CH3), 2.19~2.33 (m, 1H, CH-cycl.), 2.34~2.59 (m, 1H, CH2-cycl.), 2.62~2.76 (m, 2H, CH2CH=CH2), 2.88~3.04 (m, 1H, CH2-cycl.), 4.13 (q, J=6.8 Hz, 2H, OCH2CH3), 5.01~5.30 (m, 2H, CH2=CH), 5.67~5.87 (m, 1H, CH2=CH), 6.95 (d, J=8.8 Hz, 2H, ArH), 8.26 (d, J =6.8 Hz, 2H, ArH); 13C NMR (101 MHz, CDCl3) δ: 209.67, 207.28, 200.01, 197.66, 189.76, 164.16, 134.70, 133.94, 133.08, 126.07, 118.21, 117.71, 113.90, 112.00, 63.86, 43.66, 40.44, 39.57, 35.67, 35.00, 14.65; IR (KBr) v: 3453, 3078, 2982, 1697, 1601, 1510, 1427, 1409, 1274, 1260, 1176, 763, 750 cm-1. HRMS (ESI) calcd for C17H19O4 [M+H+]: 278.1278; found 287.1282.
(Z)-4-烯丙基-2-[(2, 4-甲氧基苯基)(羟基)亚甲基]环戊烷-1, 3-二酮(3c):淡黄色液体, 收率34%. 1H NMR (400 MHz, CDCl3) δ: 2.17~2.24 (m, 1H, CH-cycl.), 2.28~2.52 (m, 1H, CH2-cycl.), 2.55~2.68 (m, 2H, CH2CH=CH2), 2.82~3.03 (m, 1H, CH2-cycl.), 3.76 (s, 3H, OCH3), 3.83 (s, 3H, OCH3), 5.05~5.25 (m, 2H, CH2=CH), 5.60~5.78 (m, 1H, CH2=CH), 6.47(s, 1H, ArH), 6.52 (d, J=8.4 Hz, 1H, ArH), 7.40~7.46 (m, 1H, ArH); 13C NMR (101 MHz, CDCl3) δ: 205.75, 203.47, 199.24, 196.85, 190.72, 190.37, 164.75, 160.53, 134.86, 133.95, 132.07, 131.91, 118.16, 118.11, 117.95, 117.52, 114.30, 114.13, 104.89, 98.39, 98.31, 43.69, 39.55, 39.52, 35.59, 35.50, 34.03; IR (KBr) v: 3461, 2942, 2839, 1706, 1599, 1465, 1412, 1264, 1212, 1162, 1029, 833, 763, 750 cm-1. HRMS (ESI) calcd for C17H19O5 [M+H+]: 303.1227; found 303.1225.
(Z)-4-烯丙基-2-[(3, 4-甲氧基苯基)(羟基)亚甲基]环戊烷-1, 3-二酮(3d):淡黄色固体, 收率33%. m.p. 80~82 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.26~2.60 (m, 2H, CHCH2-cycl.), 2.67~2.73 (m, 2H, CH2CH=CH2), 2.89~3.09 (m, 1H, CH2-cycl.), 3.97 (s, 6H, 2OCH3), 5.01~5.22 (m, 2H, CH2=CH), 5.60~5.93 (m, 1H, CH2=CH), 6.95 (d, J=8.8 Hz, 1H, ArH), 7.90~8.10 (m, 2H, ArH); 13C NMR (101 MHz, CDCl3) δ: 209.86, 207.32, 200.01, 197.70, 189.76, 189.30, 154.46, 154.40, 148.35, 148.33, 134.61, 133.86, 126.49, 126.35, 125.88, 125.85, 118.22, 117.69, 113.02, 112.87, 112.23, 112.17, 110.05, 110.00, 56.06, 56.02, 43.60, 40.35, 39.51, 35.69, 35.65, 34.88; IR (KBr) v: 3438, 2943, 2840, 1696, 1596, 1516, 1264, 1144, 1021, 764, 750 cm-1. HRMS (ESI) calcd for C17H19O5 [M+H+]: 303.1227; found 303.1224.
(Z)-4-烯丙基-2-[(2, 4-二氯苯基)(羟基)亚甲基]环戊烷-1, 3-二酮(3e):淡黄色液体, 收率45 %. 1H NMR (400 MHz, CDCl3) δ: 2.15~3.2 (m, 5H, CH-cycl., CH2-cycl. CH2CH=), 5.00~5.26 (m, 2H, CH2=CH), 5.61~5.86 (m, 1H, CH2=CH), 7.23~7.37 (m, 2H, ArH), 7.45 (s, 1H, ArH), 12.47 (br s, 1H, OH); 13C NMR (101 MHz, CDCl3) δ: 205.24, 203.07, 199.12, 196.63, 192.39, 192.17, 137.59, 134.34, 134.22, 134.11, 133.22, 132.56, 130.08, 129.97, 129.86, 127.00, 118.80, 117.98, 114.64, 114.38, 43.78, 39.31, 39.23, 35.50, 35.06, 33.50; IR (KBr) v: 3462, 3006, 2990, 1710, 1610, 1586, 1411, 1339, 1275, 1260, 1094, 897, 763, 750 cm-1. HRMS (ESI) calcd for C15H13Cl2O3 [M+H+]: 311.0236; found 311.0238.
(Z)-4-烯丙基-2-[(2-氯-4-甲磺酰基苯基)(羟基)亚甲基]环戊烷-1, 3-二酮(3f):淡黄色液体, 收率34%. 1H NMR (400 MHz, CDCl3) δ: 2.14~2.38 (m, 1H, CH-cycl.), 2.38~2.53 (m, 1H, CH2-cycl.), 2.53~2.81 (m, 2H, CH2CH=CH2), 2.97~3.18 (m, 4H, CH2-cycl., SO2CH3), 4.90~5.34 (m, 2H, CH2=CH), 5.57~5.87 (m, 1H, CH2=CH), 7.45 (d, J=6.0 Hz, 1H, ArH), 7.85 (d, J=7.6 Hz, 1H, ArH), 7.94 (s, 1H, ArH), 11.83 (br s, 1H, OH); 13C NMR (101 MHz, CDCl3) δ: 205.35, 203.09, 199.86, 197.68, 191.86, 165.59, 143.94, 143.22, 140.94, 134.99, 134.71, 134.07, 132.48, 132.37, 129.78, 129.60, 128.59, 125.64, 125.46, 118.28, 114.51, 44.27, 44.17, 43.69, 39.15, 35.00, 33.41; IR (KBr) v: 3453, 3078, 3007, 2925, 1707, 1618, 1563, 1433, 1410, 1276, 1261, 1154, 763, 750 cm-1. HRMS (ESI) calcd for C16H16ClO5S [M+H+]: 355.0401; found 355.0405.
(Z)-4-异丙基-2-((4-甲氧基苯基)(羟基)亚甲基)环戊烷-1, 3-二酮(3g):淡黄色液体, 收率47%. 1H NMR (400 MHz, CDCl3) δ: 0.77~1.18 [m, 6H, CH(CH3)2], 2.25~3.06 (m, 4H, CCH2CHCH), 3.88 (s, 3H, OCH3), 6.96 (d, J=8.8 Hz, 2H, ArH), 8.24 (t, J=7.6 Hz, 2H, ArH); 13C NMR (101 MHz, CDCl3) δ: 209.75, 207.44, 200.52, 198.11, 189.98, 164.57, 132.97, 130.91, 128.83, 126.64, 113.44, 112.97, 65.39, 55.52, 50.15, 46.61, 36.13, 31.19, 30.57, 28.88, 28.56, 20.71, 20.44, 19.19, 17.15, 16.73, 13.73; IR (KBr) v: 3461, 3084, 2960, 1698, 1601, 1513, 1462, 1425, 1260, 1175, 1026, 844, 763, 750 cm-1. HRMS (ESI) calcd for C16H18O4Na [M+Na+]: 297.1097; found 297.1103.
(Z)-4-异丙基-2-[(4-乙氧基苯基)(羟基)亚甲基]环戊烷-1, 3-二酮(3h):淡黄色液体, 收率58 %. 1H NMR (400 MHz, CDCl3) δ: 0.68~1.16 (m, 6H, CH(CH3)2), 1.44 (t, J=6.8 Hz, 3H, OCH2CH3), 2.25~3.10 (m, 4H, CCH2CHCH), 4.11 (q, J=6.8 Hz, 2H, OCH2CH3), 6.94 (d, J=8.8 Hz, 2H, ArH), 8.24 (d, J=8.8 Hz, 2H, ArH); 13C NMR (101 MHz, CDCl3) δ: 209.79, 207.34, 200.92, 198.16, 189.81, 164.06, 133.01, 126.31, 113.86, 112.91, 63.83, 50.14, 46.63, 36.11, 31.24, 28.84, 20.46, 17.11, 14.64; IR (KBr) v: 3453, 2960, 2930, 1698, 1602, 1512, 1427, 1311, 1258, 1176, 1040, 763, 750 cm-1. HRMS (ESI) calcd for C17H21O5Na [M+H+]: 289.1434; found 289.1441.
(Z)-4-异丙基-2-[(2, 4-甲氧基苯基)(羟基)亚甲基]环戊烷-1, 3-二酮(3i):淡黄色液体, 收率36%. 1H NMR (400 MHz, CDCl3) δ: 0.66~1.21 (m, 6H, CH(CH3)2), 2.19~3.04 (m, 4H, CCH2CHCH), 3.77 (s, 3H, OCH3), 3.84 (s, 3H, OCH3), 6.47 (t, J=2.4 Hz, 1H, ArH), 6.53 (dd, J=8.0, 2.0 Hz, 1H, ArH), 7.43 (t, J=8.0 Hz, 1H, ArH); 13C NMR (101 MHz, CDCl3) δ: 205.67, 204.02, 199.74, 197.40, 190.96, 190.72, 164.66, 160.48, 131.93, 131.88, 118.42, 118.29, 115.20, 114.99, 104.82, 98.39, 98.31, 55.64, 55.58, 55.49, 50.34, 45.75, 36.09, 30.38, 28.84, 28.39, 20.74, 20.38, 17.11, 16.70; IR (KBr) v: 3452, 2960, 1706, 1600, 1465, 1433, 1263, 1212, 1162, 1030, 763, 750 cm-1. HRMS (ESI) calcd for C17H21O5 [M+H+]: 305.1384; found 305.1389.
(S)-(Z)-4-异丙基-2-[(2, 4-甲氧基苯基)(羟基)亚甲基]环戊烷-1, 3-二酮(S-3i):淡黄色液体, 收率49 %. [α]D25-4.4 (c 1.0, CH2Cl2); 1H NMR (400 MHz, CDCl3) δ: 0.74~1.44 (m, 6H, CH(CH3)2), 2.16~2.99 (m, 4H, CCH2CHCH), 3.80 (s, 3H, OCH3), 3.88 (s, 3H, OCH3), 6.50 (s, 1H, ArH), 6.56 (d, J=8.4, 1H, ArH), 7.46 (d, J=7.6 Hz, 1H, ArH); 13C NMR (101 MHz, CDCl3) δ: 204.74, 203.07, 198.63, 196.30, 191.17, 163.65, 160.88, 159.46, 156.02, 130.91, 121.09, 117.37, 116.23, 114.06, 103.80, 102.03, 97.37, 54.61, 54.49, 49.33, 44.78, 35.07, 29.37, 27.81, 27.41, 19.74, 16.07; IR (KBr) v: 3452, 2960, 1706, 1599, 1464, 1432, 1263, 1212, 1162, 1030, 764, 750 cm-1. HRMS (ESI) calcd for C17H21O5 [M+H+]: 305.1384; found 305.1388.
3.3 除草活性测定
油菜平皿法[10]:直径6 cm的培养皿中铺好一张直径5.6 cm的滤纸, 加入2 mL一定浓度的供试化合物溶液, 播种浸种4~6 h的油菜种子15粒, 30 ℃下, 黑暗培养66 h后测定胚根长度.通过黑暗条件下化合物对油菜胚根的生长抑制来检测化合物的除草活性.结果列入表 1.
稗草小杯法:通过光照条件下化合物对稗草幼苗株高的生长抑制来检测化合物的除草活性.活性指标:株高生长抑制率(%).结果列入表 1.
土壤处理:在直径8 cm的塑料小杯中放入一定量的土, 加入一定量的水, 播种后覆盖一定厚度的土壤, 于花房中培养, 幼苗出土前以塑料覆盖.每天加以定量的清水以保持正常生长.处理剂量见表.土壤处理(出苗前). 12 d后调查结果, 测定地上部鲜重, 以鲜重抑制百分数来表示药效.结果列入表 2.
茎叶处理:在直径8 cm的塑料小杯中放入一定量的土, 加入一定量的水, 播种后覆盖一定厚度的土壤, 于花房中培养, 幼苗出土前以塑料覆盖.每天加以定量的清水以保持正常生长.当幼苗长到一定时期进行茎叶喷雾处理.处理剂量见表.处理21 d后调查结果, 测定地上部鲜重, 以鲜重抑制百分数来表示药效.结果列入表 2.
辅助材料(Supporting Information) 产物3的核磁共振谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
朱有全, 胡方中, 杨华铮, 徐海珍, 化学通报, 2004, 67, w08/1-7. http://d.wanfangdata.com.cn/Periodical/hxtb200401018Zhu, Y.-Q.; Hu, F.-Z.; Yang, H.-Z.; Xu, H.-Z. Chemistry 2004, 67, w08/1-7. http://d.wanfangdata.com.cn/Periodical/hxtb200401018
-
[2]
Wang, D.-W.; Lin, H.-Y.; Cao, R.-C.; Chen, T.; Wu, F.-X.; Hao, G.-F.; Chen, Q.; Yang, W.-C.; Yang, G.-F. J. Agric. Food Chem. 2015, 63, 5587. doi: 10.1021/acs.jafc.5b01530
-
[3]
Wang, D.-W.; Lin, H.-Y.; Cao, R.-J.; Yang, S.-G.; Chen, Q.; Hao, G.-F.; Yang, W.-C.; Yang, G.-F. J. Agric. Food Chem. 2014, 62, 11786. doi: 10.1021/jf5048089
-
[4]
Wang, D.-W.; Lin, H.-Y.; Cao, R.-J.; Ming, Z.-Z.; Hao, G.-F.; Yang, W.-C.; Yang, G.-F. Pest Manage Sci 2015, 71, 1122. doi: 10.1002/ps.2015.71.issue-8
-
[5]
Wang, D.-W.; Lin, H.-Y.; He, B.; Wu, F.-X.; Chen, T.; Chen, Q.; Yang, W.-C.; Yang, G.-F. J. Agric. Food Chem. 2016, 64, 8986. doi: 10.1021/acs.jafc.6b04110
-
[6]
Jones, R. C. F.; Begley, M. J.; Peterson, G. E.; Suresh, S. J. Chem. Soc., Perkin Trans. 11990, 1959.
-
[7]
MacKelfar, F. A.; Grostic, M. F.; Olson, E. C.; Wnuk, R. J.; Branfman, A. R.; Rinehart, K. R. J. Am. Chem. Soc. 1971, 93, 4943. doi: 10.1021/ja00748a067
-
[8]
朱有全, 胡方中, 邹小毛, 姚昌盛, 刘斌, 李永红, 杨华铮, 有机化学, 2005, 25, 419. doi: 10.3321/j.issn:0253-2786.2005.04.011Zhu, Y.-Q.; Hu, F.-Z.; Zou, X.-M.; Yao, C.-S.; Liu, B.; Li, Y.-H.; Yang, H.-Z. Chin. J. Org. Chem. 2005, 25, 419. doi: 10.3321/j.issn:0253-2786.2005.04.011
-
[9]
Zhu, Y.-Q.; Yao, C.-S.; Zou, X.-M.; Hu, F.-Z.; Liu, B.; Li, Y.-H.; Yang, H.-Z. Molecules 2005, 10, 427. doi: 10.3390/10020427
-
[10]
Zhu, Y.-Q.; Zou, X.-M.; Hu, F.-Z.; Yao, C.-S.; Liu, B.; Li, Y.-H.; Yang, H.-Z. J. Agric. Food Chem. 2005, 53, 9566. doi: 10.1021/jf051510l
-
[11]
朱有全, 司学凯, 邹小毛, 刘斌, 杨华铮, 有机化学, 2007, 27, 385. doi: 10.3321/j.issn:0253-2786.2007.03.011Zhu, Y.-Q.; Si, X.-K.; Zou, X.-M.; Liu, B.; Yang, H.-Z. Chin. J. Org. Chem. 2007, 27, 385. doi: 10.3321/j.issn:0253-2786.2007.03.011
-
[12]
朱有全, 朱然, 袁燕伟, 张金, 王文虎, 邹小毛, 胡方中, 刘向明, 杨华铮, 有机化学, 2010, 30, 1027. http://sioc-journal.cn/Jwk_yjhx//CN/abstract/abstract339241.shtmlZhu, Y.; Zhu, R.; Yuan, Y.; Zhang, J.; Wang, W.; Zou, X.; Hu, F.; Liu, X.; Yang, H. Chin. J. Org. Chem. 2010, 30, 1027(in Chi-nese). http://sioc-journal.cn/Jwk_yjhx//CN/abstract/abstract339241.shtml
-
[13]
苏少泉, 农药, 2006, 45, 721. doi: 10.3969/j.issn.1006-0413.2006.11.001Su, S.-Q. Agrochemicals 2006, 45, 721. doi: 10.3969/j.issn.1006-0413.2006.11.001
-
[14]
Fried, J. WO 8101002, 1981[Chem. Abstr. 1981, 95, 168635].
-
[15]
Iimura, S.; Overman, L. E.; Paulini, R.; Zakarine, A. J. Am. Chem. Soc. 2006, 128. 13095. doi: 10.1021/ja0650504
-
[16]
Dai, W.; Katzenellenbogen, J. A. J. Org. Chem. 1993, 58, 1900. doi: 10.1021/jo00059a049
-
[17]
Morita, Y.; Suzuki, M.; Noyori, R. J. Org. Chem. 1989, 54, 1785. doi: 10.1021/jo00269a006
-
[18]
Stork, G.; Danheiser, R. L. J. Org. Chem. 1973, 38, 1775. doi: 10.1021/jo00949a048
-
[19]
Kim, T. H.; Oh, D. R.; Na, H. S. Arch. Pharm. Res. 2003, 26, 192. doi: 10.1007/BF02976828
-
[20]
Hang, C.-Y.; Liu, X.-H.; Wang, B.-L.; Li, Z.-M. Chem. Biol. Drug Des. 2010, 75, 489. doi: 10.1111/jpp.2010.75.issue-5
-
[1]
-
表 1 化合物3a~(S)-3i的除草活性(抑制率/%)a
Table 1. Herbicidal activities (inhibition rate/%) of compounds 3a~(S)-3i
化合物 R1 R2 油菜 稗草 10 mg•L-1 100 mg•L-1 10 mg•L-1) 100 mg•L-1 3a 4-OCH3 Allyl 0 85.1 10.0 45.0*** 3b 4-OCH2CH3 Allyl 21.6 82.0 5.0 30.0*** 3c 2, 4-Dimethoxy Allyl 0 58.2 5.0 13.0** 3d 3, 4-Dimethoxy Allyl 46.4 52.2 5.0 10.0* 3e 2, 4-Dichloro Allyl 28.5 66.1 5.0* 10.0*** 3f 2-Cl-4-SO2CH3 Allyl 10 86.3 0 10.0* 3g 4-OCH3 Isopropyl 0 86.4 0 25.2* 3h 4-OCH2CH3 Isopropyl 9.1 90.0 12.8 46.0* 3i 2, 4-Dimethoxy Isopropyl 0 70.8 5.0 30.2* (S)-3i 2, 4-Dimethoxy Isopropyl (S) 0 68.4 0 17.8* a*轻微褪绿白化, **褪绿白化, ***白化. 表 2 化合物3a~(S)-3i的除草活性(抑制率/%)
Table 2. Herbicidal activities of compounds 3a~(S)-3i (inhibition rate/%)
化合物 剂量/(g•ha-1) 油菜 苋菜 稗草 马唐 土壤 茎叶 土壤 茎叶 土壤 茎叶 土壤 茎叶 3a 1500 88.0 100.0 60.5 37.6 70.8 65.1 55.3 45.5 3b 1500 16.3 40.1 40.6 23.7 19.6 30.0 30.1 43.9 3c 1500 75.0 34.3 80.5 30.1 40.0 65.7 32.4 61.3 3d 1500 87.9 15.6 50.0 100 10.5 75.8 10.9 100 3e 1500 93.9 98.2 71.2 35.0 62.5 10.0 10.0 30.0 3f 1500 94.5 93.5 91.2 40.0 10.0 45.0 25.0 35.0 3g 1500 35.1 10.3 20.1 11.4 23.2 11.5 64.9 76.2 3h 1500 20.8 11.0 21.1 10.0 16.3 8.9 37.4 50.6 3i 1500 26.3 12.4 22.5 50.1 48.9 30.4 74.8 82.1 (S)-3i 1500 61.4 18.1 30.6 75.6 24.0 28.7 31.0 84.6 2[10] 750 — — — — 100 — 93 — 磺草酮 750 100 100 100 99.1 100 100 100 100 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1931
- HTML全文浏览量: 273


 下载:
下载:



 下载:
下载:

