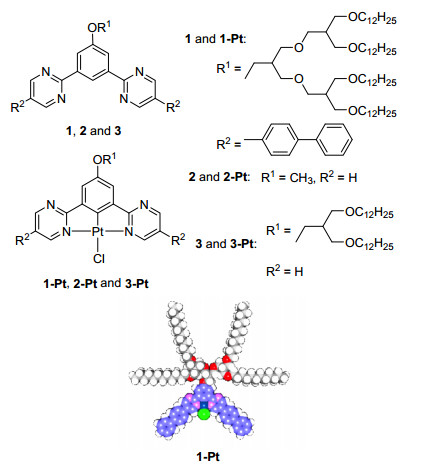
 图1
化合物1, 2, 3, 1-Pt, 2-Pt和3-Pt的分子结构及1-Pt的CPK模型图
Figure1.
Molecular structures of 1, 2, 3, 1-Pt, 2-Pt, 3-Ptand CPK model of 1-Pt
图1
化合物1, 2, 3, 1-Pt, 2-Pt和3-Pt的分子结构及1-Pt的CPK模型图
Figure1.
Molecular structures of 1, 2, 3, 1-Pt, 2-Pt, 3-Ptand CPK model of 1-Pt

Citation: Yang Lei, Hu Jiena, Zeng Wang, Wu Yang, Li Xianying, Zhang Dengqing, Jin Wusong. Synthesis, Self-Assemble and Fluorescence of Pyrimidine-Contained Novel Rod-Coil Structured N^C^N-Type Divalent Platium Complexes[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2647-2654. doi: 10.6023/cjoc201704035

含嘧啶环的新型棒-线状N^C^N型二价铂配合物的合成及其自组装和荧光性能的表征
English
Synthesis, Self-Assemble and Fluorescence of Pyrimidine-Contained Novel Rod-Coil Structured N^C^N-Type Divalent Platium Complexes
-
Key words:
- pyrimidine
- / rod-coil structure
- / platinum(Ⅱ) complex
- / self-assembly
- / fluorescence
-
钳形金属配合物(pincer-type metal complex)由于具有独特的结构而逐渐成为金属有机化学的一个重要分支.近年来, 钳形金属配合物用于催化脱氢反应[1]、氢转移反应、Heck反应[2]、Suzuki偶联反应, Diels-Alder反应、Henry反应[3]、C—O键活化、C—C活化[3]及捕捉中间体及特殊分子的报道层出不穷.钳形配体通常是指E^C^E (E, C为任何可与金属配位的原子)结构的化合物, 处于芳基2, 6邻位的给电子体原子及芳基或烷基上的原子以供体-受体的键合方式连接到金属中心, 进而形成一个类似于钳形的金属鳌合物.处于芳环对位的基团不但可用于[ECE]-M单元体的构建, 还可以进行功能化修饰, 如联结生物活性基团.另外, 利用杂原子取代基的大小、相异还可调控金属中心的立体空间和手性特征[4].有些钳形金属配合物具有很高的生物活性, 可以作为药物试剂; 含Pt、Pd、Ir等的钳形金属配合物具有发光性能, 可以应用于光电材料生产, 显示出诱人的应用前景.在已见报道的N^C^N(氮碳氮)型[5, 6]、N^N^N(氮氮氮)型[7, 8]、P^C^P(磷碳磷)型[9]、P^C^O(磷碳氧)型等诸多三齿钳形配体中, 引入N杂原子的含氮配体备受关注, 不仅能够增加有机配体的功能性, 而且其与金属配位的能力较强[10], 易通过改变中心金属和配体结构调节催化活性和选择性.例如:通过改变钳形金属配合物芳环上与金属处于对位的R基团, 可以调整钳形配体的电子效应; 如果R基团是活性官能团, 如NH、COON、OH等, 则可能与其它化合物反应从而得到新的用途.由于含氮钳形金属配合物的这些特点, 使其得到广泛的青睐, 但是大部分含氮三齿配体, 尤其是N^C^N型三齿配体还是仅限于双吡啶[11]、双亚胺[12]、双噁唑啉[13]以及双(二烷基胺甲基)类手性配体[14]的应用, 而对于带有嘧啶的N^C^N型配体的应用还鲜有报道.由于嘧啶能形成配位键和氢键, 有利于分子间通过配位键和氢键等非共价键相互作用自组装形成伸展的超分子化合物, 因而开发一种新型的含嘧啶基团的N^C^N型配体, 研究它们的自组装及发光等性能对配位化学、超分子化学及材料科学等相关学科的发展具有重要的科学意义.
在众多自组装体系中, 含有功能性刚性棒和柔性线团的棒-线(Rod-Coil)型分子备受关注.通过刚性基元的π-π相互作用以及柔性链段与刚性棒的微相分离作用, 这类分子可以自组装形成如一维柱状、二维层状、分散棒束或囊泡[15~23]等多种纳米尺度结构, 是构筑超分子体系的有效途径之一.由于基元分子的化学结构决定了自组装后超分子的尺寸、形貌以及相应的宏观性质, 因而精确地设计柔性链体积分数、分子长度、柔性链横截面积、刚性棒形状[24~26]以及调控这些参数之间的协同作用都成为当前该领域的重要研究方向.本研究基于棒-线型分子和N^C^N三齿配体的理念, 设计合成了能够与过渡金属铂(Pt)配位的、由嘧啶环提供N原子的新型棒-线型N^C^N配体.结构如图 1中1所示, 两个嘧啶环各提供一个氮原子与苯环上C—O键对位的碳原子构成V型的刚性结构(棒性部分), 作为N^C^N型三齿钳形配体的三个电子给体.与我们前期研究中合成的2和3[27]相比较, 为了增加自组装过程中分子间刚性芳环的π-π堆积作用, 我们将刚性骨架两端同时延长.另外, 考虑到柔性链段数目的增加不仅可以提高分子的溶解度, 更易导致微相分离而有利于形成自组装体, 我们在柔性链处引入了四条疏水性烷基链, 从而合成了含三齿N^C^N配体的棒-线型化合物1.另一方面, 在各类重金属配合物中, 二价铂配合物具有四配位基的平面四方形结构和优异的光电物理性质[28, 29], 在有机电致发光器件、生物和化学传感器、细胞成像和超分子自组装等领域具有非常好的应用前景.在此, 我们以铂为配位中心金属离子, 以含有嘧啶基团的棒-线型化合物1为三齿配体合成了二价铂(PtII)配合物1-Pt, 并通过核磁、紫外、荧光、荧光显微镜、电子显微镜等分析测试手段对配合物的结构、光学性质进行研究, 并对其自组装行为对发光性能的影响进行了探讨.
 图1
化合物1, 2, 3, 1-Pt, 2-Pt和3-Pt的分子结构及1-Pt的CPK模型图
Figure1.
Molecular structures of 1, 2, 3, 1-Pt, 2-Pt, 3-Ptand CPK model of 1-Pt
图1
化合物1, 2, 3, 1-Pt, 2-Pt和3-Pt的分子结构及1-Pt的CPK模型图
Figure1.
Molecular structures of 1, 2, 3, 1-Pt, 2-Pt, 3-Ptand CPK model of 1-Pt
1 结果与讨论
1.1 合成
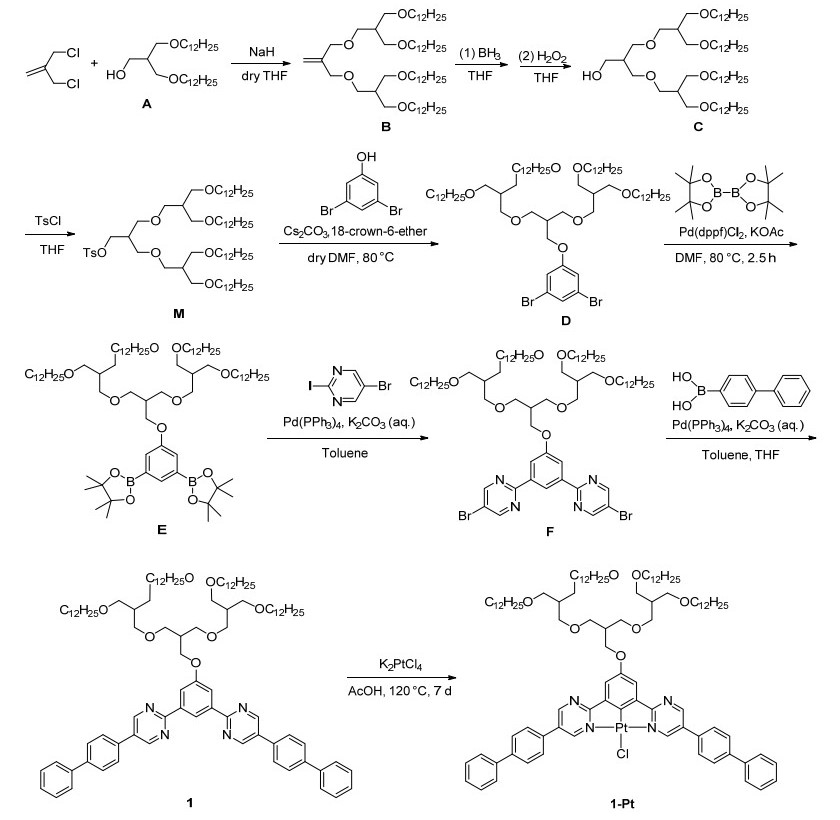
最近我们合成了新型含有嘧啶基团的N^C^N型三齿钳形铂(PtII)配合物2-Pt和3-Pt[27], 在研究其在溶液中的自组装性能时发现, 由于分子在有机溶液中溶解性较差及分子间π-π相互作用较弱, 无法通过自下而上的自组装策略来调控其在溶液中的自组装行为, 从而制约了对其发光性能的探究.为此在前期研究的基础之上采取延长共轭骨架及增加柔性侧链的分子设计, 赋予分子棒-线型结构, 希望得到具有良好溶解性及分子间相互作用的二价铂配合物来研究其在溶液中的发光性能、自组装性质以及相互之间的关系.柔性侧链A的合成可参照文献[30]合成得到, 含嘧啶分子1的棒状共轭骨架的合成是以3, 5-二溴苯酚为起始反应物, 按Scheme 1所示的合成路线进行.首先在3, 5-二溴苯酚上引入柔性侧链得到化合物B之后, 在Pd(dppf)Cl2催化下与双频哪醇合二硼反应得到中间体C, 经柱层析和凝胶渗透色谱(GPC)分离提纯后, C与5-溴-2-碘嘧啶通过钯催化的Suzuki偶联反应, 利用碘与溴的反应性差异选择性地在嘧啶2-位发生偶联, 得到化合物D.化合物D与联苯硼酸再次通过Suzuki偶联反应将刚性部分延长, 得到目标三齿配体化合物1. 1与K2PtCl4在无水乙酸溶剂中回流7 d得到棕色粘稠性固体1-Pt.
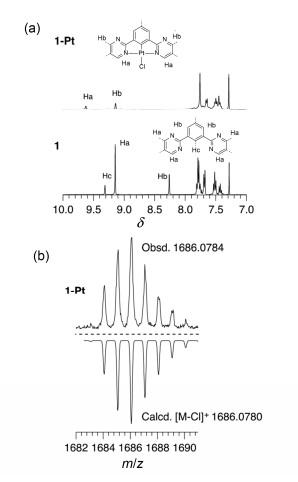
对比配体化合物1以及其铂配合物1-Pt的核磁氢谱(图 2a)可以发现, 嘧啶及中间苯环上氢的核磁信号发生了明显的变化. 1与Pt配位后, 1中δ 9.15附近嘧啶环上的两个氢的化学位移, 在形成1-Pt之后分裂成两组信号, 分别出现在δ 9.17和9.69, 这是由于铂与嘧啶配位后导致环上两个氢的化学环境发生变化所致.同时, 1中δ 9.32附近归属于中间苯环上氢的核磁信号在配位后消失. (N^C^N)PtCl型铂二价三齿配合物在基质辅助激光解析飞行质谱中经常会出现失去一个氯的离子峰[27], 1-Pt的高分辨MALDI-TOF/TOF质谱测试结果表明(图 2b), 在m/z 1686.0784处出现失去一个氯的[M-Cl]+离子峰, 不仅与计算机模拟的峰形吻合, 而且与理论计算值([M-Cl]+) m/z 1686.0780十分相近, 也说明Pt成功与配体1配位.由于在分子中引入了4条柔性侧链, 化合物1-Pt在有机溶剂中展示了良好的溶解性, 为进一步研究其溶液中的光谱性质及自组装性能提供了良好的实验基础.
1.2 光谱性质和自组装
二价铂配合物的发光性质不仅与分子中配体与铂之间的相互作用有关, 还与分子间相互作用的形式和强弱密切相关, 如分子间是否存在强π-π堆积而引起激基缔合物(excimer)的发射峰、亦或是强Pt…Pt相互作用形成二聚(dimer)或低聚体(oligomer)而产生的发射峰等.由于这些相互作用会导致紫外及荧光光谱的显著变化, 并且峰的特征较为明显, 因此我们利用光谱学知识对所合成配合物1-Pt的电荷转移状态, 如1MLCT (metal-to-ligand charge transfer)或LC (ligand centered charge transfer)及对应的发光性能进行了表征.在二氯甲烷溶液中, 1-Pt (1×10-4 mol/L)的紫外光谱如图 3a所示, 通过与配体1 (1×10-4 mol/L)的吸收光谱(图 3a中插图)相对照可以确认, 低于370 nm的高能区域中的吸收归属于共轭有机配体内的1π-π*跃迁. 1-Pt在370~400 nm区间出现强度较弱的吸收, 但覆盖于320 nm为中心的宽吸收带内.与相同浓度时的2-Pt吸收峰相比较, 可见二氯甲烷中2-Pt在370~400 nm区间有清晰的吸收峰, 其归属于金属与配体之间电荷转移跃迁[1MLCT-(5d)Pt→π* (N^C^N)][27].考虑到1-Pt和2-Pt的分子结构的差异, 1-Pt中370~400 nm区间的吸收应归功于配体内、金属与配体之间电荷转移跃迁的共同影响.在1-Pt和2-Pt的紫外光谱中都清晰地存在着以450 nm为中心的吸收峰, 其归属于3ILCT (triplet intraligand charge-transfer)状态和与二价铂相关的3MLCT状态的混合作用[27].由于PtII的强自旋-轨道耦合(Spin-Orbit Coupling)作用, 使得3MLCT态混有金属到配体的电荷转移单重态跃迁1MLCT, 在2-Pt中表现为此范围内的吸收强度明显强于350~400 nm区间的吸收.相比较而言, 这个以450 nm为中心的吸收峰在1-Pt的二氯甲烷溶液中则呈现出不同的特点, 可能是由于配体的共轭体系较大, 吸收峰变得相对平缓, 而且相比于2-Pt在二氯甲烷溶液中的吸收, 波长红移了约15 nm (450→465 nm).值得一提的是, 随着浓度的增大, 二者的紫外吸收强度都有所增强.当浓度增大到10-3mol/L, 1-Pt在二氯甲烷中出现浑浊现象, 而溶解性差的2-Pt则开始产生沉淀.但即使在此浓度下, 二者的紫外吸收峰中都没有出现低能量区域的3MMLCT (metal-metal-to-ligand charge-transfer)峰, 说明相邻的分子之间没有发生Pt…Pt相互作用. 2-Pt的单晶衍射结果(图 2b)显示出2-Pt具有近似平面的结构, 在单晶中分子间Pt…Pt之间的距离为4.22 [27], 表明分子间几乎没有Pt…Pt相互作用.因此可以认为在二氯甲烷中, 由3ILCT和3MLCT所引发的吸收峰在2-Pt和1-Pt分子中的区别, 即发生的红移现象(450→465 nm), 应归功于1-Pt中配体的共轭结构的延长所导致.
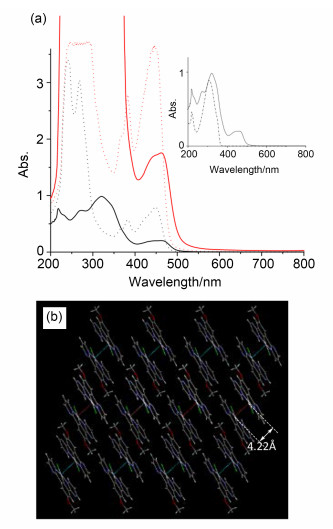 图3
(a) 浓度为1×10-4mol/L(黑)和5×10-4mol/L(红)的1-Pt(实线)和2-Pt(虚线)在二氯甲烷中的UV-vis吸收谱图[内部插图为二氯甲烷中配体1 (1×10-4mol/L, 虚线)与1-Pt (1×10-4mol/L, 实线)的UV-vis吸收光谱对照图]及(b) 2-Pt单晶结构中的二聚体聚合形态
Figure3.
(a) UV-Vis absorption spectra of 1-Pt (solid curve) and 2-Pt (dotted curve) with 1×10-4mol/L (black) and 5×10-4mol/L (red) in CH2Cl2 [inset: UV-vis comparison of 1 (1×10-4mol/L in CH2Cl2, dotted curve) and 1-Pt (1×10-4mol/L in CH2Cl2, solid curve] and (b) the aggregation of dimeric structures in the single crystal 2-Pt
图3
(a) 浓度为1×10-4mol/L(黑)和5×10-4mol/L(红)的1-Pt(实线)和2-Pt(虚线)在二氯甲烷中的UV-vis吸收谱图[内部插图为二氯甲烷中配体1 (1×10-4mol/L, 虚线)与1-Pt (1×10-4mol/L, 实线)的UV-vis吸收光谱对照图]及(b) 2-Pt单晶结构中的二聚体聚合形态
Figure3.
(a) UV-Vis absorption spectra of 1-Pt (solid curve) and 2-Pt (dotted curve) with 1×10-4mol/L (black) and 5×10-4mol/L (red) in CH2Cl2 [inset: UV-vis comparison of 1 (1×10-4mol/L in CH2Cl2, dotted curve) and 1-Pt (1×10-4mol/L in CH2Cl2, solid curve] and (b) the aggregation of dimeric structures in the single crystal 2-Pt
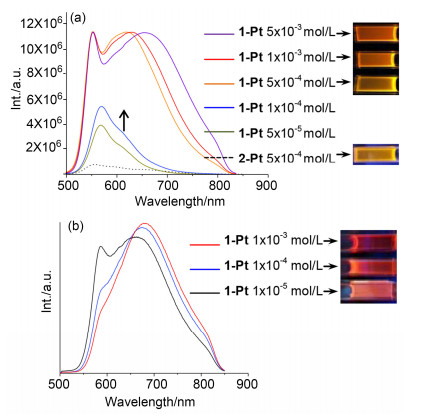
1-Pt和2-Pt的二氯甲烷溶液荧光光谱中(图 4a), 当以465 nm波长激发时, 二者在500~850 nm区间都显示了发射峰.相同浓度下(5×10-4mol/L), 含有更大共轭结构的1-Pt分子的发射峰强度明显强于2-Pt的强度.其中500~600 nm处的较强的发射峰归属于1-Pt和2-Pt的单体发射[27].在二者中都可观察到一个波长在600 nm以上的发射峰, 1-Pt中更为明显.随着1-Pt浓度的增大, 此发射峰逐渐增强并伴随着最大发射波长的红移现象, 发射带可覆盖600~850 nm的区域, 显著的宽峰说明1-Pt在二氯甲烷中发生了分子聚集.在365 nm紫外灯照射下, 1-Pt的二氯甲烷溶液的荧光对应地显示了从亮黄到橙黄的变化趋势.考虑到在紫外吸收光谱中并未出现3MMLCT的吸收峰, 因而荧光光谱中的600~850 nm范围内的发射峰应该是归属于1-Pt配体分子间的π-π堆叠而产生的激基缔合物的发光.
有趣的是, 化合物1-Pt的发光性质可以通过溶剂效应进一步进行调控, 例如在非极性的环己烷溶液中(图 4b)随浓度的增大, 单体的发射峰逐渐弱化, 而主要显示为由分子堆积产生的激基缔合物(excimer)的发射峰.在相同浓度(1×10-3mol/L)下, 与二氯甲烷中的1-Pt的最大发射波长为650 nm相比, 在环己烷中1-Pt的最大发射波长为685 nm, 红移现象非常明显, 溶液中荧光已经呈深红色.说明在高浓度下, 1-Pt在环己烷中的聚集现象更加明显.
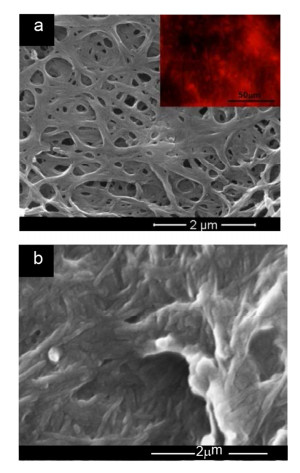
通过以上紫外和荧光光谱的讨论发现, 1-Pt在二氯甲烷和环己烷溶液中浓度高时都有聚集的现象出现, 导致产生发射波长的红移, 而且在这两种溶剂中聚集导致的红移程度不同, 因此我们对其在溶液中的自组装性能及发光性质做了进一步研究.由于引入了四条柔性长链, 1-Pt在有机溶剂中显示了良好的溶解性能.通过超声、加热, 使1-Pt (1.0 mg/mL)分别完全溶解于二氯甲烷、环己烷、正己烷、甲苯、四氢呋喃等溶剂中, 在25 ℃静置24 h后发现在二氯甲烷、环己烷两种溶剂中产生了絮状沉淀.沉淀在扫描电镜(FE-SEM)下的图像如图 5所示, 在二氯甲烷中1-Pt的自组装体呈现宽度约为150 nm的长纤维状结构, 这些纤维状结构随机交叠缠绕进一步形成疏松的三维网络结构. 图 5a插图为1-Pt的自组装体在紫外激发下的荧光显微镜图片, 与1-Pt在高浓度二氯甲烷中的橙黄色荧光相比, 图片直观地显示了自组装体的红色荧光性, 这表明1-Pt自组装体在固态中的聚集状态更为紧密.而在环己烷溶剂中(图 5b), 1-Pt的自组装体则为宽度为70~80 nm的短纤维状, 且堆积更为紧密, 这也导致了1-Pt在环己烷中荧光的发射波长比在二氯甲烷中更加红移.
2 结论
成功地设计合成了含嘧啶基团的具有棒-线分子结构的新型N^C^N三齿配体1以及其铂(PtII)配合物1-Pt.在刚性骨架上引入能与铂形成配位键的嘧啶基团和延长刚性骨架的分子设计, 不仅增强了分子间π-π相互作用, 同时在线性部分引入4条柔性长链后, 显著提高了分子的溶解性. 1-Pt在溶液中显示了良好的发光和自组装性能.当浓度增大时, 由于增强的分子间π-π相互作用, 紫外吸收和荧光发射峰的红移效果明显, 并且可通过溶剂效应进一步调控荧光特性, 特别是在极性小的环己烷溶液中, 1-Pt的荧光波长接近于近红外区域.同时, 1-Pt在有机溶剂中显示出良好的自组装性能, 在二氯甲烷及环己烷中可以形成结构清晰的纳米纤维, 且形成的自组装体具有红色荧光特性.这些结果为进一步利用溶液可涂法制备发光性二价铂配合物薄膜等提供了一个研究思路.
3 实验部分
3.1 仪器与试剂
除注明之外, 合成所用的试剂都未经特别处理, 化合物都是在干燥氮气氛围内制备而成.自组装过程所使用的四氢呋喃(THF)在使用之前经氮气氛围下钠和苯甲酮的混合物回流.二甲基甲酰胺(DMF)和二氯甲烷(CH2Cl2)以氢化钙干燥, 并在使用前蒸馏.三氯甲烷(CHCl3)用分子筛干燥并在使用前蒸馏.
使用Brucker Model Avance DMX 400 (400 MHz)室温下进行1H NMR测定, 所有氘代试剂TMS为内标.使用Brucker Model Avance DMX 400 (100 MHz)室温下进行13C NMR, 所有氘代试剂TMS为内标.基质辅助激光解吸电离飞行时间质谱(MALDI-TOF mass)使用AB Sciex model AB Sciex 4800 Plus MALDI TOF/TOF Analyzer.凝胶渗透色谱分析(GPC)使用JAI model LC-9201 recycling preparative HPLC.光学性质通过TU-1901型紫外分光光度计与HORIBA model Fluoromax-4荧光测试仪进行表征.化合物微结构使用HITACHI S-4800场发射扫描电子显微镜(FE-SEM)进行表征.
3.2 实验方法
线性部分中间体M的合成参考文献[30]所获得, 3-十二烷氧基-2-十二烷氧基甲基-1-丙醇(A)为已知化合物[31].
3.2.1 3-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基-2-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基甲基丙烯(B)的合成
向装有磁力搅拌子和回流装置的50 mL两口烧瓶中加入NaH (0.95 g, 16.2 mmol), Ar气保护下抽换气三次, 加入无水THF (10 mL)和3-氯-2-甲基丙烯(0.37 g, 3.0 mmol), 逐滴加入A (2.4 g, 5.9 mmol). 65 ℃下回流反应过夜, 冷却至室温, 加水淬灭反应, 旋蒸除去THF, 用CH2Cl2萃取(50 mL×3), 合并有机相, 蒸馏水洗(50 mL×3), 无水硫酸镁干燥有机相, 过滤除去硫酸镁, 旋蒸蒸除溶剂, 剩余物用硅胶层析柱, 得黄色油状液体1.5 g, 产率54%. 1H NMR (400 MHz, CDCl3) δ: 5.14 (s, 2H), 3.94 (s, 4H), 3.45 (d, J=8.0 Hz, 12H), 3.38 (t, J=6.7 Hz, 8H), 2.19~2.09 (m, 2H), 1.53 (d, J=6.8 Hz, 8H), 1.27 (d, J=9.1 Hz, 72H), 0.87 (d, J=7.0 Hz, 12H); MALDI-TOF-MS calcd for C60H120O6Na [M+Na]+ 959.8983, found 959.4001.
3.2.2 3-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基-2-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基甲基-1-丙醇(C)的合成
向50 mL两口烧瓶中加入B (1.2 g, 1.28 mmol), Ar气保护下, 抽换气三次, 加入无水THF (3 mL), 0 ℃下逐滴加入THF溶解的1 mol/L BH3 (3 mL), 快速搅拌2 h, 滴加3 mol/L NaOH (1.2 mL).快速搅拌15 min, 滴加30% H2O2 (1.5 mL), 室温下快速搅拌30 min加入K2CO3至饱和, CH2Cl2萃取(50 mL×3), 合并有机相, 蒸馏水洗(50 mL×3), 无水硫酸镁干燥有机相, 过滤除去硫酸镁, 旋蒸蒸除溶剂, 剩余物用硅胶层析柱提纯, 得淡黄色油状液体0.93 g, 产率75%. 1H NMR (400 MHz, CDCl3) δ: 3.73 (d, J=5.0 Hz, 2H), 3.53~3.33 (m, 24H), 2.12 (t, J=8.0 Hz, 2H), 1.58~1.49 (m, 8H), 1.25 (s, 72H), 0.92~0.83 (m, 12H); MALDI-TOF-MS calcd for C60H122O7Na [M+Na]+ 977.9088, found 977.4041.
3.2.3 3-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基-2-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基甲基-1-对甲苯磺酸基丙烷(M)的合成
向500 mL两口烧瓶中加入C (1 g, 1.05 mmol), TsCl (1 g, 5.1 mmol), Ar气保护下, 抽换气三次, 加入无水CH2Cl2 (80 mL), 吡啶(1.25 g, 15.79 mmol), 在25 ℃下快速搅拌5 h, 用CH2Cl2萃取(50 mL×30), 合并有机相, 有机相先1 mol/L HCl洗(50 mL×1), 后蒸馏水洗(50 mL×3), 无水硫酸镁干燥有机相, 过滤除去硫酸镁, 旋蒸蒸除溶剂, 剩余物用硅胶层析柱提纯, 得淡黄色液体1 g, 产率72 %. 1H NMR (400 MHz, CDCl3) δ: 7.78 (d, J=8.2 Hz, 2H), 7.34 (d, J=8.0 Hz, 2H), 4.08 (d, J=5.6 Hz, 2H), 3.34 (t, J=11.8 Hz, 24H), 2.44 (s, 3H), 2.22~2.16 (m, 1H), 2.05 (t, J=8.0 Hz, 2H), 1.54 (t, J=9.0 Hz, 8H), 1.27 (d, J=9.2 Hz, 72H), 0.88 (t, J=6.7 Hz, 12H); MALDI-TOF-MS calcd for C67H128O9SNa [M+Na]+1131.9177; found 1131.4043.
3.2.4 1-(3, 5-二溴苯氧基)-3-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基-2-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基甲基丙烷(D)的合成
向100 mL两口烧瓶中加入M (4 g, 6.7 mmol), 3, 5-二溴苯酚(378 mg, 1.5 mmol), Cs2CO3 (1.62 g, 5 mmol), 18-冠醚-6 (6.7 mg, 0.025 mmol, 5 mol%), Ar气保护下, 加入无水DMF (50 mL), 85 ℃反应48 h, 停止反应.用CH2Cl2萃取(50 mL×3), 合并有机相, 蒸馏水洗(50 mL×3), 无水硫酸镁干燥, 过滤除去硫酸镁, 旋转蒸蒸除溶剂, 剩余物用硅胶层析柱提纯[洗脱剂: V(石油醚):V(乙酸乙酯)=25:1], 得浅黄色液体3.8 g, 产率85%. 1H NMR (400 MHz, CDCl3) δ: 7.24 (s, 1H), 7.02 (d, J=1.5 Hz, 2H), 4.01 (d, J=5.6 Hz, 2H), 3.51 (t, J=6.2 Hz, 4H), 3.47 (d, J=12.0 Hz, 4H), 3.43 (d, J=6.0 Hz, 8H), 3.38 (t, J=6.6 Hz, 8H), 2.35 (t, J=8.0 Hz, 1H), 2.21~2.10 (m, 2H), 1.60~1.50 (m, 8H), 1.28 (s, 72H), 0.90 (t, J=6.8 Hz, 12H); MALDI-TOF-MS calcd for C66H124Br2O7Na [M+Na]+ 1211.7591; found 1211.7999.
3.2.5 1-(3, 5-二硼酸酯基)苯氧基-3-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基-2-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基甲基丙烷(E)的合成
向50 mL两口瓶瓶中依次加入D (390 mg, 0.325 mmol), 双频哪醇合二硼(181.7 mg, 0.72 mmol), PdCl2(dppf) (39.52 mg, 0.0392 mmol, 12 mol%), KOAc (191 mg, 1.95 mmol), Ar气保护下抽换气三次, 加入无水DMF(冷冻除氧)(20 mL), 加热至80 ℃, 反应10 h, 停止反应.冷至室温后, CH2Cl2萃取(50 mL×3), 合并有机相, 蒸馏水洗(50 mL×3), 无水硫酸镁干燥有机相, 过滤除去硫酸镁, 旋蒸蒸除溶剂, 剩余物用硅胶层析柱提纯[洗脱剂: V(石油醚):V(乙酸乙酯)=5:1], GPC分离, 得浅黄色油状物221.1 mg, 产率53%. 1H NMR (400 MHz, CDCl3) δ: 7.87 (s, 1H), 7.44 (s, 2H), 4.06 (d, J=5.7 Hz, 2H), 3.54 (d, J=5.9 Hz, 4H), 3.47~3.46 (m, 4H), 3.43 (d, J=5.9 Hz, 8H), 3.38 (t, J=2.8 Hz, 8H), 2.39~2.36 (m, 1H), 2.15 (d, J=6.0 Hz, 2H), 1.54 (s, 8H), 1.35 (s, 24H), 1.28 (s, 72H), 0.90 (t, J=6.6 Hz, 12H); 13C NMR (101 MHz, CDCl3) δ: 158.09, 133.50, 123.32, 83.72, 71.30, 69.69, 69.28, 69.19, 65.96, 40.35, 40.11, 31.94, 29.71, 29.67, 29.38, 24.87, 22.70, 14.13. MALDI-TOF-MS calcd for C78H148B2O11Na [M+Na]+ 1306.1105; found 1306.4312.
3.2.6 2, 2-(5-(3-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基-2-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基甲基)丙氧基-1, 3-苯撑)-双-5-溴嘧啶(F)的合成
在装有磁力搅拌和回流装置的25 mL两口瓶中依次加入E (235 mg, 0.176 mmol), 5-溴-2-碘嘧啶(521 mg, 1.76 mmol), Pd(PPh3)4 (19 mg, 0.0018 mmol, 10 mol%), Ar气保护下, 加入无水THF(冷冻除氧)/无水甲苯(冷冻除氧) (10/5 mL), 2 mol/L K2CO3(冷冻除氧) (0.88 mL, 10 equiv.), 加热至85 ℃回流, 反应36 h后停止反应.冷至室温后, 旋蒸除去溶剂, CH2Cl2萃取(50 mL×3), 合并有机相, 蒸馏水洗(50 mL×3), 无水硫酸镁干燥有机相, 过滤除去硫酸镁, 旋蒸蒸除溶剂, 剩余物用硅胶层析柱提纯[洗脱剂: V(石油醚):V(乙酸乙酯)=30:1], 得微黄色液体180 mg, 产率76%. 1H NMR (400 MHz, CDCl3) δ: 9.10 (s, 1H), 8.88 (s, 4H), 8.15 (s, 2H), 4.23 (d, J=5.4 Hz, 2H), 3.60 (d, J=5.9 Hz, 4H), 3.50 (d, J=3.9 Hz, 4H), 3.44 (d, J=5.9 Hz, 8H), 3.36 (t, J=6.6 Hz, 8H), 2.52~2.42 (m, 1H), 2.18 (d, J=5.9 Hz, 2H), 1.58~1.47 (m, 8H), 1.29 (d, J=20.7 Hz, 72H), 0.90 (t, J=6.7 Hz, 12H); 13C NMR (101 MHz, CDCl3) δ: 162.33, 160.09, 157.80, 138.26, 120.57, 118.60, 116.83, 71.31, 69.73, 69.21, 40.41, 31.92, 29.69, 29.65, 29.52, 29.35, 26.19, 22.68, 14.09; MALDI-TOF-MS calcd for C4H129Br2N4O7 [M+H]+ 1345.8208; found 1345.4744.
3.2.7 2, 2-(5-(3-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基-2-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基甲基)丙氧基-1, 3-苯撑)-双-5-[4-(1, 1-联苯)]嘧啶(1)的合成
在装有磁力搅拌和回流装置的25 mL两口瓶中依次加入F (200 mg, 0.15 mmol), 苯基硼酸(295 mg, 1.5 mmol), Pd(PPh3)4 (26 mg, 0.022 mmol, 15 mol%), Ar气保护下, 加入无水THF(冷冻除氧)/无水甲苯(冷冻除氧)(10/5 mL), 2 mol/L K2CO3(冷冻除氧, 0.75 mL, 10 equiv.), 加热至85 ℃回流, 反应60 h后停止反应.冷至室温后, 旋蒸除去溶剂, CH2Cl2萃取(50 mL×3), 合并有机相, 蒸馏水洗(50 mL×3), 无水硫酸镁干燥有机相, 过滤除去硫酸镁, 旋蒸蒸除溶剂, 剩余物用硅胶层析柱提纯[洗脱剂: V(石油醚):V(乙酸乙酯)=20/1], 得微黄色固体190 mg, 产率85%. m.p. 62 ℃. 1H NMR (400 MHz, CDCl3) δ: 9.33 (s, 1H), 9.16 (s, 4H), 8.28 (d, J=1.5 Hz, 2H), 7.81~7.76 (m, 8H), 7.69 (d, J=7.6 Hz, 4H), 7.52 (t, J=7.6 Hz, 4H), 7.44 (d, J=7.4 Hz, 2H), 4.32 (d, J=5.6 Hz, 2H), 3.65 (d, J=6.0 Hz, 4H), 3.53 (dd, J=5.9, 3.9 Hz, 4H), 3.478 (d, J=6.0 Hz, 8H), 3.39 (t, J=6.7 Hz, 8H), 2.53~2.49 (m, 1H), 2.22~2.18 (m, 2H), 1.55 (t, J=7.1 Hz, 8H), 1.31~1.26 (m, 72H), 0.89 (t, J=7.0 Hz, 12H); 13C NMR (101 MHz, CDCl3) δ: 162.96, 160.14, 155.02, 141.77, 140.17, 138.91, 133.31, 131.48, 128.96, 128.13, 127.80, 127.15, 127.10, 120.73, 116.55, 71.34, 69.74, 69.30, 69.23, 66.49, 40.40, 40.13, 31.94, 29.73, 29.69, 29.39, 22.71, 14.14; MALDI-TOF-MS calcd for C98H146N4O 1492.1263, found 1492.1265.
3.2.8 氯化(4-(3-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基-2-(3-十二烷氧基-2-十二烷氧基甲基)丙氧基甲基)丙氧基-2, 6-双-[2-kN-5-(4-(1, 1-联苯)]嘧啶-kC1-苯基)铂(II) (1-Pt)的合成
在装有磁力搅拌和回流装置的50 mL两口瓶中依次加入1 (90 mg, 0.060 mmol), K4PtCl4 (25.03 mg, 0.06 mmol), Ar气保护下, 加入无水乙酸(冷冻除氧)(25 mL), 加热至120 ℃回流, 反应7 d后停止反应.冷却至室温后, 旋蒸除去溶剂, CH2Cl2萃取(50 mL×3), 合并有机相, 加入适量甲醇, 析出黄色固体, 过滤, 得黑色固体53 mg, 产率51%. m.p. 76 ℃. 1H NMR (400 MHz, CDCl3) δ: 9.63 (s, 2H), 9.14 (s, 2H), 7.76 (s, 8H), 7.64 (s, 4H), 7.51 (d, J=7.1 Hz, 4H), 7.45 (s, 4H), 4.11 (d, J=4.6 Hz, 2H), 3.58 (d, J=5.5 Hz, 4H), 3.51 (d, J=5.7 Hz, 4H), 3.47 (d, J=5.8 Hz, 8H), 3.39 (t, J=6.4 Hz, 8H), 2.42 (s, 1H), 2.21 (d, J=5.6 Hz, 2H), 1.55 (s, 4H), 1.26 (s, 72H), 0.89 (t, J=6.4 Hz, 12H); MALDI-TOF-MS calcd for C98H145N4O7Pt [M-Cl]+ 1686.0780, found 1686.0784.
辅助材料(Supporting Information)中间体化合物B, C, M, D, E, F的1H NMR谱, 配体1和配合物1-Pt的1H NMR和MALDI-TOF/TOF Mass谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Jespersen, K. K; Czerw, M.; Summa, N.; Renkema, K. B.; Achord, P. D.; Goldman, A. S. J. Am. Chem. Soc. 2002, 124, 11404. doi: 10.1021/ja012460d
-
[2]
Bergbreiter, D. E.; Osburn, P. L.; Wilson, A.; Sink, E. M. J. Am. Chem. Soc. 2000, 122, 9058. doi: 10.1021/ja001708g
-
[3]
Jin, W.; Li, X. C.; Wan, B. S. J. Org. Chem. 2011, 76, 484. doi: 10.1021/jo101932a
-
[4]
Fache, F.; Schulz, E.; Tomasino, M. L.; Lemaire, M. Chem. Rev. 2000, 100, 2159. doi: 10.1021/cr9902897
-
[5]
Colombo, A.; Fiorini, F.; Septiadi, D.; Dragonetti, C.; Nisic, F.; Valore, A.; Roberto, D.; Mauro, M.; Cola, L. D. Dalton Trans. 2015, 44, 8478. doi: 10.1039/C4DT03165B
-
[6]
Wang, Y. F.; Shi, J. W.; Chen, J. H.; Zhu, W. G.; Baranoff, E. J. Mater. Chem. C 2015, 3, 7993. doi: 10.1039/C5TC01565K
-
[7]
Yeung, M. C.-L.; Chu, B. W.-K.; Yam, V. W.-W. ChemistryOpen 2014, 3, 172. doi: 10.1002/open.v3.5
-
[8]
Liu, N. J.; Wang, B. Y.; Liu, W. S.; Bu, W. F. Chem. Commun. 2011, 47, 9336. doi: 10.1039/c1cc12192h
-
[9]
Slagt, M. Q.; Van Zwieten, D. A. P.; Moerkerk, A. J. C. M.; Gobbink, R. J. M. K.; Van Koten, G. Coord. Chem. Rev. 2004, 248, 2275. doi: 10.1016/j.ccr.2004.08.014
-
[10]
Togni, A.; Venanzi, L. M. Angew. Chem., Int. Ed. 1994, 33, 497. doi: 10.1002/(ISSN)1521-3773
-
[11]
Vail der Boom, M. E.; Milstein, D. Chem. Rev. 2003, 103, 1759. doi: 10.1021/cr960118r
-
[12]
Chiu, B. K. W.; Lam, M. H. W.; Lee, D. Y. K.; Wong, W. Y. J. Organomet. Chem. 2004, 689, 2888. doi: 10.1016/j.jorganchem.2004.06.006
-
[13]
Takenaka, K.; Minakawa, M.; Uomuni, Y. J. Am. Chem. Soc. 2005, 127, 12273. doi: 10.1021/ja052780n
-
[14]
Fossey, J. S.; Jones, G.; Motevalli, M.; Nguyen, H. V.; Richards, C. J.; Stark, M. A.; Taylor, H. V. Tetrahedron:Asymmetry 2004, 15, 2067. doi: 10.1016/j.tetasy.2004.05.032
-
[15]
Lee, E.; Jeong, Y.; Kim, J.; Lee, M. Macromolecules 2007, 40, 8355. doi: 10.1021/ma071511+
-
[16]
Ryu, J.; Kim, H.; Huang, Z.; Lee, E.; Lee, M. Angew. Chem., Int. Ed. 2006, 45, 5304. doi: 10.1002/(ISSN)1521-3773
-
[17]
Lee, E.; Huang, Z.; Ryu, J. H.; Lee, M. Chem. Eur. J. 2008, 14, 6957. doi: 10.1002/chem.v14:23
-
[18]
Ryu, J. H.; Oh, N. K.; Lee, M. Chem. Commun. 2005, 13, 1770.
-
[19]
Moon, K. S.; Kim, H. J.; Lee, E.; Lee, M. Angew. Chem., Int. Ed. 2007, 46, 6807. doi: 10.1002/(ISSN)1521-3773
-
[20]
Moon, K, S.; Lee, E.; Lee, M. Chem. Commun. 2008, 26, 3061.
-
[21]
Lee, E.; Kim, J.; Lee, M. Angew. Chem., Int. Ed. 2008, 47, 6375. doi: 10.1002/anie.v47:34
-
[22]
Zhong, K. L.; Huang, Z. G.; Man, Z. J.; Jin, L. Y.; Yin, B. Z.; Lee, M. J. Polym. Sci. Part. A:Polym. Chem. 2010, 48, 1415. doi: 10.1002/pola.v48:6
-
[23]
Zhong, K. L.; Man, Z. J.; Huang, Z. G.; Chen, T.; Yin, B. Z.; Jin, L. Y. Polym. Int. 2011, 60, 845. doi: 10.1002/pi.v60.5
-
[24]
Ryu, J.; Cho, B.; Lee, M. Bull. Chem. Soc. 2006, 27, 1270. doi: 10.5012/bkcs.2006.27.9.1270
-
[25]
Lim, Y.; Moon, K. S.; Lee, M. Chem. Soc. Rev. 2009, 38, 925. doi: 10.1039/b809741k
-
[26]
Lee, M.; Cho, B.; Zin, W. C. Chem. Rev. 2001, 101, 3869. doi: 10.1021/cr0001131
-
[27]
Li, X. Y.; Hu, J. N.; Wu, Y.; Li, R.; Xiao, D. D.; Zeng, W.; Zhang, D. Q.; Xiang, Y. J.; Jin, W. S. Dyes Pigm. 2017, 141, 188. doi: 10.1016/j.dyepig.2017.02.020
-
[28]
Li, K.; Cheng, G.; Ma, C. S.; Guan, X, G.; Kwork, W. M.; Chen, Y.; Luac, W.; Che, C. M. Chem. Sci. 2013, 4, 2630. doi: 10.1039/c3sc21822h
-
[29]
Farinola, G. M.; Ragni, R. Chem. Soc. Rev. 2011, 40, 3467 doi: 10.1039/c0cs00204f
-
[30]
Kim, H. J.; Zin, W. C.; Lee, M. J. Am. Chem. Soc. 2004, 126, 7009. doi: 10.1021/ja049799v
-
[31]
Xiao, D.; Zhang, D.; Chen, B.; Xie, D.; Xiang, Y.; Li, X.; Jin, W. Langmuir 2015, 31, 10649. doi: 10.1021/acs.langmuir.5b02273
-
[1]
-
图 3 (a) 浓度为1×10-4mol/L(黑)和5×10-4mol/L(红)的1-Pt(实线)和2-Pt(虚线)在二氯甲烷中的UV-vis吸收谱图[内部插图为二氯甲烷中配体1 (1×10-4mol/L, 虚线)与1-Pt (1×10-4mol/L, 实线)的UV-vis吸收光谱对照图]及(b) 2-Pt单晶结构中的二聚体聚合形态
Figure 3 (a) UV-Vis absorption spectra of 1-Pt (solid curve) and 2-Pt (dotted curve) with 1×10-4mol/L (black) and 5×10-4mol/L (red) in CH2Cl2 [inset: UV-vis comparison of 1 (1×10-4mol/L in CH2Cl2, dotted curve) and 1-Pt (1×10-4mol/L in CH2Cl2, solid curve] and (b) the aggregation of dimeric structures in the single crystal 2-Pt
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 2238
- HTML全文浏览量: 261


 下载:
下载:





 下载:
下载:

