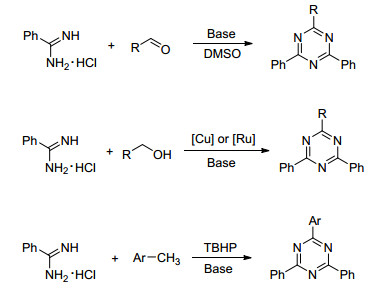
 图式1
苯甲脒盐酸盐合成芳基取代1, 3, 5-三嗪类化合物
Scheme1.
Synthesis of aryl substituted 1, 3, 5-triazine used benzamidine hydrochloride as material
图式1
苯甲脒盐酸盐合成芳基取代1, 3, 5-三嗪类化合物
Scheme1.
Synthesis of aryl substituted 1, 3, 5-triazine used benzamidine hydrochloride as material

Citation: Zou Hao, Wang Xueding, Yang Weiqing, Zhang Yuanyuan, Chen Hua, Wang Yuliang, Ma Menglin, Du Quan. Study of the Friedel-Crafts Reaction of Cyanuric Chloride with Low-Boiling Aromatic Ring[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2697-2704. doi: 10.6023/cjoc201704027

三聚氯氰与低沸点芳香环的Friedel-Crafts封管反应研究
-
关键词:
- 三聚氯氰
- / 芳香环
- / Friedel-Crafts芳基化反应
- / 封管
English
Study of the Friedel-Crafts Reaction of Cyanuric Chloride with Low-Boiling Aromatic Ring
-
Key words:
- cyanuric chloride
- / aromatic ring
- / friedel-crafts arylation reaction
- / autoclave
-
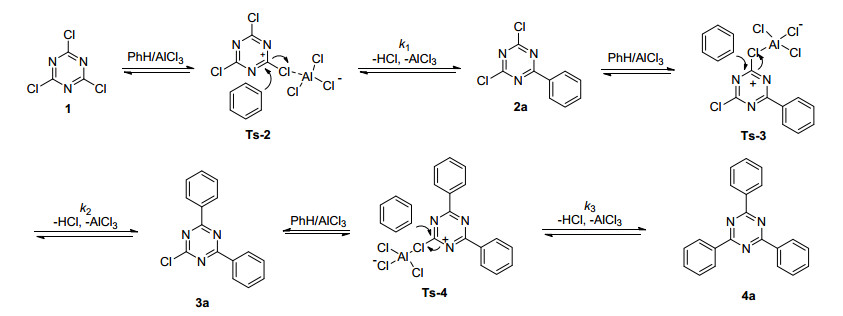
芳基取代的1, 3, 5-三嗪类化合物具有特定的生物活性, 在药物领域中应用十分普遍[1].此外, 这些化合物还被用作有机金属材料的螯合配体[2]、紫外线吸收剂[3]、液晶材料中间体[4]和过渡金属催化剂[5]等. 2009年王光荣等[6]报道了多取代基的均三嗪白色电致发光材料的制备与性能研究结果, 2013年罗浩敏等[7]报道了均三嗪衍生物的合成方法研究进展, 由此可见1, 3, 5-三嗪类衍生物研究与应用十分广泛.文献报道的2, 4-二氯-6-芳基-1, 3, 5-三嗪类化合物的合成方法较为单一, 以2, 4-二氯-6-苯基-1, 3, 5-三嗪(2a)为例, 1950年Hirt等[8]以溴苯的格氏试剂与三聚氯氰(1)采用乙醚为溶剂合成了2, 4-二氯-6-苯基-1, 3, 5-三嗪(2a), 但同时生成了较多的2-氯-4, 6-二苯基-1, 3, 5-三嗪(3a) (Eq. 1), 此后苯基取代的1, 3, 5-三嗪类化合物多采用以苯基格氏试剂与三聚氯氰(1)反应的工艺, 得到的单取代和二取代混合产物再进行分离.
2, 4, 6-三芳基-1, 3, 5-三嗪类化合物的合成方法较多, 经典的反应主要是Suzuki偶联反应[9], Forsberg等[10]以苯甲腈为原料, Lewis酸为催化剂, 高温高压条件下经环三聚反应合成了2, 4, 6-三苯基-1, 3, 5-三嗪(4a) (Eq. 2).
此外Biswas等[11]以芳香醛和苯甲脒盐酸盐在DMSO中加碱关环得到2, 4, 6-三芳基-1, 3, 5-三嗪目标产物; Xie和Zhang等[12]在碱性条件下用金属催化芳香醇和苯甲脒盐酸盐生成目标产物; 2015年Guo[13]以芳烃和苯甲脒盐酸盐加碱在TBHP存在下生成目标产物(Scheme 1).
 图式1
苯甲脒盐酸盐合成芳基取代1, 3, 5-三嗪类化合物
Scheme1.
Synthesis of aryl substituted 1, 3, 5-triazine used benzamidine hydrochloride as material
图式1
苯甲脒盐酸盐合成芳基取代1, 3, 5-三嗪类化合物
Scheme1.
Synthesis of aryl substituted 1, 3, 5-triazine used benzamidine hydrochloride as material
2014年, Huang等[14]以三氯化铝为催化剂, 以甲苯、氯苯、二甲苯和三聚氯氰为原料, 采用Friedel-Crafts反应, 在回流条件下成功制备相应的2, 4, 6-三芳基-1, 3, 5-三嗪4b、4c和4d (Eq. 3). Gregory等[15]利用三聚氯氰与间苯二酚采用Friedel-Crafts反应生成了2, 4, 6-三(2, 4-二羟基苯基)-1, 3, 5-三嗪(4e).文献报道的Friedel-Crafts反应制备三芳基-1, 3, 5-三嗪的工艺均在回流条件下进行, 底物均为高沸点的芳香环化合物.对于低沸点底物为原料采用Friedel-Crafts反应制备相应三芳基-1, 3, 5-三嗪, 如以苯为原料制备2, 4, 6-三苯基-1, 3, 5-三嗪(4a), 目前无相关文献报道, 因此对该类反应的研究具有一定的价值.
本文详细研究了以AlCl3为催化剂, 采用水热反应釜在封管条件下, 苯与三聚氯氰Friedel-Crafts芳基化反应(Eq. 4), 考察了不同条件下三种不同的取代产物2a, 3a和4a的生成情况, 计算了反应的速率与过渡态, 并在此基础之上从动力学和热力学两方面分析了反应机理.
1 结果与讨论
1.1 回流条件下三聚氯氰与苯的反应
三聚氯氰与甲苯、氯苯、间苯二酚等高沸点含供电子基的芳香环化合物的Friedel-Crafts反应有较多报道, 首先我们[16]尝试沿用文献方法制备2, 4, 6-三苯基-1, 3, 5-三嗪(4a), 将苯与三聚氯氰在AlCl3催化下回流5 h, 经HPLC检测后并未得到化合物4a, 只发现有微量的2a生成, 苯几乎未反应.证明在回流温度下苯与三聚氯氰难以通过Friedel-Crafts烷化生成相应产物.
1.2 温度与环境介质筛选结果
温度作为Friedel-Crafts芳基化反应的主要因素, 不仅对反应的选择性有影响, 而且还对反应的速度有很大影响, 由于在回流条件下无法继续升高温度, 为进一步提高反应温度, 该实验选择在水热高压反应釜中进行, 在回流温度为基点以上进行了温度条件实验, 温度范围为90~160 ℃, 结果如表 1所示.
Entry Temperature/℃ Gas medium Initial pressure/kPa Reaction pressureb/kPa Conversion/% Selectivity/% 2a 3a 4a 1 90 Air 101 101 57.8 98.5 1.4 0.1 2 100 Air 101 101 62.5 96.9 2.9 0.2 3 110 Air 101 101 69.9 75.5 21.2 3.3 4 120 Air 101 122 89.1 53.2 33.9 12.9 5 130 Air 101 304 >99.0 46.7 37.7 15.6 6 130 N2 101 304 >99.0 47.8 36.2 16.0 7 130 N2 507 527 >99.0 48.2 35.6 16.2 8 140 Air 101 334 >99.0 14.3 27.9 57.8 9 150 Air 101 517 >99.0 6.3 15.1 78.6 10 160 Air 101 628 >99.0 0.1 0.7 99.2 11 160 N2 101 618 >99.0 0.2 0.5 99.3 an(benzene):n(cyanuric chloride):n(AlCl3)=10:1:1.5, Reaction time=2 h.bThe pressure was the measured pressure when the autoclave was heated to the reaction temperature. 三聚氯氰的转化率随着温度的升高而逐渐升高, 当反应温度达130 ℃后三聚氯氰的转化率>99%(表 1, Entry 5), 进一步提高温度至170 ℃后焦油状物质开始大量出现, 目标产物急剧下降难于分离检测.选择性方面, 单取代产物2a的比例随着温度的升高而逐渐降低, 在90 ℃为最高达98.5%(表 1, Entry 1), 经简单分离纯化后可方便地得到目标产物2, 4-二氯-6-苯基-1, 3, 5-三嗪(2a).此工艺较格氏试剂方法更易操作, 原料成本也大大降低, 是一种制备2a较为优秀的方法.二取代产物3a的产率先随着温度的增加呈现上升趋势, 当温度达30 ℃时出现选择性比例最大值37.7%(表 1, Entry 5), 之后其产率随着温度增加而逐渐降低.三取代产物4a的产率则随着温度的上升逐渐升高, 在150 ℃比例达78.6%(表 1, Entry 9), 进一步升高温度至160 ℃后, 可获得99.2%以上的高选择性产物4a, 且反应转化率也达99.9%以上.
论文对比了氮气和空气环境, 常压下关闭釜体加热反应的转化率和选择性.结果显示, 在130和160 ℃温度条件下, 空气和氮气两种环境下转化率和选择性均无太大差异(表 1, Entries 5~6, 10~11), 温度超过170 ℃后即使在氮气环境下焦油状物质同样开始大量出现.分析其原因认为, 釜体内加料后剩余空气体积极小, 氧气含量低, 且关闭釜体反应后无后续氧气进入, 因此该体系下残留空气对该反应影响极小, 与氮气反应条件下结果一致.
为降低苯在高温条件下的气化率, 增加液态苯与三氯化铝及反应底物的接触碰撞几率, 试验了向釜体内预充入507 kPa的氮气(表 1, Entries 6~7), 在130 ℃下进行反应, 其转化率和选择性与常压充入氮气或空气环境关闭釜体的实验结果相差不大.因此认为温度才是影响反应的关键因素, 苯的气液比例对反应影响不大.
1.3 苯与三聚氯氰的比例考察
该反应中苯的用量对化合物2a, 3a和4a的生成有直接的影响.因此, 我们首先探究了该反应中苯的用量对反应产物的影响.将苯与三聚氯氰的物质的量比从10:1逐步降至1:1, 为保持液体体积一致和搅拌的均匀性, 实验中向反应体系中加入环已烷至体系液体体积一致.
随着苯用量的减少反应的转化率急剧下降, 当苯与三聚氯氰的物质的量比为1:1时, 转化率仅有3.1%(表 2, Entry 1), 表明随着苯用量的减少, 环已烷的稀释降低了苯与三聚氯氰铝络合物碰撞的机率导致反应活性大大下降.选择性方面, 随着苯用量的增加, 二取代产物3a和三取代产物4a均呈上升趋势, 而单取代产物2a比例出现下降(表 2, Entries 1~5), 表明苯浓度的增加有利于多取代产物生成.实验证实力求通过控制苯的用量来实现选择性控制不可行, 并不能得到理想的单一目标产物.
Entry n(cyanuric chloride):
n(benzene)Conversion/% Selectivity/% 2a 3a 4a 1 1:1 3.1 99.8 <0.1 <0.1 2 1:2 41.2 82.8 13.2 4.0 3 1:3 78.9 68.7 25.1 6.2 4 1:5 77.6 56.4 33.7 9.9 5 1:10 99.3 46.7 37.7 15.6 an(cyanuric chloride):n(AlCl3)=1:1.5, Reaction time=2 h, Reaction temperature=130 ℃. 1.4 AlCl3用量对反应的影响
Friedel-Crafts芳基化反应的催化剂用量相对较大, 很多时候为化学剂量甚至过量, 造成该现象的原因为AlCl3在催化过程中与反应物生成金属络合物, 这种络合物的解离需在酸性环境中发生, 在该反应进行过程中, 生成的HCl以气体形式存在, 且难容于苯, 不利于这种金属络合物的解离, 导致其循环催化作用效率较低, 用量加大.本文考察了AlCl3的用量对苯与三聚氯氰Friedel-Crafts反应的影响了, 结果如表 3.
Entry n(cyanuric chloride):n(AlCl3) Conversion/% Selectivity/% 2a 3a 4a 1 1:0.5 61.4 96.0 3.9 Trace 2 1:0.75 89.4 77.0 21.3 1.7 3 1:1.0 89.1 54.4 40.5 5.1 4 1:1.5 99.3 46.7 37.7 15.6 5 1:2.0 94.5 8.5 9.6 81.8 6 1:2.5 97.7 Trace Trace 99.9% an(benzene):n(cyanuric chloride)=10:1, Reaction time=2 h, Reaction temperature=130 ℃. 从表 3中我们可以看出, 随着AlCl3用量的增加, 化合物2a的选择性逐渐降低, 当三聚氯氰和AlCl3的物质的量比为1:0.5时选择性最好达96% (表 3, Entry 1), 表明当催化剂量少时, 三聚氯氰铝络合物浓度低, 不利于与苯发生Friedel-Crafts反应, 易停留在一取代阶段.化合物3a的产率在三聚氯氰和AlCl3的物质的量比为1:1时达到最大值, 得到40.5%的二取代产物, 进一步增加AlCl3用量, 由于三取代的生成更易而导致二取代产物3a的比例出现下降.在三聚氯氰和AlCl3的物质的量比为1:2.5时三聚氯氰转化率达到97.7%且产物中几乎只有4a(表 3, Entry 6), 说明在过量的Lewis酸存在下有更多的三聚氯氰铝络合物生成, 进一步促进反应向多取代化方向移动.
根据上述实验结果可以得出, 三聚氯氰与过量的苯在温度为130 ℃, 50 mol% AlCl3催化作用下反应2 h能够得到单一纯度较高的2a; 改变AlCl3用量为250 mol%时, 能够容易地得到4a的纯品.根据以上实验结果可以发现, 通过控制温度和催化剂量等关键反应因素, 能够选择性合成2a和4a, 而3a的选择性最高能达到40.5%.
1.5 三聚氯氰与苯反应机理讨论
对于反应在较低温度如90 ℃或低催化剂量如50 mol% AlCl3催化下能获得高选择性的一取代产物2a, 而在高温160℃或高催化量250 mol%的AlCl3催化下能得到选择性大于99%的三取代产物4a, 但该反应无法高选择性的获得二取代产物3a, 对其原因从动力学和热力学两个方面进行了讨论(Scheme 2).
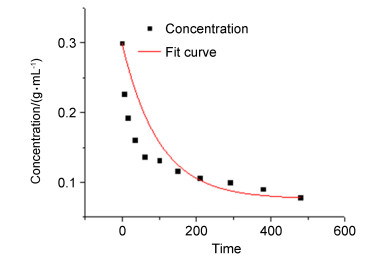
首先从动力学角度分析, Ishikawa等[17]对甲苯、二甲苯、氯苯和三聚氯氰Friedel-Crafts反应的动力学研究表明, 三聚氯氰上的三个氯原子被芳基取代的反应是分步进行的, 其反应速度随着芳基的导入而逐次降低, 且一取代速率远大于二、三取代速率, 即k1>>k2>k3.我们以三聚氯氰为浓度考察标准, 在130 ℃条件下考察其浓度随时间的变化关系, 如表 4所示.
Entry Time/
minConcentration/
%1 0 0.300 2 5 0.227 3 15 0.193 4 35 0.161 5 60 0.137 6 100 0.132 7 150 0.116 8 210 0.106 9 290 0.099 10 380 0.090 11 480 0.078 aThe tube sealing reaction was not in situ sampling, and the above data are parallel reactions. 根据表 4, 利用origin进行线性拟合, 如图 1所示, 拟合曲线公式为C(1)=-0.0726logt+0.27374, 因此, 其反应速率随着时间的变化而逐渐降低, 印证了Ishikawa等之前的研究, 所以从动力学上, 该反应存在k1>>k2>k3的关系.
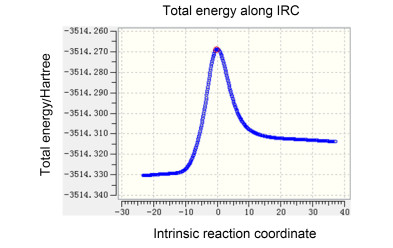
从热力学分析来看, 首先利用高斯软件进行了三聚氯氰与苯的过渡态计算, 用内禀坐标(IRC)方法进一步验证了其可以正确的连接前后的中间体, IRC验证结果如图 2和图 3所示.
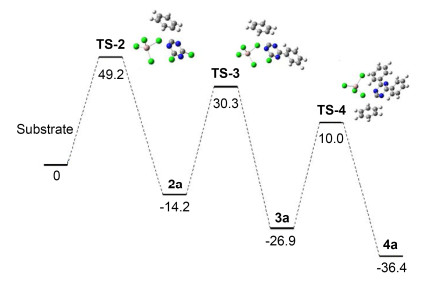
为了使计算结果更为准确, 在计算过程中也加入了溶剂化效应, 整理得到表 5中各物质的吉布斯自由能参数.最终将计算结果处理后得到如图 4所示的能量曲线图, 能量单位为kcal/mol.
Entry Substrate Gibbs free energy θ1/Hartree After PCM corrections θ2/Hartree θ1+θ2/Hartree 1 1 0.001935 -1659.318502 -1659.318482 2 AlCl3 -0.025196 -1623.348974 -1623.37417 3 PhH 0.073305 -232.3193965 -232.2460915 4 HCl -0.011217 -460.8378652 -460.8490822 5 TS-2 0.088195 -3514.935039 -3514.846844 6 TS-3 0.173363 -3286.447067 -3286.273704 7 TS-4 0.258009 -3057.961116 -3057.703107 8 2a 0.088225 -1430.826345 -1430.73812 9 3a 0.174161 -1202.329506 -1202.155345 10 4a 0.259983 -973.8275301 -973.5675471 图 4中, TS-2, TS-3和TS-4分别代表反应过程中生成化合物2a, 3a和4a三个不同的过渡态.由图 4的能垒示意图可以看出, 当三聚氯氰与苯在AlCl3催化作用下发生反应时, 需要49.2 kcal/mol的能量形成TS-2, 才能生成化合物2a.由于该反应能垒较高, 普通反应条件下无法达到其活化能所需能量, 因此, 在80 ℃常压条件下苯与三聚氯氰不会发生反应, 印证了之前实验.第一步反应生成的单取代产物2a与苯反应时, 需要44.5 kcal/mol的能量形成TS-3, 再生成化合物3a, 3a再与苯反应, 形成TS-4只需要36.9 kcal/mol的能量.
由图 4可直观了解到TS-2, TS-3和TS-4的能垒依次逐渐降低, 在高温和高催化剂量反应条件下, 由于苯和催化剂过量, 反应温度达到能翻越能垒生成化合物2a后, 不能避免化合物3a和4a的生成, 同时由于k2和k3相差不大, 使得反应几乎难以停留在二取代产物阶段, 而进一步生成三取代得到高选择性的化合物4a, 这与之前的实验数据吻合.因此, 该反应一旦进行, 升高温度或者加入更多的催化剂, 反应都会向着生成化合物4a的方向进行, 最终完全生成化合物4a.
总体分析认为由于生成一取代产物反应速率k1远大于k2和k3, 使得可以通过选择温和的反应条件, 并严格控制反应时间获得高选择性一取代产物2a.同时, 由于能垒TS-4较TS-3和TS-2更低, 使得可以反应向完全取代方向顺利移动, 从而获得三取代产物4a.
1.6 催化剂和底物的扩展
为验证反应的普适性, 对催化剂和底物进行了相关扩展实验.不同的Lewis酸都可作为Friedel-Crafts芳基化反应的催化剂, 因此考察了4种不同Lewis酸对该反应选择性的影响, 结果如表 6所示.
Entry Catalyst Conversion/% Selectivity/% 2a 3a 4a 1 AlCl3 89.1 54.4 40.5 5.1 2 FeCl3 85.8 52.6 38.9 8.5 3 SbCl3 84.2 53.8 39.7 6.5 4 SnCl5 82.5 56.2 36.6 7.2 an(benzene):n(cyanuric chloride):n(AlCl3)=10:1:1, Reaction time=2 h, Reaction temperature=130 ℃. 由表 6我们可以看出, 4种Lewis酸对该反应均具有较好的催化效果, 且其对该反应的选择性几乎无影响.由于AlCl3在其价格和催化性能上相比于其他Lewis酸具有很大的优势, 均选择无水三氯化铝作为催化剂.
对于低沸点其它芳香环底物底物, 如噻吩、呋喃等与三聚氯氰的Friedel-Crafts反应也无相关文献报道, 因此扩展底物研究三聚氯氰Friedel-Crafts反应制备相应的低沸点芳基取代产物具有一定的价值.为了验证上述反应的普适性, 选择了一系列低沸点的芳香环化合物与三聚氯氰发生Friedel-Crafts芳基化反应, 得到相应的产物, 实验结果如表 7.

Ar Compd. Conversion/% Selectivity/% 2 3 4b Ph a 89.1 54.4 40.5 5.1 Furyl f 94.7 55.0 46.5 1.5 2-Methylfuryl g 89.0 52.0 41.3 6.7 Thienyl h 93.8 53.9 45.2 0.9 2-methylthienyl i 86.3 50.0 49.5 0.6 Pyridyl j <0.1 Trace Trace Trace Pyrryl k <0.1 Trace Trace Trace an(benzene):n(cyanuric chloride):n(AlCl3)=10:1:1, Reaction time=2 h, Reaction temperature=130 ℃. bThe LC-MS and HPLC determined the content, and the targets were not isolated and characterized. 从表 7可以看出, 以吡啶和吡咯为底物的三聚氯氰Friedel-Crafts芳基化反应不能进行, 分析原因在于吡啶和吡咯为碱性极易与无水三氯化铝络合成盐而丧失反应活性, 从而不能与三聚氯氰Friedel-Crafts芳化.其它低沸点芳香化合物与苯的活性相当, 验证了该方法的通用性.
2 结论
本文研究了苯与三聚氯氰Friedel-Crafts芳基化反应, 考察了不同反应条件下三种取代产物2a, 3a和4a的生成情况, 从动力学和热力学两方面分析了实验结果, 获得了可行的利用一步合成2, 4-二氯-6-苯基-1, 3, 5-三嗪(2a)和2, 4, 6-三苯基-1, 3, 5-三嗪的方法(4a)工艺, 得到了较为理想的反应条件, 且产率较高.同时也为该类化合物的合成提供了一条可能的工业化发展道路.
3 实验部分
3.1 仪器与试剂
1H NMR由Bruker DPX-400 FT NMR型核磁共振仪测定(DMSO和CDCl3作溶剂, TMS作内标); IR由Thermo Fisher Scientific Nicolet 380测定(KB压片法); HPLC由日本岛津DGU-20A3E高效液相色谱进行测定, 色谱条件为: C18柱, 254 nm, 流动相100%甲醇, 流速1 mL/min, 柱温25 ℃, 面积归一化法; LCMS由amaZon SL-快速液质联用仪进行测定; HRMS由Varian CH-5高分辨质谱仪进行测定; 高压反应釜为成都高新区恒达试验设备有限公司生产的GYF-25mL高压反应釜.苯、呋喃、甲基呋喃、吡啶、吡咯、噻吩和三聚氯氰为成都科龙试剂厂; 溶剂等为市售分析纯试剂.
3.2 实验方法
向25 mL的高压反应釜中投入3.00 g (16.30 mmol)三聚氯氰, 14.47 mL (163.0 mmol)经无水硫酸钠干燥过的苯和3.25 g (24.46 mmol)无水AlCl3, 封闭检查密闭性, 之后将反应体系加热到90~160 ℃相应实验温度, 反应2 h后停止反应, 冷却至室温, 将反应体系倾入盛有150 mL冰水混合物的烧杯中, 搅拌, 静置30 min, 以25 mL×4甲基叔丁基醚萃取, 分出并合并有机层, 有机层以HPLC分析检测得相关产物数据; 再将有机层转移入圆底烧瓶中, 减压蒸馏除去溶剂和未反应的苯, 剩余固体用100 mL×4蒸馏水洗涤, 抽滤, 真空干燥得到目标产物2, 4-二氯-6-苯基-1, 3, 5-三嗪(2a). m.p. 121~122 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 8.09 (dd, J=12.7, 5.0 Hz, 2H), 7.72~7.65 (m, 1H), 7.57 (dt, J=13.8, 5.9 Hz, 2H); IR (KBr) v: 3433, 1625, 1525, 1496, 1383, 1254, 1106, 842, 768, 695, 650 cm-1; HRESIMS calcd for C9H5K2N3 [M-2Cl+2K]+ 232.9581, found 232.9538.
2, 4, 6-三苯基-1, 3, 5-三嗪(4a): m.p. 231~233 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 8.76 (d, J=7.2 Hz, 6H), 7.68 (d, J=6.9 Hz, 9H); IR (KBr) v: 3425, 2923, 1630, 1590, 1525, 1448, 1400, 1369, 1174, 1028, 841, 744, 684, 644 cm-1; HRESIMS calcd for C21H16N3 [M+H]+ 310.1344, found 310.1306.
柱色谱(V石油醚:V乙酸乙酯=4:1) 分离上述所得混合物得到2-氯-4, 6-二苯基-1, 3, 5-三嗪(3a). m.p. 138~140 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.66 (dd, J=8.4, 1.3 Hz, 4H), 7.66 (d, J=7.4 Hz, 2H), 7.59 (dd, J=8.1, 6.8 Hz, 4H); IR (KBr) v: 3423 1760, 1508, 1171, 831 cm-1; HRESIMS calcd for C15H13ClN3 [M+H]+ 272.0769, found 272.0785.
3.3 计算方法
所有量子化学计算均采用密度泛函理论(DFT)方法并由Gaussian 09程序包完成.各化合物的几何结构优化, 吉布斯自由能计算在B3LYP/6-311G++(d, p)理论水平下获得.基于计算所得各物质最优结构, 对于每一个过渡态, 用內禀坐标(IRC)方法进一步验证了其可以正确地连接前后中间体.考虑反应中的溶剂效应, 在气相优化结构的基础上, 采用了基于极化连续介质模型(PCM)的自洽反应场(SCRF)方法, 在B3LYP/6-311+G(d, p)水平下计算了所有反应物、过渡态、中间体及产物在溶剂苯(ε=2.284) 中的单点能.之后进行熵的校正, 每一个优化结构都在同一水平做振动频率分析, 中间体无虚频, 过渡态具有唯一虚频.
辅助材料(Supporting Information) 化合物2a, 3a和4a的1H NMR, IR和HRMS谱图; 化合物2f~3i和3f~3i的LCMS以及过渡态计算数据.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Suda, A. ; Kawasaki, K. ; Komiyama, S. ; Isshiki, Y. ; Yoon, D. O. ; Kim, S. J. ; Na, Y. J. ; Hasegawa, K. ; Fukami, T. A. ; Sato, S. Bioorg. Med. Chem. 2014, 22, 892.
(b) Zhou, J. ; Min, J. ; Li, Z. G. ; Anne, Y. ; Heather, D. ; Tian, G. ; Young-Tae, C. ; Neville, R. K. Bioorg. Med. Chem. Lett. 2008, 18, 1308.
(c) Sergio, M. ; Davide, P. ; Paolo, C. ; Nicoletta, B. ; Diego, M. ChemMedChem 2008, 3, 873.
(d) Rita, M. ; Simona, S. ; Giovanni, S. ; Francesca, V. ; Lisa, D. V. J. Med. Chem. 2004, 47, 4649.
(e) Nishimura, N. ; Kato, A. ; Maeba, I. Carbohydr. Res. 2001, 331, 77.
(f) Klenke, B. ; Stewart, M. ; Barrett, M. P. ; Brun, R. ; Gilbert, I. H. J. Med. Chem. 2001, 44, 3440.
(g) Iino, Y. ; Karakida, T. ; Sugamata, N. ; Andoh, H. ; Takei, H. ; Takahashi, M. ; Yaguchi, S. ; Matsuno, T. ; Takehara, M. ; Sakato, M. ; Kawashima S. ; Morishita, Y. Anticancer Res. 1998, 18, 171.
(h) Li, Y. J. ; Shi, X. L. ; Gao, L. X. ; Jin, K. ; Sheng, L. ; Wu, J. H. ; Peng, L. N. ; Li, J. Chin. J. Org. Chem. 2015, 35, 191 (in Chinese).
(李英俊, 史相玲, 高立信, 靳焜, 盛丽, 吴疆红, 彭立娜, 李佳, 有机化学, 2015, 35, 191. ) -
[2]
(a) Naik, S.; Kumaravel, M.; Mague, J. T.; Balakrishna, M. S. Inorg. Chem. 2014, 53, 1370.
(b) Xiao, C. Y.; Li, Y. M.; Lun, H. J.; Cui, C. Y.; Xu, Y. Q. J. Solid State Chem. 2013, 208, 127. -
[3]
Wojciech, C.; Joanna, P.; Roland, S.; Mariola, K.; Edyta, G. Dyes Pigm. 2006, 71, 224. doi: 10.1016/j.dyepig.2005.07.004
-
[4]
(a) Roy, B.; De, N.; Majumdar, K. C. Chem. Eur. J. 2012, 18, 14560.
(b) Majumdar, K. C.; De, N.; Roy, B.; Bhowmik, A. Liq. Cryst. 2010, 37, 1459.
(c) Kotha, S.; Kashinath, D.; Kumar, S. Tetrahedron Lett. 2008, 49, 5419.
(d) Lee, C. H.; Yamamoto, T. Bull. Chem. Soc. Jpn. 2002, 75, 615.
(e) Goldmann, D.; Janietz, D.; Schmidt, C.; Wendroff, J. H. Angew. Chem., Int. Ed. 2000, 39, 1851. -
[5]
(a) Hernandez-Juarez, M.; Vaquero, M.; Alvarez, E.; Salazar, V.; Suarez, A. Dalton Trans. 2013, 42, 351.
(b) Santra, P. K.; Sagar, P. J. Mol. Catal. A: Chem. 2003, 197, 37. -
[6]
王光荣, 曾和平, 有机化学, 2009, 29, 1115. http://sioc-journal.cn/Jwk_yjhx/CN/Y2009/V29/I07/1115Wang, G. R.; Zeng, H. P. Chin. J. Org. Chem. 2009, 29, 1115. http://sioc-journal.cn/Jwk_yjhx/CN/Y2009/V29/I07/1115
-
[7]
罗浩敏, 王辉, 曾卓, 曾和平, 有机化学, 2013, 33, 916. doi: 10.6023/cjoc201209024Luo, H. M.; Wang, H.; Zeng, Z.; Zeng, H. P. Chin. J. Org. Chem. 2013, 33, 916. doi: 10.6023/cjoc201209024
-
[8]
Hirt, R.; Nidecker, H.; Berchtold, R.; Schönholzer, G. Helv. Chim. Acta 1950, 33, 1365. doi: 10.1002/hlca.19500330536
-
[9]
(a) Janietz, D.; Bauer, M. Synthesis 1993, 33.
(b) Isfahani, A. L.; Mohammadpoor-Baltork, I.; Mirkhani, V.; Khosropour, A. R.; Moghadam, M.; Tangestaninejad, S.; Kia, R. Adv. Synth. Catal. 2013, 355, 957. -
[10]
Forsberg, J. H.; Spaziano, V. T.; Klump, S. P.; Sanders, K. M. J. Heterocycl. Chem. 1988, 25, 767. doi: 10.1002/jhet.v25:3
-
[11]
Biswas, S.; Batra, S. Eur. J. Org. Chem. 2012, 18, 3492. http://www.chemie.de/fachpublikationen/391910/one-step-synthesis-of-2-amino-5h-pyr-imido-5-4-b-indoles-substituted-2-1-3-5-triazin-2-yl-1h-indoles-and-1-3-5-tri-azines-from-aldehydes.html
-
[12]
Xie, F.; Chen, M.; Wang, X.; Jiang, H.; Zhang, M. Org. Biomol. Chem. 2014, 12, 2761. doi: 10.1039/C3OB42589D
-
[13]
Guo, W. Org. Biomol. Chem. 2015, 13, 10285. doi: 10.1039/C5OB01799H
-
[14]
Huang, W.; Tang, F. S.; Li, B.; Su, J. H.; Tian, H. J. Mater. Chem. 2014, 6, 1141.
-
[15]
Conn, G.; Eisler, S. Org. Lett. 2011, 13, 5080. doi: 10.1021/ol201946f
-
[16]
(a) Bernhard, M. ; Gerhard, Z. US 5322941, 1994 [Chem. Abstr. 1994, 121, 157678].
(b) Hou, B. Mod. Plast. Process. Appl. 2002, 14, 24 (in Chinese).
(侯博, 现代塑料加工应用, 2002, 14, 24. ) -
[17]
Ishikawa, M.; Yamazaki, Y.; Koyama, T. J. Ind. Chem. 1970, 73, 550. http://ci.nii.ac.jp/naid/130004278971
-
[1]
-
表 1 温度对苯与三聚氯氰Friedel-Crafts反应的影响a
Table 1. Effect of reaction temperature
Entry Temperature/℃ Gas medium Initial pressure/kPa Reaction pressureb/kPa Conversion/% Selectivity/% 2a 3a 4a 1 90 Air 101 101 57.8 98.5 1.4 0.1 2 100 Air 101 101 62.5 96.9 2.9 0.2 3 110 Air 101 101 69.9 75.5 21.2 3.3 4 120 Air 101 122 89.1 53.2 33.9 12.9 5 130 Air 101 304 >99.0 46.7 37.7 15.6 6 130 N2 101 304 >99.0 47.8 36.2 16.0 7 130 N2 507 527 >99.0 48.2 35.6 16.2 8 140 Air 101 334 >99.0 14.3 27.9 57.8 9 150 Air 101 517 >99.0 6.3 15.1 78.6 10 160 Air 101 628 >99.0 0.1 0.7 99.2 11 160 N2 101 618 >99.0 0.2 0.5 99.3 an(benzene):n(cyanuric chloride):n(AlCl3)=10:1:1.5, Reaction time=2 h.bThe pressure was the measured pressure when the autoclave was heated to the reaction temperature. 表 2 苯与三聚氯氰的摩尔比对反应的影响a
Table 2. Effect of the proportion of benzene to the reaction
Entry n(cyanuric chloride):
n(benzene)Conversion/% Selectivity/% 2a 3a 4a 1 1:1 3.1 99.8 <0.1 <0.1 2 1:2 41.2 82.8 13.2 4.0 3 1:3 78.9 68.7 25.1 6.2 4 1:5 77.6 56.4 33.7 9.9 5 1:10 99.3 46.7 37.7 15.6 an(cyanuric chloride):n(AlCl3)=1:1.5, Reaction time=2 h, Reaction temperature=130 ℃. 表 3 AlCl3用量对苯与三聚氯氰难以Friedel-Crafts反应的影响a
Table 3. Effect of the amount of AlCl3 to the reaction
Entry n(cyanuric chloride):n(AlCl3) Conversion/% Selectivity/% 2a 3a 4a 1 1:0.5 61.4 96.0 3.9 Trace 2 1:0.75 89.4 77.0 21.3 1.7 3 1:1.0 89.1 54.4 40.5 5.1 4 1:1.5 99.3 46.7 37.7 15.6 5 1:2.0 94.5 8.5 9.6 81.8 6 1:2.5 97.7 Trace Trace 99.9% an(benzene):n(cyanuric chloride)=10:1, Reaction time=2 h, Reaction temperature=130 ℃. 表 4 三聚氯氰浓度随时间变化关系表a
Table 4. Relationship between time and concentration of cyanuric chloride
Entry Time/
minConcentration/
%1 0 0.300 2 5 0.227 3 15 0.193 4 35 0.161 5 60 0.137 6 100 0.132 7 150 0.116 8 210 0.106 9 290 0.099 10 380 0.090 11 480 0.078 aThe tube sealing reaction was not in situ sampling, and the above data are parallel reactions. 表 5 各物质和状态的吉布斯自由能参数
Table 5. Gibbs free energy parameters of matters and states
Entry Substrate Gibbs free energy θ1/Hartree After PCM corrections θ2/Hartree θ1+θ2/Hartree 1 1 0.001935 -1659.318502 -1659.318482 2 AlCl3 -0.025196 -1623.348974 -1623.37417 3 PhH 0.073305 -232.3193965 -232.2460915 4 HCl -0.011217 -460.8378652 -460.8490822 5 TS-2 0.088195 -3514.935039 -3514.846844 6 TS-3 0.173363 -3286.447067 -3286.273704 7 TS-4 0.258009 -3057.961116 -3057.703107 8 2a 0.088225 -1430.826345 -1430.73812 9 3a 0.174161 -1202.329506 -1202.155345 10 4a 0.259983 -973.8275301 -973.5675471 表 6 不同Lewis酸对反应的影响a
Table 6. Different Lewis acids effect on the reaction
Entry Catalyst Conversion/% Selectivity/% 2a 3a 4a 1 AlCl3 89.1 54.4 40.5 5.1 2 FeCl3 85.8 52.6 38.9 8.5 3 SbCl3 84.2 53.8 39.7 6.5 4 SnCl5 82.5 56.2 36.6 7.2 an(benzene):n(cyanuric chloride):n(AlCl3)=10:1:1, Reaction time=2 h, Reaction temperature=130 ℃. 表 7 低沸点芳香环化合物与三聚氯氰的反应a
Table 7. Reaction between cyanuric chloride and aromatic ring

Ar Compd. Conversion/% Selectivity/% 2 3 4b Ph a 89.1 54.4 40.5 5.1 Furyl f 94.7 55.0 46.5 1.5 2-Methylfuryl g 89.0 52.0 41.3 6.7 Thienyl h 93.8 53.9 45.2 0.9 2-methylthienyl i 86.3 50.0 49.5 0.6 Pyridyl j <0.1 Trace Trace Trace Pyrryl k <0.1 Trace Trace Trace an(benzene):n(cyanuric chloride):n(AlCl3)=10:1:1, Reaction time=2 h, Reaction temperature=130 ℃. bThe LC-MS and HPLC determined the content, and the targets were not isolated and characterized. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 52
- 文章访问数: 2519
- HTML全文浏览量: 432


 下载:
下载:





 下载:
下载:

