 图1
CIE色品图以及NTSC和EBU定义的标准蓝光坐标
Figure1.
CIE chromaticity diagram and the position of NTSC & EBU's standard blue emitters
图1
CIE色品图以及NTSC和EBU定义的标准蓝光坐标
Figure1.
CIE chromaticity diagram and the position of NTSC & EBU's standard blue emitters

Citation: Tan Jihua, Huo Yanping, Cai Ning, Ji Shaomin, Li Zongzhi, Zhang Li. Progress on Donor-Acceptor Type Thermally Activated Delayed Fluorescence Based Blue Emitters[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2457-2480. doi: 10.6023/cjoc201704015

电子给体-受体型热活化延迟荧光蓝光材料研究进展
English
Progress on Donor-Acceptor Type Thermally Activated Delayed Fluorescence Based Blue Emitters
-
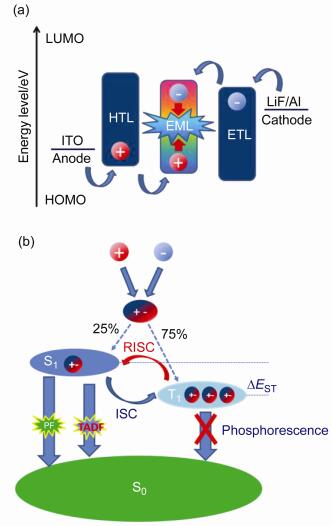
1987年, Tang及Van Slyke[1]首创性地报道了有机小分子超薄多层电致发光二极管, 引发了学术界和工业领域对有机发光二极管(OLED)的研发热潮.由于OLED具有重量轻、柔软性好、工作温度范围宽、反应时间短、亮度和对比度高及可视角宽等优点[2], 在平板显示、智能手机以及固体发光等领域有着巨大的应用潜力.一般而言, OLED主要由阳极、空穴传输层、发光层(由发光材料单独组成或分散在主体材料中组成)、电子传输层以及阴极依次堆叠组成, 空穴和电子分别由阳极和阴极注入有机层, 在发光层相遇复合, 形成激子并发射出光子, 这一现象最开始在蒽单晶中被观察到[3].激子从激发态到基态的辐射失活过程中存在不同的自旋多重态, 例如单重态或三重态, 从而发射不同性质的光, 即荧光或磷光.相应的, 基于电子从最低激发单重态(S1)辐射失活回到基态发光原理的器件为传统荧光OLED; 以电子从最低激发三重态(T1)辐射跃迁到基态发光原理的器件为磷光OLED.根据自旋统计定理[4], 电激发电子按1:3的比例分别产生单重态和三重态激子(即分别占25%和75%), 而量子力学理论的选择规则[5]指出, 只有当两个电子态具有相同自旋多重性时才能实现相互转换, 而具有不同自旋多重性的两个电子态之间的跃迁是被禁阻的, 一般情况下, 基态为自旋单重态(S0).因此, 不难发现, 传统荧光OLED仅仅利用25%的S1态电致激子发光, 75%的T1态电致激子由于自旋禁阻作用以非辐射失活的形式回到S0态导致热散失从而造成“浪费”.因此, 传统荧光OLED的内量子效率(internal quantum efficiency, IQE)仅有25%, 而遵循朗伯发光模式的荧光OLED器件的光取出效率只有20%左右, 所以传统荧光OLED器件的最大外量子效率(external quantum efficiency, EQE)只有5%.另一方面, 传统纯有机发光分子由于S1态和T1态之间自旋多重性不一致而造成的跃迁禁阻, 使得两者之间普遍存在较大的ΔEST (>0.5 eV).故一般情况下, 传统纯有机小分子仅发射荧光, 不发射磷光.直到1998年, Baldo等[6]首次报道通过在有机小分子中引入铱(Ⅲ)、铂(Ⅱ)以及锇(Ⅱ)等金属形成配合物, 可以通过自旋偶合作用加强分子内部系间窜越(intersystem crossing, ISC), 从而实现了在室温下S1和T1共同参与的磷光发射, 获得了理论上达到100%的IQE, 以朗伯模式发光获得20%的最大EQE, 克服了传统荧光OLED器件发光效率低下的问题.尽管如此, 磷光OLED器件在高电流密度工作状态下, 三重态-三重态湮灭效应尤为显著, 导致器件有机层之间的激子扩散猝灭, 造成显著的器件效率滚降效应, 通常需要掺杂在相应的主体材料中, 以获得更好的效率稳定性[7].同时, 由于磷光材料掺杂了稀土金属等贵金属, 导致其合成成本居高不下, 不利于大规模生产.
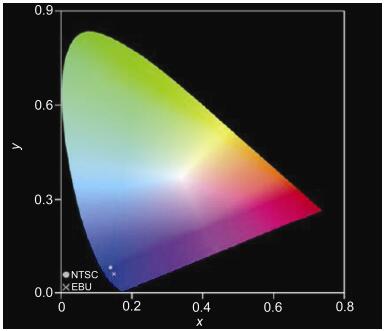
众所周知, 全彩显示或固态发光均需要红色、绿色和蓝色(red, green and blue, RGB)三种基本色光. 图 1为1931年由国际照明委员会(Commission Internationale de l′Eclairage, CIE)发布的色品图.当发光材料的发射光谱的CIE色坐标落在色品图左下角蓝色区域时, 即可称之为蓝光材料.后来, 考虑到全彩显示和固态发光技术, 美国电视委员会(US National Television Systems Committee, NTSC)和欧洲广播联盟(European Broadcasting Union, EBU)分别对标准蓝光作出了定义.其中NTSC将标准蓝光材料的CIE坐标值限定为x+y<0.30, 深蓝光材料的CIE坐标y<0.08;而EBU则规定深蓝光材料发射光谱的CIE坐标y<0.06[8].因此, 获得深蓝光材料意味着材料需要具有一个十分宽的HOMO, LUMO能隙(Eg) (>3.0 eV), 而宽能隙必然会对材料分子的设计造成困扰, 其OLED器件也会使空穴和电子注入有机层变得十分困难.同时, 相较于绿光和红光材料, 蓝光材料通常表现出更差的电致发光性能:较低的器件效率, 更短的器件寿命以及差的色纯度[8].因此, 性能优异的全彩显示或固态发光材料不但需要高电致发光效率及长器件寿命, 还需要具有适当的发光波长, 以表现出RGB基础色光.合成CIE色坐标(0.10, <0.10), 发光寿命>10000 h以及高发光效率的蓝光材料, 对于全彩显示和固态发光技术的进一步发展具有十分重要的意义.
 图1
CIE色品图以及NTSC和EBU定义的标准蓝光坐标
Figure1.
CIE chromaticity diagram and the position of NTSC & EBU's standard blue emitters
图1
CIE色品图以及NTSC和EBU定义的标准蓝光坐标
Figure1.
CIE chromaticity diagram and the position of NTSC & EBU's standard blue emitters
综上所述, 研发具有高性价比的蓝光材料已经成为推动有机光电器件进一步发展的当务之急.近年来, Adachi团队[9]报道了一种以热活化延迟荧光(thermally activated delayed fluorescence, TADF)作为发光机理的全新OLED器件.该类器件可在不引入贵金属或稀土金属的情况下实现S1态和T1态激子共同参与荧光发射.其IQE理论值可达到100%, 可媲美磷光OLED, 并且在合成成本上比磷光OLED具有更大的优势, 被誉为“第三代”发光器件.如图 2所示, 分子的S1态在能量上高于T1态, 两者之间存在一定的能级差(ΔEST), 当ΔEST足够小(<0.5 eV)时, 分子内部发生反向系间窜越(reverse intersystem crossing, RISC): T1态激子通过吸收环境热上转换到S1态[10~12].原本占据在S1态的25%的激子迅速辐射失活产生纳秒级的即时荧光(prompt fluorescence, PF), 75%的T1态激子通过RISC过程上转换到S1态后辐射失活产生微秒级甚至毫秒级寿命的延迟荧光(delayed fluorescence, DF), 由于两者在发光光谱上完全一致, 二者构成的TADF比传统荧光在寿命上高出3个数量级.根据玻耳兹曼分布关系, RISC速率常数kRISC与ΔEST成正比:
kB为玻耳兹曼常数, T为温度.所以, 为了实现高效的TADF, 获得分子内足够小的ΔEST至关重要. Tao等[13]的研究指出, ΔEST满足下列关系式:
其中E为轨道能量, K为电子排斥能, J为交换能.根据量子理论, 交换能J与分子的HOMO和LUMO能级及空间波函数有关.一般而言, 电子给体-电子受体(eletron donor-acceptor, D-A)分子通过基团之间空间阻碍作用使电子给、受体产生空间扭转, 可以使HOMO和LUMO能级分别分布在电子给体和电子受体上, 从而很大程度上实现分子的HOMO和LUMO能级在空间上分离, 使分子ΔEST降低.所以, 高效的TADF是基于足够小的ΔEST和相对较大的kr实现的.
1 D-A型热活化延迟荧光蓝光材料的设计及其合成策略
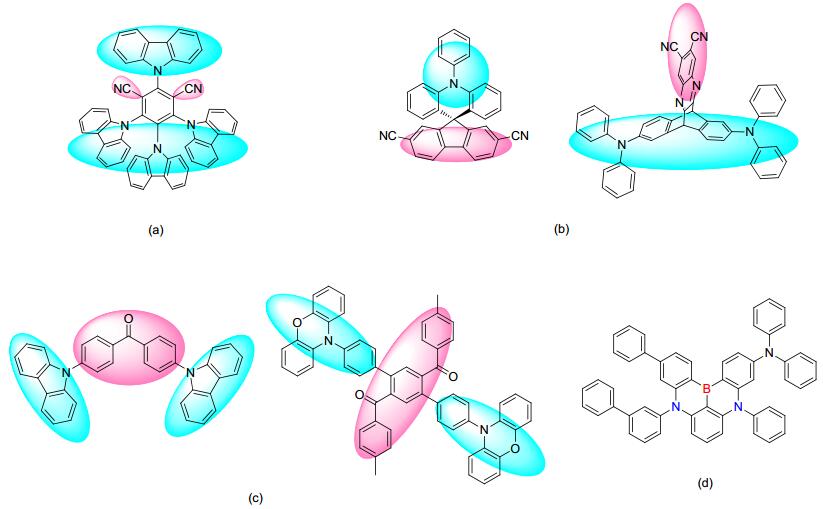
尽管TADF现象独特, 机理复杂, 但TADF材料的设计却有一定的规律可循.就高效的D-A型TADF蓝光材料而言, 应该同时满足下列三个条件: (1) 相对小的S1态和T1态能级差(ΔEST)以实现高效的RISC过程; (2) 相对大的S1态辐射衰减率(kr)以获得较高的荧光量子产率(photoluminescence quantum yield, PLQY); (3) S1能级需≥2.9 eV以实现纯蓝光发射.其中小的ΔEST可以通过分离的HOMO和LUMO能级来实现[14].根据给体单元决定HOMO分布、受体单元决定LUMO分布的基本规律, D-A结构可方便地调控HOMO和LUMO分离和重叠程度.具体地, 可以通过下列方法实现D-A分子HOMO和LUMO能级的分离(图 3): (a)通过巧妙选择电子给、受体或添加修饰基团以引起较大的空间位阻[15]; (b)通过螺连接[16]、正交连接[17]等特殊键接方式或通过物理方式实现电子给体和电子受体的空间分离; (c)通过“蝴蝶构型”[18]、“X型构型”[19]等特殊分子构型实现HOMO和LUMO能级分离; 此外, 还有(d)通过构建刚性平面并引入具有相反共振效应的原子以获得多重共振效应的方式获得较小ΔEST[20].
另一方面, 根据Franck-Condon理论[21], HOMO和LUMO一定的重叠是实现高PLQY的必要条件, 显然高PLQY与低ΔEST之间理论上是相矛盾的, 所以在设计高效的D-A型TADF材料时需要巧妙选择电子给体与受体, 平衡考虑ΔEST与PLQY两个因素是获得高效TADF材料的前提条件.目前获得高PLQY的途径有如下几点:通过分子内电子给体、电子受体基团的密集连接以及加强分子结构的刚性, 可以降低分子的重组能, 从而减少非辐射衰变, 以获得较高的辐射衰变速率[22]; 增加分子基态的电子波函数重叠密度分布, 可以提高S1态到基态的辐射衰变速率, 以达到增加PLQY的效果[23]; HOMO和LUMO能级的有效分离可以使分子前线轨道产生离域, 从而在保证获得小的ΔEST同时, 抑制辐射衰减速率的降低[24]; 通过巧妙引入修饰官能团, 使TADF分子获得聚集诱导效应, 可以较少TADF分子浓度淬灭和激子湮灭, 进而提高辐射衰减速率, 获得更高的PLQY[22].同时, 为了获得深蓝色的TADF材料, 必须合理搭配电子给体和电子受体, 使分子获得较高的S1态能级.而通过控制分子内共轭长度, 可以有效调控发光波长.一般而言, π共轭长度越长, 分子越倾向于长波发光, 不利于实现深蓝色发光并且分子较小的Stokes位移同样可以抑制非辐射衰变.此外, 针对D-A型TADF蓝光OLED器件普遍存在的效率滚降问题, 国内的苏仕健课题组[25]早年提出, 通过构建分子“载波和激子约束结构”可以极大程度上抑制蓝光OLED效率滚降问题, 从而获得高性能的蓝光器件.
目前, 常用于构筑D-A型TADF材料的电子给体主要是具有较强的给电子能力、高的三线态能级、较好的稳定性以及制备工艺简单等特点的芳胺构筑单元, 如咔唑、苯胺、吖啶、吩噁嗪及其衍生物等; 而对于电子受体来说, 则可供选择的范围更广, 如1, 3, 5-三嗪、1, 3, 4-噁二唑、1, 2, 4-三唑、嘧啶、氮杂环并菲等含氮杂环以及二苯甲酮、氰基苯、三芳基硼、二苯砜及其衍生物等. D-A型TADF分子常用的合成思路是先分别设计合成电子给体与电子受体, 最后以不同的键接方式、键接位置以及引入不同数量的电子给受体数量将两者连接, 获得结构多样和性能不同的TADF分子.并且可以通过在共轭体系中引入柔性链以改善化合物的溶解性, 使TADF材料可用于湿法加工.最常用的电子给、受体连接方式是在电子受体的相应位置引入卤素原子作为电子给体取代靶点, 在强碱或其他催化剂作用下电子给体取代卤素原子, 如Eq. 1所示.
2 D-A型热活化延迟荧光蓝光分子及其OLED
为了获得足够小的ΔEST, D-A型TADF蓝光材料可以通过引入适当的电子给体和电子受体以及巧妙利用分子的几何构型、键接方式以产生空间阻碍作用, 使电子给受体呈现较大的二面角, 实现HOMO和LUMO能级的空间分离.另一方面, 分子S1态能级需要>2.9 eV以获得较纯蓝色光.所以在选择电子给体和受体方面需要巧妙合理设计.下文将详细介绍常见的D-A型TADF蓝光材料及其在OLED器件的应用, 主要包括以1, 3, 5-三嗪类、1, 3, 4-噁二唑及1, 2, 4-三唑类、嘧啶类、氮杂环并菲类等含氮杂环化合物以及二苯甲酮类、氰基类、芳基硼类和砜类及其衍生物作为电子受体的D-A型TADF蓝光材料及OLED器件.所述TADF蓝光材料及其OLED器件光电性质数据列于表 1.
 表 1
分子在溶液中或分散在主体薄膜或非掺杂成膜中光致发光波长(λPL)、氮气环境下荧光量子产率(PLQY)、室温环境下荧光寿命(τPF, τDF)、单重态-三重态能级差(ΔEST)、电致发光波长(λEL)、最大外量子效率(EQE)以及CIE色坐标
Table 1.
PL peak (λPL) in solution or dispersed in a host film or in neat film, photoluminescence quantum yield (PLQY, under nitrogen), lifetime at room temperature(τPF, τDF), singlet-triplet energy gap (ΔEST), EL peak (λEL) and maximum EQE, CIE for TADF based blue emitters and OLEDs
表 1
分子在溶液中或分散在主体薄膜或非掺杂成膜中光致发光波长(λPL)、氮气环境下荧光量子产率(PLQY)、室温环境下荧光寿命(τPF, τDF)、单重态-三重态能级差(ΔEST)、电致发光波长(λEL)、最大外量子效率(EQE)以及CIE色坐标
Table 1.
PL peak (λPL) in solution or dispersed in a host film or in neat film, photoluminescence quantum yield (PLQY, under nitrogen), lifetime at room temperature(τPF, τDF), singlet-triplet energy gap (ΔEST), EL peak (λEL) and maximum EQE, CIE for TADF based blue emitters and OLEDs
Compound λPL/nm PLQY/% τPF/ns τDF/μs ΔEST/eV λEL/nm EQE/% CIE Ref. 1 466b, 492a 35, 39a 12, 10a 120, 230a 0.080 506 5.3 — [26] 2 457, 480a 74d 6.3 — 0.09, 0.11a 487a 20.6g 0.19, 0.35 [27] 3 458, 475a 57d 6.0 — 0.28, 0.19a 478a 16.8g 0.17, 0.27 [27] 4 458, 475a 72d 6.5 — 0.032, 0.29a 477a 14.6g 0.18, 0.28 [27] 5 435 62 27 22 0.06 485 11 — [28] 6 — 16.7c — 3.9 0.1 470 9.3f 0.15, 0.22 [29] 7 — 50.5c — — 0.03 484 14.7f 0.17, 0.34 [29] 8 — 43.0c — — 0.01 480 12.3f 0.17, 0.31 [29] 9 — 40e — 13.4 0.17 486 23.6f 0.21, 0.36 [30] 10 — 97.9c — 5.4 0.002 477 20.4f 0.18, 0.31 [31] 11 — 31.1c — 29.6 0.191 473 13.2f 0.17, 0.25 [31] 12 — 85.3c — 31.2 0.302 465 16.7f 0.15, 0.18 [31] 13 495 29.8d 11.0 4.73 — — — — [35] 14 502, 510a 43.1d, 87a, d 21.1, 11.2a 13.3, 520a 0.15 508 14.9g — [35] 15 577, 550a 12d, 45a, d 9.0, 7.0a 0.52, 5.4a 0.08 580 9.5g — [36] 16 528 7d, 44a, d 3.9 33 0.02 — 9.2g — [36] 17 495 4, 12a, d 3.6 — 0.08 — 4.3g — [36] 18 428b 75±2b, e — — 0.5 — 6.8h 0.158, 0.043 [37] 19 458, 464a 87a, e 12a 38a 0.25 470 20.4g 0.15, 0.15 [40] 20 451, 452a 69a, e 11a 40a 0.25 462 12.2g 0.15, 0.12 [40] 21 461, 466a 91a, e 13a 45a 0.26 469 17.1g 0.15, 0.18 [40] 22 454, 458a 90a, e 11a 70a 0.29 460 14.3g 0.15, 0.13 [40] 23 448, 457a 83a, e 11a 78a 0.30 458 11.4g 0.15, 0.13 [40] 24 453, 458a 54e, 92a, e 11a 330a 0.26a 468 19.0h 0.16, 0.21 [41] 25 456, 462a 50e, 94a, e 11a 210a 0.24a 472 20.8h 0.16, 0.24 [41] 26 498 77a, e — 21.4a 0.18a 499 20.9 0.21, 0.44 [42] 27 498 79a, e — 20.7a 0.19a 498 19.0 0.21, 0.44 [42] 28 489 80a, e — 26.2a 0.19a 489 24.5 0.19, 0.37 [42] 29 503, 492a 26e, 49a, e — — 0.16 496 7.5h — [47] 30 490, 483a 36e, 52a, e — — 0.13 486 8.7h — [47] 31 532, 499a 77e, 77a, e 50 18.1 0.26 499 7.5h — [47] 32 428b 75±2b, e — — 0.5 — 6.8h 0.158, 0.043 [37] 33 420b 43e — — — — 3.5h 0.156, 0.058 [37] 34 485 45b, d, 81a, d 175 5.3 0.04 490 16.5g 0.17, 0.30 [50] 35 438, 444a 21e, 55a, e — 7.1 0.21 446 8.1h 0.16, 0.14 [18] 36 462, 475a 38e, 73a, e — 4.6 0.14 484 14.3h 0.17, 0.27 [18] 37 509, 538a 44e, 70a, e — 0.12 0.03 539 10.7h 0.37, 0.58 [18] 38 566, 541a 36e, 71a, e — 0.13 0.10 586 4.2h 0.58, 0.36 [18] 39 600, 555a 10e, 36a, e — 0.03 0.06 548 6.9h 0.49, 0.51 [18] 40 496 46a, d — 925 0.05 504 10g — [19] 41 — 37e, 63a, e — 3.1 0.16 481 23.3f 0.21, 0.34 [30] 42 468, 469a 70a, e 134a 48.16a 0.06 484 11.4h 0.174, 0.310 [51] 43 490, 514a 88.0c 15 0.6 0.03 488 24.0f 0.17, 0.36 [52] 44 508, 518a 91.4c 18 1.0 0.04 514 27.2f 0.30, 0.64 [52] 45 467, 467a 90a, e 6.2 0.2 0.06 474 18.4f 0.16, 0.25 [53] 46 473 46.5c, 89b, c 28.5 166, 273b 0.34 470 8.0f — [15, 54, 55] 47 447 35e — 1.2b 0.05 462 16.4f 0.17, 0.30 [56] 48 473a 94.6e, 85a, e — 2.60 0.13 486 12.1g — [57] 49 475a 94.0e, 85a, e — 1.98 0.17 486 11.8g — [57] 50 470 87e — 2.35 0.11 510 17.9h 0.29, 0.52 [58] 51 448 66e — 2.96 0.16 475 21.8h 0.17, 0.29 [58] 52 444 61e — 4.21 0.21 473 19.5h 0.16, 0.23 [58] 53 443 76e, 74b, e — 28 0.06 463 17.8h 0.16, 0.19 [59] 54 453 81e, 100b, e — 17 0.06 471 20.0h 0.16, 0.25 [59] 55 458 46e — 24.34a 0.27 456 14g 0.14, 0.12 [60] 56 453 76e — 24.34a 0.27 460 4.8g — [60] 57 450 63e 41 173 0.36 465 8.7f 0.15, 0.18 [61] 58 499 86e 35 5.1 0.20 504 18.9f 0.23, 0.50 [61] 59 455 46.6a, e 14.2 57.9 0.02 500 19.9f 0.22, 0.40 [62] 60 455 54.9a, e 10.5 12.9 0.01 484 17.4f 0.18, 0.32 [62] 61 448 49.7e — 46.6 0.04 475 21.2f 0.20, 0.35 [63] 62 488, 490a 34.5e, 91.6a, e 10.4a 19.3 0.19 — 23.9h 0.24, 0.49 [64] 63 504, 495a 30.6e, 89.3a, e 10.7a 14.5 0.18 — 23.1h 0.28, 0.54 [64] 64 562, 550a 48.9e, 90.4a, e 26.7a 1.9 0.032 — 29.2h 0.43, 0.55 [64] 65 524, 526a 31.1e, 100a, e 15.7a 11.6 0.09 — 31.3h 0.32, 0.59 [64] 66 543, 541a 54.5e, 95a, e 23.7a 5.2 0.04 — 30.6h 0.34, 0.57 [64] 67 462, 470a 17.8e, 36a, e 6.99a 0.03 0.439 — 5.7h 0.17, 0.18 [64] 68 431, 436a 11.2e, 15a, e 6.53a 0.01 0.403 — 1.6h 0.16, 0.06 [64] 69 519 31.34e 5.09 8.01 0.03 — 1.50f 0.16, 0.28 [65] 70 450 31.12e 3.86 7.47 0.02 — 4.01f 0.15, 0.14 [65] 71 509, 504a 44d, 92a, d — — 0.071 502 22.8g 0.22, 0.55 [66] 72 495, 487a 84d, 100a, d — — 0.058 492 21.6g 0.18, 0.43 [66] 73 477, 477a 91d, 87a, d — — 0.062 488 14.0g 0.22, 0.55 [66] 74 475 100d 33 1.60 0.10 480 21.7g 0.14, 0.23 [67] 75 456 76d 28 4.02 0.12 475 19.0g 0.14, 0.12 [67] 76 451 56d 26 2.06 0.06 465 20.1g 0.15, 0.09 [67] 77 443 86d 21 3.49 0.12 465 13.3g 0.15, 0.08 [67] 78 467 99e 19 91 0.24 473 18.2f 0.15, 0.23 [68] 79 — — — — — — — — [69] 80 440a 98a, d — 2.36 0.013 466 15.1f — [69] 81 482a 99a, d — 1.87 0.028 503 22.1f — [69] 82 — — — — 0.456 — — — [70] 83 484 89.0d 41.4 6.71 0.041 479 16.0f 0.14, 0.24 [70] 84 540 87.0d 42.8 1.98 0.033 525 17.3f 0.28, 0.58 [70] 85 446 81a, d 47.8 4.15 0.040 — — 0.14, 0.09 [71] 86 462 81a, d 25.0 3.70 0.057 — — 0.14, 0.15 [71] 87 402, 421a 57e, 60a, e 2.2, 3.5a 90, 850a 0.54 420 2.9f — [72] 88 419, 430a 65e, 66a, e 3.1, 3.2a 140, 840a 0.45 425 5.6f — [72] 89 404, 423a 69e, 80a, e 5.3, 7.6a 270, 2600a 0.32 400 9.9f 0.15, 0.07 [72] 90 445 56d — 127 0.21 460 14.5f 0.16, 0.16 [73] 91 426 64d 6.5 347, 2530 0.25 428 — 0.15, 0.12 [74] 92 439 52d 8.7 378, 2860 0.17 440 — 0.19, 0.15 [74] 93 461 56.3e — 1.23 0.19 460 11.7 0.18, 0.19 [75] 94 434 69.3e — 1.16 0.26 435 5.5 0.15, 0.08 [75] 95 451, 458a 48e, 98a, e 29 2.7 0.06 486 20.5f 0.16, 0.26 [76] aDispersed in a host film. bNeat film. cCalculated from the PL measurement. dAbsolute PLQY from spectrometer measurement. eAbsolute PLQY from integrating sphere measurement. fCalculated from the current density, luminance and EL measurement. gAbsolute Maxmuim EQE from spectrometer measurement. hAbsolute Maxmuim EQE from integrating sphere measurement. 2.1 氮杂环类D-A型TADF蓝光材料
2.1.1 1, 3, 5-三嗪类D-A型TADF蓝光材料
1, 3, 5-三嗪由于含有三个亚胺氮(C=N), 呈现出高度缺电子的性质, 而三嗪环上三个与氮原子相邻的活性位点为对其做进一步修饰提供了多样性和便捷性, 所以1, 3, 5-三嗪衍生物被广泛用作电子受体构建D-A型TADF蓝光材料. 2011年, Adachi等[26]首次利用大体积的苯基吲哚并咔唑作为给体, 合成了1, 3, 5-三嗪基蓝光TADF材料1.利用给体与受体之间的空间位阻, 使分子的HOMO和LUMO能级分别分散在吲哚并咔唑和三嗪基团上.能级的有效分离使1获得较小的ΔEST (0.11 eV)的同时得到了较高的kr (≈107).以质量分数为6% (6 wt%)的1掺杂在mCP薄膜上显示的光致发光光谱中, PF寿命和DF寿命分别为10 ns和230 μs.器件结构为ITO/α-NPD/mCP/mCP:1 (6 wt%)/BP4mPy/LiF/Al (mCP为主体材料), 最大器件EQE(下文所述EQE均为器件最大值)为5.3%.为了进一步探究不同电子给体对分子HOMO的分散程度以及对TADF蓝光分子光电性能的影响, 该团队[27]设计了三种均以2, 4, 6-三苯基-1, 3, 5-三嗪作为电子受体不同的咔唑衍生物作为电子给体的TADF蓝光分子2~4.测量三种分子的振子强度F、跃迁偶极矩Q、荧光辐射衰减率kr、PLQY以及ΔEST值, 发现由于电子给体体积最大的2分子中, 电子给体与受体之间的空间位阻导致HOMO和LUMO能级分离程度更大, 获得最小的ΔEST (0.09 eV)值和最大的F值, kr值以及PLQY (74%).基于上述三种蓝光TADF分子设计的器件结构为ITO (120 nm)/m-CBP (10 nm)/DPEPO:2~4(6 wt%, 15 nm)/DPEPO (10 nm)/TPBi (30 nm)/LiF (0.8 nm)/Al, 以DPEPO为主体材料, m-CBP为空穴传输材料, 其中2也获得最高的EQE (20.6%), 3, 4依次为16.8%和14.6%.
次年, 该团队[28]以2-苯基-1, 3, 5-三嗪基团作为电子受体, 3, 3'-联咔唑作为电子给体, 合成分子5.同样通过两者的空间位阻作用使分子获得更小的ΔEST值(0.06 eV), 并表明二咔唑比单咔唑具有更好的降低分子HOMO, LUMO能级重叠作用.通过测试分子在非极性溶剂环己烷和极性溶剂四氢呋喃中的荧光光谱, 发现明显的红移及吸收强度下降现象, 表明分子在激发态时偶极矩发生变化, 证实从二咔唑转移到三嗪中心的分子内电子转移现象.器件结构为ITO/α-NPD (40 nm)/5:mCP (6 wt%, 10 nm)/5:DPEPO (6 wt%, 20 nm)/DPEPO (10 nm)/TPBi (30 nm)/LiF (0.8 nm)/Al (80 nm), 5分别分散在空穴传输型主体mCP和电子传输型主体DPEPO中, 以达到扩大载流子复合区的效果, 获得了更高的最大EQE (11%±1%).
2016年, Gong等[29]将咔唑衍生物与2, 4, 6-三苯基-1, 3, 5-三嗪组合, 制备了6~8三种蓝光TADF分子, 并得到更小的ΔEST值(0.1, 0.03和0.01 eV).通过测量三种化合物的单晶结构, 发现咔唑单元与电子受体苯基平面之间的扭转角均约为87°, 而三嗪单元与苯环平面的扭转角均约为34°, 由于在咔唑单元上修饰不同的具有给电子作用的烷基取代基, 导致咔唑的给电子作用强度不一致, 用叔丁基修饰咔唑单元所得的8表现出最小的ΔEST值, 并且发光波长发生相应的红移.表明通过在电子给体上引入具有一定空间阻碍作用的取代基团, 如甲基、叔丁基等, 可以在一定程度上降低分子的ΔEST值, 有利于获得高效的RISC过程, 但由于分子间具有更强电子推拉作用, 使分子更容易出现红移, 不利于深蓝光材料的合成.基于3种化合物的OLED器件结构为ITO (50 nm)/ PEDOT:PSS (60 nm)/TAPC (20 nm)/mCP (10 nm)/mCP: 6~8 (5%, 25 nm)/TSPO1 (35 nm)/TPBi/LiF (1 nm)/Al (200 nm), 最大EQE分别为9.3%, 14.7%和12.3%.
2016年, Lee等[30]将9-苯基-3, 3'-联咔唑作为给体连接到2, 4, 6-三苯基-1, 3, 5-三嗪受体中心制备了ΔEST仅为0.17 eV的分子9.利用该分子制作的蓝光器件结构为ITO (120 nm)/PEDOT:PSS (60 nm)/TAPC (20 nm)/9: DPEPO (25 nm)/TSPO1 (5 nm)/TPBi (30 nm)/LiF (1.5 nm)/Al (200 nm), 器件最大EQE高达23.6%.
同年, 该团队[31]以2, 4, 6-三苯基-1, 3, 5-三嗪为电子受体, 分别以邻位、间位以及对位三种方式键接苯并呋喃咔唑电子给体合成了三种空间阻碍作用依次递减的蓝光TADF分子10~12, 均获得很小的ΔEST.其中邻位取代的分子10获得最小值(0.002 eV), 间位取代次之(0.191 eV), 而对位取代产物由于电子给受体之间空间距离较远, 获得较大的ΔEST (0.302 eV).三者在无氧甲苯溶液下PLQY分别为97.9%, 31.1%和85.3%. 11较大的ΔEST以及较小的振子强度导致其较小的荧光量子产率.三种分子以ITO/PEDOT:PSS (60.0 nm)/TAPC (20.0 nm)/mCP (10.0 nm)/10~12:DPEPO (25.0 nm)/TSPO1 (5.0 nm)/TPBi (30.0 nm)/LiF (1.5 nm)/Al (200.0 nm)为结构组成OLED器件测试其性能, 三种器件均发射较纯蓝色光, CIE色坐标分别为(0.18, 0.31), (0.17, 0.25) 和(0.15, 0.18), 器件最大EQE分别为20.4%, 13.2%和16.7%.其中基于10的OLED器件荧光反应时间仅为5.4 μs, 在1000 cd/m2电流密度下仅仅出现了2.7%的效率滚降, 成为首例同时获得高外量子效率、低效率滚降以及长器件寿命的OLED蓝光器件.
2.1.2 1, 3, 4-噁二唑及1, 2, 4-三唑类D-A型TADF蓝光材料
1, 3, 4-噁二唑衍生物及1, 2, 4-三唑衍生物由于具有高三重态能级, 良好的吸电子性被广泛用作吸电子基团以构建D-A型蓝光TADF分子, 并且由于其出众的电子注入及传输能力, 十分适合用作构建OLED器件[32~34]. 2013年Adachi等[35]报道了两种以吩噁嗪衍生物作为电子给体2, 5-二苯基-1, 2, 4-噁二唑为电子受体的蓝光TADF分子13~14.同样利用吩噁嗪的强给电子能力和1, 2, 4-噁二唑的强电子接收能力, 使两者分子内发生良好的电子转移, 以获得足够小的ΔEST值(14为0.15 eV).两种分子的甲苯溶液在有氧和无氧(氮气鼓泡5 min)环境下测试其荧光量子产率, 结果表明在无氧环境下13和14均表现出更高的荧光量子产率, 分别由18.1%, 19.1%提升到29.8%, 43.1%.两者的即时和延迟荧光寿命, 均表现出类似升高.荧光量子产率和荧光寿命在有氧和无氧环境下的这种差异表明, 氧气可以淬灭三重态激子从而降低TADF分子的荧光量子产率, 使延迟荧光效果减弱.并且由两者同样在无氧环境下的荧光量子产率看出, 连接两个吩噁嗪给体的14比连接单个给体的13表现出更高的荧光强度, 表明双给体D-A分子比单给体D-A分子具有更高的荧光量子产率.基于分子14设计的TADF蓝光OLED结构为ITO/α-NPD (30 nm)/mCP (10 nm)/14:DPEPO (6 wt%, 15 nm)/DPEPO (10 nm)/TPBi (40 nm)/LiF (0.8 nm)/Al (90 nm) (DPEPO为主体材料), 其最大EQE为14.9%.
次年, 该团队[36]以1, 3, 4-噁二唑衍生物及1, 2, 4-三唑衍生物作为电子受体设计TADF分子, 获得了性能更加优异的蓝光TADF分子15~17.三个分子均以5-苯基吩嗪作为电子给体, 分别以2, 5-二苯基-1, 3, 4-噁二唑和3, 4, 5-三苯基-1, 2, 4-三唑作为电子受体.通过基于B3LYP函数方法的密度泛函理论模拟三种分子的基态几何图形, 发现电子给体平面和电子受体的苯环平面之间存在较大的二面角, 分子HOMO和LUMO能级之间较低的重叠使三种分子获得较低的ΔEST值(0.08, 0.02以及0.08 eV).以ITO/α-NPD (40 nm)/15~16:CBP (20 nm)/TPBI (60 nm)/LiF (1 nm)/Al为结构的OLED的最大EQE分别为9.5%和9.2%;另外, 蓝光分子17以ITO/ α-NPD (30 nm)/TCTA (20 nm)/CzSi (10 nm)/17 (20 nm)/ DPEPO (10 nm)/TPBI (30 nm)/LiF (1 nm)/Al为结构的OLED器件最大EQE仅为4.3%.
2016年, Li等[37]合成了一种以1, 2, 4-三唑为电子给体, 咔唑和三苯胺作为电子给体的蓝光分子18.该分子表现出较大的ΔEST (0.5 eV), 但具有较高的PLQY (75%), 成膜状态下其发光波长为428 nm, 且具有非常窄的半峰宽(55 nm), 意味着基于18组成的OLED器件将发射十分纯的蓝色光.结构为ITO/MoO3 (6 nm)/NPB (30 nm)/18 (20 nm)/TPBi (50 nm)/LiF (0.8 nm)/Al (100 nm)的OLED器件CIE色坐标为(0.158, 0.043), 且获得目前为止CIE(y)<0.06的OLED器件中最高的EQE (6.8%).值得一提的是, 器件在1000 cd·m-2电流密度下仍然保持最大EQE的79%, 即使在7323 cd·m-2下仍保持66%, 展示出非常优异的抗效率滚降的性质.
2.1.3 嘧啶类D-A型TADF蓝光材料
与1, 3, 5-三嗪相似, 嘧啶环由于存在两个缺电子的亚胺氮(C=N), 展示出灵活的可修饰性及良好的电子亲和力, 能与大多数具有较高三重态能级的电子给体单元(如咔唑)之间产生良好的电子转移效应[38].另一方面, 由于嘧啶环与咔唑, 噁二唑以及咪唑等单元相比, 具有更低的LUMO能级, 作为发光层在构建蓝光OLED器件时能使电子注入过程更容易[39].因此, 嘧啶衍生物被广泛用于构建D-A型蓝光TADF分子及其OLED器件. 2017年, Yasuda等[40]报道了一系列以嘧啶衍生物为电子受体, 并以螺吖啶衍生物为电子给体的蓝光TADF分子19~23.螺吖啶单元上氢原子以及相邻苯环上的氢原子之间存在较大的空间位阻作用使分子之间的电子给受体表现出近乎正交的构型, 使5种分子均表现出较低的ΔEST值(0.25~0.30 eV).在氮气保护下, 5种分子掺杂在PPF薄膜中获得了高达69%~91%的PLQY, 并且在无氧甲苯溶液中最大发光波长为448~461 nm, 发射深蓝色光.基于上述良好的光学性能, Yasuda等以PPF为主体材料, 构建了结构为ITO (100 nm)/HAT-CN (10 nm)/α-NPD (40 nm)/CCP (5 nm)/19~23 (20 nm)/PPF (10 nm)/TPBi (30 nm)/Liq (1 nm)/Al (100 nm)的OLED器件, 以研究5种分子的光电性能.结果显示, 5种OLED器件分别获得了20.4%, 12.2%, 17.1%, 14.3%以及11.4%的最大EQE, 均发射出深蓝色光, CIE色坐标分别为(0.16, 0.23), (0.16, 0.20), (0.16, 0.21) 以及(0.16, 0.19) 和(0.15, 0.15).此外, 5种OLED器件的启动电压均较低, 为3.5 V左右.
为了获得光电性能更加卓越的蓝光TADF分子及OLED器件, 该团队[41]同样以嘧啶单元为电子受体, 二苯基吖啶为电子给体, 通过在嘧啶中心连接两个电子给体合成两种光电性能更优越的的蓝光TADF分子24和25.由于分子内空间阻碍作用十分显著, 吖啶单元与相连的苯环之间的扭转二面角达到82°~87°, 使24和25分别获得0.16和0.15 eV的ΔEST值同时, 获得了92%和94%的PLQY(以质量分数18%掺杂在PPF薄膜中).此外, 两者的PF寿命均为11 ns, DF寿命分别为210和330 ms.基于2种高效蓝光延迟荧光分子组成的OLED器件结构为ITO (100 nm)/HAT-CN (10 nm)/α-NPD (40 nm)/ CCP (5 nm)/24, 25 (18 wt%):PPF (20 nm)/PPF (10 nm)/ TPBi (30 nm)/Liq (1 nm)/Al (100 nm), 两种器件在低电流密度以及不提高光外耦合率的情况下分别获得19.0%和20.8%的最大EQE, 且发射较纯的蓝色光, CIE色坐标分别为(0.16, 0.21) 和(0.16, 0.24).此外, 两者表现出较低的启动电压, 均为3.6 V, 且分别获得27.9和31.5 lm·W-1较高的发光效率.
同年, Kido等[42]同样以嘧啶衍生物为电子受体, 通过中心嘧啶单元两侧连接9, 9-二甲基吖啶电子给体, 合成了一系列新型的TADF分子26~28, 三种分子具有较小的ΔEST (0.18, 0.19和0.19 eV).其中28在DPEPO薄膜中展示出较高的发光强度(PLQY为80%)以及毫秒级的DF寿命(26 ms).以三种分子为发光层组成的OLED器件结构为ITO/TAPC (30 nm)/26~28 (10 wt%):DPEPO (20 nm)/B3PyPB (50 nm)/LiF (0.5 nm)/Al (100 nm), CIE色坐标分别为(0.21, 0.44), (0.21, 0.44) 以及(0.19, 0.37), 均发射较纯浅蓝色光.三种器件最大EQE分别为20.9%, 19.0%以及24.5%.值得一提的是, 基于28的OLED器件的启动电压仅为2.80 V.
2.1.4 氮杂环并菲类D-A型TADF蓝光材料
苯并菲是一类含有四个稠苯环的芳香化合物, 其衍生物被广泛用于研究设计荧光发光材料[43]、OLED器件的主体材料[44]、空穴传输材料[45]以及电子传输材料[46], 而1, 4-二氮杂苯并菲衍生物(ATP)含有三个稠苯环和一个二氮杂环, 由于二氮杂环是一个缺电子单元, 1, 4-二氮杂苯并菲衍生物存在较大的π电子共轭框架, 并具有良好的电荷传输能力以及相对较高的三重态能级(约为2.9 eV), 被广泛应用于研究设计蓝光热活化延迟荧光材料及OLED器件[43].如2014年, Takahashi等[47]报道了一系列以1, 4-二氮杂苯并菲单元为电子受体的天蓝色蓝光TADF分子及其OLED器件29~31.由于电子受体与给体之间存在较大的空间位阻作用, 使三个分子均能获得足够小的ΔEST值, 从而表现出明显的热活化延迟荧光效应.三种TADF材料的甲苯溶液在无氧处理(氮气鼓泡)后可以抑制TADF分子激发态能量转移至三线态氧中, 使其表现出更低的ΔEST值(氮气鼓泡前为0.28, 0.25以及0.50 eV, 氮气鼓泡后为0.16, 0.13以及0.26 eV).基于三种分子设计的OLED器件结构为ITO/ α-NPD/mCP/29~31 (6 wt%):α-NPD (15 nm)/PPT (10 nm)/TPBi (40 nm)/LiF (0.8 nm)/Al (70 nm), 获得了器件最大EQE分别为7.5%, 8.7%以及7.5%.
2016年, Li等[37a]报道了两种D-A型深蓝色TADF分子32和33, 分别以1, 2, 4-三唑和菲并咪唑作为电子给受体单元.在四氢呋喃溶液中, 两者的发射波长分别为428和420 nm, 并表现出较高的PLQY (75%±2%以及43%).基于两种分子设计的的非掺杂的OLED器件表现出极佳的CIE坐标, (0.158, 0.043) 以及(0.156, 0.058).基于33结构为ITO/MoO3 (6 nm)/α-NPD (35 nm)/33 (25 nm)/TPBi (55 nm)/LiF (0.8 nm)/Al (100 nm)的器件最大EQE为6.8%.器件表现出较低的效率滚降现象, 在1000 cd·m-2亮度下仍保持最大EQE的79%;即使在7323 cd·m-2最大亮度下仍然保持最大EQE的66%, 是目前已报道的CIE(y)<0.06的非掺杂发光器件中EQE较高者.而基于32结构为ITO/MoO3 (5 nm)/32 (55 nm)/ TPBi (55 nm)/LiF (0.5 nm)/Al (100 nm)的最大EQE只有3.5%.
对上述四类含氮杂环及其衍生物作为电子受体的D-A型蓝光TADF材料进行总结, 发现在氮杂环相似位点引入相同结构和数量的电子给体时(如表 2所示, 分别以2, 4, 6-三苯基-1, 3, 5-三嗪、2, 5-二苯基-1, 3, 4-噁二唑、3, 4, 5-三苯基-1, 2, 4-三唑、2, 4, 6-三苯基嘧啶以及1, 4-二氮杂苯并菲作为电子受体, 均连接两个吩噁嗪电子给体), 由于1, 3, 5-三嗪和嘧啶单元具有更好的吸电子能力、更容易引起大的空间位阻, 所以以其作电子受体构建D-A型TADF分子时更容易获得较低的ΔEST值, 其RISC过程越高效, 获得更高的PLQY; 而1, 4-二氮杂苯并菲、噁二唑和三唑单元由于其相对较弱的吸电子能力或较小的空间体积, 构建D-A型TADF分子时获得的ΔEST值相对较大, 相对不利于获得较高的PLQY.另一方面, 三嗪和嘧啶单元作为电子受体构建TADF分子时, 其发光波长往往长于以1, 4-二氮杂苯并菲、噁二唑和三唑单元作为电子受体的TADF分子, 在构建深蓝光D-A型TADF材料方面存在一定的劣势.当氮杂环电子受体连接其他电子给体时, 亦能得出同样的规律[48, 49].
2.2 二苯甲酮类D-A型TADF蓝光材料
由于二苯甲酮衍生物含有缺电子的羰基(C=O), 作为电子受体时羰基与苯环存在较大的扭转角, 是一种系间窜越十分高效(kISC=1011 s-1)的纯有机磷光体, 十分适合用作为电子受体构建D-A型TADF蓝光分子. 2013年, Adachi等[50]设计合成了首个以吖啶单元为电子给体, 蒽酮为电子受体的螺衍生物蓝光TADF分子34.具有十分低的ΔEST值(0.03 eV)的同时, 该分子在300 K下表现出即时荧光和延迟荧光现象, 两者寿命为175 ns和5.3 ms.在固体状态下具有很高的PLQY (81%), 以ITO/ α-NPD (40 nm)/mCP (10 nm)/34 (20 wt%):DPEPO (15 nm)/DPEPO (3.5 nm)/TPBi (41.5 nm)/LiF (0.8 nm)/Al (80 nm)结构构成的OLED器件的最大EQE达到16.5%.
次年, 该团队[18]又报道了一系列以二苯甲酮为电子受体, 以吩噁嗪、咔唑衍生物作为电子给体的D-A-D“蝴蝶型”TADF分子35~39.经含时密度泛函理论计算, 这些分子的基态几何图形中二苯甲酮单元的苯环和电子给体单元之间存在较大的二面角(35为51°、36为61°以及37为85°), 使分子获得很小的ΔEST值(0.03~0.21 eV). 5种分子在无氧甲苯溶液中的荧光光谱显示, PLQY为10%~44%, 含有单个苯甲酰基团的35~37三种分子的发光波长分别在438, 462以及509 nm, 而含两个苯甲酰基团的38和39分子的荧光发射峰发生红移(发射波长为566和600 nm), 发射绿光以及橙色光, 这是因为外加的高电负性苯甲酰基能够使带隙能量降低, 从而使LUMO变得更加稳定.质量分数为6%的TADF材料掺杂在DPEPO主体成膜时即时荧光寿命和延迟荧光寿命分别为35 (59 ns, 710 ms), 36 (62 ns, 460 ms), 37 (23 ns, 12 ms), 38 (24 ns, 13 ms)和39 (26 ns, 2.9 ms).为了研究35~37三种蓝光TADF分子的器件特性, 将36和37掺杂在DPEPO中, 构成结构为ITO/α-NPD (35 nm)/ mCP (5 nm)/35或36 (6 wt %):DPEPO (20 nm)/DPEPO (10 nm)/TPBi (30 nm)/LiF (0.8 nm)/Al (80 nm)的OLED器件, 分别获得最大EQE为8.1%和14.3%; 37则掺杂在mCBP中构成ITO/α-NPD (40 nm)/37 (6 wt %):mCBP (20 nm)/TPBi (40 nm)/LiF (0.8 nm)/Al (80 nm)的OLED器件, 最大EQE为10.7%. 3种蓝光TADF分子中, 36的上转换效果最好, 获得最多的三重态激子, 故其器件最大EQE最高, 且能发射较纯蓝色光, CIE色坐标为(0.17, 0.27).
随后, 该团队[19]继续以苯甲酰基-二苯甲酮为电子受体, 9, 9-二甲基吖啶为电子给体合成了一种“X型”蓝光TADF分子40(在无氧甲苯溶液中最大发射波长为496 nm发射蓝色光).苯甲酰基-二苯甲酮较大的空间体积与9, 9-二甲基吖啶单元形成较大的空间位阻作用, 使该分子的ΔEST值仅为0.02 eV, 使得40即使在室温环境也能快速完成RISC过程, 以获得更好的热活化延迟荧光.经测试, 该分子在无氧甲苯溶液中PLQY为20%左右, 但掺杂在mCBP薄膜中则升高为46%, 表明固体状态时由于分子内激子旋转被限制, 非辐射激子的猝灭被抑制.其OLED结构为ITO/α-NPD (35 nm)/mCP (10 nm)/40 (6 wt%):mCBP (20 nm)/PPF (10 nm)/TPBi (30 nm)/ LiF (0.8 nm)/Al (80 nm), 最大EQE为10.0%.但器件在高电流密度工作状态下(100 mA·cm-2以上)表现出较明显的效率滚降, 最大EQE下降至3%以下.
2016年, Lee等[30]借鉴“蝴蝶型”TADF分子35的思路, 通过在二咔唑电子给体上添加苯环, 扩大分子的空间位阻合成一种新的蓝光TADF分子41.同样获得较小的ΔEST (0.16 eV), 结构为ITO (120 nm)/PEDOT:PSS (60 nm)/TAPC (20 nm)/41:DPEPO (25 nm)/TSPO1 (5 nm)/TPBi (30 nm)/LiF (1.5 nm)/Al (200 nm)的OLED器件甚至获得了高达23.3%的最大EQE, 高于35的14.3%.
2016年末, Kim等[51]报道了一种以二苯甲酮作为电子受体, 以azasiline衍生物作为电子给体的蓝光TADF分子42.以mCP:TSPO1:45 (16 wt%)掺杂成膜测试得的ΔEST值为0.06 eV, 成膜时的PLQY达到70%.分子在甲苯溶液以及薄膜形式中测得的最大发射波长均为468 nm左右, 但以ITO (70 nm)/ReO3 (4 wt%):mCP (45 nm)/ mCP (15 nm)/mCP:TSPO1:42 (15 nm)/TSPO1 (15 nm)/ Rb2CO3 (4 wt%):TSPO1 (50 nm)/Al (100 nm)为结构制作OLED器件时, 由于器件存在空穴效应导致其发射波长红移至484 nm, 显示天蓝色, CIE色坐标为(0.174, 0.310), 最大EQE为11.4%.器件的启动电压仅为3.6 V, 在此前报道的TADF型OLED器件中为较低者.
2016年, Cheng等[52]报道了两种结构相似, 均以苯甲酰基吡啶单元为电子受体, 咔唑/3, 6-二叔丁基咔唑为电子给体的TADF分子43和44, 由于分子内电子给体和受体之间存在强的空间相互作用, 使两种分子获得很低的ΔEST值(0.03和0.04 eV).同时, 43和44分别掺杂在CzPS以及CBP薄膜中均表现出很高的PLQY (88.0%, 91.4%). 43在甲苯溶液中发射波长为490 nm发射蓝色光, 而44由于电子给体单元上连接了叔丁基, 导致其发光波长发生红移(508 nm)发射绿色光.基于43并以CzPS为主体材料的OLED结构为ITO/α-NPD (30 nm)/ mCP (20 nm)/CzPS:43 (5 wt%, 30 nm)/DPEPO (5 nm)/ TmPyPb (60 nm)/LiF (1 nm)/Al (100 nm), 获得较高的最大EQE (24.0%), 并且表现出较低的效率滚降效应.由于分子43相当小的ΔEST值抑制了材料的非辐射衰变, 其OLED器件在较高的亮度下仍然保持较高水平.
次年, 该团队[53]在2016年的研究成果基础上, 继续合成了一个与43互为同分异构体新的蓝光TADF分子45.在甲苯溶液中, 45的ΔEST为0.06 eV.荧光光谱表明其发射峰在467 nm发射蓝色光.值得一提的是, 45在晶体形式和无定型态时发射波长从460 nm发射蓝色光变为510 nm发射绿色光.更有趣的是, 其PLQY也从55%提高到82%.以ITO/α-NPD (40 nm)/mCP (10 nm)/ DPEPO:45 (10~30 wt%, 30 nm)/PPT (5 nm)/TmPyPb (60 nm)/LiF (1 nm)/Al (100 nm)为结构的OLED获得18.4%的最大EQE, 并且发现随着质量分数减少(从30%到10%), 器件的EQE逐渐增加.
2.3 含氰基的D-A型TADF蓝光材料
氰基具有十分强的吸电子能力, 成为构建低ΔEST, 高kr的D-A型TADF分子的常用电子受体. 2012年, Adachi等[15]合成了一系列咔唑基-苯二腈基TADF分子.这些分子中咔唑平面与苯二腈单元平面之间存在较大的扭曲二面角, 使其获得较低的ΔEST.该团队通过调整咔唑电子给体的数量和其与氰基的相对位置, 获得不同光学性能(从蓝色光到橙色光)的TADF分子.其中只有分子46发射蓝光(在甲苯溶液中发射波长为473 nm), ΔEST为0.34 eV.在无氧(氮气鼓泡)的甲苯溶液中测试其PLQY为46.5%.构建结构为ITO (100 nm)/α-NPD (40 nm)/mCP (10 nm)/PPT:46 (5 wt%, 20 nm)/PPT (40 nm)/ LiF/Al的OLED器件, 其中PPT为主体材料的OLED器件获得了8%的最大EQE, 大于传统荧光OLED的最大EQE (5%).但该器件在高电流密度工作状态下表现出较大的EQE效率滚降的现象. 2013年Adachi团队[54]通过建立理论模型探究了46的效率滚降原因, 构建的器件在低电流密度(J=0.01 mA·cm-2)时获得最高EQE值(13.6%±1%), 其原因是该电流密度工作状态下存在高效的载流子复合和发光层激子约束.然而随着电流密度的升高, 其EQE值逐渐下降, 在高电流密度状态(J=10 mA·cm-2)下, 其最大EQE值只有3.6%±1%, 原因为高电流密度导致激子猝灭.
为了提高以化合物46作为发光层的的OLED器件性能, 2016年Sun等[55]利用mCP为空穴传输层、PO-15为电子传输层并以质量比1:1的方式混合作为器件主体材料, 构建了基于46结构为ITO/ReO3:mCP/mCP:PO-15:46 (5 wt%)/Rb2CO3:PO-15/Al的OLED器件, 器件获得了更高的最大EQE值(21.8%).
2014年Lee等[56]设计了一种与46互为同分异构体的蓝光TADF分子47.但与46相比, 由于后者两个电子给体(咔唑基)与两个电子受体(氰基)之间为邻位取代, 在空间上两者相互的阻碍作用更为显著, 所以47获得了更低的ΔEST值(0.05 eV).但由于电子给体和受体之间的电子转移性质较46弱, 所以, 47在聚氯乙烯中发射波长蓝移(447 nm).通过积分球测量发现, 47在甲苯溶液中PLQY为35%, 而在掺杂在mPC主体中提升为87%.结构为ITO (150 nm)/PEDOT:PSS (60 nm)/TAPC (20 nm)/mCP (10 nm)/mCP:47 (15 wt%, 25 nm)/TSPO1 (35 nm)/LiF (1 nm)/Al (200 nm)的OLED器件, 获得了16.4%的最大EQE.有趣的是, 当利用47作为黄色磷光器件的主体材料时, 器件获得了高达24.9%的最大EQE值; 而当47同时作为蓝色发光材料和黄色磷光主体并且掺杂设计成OLED器件时, 获得了最大EQE为22.9%, CIE色坐标为(0.39, 0.43) 的暖色白光OLED; 以及最大EQE为21.0%, CIE色坐标为(0.31, 0.33) 的冷光白光OLED.
2015年, 该团队[57]同样在46的基础上, 以苯并呋喃咔唑和苯并噻吩咔唑代替咔唑作为电子给体了合成两种新型D-A型蓝光TADF分子48和49.替换后的两种较大电子给体基团由于与电子受体之间存在更强的空间阻碍作用, 两种分子的ΔEST值比46更低(分别为0.13和0.17 eV), 并且光电性能更加优异.在无氧(氮气鼓泡)甲苯溶液中, 48和49分别表现出94.6%和94.0%的荧光量子产率, 掺杂在mCP薄膜中为85%.基于这两种分子设计结构为ITO (50 nm)/PEDOT:PSS (60 nm)/TAPC (20 nm)/mCP (10 nm)/mCP:48或49 (25 nm, 1 wt%)/TSPO1 (35 nm)/LiF (1 nm)/Al (200 nm)的OLED器件最大EQE分别为12.1%和11.8%, 均比基于46设计的OLED器件高.
随后, Lee等[58]通过47分子自身的咔唑电子给体基团之间以不同位点进行连接, 形成三种“双胞胎”式的TADF分子50~52.利用这种方法, 通过改变咔唑基团之间的连接方式, 既可以保留47原始的发光颜色, 也可以调节其发光波长, 以获得绿色和蓝色光的TADF发光分子(发光波长分别为470, 448以及444 nm), 并且在发光性能上均有优化.在获得低ΔEST值(0.11, 0.16以及0.21 eV)的同时, 获得较高延迟荧光寿命(2.35, 2.96以及4.21 ms)和较高的荧光量子产率(87%, 66%以及61%).其中基于蓝光TADF分子的器件ITO/PEDOT: PSS (60 nm)/TAPC (10 nm)/TCTA (10 nm)/mCP (10 nm)/ DPEPO:51或52 (20 wt%, 25 nm)/TSPO1 (5 nm)/TPBi (35 nm)/LiF/Al)获得较高的器件最大EQE (21.8%和19.5%), 且表现出较纯色的蓝色光, CIE色坐标分别为(0.17, 0.29) 和(0.16, 0.23).
Lee等[59]在获得以上一系列以苯腈单元作为电子受体, 咔唑为电子给体的蓝光TADF分子的基础上, 进一步通过引入同样为吸电子的氟基团以增加材料的溶解性, 获得了一系列能用于旋涂成膜的蓝光发光材料53和54.由于咔唑基团与氰苯基团较大的空间阻碍作用, 53和54均获得很小的ΔEST值(均为0.06 eV).两者在无氧(氮气鼓泡)的甲苯溶液中发射波长分别为443和453 nm.由于以相对较弱吸电子能力的F原子取代具有相对较强吸电子能力的CN基团, 53和54的发射波长均比含两个CN基团的46[46]的发射波长短.延迟荧光寿命分别为28和17 ms, PLQY分别为76%和81%.两种分子掺杂在SiCz中, 用旋涂成膜的方式构成结构为ITO/PEDOT:PSS (60 nm)/PVC (15 nm)/SiCz:53或54 (15 wt%, 20 nm)/EMPA1 (5 nm)/TPBi (30 nm)/LiF (1 nm)/ Al (200 nm)的OLED器件获得17.8%和20.0%的最大EQE, 且发光为较纯的蓝色光, CIE色坐标为(0.16, 0.19) 和(0.16, 0.25).另外, 用真空热蒸镀的方式制作发光层的OLED器件获得的最大EQE仅为12.9%和17.3%.因此通过引入氟原子基团的TADF材料用以旋涂成膜, 可以提高OLED器件的EQE.
2016年, 由该团队[60]报道了一种以咔唑为电子给体, 氰基苯为电子受体的“联锁式”蓝光TADF分子55.由于在两个苯环连接的主干线上, 2, 2'位置上两个空间体积较大的咔唑基团之间存在空间阻碍作用, 故两个苯环之间连接的σ键旋转时会受到一定的限制.而与55互为同分异构体56的2, 2'位置上两个空间 体积较大的咔唑基团之间存在空间阻碍作用, 故两个苯环之间连接的σ键旋转时受到的限制相对较小.两者ΔEST值均为较小的0.27 eV, 但55表现出更大的振子强度, 为0.230 (56为0.193).因此, 55的PLQY为76%, 大于56 (46%).更重要的是, 荧光光谱显示55的光谱图较56的荧光光谱狭窄, 前者的半峰宽度只有48 nm(而后者为71 nm), 普遍低于已经报道的蓝光分子的半峰宽, 在制作纯蓝光OLED器件上更有优势.55和56掺杂在DPEPO中制成OLED器件获得的器件最大EQE分别为14%和4.8%, 且由于前者荧光光谱较窄, 器件能发射会较纯的深蓝色光, CIE色坐标为(0.14, 0.12).
2016年, Park等[61]报道了两个分别以邻苯二腈作为电子受体, 1-甲基咔唑和9, 9-二甲基吖啶等基团作为电子给体的楔形蓝光TADF分子57, 58.二者的ΔEST值分别0.36和0.20 eV, 掺杂在PPF (57)或mCBP (58)中的薄膜PLQY高达63%和86%.基于二者的OLED蓝光器件结构为ITO (110 nm)/α-NPD (40 nm)/mCP (10 nm)/ 57或58 (20 nm)/PPF (10 nm)/TPBi (30 nm)/LiF (0.8 nm)/Al(100 nm), 器件最大EQE分别为8.7%和18.9%.值得一提的是, 58在亮度(10000 cd·m-2)下仍然保持12.4%的最大EQE, 表现出较低的效率滚降.
Zhang等[62]报道两种以苯腈为电子受体, 吩噁嗪作为电子给体的蓝光TADF同分异构体分子59和60.由于具有相同的分子骨架, 二者的苄腈基团和吩噁嗪部分之间的二面角分别达到近乎垂直的75.29°和78.79°, 使两种分子都获得相当小的ΔEST值(分别为0.02和0.01 eV).掺杂在mCP薄膜中通过积分球测试表明二者也具有较高的PLQY, 分别为46.6%和54.9%.但由于59和60苄腈单元上连接的苯环取代基位置不同, 前者为氰基的邻位取代, 而后者为氰基的间位取代, 导致两种分子在空间上的阻碍作用不同: 60上两个与吩噁嗪紧靠着的苯环使苄腈与吩噁嗪之间的σ键旋转受限, 而59的这种限制σ键旋转的效应并不明显.这两种不同的分子空间作用, 使两者的光电性能有所不同.溶剂从非极性的环己烷到极性的乙腈, 两者均有正溶剂化变色效应: 59的发光波长和半峰宽均分别为455~615 nm和60~140 nm, 而60的发光波长和半峰宽分别为455~550 nm和60~107 nm.表明通过增加分子内的空间限制作用, 可以降低分子的正溶剂化变色效应, 同时可以提高分子发光色纯度(较低的半峰宽).基于二者的OLED器件结构为ITO/TAPC (40 nm)/TCTA (5 nm)/mCP:6.5 wt% 59或60 (20 nm)/TmPyPb (35 nm)/LiF (1 nm)/Al, 均获得较高的器件最大EQE, 分别为(19.9%和17.4%).基于60的OLED器件获得更高的色纯度, CIE色坐标(0.18, 0.32).
除了以氰基苯作为电子受体外, 近年来学者亦报道了一系列以氰基取代含氮杂环衍生物作为电子受体的蓝光TADF分子及OLED器件. 2015年, Liu等[63]报道了一种以吡啶-3, 5-二腈为电子受体, 咔唑为电子给体的蓝光TADF分子61.通过巧妙设计, 氰基与咔唑基团分别位于吡啶的对位位置, 使该分子既有较大的空间阻碍作用以获得较小的ΔEST值(0.04 eV), 又存在良好的分子内电子转移, 以获得较高的PLQY (49.7%).甲苯溶液中61的发光波长为474 nm, 获得的即时荧光和延迟荧光寿命分别为9.7 ns以及46.6 ms.该团队研究了分子61掺杂不同主体材料中的OLED器件, 最后获得最大EQE为21.2%的OLED器件, 其最大电流效率为47.7 cd·A-1, 最大电源效率为42.8 lm·W-1, CIE色坐标为(0.20, 0.35), 为已报道的性能最优异的蓝光器件之一.
2016年, Wu等[64]报道了一系列以氰基吡啶, 氰基嘧啶和氰基苯作为电子受体, 9, 9-二甲基吖啶作为电子给体的色光可调节TADF分子62~68.通过改变不同的电子受体基团以及电子给受体之间的位置关系, 可实现调节分子的发光波长, 覆盖了从蓝色光到黄色光的发光波段.其中氰基吡啶和氰基嘧啶作为电子受体的TADF分子获得了高达90%~100%的超高PLQY.由于HOMO和LUMO能级的有效分离, 几种分子均获得了较低的ΔEST值, 其中62, 67以及68三种分子发光波长在488, 462以及431 nm发射蓝色光.三者的ΔEST值和PLQY分别为0.19, 0.439, 0.403 eV和91.6%, 36%, 15%.一系列TADF分子以ITO/PEDOT:PSS (50~70 nm)/TAPC(5~15 nm)/mCP (10 nm)/mCPCN:8 wt% 62~68 (20 nm)/ 3TPYMB (30~55 nm)/LiF (0.5 nm)/Al (100 nm)结构构成的OLED器件均获得了较理想的EQE, 三种蓝光OLED获得的最大EQE分别为23.9%, 5.7%以及1.6%.此外, 基于64~66的OLED器件最大EQE高达29.2%~31.3%, 为现阶段已报道的OLED器件中较高者.
2017年, Lee等[65]首次报道以丙烯腈为电子受体的蓝光TADF材料69和70, 分别以9, 9-二甲基吖啶和3, 6-二叔丁基咔唑为电子给体.两者获得了较低的ΔEST (0.03和0.02 eV), 在无氧甲苯溶液中的PLQY为31.34%和31.32%.基于两者的器件结构分别为ITO (50 nm)/ HAT-CN (7 nm)/NPB (125 nm)/TAPC (20 nm)/mCP (10 nm)/69 (25 nm)/TSPO1 (5 nm)/TPBi (20 nm)/LiF (2.5 nm)/Al (100 nm)和ITO (50 nm)/HATCN (7 nm)/NPB (40 nm)/TCTA (10 nm)/70 (20 nm)/Bphen (35 nm)/LiF (2.5 nm)/Al (100 nm), 分别获得1.50%和4.01%的器件最大EQE, 发射较纯色的深蓝色和天蓝色光, CIE色坐标分别为(0.16, 0.28) 和(0.15, 0.14), 器件在1 cd/m2下的启动电压仅为3.2和3.5 V.
2.4 三芳基硼类D-A型TADF蓝光材料
硼原子由于存在空p轨道, 可以用于合成三芳基衍生物, 是另一种常用于构建D-A型TADF材料的电子受体. 2015年, Kaji等[66]报道了一系列最大EQE超过20%的三芳基硼衍生物TADF蓝光OLED器件.该团队以三均三甲苯硼为电子受体, 分别以吩噁嗪, 二苯胺咔唑衍生物作为电子给体合成了三种蓝光TADF分子71~73.硼原子上连接苯环既能提供共轭平面, 甲基又能保护硼原子免受氧气和水的破坏, 使整个分子具有更好的光学性能.三种分子具有足够低的ΔEST值(0.071, 0.058以及0.062 eV)以实现热活性延迟荧光.在无氧甲苯溶液中测试其PLQY分别为44%, 84%和91%, 发光波长分别为509, 495以及477 nm, 发射绿色光和蓝色光.基于72以及73两种蓝光TADF材料的OLED器件结构为: ITO (50 nm)/TAPC (80 nm)/PEPO:72或73 (16 wt%, 40 nm)/ BAlq (30 nm)/Liq (1 nm)/Al (80 nm), 分别获得了21.6%和14.0%的器件最大EQE, 两种OLED器件均发射天蓝色光, CIE色坐标分别为(0.18, 0.43) 和(0.22, 0.55).
由于10H-Phenoxaborin既具有良好的吸电子能力, 又能表现出较宽的带隙以及较大的π平面, 作为良好的D-A型的TADF材料电子受体, 近年来被广泛关注. 2015, Adachi等[67]以10H-Phenoxaborin作为电子受体, 以及吖啶或咔唑衍生物作为电子给体合成了一系列高效蓝光TADF分子74~77.通过引入空间体积较大的2, 4, 6-三异丙基苯基, 以保护中心硼原子, 避免受到水或碱以及氧气等亲核试剂的破坏, 使含硼的衍生物基团表现出优异的电子受体稳定性.并且通过引入不同的电子给体, 使TADF分子表现出不同的性质.例如吖啶衍生物与周边的氢原子的空间阻碍作用, 使电子受体与10H-Phenoxaborin产生较大的二面角; 而1, 3, 6, 8-四甲基咔唑的甲基在3, 6号位的两个甲基使咔唑的电化学稳定性更高. 4种分子在获得0.06~0.12 eV的低ΔEST值的同时, 表现出56%~100%的高PLQY, 发光波长范围从475 nm(浅蓝色光)到443 nm(深蓝色).基于结构为ITO (100 nm)/HATCN (10 nm)/α-NPD (40 nm)/CCP (10 nm)/ PPF:74~77 (50 wt%, 20 nm)/PPF (10 nm)/TPBi (30 nm)/ LiF (0.8 nm)/Al (100 nm)的蓝光OLED器件分别获得超过15%的器件最大EQE, CIE横纵色坐标均小于0.16.其中基于74的OLED获得最高的最大EQE (21.7%)、CIE为(0.14, 0.23) 的深蓝色光.重要的是, 所报道的4种蓝光TADF分子在掺杂薄膜中的PLQY不受掺杂浓度影响, 这在构建OLED器件方面具有极大优势.
2016年, 该团队[68]继续报道了一种phenazaborin为电子受体, 螺吖啶为电子给体的蓝光TADF分子78.由于分子内电子受体与电子给体之间的二面角为89.1°, 近乎相互垂直的电子给受体使分子的前线分子轨道很大程度上分离, 使78获得0.24 eV的小ΔEST值.其掺杂在PPF中制成的薄膜在氮气环境下PLQY达到99%之高, 发光波长在467 nm发射蓝色光.结构为ITO (100 nm)/HAT-CN (10 nm)/α-NPD (40 nm)/mCP (10 nm)/78 (20 wt%):PPF (20 nm)/PPF (10 nm)/TPBi (30 nm)/Liq(0.8 nm)/Al (80 nm)的OLED器件获得18.2%的最大EQE, 电流效率为32.6 cd·A-1, 发光效率为25.6 lm·W-1. CIE色坐标为(0.15, 0.23).
2015年, Oi等[69]同样以10H-Phenoxaborin为电子受体, 分别以咔唑、9, 9-二甲基吖啶以及吩噁嗪为电子给体合成分子79~81.其中79由于以咔唑作为电子给体降低了咔唑与10H-Phenoxaborin之间的二面角, 导致分子内HOMO和LUMO能级不能有效分离, 获得了较高的ΔEST值(0.35 eV), 未发现TADF现象, 仅发射蓝色的即时荧光.而分子80和81由于具有较低的ΔEST值(0.013和0.028 eV), 发射浅蓝色和绿色的延迟荧光, 且具有很高的PLQY (98%和99%).基于蓝光TADF分子80的器件ITO/PEDOT:PSS (40 nm)/α-NPD (35 nm)/ mCP (10 nm)/80 (6 wt%):DPEPO (20 nm)/DPEPO (10 nm)/TPBi (40 nm)/Al(100 nm)获得了15.1%的器件最大EQE.
同年, 该团队[70]采取同样的设计策略, 在分子79~81的良好光电性能基础上, 将原来10H-Phenoxaborin电子受体改为三苯基硼合成了一系列新的TADF分子82~84.同样由于3种分子的电子给体与相连苯环之间的二面角分别为较小的52.2°以及近乎垂直的88.4°和87.3°, 导致分子82获得了较大的ΔEST值(0.456 eV), 而83和84则为较小的0.041和0.033 eV.所以3种分子的荧光光谱中, 83和84既表现出蓝色和绿色即时荧光, 又表现出延迟荧光, 而分子82则只表现出深蓝色的即时荧光.在甲苯溶液中, 分子83和84的PLQY高达89%和87%.基于蓝光TADF分子的OLED器件结构为ITO/α-NPD (35 nm)/mCP (10 nm)/83 (6%wt):mCP (94%) (20 nm)/PPT (10 nm)/TPB (40 nm)/LiF (0.5 nm)/Al (100 nm), 获得16.0%的器件最大EQE.
为了获得更高效率的TADF材料, 该团队[71]在2016年继续以10, 10-dimethyl-5, 10-dihydrophenazasiline作为电子给体, 分别以10H-Phenoxaborin和三苯基硼作为电子受体合成两种蓝光TADF分子85和86.经过DFT理论计算, 两种分子的电子给体基团与相连苯环之间的二面角达到了近乎垂直的89.5°和89.0°, 使两种分子获得较低的ΔEST值(0.040和0.057 eV).在甲苯溶液中85和86发光波长为446和462 nm, 均发较纯的深蓝色光, 且获得了81%的PLQY.其CIE色坐标分别为(0.14, 0.09) 和(0.14, 0.15).优异的蓝光TADF性能使85和86在OLED方面存在极高的应用价值.
除D-A构型之外, Zhang等[20]报道了一种通过多重共振效应有效分离HOMO, LUMO能级的设计策略, 获得了超纯色的高效蓝光TADF材料.通过在三苯基硼单元中引入氮原子, 构成刚性多环芳香框架.而对位取代硼原子与氮原子形成相反的共振效应, 使分子共振增强, 从而达到HOMO和LUMO能级的有效分离.基于独特设计的刚性π共轭框架, 使分子表现出较大的振子强度, 使其OLED器件展现出很低的半峰宽(28 nm), 从而获得超纯色的蓝光.
2.5 砜类D-A型TADF蓝光材料
与二苯甲酮相似, 二苯砜作为电子受体时, 其在分子中心呈现出一定的扭转角, 并且具有良好的吸电子能力, 近年来被广泛用作电子受体构建D-A型TADF分子. 2012年, Adachi等[72]首次以二苯砜为电子受体, 分别以二苯胺、叔丁基二苯胺以及叔丁基咔唑合成3种蓝光TADF分子87~89.通过DFT理论计算, 分子87均具有较低的ΔEST值(0.54 eV).通过在二苯胺基团上引入叔丁基, 以增强二苯胺单元的给电子能力, 达到了降低分子内电子转移能量的效果, 使分子88获得更低的ΔEST值(0.45 eV).同样, 以咔唑单元替换二苯胺单元作为电子给体, 增加了1CT态以及3ππ*态效应, 使分子89获得了0.32 eV的ΔEST值. 3种分子掺杂在DPEPO薄膜中均发射较纯的蓝色光, 发光波长分别为421, 430以及423 nm, 并且获得60%, 66%以及80%的PLQY.基于3种蓝光TADF分子良好的荧光性能, 该团队以ITO/ α-NPD (30 nm)/TCTA (20 nm)/CzSi (10 nm)/DPEPO: 87~89 (10 wt%, 20 nm)/DPEPO (10 nm)/TPBi (30 nm)/ LiF (1 nm)/Al为结构构造OLED器件. 3种器件的最大EQE分别为2.9%, 5.6%和9.9%.分子89发射较纯的蓝光, CIE色坐标为(0.15, 0.07), 非常接近NTSC标准蓝色.但由于器件的发光层能带较大, 电荷能力不平衡, 导致3种器件表现出较为明显的效率滚降.
为了解决效率滚降问题, 该团队[73]在分子89的基础上, 以富电子的甲氧基替换叔丁基, 以提高咔唑单元的给电子能力, 合成了一种新的蓝光TADF分子90.与分子89相比, 由于电子给体的给电子能力更强, 分子90表现出更低的ΔEST值(0.24 eV).该分子掺杂在DPEPO薄膜中获得与分子89相同的PLQY (80%)的同时, 表现出更低的三重态激子跃迁时间(89为270 ms, 90为93 ms). 89以质量分数为10%掺杂在DPEPO薄膜中, 制成结构为ITO/α-NPD (30 nm)/TCTA (20 nm)/CzSi (10 nm)/90 (20 nm)/DPEPO (10 nm)/TPBI (30 nm)/ LiF (0.5 nm)/Al的OLED器件获得了14.5%的最大EQE, 并表现出较纯的蓝色光, CIE色坐标为(0.16, 0.16).更有趣的是, 由于90具有很低的三重态激子跃迁时间, 使其三重态-单重态湮灭以及三重态-三重态湮灭效率大大降低, 保证基于该分子的OLED器件在相对高电流密度的工作状态下仍然保持较高的外量子效率, 表现出较小的效率滚降效应.
2017年, Li等[74]在分子89的基础上, 通过引入更多的叔丁基咔唑基团, 获得了2种具有更低ΔEST值(0.25和0.17 eV)的新型的蓝光TADF分子91和92.两者在普通溶液如甲苯, 氯仿以及四氢呋喃溶液中均具有良好的溶解性, 使分子在湿法加工制作器件方面具有明显的优势.在无氧的甲苯溶液中, 2种分子分别获得了64%和52%的PLQY, 最大发光波长分别在426和439 nm, 发射蓝色光.基于91和92, 利用湿法加工成膜制作的非掺杂发光层器件结构为ITO/PEDOT:PSS (30 nm)/91或92 (45 nm)/ TPBI (30 nm)/LiF (1 nm)/Al (100 nm), 均能发射较纯的蓝色光, CIE色坐标分别为(0.15, 0.12) 和(0.19, 0.15), 器件启动电压均为5 V左右(4.8和5.2 V).基于91的OLED器件获得了较高的电流效率, 为4.1 cd/A.基于92的OLED器件表现出较低的效率滚降.
尽管二苯砜作为电子受体表现出良好的吸电子能力, 并且能够与苯环连接时产生较大的扭转二面角, 以获得较低的ΔEST值.但相对于其他类型的D-A型TADF分子, 近年来报道的二苯砜TADF分子ΔEST值对于实现高效热活化延迟荧光仍不理想.所以最近研究者转向以1, 4-二(二苯砜)为电子受体合成高效的的蓝光TADF材料.例如2015年, Kido的团队[75]报道了两种3, 6-二叔丁基咔唑为电子给体, 分别以1, 4-(二磺酰基苯基)苯以及1, 3-(二磺酰基苯基)苯为电子受体的蓝光TADF分子93和94.引入两个砜基团作为电子受体, 使2种分子表现出更低的ΔEST值, 分别为0.19和0.26 eV.两者掺杂在DPEPO薄膜中显示出56.3%和69.3%的PLQY.基于上述2种TADF分子制作结构为ITO/NPB (30 nm)/TCTA (20 nm)/CzSi (10 nm)/10 wt% 93或94:DTC-mBPSB: DPEPO (20 nm)/DPEPO (10 nm)/TPBI (30 nm)/LiF(1 nm)/Al的OLED器件, 分别获得11.7%和5.5%的器件最大EQE.其中, 93发射深蓝色光, CIE色坐标为(0.18, 0.19);而94则发射天蓝色光, CIE色坐标为(0.15, 0.08).
除了上述“开环式”的砜基电子受体蓝光TADF分子外, 一系列含砜基的杂环基团作为电子受体的蓝光TADF分子近年来也见诸报道.相比二苯砜等砜基“裸露”在外的电子受体基团, phenoxathiin dioxide等含砜基杂环电子受体, 由于杂环基团中的砜基受到更好的保护, 表现出了更好的化学稳定性和电化学稳定性.例如, 2016年, Yasuda等[76]报道了一种以phenoxathiin dioxide为电子受体、9, 9-二甲基吖啶作为电子给体的蓝光TADF分子95.由于phenoxathiin dioxide的强吸电子能力以及分子内电子给受体之间较大的空间阻碍作用, 95获得了0.06 eV的ΔEST值, 使分子存在高效的RISC.所以该分子以质量分数6%掺杂在DPEPO主体中成膜获得了高达98%的PLQY. ITO (110 nm)/TAPC (35 nm)/ mCBP (5 nm)/DPEPO:95 (6 wt%, 20 nm)/DPEPO (10 nm)/B3PyPB (40 nm)/LiF (0.8 nm)/Al (80 nm)结构的OLED器件获得了高达20.5%的最大EQE, 且发射较纯的蓝色光, CIE色坐标为(0.16, 0.26).
3 总结与展望
综上所述, 热活化延迟荧光材料由于具有很小的单重态-三重态能级差(ΔEST<0.5 eV), 最低激发三重态激子可以通过吸收环境热反向系间窜越到达最低激发单重态参与发射荧光, 实现理论达到100%内量子效率.高性能的热活化延迟荧光OLED解决了以往传统荧光及磷光OLED低效率、高造价以及性能不稳定的难题, 被誉为继荧光和磷光OLED后的“第三代OLED器件”.其中由于纯有机D-A型热活化延迟荧光分子设计可行性高, 合成方法简便, 造价低廉, 成为制备高光电性能热活化延迟荧光材料分子的有效途径.而高效的热活化延迟荧光蓝光材料的制备, 对于打破现有的技术瓶颈(发光效率、色纯度以及稳定性问题), 实现固态发光以及全彩显示技术的进一步发展尤为关键.目前已报道的热活化延迟荧光蓝光OLED器件中, 已经实现了最大外量子效率高达30%的同时, 兼具高色纯度、长使用寿命以及低启动电压、低效率滚降的优点.与此同时, 高效的TADF材料在发光客体、敏化剂、主体等各个领域均获得了广泛运用.
尽管如此, 设计高效的D-A型热活化延迟荧光材料在电子给受体和桥联基团的选择以及三者之间的键接方式上仍需进一步系统地优化, 以获得更小(趋近于零)的ΔEST值和更高的荧光量子产率和荧光寿命, 使器件展现出更高的最大外量子效率和使用寿命.目前采用如咔唑、9, 9-二甲基吖啶等氮杂环电子给体的D-A型蓝光热活化延迟荧光材料尽管性能出众, 但由于两类电子给体价格相对高昂, 不利于大规模生产.所以开发更多具有高性价比的电子给体或电子受体亦是急待解决的问题.另一方面, 已报道的热活化延迟荧光材料制作成器件时大多需要掺杂在适合的主体材料中, 以抑制其聚集态的浓度淬灭发光和激子湮灭, 开发高效的非掺杂热活化延迟荧光材料(如唐本忠院士开发的具有AIE效应的热活化延迟荧光材料及其OLED)既是提高器件效率的有效途径, 亦是简化工艺和降低成本的可行之路.同时, 开发高效的可溶性热活化延迟荧光材料以摆脱只能通过传统的真空热蒸镀工艺加工的困境, 亦是降低制作OLED器件工艺成本的必要任务.针对蓝光材料宽的HOMO和LUMO带宽(>3.0 eV)不利于空穴和电子注入有机层的固有属性, 开发更高效的蓝光材料或设计更合理蓝光器件结构, 是实现全色显示和固态发光的更进一步发展的突破口.
-
-
[1]
Tang, C. W.; van Slyke, S. A. Appl. Phys. Lett. 1987, 51, 913. doi: 10.1063/1.98799
-
[2]
(a) Adachi, C. Jpn. J. Appl. Phys. 2014, 53, 101.
(b) Li, B. L. Chin. J. Org. Chem. 2015, 35, 2487
(in Chinese).
(李保林, 有机化学, 2015, 35, 2487.)
(c) Wu, Y.; Zhang, Z.; Yue, S.; Huang, R.; Du, H.; Zhao, Y. Chin. J. Chem. 2015, 33, 897.
(d) Duan, L.; Tsuboi, T.; Qiu, Y. Chin. J. Chem. 2015, 33, 859.
(e) Zeng, H.; Huang, Q.; Liu, J.; Huang, Y.; Zhou, J.; Zhao, S.; Lu, Z. Chin. J. Chem. 2016, 34, 387.
(f) Jiu, Y.; Wang, J.; Liu, C.; Lai, W.; Zhao, L.; Li, X.; Jiang, Y.; Xu, W.; Zhang, X.; Huang, W. Chin. J. Chem. 2015, 33, 873.
(g) Luo, J.; Xie, G.; Gong, S.; Chen, T.; Yang, C. Chem. Commun. 2016, 52, 2292.
(f) Xie, G.; Luo, J.; Huang, M.; Chen, T.; Wu, K.; Gong, S.; Yang, C. Adv. Mater. 2017, 29, 1604223. -
[3]
Helfrich, W.; Schneider, W. G. Phys. Rev. Lett. 1965, 14, 229. doi: 10.1103/PhysRevLett.14.229
-
[4]
Baldo, M. A.; O'Brien, D. F.; Thompson, M. E.; Forrest, S. R. Phys. Rev. B 1999, 60, 14422. doi: 10.1103/PhysRevB.60.14422
-
[5]
Turro, N. J.; Ramamurthy, V.; Scaiano, J. C. Photochem. Photobiol. 2012, 88, 1033. doi: 10.1111/j.1751-1097.2012.01178.x
-
[6]
Forrest, S. R.; Baldo, M. A.; O'Brien, D. F.; You, Y.; Shoustikov, A.; Sibley, S.; Thompson, M. E. Nature 1998, 395, 151. doi: 10.1038/25954
-
[7]
Tao, Y. T.; Yang, C. L.; Qin, J. Q. Chem. Soc. Rev. 2011, 40, 2943. doi: 10.1039/c0cs00160k
-
[8]
(a) Goushi, K.; Yoshida, K.; Sato, K.; Adachi, C. Nat. Photonics 2012, 6, 253.
(b) Zhu, M. Z.; Yang, C. L. Chem. Soc. Rev. 2013, 42, 4963.
(c) Reineke, S.; Baldo, M. A. Phys. Status Solidi A 2012, 209, 2341.
(d) Lin, M. S.; Chi, L. C.; Chang, H. W.; Huang, Y. H.; Tien, K. C.; Chen, C. C.; Chang, C. H.; Wu, C. C.; Chaskar, A.; Chou, S. H.; Ting, H. C.; Wong, K. T.; Liu, Y. H.; Chi, Y. J. Mater. Chem. 2012, 22, 870. -
[9]
Endo, A.; Ogasawara, M.; Takahashi, A.; Yokoyama, D.; Kato, Y.; Adachi, C. Adv. Mater. 2009, 21, 4802. doi: 10.1002/adma.200900983
-
[10]
Zhang, Q.; Li, B.; Huang, S.; Nomura, H.; Tanaka, H.; Adachi, C. Nat. Photonics 2014, 8, 326. doi: 10.1038/nphoton.2014.12
-
[11]
Sato, K.; Shizu, K.; Yoshimura, K.; Kawada, A.; Miyazaki, H.; Adachi, C. Phys. Rev. Lett. 2013, 110, 247401. doi: 10.1103/PhysRevLett.110.247401
-
[12]
Baleizão, C.; Nagl, S.; Borisov, S. M.; Schäferling, M.; Wolfbeis, O. S.; Berberan-Santos, M. N. Chem.-Eur. J. 2007, 13, 3643. doi: 10.1002/(ISSN)1521-3765
-
[13]
Tao, Y.; Yuan, K.; Chen, T.; Xu, P.; Li, H.; Chen, R.; Zheng, C.; Zhang, L.; Huang, W. Adv. Mater. 2014, 26, 7931. doi: 10.1002/adma.v26.47
-
[14]
Chen, T.; Zheng, L.; Yuan, J.; An, Z.; Chen, R.; Tao, Y.; Li, H.; Xie, X.; Huang, W. Sci. Rep. 2015, 5, 10923. doi: 10.1038/srep10923
-
[15]
Uoyama, H.; Goushi, K.; Shizu, K.; Nomura, H.; Adachi, C. Nature 2012, 492, 234. doi: 10.1038/nature11687
-
[16]
Mehes, G.; Nomura, H.; Zhang, Q.; Nakagawa, T.; Adachi, C. Angew. Chem., Int. Ed. 2012, 51, 11311. doi: 10.1002/anie.201206289
-
[17]
Kawasumi, K.; Wu, T.; Zhu, T.; Chae, H. S.; Van Voorhis, T.; Baldo, M. A.; Swager, T. M. J. Am. Chem. Soc. 2015, 137, 11908. doi: 10.1021/jacs.5b07932
-
[18]
Lee, S. Y.; Yasuda, T.; Yang, Y. S.; Zhang, Q.; Adachi, C. Angew. Chem. 2014, 126, 6520. doi: 10.1002/ange.201402992
-
[19]
Lee, S. Y.; Yasuda, T.; Park, I. S.; Adachi, C. Dalton. Trans. 2015, 44, 8356. doi: 10.1039/C4DT03608E
-
[20]
Zhang, Q.; Li, J.; Shizu, K.; Huang, S.; Hirata, S.; Miyazaki, H.; Adachi, C. J. Am. Chem. Soc. 2012, 134, 14706. doi: 10.1021/ja306538w
-
[21]
Yao, L.; Yang, B.; Ma, Y. Sci. China, Chem. 2014, 57, 335. doi: 10.1007/s11426-013-5046-y
-
[22]
Guo, J.; Li, X. L.; Nie, H.; Luo, W.; Gan, S.; Hu, S.; Hu, R.; Qin, A.; Zhao, Z.; Su, S. J.; Tang, B. Z. Adv. Funct. Mater. 2017, 27, 1606458. doi: 10.1002/adfm.v27.13
-
[23]
Shizu, K.; Noda, H.; Tanaka, H.; Taneda, M.; Uejima, M.; Sato, T.; Tanaka, K.; Kaji, H.; Adachi, C. J. Phys. Chem. C 2015, 119, 26283. doi: 10.1021/acs.jpcc.5b07798
-
[24]
Hirata, S.; Sakai, Y.; Masui, K.; Tanaka, H.; Lee, S. Y.; Nomura, H.; Nakamura, N.; Yasumatsu, M.; Nakanotani, H.; Zhang, Q.; Shizu, K.; Miyazaki, H.; Adachi, C. Nat. Mater. 2015, 14, 330.
-
[25]
Su, S. J.; Gonmori, E.; Sasabe, H.; Kido, J. Adv. Mater. 2008, 20, 4189.
-
[26]
Endo, A.; Sato, K.; Yoshimura, K.; Kai, T.; Kawada, A.; Miya-zaki, H.; Adachi, C. Appl. Phys. Lett. 2011, 98, 083302. doi: 10.1063/1.3558906
-
[27]
Hirata, S.; Sakai, Y.; Masui, K.; Tanaka, H.; Lee, S. Y.; Nomura, H.; Nakamura, N.; Yasumatsu, M.; Nakanotani, H.; Zhang, Q.; Shizu, K.; Miyazaki, H.; Adachi, C. Nat. Mater. 2015, 14, 330.
-
[28]
Lee, S. Y.; Yasuda, T.; Nomura, H.; Adachi, C. Appl. Phys. Lett. 2012, 101, 093306. doi: 10.1063/1.4749285
-
[29]
Cha, J. R.; Lee, C. W.; Lee, J. Y.; Gong, M. S. Dyes Pigm. 2016, 134, 562. doi: 10.1016/j.dyepig.2016.08.023
-
[30]
Kim, H. M.; Choi, J. M.; Lee, J. Y. RSC Adv. 2016, 6, 64133. doi: 10.1039/C6RA13240E
-
[31]
Lee, D. R.; Choi, J. M.; Lee, C. W.; Lee, J. Y. ACS Appl. Mater. Interfaces 2016, 8, 23190. doi: 10.1021/acsami.6b05877
-
[32]
Kulkarni, A. P.; Tonzola, C. J.; Babel, A.; Jenekhe, S. A. Chem. Mater. 2004, 16, 4556. doi: 10.1021/cm049473l
-
[33]
Zhu, R.; Wen, G. A.; Feng, J. C.; Chen, R. F.; Zhao, L.; Yao, H. P.; Fan, Q. L.; Wei, W.; Peng, B.; Huang, W. Macromol. Rapid Commun. 2005, 26, 1729. doi: 10.1002/(ISSN)1521-3927
-
[34]
张志明, 李国文, 马於光, 无房, 田文晶, 沈家骢, 有机化学, 2000, 20, 529. doi: 10.3321/j.issn:0253-2786.2000.04.014Zhang, Z. M.; Li, G. W.; Ma, Y. G.; Wu, F.; Tian, W. J.; Shen, J. C.; Chin. J. Org. Chem. 2000, 20, 529(in Chinese). doi: 10.3321/j.issn:0253-2786.2000.04.014
-
[35]
Lee, J.; Shizu, K.; Tanaka, H.; Nomura, H.; Yasuda, T.; Adachi, C. J. Mater. Chem. C 2013, 1, 4599.
-
[36]
Zhang, Q.; Li, B.; Huang, S.; Nomura, H.; Tanaka, H.; Adachi, C. Nat. Photonics 2014, 8, 326. doi: 10.1038/nphoton.2014.12
-
[37]
(a) Obolda, A.; Peng, Q.; He, C.; Zhang, T.; Ren, J.; Ma, H.; Shuai, Z.; Li, F. Adv. Mater. 2016, 28, 4740.
(b) Tanaka, H.; Shizu, K.; Miyazaki, H.; Adachi, C. Chem. Commun. 2012, 48, 11392.
(c) Wu, K.; Zhang, T.; Zhan, L.; Zhong, C.; Gong, S.; Jiang, N.; Lu, Z.-H.; Yang, C. Chem.-Eur. J. 2016, 22, 10860.
(d) Takahashi, T.; Shizu, K.; Yasuda, T.; Togashi, K.; Adachi, C. Sci. Technol. Adv. Mater. 2014, 15, 034202. -
[38]
(a) Su, S. J.; Sasabe, H.; Takeda, T.; Kido, J. Chem. Mater. 2008, 20, 1691.
(b) Sun, Y.; Duan, L.; Zhang, D.; Qiao, J.; Dong, G.; Wang, L.; Qiu, Y. Adv. Funct. Mater. 2011, 21, 1881. -
[39]
Sasabe, H.; Gonmori, E.; Chiba, T.; Li, Y. J.; Tanaka, D.; Su, S. J.; Takeda, T.; Pu, Y. J.; Nakayama, K. I.; Kido, J. Chem. Mater. 2008, 20, 5951. doi: 10.1021/cm801727d
-
[40]
Park, I. S.; Komiyama, H.; Yasuda, T. Chem. Sci. 2017, 8, 953. doi: 10.1039/C6SC03793C
-
[41]
Park, I. S.; Lee, J.; Yasuda, T. J. Mater. Chem. C 2016, 4, 7911. doi: 10.1039/C6TC02027E
-
[42]
Komatsu, R.; Sasabe, H.; Seino, Y.; Nakao, K.; Kido, J. J. Mater. Chem. C 2016, 4, 2274. doi: 10.1039/C5TC04057D
-
[43]
(a) Wettach, H.; Jester, S. S.; Colsmann, A.; Lemmer, U.; Rehmann, N.; Meerholz, K.; Höger, S. Synth. Met. 2010, 160, 691.
(b) Shan, T.; Liu, Y.; Tang, X.; Bai, Q.; Gao, Y.; Gao, Z.; Li, J.; Deng, J.; Yang, B.; Lu, P.; Ma, Y. ACS Appl. Mater. Interfaces 2016. 8, 28771 -
[44]
Togashi, K.; Yasuda, T.; Adachi, C. Chem. Lett. 2013, 42, 383. doi: 10.1246/cl.121247
-
[45]
Park, J. Y.; Kim, J. M.; Lee, H.; Ko, K. Y.; Yook, K. S.; Lee, J. Y.; Baek, Y. G. Thin Solid Films 2011, 519, 5917. doi: 10.1016/j.tsf.2011.03.022
-
[46]
Togashi, K.; Nomura, S.; Yokoyama, N.; Yasuda, T.; Adachi, C. J. Mater. Chem. 2012, 22, 20689. doi: 10.1039/c2jm33669c
-
[47]
Takahashi, T.; Shizu, K.; Yasuda, T.; Togashi, K.; Adachi, C. Sci. Technol. Adv. Mater. 2014, 15, 34202. doi: 10.1088/1468-6996/15/3/034202
-
[48]
Kwon, D. Y.; Lee, G. H.; Kim, Y. S. J. Nanosci. Nanotechnol. 2015, 15, 7828. doi: 10.1166/jnn.2015.11192
-
[49]
Tsai, W. L.; Huang, M. H.; Lee, W. K.; Hsu, Y. J.; Pan, K. C.; Huang, Y. H.; Ting, H. C.; Sarma, M.; Ho, Y. Y.; Hu, H. C.; Chen, C. C.; Lee, M. T.; Wong, K. T.; Wu, C. C. Chem. Commun. 2015, 51, 13662. doi: 10.1039/C5CC05022G
-
[50]
Nasu, K.; Nakagawa, T.; Nomura, H.; Lin, C. J.; Cheng, C. H.; Tseng, M. R.; Yasuda, T.; Adachi, C. Chem. Commun. 2013, 49, 10385. doi: 10.1039/c3cc44179b
-
[51]
Sun, J. W.; Baek, J. Y.; Kim, K. H.; Huh, J. S.; Kwon, S. K.; Kim, Y. H.; Kim, J. J. J. Mater. Chem. C 2017, 5, 1027. doi: 10.1039/C6TC04653C
-
[52]
Rajamalli, P.; Senthilkumar, N.; Gandeepan, P.; Huang, P. Y.; Huang, M. J.; Ren, W. C. Z.; Yang, C. Y.; Chiu, M. J.; Chu, L. K.; Lin, H. W.; Cheng, C. H. J. Am. Chem. Soc. 2016, 138, 628. doi: 10.1021/jacs.5b10950
-
[53]
Rajamalli, P.; Senthilkumar, N.; Gandeepan, P.; Ren, W. C. Z.; Lin, H. W.; Cheng, C. H. J. Mater. Chem. C 2016, 4, 900. doi: 10.1039/C5TC03943F
-
[54]
Masui, K.; Nakanotani, H.; Adachi, C. Org. Electron. 2013, 14, 2721. doi: 10.1016/j.orgel.2013.07.010
-
[55]
Sun, J. W.; Kim, K. H.; Moon, C. K.; Lee, J. H.; Kim, J. J. ACS Appl. Mater. Interfaces 2016, 8, 9806. doi: 10.1021/acsami.6b00286
-
[56]
Cho, Y. J.; Yook, K. S.; Lee, J. Y. Sci. Rep. 2015, 5, 7859. doi: 10.1038/srep07859
-
[57]
Lee, D. R.; Hwang, S. H.; Jeon, S. K.; Lee, C. W.; Lee, J. Y. Chem. Commun. 2015, 51, 8105. doi: 10.1039/C5CC01940K
-
[58]
Kim, M.; Jeon, S. K.; Hwang, S. H.; Lee, S. S.; Yu, E.; Lee, J. Y. Chem. Commun 2016, 52, 339. doi: 10.1039/C5CC07999C
-
[59]
Cho, Y. J.; Chin, B. D.; Jeon, S. K.; Lee, J. Y. Adv. Funct. Mater. 2015, 25, 6786. doi: 10.1002/adfm.201502995
-
[60]
Cho, Y. J.; Jeon, S. K.; Lee, S. S.; Yu, E.; Lee, J. Y. Chem. Mater. 2016, 28, 5400. doi: 10.1021/acs.chemmater.6b01484
-
[61]
Park, I. S.; Lee, S. Y.; Adachi, C.; Yasuda, T. Adv. Funct. Mater. 2016, 26, 1813. doi: 10.1002/adfm.v26.11
-
[62]
Chen, D. Y.; Liu, W.; Zheng, C. J.; Wang, K.; Li, F.; Tao, S. L.; Ou, X. M.; Zhang, X. H. ACS Appl. Mater. Interfaces 2016, 8, 16791. doi: 10.1021/acsami.6b03954
-
[63]
Liu, W.; Zheng, C. J.; Wang, K.; Chen, Z.; Chen, D. Y.; Li, F.; Ou, X. M.; Dong, Y. P.; Zhang, X. H. ACS Appl. Mater. Interface 2015, 7, 18930. doi: 10.1021/acsami.5b05648
-
[64]
Pan, K. C.; Li, S. W.; Ho, Y. Y.; Shiu, Y. J.; Tsai, W. L.; Jiao, M.; Lee, W. K.; Wu, C. C.; Chung, C. L.; Chatterjee, T.; Li, Y. S.; Wong, K. T.; Hu, H. C.; Chen, C. C.; Lee, M. T. Adv. Funct. Mater. 2016, 26, 7560. doi: 10.1002/adfm.v26.42
-
[65]
Im, J. B.; Lampande, R.; Kim, G. H.; Lee, J. Y.; Kwon, J. H. J. Phys. Chem. C 2017, 121, 1305. doi: 10.1021/acs.jpcc.6b10854
-
[66]
Suzuki, K.; Kubo, S.; Shizu, K.; Fukushima, T.; Wakamiya, A.; Murata, Y.; Adachi, C.; Kaji, H. Angew. Chem. 2015, 127, 15446. doi: 10.1002/ange.201508270
-
[67]
Numata, M.; Yasuda, T.; Adachi, C. Chem. Commun. 2015, 51, 9443. doi: 10.1039/C5CC00307E
-
[68]
Park, I. S.; Numata, M.; Adachi, C.; Yasuda, T. Bull. Chem. Soc. Jpn. 2016, 89, 375. doi: 10.1246/bcsj.20150399
-
[69]
Kitamoto, Y.; Namikawa, T.; Ikemizu, D.; Miyata, Y.; Suzuki, T.; Kita, H.; Sato, T.; Oi, S. J. Mater. Chem. C 2015, 3, 9122. doi: 10.1039/C5TC01380A
-
[70]
Kitamoto, Y.; Namikawa, T.; Suzuki, T.; Miyata, Y.; Kita, H.; Sato, T.; Oi, S. Org. Electron. 2016, 34, 208. doi: 10.1016/j.orgel.2016.04.030
-
[71]
Kitamoto, Y.; Namikawa, T.; Suzuki, T.; Miyata, Y.; Kita, H.; Sato, T.; Oi, S. Tetrahedron Lett. 2016, 57, 4914. doi: 10.1016/j.tetlet.2016.09.072
-
[72]
Zhang, Q.; Li, J.; Shizu, K.; Huang, S.; Hirata, S.; Miyazaki, H.; Adachi, C. J. Am. Chem. Soc. 2012, 134, 14706. doi: 10.1021/ja306538w
-
[73]
Wu, S.; Aonuma, M.; Zhang, Q.; Huang, S.; Nakagawa, T.; Ku-wabara, K.; Adachi, C. J. Mater. Chem. C 2014, 2, 421. doi: 10.1039/C3TC31936A
-
[74]
Li, J.; Liao, X.; Xu, H.; Li, L.; Zhang, J.; Wang, H.; Xu, B. Dyes Pigm. 2017, 140, 79. doi: 10.1016/j.dyepig.2017.01.036
-
[75]
Liu, M.; Seino, Y.; Chen, D.; Inomata, S.; Su, S. J.; Sasabe, H.; Kido, J. Chem. Commun. 2015, 51, 16353. doi: 10.1039/C5CC05435D
-
[76]
Lee, S. Y.; Adachi, C.; Yasuda, T. Adv. Mater. 2016, 28, 4626. doi: 10.1002/adma.v28.23
-
[1]
-
表 1 分子在溶液中或分散在主体薄膜或非掺杂成膜中光致发光波长(λPL)、氮气环境下荧光量子产率(PLQY)、室温环境下荧光寿命(τPF, τDF)、单重态-三重态能级差(ΔEST)、电致发光波长(λEL)、最大外量子效率(EQE)以及CIE色坐标
Table 1. PL peak (λPL) in solution or dispersed in a host film or in neat film, photoluminescence quantum yield (PLQY, under nitrogen), lifetime at room temperature(τPF, τDF), singlet-triplet energy gap (ΔEST), EL peak (λEL) and maximum EQE, CIE for TADF based blue emitters and OLEDs
Compound λPL/nm PLQY/% τPF/ns τDF/μs ΔEST/eV λEL/nm EQE/% CIE Ref. 1 466b, 492a 35, 39a 12, 10a 120, 230a 0.080 506 5.3 — [26] 2 457, 480a 74d 6.3 — 0.09, 0.11a 487a 20.6g 0.19, 0.35 [27] 3 458, 475a 57d 6.0 — 0.28, 0.19a 478a 16.8g 0.17, 0.27 [27] 4 458, 475a 72d 6.5 — 0.032, 0.29a 477a 14.6g 0.18, 0.28 [27] 5 435 62 27 22 0.06 485 11 — [28] 6 — 16.7c — 3.9 0.1 470 9.3f 0.15, 0.22 [29] 7 — 50.5c — — 0.03 484 14.7f 0.17, 0.34 [29] 8 — 43.0c — — 0.01 480 12.3f 0.17, 0.31 [29] 9 — 40e — 13.4 0.17 486 23.6f 0.21, 0.36 [30] 10 — 97.9c — 5.4 0.002 477 20.4f 0.18, 0.31 [31] 11 — 31.1c — 29.6 0.191 473 13.2f 0.17, 0.25 [31] 12 — 85.3c — 31.2 0.302 465 16.7f 0.15, 0.18 [31] 13 495 29.8d 11.0 4.73 — — — — [35] 14 502, 510a 43.1d, 87a, d 21.1, 11.2a 13.3, 520a 0.15 508 14.9g — [35] 15 577, 550a 12d, 45a, d 9.0, 7.0a 0.52, 5.4a 0.08 580 9.5g — [36] 16 528 7d, 44a, d 3.9 33 0.02 — 9.2g — [36] 17 495 4, 12a, d 3.6 — 0.08 — 4.3g — [36] 18 428b 75±2b, e — — 0.5 — 6.8h 0.158, 0.043 [37] 19 458, 464a 87a, e 12a 38a 0.25 470 20.4g 0.15, 0.15 [40] 20 451, 452a 69a, e 11a 40a 0.25 462 12.2g 0.15, 0.12 [40] 21 461, 466a 91a, e 13a 45a 0.26 469 17.1g 0.15, 0.18 [40] 22 454, 458a 90a, e 11a 70a 0.29 460 14.3g 0.15, 0.13 [40] 23 448, 457a 83a, e 11a 78a 0.30 458 11.4g 0.15, 0.13 [40] 24 453, 458a 54e, 92a, e 11a 330a 0.26a 468 19.0h 0.16, 0.21 [41] 25 456, 462a 50e, 94a, e 11a 210a 0.24a 472 20.8h 0.16, 0.24 [41] 26 498 77a, e — 21.4a 0.18a 499 20.9 0.21, 0.44 [42] 27 498 79a, e — 20.7a 0.19a 498 19.0 0.21, 0.44 [42] 28 489 80a, e — 26.2a 0.19a 489 24.5 0.19, 0.37 [42] 29 503, 492a 26e, 49a, e — — 0.16 496 7.5h — [47] 30 490, 483a 36e, 52a, e — — 0.13 486 8.7h — [47] 31 532, 499a 77e, 77a, e 50 18.1 0.26 499 7.5h — [47] 32 428b 75±2b, e — — 0.5 — 6.8h 0.158, 0.043 [37] 33 420b 43e — — — — 3.5h 0.156, 0.058 [37] 34 485 45b, d, 81a, d 175 5.3 0.04 490 16.5g 0.17, 0.30 [50] 35 438, 444a 21e, 55a, e — 7.1 0.21 446 8.1h 0.16, 0.14 [18] 36 462, 475a 38e, 73a, e — 4.6 0.14 484 14.3h 0.17, 0.27 [18] 37 509, 538a 44e, 70a, e — 0.12 0.03 539 10.7h 0.37, 0.58 [18] 38 566, 541a 36e, 71a, e — 0.13 0.10 586 4.2h 0.58, 0.36 [18] 39 600, 555a 10e, 36a, e — 0.03 0.06 548 6.9h 0.49, 0.51 [18] 40 496 46a, d — 925 0.05 504 10g — [19] 41 — 37e, 63a, e — 3.1 0.16 481 23.3f 0.21, 0.34 [30] 42 468, 469a 70a, e 134a 48.16a 0.06 484 11.4h 0.174, 0.310 [51] 43 490, 514a 88.0c 15 0.6 0.03 488 24.0f 0.17, 0.36 [52] 44 508, 518a 91.4c 18 1.0 0.04 514 27.2f 0.30, 0.64 [52] 45 467, 467a 90a, e 6.2 0.2 0.06 474 18.4f 0.16, 0.25 [53] 46 473 46.5c, 89b, c 28.5 166, 273b 0.34 470 8.0f — [15, 54, 55] 47 447 35e — 1.2b 0.05 462 16.4f 0.17, 0.30 [56] 48 473a 94.6e, 85a, e — 2.60 0.13 486 12.1g — [57] 49 475a 94.0e, 85a, e — 1.98 0.17 486 11.8g — [57] 50 470 87e — 2.35 0.11 510 17.9h 0.29, 0.52 [58] 51 448 66e — 2.96 0.16 475 21.8h 0.17, 0.29 [58] 52 444 61e — 4.21 0.21 473 19.5h 0.16, 0.23 [58] 53 443 76e, 74b, e — 28 0.06 463 17.8h 0.16, 0.19 [59] 54 453 81e, 100b, e — 17 0.06 471 20.0h 0.16, 0.25 [59] 55 458 46e — 24.34a 0.27 456 14g 0.14, 0.12 [60] 56 453 76e — 24.34a 0.27 460 4.8g — [60] 57 450 63e 41 173 0.36 465 8.7f 0.15, 0.18 [61] 58 499 86e 35 5.1 0.20 504 18.9f 0.23, 0.50 [61] 59 455 46.6a, e 14.2 57.9 0.02 500 19.9f 0.22, 0.40 [62] 60 455 54.9a, e 10.5 12.9 0.01 484 17.4f 0.18, 0.32 [62] 61 448 49.7e — 46.6 0.04 475 21.2f 0.20, 0.35 [63] 62 488, 490a 34.5e, 91.6a, e 10.4a 19.3 0.19 — 23.9h 0.24, 0.49 [64] 63 504, 495a 30.6e, 89.3a, e 10.7a 14.5 0.18 — 23.1h 0.28, 0.54 [64] 64 562, 550a 48.9e, 90.4a, e 26.7a 1.9 0.032 — 29.2h 0.43, 0.55 [64] 65 524, 526a 31.1e, 100a, e 15.7a 11.6 0.09 — 31.3h 0.32, 0.59 [64] 66 543, 541a 54.5e, 95a, e 23.7a 5.2 0.04 — 30.6h 0.34, 0.57 [64] 67 462, 470a 17.8e, 36a, e 6.99a 0.03 0.439 — 5.7h 0.17, 0.18 [64] 68 431, 436a 11.2e, 15a, e 6.53a 0.01 0.403 — 1.6h 0.16, 0.06 [64] 69 519 31.34e 5.09 8.01 0.03 — 1.50f 0.16, 0.28 [65] 70 450 31.12e 3.86 7.47 0.02 — 4.01f 0.15, 0.14 [65] 71 509, 504a 44d, 92a, d — — 0.071 502 22.8g 0.22, 0.55 [66] 72 495, 487a 84d, 100a, d — — 0.058 492 21.6g 0.18, 0.43 [66] 73 477, 477a 91d, 87a, d — — 0.062 488 14.0g 0.22, 0.55 [66] 74 475 100d 33 1.60 0.10 480 21.7g 0.14, 0.23 [67] 75 456 76d 28 4.02 0.12 475 19.0g 0.14, 0.12 [67] 76 451 56d 26 2.06 0.06 465 20.1g 0.15, 0.09 [67] 77 443 86d 21 3.49 0.12 465 13.3g 0.15, 0.08 [67] 78 467 99e 19 91 0.24 473 18.2f 0.15, 0.23 [68] 79 — — — — — — — — [69] 80 440a 98a, d — 2.36 0.013 466 15.1f — [69] 81 482a 99a, d — 1.87 0.028 503 22.1f — [69] 82 — — — — 0.456 — — — [70] 83 484 89.0d 41.4 6.71 0.041 479 16.0f 0.14, 0.24 [70] 84 540 87.0d 42.8 1.98 0.033 525 17.3f 0.28, 0.58 [70] 85 446 81a, d 47.8 4.15 0.040 — — 0.14, 0.09 [71] 86 462 81a, d 25.0 3.70 0.057 — — 0.14, 0.15 [71] 87 402, 421a 57e, 60a, e 2.2, 3.5a 90, 850a 0.54 420 2.9f — [72] 88 419, 430a 65e, 66a, e 3.1, 3.2a 140, 840a 0.45 425 5.6f — [72] 89 404, 423a 69e, 80a, e 5.3, 7.6a 270, 2600a 0.32 400 9.9f 0.15, 0.07 [72] 90 445 56d — 127 0.21 460 14.5f 0.16, 0.16 [73] 91 426 64d 6.5 347, 2530 0.25 428 — 0.15, 0.12 [74] 92 439 52d 8.7 378, 2860 0.17 440 — 0.19, 0.15 [74] 93 461 56.3e — 1.23 0.19 460 11.7 0.18, 0.19 [75] 94 434 69.3e — 1.16 0.26 435 5.5 0.15, 0.08 [75] 95 451, 458a 48e, 98a, e 29 2.7 0.06 486 20.5f 0.16, 0.26 [76] aDispersed in a host film. bNeat film. cCalculated from the PL measurement. dAbsolute PLQY from spectrometer measurement. eAbsolute PLQY from integrating sphere measurement. fCalculated from the current density, luminance and EL measurement. gAbsolute Maxmuim EQE from spectrometer measurement. hAbsolute Maxmuim EQE from integrating sphere measurement. 表 2 四种典型氮杂环电子受体D-A型TADF分子在溶液中光致发光波长(λPL)、绝对荧光量子产率(PLQY, 氮气环境下)及单重态-三重态能级差(ΔEST)
Table 2. PL peak (λPL) in solution, absolute photoluminescence quantum yield (PLQY, under nitrogen) and singlet-triplet energy gap (ΔEST) for 4 typical nitrogen heterocycle-based D-Atype TADF emitters
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 153
- 文章访问数: 5655
- HTML全文浏览量: 1768







 下载:
下载:


 下载:
下载:

