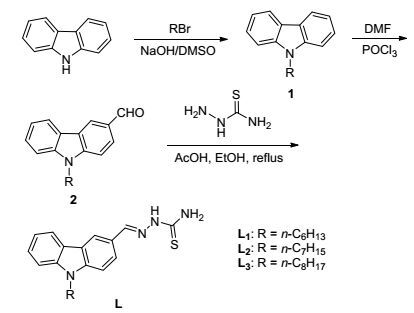
 图式 1
探针L的合成路线
Scheme1.
Synthetic route of probe L
图式 1
探针L的合成路线
Scheme1.
Synthetic route of probe L

Citation: Li Yingjun, Zhang Nan, Jin Kun, Xu Yongting, Wang Siyuan, Zhou Xiaoxia. Novel Carbazole-Thiosemicarbazide Based Schiff-Base Probes for Cu2+[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2640-2646. doi: 10.6023/cjoc201704010

新型基于咔唑-氨基硫脲席夫碱识别Cu2+的探针
English
Novel Carbazole-Thiosemicarbazide Based Schiff-Base Probes for Cu2+
-
Key words:
- carbazole
- / thiosemicarbazide
- / Schiff base
- / naked-eye recognition
- / Cu2+ fluorescence probe
-
过渡金属离子和重金属是有毒的, 并且能够残留在生态系统中, 所以过渡金属离子和重金属的污染威胁着人类健康[1].近年来, 开发检测过渡金属离子和重金属离子的化学传感器已成为化学和环境科学一个活跃的研究领域[2~7]. Cu2+是支持生物活动所必须的微量元素, 但其过量时也具有毒性.因其具有不可生物降解的性质, 并且在食物链中容易积累, 使它对人类健康和环境会造成严重的威胁[8].因此, 寻找一个可靠的方法来检测生物和环境样品中微量的Cu2+是至关重要的.识别Cu2+的高灵敏性、选择性荧光探针的设计和合成越来越受到人们的关注[9~16].
席夫碱含有C=N键, 对金属离子具有良好的结合能力, 并且其合成方法较简单, 目前已经报道了许多检测Cu2+[17]、Hg2+[18]、Zn2+[19]等金属离子的化学传感器.缩氨基硫脲是有效的金属螯合剂, 广泛用于荧光探针中, 在有毒金属离子的化学传感器方面具有重要的应用价值, 已成为近年来的研究热点[20~23].咔唑及其衍生物因具有良好的共平面性、强的分子内电荷转移、良好的溶解性、稳定性、结构修饰简便等许多优点, 咔唑基团常作为荧光团[24].基于上述思路, 本文设计合成了3个新型基于咔唑-氨基硫脲席夫碱衍生物L1~L3 (Scheme 1), 期望目标化合物L在离子识别方面具有潜在的应用价值.
1 结果与讨论
1.1 探针L的紫外-可见吸收光谱和荧光光谱
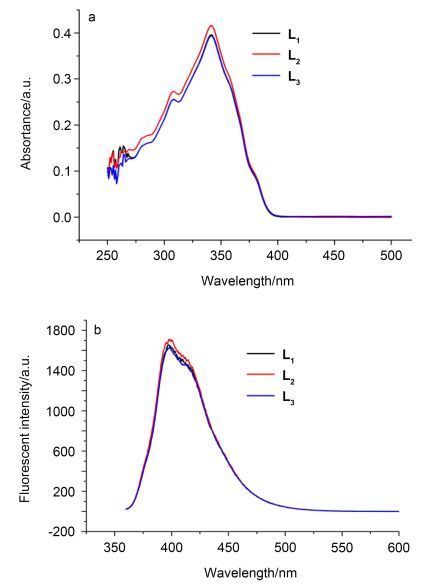
为了研究探针L1~L3的光学性质, 测试了它们的紫外-可见吸收光谱和荧光光谱(图 1).由图 1a可知, 探针L1~L3的DMSO溶液, 在308和340 nm处均出现两个吸收峰, 可以归属于共轭骨架的π-π*跃迁.由图 1b可知, 以340 nm的光进行激发时探针L1~L3的最大发射波长均为398 nm.上述结果说明, 探针L1~L3的光谱性质相似.因探针L2的吸收强度和荧光强度都高于探针L1和L3, 所以, 选择探针L2进行后续研究.
1.2 最优实验条件研究
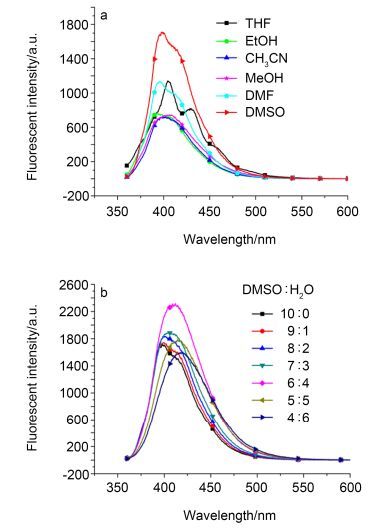
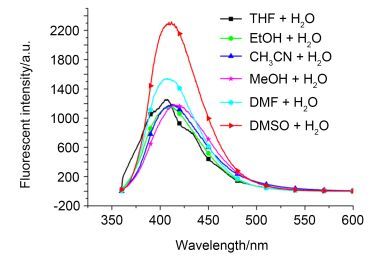
为了使L2达到最佳的选择性能, 分别进行了溶剂和pH值对L2荧光光谱影响的研究. L2在不同溶剂及在DMSO-H2O混合溶剂中的荧光光谱见图 2.由图 2a可知, 探针L2在DMSO中的荧光强度高于其它溶剂(如THF、EtOH、CH3CN、MeOH和DMF)中的荧光强度. 图 2b显示, 探针L2在DMSO-H2O混合溶剂中, 随着水的比例的增加, 荧光强度不断增大, 当DMSO与水的比例达到6:4时荧光强度最强.同时, 最大发射波长也随水的比例增大发生红移(移动了22 nm), 波形也稍有改变.这是因为, 分子的荧光光谱受溶剂极性的影响较大, 分子受激发时发生了π→π*跃迁, 其激发态比基态具有更大的极性, 随着水的比例增大, 溶剂的极性增大, 对激发态比对基态产生更大的稳定作用, 结果使荧光光谱随着溶剂的极性增大而向长波方向移动, 荧光强度随之增强, 波形发生了变化.对探针L2在其它溶剂与水混合(V:V=6:4)形成的溶液中的荧光强度的研究(图 3)表明, L2在DMSO-H2O中的荧光强度最强, 这是因为DMSO-H2O (V:V=6:4)的极性最大.基于此, 在后续的研究中以DMSO-H2O (V:V=6:4)作为溶剂.
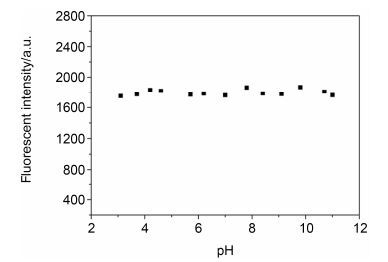
探究探针在不同pH值下的荧光发射光谱, 可以确定探针适用的pH范围.由图 4可观察到探针L2在DMSO-H2O (V:V=6:4) Tris-HCl缓冲液中的荧光强度在pH值为3.0~11.0范围内并没有明显的变化, 这说明在此pH值范围内, L2对溶液的酸碱性并不敏感.这一结果表明, L2不但可以应用于检测环境中的Cu2+, 还可以作为生物体系在近中性条件下检测Cu2+的荧光化学传感器.
1.3 裸眼识别
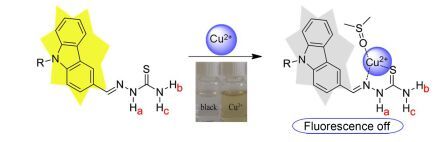
向探针L2的DMSO-H2O (V:V=6:4)溶液(1.0×10-4 mol/L)中分别加入2.0 equiv.不同的阳离子, 观察其在日光及紫外灯照射下溶液颜色的变化情况(图 5).如图 5所示, 在日光下观察发现, 当加入Cu2+后, 溶液的颜色由无色变成黄色, 而加入其它金属离子后溶液的颜色无明显变化.在紫外灯照射下(λ=365 nm)观察发现, 当加入Cu2+后, 溶液显示了明显的荧光猝灭现象, 加入其它金属离子后溶液无明显现象.这表明探针L2与Cu2+具有较强的作用力.探针L2可以裸眼识别Cu2+, 是识别Cu2+的化学传感器. L1和L3在日光及紫外灯照射下溶液颜色的变化情况同L2.
1.4 探针L2的光谱性能研究
1.4.1 探针L2对阳离子的选择性识别
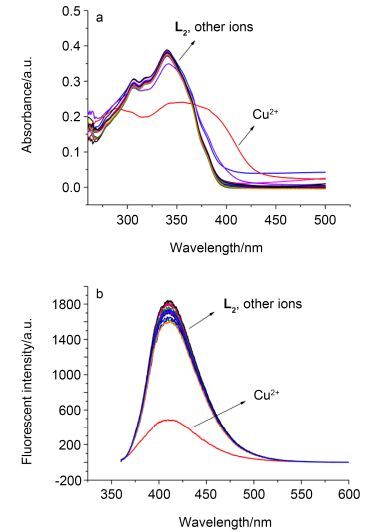
为了探究探针L2与金属离子的结合性能, 首先考查了在1 equiv.不同金属离子(Mn2+、Hg2+、Ni2+、Zn2+、Cu2+、Ba2+、Na+、K+、Li+、Sn2+、Ag+、Co2+、Pb2+、Fe3+、Sr2+、Cd2+)存在下, 探针L2在含有Tris-HCl缓冲液(pH=7.0)的DMSO-H2O (V:V=6:4)溶液中的紫外-可见和荧光光谱, 结果见图 6.紫外吸收光谱(图 6a)显示, 当加入Cu2+后在340 nm处的吸收峰明显减弱, 并且在340~450 nm之间出现了一个宽的吸收峰, 而未加入离子或加入其它金属离子时, 探针L2的紫外吸收光谱无明显变化.荧光光谱(图 6b)表明, 当加入Cu2+后, 在410 nm处的荧光强度明显减弱, 而未加入离子或加入其它金属离子时, 探针L2的荧光强度较强.由此说明, 目标化合物L2是Cu2+的高选择性的比色荧光探针.
1.4.2 干扰实验
为了进一步探究L2作为Cu2+选择性探针的实用性, 进行了在1.0 equiv.不同金属离子与1.0 equiv. Cu2+共存时的干扰实验研究.由图 7实验结果可知, 在其它金属离子存在时, 向探针L2的DMSO-H2O (V:V=6:4) Tris-HCl缓冲液(pH=7.0)中加入Cu2+后, 由Cu2+引起的荧光猝灭现象没有发生变化.由此说明, 探针L2对Cu2+的识别具有较强的抗干扰能力, 对Cu2+是一个高选择性的荧光探针.
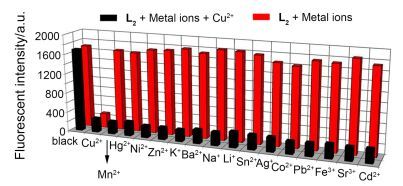 图7
其它金属离子(1.0×10-5mol/L)和Cu2+ (1.0×10-5mol/ L)共存时探针L2 (1×10-5mol/L)在DMSO-H2O (V:V=6:4) Tris-HCl缓冲液(pH=7.0)中的荧光响应(λex=340 nm)
Figure7.
Fluorescence response of probe L2 (1.0×10-5 mol/L) upon addition of various metal ions (1.0×10-5 mol/L) in and without the presence of Cu2+(1.0×10-5 mol/L) in DMSO-H2O (V:V=6:4) buffered by Tris-HCl (pH=7.0) (λex=340 nm)
图7
其它金属离子(1.0×10-5mol/L)和Cu2+ (1.0×10-5mol/ L)共存时探针L2 (1×10-5mol/L)在DMSO-H2O (V:V=6:4) Tris-HCl缓冲液(pH=7.0)中的荧光响应(λex=340 nm)
Figure7.
Fluorescence response of probe L2 (1.0×10-5 mol/L) upon addition of various metal ions (1.0×10-5 mol/L) in and without the presence of Cu2+(1.0×10-5 mol/L) in DMSO-H2O (V:V=6:4) buffered by Tris-HCl (pH=7.0) (λex=340 nm)
1.4.3 荧光滴定实验
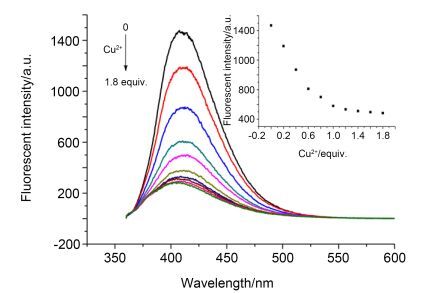
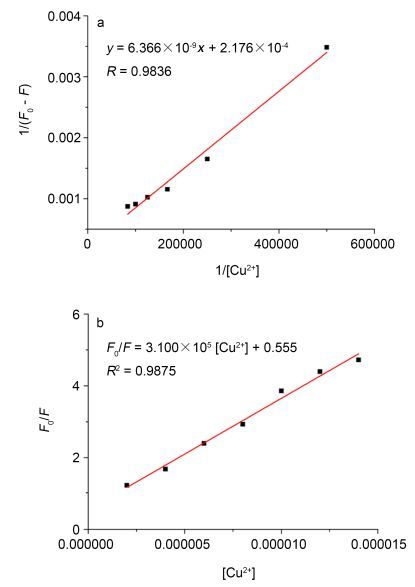
利用荧光滴定实验进一步评价了探针L2对Cu2+的选择性, 结果见图 8.荧光光谱显示, 随着Cu2+浓度的逐渐增大, 在410 nm处的最大荧光发射强度不断减弱, 当Cu2+浓度增加至1.8 equiv.时, 荧光强度基本不再降低, 说明反应体系已经达到饱和.探针L2的荧光强度与Cu2+浓度在0~8×10-6 mol·L-1区间具有良好的线性关系, 表明探针L2与Cu2+很好的结合.经过拟合得到线性回归方程: y=6.366×10-9x+2.176×10-4, R2=0.9836, 并计算得到络合常数Ka=3.42×104 L·mol-1 (图 9a).利用Stern-Volmer方程在Cu2+浓度为2×10-6~ 1.4×10-5 L·mol-1 (R2=0.9875)的范围内获得线性曲线(图 9b), 得到荧光猝灭常数Ksv=3.10×105 L·mol-1.如此高的Ksv说明较低Cu2+浓度即可导致化合物L2的荧光猝灭, 所以化合物L2可作为检测Cu2+的探针.探针L2对Cu2+的最低检测限为8.96×10-6 mol·L-1.美国环境保护局(EPA)和世界卫生组织(WHO)所规定的饮用水中铜含量的安全值分别为1.3 mg/L (≈20 µmol/L)和2.0 mg/L (≈30 µmol/L)[25].实验所得最低检测限低于EPA和WHO所规定的浓度, 所以探针L2可以用于定量检测饮用水中Cu2+浓度.
1.4.4 探针L与Cu2+的络合方式
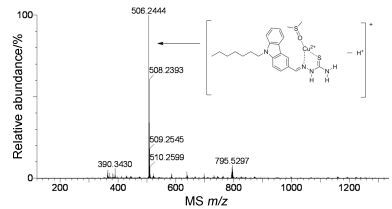
为了确定探针L2与Cu2+之间的络合比, 进行了ESI质谱分析(图 10).阳离子质谱在m/z=506.2444处显示一个峰, 归属为[L2+Cu2++DMSO-H+]+(计算值: m/z=506.1224), 说明L2与Cu2+之间是1:1配位, 且溶剂DMSO参与配位.
1.4.5 1H NMR滴定
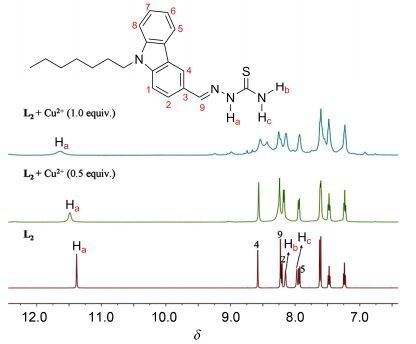
为了得到探针L2与Cu2+的络合机理, 利用累积滴加法, 进行了L2在DMSO-d6中的1H NMR滴定实验. 图 11显示, L2在δ 11.37, 8.13和7.96处出现三个单峰, 它们分别归属为NH(Ha)和NH2 (Hb和Hc)的质子信号峰.随着Cu2+浓度的增加, Ha和Hb信号峰移向低场, Hc信号峰移向高场, 当加入1.0 equiv.的Cu2+时, Ha信号峰低移至δ 11.66, Hb和Hc信号峰与其它峰合并.此外, 咔唑环上的某些质子信号峰也稍有移动, 这是由于缩氨基硫脲-Cu2+部分电荷密度的增加, 促使L2分子内电荷移动.这些现象表明, 在L2中的氨基硫脲部分与Cu2+配位, 结合MS谱可知形成一个1:1配位的L2-Cu2+络合物.探针L1和L3的1H NMR滴定也得到了同样的结果, 这说明它们与Cu2+具有相同的配位模式(详见辅助材料).
根据上述UV和FL光谱分析、1H NMR滴定以及ESI质谱分析, 探针L与Cu2+的络合模式如图 12所示.探针L中的咔唑基团是芳香性的稠杂环化合物, 具有强的发光性能, 但由于Cu2+离子与识别基团(氨基硫脲部分)结合, 探针L受光激发使荧光团(咔唑部分)电子向受体部分转移, 即发生分子内光诱导电子转移(PET), 使得探针L在410 nm处的荧光强度明显减弱, 荧光发生淬灭.
2 结论
本文利用简单的合成方法制备出了3个新型的基于咔唑-氨基硫脲席夫碱衍生物L1~L3.阳离子识别性能研究结果表明, 化合物L1~L3具有高选择性裸眼和荧光猝灭识别Cu2+的特性, 化合物L1~L3是Cu2+的裸眼、比色荧光探针. NMR和MS谱分析表明, 探针L2与Cu2+形成1:1的配合物.探针L2对Cu2+的最低检测限为8.96×10-6 mol·L-1, 低于WHO规定的饮用水中Cu2+的最大含量(20 µmol·L-1).探针L1~L3水溶性良好, 可以在DMSO-H2O (Tris-HCl缓冲液, pH=7.0)的体系中使用.探针L在检测生物体系与环境水中Cu2+含量方面具有潜在的应用价值.同时探针L1~L3自身稳定性强、合成方法简单、产率较高, 是一种可行性高的探针.
3 实验部分
3.1 仪器与试剂
X-5显微熔点测定仪(温度计未经校正); 德国TENSOR 27型FT-IR红外光谱仪, KBr压片; 德国BRUKER 500 MHz核磁共振仪, CDCl3/DMSO-d6为溶剂, TMS为内标; 美国Waters公司Q-Tof Micro型质谱仪; 德国Elementar公司Vario EL型元素分析仪; 美国Perkin Elmer Lambda 35紫外-可见分光光度计; 日本HITACHI F-7000荧光光谱仪.药品:所用药品均为试剂公司购买的分析纯试剂.
3.2 探针2-[(N-烷基-咔唑-3-基)甲叉基]肼硫代甲酰胺(L)的合成
中间体化合物1参照文献[26]方法合成, 中间体化合物2参照文献[27]方法合成.化合物1和2的波谱数据与文献[28]一致.在50 mL干燥的圆底烧瓶中依次加入1 mmol中间体化合物2、0.14 g (1.5 mmol)氨基硫脲、10 mL无水乙醇和几滴冰醋酸, 加热回流, 薄层色谱(TLC)监测反应进程.反应完成后, 将反应混合物冷却至室温, 抽滤, 粗产品用乙醇重结晶后即得到探针L.
2-[(N-己烷-咔唑-3-基)甲叉基]肼硫代甲酰胺(L1):奶白色粒状晶体, 产率94.29%. m.p. 184.3~185.1 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.38 (s, 1H, NHa), 8.58 (d, J=1.0 Hz, 1H, Cz-H4), 8.23 (s, 1H, CH=N), 8.21 (d, J=7.5 Hz, 1H, Cz-H2), 8.15 (s, 1H, NHb), 7.98 (s, 1H, NHc), 7.94 (dd, J=8.5, 1.5 Hz, 1H, Cz-H5), 7.61 (d, J=8.5 Hz, 2H, Cz-H1, H8), 7.48 (td, J=7.8, 1.0 Hz, 1H, Cz-H7), 7.24 (t, J=7.5 Hz, 1H, Cz-H6), 4.40 (t, J=7.0 Hz, 2H, NCH2), 1.68~1.82 (m, 2H, NCH2CH2), 1.10~1.35 (m, 6H, NCH2CH2(CH2)3CH3), 0.80 (t, J=7.0 Hz, 3H, CH3); 13C NMR (DMSO-d6, 125 MHz) δ: 179.43, 145.47, 142.95, 142.37, 127.98, 127.00, 126.94, 124.19, 124.02, 122.45, 122.05, 121.11, 111.47, 111.37, 44.26, 32.81, 30.35, 27.96, 23.85, 15.67; IR (KBr) v: 3437, 3275, 3153, 3041, 2925, 2853, 1628, 1598, 1495, 1473. Anal. calcd for C20H24N4S: C 68.15, H 6.86, N 15.89; found C 68.41, H 7.07, N 15.70. ESI-HRMS calcd for C20H24N4NaS (M+Na)+ 375.1614, found 375.1619.
2-[(N-庚烷-咔唑-3-基)甲叉基]肼硫代甲酰胺(L2):白色针状晶体, 产率88.89%. m.p. 174.1~174.7 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.37 (s, 1H, NHa), 8.57 (s, 1H, Cz-H4), 8.23 (s, 1H, CH=N), 8.20 (d, J=8.0 Hz, 1H, Cz-H2), 8.13 (s, 1H, NHb), 7.96 (s, 1H, NHc), 7.93 (d, J=8.5 Hz, 1H, Cz-H5), 7.60 (d, J=8.5 Hz, 2H, Cz-H1, H8), 7.47 (t, J=7.8 Hz, 1H, Cz-H7), 7.23 (t, J=7.8 Hz, 1H, Cz-H6), 4.39 (t, J=7.0 Hz, 2H, NCH2), 1.70~1.83 (m, 2H, NCH2CH2), 1.05~1.35 (m, 8H, NCH2CH2(CH2)4-CH3), 0.80 (t, J=6.5 Hz, 3H, CH3); 13C NMR (DMSO-d6, 125 MHz) δ: 179.42, 145.47, 142.95, 142.37, 127.98, 126.99, 126.94, 124.19, 124.02, 122.44, 122.05, 121.11, 111.48, 111.37, 44.26, 33.04, 30.40, 30.28, 28.29, 23.82, 15.73; IR (KBr) v: 3427, 3264, 3153, 3046, 2925, 2853, 1629, 1595, 1495, 1473. Anal. calcd for C21H26N4S: C 68.82, H 7.15, N 15.29; found C 69.02, H 6.97, N 15.53. ESI-HRMS calcd for C21H26N4NaS (M+Na)+ 389.1780, found 389.1776.
2-[(N-辛烷-咔唑-3-基)甲叉基]肼硫代甲酰胺(L3):奶白色粒状晶体, 产率89.47%. m.p. 174.8~175.7 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 11.39 (s, 1H, NHa), 8.58 (d, J=0.5 Hz, 1H, Cz-H4), 8.23 (s, 1H, CH=N), 8.21 (d, J=8.0 Hz, 1H, Cz-H2), 8.16 (s, 1H, NHb), 7.98 (s, 1H, NHc), 7.93 (dd, J=8.5, 1.5 Hz, 1H, Cz-H5), 7.61 (d, J=8.5 Hz, 2H, Cz-H1, H8), 7.47 (td, J=7.8, 0.8 Hz, 1H, Cz-H7), 7.24 (t, J=7.5 Hz, 1H, Cz-H6), 4.40 (t, J=7.0 Hz, 2H, NCH2), 1.65~1.85 (m, 2H, NCH2CH2), 1.05~1.35 (m, 10H, NCH2CH2(CH2)5CH3), 0.81 (t, J=6.8 Hz, 3H, CH3); 13C NMR (DMSO-d6, 125 MHz) δ: 179.42, 145.47, 142.95, 142.37, 127.97, 126.99, 126.93, 124.20, 124.03, 122.44, 122.04, 121.10, 111.47, 111.36, 44.26, 33.01, 30.58, 30.44, 30.37, 28.31, 23.86, 15.75; IR (KBr) v: 3432, 3269, 3153, 3041, 2925, 2853, 1628, 1594, 1495, 1473. Anal. calcd for C22H28N4S: C 69.44, H 7.42, N 14.72; found C 69.27, H 7.64, N 14.57. ESI-HRMS calcd for C22H28N4NaS (M+Na)+ 403.1946, found 403.1932.
3.3 荧光光谱测定方法
化合物L2测试溶液的配制:以DMSO为溶剂, 将化合物L2配置成2.0×10-3mol/L的储备溶液, 然后移取一定的体积再用DMSO-H2O (V:V=6:4) Tris-HCl缓冲液(pH=7.0)稀释成1.0×10-5mol/L的待测溶液. Tris-HCl缓冲液的配制:以二次蒸馏水为溶剂, 配制0.1 M Tris缓冲溶液和0.1 mol·L-1 HCl溶液, 通过HCl溶液调节以达到目标pH.
金属离子储备液的配制:以二次蒸馏水为溶剂, 配制5.0×10-3 mol/L的金属离子溶液[Pb(NO3)2、CuSO4· 5H2O、CoCl2·6H2O、Sr(NO3)2、BaCl2·2H2O、ZnSO4·7H2O、NiSO4·6H2O、3CdSO4·8H2O、MnSO4·H2O、HgNO3、SnCl2·2H2O、Fe(NO3)2·9H2O、NaCl、LiClO4·3H2O、AgNO3、KNO3], 以留备用.
荧光光谱的测定均在室温条件下进行.测试条件:室温, 样品池为1 cm×1 cm×4 cm石英比色皿, 激发狭缝宽度(EX)为5.0, 发射狭缝宽度(EM)为5.0, 激发波长λex为340 nm, 于360~660 nm范围内测试荧光.
辅助材料(Supporting Information) 所有目标化合物的IR, 1H NMR, 13C NMR, MS图谱以及探针L1和L3的裸眼识别、离子识别和核磁滴定谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Zhan, S. S.; Wu, Y. G.; Wang, L. M.; Zhan, X. J.; Liu, P. Biosens. Bioelectron. 2016, 86, 353. doi: 10.1016/j.bios.2016.06.075
-
[2]
Lee, S. Y.; Bok, K. H.; Kim, J. A.; Kim, S. Y.; Kim, C. Tetrahe-dron 2016, 72, 5563. doi: 10.1016/j.tet.2016.07.051
-
[3]
Zhou, H. T.; Sun, L.; Chen, W.; Tian, G. J.; Chen, Y.; Li, Y. R.; Su, J. H. Tetrahedron 2016, 72, 2300. doi: 10.1016/j.tet.2016.03.036
-
[4]
Kundu, A.; Hariharan, P. S.; Prabakaran, K.; Anthony, S. P. Sens. Actuators, B:Chem. 2015, 206, 524. doi: 10.1016/j.snb.2014.09.099
-
[5]
Yang, J. Y.; Chen, L. H.; Zheng, Y. Z.; Dong, X. Y.; Raghunandhan, R.; So, P. L.; Chan, C. C. Sens. Actuators, B:Chem. 2016, 230, 353. doi: 10.1016/j.snb.2016.02.038
-
[6]
Qin, J. C.; Fan, L.; Yang, Z. Y. Sens. Actuators, B:Chem. 2016, 228, 156. doi: 10.1016/j.snb.2016.01.031
-
[7]
Feng, Y.; Lia, D. X.; Wang, Q.; Wang, S. X.; Meng, X. M.; Shao, Z. L.; Zhu, M. Z.; Wang, X. Sens. Actuators, B:Chem. 2016, 225, 572. doi: 10.1016/j.snb.2015.11.081
-
[8]
Zhou, Y. Y.; Tang, L.; Zeng, G. M.; Zhang, C.; Zhang, Y.; Xie, X. Sens. Actuators, B:Chem. 2016, 223, 280. doi: 10.1016/j.snb.2015.09.090
-
[9]
Kandasamy, K.; Ganesabaskaran, S.; Pachamuthu, M. P.; Maheswari, R.; Ramanathan, A. Spectrochim. Acta, Part A 2015, 150, 34. doi: 10.1016/j.saa.2015.05.009
-
[10]
Samanta, S.; Samanta, P. K.; Dutta, S.; Biswas, P. Spectrochim. Acta, Part A 2015, 147, 262. doi: 10.1016/j.saa.2015.03.096
-
[11]
Xu, W. J.; Qi, D. Q.; You, J. Z.; Hu, F. F.; Bian, J. Y.; Yang, C. X.; Huang, J. J. Mol. Struct. 2015, 1091, 133. doi: 10.1016/j.molstruc.2015.02.083
-
[12]
Wang, E. Z.; Zhou, Y. M.; Huang, Q.; Pang, L. F.; Qiao, H.; Yu, F.; Gao, B.; Zhang, J. L.; Min, Y. H.; Ma, T. S. Spectrochim. Acta, Part A 2016, 152, 327. doi: 10.1016/j.saa.2015.07.090
-
[13]
Hu, Y.; Zhang, J.; Lv, Y. Z.; Huang, X. H.; Hu, S. L. Spectrochim. Acta, Part A 2016, 157, 164. doi: 10.1016/j.saa.2015.12.031
-
[14]
Bekhradnia, A.; Domehri, E.; Khosravi, M. Spectrochim. Acta, Part A 2016, 152, 18. doi: 10.1016/j.saa.2015.07.029
-
[15]
Diao, H. P.; Niu, W. P.; Liu, W.; Feng, L. H.; Xie, J. Spectrochim. Acta, Part A 2017, 170, 65. doi: 10.1016/j.saa.2016.07.014
-
[16]
李英俊, 李继阳, 许永廷, 靳焜, 曹欣, 有机化学, 2017, 37, 896. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345878.shtmlLi, Y. J.; Li, J. Y.; Xu, Y. T.; Jin, K.; Cao, X. Chin. J. Org. Chem. 2017, 37, 896(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345878.shtml
-
[17]
Xiong, J. J.; Huang, P. C.; Zhang, C. Y.; Wu, F. Y. Sens. Actuators, B:Chem. 2016, 226, 30. doi: 10.1016/j.snb.2015.11.113
-
[18]
Feng, L.; Shi, W.; Ma, J. C.; Chen, Y. B.; Kui, F.; Hui, Y. H.; Xie, Z. F. Sens. Actuators, B:Chem. 2016, 237, 563. doi: 10.1016/j.snb.2016.06.129
-
[19]
Liu, J. L.; Meng, X.; Duan, H. D.; Xu, T.; Ding, Z. Y.; Liu, Y.; Lucia, L. Sens. Actuators, B:Chem. 2016, 227, 296. doi: 10.1016/j.snb.2015.11.125
-
[20]
Vikneswaran, R.; Syafiq, M. S.; Eltayeb, N. E.; Kamaruddin, M. N.; Ramesh, S.; Yahya, R. Spectrochim. Acta, Part A 2015, 150, 175. doi: 10.1016/j.saa.2015.05.087
-
[21]
Ganjali, M. R.; Hosseini, M.; Motalebi, M.; Sedaghat, M.; Mizani, F.; Faridbod, F.; Norouzi, P. Spectrochim. Acta, Part A 2015, 140, 283. doi: 10.1016/j.saa.2014.12.042
-
[22]
Zhang, C. H.; Gao, B. Z.; Zhang, Q. Y.; Zhang, G. M.; Shuang, S. M.; Dong, C. Talanta 2016, 154, 278. doi: 10.1016/j.talanta.2016.03.067
-
[23]
You, G. R.; Lee, J. J.; Choi, Y. W.; Lee, S. Y.; Kim, C. Tetrahedron 2016, 72, 875. doi: 10.1016/j.tet.2015.12.064
-
[24]
Zhu, W. J.; Yang, L. L.; Fang, M.; Wu, Z. Y.; Zhang, Q.; Yin, F. F.; Huang, Q.; Li, C. J. Lumin. 2015, 158, 38. doi: 10.1016/j.jlumin.2014.09.020
-
[25]
Jagadeeswari, S.; Paramaguru, G.; Thennarasu, S.; Renganathan, R. J. Mol. Struct. 2014, 1060, 191. doi: 10.1016/j.molstruc.2013.12.017
-
[26]
Jagadeeswari, S.; Paramaguru, G.; Thennarasu, S.; Renganathan, R. J. Mol. Struct. 2014, 1060, 191. doi: 10.1016/j.molstruc.2013.12.017
-
[27]
Ramkumar, S.; Manoharan, S.; Anandan, S. Dyes Pigm. 2012, 94, 503. doi: 10.1016/j.dyepig.2012.02.016
-
[28]
Budreckiene, R.; Buika, G.; Grazulevicius, J. V.; Jankauskas, V.; Staniskiene, B. J. Photochem. Photobiol., A 2006, 181, 257. doi: 10.1016/j.jphotochem.2005.12.006
-
[1]
-
图 7 其它金属离子(1.0×10-5mol/L)和Cu2+ (1.0×10-5mol/ L)共存时探针L2 (1×10-5mol/L)在DMSO-H2O (V:V=6:4) Tris-HCl缓冲液(pH=7.0)中的荧光响应(λex=340 nm)
Figure 7 Fluorescence response of probe L2 (1.0×10-5 mol/L) upon addition of various metal ions (1.0×10-5 mol/L) in and without the presence of Cu2+(1.0×10-5 mol/L) in DMSO-H2O (V:V=6:4) buffered by Tris-HCl (pH=7.0) (λex=340 nm)
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 2807
- HTML全文浏览量: 941



 下载:
下载:












 下载:
下载:

