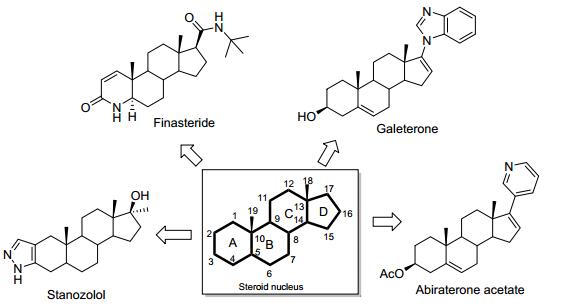
 图 1
近年来上市的部分氮杂甾体类药物
Figure 1.
Marketed steroidal heterocycles in recent years
图 1
近年来上市的部分氮杂甾体类药物
Figure 1.
Marketed steroidal heterocycles in recent years

Citation: Yu Bin, Cai Zuyun, Wang Shuai, Liu Hongmin. Recent Advances on the Synthesis and Antitumor Evaluation of Exonuclear Heterosteroids[J]. Chinese Journal of Organic Chemistry, 2017, 37(8): 1952-1963. doi: 10.6023/cjoc201704004

核外氮杂甾体的合成及其抗肿瘤活性研究进展
English
Recent Advances on the Synthesis and Antitumor Evaluation of Exonuclear Heterosteroids
-
Key words:
- steroidal heterocycles
- / synthetic methods
- / antitumor activity
-
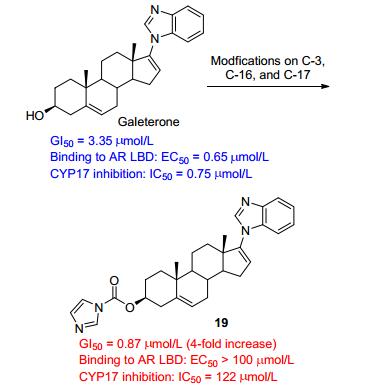
甾体类化合物是一类广泛存在于自然界的环戊烷并多氢菲类化合物, 其结构特征在于具有多环骨架结构、在C10和/或C13位上同上连接有C19和/或C18角甲基, 且具有多个手性中心.此外, 其他基团比如3-OH、C3和/或C17上羰基以及骨架上双键位置及立体构型的改变等可进一步丰富甾体类化合物的种类, 并赋予其不同或改善的生理和药理学活性.除维持正常的生理机能方面, 甾体类化合物作为一类重要的药物分子, 在新药研发领域具有举足轻重的地位, 基于甾体的新药研发一直以来是新药研发的热门领域[1].近年来取得了长足进展, 超过300余种甾体类化合物被应用于临床上相关疾病的治疗, 如4-氮杂甾体类化合物非那雄胺(Finasteride)作为一类竞争性的5α还原酶抑制剂, 用于治疗前列腺增生和男性脱发症(图 1); 甾体A环吡唑稠合的司坦唑醇(Stanozolol)具有明显改善的17α-甲基睾酮的分泌功能和蛋白同化作用, 现临床作为蛋白同化类药物[2]; 阿比特龙作为17a-羟化酶/C17, 20-裂解酶抑制剂, 目前应用于晚期前列腺癌的治疗[3].日本Tokai制药公司开发的Galeterone (TOK-001) 是用于前列腺癌治疗的药物侯选物, 目前处在临床Ⅲ期实验(NCT02438007), 其通过作用于雄激素受体(AR)信号通路中的多个靶点发挥其抗前列腺癌作用[4, 5].
近年来, 有机合成方法学的发展使基于甾体的化学修饰取得了较大的进展, 通过化学修饰手段构建具有结构新颖性和多样性的氮杂甾体类化合物库是甾体新药研发领域的热点[6].根据氮原子在甾体结构中所处位置的不同, 氮杂甾体又可分为两大类: (1) 核氮杂甾体, 即在甾体核C-1至C-17位的碳原子被氮原子取代后的甾体化合物, 已有综述对该类氮杂甾体进行了总结[7], 本文不再赘述. (2) 核外氮杂甾体, 即在甾体骨架结构上通过稠合或连接的方式引入含氮杂环, 进而构建核外氮杂甾体衍生物, 杂环环系的引入不仅增加了甾体结构的多样性和新颖性, 并且可使修饰后的甾体杂环类化合物表现出改善的或者新的药理学活性.本文通过总结近年来发表的代表性文献, 重点阐述核外氮杂甾体的合成方法及其抗肿瘤活性进展, 期望为进一步的氮杂甾体类抗肿瘤化合物的设计提供理论基础.
2 氮杂甾体类化合物的合成及其抗肿瘤活性
2.1 甾体螺吲哚酮类化合物
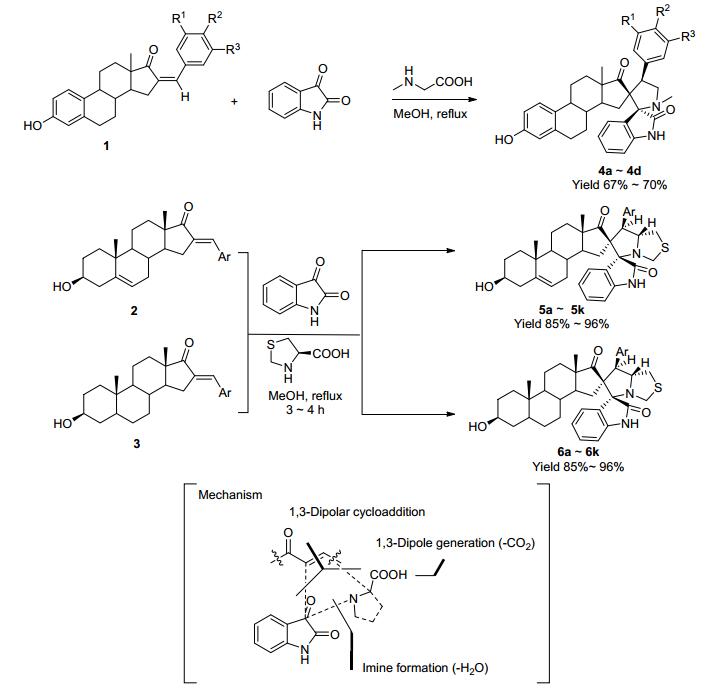
螺吲哚酮类化合物亦广泛存在于自然界中, 多种吲哚生物碱类天然产物如Spirotryprostatins[8]、Coerules-cine[9]等中发现具有螺吲哚酮骨架结构.螺吲哚酮类化合物因其新颖的3D骨架结构和广泛的生物学活性如抗HIV[10]、抗肿瘤[11, 12]、抗结核[13]、抗疟疾[14]等得到了广泛关注.在抗肿瘤药物设计方面[12, 15], 螺吲哚酮类化合物RO8994 [16]和SAR405838 [17]作为MDM2抑制剂, 其分别处在临床前和Ⅰ期临床试验中, 用于肿瘤的治疗; CFI-400945作为首个PLK4抑制剂, 在临床Ⅰ期试验中用于治疗晚期癌症[18]. 2008年, Raghunathan课题组[19]首次报道靛红、肌氨酸和甾体类化合物(亲偶极体)通过1, 3-偶极环加成反应一锅法构建结构新颖的甾体螺吲哚酮类化合物4a~4d(产率67%~70%, Scheme 1); 2014年, Kumar课题组[20]以16位芳基亚甲基取代的去氢表雄酮和表雄酮为起始原料, 在甲醇回流条件下, 分别与靛红及噻唑-4-羧酸发生1, 3-偶极环加成反应, 以85%~96%的收率得到如Scheme 1所示的单一异构体5a~5k和6a~6k, 该反应具有较高的非对应选择性及区域选择性, 通过一步反应构建2个C—C键、1个C—N键、4个连续的手性中心和1个吡咯啉环系.
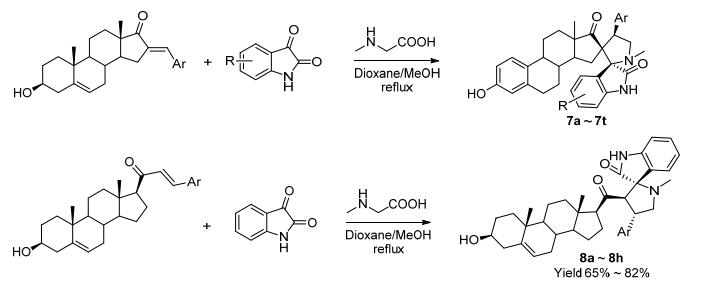
但Raghunathan及Kumar课题组均未报道其生物学活性, 同期我们课题组[21]亦报道以16位芳基亚甲基取代的去氢表雄酮、肌氨酸和靛红为起始原料, 通过1, 3-偶极环加成反应以较高收率合成了化合物7a~7t, 该反应具有高度的立体选择性、区域选择性和化学选择性(Scheme 2).抗肿瘤活性评价发现该系列化合物对多种肿瘤细胞系表现出良好的抗恶性增殖活性, 并优于5-氟尿嘧啶, 且能诱导胃癌细胞MGC-803早期凋亡和浓度依赖性的阻滞细胞生长在G2/M期.此外, 我们课题组[22]亦以21-芳基亚甲基妊娠烯醇酮、靛红及肌氨酸为原料以65%~82%的收率合成了化合物8a~8h, 该反应具有较高的非对应选择性和区域选择性, 同时构建了2个C—C键、1个C—N键、3个连续的手性中心和1个吡咯啉环系(Scheme 2).抗肿瘤活性评价发现该系列对EC109、MGC-803、SMMC-7721及MCF-7具有良好的增殖抑制活性并能诱导MCF-7细胞凋亡和阻滞细胞生长在G2/M期.计算机分子模拟发现该系列化合物与p53-MDM2抑制剂Nutlin-2占据相同的活性位点, 并与Lys94和Thr101残基形成氢键相互作用, 表明该系列化合物可能具有MDM2抑制活性.
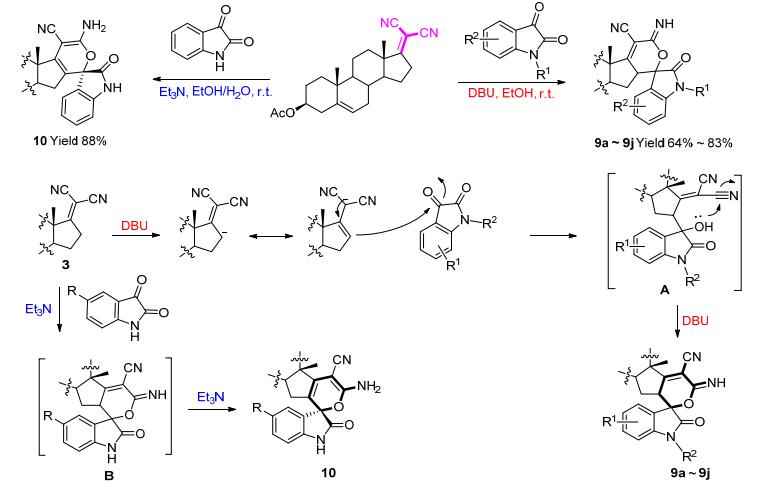
Schemes 1与2所示的是以甾体不饱和酮为基本结构构建甾体螺吲哚酮类化合物, 为增加化合物结构多样性和复杂性, 我们课题组[23]亦以甾体烯基丙二腈和靛红衍生物为原料, 通过一锅串联反应以较高产率得到了结构新颖的甾体螺吲哚酮类化合物9a~9j和10 (Scheme 3), 其结构特征在于在甾体D环上同时引入吲哚酮和吡喃杂环骨架结构, 且形成了一个C—C键、一个C—O碱、一个季碳手性中心, 并在甾体D环上构建一个螺环环系.有趣的是, 产物结构取决于所用有机碱的空间位阻, 在1, 8-二氮杂二环十一碳-7-烯(DBU)和三乙胺存在的情况下, 分别得到终产物9a~9j和10, 可能是由于DBU位阻较大且化合物9a~9j的结构较为拥挤, DBU不能促进其发生进一步的异构化.化合物10对体内体外模型中均表现出较好的增殖抑制作用且毒性较低.机制研究表明, 化合物10通过ROS介导的多种机制诱导MGC-803细胞凋亡.
2.2 甾体三唑类化合物
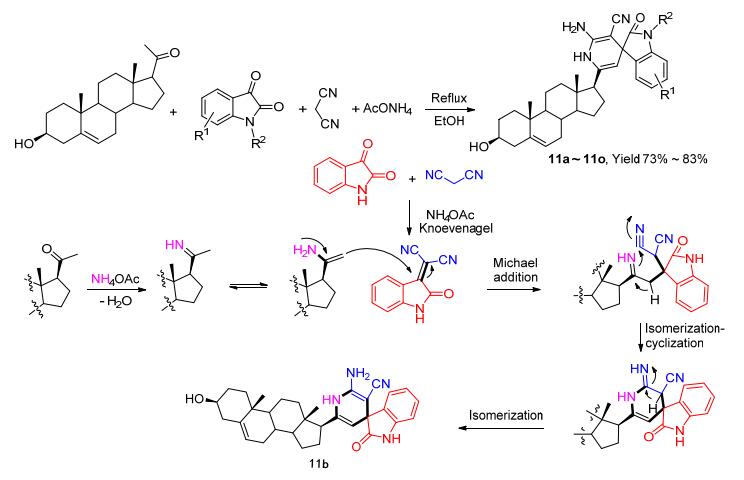
此外, 我们亦发展了一类如Scheme 4所示的一锅四组分反应, 以较好的产率得到结构新颖的化合物11a~11o, 其中NH4OAc作为氮源且催化反应的进行[24].通过一锅反应构建两个C—C键、两个C—N键和一个全碳季碳手性中心.该系列化合物对EC-109细胞表现出良好的抑制作用, 其中化合物11o (R1=H, R2=3, 4-二氯苄基)对EC-109细胞的IC50值达到0.3 μmol/L, 活性明显优于5-FU (IC50=10.6 μmol/L).
在医药化学和生物化学中.三唑化合物对酸碱水解稳定, 在氧化和还原条件下也稳定, 水溶性以及能对抗代谢降解[25].合成三唑甾体化合物最优先的方法是采用铜催化的叠氮-炔烃环合加成反应(Copper Catalyzed Azide-Alkyne Cycloaddition, CuAAC).这是一个典型的Click反应之一. Click化学是一个概念性名字.最初由Sharpless等[26]创建, 启发于自然界中的最基本单元, 在温和的条件下产生各种天然的大分子化合物, 所以Click反应必须具有反应产率高、条件温和、产物稳定及反应的区域选择性专一等优点.
在甾体新药研发领域, 将甾体母核与其他活性骨架通过三氮唑基团连接成新的杂合体亦成为开发新型甾体药物的手段, 通过此方法已开发出较多的具有良好生物学的甾体杂合体[27]. Oyelere课题组[28]采用分子杂合原理将17a-乙炔基雌二醇(ER激动剂)和去乙酰化酶(HDAC)抑制剂活性片段乙酰羟胺通过三氮唑基团连接, 设计了能够靶向于雌激素受体(ER)高表达的乳腺癌的杂合体EED-HDACi (表 1), 其中12a能选择性的显著抑制HDAC1和HDAC6 (IC50值分别为15和8 nmol/L)并能有效激活雌激素受体, 对MCF-7和MDA-MB-231显示出中等的抑制活性(IC50值分别为22.0和28.4 µmol/L).通过改变连接链的链长, 该课题组发现12b和12d具有最明显的ERa激动活性; 12a~12d能够有效抑制HDAC1和HDAC6, 其中12a和12d的活性强于临床上使用HDACi抑制剂SAHA.

Compound ERa agonism
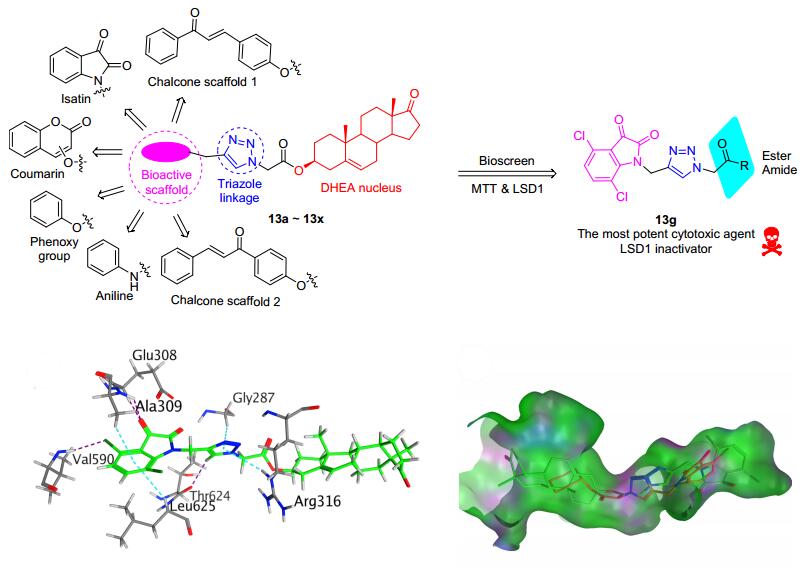
(Fold activation)IC50/(nmol·L-1) HDAC1 HDAC6 HDAC8 12a (n=2) 1.55 15 8 11000 12b (n=3) 6.84 400 140 5000 12c (n=4) 2.00 75 32 400 12d (n=5) 4.72 28 13 450 12e (n=6) 1.19 9000 1300 20000 去氢表雄酮(DHEA)是由肾上腺皮质分泌的内源性甾体类化合物, 已有文献报道其可通过多种机制, 如作用于PI3K/Akt信号通路、抑制胸苷酸合成酶等在体内体外模型中均能抑制肿瘤细胞的生长[29].基于DHEA所表现出来的抗肿瘤潜能, 我们课题组[30]将DHEA甾体母核和其他活性骨架如靛红、查尔酮、香豆素等通过三唑基团连接, 进而构建目标杂合体13a~13x(图 2).通过构效关系研究发现, 当末端活性骨架结构为靛红及其类似物时, 其能够选择性的抑制LSD1高表达的SH-SY5Y肿瘤细胞系(IC50<20 μmol/L), LSD1的抑制作用与抑制SH-SY5Y生长呈现相关性, 其中化合物13g表现出最好的LSD1抑制活性(IC50=4.06 μmol/L).除抑制LSD1外, 其能够以浓度依赖性的方式阻滞肿瘤细胞生长在G2/M期并明显诱导肿瘤细胞凋亡, 尤其是晚期凋亡, 同时伴随着线粒体膜电位的降低.分子对接结果显示, 化合物13g的甾体骨架能够更好占据LSD1活性位点处的管状疏水空腔, 缺失该结构导致LSD1抑制活性丧失(PDB code: 2H94)[31].我们首次报道基于甾体的LSD1抑制剂, 其作为先导化合物可用于开发新型甾体类LSD1抑制剂.
2.3 D环修饰的核外氮杂甾体类化合物
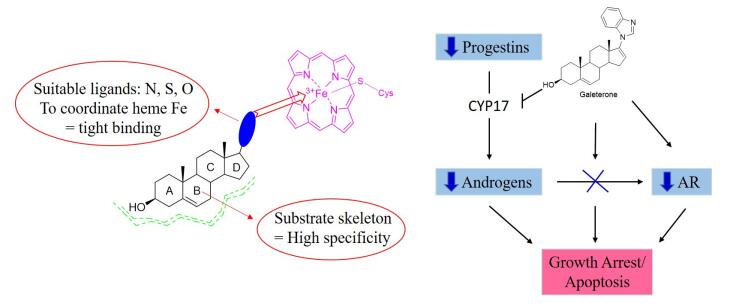
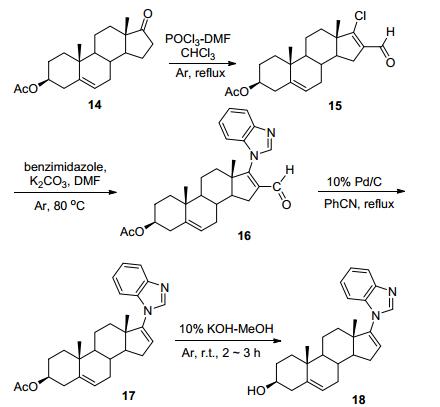
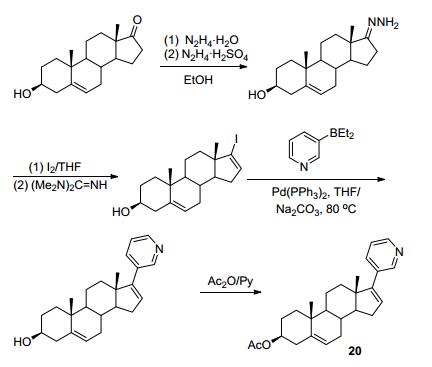
基于CYP17的天然底物黄体酮和妊娠烯醇酮[32], Njar等[5]通过在甾体C17, 20侧链、D环及其他可能与酶活性位点结合进行修饰发现了用于前列腺癌治疗的Galeterone (18), 其目前处在临床Ⅲ期实验中. Galete-rone与CYP17酶可能的结合模型如图 3所示, D环上的苯并咪唑杂环N原子能够与血红色Fe紧密结合, 从而产生高度专一性的抑制剂. Galeterone能够有效的抑制CYP17 (IC50=300 nmol/L), 其抑制活性强于阿比特龙(IC50=800 nmol/L)[5]. Galeterone通过多种机制发挥其抗前列腺癌的作用: (1) 通过抑制CYP17阻断所有组织中的雄性激素的产生; (2) 阻断雄性激素与受体的结合; (3) 诱导雄激素受体降解. Galeterone的合成如Scheme 5所示, 以去氢表雄酮醋酸酯为起始原料, 经过四步反应生成目标化合物Galeterone (18)[33], 鉴于其合成路线较为简单, 在此不再赘述.
在Galeterone的基础之上, Njar课题组通过在C-3、C-16和C-17位置进行进一步的结构修饰, 通过构效关系研究发现, C-17位的苯并咪唑基团是活性必须基团; C-3位上连接亲水的杂芳基基团能够提高化合物的抗增殖活性和雄激素受体AR的降解活性.在所修饰得到的化合物中, 化合物19 (图 4)具有最好的抗LNCaP增殖活性, 其GI50值为0.87 µmol/L, 是Galeterone活性的4倍, 且对AR的降解活性是Galeterone的8倍, 但对CYP17的抑制作用明显降低[4].
阿比特龙乙酰酯(Abiraterone acetate)是CPY-17抑制剂, 该药已于2011年4月被美国FDA批准用于治疗转移性顽固型前列腺癌, 而Hydroxyflutamide和Bicalutamide对顽固型前列腺癌无效.阿比特龙乙酰酯的合成路线如Scheme 6所示[34].此外, 阿比特龙类似物的合成及其抗肿瘤活性亦有相关文献报道[35].
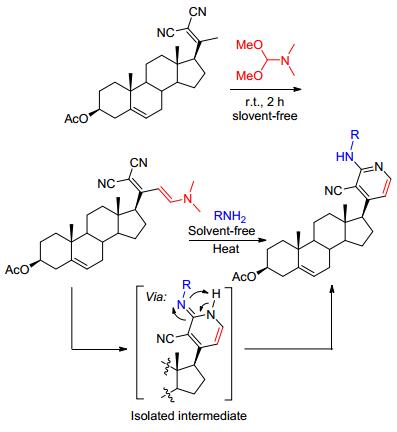
在去氢表雄酮(DHEA) 17-位引入含氮杂环可明显改善其抗肿瘤活性, 我们课题组[36]以去氢表雄酮与丙二氰缩合产物为起始原料, 发展了一类无溶剂法合成D环2-氨基吡啶取代的甾体衍生物21, 其合成路线如Scheme 7所示, 通过分离并表征反应中间体, 确定了反应机理.化合物21除用于活性筛选外, 其结构基团可允许其发生进一步的转化, 利于构建甾体化合物库.
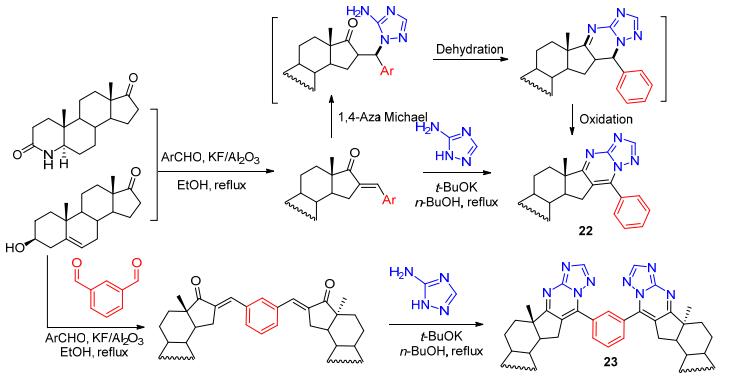
此外, 我们[37]通过KF/Al2O3催化的克莱森-施密特缩合反应构建不饱和酮结构单元, 在强碱性条件下与3-氨基三氮唑(3-AT)发生串联反应得到甾体D环三氮唑并嘧啶稠合的化合物22 (Scheme 8), 抗肿瘤活性评价发现该系列中的大部分化合物对PC-3、MCF-7及EC9706表现出相对较差的抑制活性, 只有极个别化合物显示出较好的抑制作用.甾体二聚体作为一类结构较为特殊的甾体类化合物, 其二聚骨架结构已被发现存在于多种天然产物和生物活性分子中, 同单一甾体类化合物相比, 甾体二聚体往往表现了优越的生物学活性[38, 39].我们[40]通过DHEA和苯二苯甲醛在KF/Al2O3催化下的缩合反应, 得到含有不饱和酮结构单元的甾体二聚体, 其与3-AT发生串联反应生成结构新颖的甾体二聚体23.抗肿瘤活性评价发现该化合物对多种不同来源的细胞系具有显著的抑制作用, 活性明显优于对照药物5-氟脲嘧啶, 对正常肝细胞系L-O2则毒性较低, 显示出较高的选择性(约50倍).初步的机制研究表明, 该化合物能够浓度和时间依赖性的阻滞EC109细胞生长在G2/M期并诱导EC109细胞凋亡.最近, Meza-Reyes课题组[41]采用相同合成方法, 在DHEA、表雄酮和雌素酮结构基础之上报道合成了一系列结构类似物, 其中部分D环三唑并嘧啶稠合的化合物对多种肿瘤细胞系如Hela、A2780等具有较好的抑制活性(IC50<10 μmol/L), 与顺铂活性相当, 而双甾体类化合物的活性尚未报道.
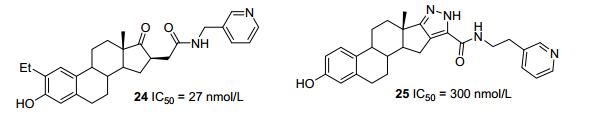
基于人17β-羟基甾体脱氢酶1(17β-HSD1) 的晶体结构, Potter等[42]设计了基于甾体的17β-HSD1抑制剂24 (图 5), 其能选择性抑制17β-HSD1 (IC50=27 nmol/L), 对17β-HSD2抑制作用较弱.对接结果显示, A环酚羟基可与His221和Glu282残基形成分叉状氢键相互作用, 这一作用解释了A环上有酚OH基团的化合物对17β-HSD1有较高的抑制作用; C-17羰基基团可与17β-HSD1活性位点催化区域的氨基酸残基形成氢键; A环上的乙基可与Leu262和Phe259形成疏水相互作用; 甾体骨架结构与Leu149, Val225, Phe226, Phe259形成疏水相互作用.这些疏水作用已在抑制剂与蛋白共结晶结构中观察到[43].该课题组[44]设计了另一化合物25, 其亦选择性抑制17β-HSD1 (IC50=300 nmol/L).
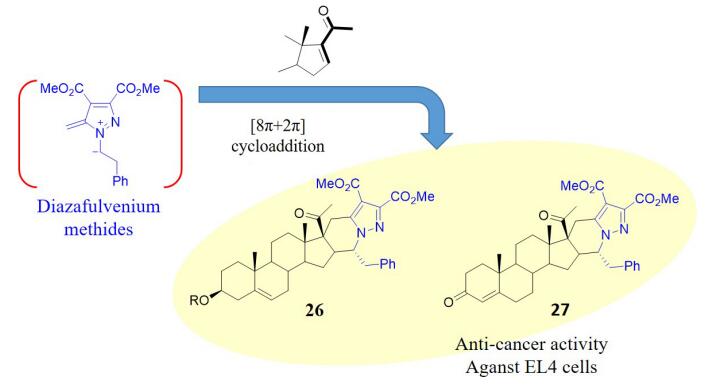
最近, Pinho e Melo课题组[45]通过活性中间体diazafulvenium methides与具有不饱和酮结构单元的甾体类化合物之间的[8π+2π]环加成反应构建了甾体新颖的D环四氢吡啶并吡唑稠合的甾体衍生物26和27(图 6), 活性评价发现其对小鼠T淋巴瘤EL4具有较好的抑制活性.
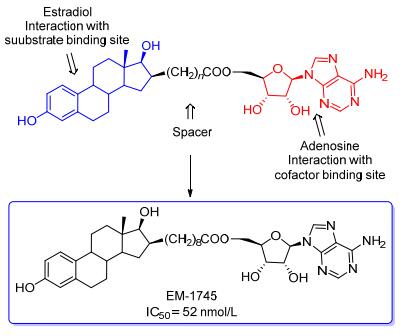
雌二醇(E2)能够刺激雌激素敏感的肿瘤的生长, 而17β-HSD参与E2的生物合成, 因此, 可通过抑制17β-HSD来控制E2的合成. Poirier课题组[46]采用分子杂合手段将雌二醇和腺苷通过亚甲基链连接设计新的杂合体(图 7).腺苷基团与辅因子结合位点结合, 雌二醇骨架与底物结合位点结合.设计的杂合体能够有效抑制的E1还原活性(E1到E2, IC50值介于52~1000 nmol/L), 两部分发挥协同作用, 只含有其中一个骨架的化合物不能抑制酶的活性.由8个亚甲基相连, 16位为β构型的化合物EM-1745对17β-HSD有最佳抑制活性(IC50=52 nmol/L).
2.4 天然氮杂甾体类化合物
除人工合成的氮杂甾体类化合物外, 氮杂甾体类骨架结构也广泛存在于天然产物中, 如Solasodine、Solanidine和Cyclopamine[47].甾体二聚体是一类结构特殊的甾体类化合物, 该类骨架结构广泛存在于多种天然产物中, 其中最具有代表性的是Cephalostatins[48]和Ritterazines[49](图 8), 其结构特征在于吡嗪环系连接两个不对称的甾体骨架结构. Cephalostatin 1能够有效抑制鼠p388细胞系增殖(ED50=0.1~0.001 pmol/L)[38], 且能够抑制抗凋亡蛋白Bcl-2的磷酸化[50]和选择性地促进Smac/DIABLO的释放和诱导癌细胞凋亡[51]; Ritterazine A对p388细胞系亦表现出了良好的增殖抑制活性(IC50=3.8×10-3 µg/mL)[52].鉴于Cephalostatins和Ritterazines较好的肿瘤抑制活性、结构新颖性和复杂性, 其合成方法及其类似物的活性评价亦有较多的文献报道, 在此不再赘述.
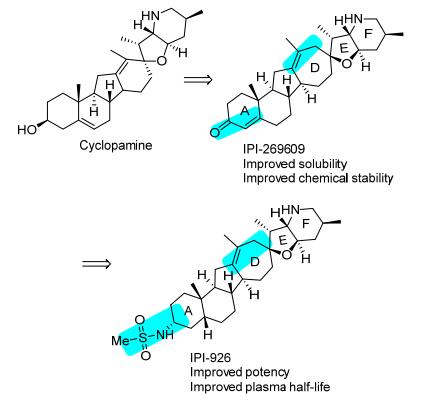
Tremblay课题组[53]通过对天然产物Cyclopamine的A环和D环的修饰发现了能够作用于刺猬信号通路的Cyclopamine类似物IPI-269609, 其与天然产物Cyclopamine对刺猬通路具有相似的抑制作用(EC50=0.20 µmol/L vs. 0.17 µmol/L), 但IPI-269609有明显改善的溶解性和化学稳定性(图 9).构效关系研究发现, F环上的NH是活性必须基团, 其决定了与靶点的结合能力, NH乙酰化产物(EC50=0.12 µmol/L)与IPI-269609的活性相当; NH上大位阻基团取代使生物活性降低; 小鼠口服给药以后, IPI-269609显示了良好的药物代谢动力学参数(F%=80%, t1/2=3.2 h, Vd=18 L/kg), 但其具有相对较差的代谢稳定性.该课题组通过对IPI-269609 A环的继续修饰, 发现了化合物IPI-926.同IPI-269609和Cyclopamine相比, IPI-926具有明显改善的药物代谢动力学参数和效能(EC50=0.007 µmol/L, t1/2=85 min). IPI-926具有较低的清除率和较高的组织分布, 且对跨膜蛋白Smoothened有明显的抑制作用(IC50=5 nmol/L), 目前已进入临床Ⅰ期实验用于肿瘤的治疗[54].
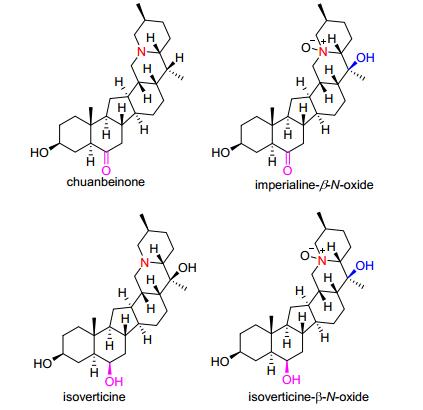
四川大学华西药学院王东东课题组[55]从伊贝母球茎中分离得到四种结构新颖的异甾体生物碱chuanbeinone, imperialine-β-N-oxide, isoverticine和isover-ticine-β-N-oxide(图 10), 其对多种肿瘤细胞系表现出中等的抗肿瘤活性, 其中chuanbeinone表现出广谱的肿瘤增殖抑制作用, 对Lewis肺癌细胞抑制作用最强(IC50=10.51 μg/mL).进一步的机制研究发现其阻滞Lewis肺癌细胞生长在S期, 降低抗凋亡蛋白Bcl-2的表达, 活性预凋亡蛋白Bax和Caspase-3.
3 结论及展望
同提取分离和微生物转化相比, 在甾体骨架结构上通过近代发展的有机合成法学引入杂环骨架结构可很大程度上丰富甾体类化合物的种类, 增加其结构新颖性、复杂性和多样性, 进而便于构建新型甾体化合物库.在甾体类化合物的构建中, 核外氮杂甾体的合成及其活性评价是甾体新药研发领域的热点, 目前已报道的甾体药物中较多含有氮杂环系结构, 如抗肿瘤药物阿比特龙和Galeterone等.在甾体骨架结构的A和D环通过化学修饰手段引入新的氮杂环系, 尤其是螺环骨架(如螺吲哚酮), 将是甾体化学领域的研究热点问题之一.通过适当的连接基团如三氮唑偶合两个或两个以上具有不同性质的分子实体形成兼备原各组成特性的新结合体亦是构建氮杂甾体的有效途径, 得到的新实体或具有新的或改善的生物学活性, 这个思路为寻找甾体新药开拓了新的研究思路.此外, 鉴于天然氮杂甾体类化合物的结构新颖性和较好的肿瘤生长抑制活性, 合成其结构类似物将利于寻找新型活性甾体衍生物.
-
-
[1]
(a) Zhang, Y.-L.; Li, Y.-F.; Shi, Y.-K.; Yu, B.; Zhang, G.-C.; Qi, P.-P.; Fu, D.-J.; Shan, L.-H.; Liu, H.-M. Steroids 2015, 104, 1.
(b) Zhang, B.-L.; Zhang, E.; Pang, L.-P.; Song, L.-X.; Li, Y.-F.; Yu, B.; Liu, H.-M. Steroids 2013, 78, 1200.
(c) Yu, B.; Sun, X.-N.; Shi, X.-J.; Qi, P.-P.; Fang, Y.; Zhang, E.; Yu, D.-Q.; Liu, H.-M. Steroids 2013, 78, 1134.
(d) Yu, B.; Shi, X.-J.; Ren, J.-l.; Sun, X.-N.; Qi, P.-P.; Fang, Y.; Ye, X.-W.; Wang, M.-M.; Wang, J.-W.; Zhang, E.; Yu, D.-Q.; Liu, H.-M. Eur. J. Med. Chem. 2013, 66, 171.
(e) Yu, B.; Zhang, E.; Sun, X.-N.; Ren, J.-L.; Fang, Y.; Zhang, B.-L.; Yu, D.-Q.; Liu, H.-M. Steroids 2013, 78, 494. -
[2]
Clinton, R. O.; Manson, A. J.; Stonner, F. W.; Neumann, H. C.; Christiansen, R. G.; Clarke, R. L.; Ackerman, J. H.; Page, D. F.; Dean, J. W.; Dickinson, W. B.; Carabateas, C. J. Am. Chem. Soc. 1961, 83, 1478. doi: 10.1021/ja01467a047
-
[3]
Ryan, C. J.; Smith, M. R.; de Bono, J. S.; Molina, A.; Logothetis, C. J.; de Souza, P.; Fizazi, K.; Mainwaring, P.; Piulats, J. M.; Ng, S.; Carles, J.; Mulders, P. F. A.; Basch, E.; Small, E. J.; Saad, F.; Schrijvers, D.; Van Poppel, H.; Mukherjee, S. D.; Suttmann, H.; Gerritsen, W. R.; Flaig, T. W.; George, D. J.; Yu, E. Y.; Efstathiou, E.; Pantuck, A.; Winquist, E.; Higano, C. S.; Taplin, M.-E.; Park, Y.; Kheoh, T.; Griffin, T.; Scher, H. I.; Rathkopf, D. E. New Engl. J. Med. 2013, 368, 138. doi: 10.1056/NEJMoa1209096
-
[4]
Purushottamachar, P.; Godbole, A. M.; Gediya, L. K.; Martin, M. S.; Vasaitis, T. S.; Kwegyir-Afful, A. K.; Ramalingam, S.; Ates-Alagoz, Z.; Njar, V. C. O. J. Med. Chem. 2013, 56, 4880. doi: 10.1021/jm400048v
-
[5]
Njar, V. C. O.; Brodie, A. M. H. J. Med. Chem. 2015, 58, 2077. doi: 10.1021/jm501239f
-
[6]
(a) Hanson, J. R. Nat. Prod. Rep. 2010, 27, 887.
(b) Frank, É.; Schneider, G. J. Steroid Biochem. Mol. Biol. 2013, 137, 301.
(c) Gupta, A.; Sathish Kumar, B.; Negi, A. S. J. Steroid Biochem. Mol. Biol. 2013, 137, 242. -
[7]
Ibrahim-Ouali, M.; Rocheblave, L. Steroids 2008, 73, 375.
Singh, R.; Panda, G. Tetrahedron 2013, 69, 2853. -
[8]
Cui, C.-B.; Kakeya, H.; Osada, H. Tetrahedron 1996, 52, 12651. doi: 10.1016/0040-4020(96)00737-5
-
[9]
Görmen, M.; Le Goff, R.; Lawson, A. M.; Daïch, A.; Comesse, S. Tetrahedron Lett. 2013, 54, 2174. doi: 10.1016/j.tetlet.2013.02.047
-
[10]
Kumari, G.; Nutan; Modi, M.; Gupta, S. K.; Singh, R. K. Eur. J. Med. Chem. 2011, 46, 1181. doi: 10.1016/j.ejmech.2011.01.037
-
[11]
(a) Lo, M. M. C.; Neumann, C. S.; Nagayama, S.; Perlstein, E. O.; Schreiber, S. L. J. Am. Chem. Soc. 2004, 126, 16077.
(b) Yu, B.; Yu, Z.; Qi, P.-P.; Yu, D.-Q.; Liu, H.-M. Eur. J. Med. Chem. 2015, 95, 35.
(c) Ding, K.; Lu, Y.; Nikolovska-Coleska, Z.; Qiu, S.; Ding, Y.; Gao, W.; Stuckey, J.; Krajewski, K.; Roller, P. P.; Tomita, Y.; Parrish, D. A.; Deschamps, J. R.; Wang, S. J. Am. Chem. Soc. 2005, 127, 10130. -
[12]
Yu, B.; Yu, D.-Q.; Liu, H.-M. Eur. J. Med. Chem. 2015, 97, 673. doi: 10.1016/j.ejmech.2014.06.056
-
[13]
Vintonyak, V. V.; Warburg, K.; Kruse, H.; Grimme, S.; Hübel, K.; Rauh, D.; Waldmann, H. Angew. Chem., Int. Ed. 2010, 49, 5902. doi: 10.1002/anie.201002138
-
[14]
Rottmann, M.; McNamara, C.; Yeung, B. K. S.; Lee, M. C. S.; Zou, B.; Russell, B.; Seitz, P.; Plouffe, D. M.; Dharia, N. V.; Tan, J.; Cohen, S. B.; Spencer, K. R.; González-Páez, G. E.; Lakshminarayana, S. B.; Goh, A.; Suwanarusk, R.; Jegla, T.; Schmitt, E. K.; Beck, H.-P.; Brun, R.; Nosten, F.; Renia, L.; Dartois, V.; Keller, T. H.; Fidock, D. A.; Winzeler, E. A.; Diagana, T. T. Science 2010, 329, 1175. doi: 10.1126/science.1193225
-
[15]
Yu, B.; Zheng, Y. C.; Shi, X. J.; Qi, Q. P.; Liu, H. M. Anti-Cancer Agent Med. Chem. 2016, 16, 1315. doi: 10.2174/1871520615666151102093825
-
[16]
(a) Zhang, Z.; Ding, Q.; Liu, J.-J.; Zhang, J.; Jiang, N.; Chu, X.-J.; Bartkovitz, D.; Luk, K.-C.; Janson, C.; Tovar, C.; Filipovic, Z. M.; Higgins, B.; Glenn, K.; Packman, K.; Vassilev, L. T.; Graves, B. Bioorg. Med. Chem. 2014, 22, 4001.
(b) Zhang, Z.; Chu, X.-J.; Liu, J.-J.; Ding, Q.; Zhang, J.; Bartkovitz, D.; Jiang, N.; Karnachi, P.; So, S.-S.; Tovar, C.; Filipovic, Z. M.; Higgins, B.; Glenn, K.; Packman, K.; Vassilev, L.; Graves, B. ACS Med. Chem. Lett. 2013, 5, 124. -
[17]
Wang, S.; Sun, W.; Zhao, Y.; McEachern, D.; Meaux, I.; Barrière, C.; Stuckey, J. A.; Meagher, J. L.; Bai, L.; Liu, L.; Hoffman-Luca, C. G.; Lu, J.; Shangary, S.; Yu, S.; Bernard, D.; Aguilar, A.; Dos-Santos, O.; Besret, L.; Guerif, S.; Pannier, P.; Gorge-Bernat, D.; Debussche, L. Cancer Res. 2014, 74, 5855. doi: 10.1158/0008-5472.CAN-14-0799
-
[18]
(a) Sampson, P. B.; Liu, Y.; Forrest, B.; Cumming, G.; Li, S.-W.; Patel, N. K.; Edwards, L.; Laufer, R.; Feher, M.; Ban, F.; Awrey, D. E.; Mao, G.; Plotnikova, O.; Hodgson, R.; Beletskaya, I.; Mason, J. M.; Luo, X.; Nadeem, V.; Wei, X.; Kiarash, R.; Madeira, B.; Huang, P.; Mak, T. W.; Pan, G.; Pauls, H. W. J. Med. Chem. 2015, 58, 147.
(b) Mason, Jacqueline M.; Lin, Dan C.-C.; Wei, X.; Che, Y.; Yao, Y.; Kiarash, R.; Cescon, David W.; Fletcher, Graham C.; Awrey, Donald E.; Bray, Mark R.; Pan, G.; Mak, Tak W. Cancer Cell 2014, 26, 163. -
[19]
Babu, A. R. S.; Raghunathan, R. Tetrahedron Lett. 2008, 49, 4618. doi: 10.1016/j.tetlet.2008.05.089
-
[20]
Kanchithalaivan, S.; Rani, M. A.; Kumar, R. R. Synth. Comm. 2014, 44, 3122. doi: 10.1080/00397911.2014.928729
-
[21]
Yu, B.; Shi, X.-J.; Qi, P.-P.; Yu, D.-Q.; Liu, H.-M. J. Steroid Biochem. Mol. Biol. 2014, 141, 121. doi: 10.1016/j.jsbmb.2014.01.015
-
[22]
Yu, B.; Sun, X.-N.; Shi, X.-J.; Qi, P.-P.; Zheng, Y.-C.; Yu, D.-Q.; Liu, H.-M. Steroids 2015, 102, 92. doi: 10.1016/j.steroids.2015.08.003
-
[23]
(a) Yu, B.; Qi, P.-P.; Shi, X.-J.; Shan, L.-H.; Yu, D.-Q.; Liu, H.-M. Steroids 2014, 88, 44.
(b) Shi, X.-J.; Yu, B.; Wang, J.-W.; Qi, P.-P.; Tang, K.; Huang, X.; Liu, H.-M. Sci. Rep. 2016, 6, 31607. -
[24]
Zhang, Y.-L.; Li, Y.-F.; Wang, J.-W.; Yu, B.; Shi, Y.-K.; Liu, H.-M. Steroids 2016, 109, 22. doi: 10.1016/j.steroids.2016.03.005
-
[25]
Pérez-Labrada, K.; Brouard, I.; Morera, C.; Estévez, F.; Bermejo, J.; Rivera, D. G. Tetrahedron 2011, 67, 7713. doi: 10.1016/j.tet.2011.08.003
-
[26]
Kolb, H. C.; Finn, M. G.; Sharpless, K. B. Angew. Chem., Int. Ed. 2001, 40, 2004. doi: 10.1002/(ISSN)1521-3773
-
[27]
(a) Devraj, R.; Barrett, J. F.; Fernandez, J. A.; Katzenellenbogen, J. A.; Cushman, M. J. Med. Chem. 1996, 39, 3367.
(b) Agouridas, V.; Magnier, E.; Blazejewski, J.-C.; Laïos, I.; Cleeren, A.; Nonclercq, D.; Laurent, G.; Leclercq, G. J. Med. Chem. 2009, 52, 883.
(c) Levine, P. M.; Garabedian, M. J.; Kirshenbaum, K. J. Med. Chem. 2014, 57, 8224.
(d) Anelli, P. L.; Lattuada, L.; Lorusso, V.; Lux, G.; Morisetti, A.; Morosini, P.; Serleti, M.; Uggeri, F. J. Med. Chem. 2004, 47, 3629.
(e) Li, M.-J.; Greenblatt, H. M.; Dym, O.; Albeck, S.; Pais, A.; Gunanathan, C.; Milstein, D.; Degani, H.; Sussman, J. L. J. Med. Chem. 2011, 54, 3575. -
[28]
Gryder, B. E.; Rood, M. K.; Johnson, K. A.; Patil, V.; Raftery, E. D.; Yao, L.-P. D.; Rice, M.; Azizi, B.; Doyle, D. F.; Oyelere, A. K. J. Med. Chem. 2013, 56, 5782. doi: 10.1021/jm400467w
-
[29]
(a) Jiang, Y.; Miyazaki, T.; Honda, A.; Hirayama, T.; Yoshida, S.; Tanaka, N.; Matsuzaki, Y. J. Gastroenterol. 2005, 40, 490.
(b) Nakayama, Y.; Sakamoto, H.; Satoh, K.; Yamamoto, T. Cancer Lett. 2000, 161, 63.
(c) Schwartz, A. G.; Pashko, L.; Whitcomb, J. M. Toxicol. Pathol.1986, 14, 357.
(d) Schwartz, A. G.; Pashko, L. L. J. Cell. Biochem. 1993, 53, 73. -
[30]
(a) Yu, B.; Qi, P.-P.; Shi, X.-J.; Huang, R.; Guo, H.; Zheng, Y.-C.; Yu, D.-Q.; Liu, H.-M. Eur. J. Med. Chem. 2016, 117, 241.
(b) Yu, B.; Wang, S.-Q.; Qi, P.-P.; Yang, D.-X.; Tang, K.; Liu, H.-M. Eur. J. Med. Chem. 2016, 124, 350. -
[31]
Chen, Y.; Yang, Y.; Wang, F.; Wan, K.; Yamane, K.; Zhang, Y.; Lei, M. Proc. Natl. Acad. Sci. U. S. A. 2006, 103, 13956. doi: 10.1073/pnas.0606381103
-
[32]
(a) Handratta, V. D.; Vasaitis, T. S.; Njar, V. C. O.; Gediya, L. K.; Kataria, R.; Chopra, P.; Newman, D.; Farquhar, R.; Guo, Z.; Qiu, Y.; Brodie, A. M. H. J. Med. Chem. 2005, 48, 2972.
(b) Ang, J. E.; Olmos, D.; de Bono, J. S. Br. J. Cancer 2009, 100, 671. -
[33]
Bruno, R. D.; Vasaitis, T. S.; Gediya, L. K.; Purushottamachar, P.; Godbole, A. M.; Ates-Alagoz, Z.; Brodie, A. M. H.; Njar, V. C. O. Steroids 2011, 76, 1268. doi: 10.1016/j.steroids.2011.06.002
-
[34]
(a) Potter, G. A.; Hardcastle, I. R.; Jarman, M. Org. Prep. Proced. Int. 1997, 29, 123.
(b) Balaev, A. N.; Gromyko, A. V.; Fedorov, V. E. Pharm. Chem. J. 2016, 50, 404. -
[35]
Guarna, A.; Occhiato, E. G.; Machetti, F.; Giacomelli, V. J. Org. Chem. 1999, 64, 4985. doi: 10.1021/jo990373m
-
[36]
Zhang, Y.-L.; Li, Y.-F.; Shi, X.-L.; Yu, B.; Shi, Y.-K.; Liu, H.-M. Steroids 2016, 115, 147. doi: 10.1016/j.steroids.2016.09.005
-
[37]
(a) Huang, L.-H.; Zheng, Y.-F.; Song, C.-J.; Wang, Y.-G.; Xie, Z.-Y.; Lai, Y.-W.; Lu, Y.-Z.; Liu, H.-M. Steroids 2012, 77, 367.
(b) Huang, L.-H.; Zheng, Y.-F.; Lu, Y.-Z.; Song, C.-J.; Wang, Y.-G.; Yu, B.; Liu, H.-M. Steroids 2012, 77, 710. -
[38]
Moser, B. R. J. Nat. Prod. 2008, 71, 487. doi: 10.1021/np070536z
-
[39]
(a) Li, Y.; Dias, J. R. Chem. Rev. 1997, 97, 283.
(b) Nahar, L.; Sarker, S. D.; Turner, A. B. Curr. Med. Chem. 2007, 14, 1349. -
[40]
Yu, B.; Shi, X.-J.; Zheng, Y.-F.; Fang, Y.; Zhang, E.; Yu, D.-Q.; Liu, H.-M. Eur. J. Med. Chem. 2013, 69, 323. doi: 10.1016/j.ejmech.2013.08.029
-
[41]
Arenas-González, A.; Mendez-Delgado, L. A.; Merino-Montiel, P.; Padrón, J. M.; Montiel-Smith, S.; Vega-Báez, J. L.; Meza-Reyes, S. Steroids 2016, 116, 13. doi: 10.1016/j.steroids.2016.09.014
-
[42]
Lawrence, H. R.; Vicker, N.; Allan, G. M.; Smith, A.; Mahon, M. F.; Tutill, H. J.; Purohit, A.; Reed, M. J.; Potter, B. V. L. J. Med. Chem. 2005, 48, 2759. doi: 10.1021/jm049045r
-
[43]
Azzi, A.; Rehse, P. H.; Zhu, D.-W.; Campbell, R. L.; Labrie, F.; Lin, S.-X. Nat. Struct. Mol. Biol. 1996, 3, 665. doi: 10.1038/nsb0896-665
-
[44]
Fischer, D. S.; Allan, G. M.; Bubert, C.; Vicker, N.; Smith, A.; Tutill, H. J.; Purohit, A.; Wood, L.; Packham, G.; Mahon, M. F.; Reed, M. J.; Potter, B. V. L. J. Med. Chem. 2005, 48, 5749. doi: 10.1021/jm050348a
-
[45]
Lopes, S. M. M.; Sousa, E. P.; Barreira, L.; Marques, C.; Rodrigues, M. J.; Pinhoe Melo, T. M. V. D. Steroids 2017, 122, 16. doi: 10.1016/j.steroids.2017.03.006
-
[46]
Poirier, D.; Boivin, R. P.; Tremblay, M. R.; Bérubé, M.; Qiu, W.; Lin, S.-X. J. Med. Chem. 2005, 48, 8134. doi: 10.1021/jm058235e
-
[47]
Lee, S. T.; Welch, K. D.; Panter, K. E.; Gardner, D. R.; Garrossian, M.; Chang, C.-W. T. J. Agr. Food Chem. 2014, 62, 7355. doi: 10.1021/jf5005622
-
[48]
Pettit, G. R.; Xu, J.-P.; Chapuis, J.-C.; Melody, N. J. Nat. Prod. 2015, 78, 1446. doi: 10.1021/acs.jnatprod.5b00129
-
[49]
(a) Fukuzawa, S.; Matsunaga, S.; Fusetani, N. J. Org. Chem. 1995, 60, 608.
(b) Fukuzawa, S.; Matsunaga, S.; Fusetani, N. J. Org. Chem. 1997, 62, 4484.
(c) Phillips, S. T.; Shair, M. D. J. Am. Chem. Soc. 2007, 129, 6589. -
[50]
Müller, I. M.; Dirsch, V. M.; Rudy, A.; López-Antón, N.; Pettit, G. R.; Vollmar, A. M. Mol. Pharmacol. 2005, 67, 1684. doi: 10.1124/mol.104.004234
-
[51]
Dirsch, V. M.; Müller, I. M.; Eichhorst, S. T.; Pettit, G. R.; Kamano, Y.; Inoue, M.; Xu, J.-P.; Ichihara, Y.; Wanner, G.; Vollmar, A. M. Cancer Res. 2003, 63, 8869. http://europepmc.org/abstract/MED/14695204
-
[52]
Fukuzawa, S.; Matsunaga, S.; Fusetani, N. J. Org. Chem. 1994, 59, 6164. doi: 10.1021/jo00100a014
-
[53]
Tremblay, M. R.; Nevalainen, M.; Nair, S. J.; Porter, J. R.; Castro, A. C.; Behnke, M. L.; Yu, L.-C.; Hagel, M.; White, K.; Faia, K.; Grenier, L.; Campbell, M. J.; Cushing, J.; Woodward, C. N.; Hoyt, J.; Foley, M. A.; Read, M. A.; Sydor, J. R.; Tong, J. K.; Palombella, V. J.; McGovern, K.; Adams, J. J. Med. Chem. 2008, 51, 6646. doi: 10.1021/jm8008508
-
[54]
Tremblay, M. R.; Lescarbeau, A.; Grogan, M. J.; Tan, E.; Lin, G.; Austad, B. C.; Yu, L.-C.; Behnke, M. L.; Nair, S. J.; Hagel, M.; White, K.; Conley, J.; Manna, J. D.; Alvarez-Diez, T. M.; Hoyt, J.; Woodward, C. N.; Sydor, J. R.; Pink, M.; MacDougall, J.; Campbell, M. J.; Cushing, J.; Ferguson, J.; Curtis, M. S.; McGovern, K.; Read, M. A.; Palombella, V. J.; Adams, J.; Castro, A. C. J. Med. Chem. 2009, 52, 4400. doi: 10.1021/jm900305z
-
[55]
Wang, D. D.; Li, Z.; Zhang, L.; Atanasov, A. G.; Wang, S. Planta Med. 2016, 82, 195.
-
[1]
-
表 1 EED-HDACi杂合体设计
Table 1. Design of EED-HDACi hybrids

Compound ERa agonism
(Fold activation)IC50/(nmol·L-1) HDAC1 HDAC6 HDAC8 12a (n=2) 1.55 15 8 11000 12b (n=3) 6.84 400 140 5000 12c (n=4) 2.00 75 32 400 12d (n=5) 4.72 28 13 450 12e (n=6) 1.19 9000 1300 20000 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 10
- 文章访问数: 2557
- HTML全文浏览量: 1312



 下载:
下载:

















 下载:
下载:

