 图式 1
化合物1~4的合成
Scheme1.
Synthesis of compounds 1~4
图式 1
化合物1~4的合成
Scheme1.
Synthesis of compounds 1~4

Citation: Qian Chao, Chuo Luopeng, Zhao Haiying, Bian Zhanxi. Spectroscopic, Electrochemistry and Thermal Properties of Monoand 1, 1'-Disubstituted 1, 2, 3-Triazolylferrocene Derivatives[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2328-2335. doi: 10.6023/cjoc201703049

单取代与1, 1'-双取代1, 2, 3-三唑基二茂铁衍生物的光谱、电化学与热性质
English
Spectroscopic, Electrochemistry and Thermal Properties of Monoand 1, 1'-Disubstituted 1, 2, 3-Triazolylferrocene Derivatives
-
Key words:
- ferrocene
- / triazole
- / spectrum
- / electrochemistry
- / thermal behavior
-
二茂铁由于具有卓越的光学、电化学、磁性及立体结构等特性, 一直受到化学、医药及材料科学的极大关注, 具有各种功能的二茂铁衍生物大量涌现.二茂铁衍生物从结构上主要分为单取代, 1, 1'-、1, 2-和1, 3-双取代[1~3]; 从衍生方法上主要通过二茂铁羰基化合物、二茂铁醚类、二茂铁烃类(脂肪烃与芳香烃)、二茂铁胺以及杂环类等进行衍生化.其中, 五元杂环化合物1, 2, 3-三唑由于具有芳香性, 较高的极性及化学稳定性, 近年来广泛用于构筑二茂铁二元及多元功能分子.其有效的合成方法是基于Sharpless及其合作者[4]于2001年发现的一价铜催化的有机叠氮与端炔的“Click”反应, 该反应的特点是可以方便高效地构筑模块化的功能分子, 这些含有二茂铁三唑环的功能分子被成功地用于主客体化学[5]、催化[6]、生物药物研究[7, 8]、阴阳离子检测[9~12]、液晶材料等[13~16]方面的研究, 充分体现了二茂铁衍生物优良的电化学与稳定性等性质.但是1, 2, 3-三唑环连接的功能分子普遍存在的弊端是溶解性差.有些功能分子为了增强其光谱吸收范围, 往往在分子中引入多个芳环以扩大共轭体系, 但是这样会使分子的溶解性进一步降低, 同时熔点增高, 限制了其有效应用.一个可行的方法是在这些功能分子中引入长的脂溶性或水溶性柔性链以改善其溶解性, 降低熔点.溶解度提高可以使材料在器件表面更好地成膜, 从而大大提升材料的性能.本文合成了一系列单取代及1, 1'-双取代1, 2, 3-三唑基二茂铁衍生物, 合成路线见Scheme 1.通过紫外-可见吸收光谱(UV-Vis)、荧光光谱与循环伏安法(CV)研究该类化合物的光谱和电化学性质, 通过热失重(TG)、示差扫描量热分析(DSC)、变温X射线粉末衍射(XRD)以及热台偏光显微镜(POM)对化合物的热性质进行研究.
1 结果与讨论
1.1 紫外-可见吸收和荧光光谱
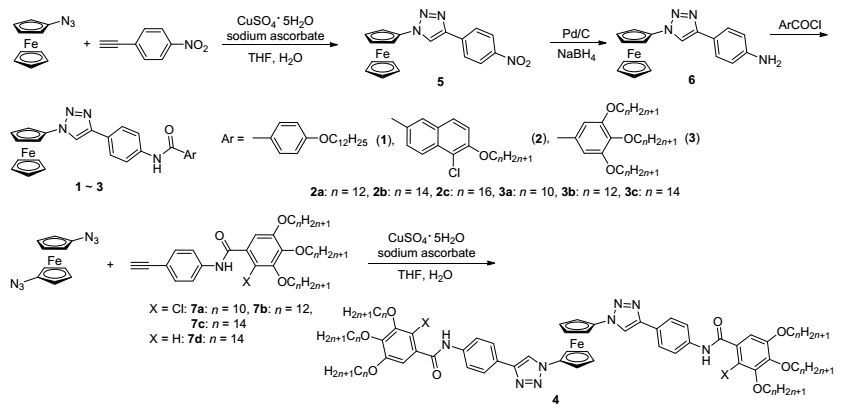
代表化合物1~4的UV-vis光谱和荧光光谱见图 1.从图 1可以看出, 化合物2c由于含有萘环出现了两个吸收带, 中心位置分别在250和285 nm, 而其它化合物仅在245~500 nm之间出现一个吸收带.这些吸收归属于Fe(d)-π*和芳基的π-π*电子跃迁, 可能与羰基的吸收重叠.单取代3c与1, 1'-双取代4d的最大吸收都出现在295 nm, 但是双取代化合物的吸收具有更大的摩尔吸光系数.此外, 由于化合物3c和4d都含有三个烷氧助色团, 此吸收带相对于化合物1发生了5 nm的红移.相反, 化合物4c中由于引入了电负性较大的氯原子, 紫外吸收发生了9 nm的蓝移.
荧光光谱见图 1插图, 激发波长为253 nm.从图中看出, 这些化合物的荧光光谱均出现在250~450 nm之间, 而化合物1的荧光最强, 量子产率Φf=0.0236.随着烷氧链的增加, 化合物3c和4d的荧光强度减弱, 这是由于烷氧基处于羰基的邻对位时属于给电子基, 而在间位却属于拉电子基.由于存在重原子效应, 含有氯原子的化合物荧光强度进一步减弱(2c: Φf=0.0084, 4c: Φf=0.0062).
1.2 溶解性
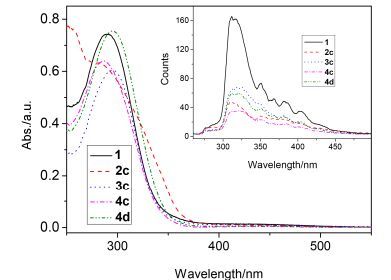
合成的1, 2, 3-三唑基二茂铁衍生物在甲苯、二氯甲烷、氯仿和四氢呋喃中溶解性较好, 在N, N-二甲基甲酰胺和乙酸乙酯中溶解性差, 在二甲亚砜、甲醇、乙腈、和石油醚中几乎不溶.为了估算此类化合物的溶解度[17], 首先测试了化合物3b在不同浓度二氯甲烷稀溶液中的紫外可见吸收光谱, 结果见图 2.取295 nm处的吸光度对浓度作图, 两者呈现非常好的线性关系(R=0.99987).将其进行线性拟合(y=0.03389x-0.0090) 可求出直线的斜率.将其饱和溶液稀释至适当浓度, 测试其紫外可见吸收光谱, 取295 nm处的吸光度, 根据Lambert-Beer定律, 将上述稀溶液拟合得到的斜率代入, 可求得饱和溶液的浓度, 据此估算出3b在二氯甲烷中的溶解度为256.3 mg•mL-1.用同样的测试方法计算出其它化合物在二氯甲烷中的溶解度. 1: 17.2 mg•mL-1, 2c: 24.8 mg•mL-1, 4c: 105.4 mg•mL-1, 4d: 146.5 mg• mL-1.可见, 含有一个长链的单取代1, 2, 3-三唑基二茂铁衍生物在二氯甲烷中溶解度相对较小, 将烷基链增加到三个后, 溶解度大幅度提升, 另外, 1, 1'-双取代4系列化合物的溶解度比单取代3系列的低.
1.3 电化学性质
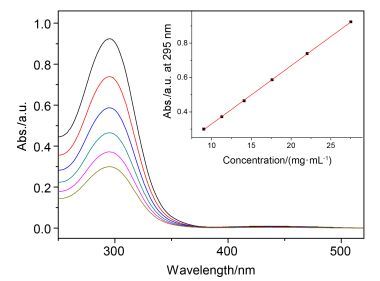
代表化合物的循环伏安(CV)曲线见图 3, 氧化还原电势数据列于表 1.从图 3与表 1可知, 在这些化合物中, 氧化还原活性的二茂铁基均发生了一个电子的转移进程.由于三唑环的拉电子效应, 半波氧化还原电位E1/2相对于二茂铁外标Fc/Fc+向阳极发生了移动, 出现在195~351 mV之间.相对于单取代化合物3c, 1, 1'-双取代的4c和4d的电势发生正向移动(约150 mV), 这是由于两个三唑环的拉电子效应使得二茂铁单元更不容易发生失电子的氧化反应.此外, 含有氯原子4c的电势比不含氯原子4d的低, 当比较化合物2c和1时观察到相同的现象.如表 1所示, 当扫描速率为50 mV•s-1时, ΔE值在82~104 mV左右, 接近二茂铁可逆的氧化还原电势值, 但是ipc/ipa偏离1, 说明这是一个准可逆的氧化还原进程[18].
 表 1
化合物1~4在CH2Cl2溶液中的氧化还原电势(vs Fc/ Fc+)
Table 1.
Electrochemical redox potentials (vs Fc/Fc+) of compounds 1~4 in CH2Cl2
表 1
化合物1~4在CH2Cl2溶液中的氧化还原电势(vs Fc/ Fc+)
Table 1.
Electrochemical redox potentials (vs Fc/Fc+) of compounds 1~4 in CH2Cl2
Compd. Epaa/mV Epcb/mV ΔEc/mV E1/2d/mV ipae/μA ipa/ipcf 1 254 154 100 204 8.16 1.24 2c 239 135 104 187 9.73 1.15 3c 243 148 95 195 5.39 1.25 4c 381 299 82 340 5.90 1.65 4d 393 310 83 351 6.19 2.12 aAnodic peak potential; bCathodic peak potential; cΔE=Epa-Epc; dE1/2=1/2(Epa+Epc); eanodic peak current; fipc, cathodic peak current. 1.4 热性质
为了研究此系列化合物的热稳定性, 在N2气氛下, 通过同步TG-DSC仪测试了代表化合物2c, 3a和4a热失重, 可以看出这些化合物的降解温度在285~305 ℃之间, 说明此类化合物的热稳定性较高.
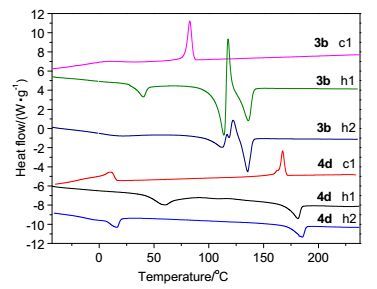
通过DSC和POM实验研究了此系列化合物的热性质.热行为数据列于表 2, 典型的DSC曲线和POM图像见图 4和图 5.在加热的开始阶段, 从DSC曲线观察到化合物1经历了从一种晶体(C1) 到另一种晶体(C2) 的相转变, 继续加热后, 化合物1既没有出现其它相也没有熔解, 而是直接降解, 这在POM图像中也观察到.萘环替换苯环后, 在含有12个碳原子长链化合物2a中出现了相似的现象, 即使把烷基链延长到14或16个碳原子(化合物2b和2c), 也没有观察到熔解现象.我们推测可能含有一个烷氧链的单取代二茂铁衍生物熔点较高, 在转变成各向同性液体之前就降解了.
 表 2
化合物1~4的相转变温度和焓变a
Table 2.
Phase transition temperatures and associated enthalpies of compounds 1~4
表 2
化合物1~4的相转变温度和焓变a
Table 2.
Phase transition temperatures and associated enthalpies of compounds 1~4
Compd. Phase transitiona/℃ [∆H/(kJ•mol-1)] First heating Second heating First cooling 1 C1 161.5 (7.1) C2 180.9 (2.3) — — 2a C1 79.3 (2.4) C2 172.9 (-2.4) C3 202.1 (-3.0) — — 2b C1 74.87 (2.3) C2 165.5 (-2.3) C1 46.1 (4.2) 38.8 (5.0) C1 2c C1 71.4 (2.9) C2 163.3 (-3.5) C1 66.5 (12.7) 60.7 (12.5) C1 3a C1 113.8 (37.9) C2 155.1 (62.5) I C1 114.7 (-13.8) C2 154.8 (60.7) I I 90.7 (-26.5) C 3b C1 40.4 (12.8) C2 113.7 (34.8) C3 117.6 (-18.2)
C4 136.1 (28.4) IC1 112.1 (8.4) C2 116.8 (-14.5) C3
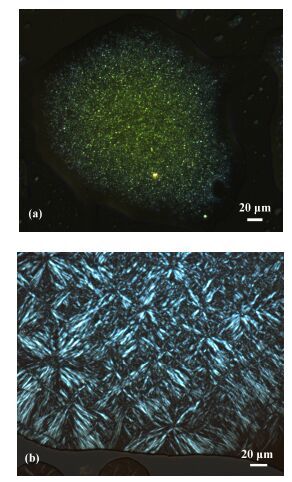
135.5 (19.8) II 82.6 (-21.1) C 3c C1 54.8 (37.8) C2 103.4 (-2.8) C3 136.5 (39.6) I C1 115.4 (12.1) C2 120.3 (22.6) C3 137.3 (29.8) I I 84.7 (-22.2) C1 4a C 171.7 (55.6) I C 171.2 (40.3) I I 148.6 (-33.2) C 4b C 169.9 (43.6) I C 168.4 (36.3) I I 145.9 (-32.4) C1 4c C1 64.4 (50.4) C2 122.5 (7.9) C3 170.4 (68.4) I C1 29.5 (20.3) C2 168.9 (46.2) I I 147.5 (-39.7) C2 18.7 (-23.5) C1 4d C1 60.1 (36.5) C2 181.4 (32.7) I C1 16.4 (26.3) C2 185.5 (29.2) I I 167.4 (-29.6) C2 9.7 (-33.2) C1 aC: crystal, I: isotropic. 为了获得低熔点的化合物, 我们制备了含有三个烷氧链的化合物3a~3c.在加热过程中, 化合物3a发生晶体(C1) 到晶体(C2) 的相转变, DSC曲线中在155 ℃出现了一个较大焓值(62.5 kJ•mol-1)的吸热峰, 此温度对应于化合物的熔点.在POM实验中也观察到化合物3a发生了从晶体到各向同性液体的相转变.在冷却过程中, 化合物3a只在90 ℃出现了一个凝固的放热峰.将烷基链延长到12和14个碳的长链时, 化合物3b和3c的熔点降低到136 ℃左右.此外, 在加热过程中除了发生多晶相转变外, 3b和3c分别在117和103 ℃附近出现凝固的放热峰, 表明有晶体析出, 这种现象在POM中也得到证实. 图 5a是化合物3b在二次加热至126℃析出晶体的图像, 说明化合物3b在进一步加热过程中, 随着分子流动性的增加, 分子重新进行了有序的堆积形成新的晶体[19].
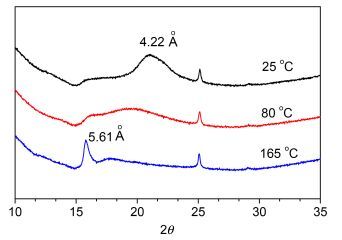
化合物4a~4d的DSC数据见表 2.与4d相比, 含有氯原子的化合物4a~4c熔点较低, 可能由于在分子刚性部分的侧面引入取代基降低了分子的对称性, 致使分子4a~4c相对于4d而言不能更加有序地排列, 因此熔点降低. 4a和4b在加热和冷却过程中只观察到单一的熔解和凝固过程, 在加热过程中, 170 ℃附近出现的吸热峰归因于化合物的熔解, 此温度对应的是化合物的熔点, 延长烷基链后熔点变化不大.对于化合物4c和4d, 在加热和冷却过程中, 观察到晶体C1到晶体C2以及晶体C2到各向同性液体的相转变.化合物4d在一次冷却过程中, 由于出现了新的晶相, 在POM观察到了双折射现象(图 5b), 这种现象在XRD实验中进一步被证实.如图 6所示, 在加热过程中, 化合物4d在2θ=21.02°附近的宽峰渐渐减弱, 同时, 在2θ=15.79°出现了一个新的峰(见图 6中165 ℃的曲线), 晶面间距d-spacing值为5.61 Å, 对应于分子侧向距离[20].
2 结论
合成并表征了一系列单取代及1, 1'-双取代1, 2, 3-三唑基二茂铁衍生物.这些化合物具有较好的吸收与荧光性质.从循环伏安实验中观察到, 此系列化合物展示准可逆的氧化还原进程.与单取代1, 2, 3-三唑基二茂铁衍生物相比, 双取代化合物难于发生失电子的氧化反应.这些化合物具有较高的热稳定性, 在某些常用溶剂中溶解性较好.含有单烷基链的化合物在加热过程中未熔解, 而是直接发生了降解反应; 含有多烷基链的化合物, 在加热和冷却过程中有的发生了单晶相的熔解和凝固过程, 有的发生了多晶相到液相的转变.这些研究为设计合成具有特定功能的1, 2, 3-三唑基二茂铁衍生物提供一定的理论依据.
3 实验部分
3.1 仪器与材料
单取代与1, 1'-双取代叠氮基二茂铁[21]以及芳基酰氯[15]参照文献方法合成.所用试剂均为市售分析纯试剂, 溶剂的干燥按常规方法进行.
Bruker-ALPHA傅里叶变换红外光谱仪, KBr压片; Avance 500 Bruker (500 MHz)核磁共振仪, 以TMS为内标; 岛津UV2600 UV-vis光谱仪; IonSpec 7.0T FTICR/MS高分辨质谱仪; 日立F-4600荧光光谱仪, 荧光量子产率以萘作为参比(Φf=0.205, 乙醇溶液)[22], 通过比较的方法计算得到; AUTOLAB PGSTAT302电化学分析仪, 在298 K下, 样品溶于干燥的CH2Cl2溶液, 加入0.1 mol•L-1四丁基六氟磷酸氨(TBAPF6)作为支持电解质, 用三电极方法, 玻碳电极为工作电极, Pt为对电极, Ag/AgCl为参比电极, Fc/Fc+作为外标, 扫描速率100 mV/s; NETZSCH STA 409 PC/PG同步TG-DSC仪, N2气氛; TA Q2000 DSC仪, N2气氛, 加热速度10 ℃• min-1; D8 discover变温XRD仪. Leica DM4500P偏光显微镜, LTS420热台.
3.2 实验方法
3.2.1 化合物5的合成
二茂铁基叠氮(0.5 g, 2.2 mmol)与四硝基苯乙炔(0.32 g, 2.2 mmol)溶解在33 mL THF中, 室温分别滴加溶于14 mL水的CuSO4•5H2O (0.55 g, 2.2 mmol)溶液和9 mL水的抗坏血酸钠(0.88 g, 4.4 mmol)溶液.反应混合物室温搅拌12 h, 加入10 mL NH3•H2O, 搅拌, 用CH2Cl2萃取.有机相用盐水洗, 水洗, 无水MgSO4干燥.减压蒸出溶剂, 硅胶柱层析, CH2Cl2洗脱.收集第二带, CH2Cl2/石油醚重结晶得到0.7 g化合物5, 产率85%. m.p. 210~212 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.33 (d, J=9.0 Hz, 2H, ArH), 8.11 (s, 1H, triazole-H), 8.07 (d, J=9.0 Hz, 2H, ArH), 4.91 (s, 2H, Fc-H), 4.34 (s, 2H, Fc-H), 4.26 (s, 5H, FcH); 13C NMR (125 MHz, CDCl3) δ: 147.38, 145.49, 136.60, 126.19, 124.39, 120.42, 93.37, 70.33, 67.02, 62.23.
3.2.2 化合物7的合成
4-乙炔基苯胺(0.1 g, 0.85 mmol)、4-二甲基氨基吡啶(0.01 g, 0.082 mmol)与0.5 mL Et3N溶解在10 mL干燥的CH2Cl2中, 搅拌下0 ℃加入溶有3, 4, 5-三烷氧基苯甲酰氯(0.85 mmol)和0.5 mL Et3N的10 mL干燥的CH2Cl2溶液.反应混合物室温搅拌12 h. TLC监测反应进程.反应完毕, 水洗, 无水MgSO4干燥.减压蒸出溶剂, 硅胶柱层析, CH2Cl2/石油醚(V:V=1:1) 洗脱.收集第一带, CH2Cl2/石油醚重结晶得到化合物7.
2-氯-3, 4, 5-三(十烷氧基)-N-(4-乙炔苯基)苯甲酰胺(7a):白色固体, 产率42%. m.p. 68~69 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.76 (s, 1H, NH), 7.61 (d, J=8.5 Hz, 2H, ArH), 7.50 (d, J=8.5 Hz, 2H, ArH), 7.02 (s, 2H, ArH), 4.03~4.00 (m, 6H, OCH2), 3.07 (s, 1H, CH), 1.84~1.72 (m, 6H, CH2), 1.48~1.44 (m, 6H, CH2), 1.35~1.25 (m, 60H, CH2), 0.88 (t, J=7.0 Hz, 9H, CH3); HRMS (MALDI+) calcd for C57H96NO4 [M+H]+ 858.7339, found 858.7342.
2-氯-3, 4, 5-三(十二烷氧基)-N-(4-乙炔苯基)苯甲酰胺(7b):白色固体, 产率45%. m.p. 64 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.18 (s, 1H, NH), 7.61 (d, J=8.5 Hz, 2H, ArH), 7.49 (d, J=8.5 Hz, 2H, ArH), 7.16 (s, 1H, ArH), 4.05~3.98 (m, 6H, OCH2), 3.07 (s, 1H, CH), 1.85~1.72 (m, 6H, CH2), 1.52~1.43 (m, 6H, CH2), 1.25~1.35 (m, 36H, CH2), 0.88 (t, J=7.0 Hz, 9H, CH3); HRMS (MALDI+) calcd for C45H71ClNO4[M+H]+ 724.5072, found 724.5080.
2-氯-3, 4, 5-三(十四烷氧基)-N-(4-乙炔苯基)苯甲酰胺(7c):白色固体, 产率40%. m.p. 65~66 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.20 (s, 1H, NH), 7.62 (d, J=8.5 Hz, 2H, ArH), 7.50 (d, J=8.5 Hz, 2H, ArH), 7.15 (s, 1H, ArH), 4.05~3.97 (m, 6H, OCH2), 3.06 (s, 1H, CH), 1.83~1.74 (m, 6H, CH2), 1.50~1.42 (m, 6H, CH2), 1.35~1.26 (m, 48H, CH2), 0.89 (t, J=7.0 Hz, 9H, CH3); HRMS (MALDI+) calcd for C51H83ClNO4[M+H]+ 808.6011, found 808.6007.
3, 4, 5-三(十四烷氧基)-N-(4-乙炔苯基)苯甲酰胺(7d):白色固体, 产率50%. m.p. 67~68 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.14 (s, 1H, NH), 7.61 (d, J=8.5 Hz, 2H, ArH), 7.48 (d, J=8.5 Hz, 2H, ArH), 7.17 (s, 1H, ArH), 4.06~3.99 (m, 6H, OCH2), 3.06 (s, 1H, CH), 1.84~1.74 (m, 6H, CH2), 1.55~1.43 (m, 6H, CH2), 1.35~1.26 (m, 60H, CH2), 0.89 (t, J=7.0 Hz, 9H, CH3). HRMS (MALDI+) calcd for C57H93ClNO4 [M+H]+ 892.6950, found 892.6946.
3.2.3 化合物1~3的合成
化合物5溶解在CH2Cl2/甲醇(30 mL, V:V=1:1) 中, 加入5% Pd/C (100 mg), 然后分三次加入NaBH4 (60 mg, 1.5 mmol).反应混合物室温搅拌30 min.过滤, 用CH2Cl2洗滤饼, 有机相用无水MgSO4干燥.减压蒸出溶剂, 得到黄色的0.085 g粗产物6, 未进行纯化, 直接进入下一步反应.
粗产物6 (约0.085 g)溶于10 mL干燥的CH2Cl2中, 0 ℃滴加芳基酰氯(0.3 mmol)的10 mL CH2Cl2溶液, 室温搅拌12 h, 反应完毕, 减压蒸出溶剂, 硅胶柱层析, CH2Cl2/EtOAc (V:V=10:1) 洗脱, 收集第二带, CH2Cl2/石油醚重结晶得到化合物1~3.
4-(十二烷氧基)-N-[4-(1-二茂铁基-1H-1, 2, 3-三唑-4-基)苯基]苯甲酰胺(1):产率43%. UV-vis (CH2Cl2) λmax [lgε/(L•mol-1•cm-1)]: 290 (4.47) nm. 1H NMR (CDCl3, 500 MHz) δ: 7.96 (s, 1H, NH), 7.89 (d, J=8.5 Hz, 2H, PhH), 7.86 (d, J=8.5 Hz, 2H, PhH), 7.82 (s, 1H, triazole-H), 7.75 (d, J=8.5 Hz, 2H, PhH), 6.98 (d, J=8.5 Hz, 2H, PhH), 4.90 (s, 2H, FcH), 4.30 (s, 2H, FcH), 4.25 (s, 5H, FcH), 4.03 (t, J=6.5 Hz, 2H, OCH2), 1.84~1.79 (m, 2H, CH2), 1.50~1.44 (m, 2H, CH2), 1.38~1.27 (m, 16H, CH2), 0.89 (t, 3H, J=6.5 Hz, CH3); 13C NMR (CDCl3, 125 MHz) δ: 164.18, 152.05, 145.05, 138.31, 128.88, 126.50, 121.88, 120.93, 120.26, 115.56, 114.54, 100.18, 96.26, 70.87, 70.23, 68.32, 66.73, 62.11, 31.77, 29.57, 26.20, 22.70, 13.88; IR (KBr) ν: 3104, 2922, 2852, 1651, 1608, 1526, 1256, 1110, 1038, 840, 508 cm-1; HRMS(MALDI+) calcd for C37H45FeN4O2 [M+H]+ 633.2892, found 633.2886.
5-氯-6-(十二烷氧基)-N-[4-(1-二茂铁基-1H-1, 2, 3-三唑-4-基)苯基]-2-萘甲酰胺(2a):产率48%. 1H NMR (CDCl3, 500 MHz) δ: 8.36 (s, 1H, NH), 8.28 (d, J=8.5 Hz, 1H, naphthalene-H), 8.17 (s, 1H, naphthalene-H), 7.99 (d, J=8.0 Hz, 1H, naphthalene-H), 7.98 (s, 1H, triazole-H), 7.90 (d, J=8.5 Hz, 2H, PhH), 7.84 (d, J=8.5 Hz, 1H, naphthalene-H), 7.80 (d, J=8.5 Hz, 2H, PhH), 7.34 (d, J=8.5 Hz, 1H, naphthalene-H), 4.90 (s, 2H, FcH), 4.30 (s, 2H, FcH), 4.25 (s, 5H, FcH), 4.20 (t, J=6.5 Hz, 2H, OCH2), 1.92~1.87 (m, 2H, CH2), 1.56~1.51 (m, 2H, CH2), 1.39~1.27 (m, 16H, CH2), 0.88 (t, J=7.5 Hz, 3H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 162.99, 152.73, 147.97, 141.49, 137.90, 128.49, 126.91, 124.74, 117.11, 115.80, 106.91, 89.84, 70.45, 69.93, 66.95, 62.34, 31.93, 29.49, 25.97, 22.71, 14.15; IR (KBr) ν: 3107, 2923, 2852, 1656, 1594, 1521, 1251, 1060, 1040, 817, 505 cm-1; HRMS (MALDI+) calcd for C41H46ClFeN4O2 [M+H]+ 717.2659, found 717.2658.
5-氯-6-(十四烷氧基)-N-[4-(1-二茂铁基-1H-1, 2, 3-三唑-4-基)苯基]-2-萘甲酰胺(2b):产率44%. 1H NMR (CDCl3, 500 MHz) δ: 8.36 (s, 1H, NH), 8.28 (d, J=8.5 Hz, 1H, naphthalene-H), 8.16 (s, 1H, naphthalene-H), 7.99 (d, J=9.0 Hz, 1H, naphthalene-H), 7.98 (s, 1H, triazole-H), 7.90 (d, J=8.0 Hz, 2H, PhH), 7.83 (d, J=9.0 Hz, 1H, naphthalene-H), 7.80 (d, J=8.0 Hz, 2H, PhH), 7.34 (d, J=8.5 Hz, 1H, naphthalene-H), 4.90 (s, 2H, FcH), 4.30 (s, 2H, FcH), 4.25 (s, 5H, FcH), 4.20 (t, J=7.0 Hz, 2H, OCH2), 1.92~1.87 (m, 2H, CH2), 1.57~1.51 (m, 2H, CH2), 1.39~1.26 (m, 20H, CH2), 0.88 (t, J=7.5 Hz, 3H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 165.27, 153.84, 147.38, 137.84, 133.53, 129.84, 128.94, 127.06, 126.61, 124.46, 120.62, 119.04, 117.53, 116.00, 101.21, 93.80, 73.83, 70.29, 66.77, 62.20, 31.94, 29.70, 29.61, 29.37, 25.97, 22.70, 14.12; IR (KBr) ν: 3111, 2923, 2849, 1655, 1595, 1522, 1251, 1060, 1040, 816, 505 cm-1; HRMS(MALDI+) calcd for C43H50ClFeN4O2 [M+H]+ 745.2972, found 745.2968.
5-氯-6-(十六烷氧基)-N-[4-(1-二茂铁基-1H-1, 2, 3-三唑-4-基)苯基]-2-萘甲酰胺(2c):产率44%; UV-vis (CH2Cl2) λmax [lg ε/(L•mol-1•cm-1)]: 251 (4.48), 283 (4.40) nm; 1H NMR (CDCl3, 500 MHz) δ: 8.37 (s, 1H, NH), 8.29 (d, J=9.0 Hz, 1H, naphthalene-H), 8.09 (s, 1H, naphthalene-H), 8.00 (d, J=9.0 Hz, 1H, naphthalene-H), 7.98 (s, 1H, triazole-H), 7.91 (d, J=8.0 Hz, 2H, PhH), 7.86 (d, J=8.5 Hz, 1H, naphthalene-H), 7.81 (d, J=8.5 Hz, 2H, PhH), 7.35 (d, J=9.0 Hz, 1H, naphthalene-H), 4.90 (s, 2H, FcH), 4.30 (s, 2H, FcH), 4.25 (s, 5H, FcH), 4.21 (t, J=6.5 Hz, 2H, OCH2), 1.93~1.87 (m, 2H, CH2), 1.57~1.51 (m, 2H, CH2), 1.39~1.26 (m, 24H, CH2), 0.88 (t, J=6.5 Hz, 3H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 165.45, 156.22, 147.34, 139.89, 133.62, 131.25, 129.13, 128.24, 126.06, 124.46, 117.49, 115.95, 99.92, 93.89, 70.29, 66.77, 62.02, 31.95, 29.70, 25.61, 25.97, 22.71, 14.12; IR (KBr) ν: 3114, 2923, 2852, 1656, 1596, 1523, 1252, 1060, 1039, 816, 505 cm-1; HRMS (MALDI+) calcd for C45H54ClFeN4O2 [M+H]+ 773.3285, found 773.3285.
3, 4, 5-三(十烷氧基)-N-[4-(1-二茂铁基-1H-1, 2, 3-三唑-4-基)苯基]苯甲酰胺(3a):产率47%. m.p. 154~155 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.97 (s, 1H, NH), 7.91~7.88 (m, 2H, PhH), 7.80 (s, 1H, triazole-H), 7.74 (d, J=9.0 Hz, 2H, PhH), 7.07 (s, 2H, PhH), 4.89 (s, 2H, FcH), 4.30 (s, 2H, FcH), 4.25 (s, 5H, FcH), 4.06~4.01 (m, 6H, OCH2), 1.86~1.73 (m, 6H, CH2), 1.52~1.44 (m, 6H, CH2), 1.36~1.28 (m, 36H, CH2), 0.88 (t, J=7.0 Hz, 9H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 165.63, 153.29, 147.23, 141.63, 138.03, 129.76, 126.50, 120.34, 118.70, 105.82, 93.76, 73.59, 70.23, 69.49, 66.74, 62.10, 31.93, 30.34, 29.69, 26.09, 22.70, 14.13; IR (KBr) ν: 3090, 2922, 2853, 1642, 1580, 1526, 1224, 1110, 1042, 846, 512 cm-1; HRMS (MALDI+) calcd for C55H81FeN4O4[M+H]+ 917.5607, found 917.5605.
3, 4, 5-三(十二烷氧基)-N-[4-(1-二茂铁基-1H-1, 2, 3-三唑-4-基)苯基]苯甲酰胺(3b):产率51%. m.p. 135~136 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.97 (s, 1H, NH), 7.88 (d, J=8.0 Hz, 2H, PhH), 7.84 (s, 1H, triazole-H), 7.74 (d, J=8.0 Hz, 2H, PhH), 7.07 (s, 2H, PhH), 4.89 (s, 2H, FcH), 4.29 (s, 2H, FcH), 4.25 (s, 5H, FcH), 4.03~4.01 (m, 6H, OCH2), 1.84~1.74 (m, 6H, CH2), 1.52~1.44 (m, 6H, CH2), 1.36~1.28 (m, 48H, CH2), 0.88 (t, J=7.0 Hz, 9H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 165.63, 153.38, 147.12, 141.73, 138.08, 129.65, 126.27, 120.17, 118.79, 105.75, 93.68, 73.59, 70.24, 69.49, 66.75, 62.10, 31.95, 30.35, 29.60, 26.09, 22.72, 14.13; IR (KBr) ν: 3096, 2923, 2851, 1641, 1581, 1533, 1232, 1119, 1040, 844, 507 cm-1; HRMS (MALDI+) calcd for C61H93FeN4O4[M+H]+ 1001.6546, found 1001.6549.
3, 4, 5-三(十四烷氧基)-N-[4-(1-二茂铁基-1H-1, 2, 3-三唑-4-基)苯基]苯甲酰胺(3c):产率50%. m.p. 135~137 ℃. UV-vis (CH2Cl2) λmax [lg ε/(L•mol-1•cm-1)]: 286 (4.38) nm; 1H NMR (CDCl3, 500 MHz) δ: 7.97 (s, 1H, NH), 7.89 (d, J=8.5 Hz, 2H, PhH), 7.76 (s, 1H, triazole-H), 7.74 (d, J=8.5 Hz, 2H, PhH), 7.07 (s, 2H, PhH), 4.89 (s, 2H, FcH), 4.30 (s, 2H, FcH), 4.25 (s, 5H, FcH), 4.06~4.01 (m, 6H, OCH2), 1.85~1.74 (m, 6H, CH2), 1.51~1.46 (m, 6H, CH2), 1.36~1.26 (m, 60H, CH2), 0.88 (t, J=7.0 Hz, 9H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 165.63, 153.29, 147.23, 141.63, 138.03, 129.76, 126.50, 120.34, 118.70, 105.82, 93.76, 73.59, 70.23, 69.49, 66.74, 62.10, 31.93, 30.34, 29.69, 26.09, 22.70, 14.13; IR (KBr) ν: 3106, 2920, 2851, 1652, 1584, 1523, 1235, 1118, 1039, 819, 503 cm-1; HRMS (MALDI+) calcd for C67H105FeN4O4[M+H]+: 1085.7485, found 1085.7486.
3.2.4 化合物4的合成
1, 1'-叠氮基二茂铁(0.085 g, 0.315 mmol)与化合物7 (0.63 mmol)溶解在5 mL四氢呋喃中, 室温分别滴加2.5 mL CuSO4•5H2O (0.16 g, 0.63 mmol)水溶液与2.5 mL抗坏血酸钠(0.25 g, 1.26 mmol)水溶液.室温反应12 h.加入5 mL NH3•H2O, 用CH2Cl2萃取, 有机相水洗, 盐水洗, 无水MgSO4干燥.减压蒸出溶剂, 硅胶柱层析, CH2Cl2/EtOAc (V:V=5:1) 洗脱.收集第二带, CH2Cl2/石油醚重结晶得到化合物4.
1, 1'-双(4-(N-(2-氯-3, 4, 5-三(十烷氧基)苯甲酰胺基)苯基)-1H-1, 2, 3-三唑-1-基)二茂铁(4a):产率82%. m.p. 170~172 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.32 (s, 2H, NH), 7.63 (s, 2H, triazole-H), 7.58 (d, J=8.5 Hz, 4H, PhH), 7.52 (d, J=8.5 Hz, 4H, PhH), 7.13 (s, 2H, PhH), 5.04 (s, 4H, FcH), 4.41 (s, 4H, FcH), 4.02~3.93 (m, 12H, OCH2), 1.82~1.74 (m, 12H, CH2), 1.52~1.42 (m, 12H, CH2), 1.37~1.26 (m, 72H, CH2), 0.88 (t, J=7.0 Hz, 18H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 163.98, 152.29, 149.85, 147.06, 144.90, 137.53, 129.81, 126.03, 120.77, 116.87, 109.22, 94.75, 74.24, 69.02, 68.23, 63.10, 31.96, 30.45, 29.71, 26.17, 22.71, 14.13; IR (KBr) ν: 3104, 2925, 2854, 1665, 1592, 1518, 1238, 1109, 1038, 841, 516 cm-1; HRMS (MALDI+) calcd for C100H149Cl2FeN8NaO8[M+Na+H]+ 1740.0156, found 1740.0019.
1, 1'-双(4-(N-(2-氯-3, 4, 5-三(十二烷氧基)苯甲酰胺基)苯基)-1H-1, 2, 3-三唑-1-基)二茂铁(4b).产率78%. m.p. 168~170 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.34 (s, 2H, NH), 7.63 (s, 2H, triazole-H), 7.58 (d, J=8.5 Hz, 4H, PhH), 7.53 (d, J=8.5 Hz, 4H, PhH), 7.12 (s, 2H, PhH), 5.04 (s, 4H, FcH), 4.41 (s, 4H, FcH), 4.00~3.93 (m, 12H, OCH2), 1.80~1.72 (m, 12H, CH2), 1.52~1.42 (m, 12H, CH2), 1.37~1.26 (m, 96H, CH2), 0.88 (t, J=7.0 Hz, 18H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 164.10, 152.43, 149.73, 147.40, 144.76, 137.22, 129.85, 126.15, 120.73, 117.60, 109.51, 94.93, 73.90, 73.79, 69.01, 68.01, 63.13, 31.95, 30.44, 29.60, 22.71, 14.13; IR (KBr) ν: 3198, 2923, 2851, 1665, 1593, 1520, 1236, 1111, 1034, 841, 515 cm-1; HRMS (MALDI+) calcd for C112H172Cl2FeN8NaO8[M+Na]+ 1907.1956, found 1907.1948.
1, 1'-双(4-(N-(2-氯-3, 4, 5-三(十四烷氧基)苯甲酰胺基)苯基)-1H-1, 2, 3-三唑-1-基)二茂铁(4c):产率88%. m.p. 169~171 ℃; UV-vis (CH2Cl2) λmax [lg ε/(L•mol-1• cm-1)]: 286 (4.80) nm; 1H NMR (CDCl3, 500 MHz) δ: 8.38 (s, 2H, NH), 7.64 (s, 2H, triazole-H), 7.58 (s, 4H, PhH), 7.53 (s, 4H, PhH), 7.12 (s, 2H, PhH), 5.06 (s, 4H, FcH), 4.41 (s, 4H, FcH), 4.01~3.92 (m, 12H, OCH2), 1.82~1.72 (m, 12H, CH2), 1.48~1.41 (m, 12H, CH2), 1.37~1.26 (m, 120H, CH2), 0.88 (t, J=7.0 Hz, 18H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 164.37, 152.17, 149.77, 147.40, 137.35, 129.77, 126.15, 120.77, 117.71, 109.45, 94.82, 73.18, 69.00, 68.22, 63.07, 31.95, 30.12, 29.28, 26.12, 22.71, 14.13; IR (KBr) ν: 3105, 2921, 2851, 1666, 1592, 1520, 1205, 1110, 1039, 820, 516 cm-1; HRMS (MALDI+) calcd for C124H196Cl2-FeN8NaO8[M+Na]+ 2075.3834, found 2075.3822.
1, 1'-双(4-(N-(3, 4, 5-三(十四烷氧基)苯甲酰胺基)苯基)-1H-1, 2, 3-三唑-1-基)二茂铁(4d):产率90%. m.p. 180~182 ℃; UV-vis (CH2Cl2) λmax [lg ε/(L•mol-1• cm-1)]: 295 (4.88) nm; 1H NMR (CDCl3, 500 MHz) δ: 8.59 (s, 2H, NH), 7.43 (s, 2H, triazole-H), 7.39 (s, 8H, PhH), 7.18 (s, 4H, PhH), 5.10 (s, 4H, PhH), 4.40 (s, 4H, FcH), 3.99~3.90 (m, 6H, OCH2), 1.76~1.72 (m, 6H, CH2), 1.49~1.25 (m, 132H, CH2), 0.87 (t, J=7.0 Hz, 9H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 166.01, 153.16, 147.42, 141.35, 137.47, 129.52, 125.50, 121.61, 116.73, 105.84, 94.65, 73.47, 69.24, 67.93, 62.27, 31.96, 30.45, 29.71, 26.17, 22.71, 14.13; IR (KBr) ν: 3107, 2921, 2851, 1648, 1583, 1522, 1236, 1118, 1041, 822, 515 cm-1; HRMS (MALDI+) calcd for C124H198-FeN8NaO8 [M+ Na]+ 2007.4613, found 2007.4590.
辅助材料(Supporting Information)化合物2c, 3a和4a的TG曲线, 化合物1~4的1H NMR谱图与DSC曲线.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Navale, D. N.; Zote, S. W.; Ramana, M. M. V. J. Appl. Chem. 2015, 4, 1180.
-
[2]
Kadkin, O. N.; Galyametdinov, Y. G. Russ. Chem. Rev. 2012, 81, 675. doi: 10.1070/RC2012v081n08ABEH004270
-
[3]
Lim J. Y. C.; Beer P. D. Eur. J. Inorg. Chem. 2017, 220.
-
[4]
Kolb, H. C.; Finn, M. G.; Sharpless, K. B. Angew. Chem. 2001, 113, 2056. doi: 10.1002/(ISSN)1521-3757
-
[5]
Diallo, A. K.; Menuel, S.; Monflier, E.; Ruiz, J.; Astruc, D. Tetrahedron Lett. 2010, 51, 4617. doi: 10.1016/j.tetlet.2010.06.115
-
[6]
Samanta, S.; Mittra, K.; Sengupta, K.; Chatterjee, S.; Dey, A. Inorg. Chem. 2013, 52, 1443. doi: 10.1021/ic3021782
-
[7]
Singh, A.; Biot, C.; Viljoen, A.; Dupont, C.; Kremer, L.; Kumar, K.; Kumar, V. Chem. Biol. Drug Des. 2016, 1.
-
[8]
张成路, 唐杰, 殷立莹, 袭焕, 国阳, 孙丽杰, 有机化学, 2016, 36, 358. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345260.shtmlZhang, C.; Tang, J.; Yin, L.; Xi, H.; Guo, Y.; Sun, L. Chin. J. Org. Chem. 2016, 36, 358(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345260.shtml
-
[9]
Bhatta, S. R.; Bheemireddy, V.; Vijaykumar, G.; Thakur, A. Sens. Actuators, B 2017, 240, 640. doi: 10.1016/j.snb.2016.09.022
-
[10]
Zapata, F.; Caballero, A.; Molina, P. Eur. J. Inorg. Chem. 2017, 237.
-
[11]
Bhatta, S. R.; Bheemireddy, V.; Thakur, A. Organometallics 2017, 36, 829. doi: 10.1021/acs.organomet.6b00883
-
[12]
王智成, 戴博娜, 丘继芳, 曹迁永, 葛金柱, 有机化学, 2015, 35, 2383. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345169.shtmlWang, Z.; Dai, B.; Qiu, J.; Cao, Q.; Ge, J. Chin. J. Org. Chem. 2015, 35, 2383(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345169.shtml
-
[13]
Cheng, H.; Ma, C.; Chen, Y.; Ni, H.; Feng, C.; Wang, B.; Zhao, K.; Yu, W.; Hu, P. Liq. Cryst. 2017, 44, 1450. doi: 10.1080/02678292.2017.1282047
-
[14]
Zhao, H. Y.; Guo, L.; Chen, S. F.; Bian, Z. X. J. Mol. Struct. 2013, 1054~1055, 164.
-
[15]
Zhao, H. Y.; Liu, X. Y.; Chuo. L. P.; Chen, S. F.; Bian, Z. X. J. Mol. Liq. 2015, 206, 213. doi: 10.1016/j.molliq.2015.02.031
-
[16]
徐建伟, 王绍辉, 李旸, 赵海英, 李保国, 边占喜, 有机化学, 2015, 35, 1526. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344894.shtmlXu, J.; Wang, S.; Li, Y.; Zhao, H.; Li, B.; Bian, Z. Chin. J. Org. Chem. 2015, 35, 1526(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344894.shtml
-
[17]
Zhao, H. Y.; Zhu, Y. Z.; Chen, C.; He, L.; Zheng, J. Y. Carbon 2012, 50, 4894. doi: 10.1016/j.carbon.2012.06.018
-
[18]
Joubert, C. C.; van As, L.; Jakob, A.; Speck, J. M.; Lang, H.; Swarts, J. C. Polyhedron 2013, 55, 80. doi: 10.1016/j.poly.2013.02.059
-
[19]
Kadkin, O. N.; Kim, E. H.; Kim, S. Y.; Choi, M.-G. Polyhedron 2009, 28, 1301. doi: 10.1016/j.poly.2009.01.045
-
[20]
Kadkin, O. N.; Kim, E. H.; Rha, Y. J.; Kim, S. Y.; Tae, J.; Choi, M.-G. Chem. Eur. J. 2009, 15, 10343. doi: 10.1002/chem.v15:40
-
[21]
Otón, F.; González, M. D. C.; Espinosa, A.; Tárraga, A.; Molina, P. Organometallics 2012, 31, 2085. doi: 10.1021/om300093c
-
[22]
Dawson, W. R.; Windsor, M. W. J. Phys. Chem. 1968, 72, 3251. doi: 10.1021/j100855a027
-
[1]
-
表 1 化合物1~4在CH2Cl2溶液中的氧化还原电势(vs Fc/ Fc+)
Table 1. Electrochemical redox potentials (vs Fc/Fc+) of compounds 1~4 in CH2Cl2
Compd. Epaa/mV Epcb/mV ΔEc/mV E1/2d/mV ipae/μA ipa/ipcf 1 254 154 100 204 8.16 1.24 2c 239 135 104 187 9.73 1.15 3c 243 148 95 195 5.39 1.25 4c 381 299 82 340 5.90 1.65 4d 393 310 83 351 6.19 2.12 aAnodic peak potential; bCathodic peak potential; cΔE=Epa-Epc; dE1/2=1/2(Epa+Epc); eanodic peak current; fipc, cathodic peak current. 表 2 化合物1~4的相转变温度和焓变a
Table 2. Phase transition temperatures and associated enthalpies of compounds 1~4
Compd. Phase transitiona/℃ [∆H/(kJ•mol-1)] First heating Second heating First cooling 1 C1 161.5 (7.1) C2 180.9 (2.3) — — 2a C1 79.3 (2.4) C2 172.9 (-2.4) C3 202.1 (-3.0) — — 2b C1 74.87 (2.3) C2 165.5 (-2.3) C1 46.1 (4.2) 38.8 (5.0) C1 2c C1 71.4 (2.9) C2 163.3 (-3.5) C1 66.5 (12.7) 60.7 (12.5) C1 3a C1 113.8 (37.9) C2 155.1 (62.5) I C1 114.7 (-13.8) C2 154.8 (60.7) I I 90.7 (-26.5) C 3b C1 40.4 (12.8) C2 113.7 (34.8) C3 117.6 (-18.2)
C4 136.1 (28.4) IC1 112.1 (8.4) C2 116.8 (-14.5) C3
135.5 (19.8) II 82.6 (-21.1) C 3c C1 54.8 (37.8) C2 103.4 (-2.8) C3 136.5 (39.6) I C1 115.4 (12.1) C2 120.3 (22.6) C3 137.3 (29.8) I I 84.7 (-22.2) C1 4a C 171.7 (55.6) I C 171.2 (40.3) I I 148.6 (-33.2) C 4b C 169.9 (43.6) I C 168.4 (36.3) I I 145.9 (-32.4) C1 4c C1 64.4 (50.4) C2 122.5 (7.9) C3 170.4 (68.4) I C1 29.5 (20.3) C2 168.9 (46.2) I I 147.5 (-39.7) C2 18.7 (-23.5) C1 4d C1 60.1 (36.5) C2 181.4 (32.7) I C1 16.4 (26.3) C2 185.5 (29.2) I I 167.4 (-29.6) C2 9.7 (-33.2) C1 aC: crystal, I: isotropic. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1156
- HTML全文浏览量: 139


 下载:
下载:






 下载:
下载:

