 图1
含碳硫键的化合物
Figure1.
Compounds containing C—S bonds
图1
含碳硫键的化合物
Figure1.
Compounds containing C—S bonds

Citation: Sun Fengli, Liu Xuemin, Chen Xinzhi, Qian Chao, Ge Xin. Progress in the Formation of C-S Bond[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2211-2220. doi: 10.6023/cjoc201703038

C-S键构筑的研究进展
English
Progress in the Formation of C-S Bond
-
Key words:
- Ullmann reaction
- / C-S bond
- / coupling reaction
-
构筑C—S键是现代有机合成重要的工具之一, 也是合成含硫化合物的主要途径.含硫化合物, 如含二价硫的硫醚、硫酚、硫醇和高价硫的砜、亚砜及磺胺类化合物等, 是天然产物、药物和功能性材料[1, 2]的重要结构骨架(图 1), 它们在生物和药理活性方面[3~5]扮演着重要的角色.因此, 不断探索简洁、高效的C—S键构筑方法, 已成为有机化学中的热门研究领域.但是, 相较于研究较为成熟的C—N和C—O键构建方法[6, 7], C—S键的高效构筑还需要更深入的研究.[8]
早期的C—S键形成反应局限于有机卤化物与硫代化物的直接偶合和硫醇与不饱和键的加成[9].在1901年, 德国的Ullmannn报道了铜催化硝基溴苯的脱卤偶联反应[10], 但传统的Ullmann偶联反应条件非常苛刻, 需要强碱、高温、过量铜试剂等条件.配体的引入使得反应条件有了极大改善, 不仅反应温和、催化剂用量少, 而且提高了官能团的兼容性.近年来, C—H键活化由于操作高效、反应路径便捷等特点, 受到了很大关注, 其主要的催化剂是过渡金属, 如钯[11]、铜[12]和镍[13]等.另外, 在无金属[14, 15]催化下通过脱除羧基引发偶联反应来构建C—S键, 具有区域选择性的优势, 在合成领域已显示出广阔的前景.本文主要以C—S键的构建方式进行分类: C—H键活化、脱羧偶联反应、Ullmann反应, 综述了近年来形成含硫化合物的一些研究, 着重从配体方面介绍Ullmann反应构建C—S键的研究进展.
1 C—H键活化
C—H键活化主要是通过过渡金属催化, 具有原子经济性高和步骤简洁等特点, 其主要的过渡金属包括钯、镍、铜等, 另外在非金属以及无金属条件催化下也可以实现C—H键活化.大多数C—H键官能团化构建C—S键的反应如Eq. 1所示[16, 17].
通过芳基卤化物的直接硫氰化来构筑C—S键是合成硫氰酸芳基酯的比较常用的方法.早在1996年, Suzuki及其同事[18]开就探索出了一种在温和条件下合成芳基硫氰酸酯的方法, 采用KCu(SCN)2与芳基碘化物交叉偶联反应合成目标产物. 2006年Guo等[19]报道了CuI催化芳基碘化物与KSCN偶联合成硫氰化产物, 这类方法的主要缺点是产率较低且底物主要局限在芳基碘化物. Wang等[20]报道了一种直接且简单的方法, 实现了在室温下咪唑并杂环化合物4通过sp2 C—H官能团化高度选择性硫氰化(Eq. 2), 该方法所得的产物C-3硫氰化咪唑并吡啶6收率高(80%~94%), 并且底物适应性较好.在咪唑并吡啶芳基环上的各种供电子和吸电子基团都具有很好的耐受性, 而且没有显示出明显的电子效应.此外, 该反应的空间位阻效果也不明显, 在不同位置取代的甲基咪唑并吡啶类可以高效地与KSCN反应.该方法大大地拓宽了硫氰酸芳基酯反应的底物范围, 不再局限于芳基碘化物.
Fu等[21]在非金属催化条件下采用一锅法, 将炔醛7、吡啶-2-胺8和醇或硫醇9三组分反应合成取代咪唑并[1, 2-a]吡啶衍生物10 (Eq. 3), 反应的特点是不含金属、环境友好且廉价易得.该合成咪唑并[1, 2-a]吡啶的方法其底物适用性广, 且收率高.
化学家期望发现合成步骤少、有毒废物排放量小、反应条件温和且选择性高的反应方案.因此, 绿色化学的概念逐渐兴起, 研究人员将多相催化、非金属催化或无催化剂等绿色合成的概念应用在C—S成键中, 使用碘[22~24]、碱[25]或纳米颗粒进行转化, 避免了过渡金属络合物和盐的使用. Wang等[26]报道了绿色简洁的水促吲哚11与磺酰肼12的硫醇化反应(Eq. 4), 该方法可以在没有任何催化剂、配体或添加剂的温和条件进行, 该反应的收率较高(最高可达到99%), 且副产物仅为氮气和水.这提供了一种环境友好且经济的反应途径.
C—H官能化为有机分子的官能化提供了高效、经济和环境友好的方案, 推动了有机合成领域的迅速发展.尽管C—H活化策略有着巨大的吸引力, 但是依然面临一些挑战, 比如:反应条件不具有普适性、底物适用性窄和惰性C—H键的活化等.
2 脱羧偶联反应
尽管构筑C—S键的方法不断改善, 但合成芳基硫化物的方法主要局限于金属硫醇盐和烷基或芳基卤化物之间的缩合反应.而有机卤化物回收的成本高, 不宜工业化生产, 相比之下, 羧酸是环境友好并且容易制备的试剂.近年来, 羧酸通过失去CO2脱除羧基引发的偶联反应在合成化学领域已显示出广阔的前景.使用容易获得的羧酸来构建杂环化合物, 用过渡金属催化脱羧反应形成C—C和C—杂键是简单且可持续的方案[27, 28].与C—H键活化反应相比, 脱羧偶联反应通常是通过失去CO2来完成, 它并不需要昂贵的有机金属试剂, 同时又保持了传统偶联反应的区域选择性优势(Eq. 5).
早在1966年, Nilsson等[29]研究了Ullmann偶联合成联芳和铜催化的芳香酸脱羧反应之间的密切联系, 他们认为往Ullmann反应混合物中加入羧酸有利于还原脱卤(Eq. 6).然后, 他们用铜(Ⅰ)催化2-噻吩甲酸或2-糠酸14和碘苯15的脱羧偶合反应[30]. 2005年Myers[31, 32]和Goossen等[33]在金属催化偶联反应领域做出许多研究进展, 之后脱羧偶联反应渐渐得到发展.
其后, 在2009年, Liu等[34]提出新的简单的合成路线(Eq. 7), 通过使用双金属系统催化芳基羧酸17和硫醇或二硫化物18进行脱羧C—S交叉偶联来合成芳基硫化物19, 反应的收率最高达到75%.
此后, 他们[35]又通过铜催化脱羧C—S交叉偶联反应制备乙烯基硫化物21 (Eq. 8).在CuI和Cs2CO3的作用下, 芳基丙炔酸20与硫醇通过脱羧偶联反应合成乙烯基硫化物, 底物适用性较好, 各种硫醇与芳基丙炔酸反应, 都能得到相应的乙烯基硫化物, 并且反应具有很高的产率, 可高达95%.对于Z-异构体具有高的立体选择性.这种方法不仅加深了我们对脱羧反应的理解, 还提供了合成乙烯基硫醚化合物的简便途径.
随后, Becht等[36]报道了一种简单的二芳基硫化物24的合成路线, 利用钯催化的富电子-2, 6-二烷氧基苯甲酸衍生物22和二芳基二硫化物23脱羧反应.
该反应适用于具有给电子取代基的芳烃羧酸的C—S键形成, 是对先前Liu小组35C—S键形成的补充.这也是首例由芳烃羧酸通过脱羧偶联反应形成C—Se键(Eq. 9).
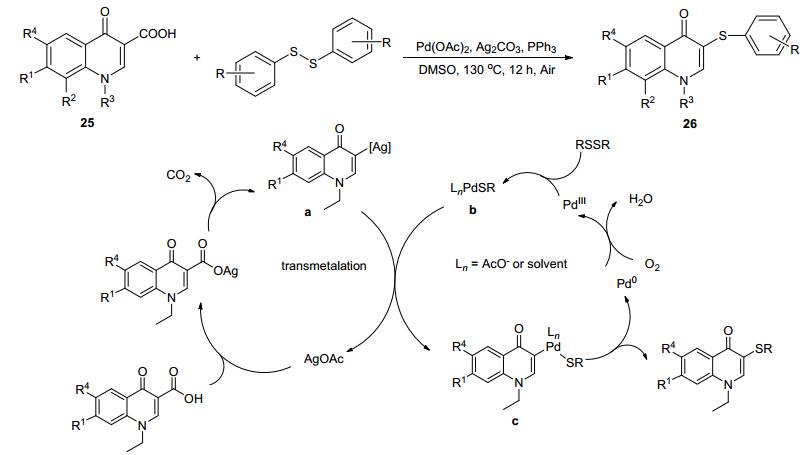
Zhang等[37]报道了钯催化喹诺酮衍生物25与二芳基二硫化物通过脱羧偶联直接硫醚化的反应体系(Scheme 1).该反应可以在空气中, 利用Pd(OAC)2和Ag2CO3双催化剂进行催化, 构造喹诺酮衍生芳基硫化物26.另外, 该小组提出了可能的机理解释:最初, 银盐体系下通过脱羧反应形成有机金属中间体a, 随后, PdⅡ与二芳基二硫化物反应生成PdⅡ配合物b.此后, 通过a和b之间的金属转移反应产生芳基PdⅡ物质c.最后, 芳基PdⅡ物质经过还原消除产生目标产物3和Pd0物质, Pd0物质又被氧气氧化到PdⅡ形成一个催化循环.
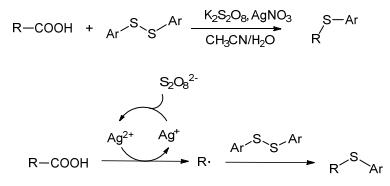
Xu等[38]同样以二芳基二硫化物为硫源开发了银类的催化体系(Scheme 2), 在反应温度为60 ℃的温和条件下, 银介导了脂肪族羧酸的脱羧C—S交叉偶联反应, 官能团显示出良好的耐受性, 该体系以K2S2O8为氧化剂.它提供了另一种进行C—S键的脱羧偶联反应合成烷基芳基硫化物的方法, 并且以相对较高的产率和选择性获得了相对应的烷基芳基硫化物.作者提出了可能的反应机理: Ag(Ⅰ)在过硫酸盐的存在下被氧化成Ag(Ⅱ), 随后, Ag(Ⅱ)与脂族羧酸结合, 通过脱羧途径产生烷基自由基.然后, 烷基自由基攻击二芳基二硫化物以产生目标产物.
由于脱羧偶合反应在化学技术中有巨大优势, 因此研究人员极力寻求合适的催化体系用于脱羧C—S交叉偶合反应, 但这些体系往往面临诸多条件的限制.因此, 加强对脱羧偶联机理的深入探讨, 对工艺条件的改善和优化、催化剂应用范围的扩大都有着至关重要的影响.
3 Ullmann反应
多年来, 许多铜催化体系用于构建C—O键, C—N键的实验方案被报道, 铜(盐)或其金属配合物诱导或催化卤代芳烃的C—C、卤代芳烃与芳香胺的C—N、卤代芳烃与酚C—O和卤代芳烃与含硫化合物的C—S键的偶联反应统称为Ullmann反应.经过近十年的发展, 其配体的选择发挥了关键作用, 不仅拓宽了Ullmann反应的应用范围, 而且提高了反应收率, 增强了反应的选择性, 并且降低了反应成本.虽然, 配体的研究已经相对较为完善, 但科研工作者仍然需要继续开发催化活性好、绿色并且多功能的配体.
3.1 N, N'-型配体
N, N'-型配体作用于铜催化的交叉偶联反应时, 一般认为其催化活性比较好, 选择性和产率都比较高[39], 其合适的反应温度一般在80~110 ℃之间, 并且大部分N, N'-型配体相对便宜, 能降低反应成本.
1995年, Suzuki等[40]首次采用CuI催化芳基或烷基碘化物和亚磺酸盐27反应, 该反应体系在氩气氛围中110 ℃条件下反应6 h, 模板反应产率为60%; 2002年, Baskin和Wang等[41]对上述Suzuki的实验进行改进, 引入了N, N'-二甲基乙二胺(29)作为配体, 产率可达70%.但是, 此过程仍然局限于芳基碘化物, 当底物为芳基溴化物时, 收率较低(Eq. 10).
同年, Venkataraman等[42]报道了使用10 mol% CuI和10 mol% 2, 9-二甲基-1, 10-菲啰啉(30)配体催化芳基碘化物和硫醇的交叉偶联反应, 该反应以叔丁醇钠作为碱, 甲苯为溶剂110℃条件下加热12 h (Eq. 11).研究表明:该方案适用于简单易得的碘化物和硫醇, 且有良好的收率.但新亚铜试剂的价格相对昂贵, 此外, 虽然K3PO4与叔丁醇钾效果相同, 但其它的碱(如三乙胺和碳酸钾)在该偶联反应中没有效果.
之后, SanMartin等[43]以环己二胺31作为配体用CuCl催化芳基卤代物和苯基硫酚的偶联反应, 该反应以水为溶剂, 产物收率最高达到99%, 同时对乙二胺、四甲基乙二胺和环己二胺进行了比较, 他们发现后两者N, N'-型配体都有较好的催化效果(Eq. 12).
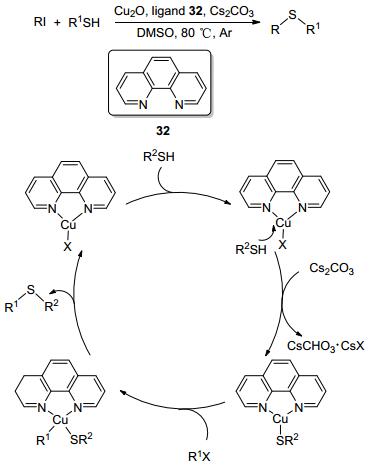
1, 10-菲罗啉32是一种廉价易得的N, N'-型配体, 许华建小组[44]用该配体在CuO催化下的C—S交叉偶联反应中, 以二甲基亚砜(DMSO)作为溶剂, 在80 ℃条件下发生反应, 收率可达75%~99%.他们采用各种芳基卤化物和硫醇对底物进行了拓展, 并得到了较为满意的结果(Scheme 3).另外, 他们发现N, N'-二甲基乙二胺和N, N, N', N'-四甲基乙二胺这两种N, N'-型配体不适合用于此反应, 而另一种N, N'-型配体1, 10-菲罗啉, 则具有极高的产率.他们提出氧化加成的路径受配体空间结构的影响很大, 因此三种不同N, N'-型配体在反应中会具有不同的反应活性.随后, Zhang等[45]也采用了1, 10-菲罗啉作为反应的配体, 在CuCl催化的吲哚33与苯亚磺酸盐生成3-磺酰吲哚34的C—S成键过程中, 1, 10-菲罗啉配体的加入大大提高了反应的收率, 且反应方案操作简单, 避免了使用有毒试剂, 在有机合成中有广阔的前景(Eq. 13).
2011年, Liu等[46]发现在需氧条件下, 由化学计量铜(Ⅰ)试剂催化形成C—S交叉偶合反应的方法, 以2, 2'-联吡啶(37)为配体, CuI催化芳基或烷基硫醇和苯并噻唑35进行巯基化反应, 简单高效地合成一系列芳基或烷基取代的巯基苯36, 收率最高达93%.实验表明, 该方法可以拓展到噻唑、苯并咪唑和吲哚等.通过这种简单方便的合成方法, 在需氧反应条件下可以合成具有良好产率的各种2-取代的巯基苯、咪唑、吲哚等(Eq. 14).
3.2 O, O'-型配体
合适的配体可以明显加快反应速率并显著降低反应温度, 然而, 配体的高成本或特异性, 可能会在一定程度上限制许多Ullmann方法的应用.研究发现O, O'-型配体可应用于各种碳-杂原子偶联反应, 它们所表现出的应用价值似乎也越来越重要[47, 48].
Buchwald等[49]将乙二醇(38)这种简单的O, O'-型二齿类配体用于5-碘-间二甲苯和苯硫酚的模板反应, 研究发现在Cu(Ⅰ)、碘化物和碳酸钾的作用下以异丙醇作为溶剂进行反应效果最优, 收率可达到92%. Buchwald等[50]对铜催化的C—N偶联化学的研究发现, 相似的催化体系也可以用于C—S偶联反应, 并且官能团耐受性很好, 同时乙二醇的介入有效地避免了昂贵配体的使用.因此, 这是一类相对简洁高效、操作简单的铜促进芳基碘化物和烷基硫醇之间的C—S偶联反应(Eq. 15).随后在2006年, Gueiffier等[51]同样用乙二醇作为配体, 使用前面Buchwald报道的反应条件, 即5 mol% CuI和乙二醇(2 equiv.)的异丙醇溶液, 碳酸钾作为碱, 对以6-碘-2-(4-氟苯基)咪唑并[1, 2-a]吡啶(39)和4-甲氧基苯苯硫酚作为底物的C—S偶联反应进行了条件的再次优化, 得到94%的产率(Eq. 16).
Bao等[52]受Buchwald等[53]的活性β-二酮类配体启发, 采用经济性、可用性都比较好且易得的酯作为配体, 即2-环己酮甲酸乙酯(41)这种新型、高效且多功能的O, O'-型配体, 在铜催化下各种N/O/S亲核试剂与芳基卤化物可以在温和条件下成功地进行偶联反应, 合成具有良好收率的各种产物, 包括N-芳基酰胺、N-芳基咪唑、芳基醚和芳基硫醚(Eq. 17).
Venkataraman小组[54]报道了一种使用5 mol% Cu(Ⅰ)催化剂[Cu(phen)(PPh3)2]NO3催化芳基硫酚和碘烯烃42合成乙烯基硫醚43的方法, 该体系需加入1.5 equiv.的K3PO4, 并以甲苯作为溶剂, 得到的产物收率较高.该方法的优点在于官能团耐受性比较好, 但该方法必须使用对空气和水分较为敏感的铜催化剂.此外, 该反应条件苛刻(反应温度高, 反应时间长).而Cook等[55]在此实验的基础上加入O, O'-型的双齿配体44, 开发了温和且有效的铜催化交叉偶联反应形成乙烯基C—S键的方法, 反应的收率可达84%~98%.鉴于其温和的反应条件、简单性和通用性以及催化剂体系的低成本, 该方法特别值得关注(Eqs. 18, 19).
3.3 N, O-型配体
上海有机所的马大为课题组发现, 在相对温和的条件下CuI能催化芳基卤化物和R-氨基酸的直接偶合.该反应提供了一个简短且经济的路线来合成手性N-芳基的R-氨基酸, 它是一些重要生物分子的共同的核心结构, 他们发现R-氨基酸的结构对Ullmann缩合反应起加速诱导的作用[56~58]. 2005年, 马大为小组[59]提出芳基卤化物与亚磺酸盐在CuI/L-脯氨酸钠盐45的催化下, 以DMSO作溶剂, 在80~95 ℃下发生偶联反应, 得到具有较高收率的选择性良好的相应芳基砜.该催化体系对大多官能团(包括羟基、氨基、乙酰苯胺、酮、酯和腈等)具有良好的耐受性(Eq. 20).
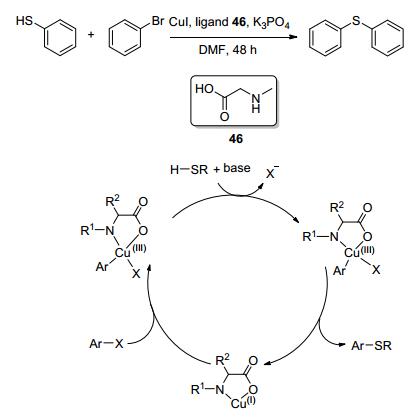
Guo等[60]将氨基酸作为配体用于CuI催化的芳基碘、溴化物与硫醇的C—S交叉偶联反应, 他们发现N, O-型配体46可以大大提高反应的催化效率.两种不同的氨基酸分别用于溴苯及碘苯与苯基硫酚的反应, 都有很好的催化效果.氨基酸类的N, O-型配体绿色环保、无毒性且廉价易得.机理的研究推测四配位铜中间体参与进程, 氨基酸配体在反应中不仅促进了芳基卤化物和Cu(Ⅰ)物质的氧化加成, 也稳定了Cu(Ⅲ)物质中间体(Scheme 4).
糖是自然界大量存在的生物有机分子之一, 已被广泛用于有机合成中[61, 62].它们作为手性助剂、试剂、有机催化剂和配体等用于不对称合成[63~65], 在过渡金属催化反应中, 单糖分子以其绿色和重要的作用引起了重大关注[66~68], 然而, 它们的作用尚不清楚. Zhang等[69]采用D-氨基葡萄糖作为一种绿色配体, 应用于铜催化芳基卤化物和亚磺酸钠合成芳砜类化合物的偶联反应.该实验方案具有较好的官能团耐受性, 如醚、酯、硝基等.药物甲磺苯咪唑能够通过该简单的合成路线合成.葡萄糖在该模板反应中取得31%的产率, 为进一步研究糖基提供了信心.之后进一步筛选糖基配体发现, N, O-型配体氨基葡萄糖47有更好的效果.因此预测它可能会在更广的范围内得到应用.通过对机理的推测, 他们发现使用N, O-型配体的催化机理是通过氧化加成和还原消除的路径.因此, 能够促进氧化加成过程或者使铜的中间体稳定的配体会对反应结果更加高效(Eq. 21).
3.4 其他
研究人员朝着绿色经济的方向不断努力, 越来越多的不需任何配体的温和催化体系得到开发, 无论是钯催化、还是铜催化体系都表现出了不错的成绩.
Qiao等[70]报道了钯催化的双C—S键形成的新型偶联反应, 他们提供了一种合成取代的1, 4-苯并噻嗪衍生物49的有效方法, 其中硫代硫酸钠在金属催化反应中作为硫源试剂, 且不需要加入任何配体.合成的衍生物是众多生物活性分子的结构元件, 这也体现出了这个实验方案在合成和药用化学方面的潜力(Eq. 22).
Li课题组[71]研究了2-取代的苯并噻唑51的合成方法, 通过使用Pd/C催化剂在室温下将N-(2-碘苯基)硫代乙酰胺衍生物50环化来实现.该方案的优点是仅在室温下, 无任何添加剂和配体参与, 就能有高达98%的产率, 该模板反应的适用性也很好, 可用于2-芳基、2-烷基和2-氨基苯并噻唑的合成.他们提出可能的反应途径:首先该反应可能通过硫原子与Pd/C的配位作用形成络合物Ⅰ, 随后经过还原消除形成六元钯化合物Ⅱ, 然后六元钯化合物将产生2位取代的苯并噻唑和再生的Pd/C (Eq. 23).
由于Pd自身的毒性、价格相对较高等特点, 限制了其在催化领域的应用, 而Cu因其价格低廉、催化活性高和低毒性等优点不断被用于催化交叉偶联反应形成
C—S键[72, 73], 受到越来越多的关注. 2008年Koten小组[74]报道一种铜催化的芳基碘化物和硫酚之间形成芳基硫醚的方法, 该反应可以在无配体条件下通过低量的(1~2.5 mol%)CuI催化形成C—S键(Eq. 24).在这种相对温和的反应条件下可以合成各种对应的二芳基硫醚, 说明该体系具有良好的化学选择性和官能团耐受性, 该催化过程具有适用性和简单性, 避免了使用成本昂贵或者需耗时制备的配体, 该方案可以在有机合成中得到大范围的应用.
4 总结
C—S键的构筑对于化学合成和构建天然产物以及进行分子设计具有十分重要的作用, 众多化学家在探究温和条件下构筑C—S键的方法上取得了显著的进展. Ullmann C—S偶联反应是目前形成C—S键较为成熟的方法, 其中配体的选择是关键.针对N, N'-型、O, O'-型和N, O-型配体进行了详细的综述.虽然配体的研究已相对完善, 但开发催化活性好、绿色并且多功能的配体仍然需要科研工作者继续努力.通过脱羧偶联和C—H键活化来构筑C—S键, 合成步骤短, 往往一步就可以得到目标产物, 且副产物的量极少, 仅脱羧偶联反应释放出少量CO2, 原子经济性较高.因此, 这两类反应最符合绿色化学的发展理念, 为开发复杂C—S化合物提供了便利的途径.然而脱羧偶联和C—H活化也存在一定的局限性, 比如:反应条件不具有普适性及底物适用性窄、选择性低等.另外, 目前对于C—S键构筑的机理研究极其有限, 在一定程度上阻碍了C—S成键的更大范围应用.因此, 研究更加高效、适用性广和环境友好的C—S键构筑方法, 对其工业化应用具有重大的意义.
-
-
[1]
Liu, J.; Yang, J.; Yang, Q.-H.; Wang, G.; Li, Y. Adv. Funct. Mater. 2010, 15, 1297.
-
[2]
Dondoni, A. Angew. Chem. 2010, 120, 9133.
-
[3]
Natarajan, A.; Guo, Y.-H.; Harbinski, F.; Fan, Y.-H.; Chen, H.; Luus, L.; Diercks, J.; Aktas, H.; Chorev, M.; Halperin, J. A. J. Med. Chem. 2004, 47, 4979. doi: 10.1021/jm0496234
-
[4]
Cole, D. C.; Lennox, W. J.; Lombardi, S.; Ellingboe, J. W.; Bernotas, R. C.; Tawa, G. J.; Mazandarani, H.; Smith, D. L.; Zhang, G.-M.; Coupet, J.; Schechter, L. E. J. Med. Chem. 2005, 48, 353. doi: 10.1021/jm049243i
-
[5]
Banerjee, M.; Poddar, A.; Mitra, G.; Surolia, A.; Owa, T.; Bhattacharyya, B. J. Med. Chem. 2005, 48, 547. doi: 10.1021/jm0494974
-
[6]
王晔峰, 曾京辉, 崔晓瑞, 有机化学, 2010, 30, 181. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338626.shtmlWang, Y.-F.; Zeng, J.-H.; Cui, X.-R. Chin. J. Org. Chem. 2010, 30, 181(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338626.shtml
-
[7]
成宜娟, 孙丽萍, 有机化学, 2013, 33, 877. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341894.shtmlCheng, Y.-J.; Sun, L.-P. Chin. J. Org. Chem. 2013, 33, 877(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341894.shtml
-
[8]
邓维, 刘磊, 郭庆祥, 有机化学, 2004, 24, 150. doi: 10.3321/j.issn:0253-2786.2004.02.004Deng, W.; Liu, L.; Guo, Q.-X. Chin. J. Org. Chem. 2004, 24, 150(in Chinese). doi: 10.3321/j.issn:0253-2786.2004.02.004
-
[9]
Kariya, A.; Yamaguchi, T.; Nobuta, T.; Tada, N.; Miura, T.; Itoh, A. RSC Adv. 2014, 4, 13191. doi: 10.1039/C3RA47863G
-
[10]
Gurbuz, N.; Karaca, E. O.; Ozdemir, I.; Cetinkaya, B. Chem. Ber. 1901, 34, 2174. doi: 10.1002/(ISSN)1099-0682
-
[11]
Zhu, F.; Wang, Z.-X. Org. Lett. 2015, 17, 1601. doi: 10.1021/acs.orglett.5b00510
-
[12]
Li, J.; Huang, H.-N.; Liang, W.-H.; Gao, Q.; Duan, Z. Org. Lett. 2012, 15, 282.
-
[13]
Zhu, J.-Y.; Chen, Y.; Lin, F.; Wang, B.-S.; Chen, Z.-W.; Liu, L.-X. Org. Biomol. Chem. 2015, 13, 3711. doi: 10.1039/C4OB02586E
-
[14]
Varun, B. V.; Prabhu, K. R. J. Org. Chem. 2014, 79, 9655. doi: 10.1021/jo501793q
-
[15]
Hostier, T.; Ferey, V.; Ricci, G.; Pardoa, D. G.; Cossy, J. Chem. Commun. 2015, 51, 13898. doi: 10.1039/C5CC05421D
-
[16]
余金权, 丁奎岭, 化学学报, 2015, 73, 1223 http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htmYu, J.-Q.; Ding, K.-L. Acta Chim. Sinica 2015, 73, 1223(in Chinese). http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htm
-
[17]
Su, Y.; Zhou, X.-J.; He, C.-L.; Zhang, W.; Ling, X.; Xiao, X. J. Org. Chem. 2016, 81, 4981. doi: 10.1021/acs.joc.6b00475
-
[18]
Suzuki, H.; Abe, H. Synth. Commun. 1996, 26, 3413. doi: 10.1080/00397919608003745
-
[19]
李红亮, 王正林, 邓卫平, 有机化学, 2016, 36, 2419. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345631.shtmlLi, H.-L.; Wang, Z.-L.; Deng, W.-P. Chin. J. Org. Chem. 2016, 36, 2419(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345631.shtml
-
[20]
Yang, D.-S.; Yan, K.-L.; Wei, W.; Li, G.-Q.; Lu, S.-L.; Zhao, C.-X.; Tian, L.-J.; Wang, H. J. Org. Chem. 2015, 80, 11073. doi: 10.1021/acs.joc.5b01637
-
[21]
Cao, H.; Liu, X.-H.; Zhao, L.-M.; Cen, J.-H.; Lin, J.-X.; Zhu, Q.-X.; Fu, M.-L. Org. Lett. 2014, 16, 146. doi: 10.1021/ol4031414
-
[22]
Liu, C.-R.; Ding, L.-H. Org. Biomol. Chem. 2015, 13, 2251. doi: 10.1039/C4OB02575J
-
[23]
Azeredo, J. B.; Godoi, M.; Martins, G. M.; Silveira, C. C.; Braga, A. L. J. Org. Chem. 2014, 79, 4125. doi: 10.1021/jo5000779
-
[24]
Ge, W.-L.; Wei, Y.-Y. Green Chem. 2012, 14, 2066. doi: 10.1039/c2gc35337g
-
[25]
Sang, P.; Chen, Z.-K.; Zou, J.-W.; Zhang, Y.-H. Green Chem. 2013, 15, 2096. doi: 10.1039/c3gc40724a
-
[26]
Yang, Y.; Zhang, S.; Tang, L.; Hu, Y.-B.; Zha, Z.-G.; Wang, Z.-Y. Green Chem. 2016, 18, 2609. doi: 10.1039/C6GC00313C
-
[27]
Shen, C.; Zhang, P.-F.; Sun, Q.; Bai, S.-Q.; Andy Hor, T. S.; Liu, X.-G. Chem. Soc. Rev. 2015, 44, 291. doi: 10.1039/C4CS00239C
-
[28]
Ma, Y.-Y.; Yan, Z.-Y.; Bian, C.-L.; Li, K.; Zhang, X.-W.; Wang, M.-F.; Gao, X.-L.; Zhang, H.; Lei, A.-W. Chem. Commun. 2015, 51, 10524. doi: 10.1039/C5CC02253C
-
[29]
Nilsson, M.; Ullenius, C. Acta Chem. Scand 1966, 20, 423. doi: 10.3891/acta.chem.scand.20-0423
-
[30]
Nilsson, M.; Ullenius, C. Acta Chem. Scand 1968, 22, 1998. doi: 10.3891/acta.chem.scand.22-1998
-
[31]
Myers, A. G.; Tanaka, D.; Mannion, M. R. J. Am. Chem. Soc. 2002, 124, 11250. doi: 10.1021/ja027523m
-
[32]
Tanaka, D.; Myers, A. G. Org. Lett. 2004, 6, 433. doi: 10.1021/ol0363467
-
[33]
Gooßen, L. J.; Deng, G.-J.; Levy, L. M. Science 2006, 313, 662. doi: 10.1126/science.1128684
-
[34]
Duan, Z.-Y.; Ranjit, S.; Zhang, P.-F.; Liu, X.-G. Chem. Eur. J. 2009, 15, 3666. doi: 10.1002/chem.200900133
-
[35]
Sadananda, R.; Duan, Z.-Y.; Zhang, P.-F.; Liu, X.-G. Org. Lett. 2010, 12, 4134. doi: 10.1021/ol101729k
-
[36]
Becht, J. M.; Drian, C. L. J. Org. Chem. 2011, 76, 6327. doi: 10.1021/jo200344w
-
[37]
Xia, C.-C.; Wei, Z.-J.; Yang, Y.; Yu, W.-B.; Liao, H.-X.; Shen, C.; Zhang, P.-F. Chem. Asian J. 2016, 11, 360. doi: 10.1002/asia.v11.3
-
[38]
Wang, P.-F.; Wang, X.-Q.; Dai, J.-J.; Feng, Y.-S.; Xu, H.-J. Org. Lett. 2014, 16, 4586. doi: 10.1021/ol502144c
-
[39]
许华建, 蔄秋石, 林义成, 李源源, 冯乙巳, 有机化学, 2010, 30, 9. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338426.shtmlXu, H.-J.; Lan, Q.-S.; Lin, Y.-C.; Li, Y.-Y.; Feng, Y.-S. Chin. J. Org. Chem. 2010, 30, 9(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338426.shtml
-
[40]
Suzuki, H.; Abe, H. Tetrahedron Lett. 1995, 36, 6239. doi: 10.1016/0040-4039(95)01095-Y
-
[41]
Baskin, J. M.; Wang, Z.-Y. Org. Lett. 2002, 4, 4423. doi: 10.1021/ol0269190
-
[42]
Bates, C. G.; Gujadhur, R. K.; Venkataraman, D. Org. Lett. 2002, 4, 2803. doi: 10.1021/ol0264105
-
[43]
Carril, M.; SanMartin, R.; Domínguez, E.; Tellitu, I. Chem. Eur. J. 2007, 13, 5100. doi: 10.1002/(ISSN)1521-3765
-
[44]
冯乙巳, 赵晓阳, 王珏玉, 郑法银, 许华建, 有机化学, 2009, 27, 2423. http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htmFeng, Y.-S.; Zhao, X.-Y.; Wang, J.-Y.; Zheng, F.-Y.; Xu, H.-J. Chin. J. Chem. 2009, 27, 2423(in Chinese). http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htm
-
[45]
Yang, Y.; Li, W.-M.; Xia, C.-C.; Ying, B.-B.; Shen, C.; Zhang, P.-F. ChemCatChem. 2016, 8, 304 doi: 10.1002/cctc.201500917
-
[46]
Ranjit, S.; Lee, R.; Heryadi, D.; Shen, C.; Wu, J.-E.; Zhang, P.-F.; Huang, K.-W.; Liu, X.-G. J. Org. Chem. 2011, 76, 8999. doi: 10.1021/jo2017444
-
[47]
Zhang, H.; Cai, Q.; Ma, D.-W. J. Org. Chem. 2005, 70, 5164. doi: 10.1021/jo0504464
-
[48]
Ouali, A.; Laurent, R.; Caminade, A. M.; Majoral, J. P.; Taillefer, M. J. Am. Chem. Soc. 2006, 128, 15990. doi: 10.1021/ja066505s
-
[49]
Kwong, F. Y.; Buchwald, S. L. Org. Lett. 2002, 4, 3517. doi: 10.1021/ol0266673
-
[50]
Kwong, F. Y.; Klapars, A.; Buchwald, S. L. Org. Lett. 2002, 4, 581. doi: 10.1021/ol0171867
-
[51]
Gueiffier, C. E.; Thery, I.; Gueiffier, A.; Buchwald, S. L. Tetrahedron 2006, 62, 6042. doi: 10.1016/j.tet.2006.04.007
-
[52]
Lv, X.; Bao, W.-L. J. Org. Chem. 2007, 72, 3863. doi: 10.1021/jo070443m
-
[53]
Shafir, A.; Buchwald, S. L. J. Am. Chem. Soc. 2006, 128, 8742. doi: 10.1021/ja063063b
-
[54]
Bates, C. G.; Saejueng, P.; Doherty, M. Q.; Venkataraman, D. Org. Lett. 2004, 6, 5005. doi: 10.1021/ol0477935
-
[55]
Kabir, M. S.; Van Linn, M. L.; Monte, A.; Cook, J. M. Org. Lett. 2008, 10, 3363. doi: 10.1021/ol801149n
-
[56]
Ma, D.-W.; Zhang, Y.-D.; Yao, J.-C.; Wu, S.-H.; Tao, F.-G. J. Am. Chem. Soc. 1998, 120, 12459. doi: 10.1021/ja981662f
-
[57]
Ma, D.-W.; Xia, C.-F.; Jiang, J.-Q.; Zhang, J.-H. Org. Lett. 2001, 3, 2189. doi: 10.1021/ol016043h
-
[58]
Ma, D.-W.; Xia, C.-F. Org. Lett. 2001, 3, 2583. doi: 10.1021/ol016258r
-
[59]
Zhu, W.; Ma, D.-W. J. Org. Chem. 2005, 70, 2696. doi: 10.1021/jo047758b
-
[60]
Deng, W.; Zou, Y.; Wang, Y.-F.; Liu, L.; Guo, Q.-X. Synlett. 2004, 7, 1254.
-
[61]
Zhao, Q.; Shen, C.; Zheng, H.; Zhang, J.-C.; Zhang, P.-F. Carbohyd Res. 2010, 345, 437. doi: 10.1016/j.carres.2009.11.032
-
[62]
Davis, A. P. Nature 2010, 464, 169. doi: 10.1038/464169a
-
[63]
Shen, C.; Xia, H.-J.; Zheng, H.; Zhang, P.-F.; Chen, X.-Z. ChemInform 2011, 42, 1936.
-
[64]
Shen, C.; Shen, F.-Y.; Xia, H.-J.; Zhang, P. F.; Chen, X.-Z. Tetrahedron:Asymmetry 2011, 22, 708. doi: 10.1016/j.tetasy.2011.04.007
-
[65]
Shen, C.; Shen, F.-Y.; Zhou, G.-B.; Xia, H.-J.; Chen, X.-Z.; Liu, X.-G.; Zhang, P.-F. Catal. Commun. 2012, 26, 6. doi: 10.1016/j.catcom.2012.05.004
-
[66]
Monopoli, A.; Calò, V.; Ciminale, F.; Cotugno, P.; Angelici, C.; Cioffi, N.; Nacci, A. J. Org. Chem. 2010, 75, 3908. doi: 10.1021/jo1005729
-
[67]
Thakur, K. G.; Srinivas, K. S.; Chiranjeevi, K.; Sekar, G. ChemInform 2012, 43, 2326.
-
[68]
Thakur, K. G.; Ganapathy, D.; Sekar, G. Chem. Commun. 2011, 42, 5076.
-
[69]
Yang, M.; Shen, H.-Y.; Li, Y.-Y.; Shen, C.; Zhang, P.-F. RSC Adv. 2014, 4, 26295. doi: 10.1039/C4RA03187C
-
[70]
Qiao, Z.-J.; Liu, H.; Xiao, X.; Fu, Y.; Wei, J.-P.; Li, Y.-X.; Jiang, X.-F. Org. Lett. 2013, 15, 2594 doi: 10.1021/ol400618k
-
[71]
Cheng, Y.-N.; Peng, Q.; Fan, W.-G.; Li, P.-X. J. Org. Chem. 2014, 79, 5812. doi: 10.1021/jo5002752
-
[72]
Yamamoto, T.; Sekine, Y. Can. J. Chem. 1984, 62, 1544. doi: 10.1139/v84-263
-
[73]
王小龙, 杨芳, 薛自燕, 有机化学, 2015, 35, 29. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344625.shtmlWang, X.-L.; Yang, F.; Xue, Z.-Y. Chin. J. Chem. 2015, 35, 29(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344625.shtml
-
[74]
Sperotto, E.; van Klink, G. P. M.; de Vries, J. G.; van Koten, G. J. Org. Chem. 2008, 73, 5625. doi: 10.1021/jo800491k
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 120
- 文章访问数: 5466
- HTML全文浏览量: 1745


 下载:
下载:




 下载:
下载:

