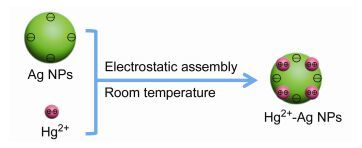
 图1
Hg2+-Ag纳米粒子形成的原理示意图
Figure1.
Schematic diagram of the formation of Hg2+-Ag NPs
图1
Hg2+-Ag纳米粒子形成的原理示意图
Figure1.
Schematic diagram of the formation of Hg2+-Ag NPs

Citation: Li Wenting, Qu Wenjuan, Zhang Haili, Li Xiang, Lin Qi, Yao Hong, Zhang Youming, Wei Taibao. Development on Application of Phenazine Derivatives in Molecular Recognition and Self-assembly[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2619-2639. doi: 10.6023/cjoc201703023

吩嗪衍生物在分子识别与自组装中的应用进展
English
Development on Application of Phenazine Derivatives in Molecular Recognition and Self-assembly
-
Key words:
- phenazine
- / natural product
- / molecular recognition
- / supramolecular self-assembly
-
吩嗪类化合物是常被有机化学研究者作为研究对象的一类化合物, 它广泛存在于自然界中, 也是许多合成产品、有机天然产物以及功能材料的结构骨架, 因此这类天然产物的分离鉴定、合成以及对其结构的功能化一直以来是有机化学研究中的一个热点[1~7].研究初期该类化合物被用作染料, 逐渐对其性质开发发现它们具有非常好的生物活性, 同时也是一种较好的功能材料, 近年来它的应用被广泛渗透到农业、医药、导体、发色体和电池材料等领域[8~14].另外, 吩嗪衍生物因其自身的结构特点(含有缺电子的π体系, 带有孤对电子的氮原子以及三个稠合芳环)既可以作为离子配体和氢键受体, 又有利于π-π电子的相互交叠作用, 并且易于被质子化具有一定的电子接受能力.因此, 该类化合物在超分子化学的弱相互作用领域有着相当大的应用前景[15~17].又因其具有较大的共轭体系和特殊的光学性能、较高的荧光量子产率、较窄的发射谱带、较大的斯托克斯位移, 并且, 最大吸收与发射波长在可见光区, 使得其多年以来一直作为分子探针和分子自组装器件中的信号响应部分被研究[18, 19].近年来, 吩嗪衍生物在分子识别和超分子自组装领域的应用受到关注, 其文献散见于各种期刊, 尚未见较为系统的综述报道.鉴于此, 在我们对吩嗪衍生物的合成及其离子识别性能研究的基础上, 综述了近年来吩嗪及其衍生物在超分子化学中的应用进展, 将其分为分子识别(MR)和超分子自组装(MS-A)两类.根据与吩嗪衍生物所作用的客体的类型的不同将MR分为阳离子识别(CR)、阴离子识别(AR)以及中性分子识别(NMR)三类.根据驱动力的不同又将MS-A分为以下四类:氢键作用诱导的自组装(HBSA)、堆积作用诱导的自组装(ASA)、金属-配体作用诱导的自组装(M-LSA)和多种作用力协同作用诱导的自组装(MFSA)以及外界环境的导向作用诱导的自组装(OESA).
1 分子识别
分子识别(MR)一直以来作为超分子化学的一个重要的应用领域, 它是指一种受体通过分子间弱相互作用选择性结合某种特定的物种的过程, 它们之间的关系正如锁和钥匙之间关系是一一匹配的.受体分子由信号报告基团和识别位点两部分组成, 在分子识别的过程中受体分子通过与特定的物种相结合引起体系中分子结构或者某种特定行为的变化, 从而致使与信号报告基团对识别相关的信息的存储、传递及表达.分子识别(MR)通常分为阳离子识别(CR)、阴离子识别(AR)以及中性分子识别(NMR)这三类[20, 21].
1.1 离子识别
阴、阳离子识别作为分子识别中的主要研究内容, 是由于它在自然界中的广泛存在以及在各个领域的广泛应用.阴、阳离子可以参与生物体各种生命活动, 众所周知它们在人体的代谢过程中占有相当重要的地位.阴、阳离子在体内的缺失或富集都会对蛋白质造成破坏(蛋白质控制着细胞膜内外阴、阳离子的相互传送), 造成阴、阳离子在细胞膜失衡, 进而对人体的健康造成损害[22], 因此, 用方便、快捷以及高效的方法在各种环境复杂的细胞中对某种离子专一地进行检测引起了生物学、医学、化学以及环境学研究者的极大兴趣[23, 24].在各种检测方法中用化学传感器来对阴、阳离子达到检测成为离子识别领域的一个研究热点, 该类方法不需要昂贵的仪器, 操作过程简便并且检测时间较短.吩嗪类衍生物作为广大化学研究者手中炙手可热的一类化合物, 并且一直以来被列为信号报告基团中一种较好的信号报告基团以及具有多个配位点和较强的配位能力, 因此得到了许多性质较好的基于吩嗪衍生物的离子传感器, 其中有机小分子的离子识别传感器占据的数量是相对较多的.在研究者的不断努力下, 出现了基于金属配合物、纳米材料、高分子材料以及超分子材料等吩嗪衍生物的离子识别新材料, 这些新型材料的出现, 大大地扩展了基于吩嗪衍生物的离子识别探针的使用范围和实际应用的价值, 下面我们将对基于吩嗪衍生物的离子识别材料进行简单的综述.近年来, 我们课题组[25~27]在基于吩嗪衍生物的阴、阳离子识别方面也取得了一些结果, 特别是在水溶液中重金属离子或有毒阴离子, 如Hg2+, Ag+, CN-等有很好的响应性能.
1.1.1 阳离子识别
2012年Bun等[28]合成了一系列乙炔基吩嗪并进一步得到它们的二-三氮唑基的环加成物1a~1d和2a~2d, 这些环加成物可以作为银离子的传感器.这些受体分子与Ag+离子的键合是通过与吩嗪和三氮唑环的氮原子配位而实现的.为了实现在水溶液中识别银离子, 作者在三氮唑单元上引入了水溶性的乙二醇链.并且在研究中发现, 在吩嗪的芳环上引入卤族元素时, 由于它的吸电子性能, 导致受体分子对银离子的键合能力降低.在此, 我们以化合物1a为例, 在水溶液中化合物1a在560 nm处有最大发射峰, Ag+加入后与吩嗪和三氮唑环的氮原子发生配位(Eq. 1), 使受体1a的荧光猝灭, 从而达到在水溶液中对银离子的识别.
2014年Zhang等[29]设计合成了一种新的氮杂苯并传感器3, 该传感器有四个依附于N苯并杂环骨架两端的噻吩基团, 这样可以提高对金属阳离子的选择性.因此, 噻吩基团不仅具有键合金属离子的能力, 而且可以改变N取代的苯并杂环骨架的电子云密度.并且传感器3可以作为一种有效的阳离子传感器, 在15种阳离子(Mg2+, Mn2+, Na+, Cr2+, Cu2+, Fe3+, Hg2+, K+, Li+, Ni2+, Zn2+, Pb2+, Ca2+, Cd2+和Co2+)中单一地检测Cu2+离子. Cu2+离子的加入使传感器3溶液的颜色发生非常明显的变化(粉红色变为紫罗兰色), 在相应的紫外-可见光谱上3的最大吸收峰发生显著的红移.在365 nm的紫外灯下溶液的颜色由橘黄变为无色, 在相应的荧光光谱中荧光完全猝灭.并且传感器3对Cu2+离子的最低检测限为1.2 μmol·L-1.
2015年Júnior等[30]利用天然产品拉帕醇成功地合成了基于吩嗪的1, 2, 3-三氮唑发光探针4.在不同金属离子(Cu2+, Fe3+, Hg2+, Cd2+, Ca2+, Co2+, Ni2+, Ag+, Mg2+, Na+, Pb2+, Zr2+和Zn2+)存在的条件下研究了探针4的荧光性能.研究发现, 该探针能够在H2O/ CH3CN (V:V=8.5:1.5)溶液中检测Cd2+离子(Eq. 2).在4的溶液中加入氯化镉后, 溶液荧光的颜色由蓝色变为绿色, 在相应的荧光光谱上, 探针4的发射峰明显增强并伴有60 nm的红移, 其他金属离子的加入没有引起类似的变化, 因此, 该探针可以用于Cd2+离子的检测.
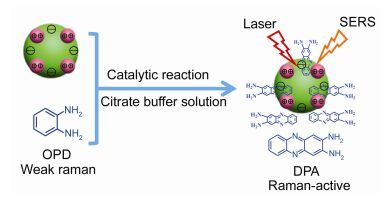
2015年Xu等[31]设计并构建了一个基于Hg2+-Ag纳米粒子配位催化反应的汞离子的表面增强拉曼散射传感器, 该传感器可以用于水质量的监控.如图 1所示, 作者通过静电相互作用在水相中将Ag纳米粒子(Ag NPs)(平均粒径是49 nm)与汞离子结合形成Hg2+-Ag纳米粒子(Hg2+-Ag NPs).如图 2所示, 形成的Hg2+-Ag粒子可以催化邻苯二胺(OPD)和溶解的氧之间的氧化还原反应形成2, 3-二胺基吩嗪(DAP), 由于2, 3-二胺基吩嗪依附到Ag纳米粒子表面, 产生拉曼效应并且拥有一个强的拉曼光谱信号.因此, 作者可以通过追踪2, 3-二胺基吩嗪的拉曼散射的强度来检测汞离子, 并且该方法对汞离子的最低检测浓度是1.0 nmol·L-1.这个传感器对汞离子显示出较高的灵敏度和选择性, 并且对水质量的检测具有一定价值.
2016年Su等[32]设计合成了两种基于N, N-二取代-二氢吩嗪类似物的比色和荧光探针5和6, 这两种探针可以在四氢呋喃中高选择性和高灵敏度地通过赫克偶联反应快速识别Hg2+离子.加入Hg2+后, 两种探针在短波长处的吸收峰降低, 而在长波长处的吸收峰增强, 并且颜色从无色变为黄色, 因此, 这两种探针可以在裸眼上对Hg2+离子达到识别.与此同时, Hg2+的加入使5和6溶液的荧光减弱.值得注意的是, 通过吸收光谱法可测得5和6对Hg2+的最低检测限分别为4.8和2.6 nmol· L-1. 5和6可以在几秒内迅速响应Hg2+离子.
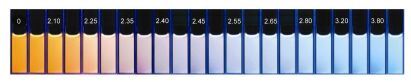
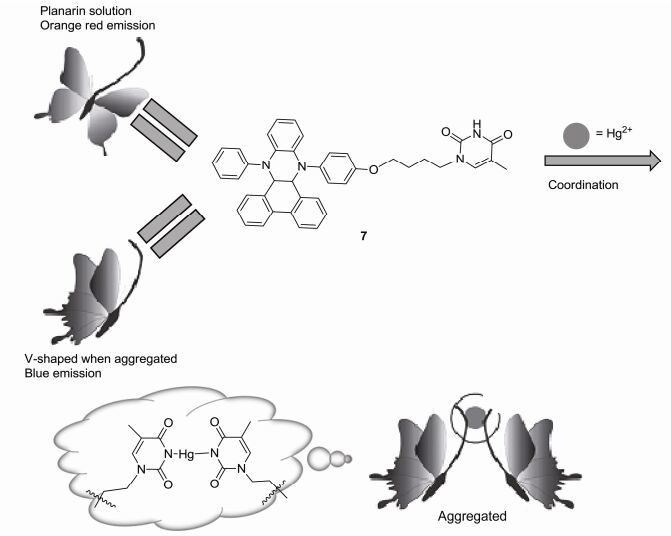
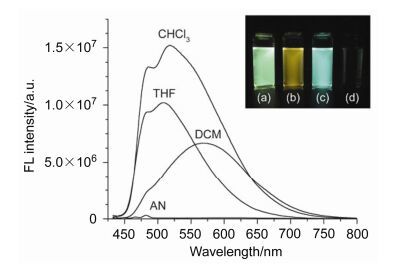
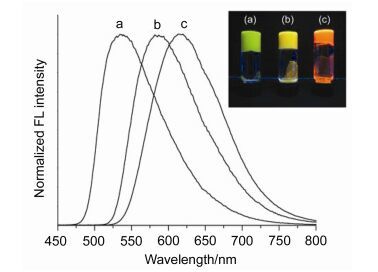
2016年Tian等[33]成功设计了一种能够比率荧光检测Hg2+的探针7.探针7由9, 14-二苯基-9, 14-二氢二苯并[a, c]吩嗪(DPAC)骨架和胸腺嘧啶通过非共轭间隔基相连而构成.在该探针中, DPAC单元作为一个双发射的发色团(分子结构为平面时发橙红色荧光, 分子结构弯曲时发蓝色荧光)以振动诱导发射(VIE)为特色.在低粘性溶液中可检测到DPAC有一个橙红色发射和一个可忽略的弱的蓝色发射.相反地, 在固态时可以观察到DPAC仅仅有一个蓝色发射.这种现象表明DPAC的结构对环境的变化比较灵敏, 这是由于增加分子周边的粘性可以抑制这种分子由平面到弯曲的大振幅的振动, 因此, DPAC在固态时仅发出蓝色发射.在探针7的THF/ H2O (V:V=3:7, 10×10-5 mol·L-1)溶液中加入0~4 equiv.的Hg2+时, 溶液的颜色在365 nm紫外灯下由橙红色逐渐变为蓝色, 在相应的荧光光谱中470 nm处的发射峰逐渐增强, 而在600 nm处的发射峰逐渐减弱(图 3).这是由于探针7在THF/H2O (V:V=3:7, 10×10-5 mol·L-1)溶液中大部分分子呈平整的蝴蝶状, 少数分子呈折叠的蝴蝶状, 当加入Hg2+时, 探针7的胸腺嘧啶单元与Hg2+之间发生配位抑制了DPAC分子结构由弯曲到平面的振动, 致使DPAC分子结构呈折叠的蝴蝶状, 同时溶液的荧光变为蓝白色.化合物7对Hg2+的最低检测限为(21.7±0.1)×10-6 mol·L-1.这些结果表明, 探针7在Hg2+的识别中完美地应用了VIE机理(图 4).
2015年Wei等[34]设计和合成了基于吩嗪衍生物的荧光传感器8 (Eq. 3).传感器8可以在二甲亚砜(DMSO)溶液中通过荧光猝灭行为高选择性和高灵敏度地识别Fe3+离子.并且其他阳离子, 包括Ca2+, Hg2+, Ag+, Cu2+, Zn2+, Pb2+, Cd2+, Ni2+, Cr3+, Co2+和Mg2+对探针的识别行为没有影响.传感器8对Fe3+的最低检测限为2.860×10-7 mol·L-1.一旦与Fe3+结合, 8对H2PO4-显示出较高的选择性.此外, 在生成的8-Fe3+配合物中加入H2PO4-后可以恢复原来的荧光, 产生一个开-关-开的识别模式, 在同一介质中对H2PO4-的最低检测限为1.866×10-7 mol·L-1.
2015年Wei等[35]设计了一个能够在含水体系中紫外荧光双通道检测Ag+离子的传感器9 (Scheme 1), 该传感器以吩嗪作为信号报告基团, 以咪唑上的氮原子和呋喃环中的氧原子为键合位点.传感器9对Ag+的紫外和荧光最低检测限分别为4.07×10-7和3.84×10-7 mol·L-1, 并且该识别过程不受其他竞争金属离子的影响.另外, 传感器9可以作为一个在荧光上可循环检测Ag+离子的传感器.同时, 作者制备了该传感器的检测试纸, 该试纸能够方便快捷地检测溶液中Ag+的存在.
1.1.2 阴离子识别
2008年Shive等[36]设计合成了两种基于吩嗪脲和吩嗪硫脲衍生物的阴离子传感器10和11, 这两种传感器在纯的DMSO溶液中能够裸眼比色检测F-, AcO-以及H2PO4-离子.当分别在传感器10和11的DMSO溶液中加入一定量的上述三种阴离子时, 10和11的DMSO溶液颜色均由淡黄色变为深红色.在相应的紫外光谱中, 主体10在400 nm处的吸收峰红移至500 nm处, 而主体11在400 nm处的吸收峰红移至525 nm处.
2013年Zhang等[37]报道了一种以吩嗪为信号报告基团的阴离子传感器12, 该传感器能够在乙腈溶液中高选择性地紫外和荧光双通道识别F-离子, 并且其它竞争的阴离子对F-离子的检测没有干扰.传感器12对F-离子的最低检测限为8.62×10-5 mol·L-1.另外并且作者通过核磁滴定证明受体分子对F-离子的可能的识别机理为去质子化作用.
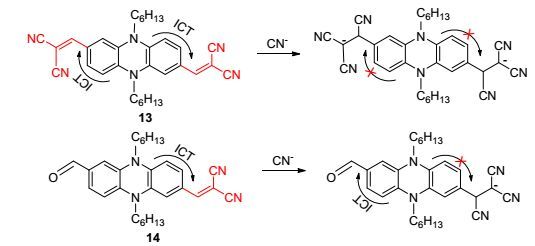
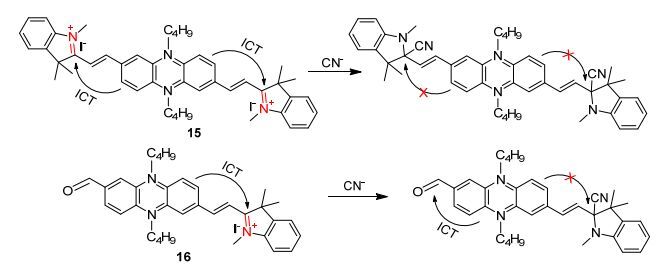
2013和2014年Hua等[38, 39]先后设计合成了两类能够识别CN-离子的传感器分子, 传感器13和14 (Scheme 2)以及15和16 (Scheme 3)分别以二氰基乙烯基和N-甲基吲哚基为识别位点和吸电子基.传感器14中一个二氰基乙烯基和16中一个N-甲基吲哚基被不容易起化学反应的甲酰基取代, 并且该基团也可以作为吸电子基.传感器13与CN-离子发生双边反应后阻断了ICT过程, 从而产生了荧光猝灭效应.由于探针14只有单边的ICT识别过程从而对CN-离子产生了显著的比色和比率近红外荧光的响应.在传感器15和16中, 由于电子从吩嗪供体转移到吲哚受体使这两个传感器分子在原始状态下没有荧光.在传感器15中加入氰离子后, 分子内电荷转移减少和消失导致580 nm处的荧光发射峰显著增强.由于传感器分子16识别氰离子的过程是在单边进行的, 分子内电荷转移的取向被重新定向, 因在630 nm处的荧光发射峰显著增强.因此, 化合物14和16可以作为两类较好的反应型比率荧光识别氰离子的传感器.
2013年Zhang等[40]通过两步反应成功合成了两个氮杂苯并传感器17和18. 17可以作为F-和H2PO4-的高效阴离子传感器, 而17可以在10种不同的阴离子(F-, I-, PF6-, HSO4-, Cl-, Br-, AcO-, NO3-, BF4-和H2PO4-)中单一地选择性检测F-离子.当在18的DMSO溶液中加入F-后溶液的颜色由粉红色变为褐绿色, 紫外光谱上的525和575 nm处的吸收峰显著降低, 而在455, 675以及750 nm处分别出现了三个新的吸收峰, 当在17的DMSO溶液加入H2PO4-时溶液的颜色由粉红色变为褐棕色, 在相应的紫外光谱中出现了三个与加入F-后相似的新的吸收峰, 在525和575 nm处的吸收峰没有完全消失.当在18的DMSO溶液中加入F-后在525 nm处的吸收峰降低, 在475, 685以及750 nm处出现三个新的吸收峰, 溶液的颜色由粉红色变为褐棕色.
2015年Yoon等[41]设计合成了咪唑啉-2-硫酮探针19 (Eq. 4), 该传感器以吩嗪为信号报告基因, 咪唑啉-2-硫酮为识别位点.没有荧光的探针19可在水中与OCl-离子通过特殊的反应得到相应的有荧光的咪唑鎓盐, 该探针对OCl-的最低检测限可达0.071 μmol·L-1.其它共存活性氧, 包括H2O2, NO·, ROO·, ONOO-, ·OH, 和叔丁基过氧化物对OCl-的识别没有干扰.
2016年Wei等[42]设计合成了一种基于二羟基吩嗪荧光打开的CN-离子传感器20 (Scheme 4).该传感器在水中对CN-离子显示出较高灵敏度和较好的选择. CN-离子的响应机理涉及了氢键和去质子化过程, 从而引起传感器20的荧光显著增强.传感器20对CN-的最低检测限为5.65×10-7 mol·L-1, 其他阴离子对CN-离子的检测几乎没有影响.此外, 我们制作了基于传感器20的试纸, 该试纸对水中CN-的检测表现出良好的选择性.值得注意的是, 该传感器已被成功应用于食品样本中CN-的检测, 这一新颖的识别特性使传感器在生物、医药等领域具有非常重要的应用价值.
2017年Wei等[43]设计合成了一种新型的咪唑并吩嗪内酰胺荧光传感器21.该传感器在DMSO溶液中发出亮黄色荧光, 当CN-加入到传感器21的DMSO溶液中, 溶液的荧光光谱发生明显的下降并伴有红移, 在365 nm荧光灯下溶液的颜色由黄色变为橘红色, 其它离子的加入对传感器21的DMSO溶液没有产生类似的变化.另外, 传感器21对CN-的荧光最低检测限为9.96× 10-7 mol·L-1.此外, 作者将21负载于固态硅胶之上, 制备了固体CN-识别材料, 并成功将其用于对固体NaCN的识别和对CN-水溶液的检测.
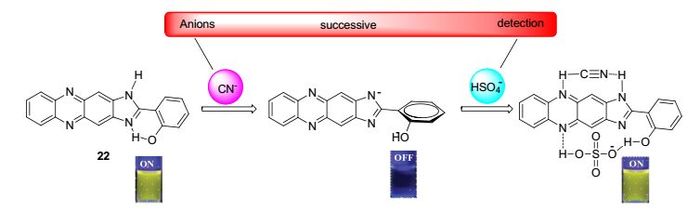
2016年Wei等[44]设计并合成了基于吩嗪衍生物的传感器22 (Scheme 5).该传感器可以高灵敏度地在含水体系中连续检测CN-和HSO4-.当在传感器22中加入CN-的水溶液时, 传感器22的溶液颜色立即从黄色变为橙色, 与此同时, 溶液的黄色荧光完全猝灭.更有趣的是, 在含有CN-的传感器22的溶液中加入HSO4-后, 溶液的颜色和荧光可以恢复.并且其他阴离子的加入不能引起类似的变化.另外, 22对CN-和22+CN-对HSO4-的最低检测限分别为8.90×10-8和1.46×10-10mol·L-1.值得注意的是, 传感器22的这种连续响应特性使得它在水溶液中对CN-和HSO4-的检测具有潜在的应用.
2016年Wei等[45]开发了一个基于Zn2+-吩嗪席夫碱配合物的传感器23-Zn2+ (Scheme 6), 该传感器能够紫外和荧光双通道识别氰离子.氰离子在含水介质中通过除去传感器23-Zn2+的Zn2+而产生溶液颜色的变化(从红色变为浅黄色)和打开的荧光响应信号.同时, 该传感器对氰离子的灵敏度低于世界卫生组织规定的饮用水中氰离子的最大允许水平.此外, 制作了基于传感器23-Zn2+的可以方便和有效检测CN-的试纸.值得注意的是, 23-Zn2+可以用来选择性检测发芽土豆中的氰化物.因此, 该传感器在含水介质中检测微摩尔水平的氰离子具有潜在的应用价值.
2016年Wei等[46]设计并合成了基于吩嗪衍生物的紫外-荧光双通道传感器24.该传感器可以在水溶液中高灵敏度和高选择性地检测CN-离子.当将CN-离子的水溶液加入到传感器24的溶液中时, 溶液的颜色由黄色变为橘色并且黄色荧光猝灭, 其它阴离子的加入不会产生类似的变化.传感器24对CN-的荧光光谱最低检测限为5.0×10-8 mol·L-1.此外, 作者制作了基于传感器24的试纸, 可以用来方便和有效地检测水溶液中的CN-离子.
1.2 中性分子识别
中性分子识别是指受体和特定物种是在分子水平上通过分子间弱相互作用发生选择性结合进而引起体系分子结构及某种特定属性变化的过程.中性分子识别是分子识别的一个研究难点, 一般情况下它们所处的环境比较复杂, 并且很多中性分子与受体分子作用的位点较少, 因此开发能够识别中性分子的传感器是化学研究中的一大难点.由于吩嗪衍生物具有多个配位点及较强的配位能力, 容易形成氢键和π-π堆积作用, 自身可作为一种较好的信号报告基团, 使它在中性分子识别领域占有相当大的优势. 2010年Nagano等[47]开发了一系列基于偶氮苯衍生物的对缺氧灵敏的近红外的荧光探针25~27.这些探针以偶氮基团作为识别位点, 如图 5所示, 在缺氧条件下偶氮官能团的N=N键通过一系列酶化反应发生裂解.探针25~27由一个近红外的二碳花青染料和一个荧光猝灭剂通过偶氮官能团相连而成.在含氧量正常的情况下, 偶氮基不能断裂, 因此花青染料的荧光保持着猝灭的状态, 这是由于荧光共振能量转移使荧光淬火.在缺氧的条件下, 由于偶氮基的断裂使荧光猝灭剂减少, 使花青染料和猝灭剂之间的荧光共振能量转移过程被破坏, 使近红外的花青染料的荧光明显增强.从而对缺氧达到近红外荧光响应.
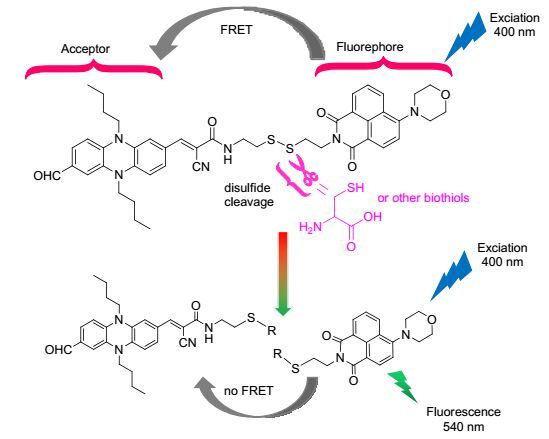
2015年Hua等[48]设计合成了一个高效的能够检测半胱氨酸的荧光传感器28, 该传感器分子通过二硫键连接将两个荧光基团萘酰亚胺和吩嗪衍生物, 并且在该传感器分子中二硫键还作为识别位点.传感器28在初始状态下没有荧光的原因是发生了分子内的荧光共振能量转移(FRET)过程, 该过程是由萘酰亚胺的发射光谱和吩嗪的吸收光谱的重叠而引起.如图 6所示, 当在传感器28中加入半胱氨酸时, 半胱氨酸与二硫键之间通过特殊的反应使二硫键断裂, 从而消除了FRET过程, 使传感器分子在540 nm处的荧光明显增强, 从而实现了在同型半胱氨酸、谷胱甘肽存在的条件下对半胱氨酸高灵敏度和高选择性的识别.
2015年Schneebeli等[49]将手性辅助合成作为一个有效的方法来精确控制大分子的带状结构, 设计合成了吩嗪衍生物的C型带状大分子29和30.这两种带状分子29和30通过π-π堆积作用和疏水效应绑定到柱5芳烃空腔的外部形成一种新型的超分子配合物.这种超分子配合物可以利用柱5芳烃的中央空腔来检测二(辛)紫罗碱二溴化物.将这种带状分子绑定到柱5芳烃空腔外部可以增加缺电子客体与柱芳烃空腔之间的亲和力.这些研究结果不仅提供了一种可以精确控制纳米结构的新合成方法, 而且传统的大环主体成为客体, 甚至预先合成的更大的材料成为客体, 还打开了一扇增强超分子相互作用的门.
2016年Hua等[50]设计合成了一个以琥珀酰亚胺为封端基的吩嗪衍生物31 (Eq. 5), 该化合物能够以近红外识别半胱氨酸.当在受体分子31中加入半胱氨酸时, 溶液的颜色从墨绿色变为橙色, 在相应的紫外光谱上的616 nm处的吸收峰消失.在荧光光谱上的近红外发射峰(670 nm)增强.动态反应证明, 氰乙酸基容易被SH基通过迈克尔加成反应快速进攻.被高度活化的氨基(NH2)以及NHS活性的羰基可以靶向进攻氨基酸, 并且可以加速SH基的亲核进攻过程.核磁滴定表明可能的识别机理是发生了α, β-不饱和羰基环加成反应.此外, 由于其良好的生物相容性, 它被成功地应用到在海拉细胞中用近红外荧光信号检测半胱氨酸.
2016年Zhang等[51]成功地合成了一种可以在其他缺电子化合物或者强酸存在的条件下识别苦味酸的荧光探针32 (Eq. 6).该探针以吩嗪单元为信号报告基团, 咪唑上的氮原子为识别位点.该探针的乙醇溶液在525 nm处有一个较强的发射峰, 并且溶液在365 nm荧光灯下呈亮绿色, 当在该溶液中加入缺电子化合物或者强酸时, 只有苦味酸的加入使荧光发射峰迅速消失, 并且使溶液的荧光猝灭.此外, 探针32对苦味酸的最低检测限可达2.4×10-7 mol·L-1.
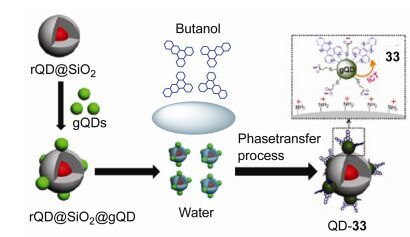
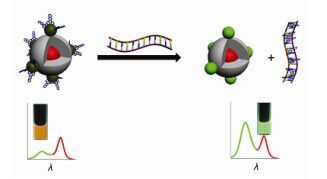
对生物大分子的识别在很大程度上加大了化学传感器的设计难度, 因此用有机小分子作为传感器来识别生物大分子也相对较为罕见, 但是在研究者的不断努力下, 一些可参与到生物大分子识别过程中吩嗪衍生物也被设计和合成出来, 并且在识别过程中起到至关重要的作用. 2016年Sun等[52]开发了一个概念验证的量子点-配体(QD-33)体系, 该体系通过结合比率荧光技术可肉眼选择性检测核酸.该体系包含一个双发射的量子点纳米复合物, 该纳米复合物是由一个红色发射量子点(rQD)嵌入二氧化硅纳米颗粒内部和绿色发射量子点(gQDs)静电组装到二氧化硅表面组成, 将该纳米复合物作为信号报告基团.疏水化合物二吡啶并[3, 2-a:2', 3'-c]吩嗪(33)通过相转移过程附加到gQDs表面, 作为gQDs的配体和荧光猝灭剂(图 7). QD-33体系已成功被应用到双链DNA (dsDNA)的检测中.因为双链DNA可与配体33紧密结合, 从而破坏体系QD-33, 使33从gQDs的表面被置换下来, 并且使gQDs的荧光恢复.由于嵌入的rQDs的荧光保持不变, 双发射荧光的颜色从橙色变为亮绿色, 可以通过裸眼清楚地观察到(图 8).因此, 体系QD-33提供了一个非常简单但普遍的策略以方便、灵敏和具体的方式检测核酸.
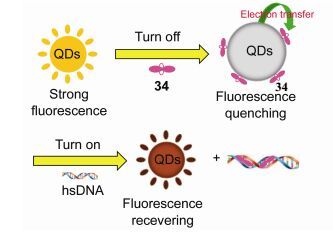
2016年He等[53]开发了一个由量子点(GSH-CdTe QDs)和吩嗪染料34组装的双发射的荧光生物传感器(QDs-34), 该传感器可用于检测鲱鱼精的DNA (hsDNA). GSH-CdTe QDs与34通过电荷转移过程结合使GSH-CdTe QDs的荧光猝灭.由于DNA与34有较高的亲和力可以将34从GSH-CdTe QDs的表面置换下来, 使GSH-CdTe QDs的荧光恢复.该传感器对hsDNA的检测表现出良好的灵敏度和选择性, 最低检测限可以达到10.8 ng/mL, 此外, 无论是生物相关的金属离子、常见有机化合物还是氨基酸对hsDNA的检测没有显著的干扰(图 9).
2 基于吩嗪类衍生物的超分子自组装
超分子自组装作为超分子化学在弱相互作用中另一个重要的研究内容, 它是超分子在实际应用中的重要的基础.超分子自组装是指一个或多个物种(分子或离子)之间通过一种或多种协同的非共价键弱相互作用(范德华力、氢键、π-π堆积、卤键、阳离子-π、离子键、CH-π和溶剂化作用等)自发地聚集成特定结构和功能的超分子组装体的过程[54].这些弱相互作用很容易受到外界环境的影响, 因此, 外界环境的导向作用也是影响超分子自组装的一个重要方面.由于吩嗪及其衍生物分子具有多个配位点和较大的共轭体系(含有缺电子的π体系, 带有孤对电子的氮原子以及三个稠合芳环), 使其在超分子自组装中得到广泛的应用.对吩嗪及其衍生物形成的特殊的自组装形态功能的研究将有助于实现其在医药、生物化学、材料、信息等多种高新前沿领域的应用.
2.1 自组装的驱动力类型
2.1.1 氢键作用诱导的自组装
氢键作用诱导的自组装一般在两个或两个以上的分子间发生, 并且在体系中可以形成多重氢键. A—H…B为氢键的基本构成, 其中A和B原子的电负性远大于H原子的电负性, 例如氧族元素(N和O原子)和卤族元素(F, Cl和Br原子)等.对于单重氢键来说氢键的强度依赖于A和B原子之间的电负性差异和原子半径的大小, 原子间的电负性差异越大则形成的氢键越强, 原子半径相差越大则形成的氢键也会越强.然而, 多重氢键中氢键强度主要依赖于原子的种类和形成的几重氢键的重数等.由于吩嗪及其衍生物结构中含有未配位的N原子, 使其可与其它分子之间形成单重或多重氢键[55]. 2007年Hiroyuki等[56]研究了两种化合物(吩嗪-氯冉酸和吩嗪鎓盐-氢氯冉酸盐)形成的晶体的微观结构.研究发现, 吩嗪和氯冉酸通过两种不同的O—H…N氢键交替排列, 并且沿氢键方向形成了一个超分子链35, 在链状结构中可以观察到35中存在分子间氢键C—H…O和分子内氢键O—H…O.氯冉酸分子给吩嗪提供一个氢质子后形成两种盐, 即吩嗪鎓盐和氢氯冉酸盐, 这两种离子通过两种氢键N—H…O和O—H…N连接, 并且沿氢键方向形成了另一个超分子链36.
2012年Hung等[57]设计了由吩嗪和香草醛形成的1:2的共晶, 可用于选择性移除香草醛.研究发现, 在吩嗪-香草醛形成共晶体中, 两个香草醛分子分布在吩嗪分子平面的两侧, 通过O—H…N氢键与吩嗪分子的两个氮原子相连形成超分子组装体37.
2014年Franz等[58]利用X射线晶体学研究了硅烷二醇[R2Si(OH)2]与双官能团杂环化合物之间通过自缔合和氢键诱导的超分子组装现象.研究发现, 在硅烷二醇形成的氢键单晶中, 硅烷二醇自缔合形成一个环状的供体-受体的双重氢键二聚体, 剩余的两个外部的氢质子被酸化后作为一个路易斯碱的氢键供体与一个中性的路易斯碱之间形成交替的氢键.在本文中作者选取二(2, 4, 6-三甲苯基)硅烷二醇和吩嗪形成的共晶为研究对象, 吩嗪作为一个刚性间隔以2:1比例与硅烷二醇通过氢键连接构建了一个超分子无限链38.
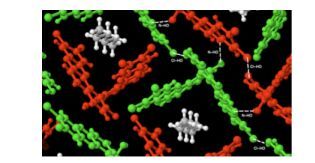
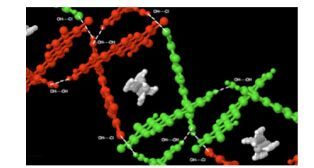
2014年Kozlowski等[59]合成了一些具有手性轴的二苯并吩嗪, 研究发现, 具有一个手性轴的四氯化二苯并吩嗪39在链状烷烃的诱导下, 在固态时发生了从无序的非晶形式到有序的多晶形式的转变.这种相变是由孔隙的形成引起的, 微分扫描量热法表明形成的孔隙通过强的亲和力容纳不同长度的线性烷烃链. X射线单晶衍射分析表明这一系列弱的氢键O—H…Cl决定了孔隙结构. 图 10和11分别是39·己烷的和39·十三烷的单晶结构, 分子间由弱的O—H…Cl—C氢键连接起来形成了一个封装烷烃分子的网络结构.
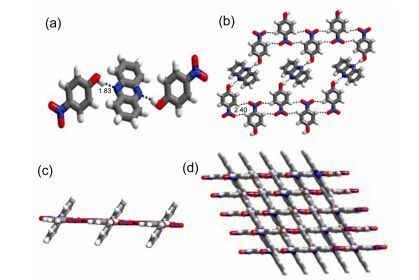
2016年Pedireddi等[60]合成了4-硝基苯酚和各种氮杂化合物的共晶, 并通过X射线单晶衍射法对其结构进行表征.所有的共晶分子间形成了一种紧密的堆积, 这是由于组成共晶的分子间形成了十字链的网状结构.在此, 我们以4-硝基苯酚和吩嗪形成的共晶为例, 4-硝基苯酚和吩嗪之间形成了2:1的配合物.吩嗪分子的氮原子给酚类基团参与简单的分子识别过程提供了一个键合位点.组分之间基本的识别过程是通过形成氢键O—H…N实现的, 从而得到一个三聚物单元, 如图 12a所示.晶格的分子堆积表明, 分子在二维上以层状方式排列.进一步对层状排列结构分析表明, 三聚物单元通过与含有氧原子的NO2基团相互作用与4-硝基苯酚形成四重C—H…O氢键, 使得4-硝基苯酚通过吩嗪分子彼此连接形成一个超分子链(图 12b).在这些层排列中, 吩嗪与4-硝基苯酚的链不在同一个平面上, 它们平面间成56.68°的角(图 12c).共晶在三维空间上显示出交叉的层状网络结构, 如图 12d所示.
2.1.2 堆积作用诱导的自组装
堆积作用通常发生在有共轭结构的缺电子和富电子体系之间, 形成π-π堆积的两个体系之间在空间上有三种比较典型构型, 即面对面型(face-to-face)、边对面型(edge-to-face)以及偏移堆积型(offset stacked).嗪及其衍生物具有缺电子的π体系以及较大的共轭结构, 它可与自身及其它具有共轭体系的分子之间产生π-π堆积作用. 2015年Rau等[61]合成并研究了一系列钌配合物的晶体结构, 其中40和41在固态时显示出的一种二聚体结构, 这种结构是由π-π相互作用形成. 40在固态下的二聚体沿吡啶-吩嗪平面显示出一种π-π相互作用(图 13, a).而41的二聚体拥有两种不同于40的π相互作用——堆积的吡啶—吩嗪平面两侧的苯环之间发生相互作用.与40相同的π相互作用是沿吡啶-吩嗪平面的π-π相互作用(图 13, b), 另外两种是在每个苯基-苯基相互作用中有一个C—H…π作用(图 13, c). 41中的这三个π相互作用(一种π-π和两种CH-π)与40中仅有一种π-π相互作用相比是一种不同的聚集方式.
 图13
(a) 40在固态下的阳离子二聚体的分子结构、(b) 41在固态下的二聚体的分子结构及(c)两个二聚的41的苯环间的C—H…π相互作用的详视图
Figure13.
(a) Molecular structure of a cation dimer 40 in the solid state, (b) molecular structure of a cation dimer of 41 in the solid state and (c) detailed view on the C—H…π contact between the phenyl-rings of two dimerized 41
图13
(a) 40在固态下的阳离子二聚体的分子结构、(b) 41在固态下的二聚体的分子结构及(c)两个二聚的41的苯环间的C—H…π相互作用的详视图
Figure13.
(a) Molecular structure of a cation dimer 40 in the solid state, (b) molecular structure of a cation dimer of 41 in the solid state and (c) detailed view on the C—H…π contact between the phenyl-rings of two dimerized 41
2015年Eduardo等[62]设计合成了一系列N杂环的铱配合物, 用X射线衍射研究了含有吩嗪基团的配合物42的单晶结构.分子的晶体堆积表明, 双分子之间存在一个一维的π堆积作用, 且两个分子以反向平行中心对称的方式分布, 分子间距离为3.37Å(图 14).
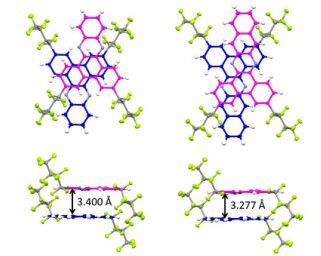
2015年Haoran等[63]研究了一系列文献中报道的全氟丁基取代的含有N的芳香族化合物43~45的晶体结构, 其单晶结构表明化合物具有层状的π-π叠加堆积方式, 并且晶面间距可以通过融合含有N的芳烃与不同大小的π-共轭结构来调节.单晶结构和理论计算都表明晶面间距可通过π共轭的大小来调控, 较大的π共轭有助于形成较短的晶面间距但仍然维持层状的π-π叠加堆积方式, 可以通过特定的立体效果改变全氟烃基取代基的位置和样式来优化分子的拓扑结构, 专一地形成层状π-π积的结构.化合物43和45为结构异构体, 作者通过研究还发现化合物43显示出一个完美的π-π叠加层状的晶体堆积方式, 并且相邻芳环间的晶面间距为3.400 Å.而化合物45相邻芳环间的晶面间距为3.416 Å比化合物43的晶面间距大, 这是由于化合物43的全氟丁基基团的位阻较低.化合物45显示出一个轻微扭曲的整体晶体堆积方式, 在晶体结构中可以观察到是通过一个局部的π-π叠加结构形成.这样一个扭曲的堆积图, 某种程度上是由于附近没有较大的全氟丁基取代的芳核边缘的sp2杂化的C—H偶极-π相互作用.相比之下, 化合物43中的sp2杂化的C—H偶极子较少, 由于附近的全氟丁基基团的位阻抑制了sp2杂化的C—H偶极-π相互作用的形成.两种化合物这些简单的空间模型清楚地表明这两种化合物之间形成sp2杂化的C—H偶极-π相互作用不同的可能性.因此, 化合物43形成sp2杂化的C—H偶极-π相互作用的可能性更低, 更倾向于形成T型分子堆积图(图 15).化合物44显示完美的π-π堆积层状结构, 晶面间距为3.277 Å.化合物43与化合物44的堆积图非常相似, 可以看出增加π共轭有助于减少晶面间距(图 16).
2.1.3 金属-配体作用诱导的自组装
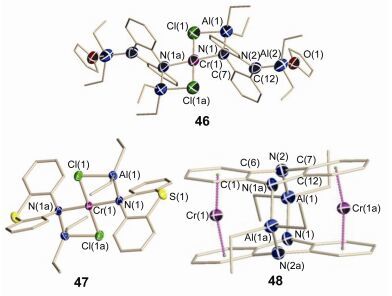
金属-配体作用主要指金属原子和有机分子(配体)之间通过分子间弱相互作用形成金属有机配合物的过程.吩嗪及其衍生物分子具有大的离域π体系, 能与过渡金属发生大量电荷转移的相互作用, 从而形成具有特定形态的超分子配合物. 2013年Budzelaar等[64]研究了吩嗪和吩噻嗪分别与烷基铝-铬盐相互作用形成杂金属Al-Cr配合物的晶体结构.当用4 equiv.的三乙基铝处理悬浮在丙酮中的吩嗪和CrCl2(THF)2时, 可以得到五核的杂双金属二价的配合物46.在该配合物中吩嗪配体的两个氮原子与三个金属相连接.利用吩噻嗪发生类似的反应得到三金属的配合物47, 但是在该过程中硫原子没有发生配位.在制备47的过程中, 加入过量的三乙基铝时发生了不同的反应得到配合物48.铝酸残留物支撑两个平行并且重叠的吩嗪分子, 形成一个刚性笼并且封装了两个铬原子.化合物46, 47和48的单晶结构如图 17所示.
2015年Himmel等[65]第一次合成了胍基取代的嗪衍生物49, 并且详细研究了它的结构和电子特性. 49的荧光信号峰强烈依赖于溶剂的极性, 荧光信号峰分布在515 nm(乙醚)到640 nm(水中)之间.随后, 作者着重分析了吩嗪在荧光体系下的电子配位特性, 配位首先发生在胍基并且导致发射峰蓝移以及发光寿命巨大的减少.当向化合物49的乙腈和二氯乙烷的两种溶液中分别加入2 equiv.的CuI后得到配合物[49(CuI)2], 两种溶液分别在533和519 nm处的光学信号峰几乎完全猝灭. 49与2 equiv.的ZnCl2反应得到结构确定的双核配合物[49(ZnCl2)2](图 18), 该配合物在乙腈和二氯乙烷中的最大发射峰分别在506和512 nm处, 与50在这两种溶液中最大发射峰533和519 nm相比均发生蓝移.当往[49(ZnCl2)2]的二氯乙烷溶液中逐渐加入ZnCl2时, 溶液的颜色逐渐由黄色变为紫色.在相应的紫外光谱中, 486 nm处的吸收峰和459 nm处的肩峰下降, 581 nm处的吸收峰和543 nm处的肩峰增强.这是由于过量的ZnCl2与配合物[49(ZnCl2)2]中吩嗪的N原子键合后得到低聚物的链和环(图 19).将49与2.5 equiv.的ZnCl2反应后得到配合物[(49)2(ZnCl2)5], 并且在CH2Cl2-Et2O混合溶剂中得到该配合物的紫色的单晶, 晶体结构如图 18.
2.1.4 多种作用力协同作用诱导的自组装
通常具有π-共轭体系的分子形成的复杂超分子和比较稳定的聚集体是在π-π堆积和其他作用力的共同作用下形成的.吩嗪衍生物含有缺电子的π体系, 带有孤对电子的氮原子以及较大的共轭体系通常可与其它分子之间在多种弱相互作用协同作用下形成特定结构和功能的超分子组装体.
2.1.4.1 氢键和π-π堆积协同作用
由于吩嗪具有较大的共轭体系并且结构中含有带孤对电子的N原子, 通常它与其它分子之间的超分子自组装是在氢键和π-π堆积协同作用下完成. 2017年Wei等[66]合成了一种咪唑并吩嗪衍生物, 并通过X射线单晶衍射法对其结构进行表征.其晶体结构表明两个分子之间通过π-π作用反向平行堆积, 并且咪唑上的H原子与下一个堆积体中吩嗪的N原子之间通过氢键N—H…N使分子在空间内形成一个超分子链, 如图 20所示.通过扫描电镜可以观察到其分子结构呈纺锤状.
2.1.4.2 静电作用和π-π堆积协同作用
静电作用在超分子自组装过程中也起着相当重要的作用.我们将带有电荷的不同基团之间的静电作用称之为盐键, 基团所带的电荷数越多则盐键的作用能越大, 反之亦然, 基团电荷间的距离越大则盐键的作用能越小, 反之亦然. 2014年Wang等[67]合成了两种新型的具有吩嗪单元的电子受体50和51.这两种受体可与天冬氨酸修饰的苝二酰亚胺(PASP)形成电子受体-供体配合物, 并且具有稳定的缔合常数Ka (2.94×104和1.30×104 L·mol-1).研究发现溶剂极性、电子接受能力以及吩嗪衍生物的取代基对苝二酰亚胺-吩嗪配合物的键合强度有重要的影响.电化学、电子顺磁共振以及荧光时间响应等分析表明, 苝二酰亚胺与吩嗪衍生物之间发生了光诱导电子转移过程.因此, 苝二酰亚胺与受体50和51形成的针状和棒状的纳米结构是由供体与受体之间通过静电作用和π-π堆积协同作用共自组装形成(图 21).
2.1.4.3 疏水效应和π-π堆积协同作用
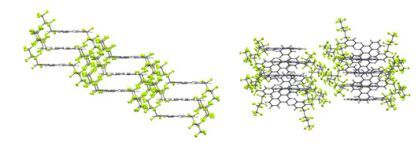
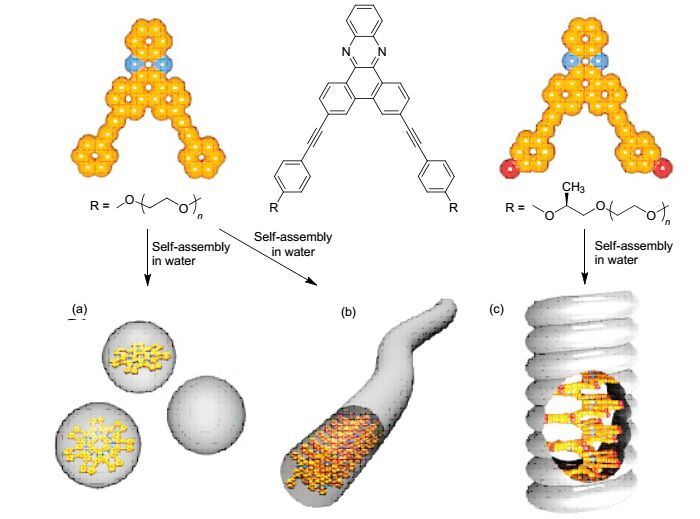
具有π-共轭结构的化合物通常都具有疏水作用, 因此, 在π-共轭结构中引入侧链或着亲水性基团可使π-共轭结构分子表现出两亲性.两亲性分子在不良溶剂(水)中疏水端聚集在一起以减少与水分子的接触, 而亲水端则伸展到溶剂中来增大两亲性分子在不良溶剂中的溶解性.在良性溶剂中两亲性分子分散成“单分子”状态.由此, 在水不同结构的两亲性π-共轭结构分子可以自组装形状各异的纳米超分子结构. 2015年Jin等[68]合成了一系列两亲性分子52~56, 这些分子包含了一个由一个二苯并[a, c]吩嗪单元和苯基相连形成的刚性部分, 并且包含了聚合度为6, 8和12的聚环氧乙烷的柔性链.并通过差示扫描量热法(DSC)、热光学偏振显微镜(POM)、小角X射线散射(SAXS)、紫外和荧光光谱、透射电子显微镜法(TEM), 圆二色谱(CD)以及原子力显微镜(AFM)研究了它们在水溶液中的聚集行为.分子52~54具有不同的聚环氧乙烷盘旋链, 在固态时自组装成斜柱状结构.在水溶液中, 分子52(具有6个聚合度)自组装成球立状, 然而, 分子53, 54和56(具有比分子52更长的盘旋链)根据不同的聚环氧乙烷链的长度, 显示出形成圆柱状胶束或不同长度胶束的自组装能力(图 22和23).有趣的是, 将侧甲基合并到分子55, 56盘旋链上, CD实验和透射电镜显示出这些分子自组装成螺旋状纤维.这些结果表明侧甲基致使螺旋杆段的形成(图 24).
2016年Wei等[69]设计了基于1, 4二乙氧基柱5芳烃(EtP5A)和吩嗪衍生物57的可运动的准2轮烷.由于分子内驱动力如π-π堆积、疏水作用以及C—H…π作用的存在使吩嗪轴单向穿入柱芳烃轮内.并且通过核磁滴定研究发现, 在吩嗪衍生物和柱芳烃溶液中增加柱芳烃的浓度, 可以使柱芳烃的轮逐渐向吩嗪衍生物轴上的咪唑部分移动, 如图 25所示.
2.2 外界环境的导向作用诱导的自组装
外界环境的导向作用诱导的自组装主要是分子间的弱相互作用受到外界环境的改变而发产生变化促使分子自组装过程的发生, 主要诱导因素包括pH值、温度以及溶剂的构成.
2.2.1 溶剂构成
2015年Robins等[70]研究了取代基位置在设计低分子量π-有机凝胶因子中的重要性.将缺电子的NO2取代基系统地添加到新型的T形吩嗪分子上以检测电子和组装的性质.通过紫外可见光谱和循环伏安法表征电子的性能, 并且做了NO2基团的数目和位置的比较.结果表明, NO2位置最明显的影响是两个分子具有四个NO2基团, 并且被放置在分子的不同位置.有趣且意想不到的是, 58和59的光物理性质和依赖溶剂的凝胶特性大不相同. 58显示出一种独特的荧光溶剂化显色效应, 荧光强度对溶剂极性有极大的依赖, 这个结果表明分子内发生了电荷转移(图 26).然而, 并没有观察到59的荧光溶剂化显色效应. 58的凝胶当溶剂从乙腈变为乙酸乙酯再变为环己烷时产生着色异常现象, 颜色从绿色变为黄色再变为橘色(图 27).凝胶59在这些溶剂中不会显示出与凝胶58相似的性质.用电场发射扫描电镜检测58和59在不同溶剂中的形态, 发现58的形态在不同溶剂中有显著的差异, 而59的形态在不同溶剂中没有发生明显的变化(图 28).我们得出的结论是, 在设计有机凝胶因子有效的分子时不单要考虑取代基的数目, 而且取代基位置对这些体系的某些基本性质有着较大的影响.
2.2.2 pH效应
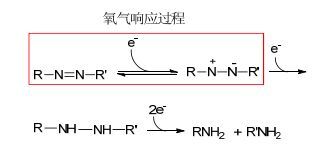
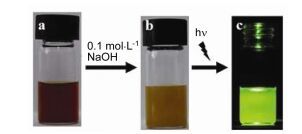
2014年Han等[71]在有CuCl2和合适浓度的NaCl存在的条件下开发了一个调控聚邻苯二胺(60)纳米微观结构的方法.氯化铜的作用是将邻苯二胺氧化为低聚物. NaCl有助于调节低聚物之间的非共价相互作用.通过控制NaCl和邻苯二胺单体的浓度可以得到聚邻苯二胺各种形态的结构.如图 29所示, 当引入低浓度的氯化钠溶液时其微观结构呈蝴蝶结状, 而引入高浓度的氯化钠溶液时其的微观结构呈超长带状, 当邻苯二胺的浓度较高时它的微观结构呈簇状.研究发现, 由于去质子化的作用溶液的酸性可以影响聚邻苯二胺的形态和光学特性(图 30).没有荧光的带状的聚邻苯二胺用碱处理后会发出强的荧光(图 31).基于这些性质作者开发了一个聚邻苯二胺纳米带的pH传感器.
 图29
样品1 (oPD/0.017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/ 0.083 mol·L-1)、样品2 (oPD/0.017 mol·L-1, NaCl/1.03 mol· L-1, CuCl2/0.083 mol·L-1)、样品3 (oPD/0.033 mol·L-1, NaCl/ 2.06 mol·L-1, CuCl2/0.083 mol·L-1)和样品4 (oPD/0.0017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1)的扫描电镜照片
Figure29.
SEM images of sample 1 (oPD/0.017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1), sample 2 (oPD/0.017 mol·L-1, NaCl/1.03 mol·L-1, CuCl2/0.083 mol·L-1), sample 3 (oPD/0.033 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1), and sample 4 (oPD/0.0017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1), respectively
图29
样品1 (oPD/0.017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/ 0.083 mol·L-1)、样品2 (oPD/0.017 mol·L-1, NaCl/1.03 mol· L-1, CuCl2/0.083 mol·L-1)、样品3 (oPD/0.033 mol·L-1, NaCl/ 2.06 mol·L-1, CuCl2/0.083 mol·L-1)和样品4 (oPD/0.0017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1)的扫描电镜照片
Figure29.
SEM images of sample 1 (oPD/0.017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1), sample 2 (oPD/0.017 mol·L-1, NaCl/1.03 mol·L-1, CuCl2/0.083 mol·L-1), sample 3 (oPD/0.033 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1), and sample 4 (oPD/0.0017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1), respectively
3 结论与展望
我们总结了近年来吩嗪衍生物在分子识别和超分子自组装中的应用进展, 不同类型的超分子组装体和不同的识别性能与吩嗪衍生物的结构有着密切的关系.具有多个配位点、较强的配位能力以及容易形成π-π堆积作用和氢键等特点的吩嗪衍生物使其在分子识别及自组装体系的构筑上有着重要应用.通过对吩嗪衍生物主体分子和客体分子的有效设计, 可形成适宜结构的超分子化合物, 用于晶体工程和超分子等方面新材料的合成以及分子的识别.吩嗪类衍生物为新合成功能性材料开辟了新的途径, 因而具有广阔的发展空间, 并且将会应用到更多领域.
-
-
[1]
Chowdhury, G.; Sarkar, U.; Pullen, S.; Wilson, W. R.; Rajapakse, A.; Fuchsknotts, T.; Fuchs-Knotts, T.; Gates, S. Chem. Res. Toxicol. 2012, 25, 197. doi: 10.1021/tx2004213
-
[2]
Saleh, O.; Bonitz, T.; Flinspach, K.; Kulik, A.; Burkard, N.; Mühlenweg, A.; Andreas, V.; Stefan, P.; Michael. L.; Bertolt, G.; Hans-Peter, F.; Lutz, H. Med. Chem. Commun. 2012, 3, 1009. doi: 10.1039/c2md20045g
-
[3]
Zhi, X.; Yang, C.; Zhang, R.; Hu, Y.; Ke, Y.; Xu, H. Ind. Crops Prod. 2013, 42, 520. doi: 10.1016/j.indcrop.2012.06.045
-
[4]
Marler, L.; Condasheridan, M.; Cinelli, M. A.; Morrell, A. E.; Cushman, M.; Chen, L.; Huang. K.; Van, B. R.; Pezzuto, J. M. Anticancer Res. 2010, 30, 4873.
-
[5]
Gerardo, P.; Marco, M.; Aida, R.; Anna, A.; Astolfo, Z.; Alessio, C.; Antonio, E. Nat. Prod. Res. 2013, 27, 956. doi: 10.1080/14786419.2012.696257
-
[6]
Conda-Sheridan, M.; Udumula, V.; Endres, J. L.; Harper, C. N.; Jaramillo, L.; Zhong, H. A.; Kenneth, W. B.; Martin, C.-S. Eur. J. Med. Chem. 2016, 125, 710.
-
[7]
Koot, D.; Cromarty, D. Drug Delivery Transl. Res. 2015, 5, 257. doi: 10.1007/s13346-015-0222-6
-
[8]
Cimmino, A.; Evidente, A.; Mathieu, V.; Andolfi, A.; Lefranc, F.; Kornienko, A.; Kiss, R. Nat. Prod. Res. 2012, 29, 487. doi: 10.1039/c2np00079b
-
[9]
Cloonan, S. M.; Elmes, R. B. P.; Erby, M. L.; Bright, S. A.; Poynton, F. E.; Nolan, D. E.; Quinn, S. J.; Gunnlaugsson, T.; Williams, D. C. J. Med. Chem. 2015, 58, 4494. doi: 10.1021/acs.jmedchem.5b00451
-
[10]
Haas, D.; Blumer, C.; Keel, C. Curr. Opin. Biotechnol. 2000, 11, 290. doi: 10.1016/S0958-1669(00)00098-7
-
[11]
Laursen, J.; Nielsen, J. Chem. Rev. 2004, 104, 1663. doi: 10.1021/cr020473j
-
[12]
Bunz, U. H. F. Chem. Eur. J. 2009, 15, 6780. doi: 10.1002/chem.v15:28
-
[13]
Bunz, U. H. F.; Engelhart, J. U.; Lindner, B. D.; Schaffroth, M. Angew. Chem., Int. Ed. 2013, 52, 3810. doi: 10.1002/anie.v52.14
-
[14]
Miao, Q. Adv. Mater. 2014, 26, 5541. doi: 10.1002/adma.201305497
-
[15]
Xue, H.; Tang, X. J.; Wu, L. Z.; Zhang, L. P.; Tung, C. H. J. Org. Chem. 2005, 70, 9727. doi: 10.1021/jo051091r
-
[16]
Brombosz, S. M.; Zucchero, A. J.; Phillips, R. L.; Vazquez, D.; Wilson, A.; Bunz, U. H. F. Org. Lett. 2007, 9, 4519. doi: 10.1021/ol7020302
-
[17]
Feng, X. J.; Tian, P. Z.; Xu, Z.; Chen, S. F.; Wong, M. S. J. Org. Chem. 2013, 78, 11318. doi: 10.1021/jo401808c
-
[18]
Gill, M. R.; Cecchin, D.; Walker, M. G.; Mulla, R. S.; Battaglia, G.; Smythe, C.; Thomas, J. A. Chem. Sci. 2013, 4, 4512. doi: 10.1039/c3sc51725j
-
[19]
Yang, L.; Li, X.; Yang, J.; Qu, Y.; Hua, J. ACS Appl. Mater. Interfaces 2013, 5, 1317. doi: 10.1021/am303152w
-
[20]
Edwardson, T. G.; Lau, K. L.; Bousmail, D.; Serpell, C. J.; Sleiman, H. F. Nat. Chem. 2016, 8, 162.
-
[21]
Bisker, G.; Dong, J.; Park, H. D.; Iverson, N. M.; Ahn, J.; Nelson, J. T.; Landry, M. P.; Kruss, S.; Strano, M. S. Nat. Commun. 2016, 7, 10241. doi: 10.1038/ncomms10241
-
[22]
Rónavári, A.; Kovács, D.; Vágvölgyi, C.; Kónya, Z.; Kiricsi, M.; Pfeiffer, I. J. Basic Microbiol. 2016, 56, 557. doi: 10.1002/jobm.v56.5
-
[23]
Shi, B. B.; Zhang, Y. M.; Wei, T. B.; Lin, Q.; Yao, H.; Zhang, P.; You, X. M. Sens. Actuators, B:Chem. 2014, 190, 555. doi: 10.1016/j.snb.2013.09.043
-
[24]
Gao, G. Y.; Qu, W. J.; Shi, B. B.; Zhang, P.; Lin, Q.; Yao, H.; Yang, W. L.; Zhang, Y. M.; Wei, T. B. Sens. Actuators, B:Chem. 2014, 26, 39.
-
[25]
Li, W. T.; Wu, G. Y.; Qu, W. J.; Li, Q.; Lou, J. C.; Qu, W. J.; Yao, H.; Zhang, Y. M.; Wei, T. B. Sens. Actuators, B:Chem. 2017, 239, 671. doi: 10.1016/j.snb.2016.08.016
-
[26]
Wei, T. B.; Wu, G. Y.; Shi, B. B.; Lin, Q.; Yao, H.; Zhang, Y. M. Chin. J. Chem. 2014, 32, 1238. doi: 10.1002/cjoc.v32.12
-
[27]
张鹏, 张有明, 林奇, 姚虹, 魏太保, 有机化学, 2014, 34, 1300. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344381.shtmlZhang, P.; Zhang, Y.; Lin, Q.; Yao, H.; Wei, T. Chin. J. Org. Chem. 2014, 34, 1300(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344381.shtml
-
[28]
Bryant, J. J.; Zhang, Y.; Lindner, B. D.; Davey, E. A.; Appleton, L. A.; Qian, X.; Bunz, U. H. F. J. Org. Chem. 2012, 77, 7479. doi: 10.1021/jo3012978
-
[29]
Li, G.; Gao, J. K.; Zhang, Q. C. Asian J. Org. Chem. 2014, 3, 203. doi: 10.1002/ajoc.v3.2
-
[30]
Jardim, G. A. M.; Calado, H. D. R.; Cury, L. A.; Júnior, E. N. S. Eur. J. Org. Chem. 2015, 4, 703.
-
[31]
Qi, G.; Fu, C.; Chen, G.; Xu, S; Xu, W. RSC Adv. 2015, 5, 49759. doi: 10.1039/C5RA08009F
-
[32]
Zhou, H.; Sun, L.; Chen, W.; Tian, G.; Chen, Y.; Li, Y.; Su, J. Tetrahedron 2016, 72, 2300. doi: 10.1016/j.tet.2016.03.036
-
[33]
Zhou, H.; Mei, J.; Chen, Y. A.; Chen, C. L.; Chen, W.; Zhang, Z.; Su, J.; Chou, P. T.; Tian, H. Small 2016, 12, 6542. doi: 10.1002/smll.v12.47
-
[34]
Gao, G. Y.; Qu, W. J.; Shi, B. B.; Lin, Q.; Yao, H.; Zhang, Y. M.; Chang, J.; Cai, Y.; Wei, T. B. Sens. Actuators, B:Chem. 2015, 213, 501. doi: 10.1016/j.snb.2015.02.077
-
[35]
Li, W.-T.; Wu, G.-Y.; Qu, W.-J.; Li, Q.; Lou, J.-C.; Lin, Q.; Yao, H.; Zhang, Y.-M.; Wei, T.-B. Sens. Actuators, B:Chem. 2017, 239, 671. doi: 10.1016/j.snb.2016.08.016
-
[36]
Shive, M. S. C.; Tanuja, B.; Bhaskar, G. Tetrahedron Lett. 2008, 49, 6646. doi: 10.1016/j.tetlet.2008.09.033
-
[37]
Wang, C.; Li, G.; Zhang, Q. Tetrahedron Lett. 2013, 54, 2633. doi: 10.1016/j.tetlet.2013.03.030
-
[38]
Yang, L.; Li, X.; Yang, J.; Qu, Y.; Hua, J. ACS Appl. Mater. Interfaces 2013, 5, 1317. doi: 10.1021/am303152w
-
[39]
Yang, L.; Li, X.; Qu, Y.; Qu, W.; Zhang, X.; Hang, Y.; Ågren, H.; Hua, J. Sens. Actuators, B:Chem. 2014, 203, 833. doi: 10.1016/j.snb.2014.07.045
-
[40]
Li, G.; Wu, Y.; Gao, J.; Li, J.; Zhao, Y.; Zhang, Q. Chem. Asian J. 2013, 8, 1574. doi: 10.1002/asia.v8.7
-
[41]
Xu, Q.; Heo, C. H.; Kim, G.; Lee, H. W.; Kim, H. M.; Yoon, J. Angew. Chem., Int. Ed. 2015, 54, 4890. doi: 10.1002/anie.201500537
-
[42]
Wei, T.-B.; Li, W.-T.; Li, Q.; Su, J.-X.; Qu, W.-J.; Lin, Q.; Yao, H.; Zhang, Y-M. Tetrahedron Lett. 2016, 57, 2767 doi: 10.1016/j.tetlet.2016.05.028
-
[43]
李翔, 林奇, 曲文娟, 李乔, 程晓斌, 李文婷, 张有明, 姚虹, 魏太保, 有机化学, 2017, 37, 889. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345877.shtmlLi, X.; Lin, Q.; Qu, W.; Li Q.; Chen, X.; Li, W.; Zhang, Y.; Yao, H.; Wei, T. Chin. J. Org. Chem. 2017, 37, 889(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345877.shtml
-
[44]
Wei, T. B.; Li, W. T.; Li, Q.; Qu, W. J.; Li, H.; Yan, G. T.; Li, Q.; Yao, H.; Zhang, Y. M. RSC Adv. 2016, 6, 43832. doi: 10.1039/C6RA06769G
-
[45]
Li, W.-T.; Qu, W.-J.; Zhu, X.; Li, Q.; Zhang, H.-L.; Yao, H.; Lin, Q.; Zhang, Y.-M.; Wei, T.-B. Sci. China, Chem. 2017, 60, 754. doi: 10.1007/s11426-016-0438-4
-
[46]
Zhang, H. L; Wei, T. B.; Li, W. T.; Qu, W. J.; Leng, Y. L.; Zhang, J. H.; Lin, Q.; Zhang, Y. M.; Yao, H. Sens. Actuators, B:Chem. 2017, 239, 671. doi: 10.1016/j.snb.2016.08.016
-
[47]
Kiyose, K.; Hanaoka, K.; Oushiki, D.; Nakamura, T.; Kajimura, M.; Suematsu, M.; Nishimatsu, H.; Yamane, T.; Terai, T.; Hirata, Y.; Nagano, T. J. Am. Chem. Soc. 2010, 132, 15846. doi: 10.1021/ja105937q
-
[48]
Yang, L.; Qu, W.; Zhang, X.; Hang, Y.; Hua, J. Analyst 2015, 140, 182. doi: 10.1039/C4AN01732C
-
[49]
Liu, X.; Weinert, Z. J.; Sharafi, M.; Liao, C.; Li, J.; Schneebeli, S. T. Angew. Chem., Int. Ed. 2015, 54, 12772. doi: 10.1002/anie.201506793
-
[50]
Qu, Y.; Zhang, X.; Wang, L.; Yang, H.; Yang, L.; Cao, J.; Hua, J. RSC Adv. 2016, 6, 22389. doi: 10.1039/C5RA26784F
-
[51]
Gu, P.-Y.; Wang, C.; Nie, L.; Long, G.; Zhang, Q. RSC Adv. 2016, 6, 37929. doi: 10.1039/C6RA08547D
-
[52]
Liu, Y.; Ye, M.; Ge, Q.; Qu, X.; Guo, Q.; Hu, X.; Sun, Q. Anal. Chem. 2016, 88, 1768. doi: 10.1021/acs.analchem.5b04043
-
[53]
Wang, L.; Liu, S.; Hao, C.; Zhang, X.; Wang, C.; He, Y. Sens. Actuators, B:Chem. 2016, 229, 145. doi: 10.1016/j.snb.2016.01.117
-
[54]
Zhang, S. G. Biotechnol. Adv. 2002, 20, 321. doi: 10.1016/S0734-9750(02)00026-5
-
[55]
Gilday, L. C.; Robinson, S. W.; Barendt, T. A.; Langton, M. J.; Mullaney, B. R.; Beer, P. D. Chem. Rev. 2015, 115, 6114.
-
[56]
Kazuma, G.; Tetsuo, A.; Hiroyuki, I. Acta Crystallogr. 2007, 63, 17. doi: 10.1107/S0108768106039462
-
[57]
Tu, L.; Hsin, R. C.; Hong, Y. L.; Hung, L. L. Cryst. Growth Des. 2012, 12, 5897. doi: 10.1021/cg300763t
-
[58]
Tran, N. T.; Wilson, S. O.; Franz, A. K. Chem. Commun. 2014, 50, 3738. doi: 10.1039/C4CC00672K
-
[59]
Metz, A. E.; Podlesny, E. E.; Carroll, P. J.; Klinghoffer, A. N.; Kozlowski, M. C. J. Am. Chem. Soc. 2014, 136, 10601. doi: 10.1021/ja506137j
-
[60]
Nayak, A.; Pedireddi, V. R. Cryst. Growth Des. 2016, 16, 5966. doi: 10.1021/acs.cgd.6b01011
-
[61]
Ritter, K.; Pehlken, C.; Sorsche, D.; Rau, S. Dalton Trans. 2015, 44, 8889. doi: 10.1039/C5DT00214A
-
[62]
Hugo, V.; Macarena, P.; Eduardo, P. Inorg. Chem. 2015, 54, 3654. doi: 10.1021/acs.inorgchem.5b00250
-
[63]
Mohammad, O. B.; Jeffery, D. M.; Haoran, S. Cryst. Growth Des. 2015, 15, 2235. doi: 10.1021/cg501894u
-
[64]
Shuster, V.; Gambarotta, S.; Nikiforov, G. B.; Budzelaar, P. H. M. Organometallics 2013, 32, 2329. doi: 10.1021/om3012097
-
[65]
Bindewald, E.; Lorenz, R.; Hübner, O.; Brox, D.; Herten, D.-P.; Kaifer, E.; Himmel, H.-J. Dalton Trans. 2015, 44, 3467. doi: 10.1039/C4DT03572K
-
[66]
Wei, T.; Zhang, H.; Li, W.; Qu, W.; Su, J.; Lin, Q.; Zhang, Y.; Yao, H. Chin. J. Chem. 2017, 35, 1311. doi: 10.1002/cjoc.v35.8
-
[67]
Gao, Y.; Li, H.; Yin, S.; Liu, G.; Cao, L.; Li, Y.; Wang, X.; Ou, Z.; Wang, X. New J. Chem. 2014, 38, 5647. doi: 10.1039/C4NJ01083C
-
[68]
Liu, Y.; Zhong, K.; Li, Z.; Wang, Y.; Chen, T.; Lee, M.; Jin, L. Y. Polym. Chem. 2015, 6, 7395. doi: 10.1039/C5PY01056J
-
[69]
Liang, G.; Wu, G.; Wang, H.; Su, J.; Li, H.; Lin, Q.; Zhang, Y.; Wei, T. J. Inclusion Phenom. Macrocyclic Chem. 2016, 86, 173. doi: 10.1007/s10847-016-0662-8
-
[70]
Lee, D. C.; Brownell, L. V.; Jang, K.; Han, S. J.; Robins, K. A. Phys. Chem. Chem. Phys. 2015, 17, 2457. doi: 10.1039/C4CP05090H
-
[71]
Jiang, K.; Ma, S.; Bi, H.; Chen, D.; Han, X. J. Mater. Chem. A 2014, 2, 19208. doi: 10.1039/C4TA04269G
-
[1]
-
图 13 (a) 40在固态下的阳离子二聚体的分子结构、(b) 41在固态下的二聚体的分子结构及(c)两个二聚的41的苯环间的C—H…π相互作用的详视图
Figure 13 (a) Molecular structure of a cation dimer 40 in the solid state, (b) molecular structure of a cation dimer of 41 in the solid state and (c) detailed view on the C—H…π contact between the phenyl-rings of two dimerized 41
图 29 样品1 (oPD/0.017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/ 0.083 mol·L-1)、样品2 (oPD/0.017 mol·L-1, NaCl/1.03 mol· L-1, CuCl2/0.083 mol·L-1)、样品3 (oPD/0.033 mol·L-1, NaCl/ 2.06 mol·L-1, CuCl2/0.083 mol·L-1)和样品4 (oPD/0.0017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1)的扫描电镜照片
Figure 29 SEM images of sample 1 (oPD/0.017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1), sample 2 (oPD/0.017 mol·L-1, NaCl/1.03 mol·L-1, CuCl2/0.083 mol·L-1), sample 3 (oPD/0.033 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1), and sample 4 (oPD/0.0017 mol·L-1, NaCl/2.06 mol·L-1, CuCl2/0.083 mol·L-1), respectively
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 22
- 文章访问数: 2644
- HTML全文浏览量: 417














 下载:
下载:




































 下载:
下载:

