 图 1
氨基喹啉类药物
Figure 1.
Selected examples for aminoquinolines bioactive molecules
图 1
氨基喹啉类药物
Figure 1.
Selected examples for aminoquinolines bioactive molecules

Citation: Zhu Longzhi, Cao Xin, Li You, Liu Ting, Wang Xie, Qiu Renhua, Yin ShuangFeng. Recent Advances on the C-H Bond Functionalization on C(5) Position of 8-Aminoquinolines[J]. Chinese Journal of Organic Chemistry, 2017, 37(7): 1613-1628. doi: 10.6023/cjoc201703020

8-氨基喹啉C(5) 位C-H键官能化研究进展
English
Recent Advances on the C-H Bond Functionalization on C(5) Position of 8-Aminoquinolines
-
氨基喹啉(Aminoquinoline, AQ)及其衍生物是一种在天然产物和药物分子中存在的重要芳香含氮杂环, 大多数以生物碱的形式存在.氨基喹啉在药物中有着重要的应用[1], 也能在材料领域用于金属离子吸附和荧光成像[2].相比其它的喹啉衍生物, 氨基喹啉具有高效的生物活性.比如伯氨喹、氯喹啉以及他非诺喹等具有疟疾预防和治疗作用(图 1).他非诺喹是一种对8-氨基喹啉C(5) 位进行修饰后得到的新型药物, 与扑疟喹和伯氨喹相比, 具有较小的毒性; 其在血液代谢中周期更长, 该药物和其它喹啉类药物合用可根治间日疟原虫引起的疟疾[3].
8-氨基喹啉还可作为有机配体或双齿导向基参与一系列有机合成反应. 2005年, Daugulis小组[4]首次报道了8-氨基喹啉衍生物作为双齿导向基的γ位C(sp3)—H键芳基化反应.随着这一体系的逐渐完善, 已有许多优秀的课题组报道了8-氨基喹啉在双齿导向基方面的应用(图 2)[5].基于对碳-氢活化领域的持续兴趣[6], 最近我们[7]也报道了一些8-氨基喹啉导向的碳氢键功能化的工作.
在喹啉母环上连接上不同化学性质的取代基(如吸电子基团、给电子基团或大位阻基团), 能显著改变喹啉的物理化学性质, 因而具有潜在的应用价值.目前已有许多经典的缩合反应, 如Skraup, Döbner-Von Miller, Friedländer, Conrad-Limpach-Knorr和Combes synthesis反应可用于高效合成单取代或多取代喹啉衍生物[8].但是上述反应存在着需要强酸、高温的条件等缺点, 从而限制了其底物适应范围; 并且当环化的取代基不同时, 存在着选择性难以控制等难题.
近年来, 因不需要对底物进行预官能化变成有机金属试剂或者有机卤化物, 具有原子经济性和步骤经济性等优点, 碳氢活化取得了广泛的进展[9, 5h].现已发展成为构建C—C键和C—Z (Z为杂原子)键的重要方法之一.氢/氘交换研究表明在强酸性介质中喹啉环各位置亲电取代反应的顺序为8>5, 6>7>3, 吡啶环相邻的位置(5和8) 是活性最高的.它的亲电取代反应大多仅发生在苯环, 而亲核取代反应几乎在吡啶环上发生[10].
通过对现有氨基喹啉母体结构进行碳氢键活化/官能团化来构建单取代及多取代喹啉无疑是方便快捷的一种方法.已有一系列合成方法见诸报道, 如许多课题组报道了喹啉C(2)[11], C(3)[12], C(4)[13]和C(8)[14]位活化的例子; 也有一些综述被报道出来[15]. 2015年, Sawamura等[15a]系统总结了过渡金属催化的喹啉环位置[C(2) 除外]选择性活化的报道.同年, Larionov等[15b]总结了最近十年吡啶及喹啉吡啶A环的位置选择性研究进展.但是, 专一地对于喹啉环5位碳氢键官能化的研究进展, 目前还没有报道.基于此, 本综述从近年来8-氨基喹啉5位碳氢键官能化的研究工作出发, 系统总结合成方法中的反应条件、底物适用范围和反应机理的异同点, 为喹啉5位的进一步研究及喹啉其它位置的研究提供参考.
针对已有文献的调研和分析, 本文按照成键类型[碳-卤键、碳-碳键、碳-硫(硒)键、碳-氮键和碳-氧键]进行分类, 对喹啉5位官能团化的研究进行分类和总结.
1 8-氨基喹啉5位碳-卤键形成反应研究
有机卤化物在染料, 药物和材料的合成方面有着广泛的应用, 也是一类重要的有机合成中间体.通常, 有机化合物先通过卤化反应预官能团化, 之后通过一系列过渡金属催化偶联反应或亲核取代反应进一步引入所需官能团.因此, 构建碳-卤键是有机合成的热门领域[16].在喹啉5位引入卤素, 为进一步官能团化提供了可能, 因此成为了喹啉5位研究的最热门领域之一.我们将按照催化剂种类(金属催化、非金属催化)分类, 讨论反应条件、底物适用范围、机理及应用; 其中金属催化中又分金属卤源及非金属卤源两类分别讨论.
1.1 金属催化的8-氨基喹啉5位卤化反应
1.1.1 以金属卤盐为卤源的5位卤化反应
2013年, 美国Stahl课题组[17]研究了在不同条件下N-(8-喹啉基)-苯甲酰胺由二价铜调控的C—H键氧化反应(Scheme 1). N-(8-喹啉基)苯甲酰胺在二价铜催化下, 不同反应条件时有着不同的反应产物.在碱性反应条件下, 苯甲酰胺基可直接发生C—H键的甲氧基化反应; 在乙酸存在的酸性反应条件下, 8-氨基喹啉可远程导向C(5) 位氯化反应.
8-氨基喹啉C(5) 位氯化反应以氯化亚铜为催化剂, 氯化锂为添加剂, 在氧气氛围下, 能以较高的区域选择性生成5位氯化的产物.作者采用8-氨基喹啉作为一种二齿配体与氯化亚铜络合, 这是反应具有高度区域选择性的重要原因.同时, 通过一系列控制实验与详细的密度泛函理论(DFT)计算, 他们认为反应遵循单电子转移机理(SET), 这为后续喹啉5位的其它官能团化的研究奠定了基础.
2015年, Xie课题组[18]报道了铜媒介的喹啉5位的单氯化反应及钯催化的5, 7-双氯化反应.单氯化反应以化学计量的氯化铜为氯源, 醋酸铜为碱性添加剂, 区域选择性较好, 对各类官能团有着良好的兼容性.在铜催化的以氯化铜为氯源的5位单氯化反应中, 作者通过研究发现, 该反应对于喹啉环上的电子云密度较为敏感.比如, 在喹啉环2位上连有吸电子基团时, 相对于连有给电子基团的产率要低(Eq. 1).钯也能催化喹啉5位的单氯化反应, 以氯化钯作为催化剂, 以N-氯代丁二酰亚胺(NCS)为氯源(Eq. 2).当提高NCS的用量至2.4 equiv.时, 即可得到5, 7-双氯化产物(Eq. 3), 以32%至95%的产率得到了多种喹啉环的二氯化产物.并且, 当喹啉5位被封住时, 反应的位点变为7位.根据底物类型的不同, 作者将单氯化及双氯化的反应总结如Scheme 2所示.对于反应的机理, 作者也进行了较为详细的研究, 作者认为铜媒介单氯化及钯催化单/双氯化反应均遵循单电子转移机理(SET).
2016年, Zhou, Shen和Zhang课题组[19]报道了以醋酸铜作催化剂、醋酸碘苯作氧化剂、卤化钠作为卤源的的喹啉环C(5) 位的卤化反应.通过改变氧化剂醋酸碘苯和卤源的用量, 可得到5位单取代的(Eq. 4) 或者5, 7双溴化的(Eq. 5) 产物.作者通过一系列的控制实验证明了单电子转移机理(SET)在卤化反应中起到了决定性作用.
1.1.2 金属既作催化剂又作卤源的5位卤化反应
Huang课题组[20]报道了以二价卤化铜盐(CuX2)作催化剂兼卤源, 醋酸碘苯氧化的喹啉5位的卤化反应(Eq. 6). Sarma课题组[21]也发展了二价卤化铜盐兼作催化剂和卤源的喹啉5位的溴化和氯化反应, 产率70%至98%(Eq. 7).
Li课题组[22]报道了N-氟代双苯磺酰胺(NFSI)氧化的一价卤化亚铜盐(CuX)兼作催化剂和卤源的氨基喹啉5位的卤化反应(Eq. 8). Xu和Zhu课题组[23]也独立报道了类似的卤化体系(Eq. 9).
1.1.3 以非金属卤源为卤源的5位卤化反应
2016年, Wu和Su课题组[24]报道了醋酸铜催化的喹啉衍生物5位的碘化反应, 能专一地以较高产率得到一系列5位碘化的产物(Eq. 10).但是对于杂芳烃的吡啶和噻吩酰胺类化合物, 该反应得到的是喹啉5位取代的单取代以及双碘代(5位和杂芳烃邻位都取代的)的混合物.对于喹啉2位甲基取代的底物, 则只能以31%的产率得到三碘代的产物.
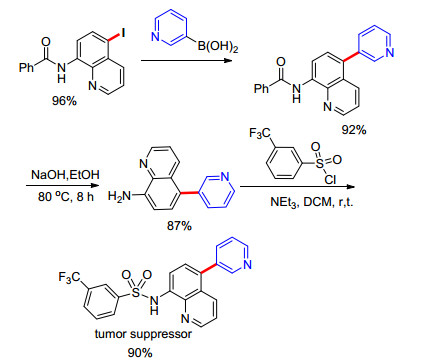
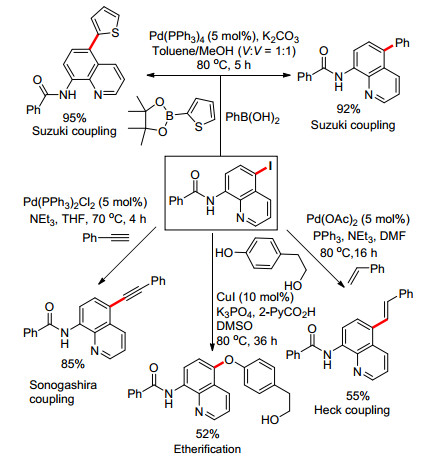
2016年, Baidya课题组[25]也报道了铜催化的喹啉5位碘化和溴化反应, 产率50%至97% (Eq. 11).并且将该反应运用于合成具有肿瘤抑制活性的生物活性分子中(Scheme 3).然而, 该反应体系不能拓展到以NCS为氯源的喹啉5位氯化反应.此外, 作者还对底物的转化做了一系列偶联反应方面的研究(Scheme 4).比如:从氨基喹啉5位碘化产物为原料, 可较高产率地得到Suzuki偶联反应、Sonogashira偶联反应、Heck偶联反应以及与苯酚的醚化反应的目标产物.
Koley课题组[26]在探索镍催化的苯甲酰胺氨基喹啉的碘化反应时发现, 当使用氯化镍作催化剂时, 以碘单质为碘源, 能一锅法以85%的产率得到喹啉5位碘化的产物(Eq. 12), 但该反应需要使用大大过量的碘源(4.5 equiv.).
1.2 无过渡金属催化的喹啉5位卤化反应
1.2.1 以金属卤盐为卤源的5位卤化反应
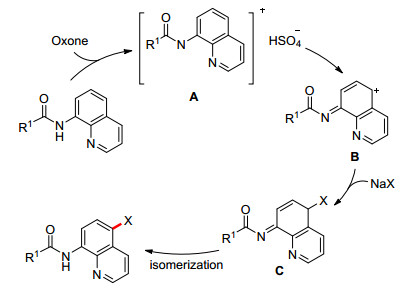
Zhang和Li课题组[27]报道了无过渡金属催化的喹啉C(5) 位的卤化反应(Eq. 13).该反应使用廉价无毒的金属盐(NaCl/NaBr)为卤化试剂, 过硫酸氢钾复合盐(Oxone, 2KHSO5·KHSO4·K2SO4)为氧化剂, 对水氧稳定性较好.因NaCl的活性不及NaBr的活性, 将温度从室温提升至130 ℃, 并且溶剂变为DMF, 即可较高产率的得到氯化产物.但是该方法无法用于喹啉5位的碘化反应.对于机理的研究, 作者发现该反应并不经过自由基机理, 也排除了亲电取代机理; 作者认为反应很可能经历氧化卤化机理(Scheme 5).首先喹啉化合物被过硫酸氢钾复合盐氧化形成阳离子中间体A, 然后经过电子离域形成碳正离子B, 中间体B被卤素盐捕获后形成烯胺中间体C, C最后经过异构化得到目标产物.
Ghosh课题组[28]也报道了类似的无过渡金属催化的喹啉5位的卤化反应(Eq. 14).该反应使用过二硫酸钾作为氧化剂, 使用四丁基卤化铵(TXAI, X=Cl, Br, I) (Condition A)或者N-卤代丁二亚酰胺(NXS, X=Cl, Br, I) (Condition B)为卤素源.
1.2.2 无金属参与的喹啉5位卤化反应
2017年, Wang和Xu课题组[29]报道了水相中的无金属催化的以N-卤代丁二亚酰胺(NCS, NBS, NIS)为卤源的喹啉5位卤化反应, 实现了完全无金属参与(Eq. 15).反应迅速高效, 无需惰性气体保护.溴化反应的条件非常温和, 对于稍微不活泼的氯化反应及不稳定的碘化反应, 则需要提高温度至100 ℃, 并且使用溴化反应2倍量的卤源.
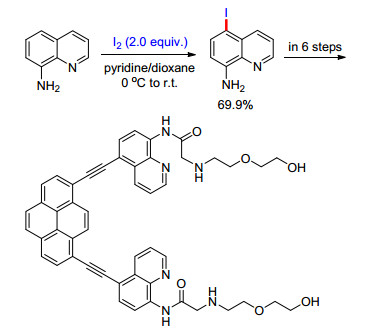
2014年, Xu课题组[30]报道了一例无金属催化的以碘单质作为碘源、吡啶作为配体的8-氨基喹啉C(5) 位的碘化反应(69.9%), 并且将其作为偶联中间体应用到荧光探针的合成中(Scheme 6).
2 8-氨基喹啉5位碳-碳键形成反应研究
2.1 8-氨基喹啉5位烯丙基化反应研究
2014年, Zeng课题组[31]报道了FeCl3催化的8-氨基喹啉衍生物与烯丙醇类化合物生成5位烯丙基化产物的反应(Eq. 16).该法采用氯化铁作催化剂, 羟基作为离去基团, 以中等至良好的产率生成5位烯丙基化产物.反应通过螯合诱导进行C—H活化, 通过控制催化剂体系来实现特定的空间立体和区域选择性.
当改变条件为乙酰丙酮铁催化、dppe作为配体时, 可得到4位烯丙基化的产物, 并伴随有极少量的邻位取代的烯丙基化产物生成, 无5位烯丙基化的产物生成(Eq. 17).
2.2 8-氨基喹啉5位烷基化反应
2016年, Watkins课题组[32]报道了铑催化的N-Boc缩醛胺与氨基喹啉类化合物的反应, 能以较高产率得到一系列支链胺类化合物(Eq. 18).稍微提高反应温度至90 ℃, 延长反应时间至36 h, 使用0.4倍量AgSbF6, 即可以中等产率得到一系列喹啉5位二聚体产物(Eq. 19).此前, Wu和Su课题组[24]报道了铜催化的苯甲酰胺喹啉二聚的一个例子, 产率为49%, 但是需要170 ℃的高温(Eq. 20).
2016年Niu和Song课题组[33]在探究钴催化的非活化芳烃的C—H键交叉偶联反应过程中, 用2, 6-二叔丁基-4-甲基苯酚(BHT)作为自由基捕获剂, 得到了8-氨基喹啉5位苄基化的产物, 产率为23% (Eq. 21).受此启发, 随后他们进行更深入的探究, 实现了首例钴催化的氨基喹啉C(5) 位的苄基化反应[34].该反应以四水醋酸钴为催化剂, 三氟乙酸银(AgTFA)为氧化剂, 反应有较好的底物适应性, 产率44%至98% (Eq. 22), 为8-氨基喹啉C(5) 苄基类化合物的合成提供了一种有效的合成方法.
2017年, Xiao和Yu课题组[35]报道了铁催化的8-氨基喹啉衍生物5位的苄基化反应(Eq. 23).该反应以氯化铁作为催化剂, 以磺胺类化合物为苄基源, 通过C—N键的断裂实现了氨基喹啉5位的苄基化反应.
此外, Baidya课题组[36]在报道铜催化的, 用偶氮二羧酸酯作为胺源, 8-氨基喹啉5位的远程胺化反应时, 使用偶氮二异丁腈(AIBN)代替偶氮二羧酸酯作为自由基捕获剂, 得到了一例碳碳键形成反应的产物, 产率为24% (Eq. 24).
2.3 喹啉5位氟烷基化反应
2.3.1 喹啉5位三氟甲基化反应的研究
2016年, Huang课题组[37]报道了一种无金属催化的8-酰胺喹啉5位的三氟甲基化反应(Eq. 25).该法采用醋酸碘苯(PIDA)作氧化剂, 亚硫酸氢铵作为添加剂, 在空气氛围下, 使用廉价的三氟甲磺酸钠(Langlois试剂)作为三氟甲基化试剂, 能够得到一系列喹啉环C(5) 位三氟甲基化的喹啉衍生物, 产率中等.此外, 作者研究了C(6) 位电子效应对于反应的影响, 对于给电子基团如甲基, 反应能很好的进行, 但是对于吸电子基团如卤素, 反应则很难进行.
Kuninobu和Kanai课题组[38]报道了铜催化的以Togni’s试剂作为三氟甲基源的8-氨基喹啉5位三氟甲基化反应(Eq. 26).该反应对于一系喹啉8位为酰胺化合物, 氨基甲酸酯、尿素、磺酰胺基类官能团都有较好的适应性, 产率中等.作者对于机理的研究时, 发现反应的历程因底物的不同而不同.当底物为酰氨基喹啉衍生物时, 氯化亚铜催化Togni’s试剂产生三氟甲基自由基经历的是自由基历程; 而对于8-氨基喹啉类化合物, 经历的不是自由基过程, 而是路易斯酸催化的Friedel-Craft反应.
Cai课题组[39]报道了溴化铜催化的使用三氟甲磺酸钠盐为三氟甲基源的喹啉5位三氟甲基化反应(Eq. 27).对于各类芳基、烷基类酰胺都有很好的底物兼容性, 产率中等至良好.作者发现, 该三氟甲基化反应也能拓展到其它全氟烷基磺酸盐底物, 得到其全氟烷基化的产物.对于机理的研究, 作者认为反应经历自由基过程.
Zhang课题组[40]报道了无过渡金属催化的氨基喹啉C(5) 位的全氟烷基化反应(Eq. 28).该反应以三甲基硅基全氟烷烃(TMSCnF2n+1)作为全氟烷基源, 以双(三氟乙酸)碘苯作为氧化剂, 氟化钾作为添加剂, 室温下反应20 min以良好至优秀的产率得到目标产物.机理研究表明, 该反应经历自由基历程.
Shen和Zhang课题组[41]报道了多相催化剂壳聚糖负载的醋酸铜(CS@Cu(OAc)2)催化的, 使用三氟甲磺酸钠盐作为三氟甲基源的三氟甲基化反应, 产率良好至优秀(Eq. 29).过滤后的多相催化剂壳聚糖@醋酸铜经过乙酸乙酯和水洗后干燥即可再次循环使用.五次循环使用后, 还能保持稳定的催化效果.该催化剂经过循环使用后, 也没有明显的质量损失.
2.3.2 喹啉5位二氟烷基化反应
Li和Wang课题组[42]报道了镍催化的以二氟烷基溴化物为二氟烷基源的喹啉5位二氟烷基化反应(Eq. 30).该反应对于一系列的氨基喹啉类化合物都有很好的适应性, 产率37%至94%.对于机理的研究, 作者认为反应经历自由基历程.
3 喹啉5位碳-硫(硒)键形成反应的研究
3.1 喹啉5位硫醚化反应研究
2015年, 我们课题组[7c]报道了铜促进的喹啉5位远程硫醚化及硒醚化反应(Eq. 31).该反应对于各类二芳基二硫醚、二烷基二硫醚都有较好的底物适应性; 对于各类脂肪酰胺的效果较好.同时, 该反应也能拓展到各类二芳基二硒醚, 有着良好的收率.对于机理的研究表明, 硫醚化反应经历了单电子转移的自由基过程(SET).
3.2 喹啉5位硒醚化反应研究
2016年, Baidya课题组[43]也报道了喹啉5位的硒醚化反应(Eq. 32).他们以Cu(OTf)2为催化剂、Ag2CO3为氧化剂, 加入Selectfluor, 于100 ℃下反应48 h, 即可较高选择性的得到5位硒醚化的产物, 产率45%~98%.
3.3 喹啉5位硫(硒)氰化反应研究
Wang和Xu课题组[44]报道了铜催化的喹啉C(5) 位硫氰基化/硒氰基化反应(Eq. 33).该反应以市售廉价易得的KSCN或者KSeCN为硫氰基/硒氰基源, 对一系列脂肪类、芳香类8-氨基喹啉类化合物都有很好的兼容性.电子效应对于该类反应的影响较为明显, 当喹啉环上面连有给电子基团时效率比吸电子的要高, 当连有强拉电子基团, 如氰基时, 反应不能进行.喹啉环的C(2) 和C(7) 对于反应也有较大的位阻影响, 当C(2) 位置行连有取代基团时, 效率很低; 单C(7) 被取代时, 反应则不能进行.
3.4 喹啉5位磺酰化反应的研究
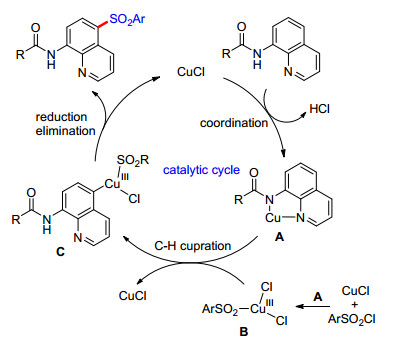
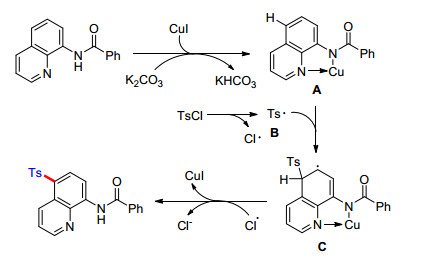
2015年, Wei课题组[45]率先报道了喹啉5位的磺酰化反应(Eq. 34).该法采用氯化亚铜作催化剂, 碳酸钠作为碱性添加剂, 在氩气氛围下, 以中等至良好的产率生成5位磺酰化产物.反应采用廉价的磺酰氯作为磺酰化试剂, 反应专一性选择性非常高, 对于各种底物都有很好的兼容性.对于杂环基噻吩磺酰氯也能兼容; 但是烷基磺酰氯, 在该反应体系中不能兼容, 这很可能是因为烷基磺酰氯在该反应体系下不稳定.对于机理的研究, 他们推测该反应很可能经历了形成Cu(Ⅲ)中间体B的过程(Scheme 7).
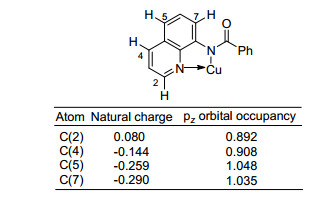
Yang和Wu课题组[46]也报道了空气氛围下, 碘化亚铜催化的以磺酰氯作为磺酰基源的喹啉5位磺酰化反应, 效率良好(Eq. 35).并且他们进一步将磺酰基底物拓展到了烷基化合物, 如环丙基磺酰氯, 有中等收率.他们对可能的中间体进行了理论计算.虽然自然电荷的密度C(7) 的最高(图 3), 但是考虑到pz轨道的朝向和喹啉环π轨道的朝向是一致的, 因此pz轨道的占据率将对评价某个特定原子的反应活性更有效.在这四个原子中, C(5) 位的碳原子有最大的pz轨道占有率, 表明C(5) 位原子可能是最可能的亲电反应位点[47], 从而磺酰化反应容易发生在C(5) 位. C(7) 位的pz轨道占有率紧随其后, 这在一定程度上解释了, 当喹啉环C(5) 位被取代后, 反应为什么常常发生在C(7) 位.他们推测反应过程中经历了单电子转移(SET)过程(Scheme 8).
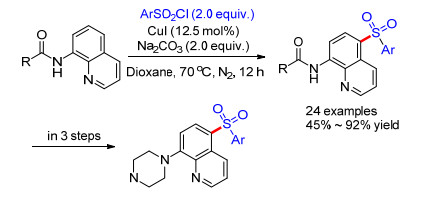
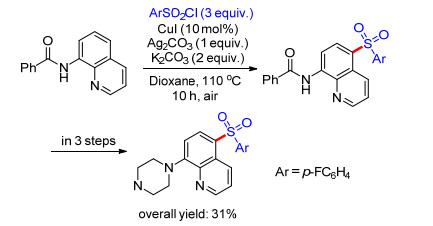
Zhang, Huang和Liu课题组[48]也报道了CuI催化的磺酰氯作为磺酰基源的喹啉远程5位磺酰化反应, 产率45%至92% (Scheme 9).并且, 作者将此方法应用于一种潜在5-HT6血清素受体的PET显像放射性配体[1d]类似物的合成, 产率良好.此外, 改变催化剂为醋酸铜, 更换氧化剂和离去基团的种类, 还能拓展到C—O, C—Br, C—N, C—C和C—I键等的构建(Eq. 36), 为药物分子的设计和光电材料的特定位置的修饰提供了可能.
Weng和Lu课题组[49]也报道了碘化亚铜催化的磺酰氯作为磺酰基源的喹啉远程5位磺酰化反应, 产率32%至91%.他们将此方法应用于一种潜在的氟代5-HT6血清素受体的PET显像放射性配体[1d]的合成, 结合已有文献的报道, 4步后能以31%的总收率得到该配体(Scheme 10).
Lin, Ke和Zeng课题组[50]报道了溴化亚铜催化的芳基磺酰氯为磺酰基源的喹啉5位磺酰化的反应, 反应产率52%至81% (Eq. 37).他们通过控制实验和DFT计算, 认为该磺酰化过程经历了一种单电子转移过程(SET).
Manolikakes课题组[51]报道了以氯化铜作为催化剂, 醋酸锰作为氧化剂, 磺酸钠盐作为磺酰化试剂在室温下就能进行的高效率反应, 反应时间只需要90 min (Eq. 38).这进一步丰富了喹啉5位的磺酰化的研究.对于机理的研究, Manolikakes等认为该反应经历了单电子转移的自由基过程(SET), 并且由于三价锰离子(Mn3+)相对于铜(Cu2+)有更高的氧化电位, 因而可实现室温下喹啉5位快速磺酰化反应.
Xia和Zhang课题组[52]报道了类似的醋酸铜催化的, 以过苯甲酸特丁酯(TBPB)作氧化剂, 磺酸钠盐为磺酰源的磺酰化反应, 反应产率43%至85% (Eq. 39).
此外, 在2015年Kambe教授[7d]在报道镍催化的苯甲酰胺基喹啉苯环邻位的磺酰化反应时, 发现产物伴随着喹啉环5位也磺酰化的双磺酰化产物的生成, 但是产率非常低(Eq. 40).
4 喹啉5位碳-氮键形成反应的研究
4.1 喹啉5位胺化反应的研究
2016年, Baidya课题组[36]报道了铜催化的8-氨基喹啉C(5) 位的胺化反应(Eq. 41).该法采用三氟甲磺酸铜作催化剂, 碳酸银作氧化剂, 用偶氮二羧酸酯作为胺源, 以中等至较好的产率生成5位胺化产物. 8-酰胺喹啉单元与催化剂形成的过渡态中间体对反应的发生至关重要.反应对各类官能团有着良好的兼容效果, 可被广泛用于合成一系列药物中间体.但对于大位阻的N-Boc的偶氮二羧酸酯, 反应不能进行.作者在捕获自由基中间体后, 认为反应遵循单电子转移(SET)的机理.
4.2 喹啉5位磺胺化反应的研究
Zhu和Xu课题组[53]报道了无金属催化的喹啉5位磺酰胺化的反应(Eq. 42).该反应使用醋酸碘苯作为媒介及氧化剂, 二芳基磺酰亚胺作为磺酰胺源.对于各类二芳基磺酰亚胺和酰胺, 都有较好的底物兼容性, 对于机理的研究, 作者认为经历了阳离子自由基中间体的单电子转移的自由基过程(SET).
Zhang和Li课题组[54]报道了无金属催化的8-氨基喹啉5位的磺胺化反应(Eq. 43).该反应以N-氟代双苯磺酰亚胺(NFSI)作为磺胺化试剂, 以高价碘试剂双(叔丁基羰基氧)碘苯[PhI(OPiv)2]作为氧化剂, 产率一般到中等.对于苯胺类衍生物底物, 也有很好的对位选择性.作者认为该反应经历自由基历程.
Qi和Zhang课题组[55]报道了铜催化的远程碳氢键磺胺化的反应(Eq. 44).他们使用市售N-氟代双苯磺酰亚胺(NFSI)作为磺胺化试剂及氧化剂, 温和条件下即可得到各种5位磺胺化的取代喹啉, 产率中等至良好.对于机理的研究, 他们认为该反应经历了一个Cu(Ⅱ)催化的SET自由基过程.
4.3 喹啉5位叠氮化反应的研究
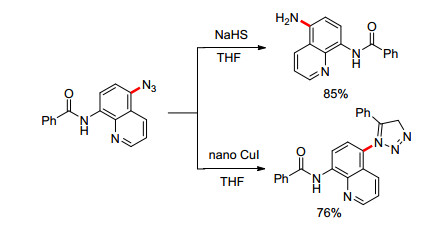
2016年, Zhu课题组[56]报道了醋酸铜催化的喹啉环5位的叠氮化反应(Eq. 45).该反应以廉价的叠氮化钠作为叠氮化试剂, 四丁基溴化胺(TBAB)和1, 8-二氮杂二环十一碳-7-烯(DBU)作为添加剂, 对于一系列芳基酰胺类化合物、烷基酰胺类化合物都有良好的底物适应性.对于不同位置取代的喹啉类化合物也有中等至良好的产率, 但是当喹啉2位被取代时, 由于位阻的影响, 中间体铜配合物无法形成, 因而无法得到相应产物.此外, 作者对叠氮化产物进行了一系列的应用拓展(Scheme 11).如叠氮可被硫氢化钠还原得到氨基化产物(85%), 也能用纳米碘化亚铜催化进行点击反应得到环加成产物(76%).
4.4 喹啉5位硝化反应的研究
2016年, Whiteoak和Ribas课题组[57]首次报道了使用Co(NO3)2·6H2O作为催化剂的, 亚硝酸叔丁酯(TBN)作为硝基源的氨基喹啉5位硝化反应(Eq. 46).由于TBN在室温下即可原位生成NO2和叔丁氧基自由基, 因此该反应可在室温下高效进行.但是, 几乎在所有的情况下反应体系中得到的都是喹啉5位硝化和7位硝化的混合物, 彻底纯化较为困难.并且, 该反应对于强拉电子性的基团, 如对硝基苯甲酰胺类化合物和三氟甲酰胺类化合物不反应; 对于大位阻的叔丁基, 由于其阻碍了Co催化剂的配位, 从而效率很低.只有当喹啉5位被取代后, 才能专一地在喹啉7位得到硝化的产物.同样表现出很强的电子效应, 强拉电子的NO2不能使反应有效进行.由于与催化剂的相互作用, 初级胺也不能使反应有效进行.他们通过研究推测该反应经历一个SET单电子转移过程.
Koley课题组[58]也报道了相类似的用亚硝酸叔丁酯(TBN)作为硝基源、氯化铜催化的喹啉5位或7位硝化的反应(Eq. 47).相对于Ribas等的方法[57], 该反应将官能团适应性进一步拓展到了强拉电子基团, 但同样得到的是以5位硝化产物为主的混合物.
Zhang课题组[59]报道了Cu(NO3)2/NaNO2/PhI(TFA)2的硝化反应体系, 能专一地得到5位硝化的产物(Eq. 48).该反应非常迅速, 室温下1 min就能反应完毕.同时, 他们也探索了喹啉环5位被溴取代后的继续硝化反应, 同样的硝化条件下, 得到的则是7位硝化的产物, 产率良好.
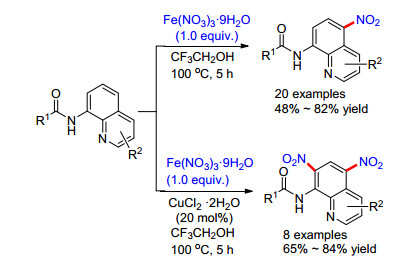
Zhang和Fan课题组[60]报道了铁催化的喹啉5位硝化反应.该反应使用廉价无毒的Fe(NO3)3·9H2O为促进剂, 该促进剂高温下热解可生成硝基自由基作为硝基源(Scheme 12).当加入CuCl2·2H2O作为催化剂时, 则主要得到5, 7-双硝化的产物(Scheme 12). 5, 7-双取代产物的取得, 作者经过控制实验和调阅文献[61]认为, 并不是经历同样的自由基阶段, 而是:第一阶段经历自由基过程得到5位硝化的产物; 第二阶段则经历了5位硝化产物与催化剂CuCl2·2H2O先配位形成中间体, 然后经历亲电取代形成5, 7-双硝化的产物.
5 喹啉5位碳氧键形成反应
5.1 喹啉5位的酯化反应
2017年, Xia课题组[62]发展了铜催化的喹啉环5位酯化反应(Eq. 49).该反应以醋酸铜为催化剂, 醋酸碘苯为氧化剂, 脂肪羧酸为酯基源, 对于一系列芳基酰胺, 烷基酰胺都有较好的适应性, 产率良好.酯化产物水解后, 即可得到5位羟基的喹啉衍生物, 可能可应用于药物中间体的合成.此外, 2016年, Ye课题组[63]也报道了喹啉5位酯化反应的一个例子, 酯基来源于醋酸碘苯(Eq. 50).
5.2 喹啉5位的成醚反应
2013年, Shi课题组[64]在报道钯催化的β位置C(sp3)—H键烷氧基化反应时发现8-酰胺喹啉5位的烷氧基化反应.当采用8-酰胺喹啉作为双齿导向基团时, 高选择性地生成了喹啉5位烷氧基化的产物, 产率为22% (Eq. 51). 2015年, Yang和You课题组[65]报道了镍催化的喹啉5位甲氧基化的一个例子, 产率为52% (Eq. 52).
6 机理
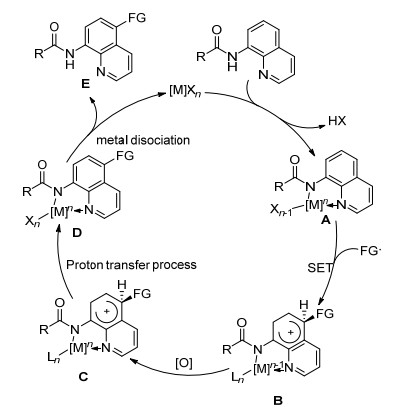
我们将过渡金属催化的氨基喹啉5位官能团化反应的主要机理归纳如Sheme 13所示:首先, 官能团底物在氧化剂作用下或者经由热解均裂产生自由基FG.接着, 氨基喹啉底物与催化剂配位后脱去质子形成中间体A, 中间体A经过单电子转移过程, 且在自由基FG的进攻下得到中间体B, B氧化得到中间体C, C经质子转移得到中间体D, 中间体D解离得到酰胺喹啉5位官能团化的产物E, 所解离得到的催化剂再参与到下一个催化循环中.
7 结论与展望
本综述总结了近年来通过碳氢活化方法对8-氨基喹啉类化合物喹啉环C(5) 位进行专一修饰的方法.目前已报道的方法中, 主要通过过渡金属(Cu(Ⅱ)或Cu(Ⅰ))催化的单电子转移机理(SET)形成一系列新键, 如碳-卤键、碳-硫(硒)键、碳-碳键、碳-氮键和碳-氧键等化学键.同时, 我们也可看到对于氨基喹啉环5位的碳氢键活化这一领域的研究非常活跃, 众多课题组都独立的发展了许多方法.这些新方法的出现, 可直接合成一系列复杂分子或合成一些平台分子; 对于丰富喹啉分子库, 进一步拓展其在药物、材料方面的应用有着重要作用.特别是完全无金属参与的卤化过程的报道, 使其在药物合成中具有一定的应用前景; 多相催化剂体系的报道, 使得这一体系应用前景更加光明.此外, 氨基喹啉C(5) 位官能团化的深入研究, 对于氨基喹啉其它位置官能团化的研究及喹啉类似物的官能团化, 也能提供一定的借鉴指导意义.但是, 目前喹啉5位的官能团化多依赖于铜催化/媒介的氨基喹啉的远程双齿导向作用, 对于普通喹啉的官能化方法还比较少, 体系不太成熟.目前大多方法限于方法学的研究, 具体的适合放大的报道还比较少.
-
-
[1]
(a) Michael, J. P. Nat. Prod. Rep. 2008, 25, 166.
(b) Kaur, K.; Jain, M.; Reddy, R. P.; Jain, R. Eur. J. Med. Chem. 2010, 45, 3245.
(c) Eicher, T.; Hauptmann, S.; Speicher, A. The Chemistry of Heterocycles: Structures, Reactions, Synthesis, and Applications, 3rd, John Wiley & Sons, New York, 2013.
(d) Colomb, J.; Becker, G.; Fieux, S.; Zimmer, L.; Billard, T. J. Med. Chem. 2014, 57, 3884.
(e) Tekwani, B. L.; Walker, L. A. Curr. Opin. Infect. Dis. 2006, 19, 623. -
[2]
(a) Fahrni, C. J.; O'Halloran, T. V. J. Am. Chem. Soc. 1999, 121, 11448.
(b) Huang, J.; Xu, Y.; Qian, X. Dalton. Trans. 2014, 43, 5983.
(c) McQuade, L. E.; Lippard, S. J. Inorg. Chem. 2010, 49, 7464.
(d) Zhu, S. S.; Lin, W. Y.; Yuan, L. Dyes Pigm. 2013, 99, 465. -
[3]
Peters, W. J. R. Soc. Med. 1999, 92, 345. doi: 10.1177/014107689909200705
-
[4]
Zaitsev, V. G.; Shabashov, D.; Daugulis, O. J. Am. Chem. Soc. 2005, 127, 13154. doi: 10.1021/ja054549f
-
[5]
(a) Rouquet, G. ; Chatani, N. Angew. Chem. , Int. Ed. 2013, 52, 11726.
(b) Corbet, M. ; De Campo, F. Angew. Chem. , Int. Ed. 2013, 52, 9896.
(c) Chen, Z. ; Wang, B. ; Zhang, J. ; Yu, W. ; Liu, Z. ; Zhang, Y. Org. Chem. Front. 2015, 2, 1107.
(d) Daugulis, O. ; Roane, J. ; Tran, L. D. Acc. Chem. Res. 2015, 48, 1053.
(e) Castro, L. C. M. ; Chatani, N. Chem. Lett. 2015, 44, 410.
(f) Liu, J. ; Chen, G. ; Tan, Z. Adv. Synth. Catal. 2016, 358, 1174.
(g) Rit, R. K. ; Yadav, M. R. ; Ghosh, K. ; Sahoo, A. K. Tetrahedron 2015, 71, 4450.
(h) Zhang, B. ; Guan, H. ; Liu, B. ; Shi, B. Chin. J. Org. Chem. 2014, 34, 1487 (in Chinese).
(张博, 管晗曦, 刘斌, 史炳锋, 有机化学, 2014, 34, 1487. )
(i) Luo, F. ; Long, Y. ; Li, Z. ; Zhou, X. Acta Chim. Sinica 2016, 74, 805 (in Chinese).
(罗飞华, 龙洋, 李正凯, 周向葛, 化学学报, 2016, 74, 805. ) -
[6]
(a) Qiu, R.; Reddy, V. P.; Iwasaki, T.; Kambe, N. J. Org. Chem. 2015, 80, 367.
(b) Zhu, L.; Cao, X.; Qiu, R.; Iwasaki, T.; Reddy, V. P.; Xu, X.; Yin, S.-F.; Kambe, N. RSC Adv. 2015, 5, 39358.
(c) Reddy, V. P.; Qiu, R. H.; Iwasaki, T.; Kambe, N. Org. Lett. 2013, 15, 1290.
(d) Su, L.; Dong, J.; Liu, L.; Sun, M.; Qiu, R.; Zhou, Y.; Yin, S.-F. J. Am. Chem. Soc. 2016, 138, 12348. -
[7]
(a) Wang, X.; Qiu, R.; Yan, C.; Reddy, V. P.; Zhu, L.; Xu, X.; Yin, S.-F. Org. Lett. 2015, 17, 1970.
(b) Wang, X.; Zhu, L.; Chen, S.; Xu, X.; Au, C. T.; Qiu, R. Org. Lett. 2015, 17, 5228.
(c) Zhu, L.; Qiu, R.; Cao, X.; Xiao, S.; Xu, X.; Au, C. T.; Yin, S.-F. Org. Lett. 2015, 17, 5528.
(d) Reddy, V. P.; Qiu, R.; Iwasaki, T.; Kambe, N. Org. Biomol. Chem. 2015, 13, 6803. -
[8]
(a) Marco-Contelles, J.; Pérez-Mayoral, E.; Samadi, A.; Carreiras, M. d. C.; Soriano, E. Chem. Rev. 2009, 109, 2652.
(b) Sudharshan, M.; Zehra, T.; Sanjay, B. Curr. Org. Chem. 2008, 12, 1116.
(c) Reitsema, R. H. Chem. Rev. 1948, 43, 43.
(d) Bergstrom, F. W. Chem. Rev. 1944, 35, 153.
(e) Kouznetsov, V. V.; Méndez, L. Y. V.; Gómez, C. M. M. Curr. Org. Chem. 2005, 9, 141.
(f) Kong, L. K.; Zhou, Y. Y.; Huang, H.; Yang, Y.; Liu, Y. Y.; Li, Y. Z. J. Org. Chem. 2015, 80, 1275.
(g) Wang, Y.; Chen, C.; Peng, J.; Li, M. Angew. Chem., Int. Ed. 2013, 52, 5323.
(h) Horn, J.; Marsden, S. P.; Nelson, A.; House, D.; Weingarten, G. G. Org. Lett. 2008, 10, 4117.
(i) Shaabani, A.; Rahmati, A.; Badri, Z. Catal. Commun. 2008, 9, 13.
(j) Manske, R. Chem. Rev. 1942, 30, 113.
(k) Prajapati, S. M.; Patel, K. D.; Vekariya, R. H.; Panchal, S. N.; Patel, H. D. RSC Adv. 2014, 4, 24463. -
[9]
(a) Zhang, F.-L.; Hong, K.; Li, T.-J.; Park, H.; Yu, J.-Q. Science 2016, 351, 252.
(b) Wang, X.-C.; Gong, W.; Fang, L.-Z.; Zhu, R.-Y.; Li, S.; Engle, K. M.; Yu, J.-Q. Nature 2015, 519, 334.
(c) Chen, X.; Engle, K. M.; Wang, D.-H.; Yu, J.-Q. Angew. Chem., Int. Ed. 2009, 48, 5094.
(d) Song, G.; Li, X. Acc. Chem. Res. 2015, 48, 1007.
(e) Kuhl, N.; Hopkinson, M. N.; Wencel-Delord, J.; Glorius, F. Angew. Chem., Int. Ed. 2012, 51, 10236.
(f) Engle, K. M.; Mei, T.-S.; Wasa, M.; Yu, J.-Q. Acc. Chem. Res. 2011, 45, 788.
(g) Zhang, C.; Tang, C.; Jiao, N. Chem. Soc. Rev. 2012, 41, 3464.
(h) Sun, C. L.; Li, B. J.; Shi, Z. J. Chem. Rev. 2011, 111, 1293.
(i) Ackermann, L.; Vicente, R.; Kapdi, A. R. Angew. Chem., Int. Ed. 2009, 48, 9792.
(j) Daugulis, O.; Do, H.-Q.; Shabashov, D. Acc. Chem. Res. 2009, 42, 1074. -
[10]
徐亚琼, 硕士论文, 河南师范大学, 新乡, 2015.Xu, Y. M. S. Thesis, Henan Normal University, Xinxiang, 2015.
-
[11]
(a) Berman, A. M.; Lewis, J. C.; Bergman, R. G.; Ellman, J. A. J. Am. Chem. Soc. 2008, 130, 14926.
(b) Tobisu, M.; Hyodo, I.; Chatani, N. J. Am. Chem. Soc. 2009, 131, 12070.
(c) Zhao, D.; Wang, W.; Yang, F.; Lan, J.; Yang, L.; Gao, G.; You, J. Angew. Chem., Int. Ed. 2009, 48, 3296. -
[12]
Wasa, M.; Worrell, B. T.; Yu, J. Q. Angew. Chem., Int. Ed. 2010, 49, 1275. doi: 10.1002/anie.200906104
-
[13]
(a) Tsai, C.-C.; Shih, W.-C.; Fang, C.-H.; Li, C.-Y.; Ong, T.-G.; Yap, G. P. J. Am. Chem. Soc. 2010, 132, 11887.
(b) Chen, Q.; du Jourdin, X. M.; Knochel, P. J. Am. Chem. Soc. 2013, 135, 4958. -
[14]
(a) Kwak, J.; Kim, M.; Chang, S. J. Am. Chem. Soc. 2011, 133, 3780.
(b) Boudet, N.; Lachs, J. R.; Knochel, P. Org. Lett. 2007, 9, 5525. -
[15]
(a) Iwai, T.; Sawamura, M. ACS Catal. 2015, 5, 5031.
(b) Stephens, D. E.; Larionov, O. V. Tetrahedron 2015, 71, 8683. -
[16]
(a) Liao, G. ; Shi, B. Acta Chim. Sinica 2015, 73, 1283 (in Chinese).
(廖港, 史炳锋, 化学学报, 2015, 73, 1283. )
(b) Voskressensky, L. G. ; Golantsov, N. E. ; Maharramov, A. M. Synthesis 2016, 48, 615. -
[17]
Suess, A. M.; Ertem, M. Z.; Cramer, C. J.; Stahl, S. S. J. Am. Chem. Soc. 2013, 135, 9797. doi: 10.1021/ja4026424
-
[18]
Guo, H.; Chen, M.; Jiang, P.; Chen, J.; Pan, L.; Wang, M.; Xie, C.; Zhang, Y. Tetrahedron 2015, 71, 70. doi: 10.1016/j.tet.2014.11.037
-
[19]
Xu, J.; Zhu, X.; Zhou, G.; Ying, B.; Ye, P.; Su, L.; Shen, C.; Zhang, P. Org. Biomol. Chem. 2016, 14, 3016. doi: 10.1039/C6OB00169F
-
[20]
Liu, X.-X.; Wu, Z.-Y.; Luo, X.-L.; He, Y.-Q.; Zhou, X.-Q.; Fan, Y.-X.; Huang, G.-S. RSC Adv. 2016, 6, 71485. doi: 10.1039/C6RA14863H
-
[21]
Rao, N. S.; Reddy, G. M.; Sridhar, B.; Sarma, M. H. Eur. J. Org. Chem. 2017, 2017, 438. doi: 10.1002/ejoc.201601151
-
[22]
Ding, J.; Li, W.; Ye, K.; Li, J. ChemistrySelect 2016, 1, 5874. doi: 10.1002/slct.201601108
-
[23]
He, X.; Xu, Y.-Z.; Kong, L.-X.; Wu, H.-H.; Ji, D.-Z.; Wang, Z.-B.; Xu, Y.-G.; Zhu, Q.-H. Org. Chem. Front. 2017, 4, 1046. doi: 10.1039/C6QO00644B
-
[24]
Su, Q.; Wu, Q.; Wu, C.; Zhou, H.; He, M.; Li, P.; Mu, Y. Synlett 2016, 27, 868. doi: 10.1055/s-00000083
-
[25]
Sahoo, H.; Ramakrishna, I.; Baidya, M. ChemistrySelect 2016, 1, 1949. doi: 10.1002/slct.201600532
-
[26]
Khan, B.; Kant, R.; Koley, D. Adv. Synth. Catal. 2016, 358, 2352. doi: 10.1002/adsc.v358.14
-
[27]
Wang, Y.; Wang, Y.; Jiang, K.; Zhang, Q.; Li, D. Org. Biomol. Chem. 2016, 14, 10180. doi: 10.1039/C6OB02079H
-
[28]
Sen, C.; Sahoo, T.; Ghosh, S. C. ChemistrySelect 2017, 2, 2745. doi: 10.1002/slct.201700380
-
[29]
Chen, J.; Wang, T.; Liu, Y.; Wang, T.; Lin, A.; Yao, H.; Xu, J. Org. Chem. Front. 2017, 4, 622. doi: 10.1039/C6QO00765A
-
[30]
Huang, C.-B.; Chen, L.-J.; Huang, J.; Xu, L. RSC Adv. 2014, 4, 19538. doi: 10.1039/c4ra02373k
-
[31]
Cong, X.; Zeng, X. Org. Lett. 2014, 16, 3716. doi: 10.1021/ol501534z
-
[32]
Reddy, M. D.; Fronczek, F. R.; Watkins, E. B. Org. Lett. 2016, 18, 5620. doi: 10.1021/acs.orglett.6b02848
-
[33]
Du, C.; Li, P.-X.; Zhu, X.; Suo, J.-F.; Niu, J.-L.; Song, M.-P. Angew. Chem., Int. Ed. 2016, 55, 13571. doi: 10.1002/anie.201607719
-
[34]
张家恒, 郝新奇, 王正龙, 任常久, 牛俊龙, 宋毛平, 有机化学, 2017, 37, 1237. http://sioc-journal.cn/Jwk_yjhx/EN/Y2017/V37/I5/1237Zhang, J.; Wang, Z.; Ren, C.; Niu, J.; Song, M. Chin. J. Org. Chem. 2017, 37, 1237(in Chinese). http://sioc-journal.cn/Jwk_yjhx/EN/Y2017/V37/I5/1237
-
[35]
Cui, M.; Liu, J.-H.; Lu, X.-Y.; Lu, X.; Zhang, Z.-Q.; Xiao, B.; Fu, Y. Tetrahedron Lett. 2017, 58, 1912. doi: 10.1016/j.tetlet.2017.02.090
-
[36]
Sahoo, H.; Reddy, M. K.; Ramakrishna, I.; Baidya, M. Chem. Eur. J. 2016, 22, 1592. doi: 10.1002/chem.201504207
-
[37]
Wu, Z.; He, Y.; Ma, C.; Zhou, X.; Liu, X.; Li, Y.; Hu, T.; Wen, P.; Huang, G. Asian J. Org. Chem. 2016, 5, 724. doi: 10.1002/ajoc.v5.6
-
[38]
Kuninobu, Y.; Nishi, M.; Kanai, M. Org. Biomol. Chem. 2016, 14, 8092. doi: 10.1039/C6OB01325B
-
[39]
Jin, L.-K.; Lu, G.-P.; Cai, C. Org. Chem. Front. 2016, 3, 1309. doi: 10.1039/C6QO00369A
-
[40]
Xu, J.; Qiao, L.; Ying, B.; Zhu, X.; Shen, C.; Zhang, P. Org. Chem. Front. 2017, 4, 1116. doi: 10.1039/C6QO00655H
-
[41]
Shen, C.; Xu, J.; Ying, B.; Zhang, P. ChemCatChem 2016, 8, 3560. doi: 10.1002/cctc.201601068
-
[42]
Chen, H.; Li, P. H.; Wang, M.; Wang, L. Org. Lett. 2016, 18, 4794. doi: 10.1021/acs.orglett.6b02166
-
[43]
Sahoo, H.; Mandal, A.; Selvakumar, J.; Baidya, M. Eur. J. Org. Chem. 2016, 2016, 4321. doi: 10.1002/ejoc.v2016.25
-
[44]
Chen, J.; Wang, T.; Wang, T.; Lin, A.; Yao, H.; Xu, J. Org. Chem. Front. 2016, 4, 130.
-
[45]
Liang, H. W.; Jiang, K.; Ding, W.; Yuan, Y.; Shuai, L.; Chen, Y. C.; Wei, Y. Chem. Commun. 2015, 51, 16928. doi: 10.1039/C5CC05527J
-
[46]
Qiao, H.; Sun, S.; Yang, F.; Zhu, Y.; Zhu, W.; Dong, Y.; Wu, Y.; Kong, X.; Jiang, L.; Wu, Y. Org. Lett. 2015, 17, 6086. doi: 10.1021/acs.orglett.5b03114
-
[47]
Fu, R.; Lu, T.; Chen, F.-W. Acta Phys.-Chim. Sin. 2014, 30, 628.
-
[48]
Xu, J.; Shen, C.; Zhu, X.; Zhang, P.; Ajitha, M. J.; Huang, K. W.; An, Z.; Liu, X. Chem. Asian J. 2016, 11, 882. doi: 10.1002/asia.v11.6
-
[49]
Li, J.-M.; Weng, J.; Lu, G.; Chan, A. S. C. Tetrahedron Lett. 2016, 57, 2121. doi: 10.1016/j.tetlet.2016.04.011
-
[50]
Wei, J.; Jiang, J.; Xiao, X.; Lin, D.; Deng, Y.; Ke, Z.; Jiang, H.; Zeng, W. J. Org. Chem. 2016, 81, 946. doi: 10.1021/acs.joc.5b02509
-
[51]
Liang, S.; Manolikakes, G. Adv. Synth. Catal. 2016, 358, 2371. doi: 10.1002/adsc.201600388
-
[52]
Xia, C.; Wang, K.; Xu, J.; Wei, Z.; Shen, C.; Duan, G.; Zhu, Q.; Zhang, P. RSC Adv. 2016, 6, 37173. doi: 10.1039/C6RA04013F
-
[53]
Ji, D.; He, X.; Xu, Y.; Xu, Z.; Bian, Y.; Liu, W.; Zhu, Q.; Xu, Y. Org. Lett. 2016, 18, 4478. doi: 10.1021/acs.orglett.6b01980
-
[54]
Wang, Y.; Wang, Y.; Guo, Z.; Zhang, Q.; Li, D. Asian J. Org. Chem. 2016, 5, 1438. doi: 10.1002/ajoc.201600389
-
[55]
Yin, Y.; Xie, J.; Huang, F.-Q.; Qi, L.-W.; Zhang, B. Adv. Synth. Catal. 2017, 359, 1037. doi: 10.1002/adsc.201600947
-
[56]
Dou, Y.; Xie, Z.; Sun, Z.; Fang, H.; Shen, C.; Zhang, P.; Zhu, Q. ChemCatChem 2016, 8, 3570. doi: 10.1002/cctc.201600874
-
[57]
Whiteoak, C. J.; Planas, O.; Company, A.; Ribas, X. Adv. Synth. Catal. 2016, 358, 1679. doi: 10.1002/adsc.v358.10
-
[58]
Khan, B.; Khan, A. A.; Bora, D.; Verma, D.; Koley, D. ChemistrySelect 2017, 2, 260. doi: 10.1002/slct.201601917
-
[59]
Zhu, X.; Qiao, L.; Ye, P.; Ying, B.; Xu, J.; Shen, C.; Zhang, P. RSC Adv. 2016, 6, 89979. doi: 10.1039/C6RA19583K
-
[60]
He, Y.; Zhao, N.; Qiu, L.; Zhang, X.; Fan, X. Org. Lett. 2016, 18, 6054. doi: 10.1021/acs.orglett.6b02998
-
[61]
Sadhu, P.; Alla, S. K.; Punniyamurthy, T. J. Org. Chem. 2015, 80, 8245. doi: 10.1021/acs.joc.5b01021
-
[62]
Xia, C.; Wang, K.; Xu, J.; Shen, C.; Sun, D.; Li, H.; Wang, G.; Zhang, P. Org. Biomol. Chem. 2017, 15, 531. doi: 10.1039/C6OB02375D
-
[63]
Wang, H.; Niu, Y.; Zhang, G.; Ye, X.-S. Tetrahedron Lett. 2016, 57, 4544. doi: 10.1016/j.tetlet.2016.08.086
-
[64]
Chen, F.-J.; Zhao, S.; Hu, F.; Chen, K.; Zhang, Q.; Zhang, S.-Q.; Shi, B.-F. Chem. Sci. 2013, 4, 4187. doi: 10.1039/c3sc51993g
-
[65]
Wang, C.; Yang, Y.; Qin, D.; He, Z.; You, J. J. Org. Chem. 2015, 80, 8424. doi: 10.1021/acs.joc.5b01302
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 43
- 文章访问数: 3973
- HTML全文浏览量: 862





 下载:
下载:















 下载:
下载:

