
Citation: Han Enjian, Guo Yong, Chen Qingyun. Copper-Mediated Addition Reactions to Styrenes with 1, 1, 1-Trifluoro-2, 2-dichloroethane or 1, 1, 1-Trifluoro-2, 2, 2-tricholorethane[J]. Chinese Journal of Organic Chemistry, 2017, 37(7): 1714-1720. doi: 10.6023/cjoc201702037

铜参与的1, 1, 1-三氟-2, 2-二氯乙烷及1, 1, 1-三氟-2, 2, 2-三氯乙烷与苯乙烯的加成反应研究
English
Copper-Mediated Addition Reactions to Styrenes with 1, 1, 1-Trifluoro-2, 2-dichloroethane or 1, 1, 1-Trifluoro-2, 2, 2-tricholorethane
-
氟氯烷烃(HCFCs)在氟化工产品中有举足轻重的地位, 这类化合物具有很多优良的性能, 如低毒、不燃及很好的溶解性、化学稳定性和热稳定性等, 主要用来做制冷剂、发泡剂和清洗剂.尽管用途广泛, 氟氯烷烃对环境具有负面影响, 主要表现在破坏臭氧层和导致温室效应两个方面[1].国际社会于1987年签订了《蒙特利尔协定》来限制其使用[1].此外, 由于氟原子的特殊性, 含氟化合物在农药, 医药等领域得到了广泛的应用[2], 如何将氟原子引入分子成为当今研究的热点[3].考虑到HCFCs本身就含有三氟甲基、二氟甲基、单氟甲基等基团, 如果能对其惰性的C—Cl进行有效的化学转化, 可以将其转变为便宜高效地含氟砌块.因此无论是从氟化学合成角度还是环境保护角度来看, 实现HCFCs惰性C—Cl键的转化都具有重大意义.
1, 1, 1-三氟-2, 2-二氯乙烷(HCFC-123) 是一种常用的工业清洗剂.这种廉价易得的工业原料中含有一个三氟甲基, 可以作为很好的三氟甲基砌块, 但目前对其研究的报道还比较少[4].
我们课题组一直致力于氟氯烷烃C—Cl键断裂的研究工作[5].其中, 对CF3CHCl2惰性C—Cl键的转化取得了一些成果:如实现了CF3CHCl2与苯酚[5d]、苯硫酚[5d]、亚磷酸酯[5f]以及与炔烃[5e]等亲核试剂的偶联反应; 但CF3CHCl2与活泼烯烃的反应研究尚未报道.该反应主要存在以下两个难点:一是C—Cl的键能比较大, 导致氟氯烷烃C—Cl键断裂比较困难, 不容易生成氟烷基自由基; 二是自由基与活泼烯烃的加成受烯烃聚合副反应的影响, 导致反应不能顺利的发生.因此, 如何实现CF3CHCl2与活泼烯烃的自由基加成反应具有一定的挑战性.近几年, 金属参与的卤代烷烃与活泼烯烃的原子转移自由基加成反应(ATRA)得到了广泛的应用[6], 该类反应通过金属卤化物快速的淬灭自由基加成产生的烷基自由基, 很好的避免烯烃聚合副反应的发生.基于以上研究, 我们发展了一类铜参与下CF3CH-Cl2与取代苯乙烯化合物的原子转移自由基加成反应.
1 结果与讨论
首先我们在亚磺化脱卤的条件下对CF3CHCl2与4-甲基苯乙烯(2a)的加成反应进行研究(Eq. 1):采用保险粉作还原剂, 二甲基亚砜(DMSO)作溶剂, 该方法能够有效地断裂HCFCs惰性的C—Cl生成氟烷基自由基[5a, 5g].以19F NMR跟踪实验结果发现:该反应在δ -74.5~-75.5之间出现多个杂峰, 反应没有得到单一的加成产物.考虑到产生的苄基自由基与苯乙烯发生加成聚合的速率远大于与氯原子转移淬灭的速率[7], 反应产生的可能是三氟一氯乙基自由基与4-甲基苯乙烯调聚的产物.
为了抑制反应聚合物的产生, 同时考虑到Cu在一定条件下能够断裂CF3CHCl2的C—Cl键, 并且被广泛地应用于卤代烃的ATRA反应中, 我们对Cu参与下CF3CHCl2与取代苯乙烯底物的加成反应进行了尝试.以4-苯基苯乙烯(2b)为底物进行实验, 研究发现:在30 mol%催化量的氯化亚铜, 30 mol% 2, 2'-联吡啶的条件下(Table 1, Entry 1), 1 equiv.的4-苯基苯乙烯(2b)与2 equiv.的CF3CHCl2在1, 2-二氯乙烷溶剂中反应8 h, 可以以27%的氟谱产率得到CF3CHCl2对4-联苯乙烯原子转移自由基加成的产物3b, dr值为2:1.通过进一步对氯化亚铜和配体2, 2'-联吡啶的投料比的考察(Table 1, Entries 2, 3), 发现当氯化亚铜的量为1 equiv., 联吡啶的量为2 equiv.时(Table 1, Entry 3), 反应效果最佳, 氟谱收率达到82%(dr值为2:1).

Entry 2/CuCl/ligand R Ligand Solvent Yieldb/% 1 1:0.3:0.3 Ph Bpy DCE 27 2 1:1:1 Ph Bpy DCE 49 3 1:1:2 Ph Bpy DCE 82 4 1:1:2 CH3 Bpy Toluene 0 5 1:1:2 CH3 Bpy DCM 64 6 1:1:2 CH3 Bpy DCE 92 7 1:1.2 CH3 Bpy THF 18 8 1:1.2 CH3 Bpy CH3CN 92 9 1:1.2 CH3 Bpy DMF 30 10 1:1.2 CH3 Bpy DMSO 59 11 1:1:2 CH3 Bpy iPrOH 67 12 1:1:0 CH3 — DCE 0 13 1:1:4 CH3 PPh3 DCE 0 14 1:1:4 CH3 Et2NH DCE 24 15 1:1:1.5 CH3 TMEDA DCE 51 16 1:1:1.5 CH3 PMDETA DCE 84 17 1:1:2 CH3 Dtbbpy DCE 31 18 1:1:2 CH3 Phen DCE 21 aReaction condition: 2 (0.5 mmol), 1a (1.0 mmol), DCE (2.0 mL). bYields were determined by 19F NMR spectroscopy using 4-(trifluoromethyl)anisole as an internal standard. 得到以上初步结果, 随后我们以4-甲基苯乙烯(2a)为底物对反应的溶剂和配体进行了筛选.在常规原子转移反应的溶剂乙腈、1, 2-二氯乙烷(Table 1, Entries 6, 8) 中, 反应产率比较高, 均为92%.而在其他的原子转移溶剂二氯甲烷、异丙醇中虽然也能得到中等产率的产物(Table 1, Entries 5, 11), 但反应中产生了少量的CF3CH2Cl; 当采用大极性溶剂DMF、DMSO (Table 1, Entries 9, 10) 时, 反应产率较低, 且有其他副产物产生; 以甲苯作溶剂时(Table 1, Entry 4), 反应不会发生.
反应中与铜配位的配体是很重要的.不添加配体反应不能进行(Table 1, Entry 12).文献中曾报道三苯基膦和胺与铜配位能显著提高铜的还原性[5c, 8], 但是在该反应中加入三苯基膦作配体时(Table 1, Entry 13), 反应不能发生.而当改用胺类配体Et2NH时(Table 1, Entry 14), 能够以24%的收率得到目标产物3a; 当选用更富电子的双齿氮配体四甲基乙二胺时(Table 1, Entry 15), 产率能提高到51%;选用三齿氮配体PMDETA时(Table 1, Entry 16), 产率能够达到84%, dr值为2:1;而采用不含有活泼质子的联吡啶作配体时, 反应效果最好(Table 1, Entry 6);使用其他联吡啶衍生物配体如4, 4'-二叔丁基-2, 2'-联吡啶(dtbbpy)和邻菲罗啉(phen), 反应产率降低(Table 1, Entries 17, 18)[9].
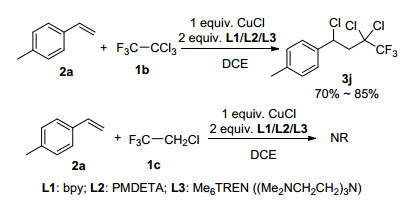
在我们优化的条件下, 将CF3CHCl2换为更活泼的CF3CCl3时, 反应也能够发生, 得到三氟二氯乙基自由基与苯乙烯的加成产物; 当底物换为更惰性的CF3CH2Cl时, 即使采用还原性更高的氮配体, 反应也不会发生(Scheme 1).
基于最优条件, 我们对反应底物的普适性进行了考察(Table 2).该反应对连有给电子基团的底物的反应性比较好, 如甲基、叔丁基、苯基和乙酰氧基等, 反应都能得到中等到优秀的产率; 而其他取代基如氯、溴等卤素原子也能很好地兼容; 另外, 无论是在芳基的3位还是在2位有取代基的烯烃, 反应都能进行, 值得指出的是2位取代的苯乙烯因为位阻原因, 产率有所降低.当以对甲氧基取代的苯乙烯为底物时, 反应只能得到少量的产物, 原因是原料4-甲氧基苯乙烯在反应体系下发生了分解; 而一些吸电子基团如氰基、硝基取代的苯乙烯反应性也不好, 可能是由于产生的氟烷基自由基为缺电子自由基, 其对吸电子基团取代的苯乙烯加成得到的苄基自由基稳定性较差的原因导致的.















aReaction conditions: 2 (0.5 mmol), 1a/1b (1.0 mmol), DCE (2.0 mL). bIsolated yield. 该反应的反应过程可能为金属参与的原子转移自由基加成机理(Scheme 2).联吡啶配位的一价铜具有强还原性, 通过单电子转移还原CF3CXCl2, 使其C—Cl键发生均裂, 产生氟烷基自由基(B)和二价铜; 氟烷基自由基与苯乙烯发生自由基加成反应产生较稳定的苄基自由基(C); 该苄基自由基可以迅速与配位的氯化铜发生氯原子转移反应得到产物, 从而避免与另一分子烯烃进行加成得到聚合物.该反应需要等量的氯化亚铜, 催化量的氯化亚铜只能得到催化量的产物.我们尝试在催化量的铜(10 mol%)条件下, 添加等量的还原剂锌粉或等量的自由基引发剂AIBN来实现一价铜物种的催化循环, 遗憾的是在该条件下反应反而不能发生.铜物种之所以不能循环可能是氯化铜中的氯元素转移到苄基自由基上生成的一价铜物种配位方式发生了改变, 导致其没有足够的还原性去还原CF3CXCl2惰性的C—Cl键.
2 结论
在本文中, 我们采用金属铜调控的原子转移自由基加成反应, 通过添加联吡啶来增强铜的还原性成功实现了CF3CHCl2较惰性C—Cl键的断裂, 并与活泼的苯乙烯类化合物反应生成单一的原子转移自由基加成产物.反应官能团兼容性好, 条件温和.产物还可以发生进一步的转化.这一方法很好地弥补了氟烷基自由基与烯烃加成反应的局限性, 并为HCFC-123的转化利用提供了新途径.
3 实验部分
3.1 仪器与试剂
溶剂均以标准方法处理纯化; 温度计未经校正, 熔点在上海精密科学仪器有限公司生产的SWG X-4显微熔点仪或上测定; 1H NMR谱在Bruker AM 300 (300 MHz), Varian 360L (300 MHz), 或Agilent (400 MHz)上测定, 用TMS作为内标; 19F NMR谱在Bruker AM 300 (283 MHz), Varian 360L (282 MHz), 或Agilent (376 MHz)上测定, 用CFCl3作为内标; 13C NMR谱在Bruker AV-400 (100 MHz)或Agilent MR400 (100 MHz)上测定, 用CDCl3作为内标; MS (EI)在HP-5973N型质谱仪上测定; HRMS (EI)在SATURN 2000型质谱仪测定; MS (ESI)在AGILENT1100型质谱仪或Shimadzu LCMS-2010EV型质谱仪测定; HRMS (ESI)谱用FTMS-7型质谱仪测定; 元素分析由Perkin-Elmer 2400 Series Ⅱ Elemental Analyzer测定; 红外光谱在Perkin-Elmer 983上测定.柱层析使用烟台化工厂生产的硅胶(300~400目).
3.2 实验方法
3.2.1 亚磺化脱卤下HCFC-123与4-甲基苯乙烯的反应
在5 mL的Schlenk管中加入Na2S2O4 (0.75 mmol)、碳酸氢钠(0.75 mmol), 抽换氮气三次, 在氮气保护下, 加入2 mL DMSO作溶剂, 1a (0.75 mmol)以及4-甲基苯乙烯(0.5 mmol), 拧紧Schlenk管于80 ℃油浴中加热6 h.反应冷却至室温.加入三氟甲苯作内标(0.4 mmol), 19F NMR检测, δ -74.5~-75.5出现多个杂峰.
3.2.2 铜参与的HCFC-123与取代苯乙烯加成反应
在5 mL的Schlenk管中加入CuCl (0.5 mmol)和2, 2'-联吡啶(1.0 mmol), 抽换氮气三次, 在氮气保护下, 加入2 mL二氯乙烷、1a/1b (1.0 mmol)以及取代苯乙烯(0.5 mmol), 拧紧Schlenk管于80 ℃油浴中加热8 h.反应冷却至室温.用二氯甲烷萃取, 抽滤过滤掉固体, 经水洗, 饱和食盐水洗2次, 无水硫酸钠干燥合并所得滤液经真空旋蒸, 柱层析分离得产物3.
(1, 3-二氯-4, 4, 4-三氟丁基)-4-甲基苯(3a):无色液体, 分离产率85%. 1H NMR (400 MHz, CDCl3) δ: 7.33~7.35 (m, 2H), 7.22~7.25 (m, 2H), 5.20 (dd, J=11.6, 2.0 Hz, 0.65H), 5.11 (dd, J=10.4, 5.6 Hz, 0.33H), 4.61~4.68 (m, 0.65H), 3.69~3.74 (m, 0.34H), 2.65~2.78 (m, 1.41H), 2.40 (s, 3.0H), 2.30~2.37 (m, 0.83H); 13C NMR (100 MHz, CDCl3) δ: 139.4, 139.0, 137.1, 135.4, 129.9, 129.6, 127.1, 126.8, , 124.1 (q, JCF=276 Hz), 123.7 (q, JCF=276 Hz), 59.2, 57.9, 55.8 (q, JCF=34 Hz), 54.6 (q, JCF=34 Hz), 41.2, 21.2, 21.1; 19F NMR (376 MHz, CDCl3) δ: -74.4 (d, J=7.5 Hz, 0.66×3F), -74.6 (d, J=7.5 Hz, 0.32×3F); IR (neat) ν: 3029, 2927, 2865, 1903, 1615, 1515, 1426, 1374, 1314, 1267, 1189, 1163, 1127, 1027, 937, 882, 837, 767, 741 cm-1; MS (EI) m/z: 270 (M+, 17), 235 (100); HRMS (EI) calcd for C11H11F3Cl2 270.0190, found 270.0192.
(1, 3-二氯-4, 4, 4-三氟丁基)-4-苯基苯(3b):无色液体, 分离产率75%. 1H NMR (400 MHz, CDCl3) δ: 7.59~7.65 (m, 4H), 7.45~7.51 (m, 4H), 7.37~7.41 (m, 1H), 5.24 (dd, J=11.2, 2.4 Hz 0.69H), 5.16 (dd, J=10.4, 5.2 Hz, 0.33H), 4.62~4.67 (m, 0.64H), 3.73~3.78 (m, 0.34H), 2.67~2.86 (m, 1.41H), 2.33~2.41 (m, 0.71H); 13C NMR (100 MHz, CDCl3) δ: 142.4, 142.1, 140.2, 140.1, 138.8, 137.2, 128.9, 128.9, 127.9, 127.7, 127.6, 127.3, 127.1, 124.0 (q, JCF=277 Hz), 123.7 (q, JCF=277 Hz), 59.0, 57.8, 55.5 (q, JCF=33 Hz), 54.6 (q, JCF=33 Hz), 41.2; 19F NMR (376 MHz, CDCl3) δ: -74.4 (d, J=6.4 Hz, 0.65×3F), -74.5 (d, J=6.4 Hz, 0.33×3F); IR (neat) ν: 3059, 3032, 2974, 1913, 1677, 1600, 1520, 1411, 1375, 1312, 1267, 1164, 1127, 1076, 952, 881, 841, 766 cm-1; MS (EI) m/z: 332 (M+, 27), 297 (100). HRMS (EI) calcd for C16H13F3Cl2 332.0346, found 332.0352.
(1, 3-二氯-4, 4, 4-三氟丁基)-4-叔丁基苯(3c):无色液体, 分离产率85%. 1H NMR (400 MHz, CDCl3) δ: 7.40~7.43 (m, 2H), 7.31~7.35 (m, 2H), 5.15 (dd, J=11.6, 2.0 Hz, 0.67H), 5.10 (dd, J=10.4, 5.2 Hz, 0.31H), 4.56~4.63 (m, 0.67H), 3.65~3.72 (m, 0.30H), 2.61~2.74 (m, 1.42H), 2.27~2.31 (m, 0.74H), 1.32~1.33 (m, 9.3H); 13C NMR (100 MHz, CDCl3) δ: 152.5, 152.2, 136.9, 135.3, 126.8, 126.6, 126.2, 125.9, 124.0 (q, JCF=277 Hz), 123.7 (q, JCF=280 Hz), 59.1, 57.9, 55.5 (q, JCF=33 Hz), 54.6 (q, JCF=33 Hz), 41.2, 34.7, 34.6, 31.3; 19F NMR (376 MHz, CDCl3) δ: -74.4 (d, J=6.8 Hz, 0.67×3F), -74.6 (d, J=6.8 Hz, 0.30×3F); IR (neat) ν: 3058, 3032, 2965, 2906, 2870, 1908, 1613, 1516, 1416, 1464, 1395, 1268, 1186, 1127, 1027, 938, 884, 835, 740 cm-1; MS (EI) m/z: 312 (M+, 14), 297 (100). HRMS (EI) calcd for C14H17F3Cl2 312.0659, found 312.0662.
(1, 3-二氯-4, 4, 4-三氟丁基)苯(3d)[5d]:无色液体, 分离产率90%; 1H NMR (400 MHz, CDCl3) δ: 7.31~7.42 (m, 5H), 5.18 (dd, J=11.6, 2.0 Hz, 0.65H), 5.10 (dd, J=10.4, 5.6 Hz, 0.27H), 4.57~4.65 (m, 0.67H), 3.65~3.70 (m, 0.30H), 2.63~2.81 (m, 1.31H), 2.84~2.36 (m, 0.72H); 19F NMR (376 MHz, CDCl3) δ: -74.5 (d, J=6.4 Hz, 0.71×3F), -74.6 (d, J=6.8 Hz, 0.29×3F);
1-氯-4-(1, 3-二氯-4, 4, 4-三氟丁基)苯(3e):无色液体, 分离产率79%. 1H NMR (400 MHz, CDCl3) δ: 7.33~7.40 (m, 4H), 5.14 (dd, J=11.6, 2.8 Hz 0.68H), 5.16 (dd, J=10.0, 6.0 Hz, 0.32H), 4.54~4.62 (m, 0.68H), 3.61~3.69 (m, 0.31H), 2.61~2.72 (m, 1.46H), 2.24~2.31 (m, 0.75H); 13C NMR (100 MHz, CDCl3) δ: 138.4, 136.9, 135.3, 134.9, 129.5, 129.2, 128.5, 128.2, 123.9 (q, JCF=277 Hz), 123.6 (q, JCF=277 Hz), 58.3, 57.1, 55.3 (q, JCF=35 Hz), 54.6 (q, JCF=35 Hz), 41.2; 19F NMR (376 MHz, CDCl3) δ: -74.5 (d, J=6.4 Hz, 0.65×3F), -74.6 (d, J=6.4 Hz, 0.33×3F); IR (neat) ν: 3034, 2976, 2930, 1901, 1775, 1651, 1598, 1493, 1411, 1338, 1311, 1164, 1128, 1026, 938, 832, 742 cm-1; MS (EI) m/z: 290 (M+, 17), 255 (100). HRMS (EI) calcd for C10H8F3Cl3 289.9644, found 289.9645.
4-(1, 3-二氯-4, 4, 4-三氟丁基)苯基乙酸酯(3f):白色固体, 分离产率70%. m.p. 47.2~50.5 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.41~7.43 (m, 2H), 7.10~7.15 (m, 2H), 5.16 (dd, J=11.6, 2.4 Hz, 0.64H), 5.08 (dd, J=10.0, 5.2 Hz, 0.33H), 4.54~4.62 (m, 0.65H), 3.66~3.74 (m, 0.32H), 2.61~2.73 (m, 1.38H), 2.23~2.31 (m, 3.80H); 13C NMR (100 MHz, CDCl3) δ: 169.2, 169.1, 151.2, 150.9, 137.4, 135.8, 128.3, 128.1, 123.9 (q, JCF=277 Hz), 123.6 (q, JCF=277 Hz), 122.4, 122.2, 58.4, 57.3, 55.3 (q, JCF=35 Hz), 54.4 (q, JCF=35 Hz), 41.2, 21.1; 19F NMR (376 MHz, CDCl3) δ: -74.5 (d, J=6.8 Hz, 0.66×3F), -74.6 (d, J=6.4 Hz, 0.33×3F); IR (neat) ν: 3062, 2977, 2928, 1758, 1607, 1511, 1427, 1371, 1314, 1224, 1189, 1127, 1028, 955, 940, 917, 855, 737 cm-1; MS (EI) m/z: 314 (M+, 4), 237 (100); HRMS (EI) calcd for C12H11O2F3Cl2 314.0088, found 314.0086.
1-溴-4-(1, 3-二氯-4, 4, 4-三氟丁基)苯(3g):无色液体, 分离产率64%. 1H NMR (400 MHz, CDCl3) δ: 7.51~7.55 (m, 2H), 7.28~7.30 (m, 2H), 5.12 (dd, J=11.6, 2.0 Hz 0.70H), 5.04 (dd, J=10.0, 5.6 Hz, 0.34H), 4.54~4.62 (m, 0.70H), 3.61~3.69 (m, 0.34H), 2.61~2.74 (m, 1.55H), 2.24~2.31 (m, 0.79H); 13C NMR (100 MHz, CDCl3) δ: 138.9, 137.4, 132.5, 132.2, 128.8, 128.5, 123.9 (q, JCF=277 Hz), 123.6 (q, JCF=277 Hz), 123.4, 123.0, 58.3, 57.1, 55.2 (q, JCF=36 Hz), 54.3 (q, JCF=36 Hz), 41.1; 19F NMR (376 MHz, CDCl3) δ: -74.4 (d, J=6.8 Hz, 0.67×3F), -74.6 (d, J=6.0 Hz, 0.32×3F); IR (neat) ν: 3030, 2975, 2929, 1901, 1779, 1648, 1593, 1490, 1426, 1408, 1376, 1311, 1267, 1189, 1128, 1011, 938, 881, 829 cm-1; MS (EI) m/z: 334 (M+, 14), 301 (100). HRMS (EI) calcd for C10H8F3Cl2Br 333.9139, found 333.9138.
1-溴-3-(1, 3-二氯-4, 4, 4-三氟丁基)苯(3h):无色液体, 分离产率73%. 1H NMR (400 MHz, CDCl3) δ: 7.56~7.58 (m, 1H), 7.47~7.50 (m, 1H), 7.33~7.51 (m, 1H), 7.24~7.30 (m, 1H), 5.11 (dd, J=12.0, 2.8 Hz 0.73H), 5.02 (dd, J=10.0, 6.0 Hz, 0.36H), 4.54~4.62 (m, 0.73H), 3.66~3.74 (m, 0.36H), 2.60~2.71 (m, 1.62H), 2.25~2.33 (m, 0.82H); 13C NMR (100 MHz, CDCl3) δ: 142.0, 140.7, 132.5, 132.1, 130.7, 130.5, 130.3, 130.0, 125.7, 125.5, 124.5 (q, JCF=277 Hz), 123.6 (q, JCF=277 Hz), 123.2, 122.9, 58.1, 57.0, 55.2 (q, JCF=36 Hz), 54.3 (q, JCF=36 Hz), 41.2; 19F NMR (376 MHz, CDCl3) δ: -74.4 (d, J=6.4 Hz, 0.66×3F), -74.5 (d, J=6.0 Hz, 0.32×3F); IR (neat) ν: 3062, 2972, 1952, 1872, 1756, 1696, 1572, 1477, 1428, 1376, 1312, 1267, 1188, 1164, 1127, 1074, 1026, 955, 941, 894, 827 cm-1; MS (EI) m/z: 334 (M+, 22), 301 (100). HRMS (EI) calcd for C10H8F3Cl2Br (M+) 333.9139, found 333.9139.
(1, 3, 3-三氯-4, 4, 4-三氟丁基)苯(3i):无色液体, 分离产率92%. 1H NMR (400 MHz, CDCl3) δ: 7.35~7.46 (m, 5H), 5.37 (t, J=6.0 Hz, 1H), 3.15 (dm, J=6.0 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 140.6, 129.0, 128.9, 127.3, 122.6 (q, JCF=280 Hz), 82.8 (q, JCF=35 Hz), 57.1, 49.3; 19F NMR (376 MHz, CDCl3) δ: -81.9 (s, 3F); IR (neat) ν: 3067, 3034, 2943, 1949, 1602, 1495, 1456, 1429, 1261, 1205, 1033, 983, 903, 698 cm-1; MS (EI) m/z: 290 (M+, 14), 125 (100). HRMS (EI) calcd for C10H8F3Cl3 289.9644, found 289.9647.
1-(1, 3, 3-三氯-4, 4, 4-三氟丁基)-4-甲基苯(3j):无色液体, 分离产率79%. 1H NMR (400 MHz, CDCl3) δ: 7.35 (d, J=8.0 Hz, 2H), 7.21 (d, J=8.0 Hz, 2H), 5.37 (t, J=6.0 Hz, 1H), 3.07~3.22 (m, 2H), 2.38 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 139.0, 137.7, 129.6, 127.2, 122.1 (q, JCF=280 Hz), 82.9 (q, JCF=35 Hz), 57.1, 49.2, 21.2; 19F NMR (376 MHz, CDCl3) δ: -81.9 (s, 3F); IR (neat) ν: 3028, 2925, 2865, 1901, 1614, 1515, 1429, 1262, 1205, 1073, 1033, 983, 942, 819, 777 cm-1; MS (EI) m/z: 304 (M+, 18), 269 (100). HRMS (EI) calcd for C11H10F3Cl3 303.9800, found 303.9805.
1-(1, 3, 3-三氯-4, 4, 4-三氟丁基)-4-苯基苯(3k):黄色固体, 分离产率90%. m.p. 61.2~66.5 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.66 (t, J=8.0 Hz, 4H), 7.56 (d, J=8.0 Hz, 2H), 7.56 (d, J=8.0 Hz, 2H), 7.40 (d, J=8.0 Hz, 1H), 5.48 (t, J=6.0 Hz, 1H), 3.24 (dm, J=6.0 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 142.0, 140.3, 139.6, 128.9, 127.8, 127.7, 127.1, 126.7, 124.9 (q, JCF=280 Hz), 82.9 (q, JCF=35 Hz), 57.0, 49.3; 19F NMR (376 MHz, CDCl3) δ: -81.6 (s, 3F); IR (neat) ν: 3083, 3030, 2950, 1486, 1431, 1411, 1262, 1206, 1075, 1036, 983, 910, 878, 743, 692 cm-1; MS (EI) m/z: 366 (M+, 29), 331 (100). HRMS (EI) calcd for C16H12F3Cl3 365.9957, found 365.9953.
1-氯-4-(1, 3, 3-三氯-4, 4, 4-三氟丁基)苯(3l):无色液体, 分离产率89%. 1H NMR (400 MHz, CDCl3) δ: 7.35~7.40 (m, 4H), 5.33 (t, J=6.0 Hz, 1H), 3.10 (dm, J=6.0 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 139.0, 134.9, 128.4, 123.4, 121.9 (q, JCF=280 Hz), 82.6 (q, JCF=35 Hz), 56.3, 49.2; 19F NMR (376 MHz, CDCl3) δ: -79.9 (s, 3F); IR (neat) ν: 3030, 1899, 1598, 1493, 1429, 1262, 1206, 1093, 1073, 985, 878, 803 cm-1; MS (EI) m/z: 324 (M+, 14), 159 (100). HRMS (EI) calcd for C10H7F3Cl4 323.9254, found 323.9250.
1-溴-3-(1, 3, 3-三氯-4, 4, 4-三氟丁基)苯(3m):无色液体, 分离产率77%. 1H NMR (400 MHz, CDCl3) δ: 7.58 (dd, J=1.0 Hz, 8.0 Hz, 2H), 7.38 (td, J=6.0, 1.0 Hz, 1H), 7.23~7.16 (m, 1H), 5.94 (t, J=6.0 Hz, 1H), 3.12 (dm, J=6.0 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 139.7, 133.3, 130.3, 129.3, 128.3, 122.8, 122.1 (q, JCF=280 Hz), 82.6 (q, JCF=35 Hz), 55.4, 48.3; 19F NMR (376 MHz, CDCl3) δ: -80.2 (s, 3F); IR (neat) ν: 3063, 1923, 1800, 1589, 1570, 1472, 1441, 1262, 1206, 1074, 1025, 976, 908, 757 cm-1; MS (EI) m/z: 368 (M+, 13), 205 (100). HRMS (EI) calcd for C10H7F3Cl3Br 367.8749, found 367.8748.
1-氯-2-(1, 3, 3-三氯-4, 4, 4-三氟丁基)苯(3n):无色液体, 分离产率77%. 1H NMR (400 MHz, CDCl3) δ: 7.59 (t, J=1.6 Hz, 1H), 7.46~7.49 (dm, J=8.0 Hz, 1H), 7.35~7.37 (dm, J=8.0 Hz, 1H), 7.23~7.27 (m, 1H), 5.29 (t, J=6.0 Hz, 1H), 3.11 (dm, J=6.0 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 142.7, 132.2, 130.5, 130.4, 125.9, 122.8, 121.9 (q, JCF=280 Hz), 82.3 (q, JCF=35 Hz), 56.1, 49.2; 19F NMR (376 MHz, CDCl3) δ: -79.9 (s, 3F); IR (neat) ν: 3063, 2964, 1942, 1870, 1762, 1572, 1508, 1429, 1262, 1206, 1095, 1073, 987, 912, 833, 695 cm-1; MS (EI) m/z: 368 (M+, 14), 205 (100). HRMS (EI) calcd for C10H7-F3Cl3Br 367.8749, found 367.8755.
辅助材料(Supporting Information) 化合物3a~3n的1H NMR, 19F NMR和13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Banks, R. E. J. Fluorine Chem. 1994, 67, 193.
(b) Good, D. A.; Francisco, J. S. Chem. Rev. 2003, 103, 4999. -
[2]
For recent reviews and papers, see: (a) Smart, B. E. J. Fluorine Chem. 2001, 109, 3.
(b) Maienfisch, P. ; Hall, R. G. Chimia 2004, 58, 93.
(c) Special issue on "Fluorine in the Life Sciences": Chem. Biol. Chem. 2004, 5, 557.
(d) Muller, K. ; Faeh, C. ; Diederich, F. Science 2007, 317, 1881.
(e) Purser, S. ; Moore, P. R. ; Swallow, S. ; Gouverneur, V. Chem. Soc. Rev. 2008, 37, 320.
(f) Chen, Y. -Z. ; Ren, Y. -J. Chin. J. Org. Chem. 2015, 35, 1123 (in Chinese).
(陈衍炽, 任玉杰, 有机化学, 2015, 35, 1123. )
(g) Liu, T. -T. ; Ni, Y. ; Zhong, L. -K. ; Huang, H. -Y. ; Hu, W. Q. ; Xu, T. -M. ; Tan, C. -X. Chin. J. Org. Chem. 2015, 35, 422 (in Chinese).
(刘婷婷, 倪芸, 钟良坤, 黄红英, 胡伟群, 许天明, 谭成侠, 有机化学, 2015, 35, 422. ) -
[3]
(a) Xu, J. -B. ; Chen, P. -H. ; Ye, J. -X. ; Liu, G. S. Acta Chim. Sinica 2015, 73, 1294 (in Chinese).
(徐佳斌, 陈品红, 叶金星, 刘国生, 化学学报, 2015, 73, 1294. )
(b) Zhang, K. ; Xu, X. -H. ; Qing, F. -L. Chin. J. Org. Chem. 2015, 35, 556 (in Chinese).
(张柯, 徐修华, 卿凤翎, 有机化学, 2015, 35, 556. )
(c) He, J. -Q. ; Lou, S. -J. ; Xu, D. -Q. Acta Chim. Sinica 2016, 36, 1218 (in Chinese).
(何将旗, 娄绍杰, 许丹倩, 有机化学, 2016, 36, 1218. )
(d) Ni, C. -F. ; Zhu, L. -G. ; Hu, J. -B. Acta Chim. Sinica 2015, 73, 90 (in Chinese).
(倪传法, 朱林桂, 胡金波, 化学学报, 2015, 73, 90. )
(e) Li, G. -M. ; Sun, D. -Q. Chin. J. Org. Chem. 2016, 36, 1715 (in Chinese).
(李恭铭, 孙德群, 有机化学, 2016, 36, 1715. )
(f) Zhang, B. ; Zhang, X. -G. Chin. J. Chem. 2016, 34, 477.
(g) Yang, B. ; Xu, S. -H. ; Qing, F. -L. Chin. J. Chem. 2016, 34, 465.
(h) Zhang, Z. -K. ; Yu, W. -Z. ; Zhou, Q. ; Li, T. -J. ; Zhang, Y. ; Wang, J. -B. Chin. J. Chem. 2016, 34, 473. -
[4]
(a)Tamura, M.; Sekiya, A. J. Fluorine Chem. 1995, 71, 119.
(b) Aoyama, H. WO 9412454, 1994 [Chem. Abstr. 1994, 121, 179088].
(c) Xu, Y.; Dolbier, W. R. Jr.; Rong, X. X. J. Org. Chem. 1997, 62, 1576. -
[5]
(a) Long, Z.-Y.; Chen, Q.-Y. J. Org. Chem. 1999, 64, 4775.
(b) Huang, X.-T.; Chen, Q.-Y. J. Org. Chem. 2001, 66, 4651.
(c) Tang, X.-J.; Chen, Q.-Y. Chem. Sci. 2012, 3, 1694.
(d) Tang, X.-J.; Chen, Q.-Y. Org. Lett. 2012, 14, 6214.
(e) Han, E.-J.; Sun, Y.; Shen, Q.; Chen, Q.-Y.; Guo, Y.; Huang, Y.-G. Org. Chem. Front. 2015, 2, 1379.
(f) Luo, J.; Han, E.-J.; Shen, Q.; Huang, M.; Huang, Y. -J.; Liu, H.; Wang, W.; Chen, Q.-Y.; Guo, Y. Org. Process Res. Dev. 2016, 20, 1988.
(g) Zhang, C.-P.; Chen, Q.-Y.; Guo, Y.; Xiao, J.-C.; Gu, Y.-C. Chem. Soc. Rev. 2012, 41, 4536. -
[6]
(a) De Malde, M.; Minisci, F.; Pallini, U.; Volterra, E.; Quilico, A. Chim. Ind. (Milan) 1956, 38, 371.
(b) Iqbal, J.; Bhatia, B.; Nayyar, N. K. Chem. Rev. 1994, 94, 519.
(c) Nagashim, H.; Ozaki, N.; Ishii, M.; Seki, K.; Washiyama M.; Itoh, K. J. Org. Chem. 1993, 58, 464.
(d) Nishikata, T.; Noda, Y.; Fujimoto, R.; Sakashita, T. J. Am. Chem. Soc. 2013, 135, 16372. -
[7]
Odian, G. Principle of Polymerization, 4th ed., John Wiley & Sons, Hoboken, 2004.
-
[8]
Eckenhoff, W. T.; Pintauer, T. Catal. Rev. 2010, 52, 1. doi: 10.1080/01614940903238759
-
[9]
Udding, J. H.; Hiemstra, H.; Speckamp, W. N. J. Chem. Soc., Perkin Trans. 21992, 1529. https://www.researchgate.net/publication/279998925_Radical-transfer_catalysis_versus_lewis_acid_catalysis_by_the_copper(I)_chloride22-bipyridine_complex_An_illustration_of_the_synthetic_significance_of_captodative_radical_stabilization
-
[1]
-
表 1 优化反应条件a
Table 1. Screening of the reaction conditions

Entry 2/CuCl/ligand R Ligand Solvent Yieldb/% 1 1:0.3:0.3 Ph Bpy DCE 27 2 1:1:1 Ph Bpy DCE 49 3 1:1:2 Ph Bpy DCE 82 4 1:1:2 CH3 Bpy Toluene 0 5 1:1:2 CH3 Bpy DCM 64 6 1:1:2 CH3 Bpy DCE 92 7 1:1.2 CH3 Bpy THF 18 8 1:1.2 CH3 Bpy CH3CN 92 9 1:1.2 CH3 Bpy DMF 30 10 1:1.2 CH3 Bpy DMSO 59 11 1:1:2 CH3 Bpy iPrOH 67 12 1:1:0 CH3 — DCE 0 13 1:1:4 CH3 PPh3 DCE 0 14 1:1:4 CH3 Et2NH DCE 24 15 1:1:1.5 CH3 TMEDA DCE 51 16 1:1:1.5 CH3 PMDETA DCE 84 17 1:1:2 CH3 Dtbbpy DCE 31 18 1:1:2 CH3 Phen DCE 21 aReaction condition: 2 (0.5 mmol), 1a (1.0 mmol), DCE (2.0 mL). bYields were determined by 19F NMR spectroscopy using 4-(trifluoromethyl)anisole as an internal standard. 表 2 底物扩展a, b
Table 2. Substrate scope for the reaction















aReaction conditions: 2 (0.5 mmol), 1a/1b (1.0 mmol), DCE (2.0 mL). bIsolated yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 4
- 文章访问数: 1607
- HTML全文浏览量: 180



 下载:
下载:

 下载:
下载:

