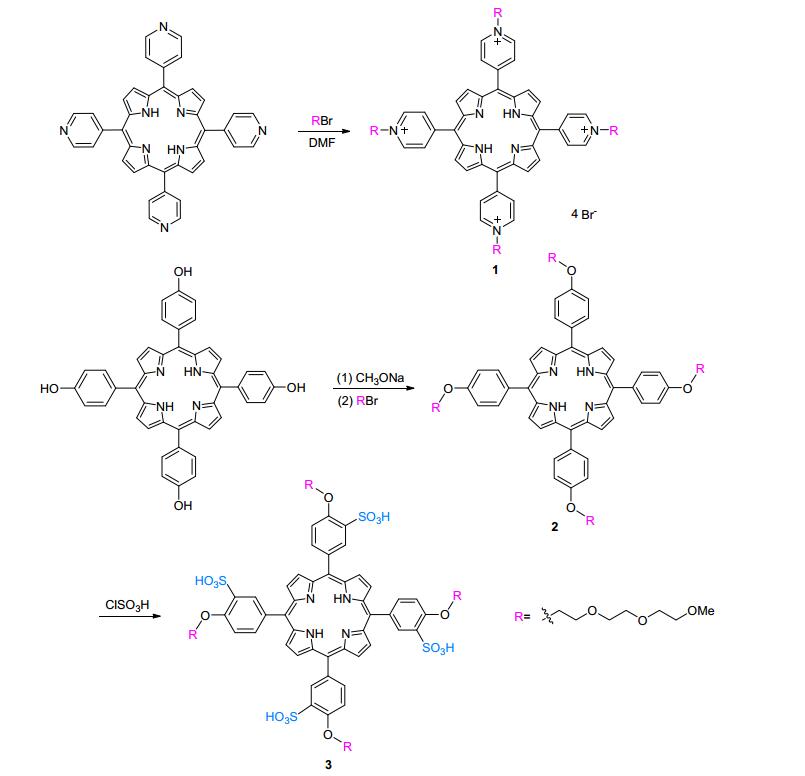
 图式1
两种不同类型水溶性卟啉的合成方法
Scheme1.
Synthesis of two different types of water-soluble porphyrins
图式1
两种不同类型水溶性卟啉的合成方法
Scheme1.
Synthesis of two different types of water-soluble porphyrins

Citation: Chang Yi, Liu Mengyang, Niu Mengyuan. Efficient Synthesis of Anionic and Cationic Water-Soluble Porphyrins[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2442-2448. doi: 10.6023/cjoc201702035

阴、阳离子型水溶性卟啉的有效合成
English
Efficient Synthesis of Anionic and Cationic Water-Soluble Porphyrins
-
Key words:
- water-soluble
- / porphyrins
- / manganese porphyrin
- / substituents
- / synthesis
- / modification
-
卟啉及金属卟啉在自然界的各种生命活动中有着举足轻重的作用.它们广泛地存在于生物体内和能量转移紧密关联的重要组织器官中, 动物体内的血红素(铁卟啉)和血蓝素(铜卟啉)、植物体内的维生素B12(钴卟啉)和叶绿素(镁卟啉)等天然卟啉化合物无不在氧的传递、光合作用、电子传输和能量产生等生命活动具有令人惊叹的生理功能[1].同时, 由于具有耐热、耐光、耐酸、耐碱稳定性和优异的光电性质, 使得它们在光学材料器件[2]、太阳能利用[3]、离子识别[4]、催化[5]等诸多技术领域得到了广泛应用; 而且由于卟啉本身的特殊机构和易修饰性, 使得它们在生物活性模拟[6]、光动力治疗[7]、医药[8]等与生命活动相关的技术领域日益显现出极为诱人的应用前景.
卟啉化合物的生物活性研究要求研究对象必须具有良好的水溶性.通过在卟啉的芳环上引入亲水性基团, 可以将各种疏水性卟啉转变为亲水性卟啉.水溶性卟啉的研究已经有一百多年的时间, 但具备良好水溶性同时, 给分离提纯等后处理操作带来更大的挑战, 使水溶性卟啉的应用研究受到很大制约.因此, 如何高效、简捷地合成得到水溶性卟啉一直是该领域研究的热点问题.离子化法是制备水溶性卟啉的主要方法之一[9], 通过卟啉中吡啶基、氨基质子化形成阳离子型水溶性卟啉; 或经由磺化反应引入磺酸根、也可通过羧酸脂基水解的方法得到阴离子型水溶性卟啉; 多种类型的功能性基团可以通过酰化、取代或配位等简单的反应引入到卟啉体系中, 从而满足卟啉功能性结构设计要求, 这对于卟啉化合物的生物活性研究有着积极的作用[10].
离子型水溶性卟啉的方法目前在实际研究过程中仍存在着不少问题, 如阳离子化不完全、磺化过度导致的副产物较多、金属配位反应进行不彻底、收率较低、后处理复杂等.因此发展简便、高效、低成本、后处理难度小的新条件、新方法是水溶性卟啉合成研究的重要方向.本文通过新的反应条件, 以meso-四(4-吡啶基)卟啉和meso-四(4-羟基苯基)卟啉作为起始原料, 可以高效地得到阴、阳两类不同离子类型的水溶性卟啉化合物(Scheme 1), 并通过取代基团修饰、金属离子配位的方法达到功能化修饰的目的, 整个合成过程操作简单, 提纯分离操作简单.
1 结果与讨论
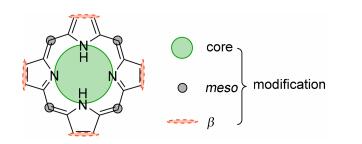
1.1 功能性修饰
独特的性能是卟啉化合物生理活性研究所必须具备的特征.卟啉化合物独特的性能是通过金属离子和取代基团的功能性修饰实现的(图 1), 本文研究通过锰离子配位和三乙二醇单甲醚基团取代达到卟啉功能性修饰的目的, 希望通过这类修饰方法能够得到一种性质优良的医学诊断造影剂.
磁共振成像(MRI)目前是医学造影诊断中最常用的技术之一, 目前临床广泛使用的是小分子钆基配合物[11], 但近年的研究结果发现, 钆基造影剂容易引起生物体肾细胞的纤维化(NSF)[12], 因此, 如何设计靶向性更高[13]、对人体造成伤害更小的造影剂有着重要的现实意义.顺磁性金属卟啉化合物由于具有较强的MRI造影信号被认为是一类“肿瘤特异性”MRI造影剂, 在医学造影诊断中的有很好的应用前景.本实验选取的锰离子具有较强的顺磁性, 同时也是人体内存在的微量金属元素之一, 因此是取代外源性钆离子作为医学造影剂的理想金属元素; 三乙二醇单甲醚基团具有特异性的DNA分子识别能力[14], 这可以显著地改善分子的靶向性.
1.2 阴、阳离子类型水溶性卟啉合成方法
将meso-四(4-吡啶基)卟啉和过量的溴代三乙二醇单甲醚混合在少量的溶剂中加热反应, 常用的反应溶剂是N, N-二甲基甲酰胺(DMF)[15], 反应结束后, 分离提纯即可得到目标化合物.通常经过很长时间的反应后, 原料中的四个吡啶基依然有大部分未能充分反应, 给后处理和产物的提纯带来很大的麻烦.我们发现, 化合物在DMF中溶解度较低是造成取代反应不完全的主要原因.从改善溶解度的角度出发, 尝试了多种溶剂体系, 发现在DMF和醇(甲醇效果最好)的混合溶剂体系中, 反应进行的较为充分.在此基础上, 考察了不同比例混合溶剂条件对该类反应的影响(表 1).可以看出, 两种溶剂在混合溶剂中的比例对反应有着重大的影响, DMF和甲醇的比例在4:1附近时, 反应进行的最为彻底, 收率显著提高, 但是随着甲醇比例的提高, 收率显著下降, 在甲醇体系中则没有检测到产物.分析认为, 由于取代产物在醇中有着较高的溶解度, 加入少量的甲醇后打破了溶解平衡, 使得取代反应向正向进行; 但是随着甲醇比例的增加,meso-四(4-吡啶基)卟啉的溶解度大大降低, 参与反应的卟啉减少, 造成同样反应时间内产率显著降低, 整个反应处于二者的动态平衡之中, 单一溶剂体系很难协调处理两种平衡移动的方向, 因此, 合适比例的混合溶剂体系是该类型反应的最优化条件.
 表 1
吡啶基阳离子型卟啉合成反应条件优化a
Table 1.
Optimization of reaction conditions for the synthesis of pyridinium cationic porphyrin.
表 1
吡啶基阳离子型卟啉合成反应条件优化a
Table 1.
Optimization of reaction conditions for the synthesis of pyridinium cationic porphyrin.
Entry V(DMF)/mL V(CH 3OH)/mL Yield/% 1 5 — 51 2 4 1 80 3 3 2 65 4b 2 3 32 5b 1 4 10 6b — 5 — a反应条件: meso-四(4-吡啶基)卟啉(100 mg, 1 equiv.)和溴代三乙二醇单甲醚(20 equiv.), 反应温度100 ℃, 反应时间12 h; b反应温度65 ℃, 反应时间24 h. 由卟啉制备阴离子型水溶性卟啉, 浓硫酸磺化引入磺酸根是常用的方法[16].未经过特殊修饰卟啉, 如meso-四(4-苯基)卟啉(H2TPP), 在浓硫酸溶液中有较高的稳定性, meso-位的苯环上只进行单一的磺化反应而不引发复杂的副反应.但是对于meso-位苯环上有功能性取代基团修饰的卟啉, 取代基团很难在浓硫酸中保持稳定, 同样的磺化反应条件下, 副反应较多, 分离提纯十分困难.氯磺酸也是一类常用的磺化试剂, 磺化反应的条件也较为温和, 对于含有特殊功能性基团修饰的卟啉来说, 用氯磺酸进行磺化较为适宜.我们以氯仿作为稀释剂, 从ClSO3H的用量、反应温度、反应时间三个方面对反应条件进行正交试验优化选择(表 2).温度的影响要大于其它两个因素, 综合三个方面因素, 得到了该类型卟啉化合物的最佳反应条件:低温条件下, 卟啉同20 equiv.的氯磺酸反应60 min即得到磺化产物, 经过反相柱分离可得到单一的磺化产物, 收率高.
 表 2
不同实验条件对卟啉磺化反应的影响a
Table 2.
Influences on the sulfonation of porphyrin with different reaction conditions
表 2
不同实验条件对卟啉磺化反应的影响a
Table 2.
Influences on the sulfonation of porphyrin with different reaction conditions
Entry ClSO3H/equiv. T/℃ Time/min Yield/% 1 10 0 15 38 2 10 20 30 45 3 10 40 60 42 4 20 0 60 85 5 20 20 15 62 6 20 40 30 52 7 30 0 30 70 8 30 20 60 56 9 30 40 15 27 a反应条件: meso-四(4-三乙二醇单甲醚氧基)卟啉(0.16 mmol), 溶剂CHCl3 (2 mL). 1.3 卟啉锰配合物的合成
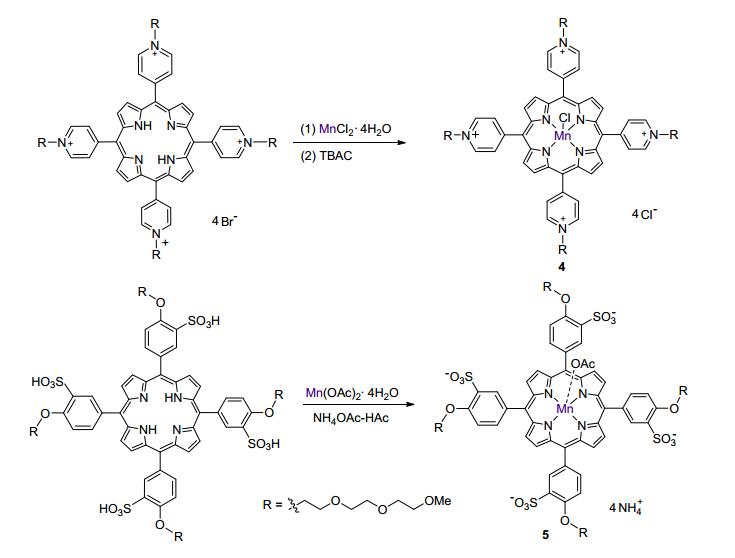
卟啉锰配合物是由卟啉和金属锰盐在加热的条件下反应生成[17], 对于非水溶性卟啉来说, 反应完毕后只需要经过简单的硅胶柱提纯, 除去无机盐分和少量杂质即可得到纯净的化合物.但是对于应用于生理活性研究的水溶性卟啉来说, 必须减少产物中水溶性杂质的干扰, 相对于非水溶性卟啉, 其后处理过程较为繁琐.因此在合成水溶性卟啉化合物时, 需要尽量减少反应过程中杂质离子的引入, 从而在保证产物的纯度同时降低后处理难度(Scheme 2).
合成阳离子型水溶性锰卟啉化合物, 溶液中同时存在着Cl-和Br-两种阴离子, 通过离子交换方法, 利用NH4PF6中的阴离子 PF6-将金属卟啉阳离子以沉淀的形式从水相中分离出来, 去除Cl-和Br-的干扰, 之后再将沉淀溶解在丙酮溶液中, 通过加入四丁基氯化铵或四丁基溴化胺, 使最终产物以单一组分形式沉淀析出.利用这种方法一方面使产物中只含有单一种类阴离子; 另一方面在多次溶解、沉淀、过滤、洗涤的过程中除去了产物中存在的少量杂质, 提高了产品的纯度.
在阴离子型水溶性锰卟啉中, 分子中存在四个磺酸根基团, 溶解后体系的酸度较大, 不利于卟啉和金属的配位反应; 而在碱性体系中反应, 相应的过渡金属离子易生产沉淀, 阻碍配位反应进行, 因此对于该类型反应, 反应过程中pH始终保持近中性是最理想的反应条件.因此, 我们选择醋酸盐-醋酸的缓冲溶液作为反应体系, 保证反应过程中体系的pH一直保持在理想的范围内; 同时选用锰的醋酸盐, 维持整个体系中阴离子种类的单一性, 减化提纯操作过程, 提高产物的纯度.
1.4 卟啉化合物的紫外-可见吸收光谱
卟啉化合物具有特殊的电子结构, 对应的紫外吸收光谱具有自身特征吸收类型.根据Gouterman前线轨道理论(Gouterman Four Orbital Model)[18], 卟啉在受光激发后可产生两种方式的跃迁, 由于两种跃迁所需能量相近, 通过组态相互作用, 产生卟啉的特征电子吸收光谱, 在380~450 nm左右的强峰(Soret谱带, 又称B峰)来源于基态至第二激发态引起的跃迁, 而在500~700 nm左右的若干弱吸收谱带(Q峰)则来源于基态至第一激发态的跃迁.以其中两个化合物为例, 图 2a为未配位卟啉3的紫外-可见吸收光谱图, B带吸收位于412 nm, 强吸收峰, Q带则为分散在515, 553, 581, 634 nm处的四个弱吸收峰组成. 图 2b为锰卟啉5的紫外吸收光谱图, 卟啉和锰离子结合后, 吸收光谱发生了较大的变化, B带强吸收峰由412 nm红移到了462 nm, 这是由于金属卟啉的电子吸收光谱受中心金属离子的影响比较大, 与中心金属离子外层d轨道的能级分裂所占据的电子数有关.金属离子的配位使得卟啉体系的对称性增大, 分子轨道能级简并度增强, 电子跃迁种类减少, Q带吸收峰的数目也相应地减少.同时由于轴向配位作用会降低卟啉环HOMO和LUMO之间的能极差, 因此吸收峰会有相应的红移效果. 382, 402, 422 nm处较强的吸收峰是锰离子卟啉配位后形成新的分子轨道产生的电子跃迁吸收, 通过未配位卟啉和锰卟啉电子吸收光谱之间的显著差异, 可以很方便地监测卟啉配位反应进程, 控制反应时间.
2 结论
本文以meso-四(4-吡啶基)卟啉和meso-四(4-羟基苯基)卟啉为原料, 通过DMF/甲醇混合溶剂体系和氯磺酸磺化高效地合成了吡啶基阳离子型水溶性卟啉和含磺酸根阴离子型水溶性卟啉, 通过引入三乙二醇单甲醚单元以及金属锰离子配位, 希望能够达到化合物功能性设计的目的.该类离子型水溶性卟啉的制备方法具有后处理操作简单、反应条件温和、收率高等优点.
3 实验部分
3.1 仪器与试剂
UV-Vis谱用SHIMADZU UV-1800型紫外-可见光分光光度计测定; 1H NMR、13C NMR用Bruker Avance-300 MHz和Bruker Advance Ⅲ HD 600 MHz核磁共振仪测定; 元素分析用PE-2400型元素分析仪测定; 高分辨质谱用Bruker micro Tof Ⅱ型质谱仪测定; 高效液相色谱采用Dionex Ultimate 3000 system型色谱仪; 熔点由SGW®X-4显微熔点仪测定.吡咯(分析纯使用前重新蒸馏)、吡啶-4-甲醛、对羟基苯甲醛、三乙二醇单甲醚、三溴化磷等试剂均从阿拉丁试剂公司购置, 三氯甲烷、甲醇等常用溶剂均为成都科龙化工试剂厂产品.
3.2 卟啉配体及配合物的合成
meso-四(4-吡啶基)卟啉和meso-四(4-羟基苯基)卟啉通过改良Adler-Longo卟啉合成方法[19]得到.将醛溶解在适量的丙酸溶液中, 搅拌均匀, 加热至80 ℃, 滴加溶解在少量丙酸中的等摩尔吡咯, 加热回流, 反应2 h后冷却至室温, 加入甲醇或乙醇溶液冷却搅拌过夜, 过滤得到粗产物, 用硅胶柱提纯得到纯度较高产品.
3.2.1 溴代三乙二醇单甲醚的合成
氮气保护下将三乙二醇单甲醚(20.5 g, 0.17 mol)溶解在100 mL乙醚中, 冰水浴冷却至0 ℃, 将三溴化磷(6 mL, 0.063 mol)缓慢滴加至上述溶液中, 在同样的温度条件下, 反应20 min, 加入7.5 mL甲醇, 室温条件下继续反应30 min, 加入25 mL水猝灭反应, 乙醚萃取, 有机相用饱和NaHCO3和饱和NaCl溶液分别洗涤多次, 无水硫酸镁干燥, 减压蒸去溶剂, 真空干燥得溴代三乙二醇单甲醚[20].产物为无色透明液体, 5.5 g, 产率20%. 1H NMR (300 MHz, CDCl3) δ: 3.74 (t, J=6.3 Hz, 2H), 3.65~3.56 (m, 6H), 3.52~3.46 (m, 2H), 3.40 (t, J=6.3 Hz, 2H), 3.31 (s, 3H); 13C NMR (126 MHz, CDCl3) δ: 71.95, 71.22, 70.63, 70.61, 70.55, 59.04, 30.28.
3.2.2 meso-四(4-三乙二醇单甲醚吡啶基)卟啉(1)的合成
将meso-四(4-吡啶基)卟啉(100 mg, 0.16 mmol)和溴代三乙二醇单甲醚(0.73 g, 3.2 mmol)溶解在N, N-二甲基甲酰胺(DMF) (4 mL)和甲醇(1 mL)的混合溶液中, Ar气保护, 加热至100 ℃, 反应12 h, 待反应完全后减压蒸去溶剂, 粗产物用水和丙酮(V:V=1:2) 重结晶, 所得固体用二氯甲烷和丙酮冲洗, 真空干燥.产物为紫红色粘稠液体, 200 mg, 产率80%. UV-vis (water) λmax (ε/[L•mol-1•cm-1]): 424 (2.01×105), 520 (1.33×104), 555 (5.77×103), 585 (6.02×103), 644 (1.28×103) nm. 1H NMR (300 MHz, Methanol-d4) δ: 9.60~9.55 (m, 8H), 9.49~9.47 (m, 4H), 9.08~9.04 (m, 12H), 5.31~5.29 (m, 8H), 4.43~4.40 (m, 8H), 3.98~3.95 (m, 8H), 3.85~3.83 (m, 8H), 3.78~3.75 (m, 8H), 3.63~3.60 (m, 8H), 3.27 (s, 12H); 13C NMR (126 MHz, Methanol-d4) δ: 158.20, 144.24, 144.04, 132.65, 115.80, 71.59, 70.16, 69.91, 68.92, 61.37, 57.65, 34.00. HR-ESI-MS calcd for [C72H82N4O28-S4]4+ 394.5994; found 394.6015. Anal calcd for C68H86-Br4N8O12 C 53.48, H 5.68, N 7.34; found C 53.44, H 5.70, N 7.51.
3.2.3 meso-四(4-三乙二醇单甲醚氧基-3-磺酸基苯基)卟啉(3)的合成
氮气保护下, 将meso-四(4-羟基苯基)卟啉(500 mg, 0.74 mmol)溶解在甲醇(30 mL)和NaOCH3 (7 mL, 1 mol)的混合溶液中, 室温反应30 min, 旋蒸除去溶剂, 真空干燥, 氮气保护下, 加入溴代三乙二醇单甲醚(1.5 g, 6.4 mmol)和DMF (30 mL), 加热至100 ℃反应过夜, 待反应完全后减压除去溶剂, 粗产物用硅胶柱分离提纯, 以CH3OH/CH2Cl2 (V:V=1:99) 作为淋洗剂, 收集前段紫红色流出液, 蒸干溶剂得meso-四(4-三乙二醇单甲醚氧基苯基)卟啉(2).
氮气保护下, 将化合物2 (200 mg, 0.16 mmol)溶解在CHCl3 (2 mL)中混合搅拌均匀, 缓慢将ClSO3H (0.23 mL, 3.4 mmol)滴加到上述体系中, 冰水浴条件下搅拌反应60 min, 缓慢加入冰水(5 mL), 用氢氧化钠水溶液(1 mol/L)中和溶液的酸直至溶液颜色变为红色, 减压旋蒸除去大部分溶剂, 过滤除去无机盐类杂质, 冷冻干燥除水, 粗产物用反相C18柱分离, CH3CN/H2O (V:V=1:9) 作为淋洗剂, 收集紫红色组分, 蒸干溶剂得meso-四(4-三乙二醇单甲醚氧基-3-磺酸基苯基)卟啉(3), 紫色固体, 212 mg, 产率为85%. m.p. 185 ℃; UV-vis (H2O, base) λmax (ε/[L•mol-1•cm-1]): 412 (6.90×104), 515 (7.70×103), 553 (4.47×103), 581(5.23×103), 634 (2.88×103) nm. 1H NMR (300 MHz, DMSO-d6) δ: 8.86 (br s, 8H), 8.56~8.50 (m, 4H), 8.27~8.15 (m, 4H), 7.55~7.53 (m, 4H), 3.85~3.72 (m, 16H), 3.71~3.60 (m, 16H), 3.53~3.50 (m, 16H), 3.32 (s, 12H), -2.86 (s, 2H); 13C NMR (126 MHz, DMSO-d6) δ: 162.80, 71.70, 71.44, 70.21, 70.14, 70.04, 70.01, 69.76, 65.45, 61.69, 58.74, 58.52, 36.27, 31.24, 15.58; HR-ESI-MS calcd for [C72H82N4O28S4]4-: 394.5994, found 394.6015. Anal calcd for C72H86N4O28S4 C 54.61, H 5.47, N 3.54; found C 54.66, H 5.50, N 3.46.
3.2.5 meso-四(4-三乙二醇单甲醚吡啶基)卟啉锰配合物(4)的合成
将meso-四(4-三乙二醇单甲醚吡啶基)卟啉(200 mg, 0.13 mmol)和MnCl2•4H2O(490 mg, 2.6 mmol)溶解在甲醇和水的混合溶液中(70 mL), 加热至微沸状态, 加入NaOH (400 μL, 1 mol/L), 紫外可见吸收光谱监测反应进程, 反应完全后冷却至室温, 加入NH4PF6, 过滤除去溶液, 用水洗涤固体, 将固体溶解在丙酮中, 滴加四丁基氯化铵(TBAC), 过滤后少量丙酮冲洗固体, 真空干燥得到meso-四(4-三乙二醇单甲醚吡啶基)卟啉锰配合物(4), 褐色粘稠液体, 160 mg, 产率为85%. UV-vis (water) λmax (ε/[L•mol-1•cm-1]): 332 (2.63×104), 379 (3.63×104), 400 (3.71×104), 420 (2.77×104), 462 (1.16×105), 564 (1.05×104), 675 (0.90×103), 770 (1.20×103) nm. HR-ESI-MS calcd for [C68H84N8O12ClMn]3+ ([M-4Cl]3+) 431.5087, found 431.5069. Anal calcd for C68H84-Cl5MnN8O12: C 56.81, H 5.89, N 7.79; found C 56.85, H 5.63, N 7.71.
3.2.6 meso-四(4-三乙二醇单甲醚氧基-3-磺酸基苯基)卟啉锰配合物(5)的合成
将meso-四(4-三乙二醇单甲醚氧基-3-磺酸基苯基)卟啉(200 mg, 0.12 mmol)和Mn(OAc)2•4H2O (110 mg, 0.45 mmol)缓和溶解在pH=6.8的醋酸醋酸铵缓冲溶液中(15 mL), 加热至90 ℃反应, 紫外可见吸收光谱监测反应进程, 待反应完全后, 减压蒸去溶剂, 粗产物用反相C18柱分离, 用水作为淋洗剂, 收集绿色组分, 蒸干溶剂得到meso-四(4-三乙二醇单甲醚氧基-3-磺酸基苯基)卟啉锰配合物(5), 绿色固体, 180 mg, 产率为86%. m.p. 206 ℃; UV-vis (water) λmax (ε/[L•mol-1•cm-1]): 382 (4.91×103), 402 (5.00×103), 422 (4.11×104), 468 (8.70×104), 517 (5.65×103), 568 (9.70×103), 612 (8.67×103) nm. HR-ESI-MS calcd for [C72H80N4O28S4-Mn]3- 543.7735, found 543.7767. Anal calcd for C74H99-N8O30S4Mn: C 50.39, H 5.66, N 6.35; found C 50.88, H 5.72, N 6.68.
辅助材料(Supporting Information) 化合物的1H NMR、13C NMR图谱, 以及化合物4和5高分辨质谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/) 上下载.
-
-
[1]
Sessler, J. L.; Tomat, E. Acc. Chem. Res. 2007, 40, 371. doi: 10.1021/ar600006n
-
[2]
(a) McConnell, A. J.; Wood, C. S.; Neelakandan, P. P.; Nitschke, J. R. Chem. Rev. 2015, 115, 7729.
(b) Tanaka, T.; Osuka, A. Chem. Soc. Rev. 2015, 44, 943.
(c) Chang, Y.; Michelin, C.; Bucher, L.; Desbois, N.; Gros, C. P.; Piant, S.; Bolze, F.; Fang, Y.-Y.; Jiang, X.-Q.; Kadish, K. M. Chem. Eur. J. 2015, 21, 12018.
(d) Liang, P.-X.; Mi, Y.-S.; Duan, J.-S.; Yang, Z.; Wang, D.; Cao, H.; He, W.-L.; Yang, H. Chin. J. Chem. 2016, 34, 381. -
[3]
(a) Wang, Y. -Q. ; Chen, B. ; Wu, W. -J. ; Li, X. ; Zhu, W. -H. ; Tian, H. ; Xie, Y. -S. Angew. Chem. , Int. Ed. 2014, 53, 10779.
(b) Xie, Y. -S. ; Tang, Y. -Y. ; Wu, W. -J. ; Wang, Y. -Q. ; Liu, J. -C. ; Li, X. ; Tian, H. ; Zhu, W. -H. J. Am. Chem. Soc. 2015, 137, 14055.
(c) Gu, C. -Z. ; Meng, S. -X. ; Feng, Y. -Q. Chin. J. Org. Chem. 2015, 35, 1229(in Chinese).
(顾承志, 孟舒献, 冯亚青, 有机化学, 2015, 35, 1229. )
(d) Lu, J. -M. ; Cai, W. -Q. ; Zhang, G. -C. ; Liu, S. -J. ; Lei, Y. ; Fei, H. Acta Chim. Sinica 2015, 73, 1153(in Chinese).
(卢俊明, 蔡万清, 张桂传, 刘升建, 应磊, 黄飞, 化学学报, 2015, 73, 1153. ) -
[4]
(a) Ding, Y.-B.; Zhu, W.-H.; Xie, Y.-S. Chem. Rev. 2017, 117, 2203.
(b) Ding, Y.-B.; Tang, Y.-Y.; Zhu, W.-H.; Xie, Y.-S. Chem. Soc. Rev. 2015, 44, 1101-1112. -
[5]
(a) To, C. -T. ; Yang, W. ; Chan, K. -S. Chin. J. Chem. 2016, 34, 955.
(b) Xu, Y. ; Zhang, H. -Z. ; Wang, X. -Y. ; Liu, G. -Y. Chin. J. Chem. 2015, 33, 1393.
(c) Ren, Q. -G. ; Zhou, X. -T. ; J, H. -B. Chin. J. Org. Chem. 2010, 30, 1605(in Chinese).
(任清刚, 周贤太, 纪红兵, 有机化学, 2010, 30, 1605. ) -
[6]
(a) Meunier, B.; de Visser, S. P.; Shaik, S. Chem. Rev. 2004, 104, 3947.
(b) Dydio, P.; Key, H. M.; Nazarenko, A.; Rha1, J. Y.-E.; Seyedkazemi1, V.; Clark, D. S.; Hartwig, J. F. Science 2016, 354, 102. -
[7]
(a) Dolmans, D. E. J. G. J. ; Fukumura, D. ; Jain, R. K. Nat. Rev. Cancer 2003, 3, 380.
(b) Lu, K. -D. ; He, C. -B. ; Lin, W. -B. J. Am. Chem. Soc. 2015, 137, 7600.
(c) Schmitt, J. ; Heitz, V. ; Sour, A. ; Bolze, F. ; Ftouni, H. ; Nicoud, J. -F. ; Flamigni, L. ; Ventura, B. Angew. Chem. , Int. Ed. 2015, 54, 169.
(d) Long, S. -R. ; Wan, Y. ; Xia, A. -D. Acta Chim. Sinica 2015, 73, 723(in Chinese).
(龙飒然, 宛岩, 夏安东, 化学学报, 2015, 73, 723. ) -
[8]
Singh, S.; Aggarwal, A.; Bhupathiraju, N. V. S. D. K.; Arianna, G.; Tiwari, K.; Drain, C. M. Chem. Rev. 2015, 115, 10261. doi: 10.1021/acs.chemrev.5b00244
-
[9]
(a) Bonnett, R. Chem. Rev. 1995, 24, 415.
(b) Almarsson, O.; Adalsteinsson, H.; Bruice, T. C. J. Am. Chem. Soc. 1995, 117, 4524. -
[10]
Pratviel, G. Coord. Chem. Rew. 2016, 308, 460. doi: 10.1016/j.ccr.2015.07.003
-
[11]
Todd, D. J.; Kay, J. Annu. Rev. Med. 2016, 67, 273. doi: 10.1146/annurev-med-063014-124936
-
[12]
Yang, J.-J.; Yang, J.-H.; Wei, L.-X.; Zuikiya, O.; Yang, W.; Li, S.-Y.; Zou, J.; Maniccia, A. W.; Mao, H.; Zhao, F.-Q.; Malchow, R.; Zhao, S.-M.; Johnson, J.; Hu, X.-P.; Krogstad, E.; Liu, Z.-R. J. Am. Chem. Soc. 2008, 130, 9260. doi: 10.1021/ja800736h
-
[13]
汪凌云, 曹德榕, 有机化学, 2012, 32, 2248. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341476.shtmlWang, L.-Y.; Cao, D.-R. Chin. J. Org. Chem. 2012, 32, 2248(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341476.shtml
-
[14]
Laguerre, A.; Chang, Y.; Pirrotta, M.; Desbois, N.; Gros, C. P.; Lesniewska, E.; Monchaud, D. Org. Biomol. Chem. 2015, 13, 7034. doi: 10.1039/C5OB00692A
-
[15]
Dong, R.-J.; Bo, Y.; Tong, G.-S.; Zhou, Y.-F.; Zhu, X.-Y.; Lu, Y.-F. Nanoscale 2014, 6, 4544. doi: 10.1039/C4NR00212A
-
[16]
Zhou, X.-T.; Ren, G.-Q.; Ji, H.-B. J. Porphyrins Phthalocyanines 2013, 17, 1104. doi: 10.1142/S1088424613500776
-
[17]
Mori, S.; IshⅡ, K.; Hirakawa, Y.; Nakamura, R.; Hashimoto, K. Inorg. Chem. 2011, 50, 2037. doi: 10.1021/ic100342k
-
[18]
Gouterman, M. In The Porphyrins, Vol. 3, Ed.:Dolphin, D., Academic Press, New York, 1978, Part A, pp. 1~165.
-
[19]
Adler, A. D.; Longo, F. R. J. Org. Chem. 1967, 32, 476.
-
[20]
Sreejith, S.; Joseph, J.; Lin, M.-J.; Menon, N. V.; Borah, P.; Ng, H.-J.; Loong, Y. X.; Kang, Y.-J.; Yu, S. W.-K.; Zhao, Y.-L. ACS Nano 2015, 9, 5695. doi: 10.1021/acsnano.5b02172
-
[1]
-
表 1 吡啶基阳离子型卟啉合成反应条件优化a
Table 1. Optimization of reaction conditions for the synthesis of pyridinium cationic porphyrin.
Entry V(DMF)/mL V(CH 3OH)/mL Yield/% 1 5 — 51 2 4 1 80 3 3 2 65 4b 2 3 32 5b 1 4 10 6b — 5 — a反应条件: meso-四(4-吡啶基)卟啉(100 mg, 1 equiv.)和溴代三乙二醇单甲醚(20 equiv.), 反应温度100 ℃, 反应时间12 h; b反应温度65 ℃, 反应时间24 h. 表 2 不同实验条件对卟啉磺化反应的影响a
Table 2. Influences on the sulfonation of porphyrin with different reaction conditions
Entry ClSO3H/equiv. T/℃ Time/min Yield/% 1 10 0 15 38 2 10 20 30 45 3 10 40 60 42 4 20 0 60 85 5 20 20 15 62 6 20 40 30 52 7 30 0 30 70 8 30 20 60 56 9 30 40 15 27 a反应条件: meso-四(4-三乙二醇单甲醚氧基)卟啉(0.16 mmol), 溶剂CHCl3 (2 mL). -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 21
- 文章访问数: 1761
- HTML全文浏览量: 475



 下载:
下载:



 下载:
下载:

