
Citation: Lin Wei, Cai Qi, Zheng Chunzhi, Zheng Yongxiang, Shi Daqing. Synthesis of Functionalized Coumarino[4, 3-d]pyrazolo[3, 4-b]pyridine Derivatives and Their Selective Recognition for Zn2+[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2392-2398. doi: 10.6023/cjoc201702032

官能团化香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物的合成及其对锌离子的选择性识别
-
关键词:
- 香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物
- / 合成
- / 荧光性质
- / 锌离子
- / 选择性识别
English
Synthesis of Functionalized Coumarino[4, 3-d]pyrazolo[3, 4-b]pyridine Derivatives and Their Selective Recognition for Zn2+
-
香豆素是一种存在于自然界的杂环化合物, 具有广泛的生物和药理活性, 如抗菌[1]、抗炎[2]、抗艾滋病病毒(HIV)[3]、抗肿瘤[4]和抗凝血[5]等活性.另外, 由于香豆素骨架中存在大的共轭体系, 香豆素衍生物具有很强的荧光性、光稳定性和很高的荧光量子产率[6], 常被用作荧光团设计成荧光探针, 用于金属离子[7]、阴离子[8]或者生物分子[9]的检测.一些杂环稠合的香豆素衍生物也具有非常好的荧光性质, 香豆素并呋喃衍生物[10]及香豆素并吡咯衍生物[11]都具有非常好的荧光性质, 可用作荧光材料.文献报道香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物[12]也具有很高的荧光量子产率及很好的电化学稳定性、热稳定性和光化学稳定性, 在有机电致发光器件具有潜在的应用价值.
锌离子是人体器官中必不可少的过渡金属, 在生命活动中起着极其重要的作用[13].研究表明, 细胞内的锌离子代谢失调与诸多疾病有关, 例如阿尔氏海默症、糖尿病、前列腺癌等[14].另外, 锌离子的过量排放也能造成环境的污染.因此, 研究开发能够高选择性、高灵敏度检测锌离子的方法引起了人们的广泛关注.近年来, 由于荧光探针法具有选择性好、灵敏度高及操作简便快捷的特点, 使得荧光探针在锌离子的识别与检测过程中发挥了重要作用.常用于锌离子识别的荧光探针有喹啉类[15]、荧光素类[16]、腙类[17]、联吡啶类[18]和吖嗪类[19].基于香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物具有很好的荧光特性, 我们在研究香豆素衍生物合成[20]的基础上, 设计并合成了具有酮基侧链的香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物, 并将其应用于锌离子的荧光检测.
1 结果与讨论
1.1 香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物的合成
我们参考文献[20c]的方法, 利用硫酸酮催化的3-乙酰乙酰基香豆素1与5-氨基吡唑2的加成环化反应合成了一系列酮基取代的香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物3.合成路线见Eq. 1, 结果见表 1.
 表 1
香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物3a~3h的合成
Table 1.
Synthesis of coumarino[4, 3-d]pyrazolo[3, 4-b]pyridine derivatives 3a~3h
表 1
香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物3a~3h的合成
Table 1.
Synthesis of coumarino[4, 3-d]pyrazolo[3, 4-b]pyridine derivatives 3a~3h
Entry Product R1 R2 R3 R4 Time/h Yield/% 1 3a H H CH3 CH3 4 76 2 3b CH3O H CH3 CH3 10 75 3 3c H H C6H5 C6H5 24 64 4 3d H Br C6H5 C6H5 24 62 5 3e H Br C6H5 CH3 15 72 6 3f H CH3O C6H5 CH3 10 70 7 3g H Cl CH3 C6H5 8 74 8 3h CH3O H CH3 C6H5 18 65 我们在合成时发现原文献中的催化剂CuCl2•2H2O对该反应的催化效果并不是很好, 经过筛选我们最终确定20 mol%的无水硫酸铜作为该反应的催化剂, 同样我们也考察了溶剂、温度对反应的影响, 结果表明在乙醇溶剂中回流时的收率最高, 所以我们得到的最佳反应条件是以20 mol% CuSO4作催化剂, 在乙醇溶液中回流反应.在该反应条件下我们合成得到了8个目标产物, 从表 1可以看出该方法都能得到中等左右的收率, 但是反应需要的时间差别比较大, 时间的长短与原料1在乙醇中的溶解度有关, 溶解度大的反应时间短, 而溶解度差的需要的时间就长.产物的结构通过红外、核磁共振氢谱、核磁共振碳谱及质谱进行确定.
根据产物的结构及反应的规律, 我们推测该反应可能的机理见Scheme 1.首先, 3-乙酰乙酰基香豆素1与5-氨基吡唑2发生Michael加成反应, 经过互变异构得到中间体A, 中间体A接着发生分子内的亲核加成反应生成中间体B, 中间体B失水得中间体C, 最后中间体C芳构化得目标产物3.
1.2 化合物3的荧光性质
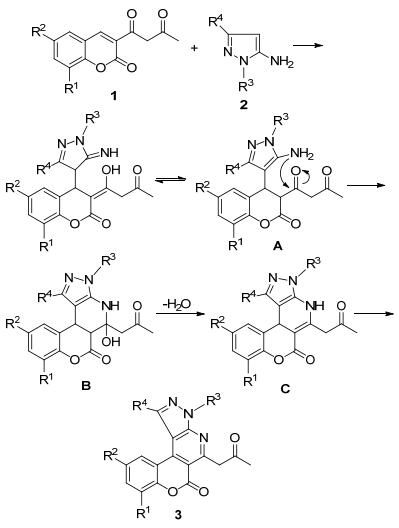
我们研究了合成化合物的荧性质, 化合物3a~3h在乙醇溶液中的荧光光谱见图 1, 荧光量子产率见表 2.从图 1可以看出分子中取代基对荧光性质的影响比较明显, 当吡唑环上的两个取代基都为甲基时, 发射波长最短, 为435 nm, 同时荧光强度最强.而当吡唑环中有苯基时, 发射波长最长, 为490~495 nm, 同时荧光强度较弱.从表 2可以看出, 化合物3a、3b具有很高的荧光量子产率.另外, 分子中同时具有酮羰基和吡啶环, 有望设计成新型的荧光探针.
 表 2
化合物3a~3h在乙醇溶液中的荧光及量子产量a
Table 2.
Luminescence and fluorescence quantum yields of compounds 3a~3h in ethanol
表 2
化合物3a~3h在乙醇溶液中的荧光及量子产量a
Table 2.
Luminescence and fluorescence quantum yields of compounds 3a~3h in ethanol
Compound Emax/(L•mol-1•cm-1) λmax(ex)/nm λmax(em)/nm RFIb ΦFc 9, 10-Diphenylanthracene 1.9798 220.5 428.4 5585 0.660 3a 2.6777 196.0 435.0 6435 1.029 3b 2.7212 197.0 447.0 4726 0.768 3c 2.7447 198.0 477.0 3259 0.534 3d 2.6777 196.0 492.0 1002 0.160 3e 2.9208 198.0 492.0 193.7 0.034 3f 2.9586 195.0 465.0 197.1 0.035 3g 2.7958 197.0 475.0 2242 0.374 3h 2.7695 196.0 465.0 1208 0.200 a c=5×10-5 mol•L-1. bRelative fluorescence intensity. cRelative fluorescence quantum yield. 1.3 化合物3对锌离子的选择性识别
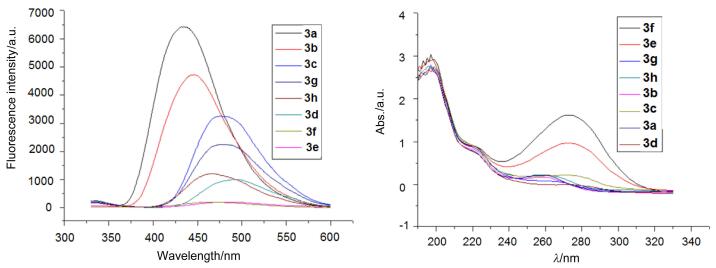
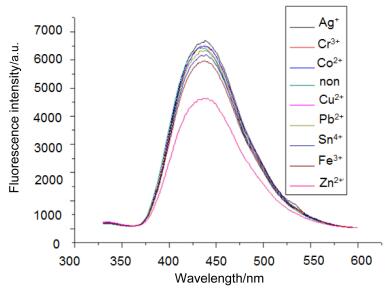
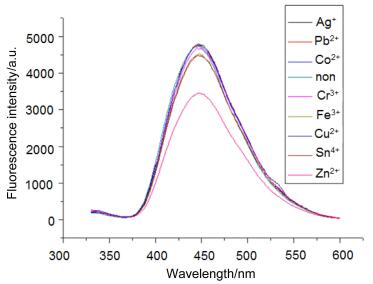
考虑到化合物3a和3b具有很强的荧光性, 我们研究了它们对金属离子的识别能力, 分别研究了它们与金属离子, 包括Cu2+、Co2+、Pb2+、Fe3+、Cr3+、Sn4+、Ag+和Zn2+的作用情况, 结果见图 2和图 3.从图 2可以看出当化合物3a中加入Ag+离子时, 荧光强度略有增加, 当加入Co2+和Cr3+时荧光强度基本无影响, 而当加入其它几种金属离子时荧光强度减弱, 尤其是当加入Zn2+时作用最明显.从图 3可以看出, 当在化合物3b中加入Co2+、Pb2+和Ag+时, 荧光强度无明显变化, 而当加入其它几种离子时, 荧光强度减弱, 尤其是当加入Zn2+时作用最明显.这说明锌离子与化合物3a和3b有作用, 可以通过荧光强度的变化来识别锌离子.
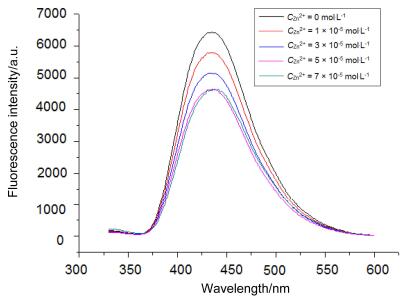
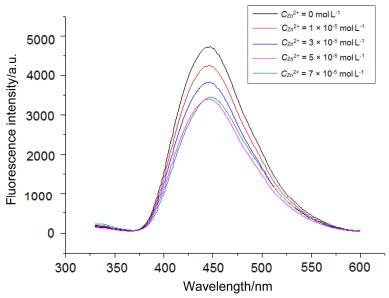
基于锌离子对化合物3a和3b的荧光谱具有明显的影响, 我们进一步考察了不同浓度的锌离子对化合物3a和3b的荧光强度的影响, 结果见图 4和图 5.从图 4和图 5可以看出随着锌离子浓度增加, 化合物3a和3b的荧光强度逐渐减弱, 当锌离子浓度从5×10-5 mol•L-1增加到7×10-5 mol•L-1时荧光强度基本没有变化, 这说明化合物3a和3b与金属锌离子达到了最大配位, 即1:1配位.化合物3a和3b与金属锌离子1:1配位时的量子产率分别为0.602和0.450.
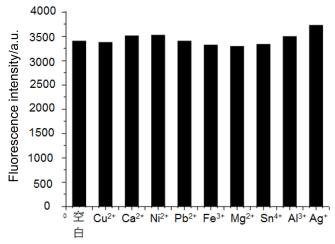
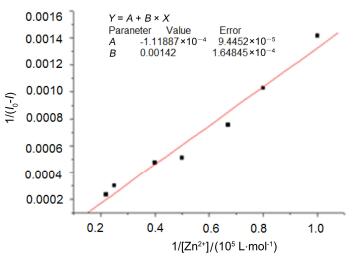
为了进一步研究化合物作为锌离子探针的应用, 我们还进行了其它金属离子对锌离子的干扰实验.在化合物3b (水溶液浓度为5×10-5 mol•L-1)和Zn2+(水溶液浓度为5×10-5 mol•L-1)的混合溶液中加入各种金属离子Cu2+、Ca2+、Ni2+、Pb2+、Fe3+、Mg2+、Sn4+、Al3+和Ag+ (水溶液浓度为5×10-5 mol•L-1), 测试荧光.结果如图 6所示, 金属离子对锌离子几乎没有干扰, 所以其他金属离子干扰不会对锌离子的检测造成太大影响.化合物3b和Zn2+络合物稳定常数Ka通过Benesi-Hildebrand方法计算为3.00×106 L•mol-1. Benesi-Hilderbrand曲线是以1/(I0-I)为纵坐标, 1/[Zn2+]作横坐标得到的, 相关系数为0.99, 表明1与Zn2+之间是以1:1的结合比相结合的(图 7).计算公式为:
由工作曲线可以得到斜率和截距, 从公式可以看出稳定常数Ka就是截距除以斜率得到的.
化合物3a或3b与锌离子的识别可能是通过分子中吡啶环上的氮原子及羰基的氧原子与锌离子的络合进行的, 由于这种作用比较弱, 所以作用后的强度变化不是特别明显.
2 结论
我们以3-乙酰乙酰基香豆素与5-氨基吡唑为原料, 利用硫酸铜催化的加成环化反应合成了一系列官能团化的香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物.并研究了这些化合物的荧光性质, 发现化合物3a和3b具有很强的荧光性和很高的荧光量子产率.利用荧光光谱考察了化合物3a和3b与Ag+、Cr3+、Co2+、Cu2+、Pb2+、Sn4+、Fe3+、Zn2+等金属离子的作用, 结果表明化合物3a和3b对Zn2+具有很好的选择性识别能力, 为锌离子的选择性识别提供了一种新的方法.
3 实验部分
3.1 试剂与仪器
熔点测定使用北京科仪电光仪器厂生厂的TX5显微熔点仪测定(温度未校正); 红外光谱采用Varian F-1000型红外光谱仪测定(KBr压片); 核磁共振氢谱和核磁共振碳谱在Agilent Inova-400MHz或Agilent Inova-300 MHz型核磁共振仪测定, CDCl3为溶剂, 四甲基硅烷(TMS)为内标; 高分辨质谱在Bruker MicrOTOF-QII质谱器测定, 采用电喷雾离子源(ESI)形式; 紫外-可见光谱在UV-2500PC型紫外可见分光光谱仪上测定; 荧光光谱在Hitachi F-4500荧光分光光度计上测定; 原料3-乙酰乙酰基香豆素参考文献[21]的方法合成; 所用试剂均为分析纯或化学纯, 使用前未经纯化.
3.2 香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物3a~3h的合成通法
在50 mL干燥的圆底烧瓶中加入3-乙酰乙酰基香豆素(1, 1 mmol)、5-氨基吡唑(2, 1 mmol)、无水硫酸铜(0.2 mmol)及10 mL乙醇.反应混合物在搅拌下加热回流反应4~24 h, 薄层色谱(TLC)检测反应进程.反应完成后, 冷却, 减压浓缩除去溶剂, 剩余物进行柱层析(硅胶柱, 石油醚/丙酮为淋洗剂)得纯产物3a~3h.
1, 3-二甲基-5-(2-氧代丙基)香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶-6(3H)-酮(3a):白色固体, m.p. 188~190 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.31 (d, J=7.6 Hz, 1H, ArH), 7.61 (t, J=7.2 Hz, 1H, ArH), 7.38 (d, J=6.8 Hz, 2H, ArH), 4.58 (s, 2H, CH2), 4.12 (s, 3H, CH3), 2.86 (s, 3H, CH3), 2.43 (s, 3H, CH3); 13C NMR (75 MHz, CDCl3) δ: 205.2, 160.5, 158.8, 152.5, 152.0, 142.6, 141.4, 132.8, 129.2, 123.9, 116.8, 109.8, 107.8, 54.7, 34.0, 30.5, 19.3; IR (KBr) ν: 2921, 1719, 1616, 1544, 1458, 1384, 1260, 1024, 799, 760, 692 cm-1; HRMS (ESI) calcd for C18H16N3O3 [M+H]+ 322.1192, found 322.1189.
8-甲氧基-1, 3-二甲基-5-(2-氧代丙基)香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶-6(3H)-酮(3b):白色固体, m.p. 196~199 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.87 (d, J=8.0 Hz, 1H, ArH), 7.32 (t, J=8.0 Hz, 1H, ArH), 7.16 (d, J=7.6 Hz, 1H, ArH), 4.59 (s, 2H, CH2), 4.13 (s, 3H, CH3), 3.99 (s, 3H, CH3O), 2.85 (s, 3H, CH3), 2.43 (s, 3H, CH3); 13C NMR (75 MHz, CDCl3) δ: 205.3, 160.2, 158.9, 147.9, 143.0, 142.5, 141.6, 123.6, 120.7, 120.3, 117.7, 114.6, 109.8, 108.1, 56.6, 54.7, 34.1, 30.6, 19.3; IR (KBr) ν: 2914, 1715, 1608, 1593, 1457, 1270, 1201, 1167 1059, 910, 767, 688 cm-1; HRMS (ESI) calcd for C19H17N3O4 351.1219, found 351.1212.
5-(2-氧代丙基)-1, 3-二苯基香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶-6(3H)-酮(3c):灰色固体, m.p. 229~232 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.29 (d, J=8.0 Hz, 2H, ArH), 7.55 (t, J=7.2 Hz, 4H, ArH), 7.50~7.39 (m, 5H, ArH), 7.34 (d, J=7.6 Hz, 2H, ArH), 6.72 (t, J=8.0 Hz, 1H, ArH), 4.69 (s, 2H, CH2), 2.46 (s, 3H, CH3); 13C NMR (75 MHz, CDCl3) δ: 205.2, 160.3, 159.7, 152.6, 151.7, 147.5, 142.4, 138.6, 134.3, 132.9, 131.6, 129.7, 129.2, 128.8, 127.3, 123.2, 122.8, 116.9, 115.6, 111.3, 107.9, 54.9, 30.6; IR (KBr) ν: 2834, 1735, 1593, 1554, 1438, 1384, 1356, 1236, 1027, 752, 691 cm-1; HRMS (ESI) calcd for C28H19N3O3 445.1426, found 445.1436.
10-溴-5-(2-氧代丙基)-1, 3-二苯基香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶-6(3H)-酮(3d):黄色固体, m.p. 200~201 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.27 (d, J=6.8 Hz, 2H, ArH), 7.56~7.51 (m, 9H, ArH), 7.41 (t, J=8.0 Hz, 1H, ArH), 7.21 (d, J=6.8 Hz, 1H, ArH), 4.69 (s, 2H, CH2), 2.47 (s, 3H, CH3); 13C NMR (75 MHz, CDCl3) δ: 205.0, 151.6, 151.4, 147.4, 141.0, 138.5, 135.6, 134.5, 133.9, 129.9, 129.6, 129.3, 129.1, 127.5, 122.9, 118.4, 117.2, 116.2, 111.3, 107.7, 54.9, 30.6; IR (KBr) ν: 2976, 1729, 1550, 1498, 1381, 1256, 1112, 902, 758, 674 cm-1; HRMS (ESI) calcd for C28H18BrN3O3 523.0532, found 523.0536.
10-溴-1-甲基-5-(2-氧代丙基)-3-苯基香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶-6(3H)-酮(3e):灰色固体, m.p. 244~246 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.51 (s, 1H, ArH), 8.18 (d, J=7.6 Hz, 2H, ArH), 7.72 (d, J=8.8 Hz, 1H, ArH), 7.54 (t, J=7.6 Hz, 2H, ArH), 7.37 (t, J=7.6 Hz, 1H, ArH), 7.32 (d, J=8.8 Hz, 1H, ArH), 4.62 (s, 2H, CH2), 2.97 (s, 3H, CH3), 2.43 (s, 3H, CH3); 13C NMR (75 MHz, CDCl3) δ: 205.0, 159.8, 159.4, 151.5, 142.9, 141.3, 138.5, 135.6, 131.8, 129.3, 127.2, 122.6, 119.3, 118.5, 116.7, 110.9, 109.6, 108.1, 54.9, 30.6, 19.4; IR (KBr) ν: 2920, 1739, 1589, 1541, 1483, 1352, 1205, 1046, 828, 753, 689 cm-1; HRMS (ESI) calcd for C23H16BrN3O3Na [M+Na]+ 484.0273, found 484.0238.
10-甲氧基-1-甲基-5-(2-氧代丙基)-3-苯基香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶-6(3H)-酮(3f):黄色固体, m.p. 218~220 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.19 (s, 2H, ArH), 7.79~7.36 (m, 6H, ArH), 4.62 (s, 2H, CH2), 3.95 (s, 3H, CH3O), 3.00 (s, 3H, CH3), 2.43 (s, 3H, CH3); 13C NMR (75 MHz, CDCl3) δ: 205.2, 160.5, 159.5, 155.9, 146.9, 142.6, 138.6, 129.2, 127.0, 122.7, 122.5, 120.0, 118.6, 117.2, 113.0, 112.7, 56.3, 55.0, 30.6, 19.8; IR (KBr) ν: 3056, 1729, 1616, 1547, 1507, 1385, 1276, 1167, 1119, 872, 798, 755, 688 cm-1; HRMS (ESI) calcd for C24H19-N3O4 413.1376, found 413.1366.
10-氯-3-甲基-5-(2-氧代丙基)-1-苯基香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶-6(3H)-酮(3g):灰色固体, m.p. 228~230 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.43~7.42 (m, 4H, ArH), 7.32 (t, J=6.4 Hz, 1H, ArH), 7.21 (d, J=6.4 Hz, 3H, ArH), 4.61 (s, 2H, CH2), 4.23 (s, 3H, CH3), 2.42 (s, 3H, CH3); 13C NMR (75 MHz, CDCl3) δ: 205.2, 160.2, 159.3, 152.0, 150.9, 146.2, 141.1, 134.3, 132.6, 131.3, 129.6, 129.5, 129.1, 128.9, 118.1, 116.9, 110.5, 106.2, 54.9, 34.6, 30.6; IR (KBr) ν: 2920, 1719, 1540, 1457, 1396, 1258, 1156, 1021, 816, 772, 707 cm-1; HRMS (ESI) calcd for C23H16ClN3O3 417.0880, found 417.0881.
8-甲氧基-3-甲基-5-(2-氧代丙基)-1-苯基香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶-6(3H)-酮(3h):灰色固体, m.p. 189~190 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.47~7.37 (m, 5H, ArH), 6.97 (d, J=8.0 Hz, 1H, ArH), 6.90 (d, J=8.0 Hz, 1H, ArH), 6.63 (t, J=8.0 Hz, 1H, ArH), 4.65 (s, 2H, CH2), 4.26 (s, 3H, CH3), 3.94 (s, 3H, CH3O), 2.46 (s, 3H, CH3); 13C NMR (75 MHz, CDCl3) δ: 205.3, 160.1, 159.3, 152.1, 147.3, 146.4, 142.7, 142.4, 134.7, 129.6, 128.9, 128.7, 122.9, 122.7, 116.6, 114.5, 110.5, 106.4, 56.5, 54.7, 34.5, 30.6; IR (KBr) ν: 2929, 1718, 1565, 1538, 1482, 1464, 1361, 1278, 1199, 1119, 954, 771, 700 cm-1; HRMS (ESI) calcd for C24H18N3O4 [M-H]+412.1297, found 412.1355.
-
-
[1]
(a) Shi, Y.; Zhou, C. H. Bioorg. Med. Chem. Lett. 2011, 21, 956.(b) Varun, G.; Bhila, C. V.; Patel, N. H.; Patel, D. I. B. Med. Chem. Res. 2013, 22, 4338.(c) Laxmi, S. V.; Kuarm, B. S.; Rajitha, B. Med. Chem. Res. 2013, 22, 768.
-
[2]
Hemshekhar, M.; Sunitha, K.; Thushara, R. M.; Santhosh, S.; Sundaram, M. S.; Kemparaju, K.; Girish, K. S. Biochimie 2013, 95, 1326. doi: 10.1016/j.biochi.2013.02.014
-
[3]
(a) Kirkiacharian, S.; Thuy, D. T.; Sicsic, S. Farmaco 2002, 57, 703.(b) Kashman, Y. J. Med. Chem. 1992, 35, 2735.
-
[4]
(a) Li, W.; Sun, Y. N.; Yan, X. T.; Yang, S. Y.; Kim, E. J.; Kang, H. K.; Kim, Y. H. J. Agric. Food Chem. 2013, 61, 10730.(b) Francisco, C. S.; Rodrigues, L. R.; Cerqueira, N. M.; OliveiraCampos, A. M.; Rodrigues, L. M. Eur. J. Med. Chem. 2012, 47, 370.
-
[5]
Daly, A. K. Arch. Toxicol. 2013, 87, 407. doi: 10.1007/s00204-013-1013-9
-
[6]
(a) Sanap, K. K. ; Samant, S. D. Tetrahedron Lett. 2012, 53, 5407. (b) Hirano, T. ; Kubo, H. ; Shiraishi, T. ; Hiromoto, K. ; Fujiwara, T. ; Kagechika, H. Tetrahedron Lett. 2012, 53, 5916. (c) Lin, Q. H. ; Bao, C. Y. ; Cheng, S. Y. ; Yang, Y. L. ; Ji, W. ; Zhu, L. Y. J. Am. Chem. Soc. 2012, 134, 5052. (d) Li, Q. ; Zeng, Y. ; Zhang, X. H. ; Yu, T. J. ; Chen, J. P. ; Li, Y. Acta Chim. Sinica 2015, 73, 826(in Chinese). (李婧, 曾毅, 张小辉, 于天君, 陈金平, 李嫕, 化学学报, 2015, 73, 826. )
-
[7]
(a) Ast, S. ; Muller, H. ; Flehr, R. ; Klamroth, T. ; Walz, B. ; Holdt, H. J. Chem. Commun. 2011, 47, 4685. (b) Dong, Y. ; Li, J. F. ; Jiang, X. X. ; Song, F. Y. ; Cheng, Y. X. ; Zhu, C. J. Org. Lett. 2011, 13, 2252. (c) Yan, L. Q. ; Xie, M. S. ; Peng, M. S. ; Liu, W. Aust. J. Chem. 2013, 66, 1584. (d) Wang, L. Y. ; Li, H. H. ; Cao, D. R. Sens. Actuators B, Chem. 2013, 181, 749. (e) Li, C. W. ; Yang, D. ; Yi, B. ; Guo, Y. Chin. J. Org. Chem. 2016, 36, 787(in Chinese). (李长伟, 杨栋, 尹兵, 郭媛, 有机化学, 2016, 36, 787. )
-
[8]
(a) Kang, C. ; Kim, J. S. Org. Lett. 2011, 13, 5056. (b) Li, G. P. ; Zhu, D. J. ; Liu, Q. ; Xue, L. ; Jiang, H. Org. Lett. 2013, 15, 2002. (c) Yan, X. Q. ; Zhuo, J. B. ; Wang, J. C. ; Xie, L. L. ; Yuan, Y. F. Chin. J. Org. Chem. 2015, 35, 2184(in Chinese). (晏希泉, 卓继斌, 王吉成, 谢莉莉, 袁耀锋, 有机化学, 2015, 35, 2184. )
-
[9]
Yang, Y. T.; Huo, F. J.; Yin, C. X.; Zhang, A. M.; Chao, J. B.; Li, Y. Q.; Nie, Z. X.; Ramon, M. M.; Liu, D. S. Biosens. Bioelectron. 2013, 47, 300. doi: 10.1016/j.bios.2013.03.007
-
[10]
Li, K. T.; Lin, Y. B.; Yang, D. Y. Org. Lett. 2012, 14, 1190. doi: 10.1021/ol203229z
-
[11]
Lin, C. H.; Yang, D. Y. Org. Lett. 2013, 15, 2802. doi: 10.1021/ol401138q
-
[12]
Chen, J. H.; Liu, W. M.; Ma, J. J.; Xu, H. T.; Wu, J. S.; Tang, X. L.; Fan, Z. Y.; Wang, P. F. J. Org. Chem. 2012, 77, 3475. doi: 10.1021/jo3002722
-
[13]
Atsushi, T. Brain Res. Rev. 2000, 34, 137. doi: 10.1016/S0165-0173(00)00044-8
-
[14]
Robert, A. C.; William, R. H.; Charles, P. F.; Wolfqang, M. Metallomics 2010, 2, 306. doi: 10.1039/b926662c
-
[15]
(a) De Silva, A. P.; Gunaratne, H. Q. N.; Gunnlaugsson, T.; Huxley, A. J. M.; McCoy, C. P.; Rademacher, J. T.; Rice, T. E. Chem. Rev. 1997, 97, 1515.(b) Mikata, Y.; Wakamatsu, M.; Yano, S. Dalton Trans. 2005, 5, 545.(c) Mikata, Y.; Wakamatsu, M.; Kawamura, A.; Yamanaka, N.; Yano, S.; Odani, A.; Morihiro, K.; Tamotsu, S. Inorg. Chem. 2006, 45, 9262.
-
[16]
(a) Hirano, T. ; Kikuchi, K. ; Urano, Y. ; Higuchi, T. ; Nagano, T. J. Am. Chem. Soc. 2000, 122, 12399. (b) Gee, K. R. ; Zhou, Z. L. ; Qian, W. J. ; Kennedy, R. J. Am. Chem. Soc. 2002, 124, 776. (c) Gou, M. ; Tong, L. B. ; Jiang, L. ; Sun, J. ; Yin, G. Chin. J. Inorg. Chem. 2009, 25, 956(in Chinese). (郭敏, 佟履冰, 姜李, 孙剑, 尹桂, 无机化学学报, 2009, 25, 956. )
-
[17]
(a) Tang, B. ; Wang, X. Q. ; Zhang, Z. D. Chin. J. Appl. Chem. 1997, 14, 28(in Chinese). (唐波, 王晓清, 张志德, 应用化学, 1997, 14, 28. )(b) Wu, L. H. ; Xue, W. X. Chem. World 2009, 50, 529(in Chinese). (吴粦华, 薛王欣, 化学世界, 2009, 50, 529. )
-
[18]
韩换美, 吴亚光, 肖守军, 无机化学学报, 2010, 26, 1426. http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htmHan, H. M.; Wu, Y. G.; Xiao, S. J. Chin. J. Inorg. Chem. 2010, 26, 1426(in Chinese). http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htm
-
[19]
沈萍, 胡胜利, 化学试剂, 2012, 34, 737. doi: 10.3969/j.issn.0258-3283.2012.08.015Shen, P.; Hu, S. L. Chem. Reagents 2012, 34, 737(in Chinese). doi: 10.3969/j.issn.0258-3283.2012.08.015
-
[20]
(a) Wang, H. Y. ; Liu, X. C. ; Feng, X. ; Huang, Z. B. ; Shi, D. Q. Green Chem. 2013, 15, 3307. (b) Wang, H. Y. ; Liu, X. C. ; Huang, Z. B. ; Shi, D. Q. J. Heterocycl. Chem. 2015, 52, 380. (c) Liu, X. C. ; Lin, W. ; Feng, X. ; Huang, Z. B. ; Shi, D. Q. J. Heterocycl. Chem. 2014, 51, 1036. (d) Jin, P. P. ; Liu, X. C. ; Liu, D. Q. ; Huang, Z. B. ; Shi, D. Q. J. Heterocycl. Chem. 2015, 52, 1625. (e) Wang, J. X. ; Lin, W. ; Liu, H. T. ; Hu, M. H. ; Feng, X. ; Ren, J. F. ; Huang, Z. B. ; Shi, D. Q. Chin. J. Org. Chem. 2015, 35, 927(in Chinese). (王菊仙, 林伟, 刘洪涛, 胡明华, 冯贤, 任金凤, 黄志斌, 史达清, 有机化学, 2015, 35, 927. )
-
[21]
Shi, C. L.; Shi, D. Q. J. Chem. Res. 2011, 585.
-
[1]
-
表 1 香豆素并[4, 3-d]吡唑并[3, 4-b]吡啶衍生物3a~3h的合成
Table 1. Synthesis of coumarino[4, 3-d]pyrazolo[3, 4-b]pyridine derivatives 3a~3h
Entry Product R1 R2 R3 R4 Time/h Yield/% 1 3a H H CH3 CH3 4 76 2 3b CH3O H CH3 CH3 10 75 3 3c H H C6H5 C6H5 24 64 4 3d H Br C6H5 C6H5 24 62 5 3e H Br C6H5 CH3 15 72 6 3f H CH3O C6H5 CH3 10 70 7 3g H Cl CH3 C6H5 8 74 8 3h CH3O H CH3 C6H5 18 65 表 2 化合物3a~3h在乙醇溶液中的荧光及量子产量a
Table 2. Luminescence and fluorescence quantum yields of compounds 3a~3h in ethanol
Compound Emax/(L•mol-1•cm-1) λmax(ex)/nm λmax(em)/nm RFIb ΦFc 9, 10-Diphenylanthracene 1.9798 220.5 428.4 5585 0.660 3a 2.6777 196.0 435.0 6435 1.029 3b 2.7212 197.0 447.0 4726 0.768 3c 2.7447 198.0 477.0 3259 0.534 3d 2.6777 196.0 492.0 1002 0.160 3e 2.9208 198.0 492.0 193.7 0.034 3f 2.9586 195.0 465.0 197.1 0.035 3g 2.7958 197.0 475.0 2242 0.374 3h 2.7695 196.0 465.0 1208 0.200 a c=5×10-5 mol•L-1. bRelative fluorescence intensity. cRelative fluorescence quantum yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 2
- 文章访问数: 1629
- HTML全文浏览量: 593


 下载:
下载:







 下载:
下载:

