 图 1
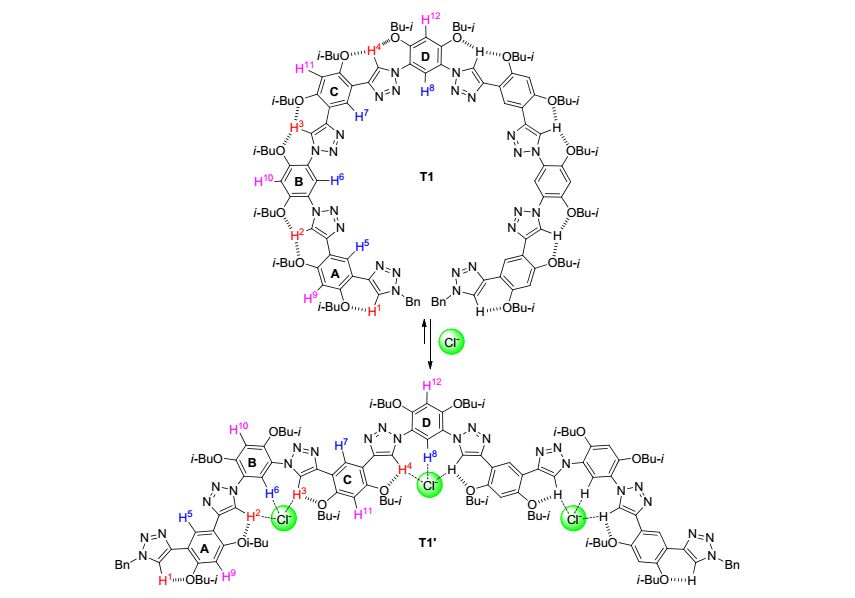
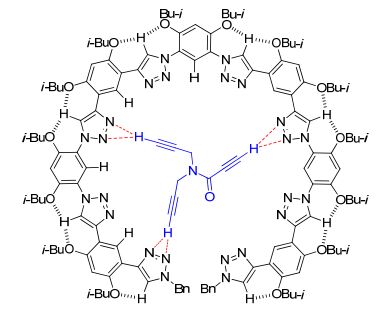
T1受分子内三中心C—H…O氢键驱动形成的螺旋二级结构及形成分子间C—H…Cl-氢键后形成的弯月型二级结构
Figure 1.
Three-center C—H…O hydrogen bonding-driven helical conformation of T1 and the crescent conformation induced by intermolecular C—H…Cl- hydrogen bonding
图 1
T1受分子内三中心C—H…O氢键驱动形成的螺旋二级结构及形成分子间C—H…Cl-氢键后形成的弯月型二级结构
Figure 1.
Three-center C—H…O hydrogen bonding-driven helical conformation of T1 and the crescent conformation induced by intermolecular C—H…Cl- hydrogen bonding

Citation: Sun Guangjun, Nie Chengbin, Zhao Xin, Li Zhanting. Intramolecular C-H…O Hydrogen Bonding-Driven 1, 2, 3-Trazole Foldamers:Assessment of Intermolecular C-H…X- (X=Cl, Br, I) and C-H…N Hydrogen Bonding[J]. Chinese Journal of Organic Chemistry, 2017, 37(7): 1757-1763. doi: 10.6023/cjoc201702012

C-H…O氢键驱动的1, 2, 3-三氮唑折叠体:评估分子间C-H…X-(X=Cl, Br, I)和C-H…N氢键的稳定性
English
Intramolecular C-H…O Hydrogen Bonding-Driven 1, 2, 3-Trazole Foldamers:Assessment of Intermolecular C-H…X- (X=Cl, Br, I) and C-H…N Hydrogen Bonding
-
Key words:
- hydrogen bonding
- / foldamer
- / 1, 2, 3-triazole
- / alkyne
- / molecular recognition
- / non-covalent interaction
-
芳香骨架的人工二级结构具有构象预测性高、骨架易于修饰和合成方法简单等特点, 在分子识别与自组装研究领域应用广泛[1~16].由苯环连接的1, 2, 3-三氮唑寡聚体代表一类重要的芳香二级结构骨架[10, 11].此类骨架可以通过三氮唑与Cl-形成分子间C5—H…Cl-氢键诱导产生折叠或螺旋构象[17~20].稍后的研究揭示, 在极性溶剂中, 较长的骨架也可以通过疏溶剂作用驱动的芳环堆积形成螺旋构象[21].通过这两种方法诱导产生的螺旋构象大约每四个三氮唑单元可以形成一轮, 整个骨架产生一个较小的内穴, 可以络合卤素负离子.我们发现, 分子内六元环的C5—H…O[22~24]或C5—H…F氢键可以直接诱导这类骨架形成另一类具有更大内穴的折叠或螺旋结构[25~27].这一螺旋结构的三氮唑N-2和N-3原子作为氢键受体很弱[28], 但能形成较强的N…I卤键[25].由于1, 2, 3-三氮唑具有与酰胺基团类似的较大偶极矩[11, 29], 并且被认为是酰胺基团的极性基团类似物, 可用于设计生物活性分子[29~35], 有必要进一步研究这一芳香基团形成其它分子间氢键的倾向性.本文报道这类三氮唑寡聚体骨架与Cl-形成分子间C5—H…Cl-氢键及与炔基形成C—H…N氢键的倾向性.
1 结果与讨论
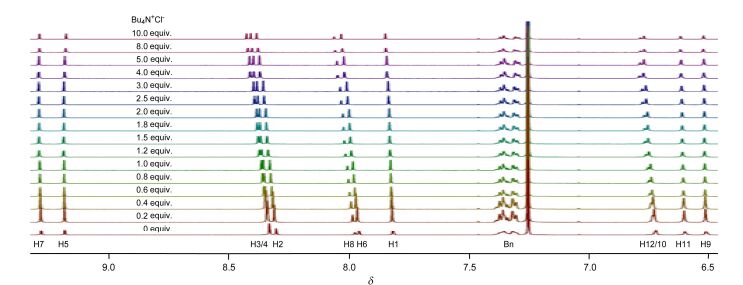
我们首先利用1H NMR研究Cl-(四丁基铵盐)与三氮唑八聚体T1的相互作用. T1在CDCl3中的1H NMR信号已经归属[25].受分子内三中心C5—H…O氢键的驱动, 这一分子的骨架形成一个螺旋型二级结构(图 1)[25].加入四丁基氯化铵(Bu4N+Cl-, 0~10 equiv.)诱导部分信号向低场移动.中间的三个三氮唑C5—H信号(H2-4) 位移最大(Δδ=0.08, 0.08, 0.10), 表明这三个H原子形成了更为稳定的分子间C5—H…Cl-氢键(图 2).由于临近的异丁氧基存在空间位阻, 这一结果意味着原来异丁氧基形成的C5—H…O氢键将会变弱.端位两个三氮唑C5—H信号(H-1) 向低场位移很小(Δδ<0.02), 表明这一C5—H原子形成的C5—H…Cl-氢键要弱很多, 也表明这一三氮唑形成的C-4一侧的分子内六元环氢键稳定性较高.
 图 1
T1受分子内三中心C—H…O氢键驱动形成的螺旋二级结构及形成分子间C—H…Cl-氢键后形成的弯月型二级结构
Figure 1.
Three-center C—H…O hydrogen bonding-driven helical conformation of T1 and the crescent conformation induced by intermolecular C—H…Cl- hydrogen bonding
图 1
T1受分子内三中心C—H…O氢键驱动形成的螺旋二级结构及形成分子间C—H…Cl-氢键后形成的弯月型二级结构
Figure 1.
Three-center C—H…O hydrogen bonding-driven helical conformation of T1 and the crescent conformation induced by intermolecular C—H…Cl- hydrogen bonding
仔细分析T1四个不同苯环上H的化学位移变化揭示, 内侧的三个不同的三氮唑三中心C5—H…O氢键中的两类六元环氢键具有不同的稳定性.与三氮唑C-4原子相连的两个苯环(A和C)上H-5, H-7, H-9和H-11的信号化学位移变化都非常小(Δδ<0.01), 表明这两个苯环上异丁基氧原子形成的C5—H…O氢键都较为稳定, Cl-的加入不能有效破坏或弱化此一氢键.与此相对照, 与三氮唑N-1原子连接的另两类苯环(B和D)上的H-6, H-8, H-10和H-12原子信号明显向低场移动(Δδ 0.09, 0.07, 0.05和0.05), 表明这一侧苯环上异丁基氧原子形成的C5—H…O氢键较弱, 受破坏或弱化的程度较高, 意味着Cl-主要从这一侧接近三氮唑的C5—H原子形成C5—H…Cl-氢键. H-6和H-8信号向低场移动可归结为其与Cl-形成弱的分子间C—H…Cl-氢键(图 1).而H-10和H-12信号向低场移动可以认为是, 分子间C—H…Cl-氢键的形成使得相连的两个三氮唑的N-2原子与这两个苯环的异丁基氧产生静电排斥作用, 使得这些异丁基氧原子更接近于二者之间的H-10和H-12原子, 从而导致增强的静电吸引作用或弱氢键.受溶解度限制, 我们不能增加更高浓度的四丁基氯化铵.对变化较大的信号化学位移分析表明, 在加入10 equiv.的四丁基氯化铵时, 化学位移变化仍没有达到形成一个平台, 即理论上三氮唑的三中心C5—H…O氢键并没有完全被破坏.考虑到氢键的动态性, 过量的四丁基氯化铵的加入主要诱导其三氮唑N-1原子一侧分子内氢键破坏, 在极端情况下产生另一个低能量的折叠或弯月型构象T1'(图 1). A和C苯环上H-5和H-7原子的化学位移在四丁基氯化铵过量较多时向高场移动, 表明这两个苯环上的异丁基氧原子形成的C5—H…O氢键受到部分破坏, 其与相连的三氮唑共平面性降低, 从而导致与两个连接的三氮唑的N-3原子的弱C—H…N氢键进一步降低.
加入四丁基溴化铵或四丁基碘化铵到同样浓度的T1 (5.0 mmol/L)的CDCl3溶液中, 导致后者的1H NMR低产区信号产生非常类似的化学位移变化(辅助材料图S1和图S2), 表明Br-和I-负离子也可以形成类似的分子间C—H…Br-和C—H…I-氢键.
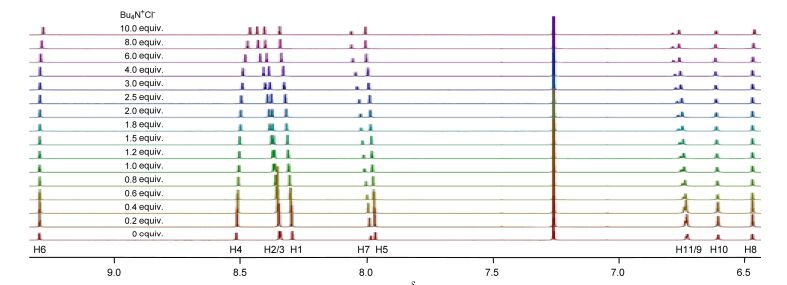
进一步的, 我们研究了四丁基氯化铵与较短的T2之间的相互作用. T2并入了六个1, 2, 3-三氮唑单元, 总体上其三个不同的三氮唑C5—H原子都形成了分子间C5—H…Cl-氢键, 导致这些H原子信号向低场移动(图 3).与T1类似, 这些分子间C5—H…Cl-氢键也导致B和D两类苯环上的H-5, H-9, H-7和H-11原子的化学位移向低场移动.但与T1不同的是, A和C两苯环上H-4和H-6位移明显向高场移动(Δδ -0.05和-0.02).这可能是因为, 在四丁基氯化铵过量时形成的分子间C—H…Cl-氢键一定程度上弱化了这两类苯环一侧形成的六元环C5—H…O氢键, 导致苯环与三氮唑之间的扭曲角增大, 弱化了这两个H原子与相邻三氮唑N-3之间的弱静电吸引作用或弱氢键. T1同类型的H原子化学位移变化很小, 一个可能原因是其更长的骨架导致端位苄基错位, 形成超过一轮的扭曲螺旋构象, 过量卤素负离子的加入没有改变相应三氮唑和苯环之间的扭曲.
对更短的三氮唑四聚体T3的合成见Eq. 1. T3(5.0 mmol/L)的1H NMR (CDCl3)研究表明, 四丁基氯化铵(10 equiv.)诱导H-1, H-2和H-3的化学位移向低场移动δ 0.03, 0.07和0.07(辅助材料图S3), 变化趋势与T1 和T2相同.二维NOESY核磁实验揭示, 在CDCl3中, H-1和H-2与相邻的异丁基存在NOE相关(辅助材料图S4), 但在过量四丁基氯化铵存在下, 这些NOE作用消失(辅助材料图S5), 表明其分子内的C5—H…O氢键被Cl-破坏或弱化, 特定低能量构象稳定性降低, 也进一步证明了分子间C—H…Cl-氢键的形成.
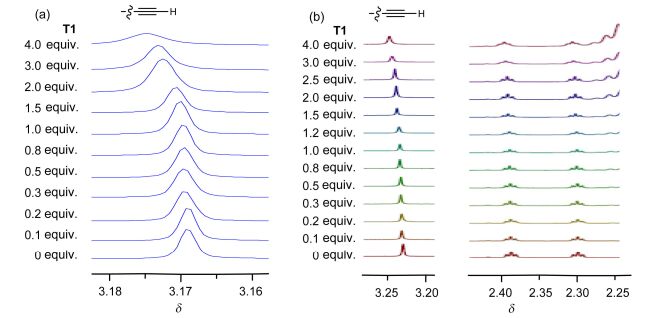
我们此前研究表明, T1与三碘衍生物可以通过协同N…I卤键形成稳定的1:1络合物[25].炔烃端基C—H键极化性较高, 因此可以形成弱的C—H…O氢键[36], 但一般只能在晶体中观察到[37].在CDCl3和CD2Cl2中的1H NMR研究表明, T1和苯乙炔之间没有形成可以观察到的相互作用.我们进一步合成了三炔衍生物G1~G6, 在CD2Cl2中通过1H NMR研究了T1的加入对这些分子的炔基端H原子化学位移的影响. 1H NMR实验揭示, 加入过量的T1 (4.0 equiv.)导致G1 (5.0 mmol/L)的炔基C—H信号向低场移动δ 0.007(图 4a), 并且位移在加入T1超过1 equiv.时开始明显. 4.0 equiv.的T1可以引起G2与羰基相连的炔基端位H化学位移向低场移动达δ 0.02, 两个炔丙基端位H化学位移向低场移动δ 0.015和0.008 (图 4b).上述化学位移尽管较小, 但可以重复测定, 并且对同样浓度的丙炔酸甲酯的1H NMR实验表明, 4倍量的T1不能导致其炔基端位H化学位移发生任何变化, 而过量8倍的1N, 4-二(2-甲氧基苯基)-1, 2-3-三氮唑也不能导致G1或G2的端基炔H化学位移发生可观察到的变化.这些实验表明, T1的三氮唑N-2和N-3原子确实能通过协同的弱分子间C—H…N氢键络合G1和G2. G2与羰基相连的炔基H表现出最大的化学位移变化可以归结为, 羰基的拉电子效应增强了这一H原子的缺电性, 因此其作为供体形成氢键的能力也更强一些. T1的折叠构象与G2比较匹配, 可能也是一个因素.作为例子, T1和G2的结合模式列于图 5.
在保持炔烃分子浓度为5.0 mmol/L的条件下, 4.0 equiv.的T1导致G3的炔烃端基H信号化学位移向低场移动δ 0.007(辅助材料图S6), 移动幅度小于G3的三个信号, 也表明羰基相连的炔基端位H能形成更强的C—H…N氢键.在相同条件下, G4的两个炔基信号向低场位移δ 0.01(辅助材料图S7).这一客体只有两个炔基结合位点, 但化学位移变化值仍大于G3, 表明三氟乙酰基的拉电子效应提高了单个炔基端位H形成C—H…N氢键的能力.加入两倍当量的T1可以导致三炔G5的炔基端位H化学位移向低场移动δ 0.005(辅助材料图S8), 而G6的炔基端位H化学位移变化很小(δ<0.001) (辅助材料图S9), 表明柔性链的引入不利于分子间C—H…N氢键的形成.
2 结论
通过1H NMR研究揭示, 1, 2, 3-三氮唑芳香二级结构的折叠或螺旋构象可以通过形成分子间C5—H…X- (X=Cl, Br, I)氢键, 诱导三氮唑骨架形成一类新的更加扩展的弯月形二级结构.三氮唑芳香螺旋体的形成也有利于促进其N-2和N-3原子形成与炔基端位H形成分子间C—H…N氢键.尽管总体上, 这一分子间氢键非常弱, 引起的化学位移变化相当小, 研究表明, 即使在溶剂本身作为氢键供受体参与竞争的情况下, 汇聚式的三氮唑螺旋构象仍然能够诱导多个弱氢键形成协同效应, 产生可以观测到的光谱性质变化.氯仿和二氯甲烷是极性较低的有机溶剂, 但仍然可以作为供受体形成分子间的氢键.未来我们将在三氮唑寡聚体外侧引入长的脂肪链, 制备在烃类溶剂中溶解的折叠体, 以研究是否能实现更稳定的弱氢键结合及实现定量评估.
3 实验部分
3.1 仪器与试剂
1H NMR, 13C NMR谱图采用Bruker Avant Ⅱ 400 MHz型核磁共振谱仪; 高分辨质谱采用Bruker micrOTOF Ⅱ 10257型质谱仪进行测定; 在未特别说明的情况下, 实验中所涉及的溶剂和反应底物均为商品试剂, 一般购自上海阿拉丁试剂公司、安耐吉试剂公司、国药集团、百灵威科技有限公司、Aldrich以及TCI等试剂公司.薄层色谱采用Silica gel HSGF254 plate (0.2 mm; 黄海; 烟台江友), 柱层析采用粗孔硅胶(300~400目; 上海泰坦).化合物T1, T2[25]和G1[38]根据文献制备, G3从Aldrich购买.
3.2 实验方法
3.2.1 化合物T3的制备
于50 mL三颈瓶中加入化合物1[25] (0.25 g, 0.30 mmol)、五水硫酸铜(0.15 g, 0.60 mmol)、抗坏血酸钠盐(0.46 g, 2.3 mmol)、三[(1-苄基-1H-1, 2, 3-三唑-4-基)甲基]胺(TBTA, 24 mg, 0.045 mmol).抽空换氮气四次后加入30 mL二氯甲烷、叔丁醇和水(V:V:V=10:5:2) 混合溶剂及苄基叠氮化物(0.34 mg, 2.5 mmol).常温下搅拌36 h后用旋转蒸发仪除去溶剂.残留物用30 mL二氯甲烷处理.有机相分别用EDTA水溶液(10 mmol/L, 15 mL)、水(15 mL×2) 和饱和食盐水(15 mL)洗涤, 再用无水硫酸钠干燥.固体过滤后旋除溶剂, 所得有机物用柱层析分离[V(甲醇):V(二氯甲烷)=1:80~1:70], 得产物T3 0.18 g, 产率56%, 白色固体. m.p.>290℃; 1H NMR (500 MHz, CDCl3) δ: 9.21 (s, 2H), 8.33 (s, 2H), 7.97 (s, 1H), 7.81 (s, 2H), 7.38~7.27 (m, 10H), 6.73 (s, 1H), 6.50 (s, 2H), 5.53 (s, 4H), 3.85 (dd, J=9.0, 6.6 Hz, 8H), 3.78 (d, J=6.3 Hz, 4H), 2.17 (tt, J=13.3, 6.6 Hz, 2H), 2.06~1.95 (m, 4H), 1.04 (d, J=6.7 Hz, 12H), 0.90 (dd, J=6.7, 4.0 Hz, 24H); 13C NMR (126 MHz, CDCl3) δ: 156.2, 156.0, 153.6, 143.6, 142.8, 135.0, 129.0, 128.5, 128.2, 127.4, 124.5, 124.3, 122.1, 120.0, 112.5, 99.0, 96.4, 76.0, 75.1, 74.9, 54.0, 29.7, 28.4, 28.2, 19.6, 19.4, 19.1; MS (ESI) m/z: 1111.7 [M+H]+. HRMS (MALDI-TOF) calcd for C64H79N12O6[M+H]+ 1111.6240, found 1111.6248.
3.2.2 化合物G2的制备
氮气保护下于50 mL蛋形瓶中加入20 mL干燥的N, N-二乙基甲酰胺(DMF), 然后搅拌下依次加入二炔丙胺(0.33 g, 3.6 mmol)、丙炔酸(0.26 g, 3.6 mmol)、N, N-二异丙基乙胺(1.9 mL, 10.8 mmol)、2-(7-偶氮苯并三氮唑)-N, N, N', N'-四甲基脲六氟磷酸酯(HATU) (2.7 g, 7.1 mmol).所得溶液常温搅拌18 h后加入300 mL水, 然后用乙酸乙酯(50 mL×3) 萃取.合并有机相, 分别用水(50 mL×3) 和饱和食盐水(50 mL)洗涤, 无水硫酸钠干燥.固体过滤后用旋转蒸发仪旋除溶剂, 所得样品柱层析分离[V(乙酸乙酯):V(石油醚)=1:8~1:4], 得产物G2 0.16 g, 产率30%, 蜡状固体. 1H NMR (400 MHz, CDCl3) δ: 4.46 (dd, J=65.2, 2.4 Hz, 4H), 3.19 (s, 1H), 2.30 (dt, J=33.3, 2.4 Hz, 2H); 13C NMR (101 MHz, CDCl3) δ: 152.4, 80.1, 77.2, 77.0, 74.7, 73.6, 72.9, 37.5, 32.6; MS (ESI) m/z: 146.1 [M+H]+, 178.1 [M+Na]+. HRMS (EI-TOF) calcd for C9H8NO [M+H]+ 145.0528, found 145.0525..
3.2.3 化合物G4的制备
氮气保护下于50 mL蛋形瓶中加入20 mL干燥的二氯甲烷, 之后顺次加入二炔丙胺(0.26 g, 2.8 mmol)和干燥三乙胺(0.4 mL, 2.8 mmol), 搅拌下缓慢向溶液中加入三氟醋酸酐(1.5 mL, 11.2 mmol).室温搅拌3 h后, 向溶液中缓慢加入质量分数为5%碳酸氢钠水溶液(30 mL).分液后所得水相用二氯甲烷(20 mL×2) 萃取.合并有机相, 分别用5%碳酸氢钠水溶液(20 mL)、水(20 mL×2) 和饱和食盐水(20 mL)洗涤, 无水硫酸钠干燥后过滤固体.有机相用旋转蒸发仪浓缩, 样品用柱层析分离[V(二氯甲烷):V(石油醚)=1:5~1:3], 得产物G4 0.16 g, 产率30%, 油状物. 1H NMR (400 MHz, CDCl3) δ: 4.39 (dd, J=22.2, 1.7 Hz, 4H), 2.35 (dt, J=18.2, 2.4 Hz, 2H). HRMS (EI-TOF) calcd for C8H7F3NO[M+H]+ 190.0408, found 190.0399.
3.2.4 化合物G5的制备
氮气保护下于50 mL蛋形瓶中加入20 mL DMF, 然后加入间-苯三甲酸(0.5 g, 2.4 mmol)和碳酸钾(1.5 g, 9.5 mmol).搅拌20 min后向体系滴加炔丙基溴(0.8 mL, 10.2 mmol).室温搅拌21 h后用旋转蒸发仪除去溶剂, 残留物用30 mL二氯甲烷溶解.有机相分别用水(10 mL×2) 和饱和食盐水(10 mL)洗涤, 再用无水硫酸钠干燥.固体过滤后除去溶剂, 所得有机物用柱层析分离[V(乙酸乙酯):V(石油醚)=1:10~1:6], 得产物G5 0.61 g, 产率79%, 蜡状固体. 1H NMR (400 MHz, CDCl3) δ: 8.93 (s, 3H), 4.99 (s, 6H), 2.56 (t, J=2.4 Hz, 3H); MS (ESI) m/z: 325.2 [M+H]+. HRMS (MALDI-MS) calcd for C18H13O6 [M+H]+ 325.0641, found 325.0649..
3.2.5 化合物G6的制备
氮气保护下于100 mL蛋形瓶中加入干燥40 mL四氢呋喃, 然后加入间-苯三甲酸(0.42 g, 2.0 mmol)和三乙胺(0.90 mL, 6.0 mmol).搅拌20 min后向体系中加入缩合剂1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDCI, 1.35 g, 7.00 mmol)及3-丁炔-1-醇(0.49 g, 7.00 mmol).搅拌继续21 h后浓缩, 残留物用30 mL二氯甲烷处理.有机相分别用水(20 mL×3) 和饱和食盐水(20 mL)洗涤, 再用硫酸钠干燥.固体过滤后旋除溶剂, 所得有机物用柱层析分离[V(乙酸乙酯):V(石油醚)=1:8~1:6], 得G6 0.19 g, 产率26%, 油状物.1H NMR (400 MHz, CDCl3) δ: 8.89 (s, 3H), 4.50 (t, J=6.8 Hz, 6H), 2.71 (td, J=6.8, 2.6 Hz, 6H), 2.05 (t, J=2.6 Hz, 3H); 13C NMR (126 MHz, CDCl3) δ: 164.6, 134.8, 131.1, 79.6, 70.3, 63.2, 19.1; MS (ESI) m/z: 367.2 [M+H]+, 389.2 [M+Na]+. HRMS (MALDI-TOF) calcd for C21H19O6 [M+H]+ 367.1167, found 367.1166..
辅助材料(Supporting Information) 核磁滴定图谱和主体-客体混合样品图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Hill, D. J.; Mio, M. J.; Prince, R. B.; Hughes, T. S.; Moore, J. S. Chem. Rev. 2001, 101, 3893. doi: 10.1021/cr990120t
-
[2]
Huc, I. Eur. J. Org. Chem. 2004, 17.
-
[3]
Gong, B. Acc. Chem. Res. 2008, 41, 1376. doi: 10.1021/ar700266f
-
[4]
Li, Z.-T.; Hou, J.-L.; Li, C. Acc. Chem. Res. 2008, 41, 1343. doi: 10.1021/ar700219m
-
[5]
Juwarker, H.; Suk, J.-M.; Jeong, K.-S. Chem. Soc. Rev. 2009, 38, 3316. doi: 10.1039/b909034g
-
[6]
Ni, B.-B.; Yan, Q.; Ma, Y.; Zhao, D. Coord. Chem. Rev. 2010, 254, 954. doi: 10.1016/j.ccr.2010.02.004
-
[7]
Gan, Q.; Wang, Y.; Jiang, H. Curr. Org. Chem. 2011, 15, 1293. doi: 10.2174/138527211795378227
-
[8]
Zhang, D.-W.; Zhao, X.; Hou, J.-L.; Li, Z.-T. Chem. Rev. 2012, 112, 5271. doi: 10.1021/cr300116k
-
[9]
Zhang, D.-W.; Zhao, X.; Li, Z.-T. Acc. Chem. Res. 2014, 47, 1961. doi: 10.1021/ar5000242
-
[10]
Lee, S.; Flood, A. H. Top. Heterocycl. Chem. 2012, 28, 85.
-
[11]
Hua, Y.; Flood, A. H. Chem. Soc. Rev. 2010, 39, 1262. doi: 10.1039/b818033b
-
[12]
施朱名, 宋宇, 陆方, 周天佑, 赵新, 张文科, 黎占亭, 化学学报, 2013, 71, 51.Shi, Z.; Song, Y.; Lu, F.; Zhou, T.; Zhao, X.; Zhang, W.; Li, Z. Acta Chim. Sinica 2013, 71, 51(in Chinese).
-
[13]
汪奕, 王辉, 张丹维, 黎占亭, 有机化学, 2016, 36, 1580. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345572.shtmlWang, Y.; Wang, H.; Zhang, D.; Li, Z. Chin. J. Org. Chem. 2016, 36, 1580(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345572.shtml
-
[14]
Zhang, Y.-C.; Chen, L.; Wang, H.; Zhou, Y.-M.; Zhang, D.-W.; Li, Z.-T. Chin. Chem. Lett. 2016, 27, 817. doi: 10.1016/j.cclet.2016.03.041
-
[15]
Chen, L.; Zhang, Y.-C.; Wang, W.-K.; Tian, J.; Zhang, L.; Wang, H.; Zhang, D.-W.; Li, Z.-T. Chin. Chem. Lett. 2015, 26, 811. doi: 10.1016/j.cclet.2015.01.036
-
[16]
Gan, Q.; Wang, Y.; Jiang, H. Chin. J. Chem. 2013, 31, 651. doi: 10.1002/cjoc.201300240
-
[17]
Meudtner, R. M.; Ostermeier, M.; Goddard, R.; Limberg, C.; Hecht, S. Chem. Eur. J. 2007, 13, 9834. doi: 10.1002/chem.200701240
-
[18]
Hua, Y.; Flood, A. H. J. Am. Chem. Soc. 2010, 132, 12838. doi: 10.1021/ja105793c
-
[19]
Wang, Y.; Xiang, J.; Jiang, H. Chem. Eur. J. 2011, 17, 613. doi: 10.1002/chem.201001560
-
[20]
Wang, Y.; Bie, F.; Jiang, H. Org. Lett. 2010, 12, 3630. doi: 10.1021/ol1014043
-
[21]
Wang, Y.; Li, F.; Han, Y.; Wang, F.; Jiang, H. Chem. Eur. J. 2009, 15, 9424. doi: 10.1002/chem.v15:37
-
[22]
Zhu, Y.-Y.; Wang, G.-T.; Wang, R.-X.; Li, Z.-T. Cryst. Growth Des. 2009, 9, 4778. doi: 10.1021/cg9006197
-
[23]
Lu, B.-Y.; Li, Z.-M.; Zhu, Y.-Y.; Zhao, X.; Li, Z.-T. Tetrahedron 2012, 68, 8857. doi: 10.1016/j.tet.2012.08.061
-
[24]
Wu, C.-F.; Zhao, X.; Lan, W.-X.; Cao, C.; Liu, J.-T.; Jiang, X.-K.; Li, Z.-T. J. Org. Chem. 2012, 77, 4261. doi: 10.1021/jo300063u
-
[25]
You, L.-Y.; Chen, S.-G.; Zhao, X.; Liu, Y.; Lan, W.-X.; Zhang, Y.; Lu, H.-J.; Cao, C.-Y.; Li, Z.-T. Angew. Chem., Int. Ed. 2012, 51, 1657. doi: 10.1002/anie.v51.7
-
[26]
Wu, C.-F.; Li, Z.-M.; Xu, X.-N.; Zhao, Z.-X.; Zhao, X.; Wang, R.-X.; Li, Z.-T. Chem. Eur. J. 2014, 20, 1418. doi: 10.1002/chem.v20.5
-
[27]
Liu, Y.-H.; Zhang, L.; Xu, X.-N.; Li, Z.-M.; Zhang, D.-W.; Zhao, X.; Li, Z.-T. Org. Chem. Front. 2014, 1, 494. doi: 10.1039/C4QO00047A
-
[28]
Wang, D.-Y.; You, L.-Y.; Wang, J.-L.; Wang, H.; Zhang, D.-W.; Li, Z.-T. Tetrahedron Lett. 2013, 54, 6967. doi: 10.1016/j.tetlet.2013.10.064
-
[29]
Holub, J. M.; Kirshenbaum, K. Chem. Soc. Rev. 2010, 39, 1325. doi: 10.1039/b901977b
-
[30]
Milli, L.; Larocca, M.; Tedesco, M.; Castellucci, N.; Ghibaudi, E.; Cornia, A.; Calvaresi, M.; Zerbetto, F.; Tomasini, C. J. Org. Chem. 2014, 79, 5958. doi: 10.1021/jo500963n
-
[31]
Kann, N.; Johansson, J. R.; Beke-Somfai, T. Org. Biomol. Chem. 2015, 13, 2776. doi: 10.1039/C4OB02359E
-
[32]
Li, X. Chem. Asian J. 2011, 6, 2606. doi: 10.1002/asia.v6.10
-
[33]
Xu, Y.-Y.; Qian, A.-R.; Cao, X.-F.; Ling, C.-Y.; Cao, Y.-B.; Wang, R.-L.; Li, Y.-S.; Yang, Y.-S. Chin. Chem. Lett. 2016, 27, 703. doi: 10.1016/j.cclet.2016.01.040
-
[34]
Wang, B.; Shi, Y.; Zhan, Y.; Zhang, L.; Zhang, Y.; Wang, L.; Zhang, X.; Li, Y.; Li, Z.; Li, B. Chin. J. Chem. 2015, 33, 1124. doi: 10.1002/cjoc.201500436
-
[35]
Cai, M.; Hu, J.; Tian, J.-L.; Yan, H.; Zheng, C.-G.; Hu, W.-L. Chin. Chem. Lett. 2015, 26, 675. doi: 10.1016/j.cclet.2015.03.015
-
[36]
Desiraju, G. R. Acc. Chem. Res. 2002, 35, 565. doi: 10.1021/ar010054t
-
[37]
Lehane, K. N.; Moynihan, E. J. A.; Brondel, N.; Lawrence, S. E.; Maguire, A. R. CrystEngComm 2007, 9, 1041. doi: 10.1039/b709261j
-
[38]
Yoosaf, K.; Llanes-Pallas, A.; Marangoni, T.; Belbakra, A.; Marega, R.; Botek, E.; Champagne, B.; Bonifazi, D.; Armaroli, N. Chem. Eur. J. 2011, 17, 3262. doi: 10.1002/chem.v17.11
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 14
- 文章访问数: 2166
- HTML全文浏览量: 365


 下载:
下载:




 下载:
下载:

