
Citation: Cheng Hua, Nie Ren, Wang Wanqiang, Huang Lin, Liu Ke, Chen Cheng, Wu Qiongyou. Research Progress in Structural Modification of Antimycin A[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1368-1381. doi: 10.6023/cjoc201702010

抗霉素A结构改造的研究进展
English
Research Progress in Structural Modification of Antimycin A
-
Key words:
- antimycin A
- / inhibitor
- / biological activity
- / structural modification
-
1 抗霉素A的发现及生物活性研究
1948年, Leben等[1]在威斯康星大学发现了一株能抑制苹果黑星病菌并可产生黑绿色素的链霉菌, 随后从其发酵液中获得了一种活性提取物, 发现它对大多数所测试的真菌及部分细菌有抑制作用.尽管未能从中分离出纯化合物, 但鉴于其独特的活性, 他们仍将其中有生物活性的物质取名为Antimycin[2].一年后, Dunshee等[3]从初提取物中分离出一种表观单一、具有生物活性的结晶.由于母液中还含有其它生物活性物质, 他们将结晶命名为Antimycin A.随着层析柱技术不断发展, Dunshee等所得的生物活性结晶被证实至少含有四种化合物, 因此科学家们后来根据它们在层析中的相对位移依次命名为Antimycins A1, A2, A3和A4[4].由于早期结构鉴定手段有限, 从不同来源分离到的Antimycin A因为结构未能及时确定而被冠以不同的名字, 如blastmycin, 720-A等[5].随着纯化和结构鉴定手段的发展, 这些化合物被证明与Antimycin A是同一化合物[6].因此, Antimycin A被一直沿用至今, 而其它名字则逐渐被淘汰. 1970年, Berti等[7]发现了Antimycins A5和A6, 而Antimycins A7和A8则由Barrow等[8]在1997年才发现. Antimycins A9, A10~A16, 以及A17发现得更晚, 直到2005年才分别由Shiomi, Hosotani和Lin小组[9~11]报道. 2010年, 孙承航课题组[12]从树植物木榄叶中分离得到A18.
2010年, Zheng课题组[13]通过高效反向色谱仪从Antimycin A的培养基发酵液中分离并纯化出8种组分, 它们分别为Antimycins A1~A3, A8, 为Antimycin A的分离与纯化提出了全新的方法.到目前为止, 被发现的Antimycin A系列化合物已达46种[14, 15], 其中包括Antimycins A1~A8, A10(均由a, b两个成分组成), 及Antimycins A9, A11~A20(均为单组分).上述抗霉素类化合物按照发现顺序以Antimycins A1~A20命名, 而另一类抗霉素类化合物由于C-7, C-8侧链特点而单独命名[22], 它们的发现顺序、发现模型、产生菌株及来源见表 1, 化学结构见表 2. Antimycin A3b是Antimycin A混合物中最主要的成分[2], 且文献中出现的生物活性研究也大都用A3b.因此, 如无特别说明, 后面内容中的Antimycin A指的就是Antimycin A3b.

Antimycin A对几乎所有生物的线粒体呼吸链都有抑制作用, 是呼吸作用电子传递链的不可逆抑制剂[23], 它与细胞色素bc1复合物的Qi位点结合[24, 25], 阻断了电子从细胞色素b到细胞色素c1的传递[26], 结果导致: (1) 线粒体膨胀[27]; (2) 细胞ATP含量迅速下降, 与ATP有关酶的活性降低或失活, 进而导致细胞内K+, Na+梯度失衡, 最终使细胞涨亡; (3) 内质网释放储存的Ca2+, 增加胞浆中游离的Ca2+浓度, 进而致使胞外的Ca2+进入, 最终使细胞吸水膨胀[28]; (4) Antimycin A与细胞色素b和c1复合体的结合, 阻断了Q循环中单电子的传递[29].因此, Antimycin A表现出广泛的生物活性. 1997年, Barrow[30]报道了Antimycin A对ATP-柠檬酸裂解酶的抑制作用, 其Ki值为4~60 μmol/L; 2004年, 欧阳钧课题组[31]发现Antimycin A能够抑制PC12细胞线粒体COⅡ的基因表达; 2015年, Wu等[32]通过高通量筛选平台发现Antimycin A是一种潜在的肺癌肿瘤治疗药物; 同年, 崔树娜课题组[33]发现Antimycin A能够诱导RAW264.7巨噬细胞线粒体的损伤, 增强巨噬细胞对白色念珠菌的吞噬功用, 降低脂多糖诱导的炎症反应, 可能与激活MAPK P38磷酸化, 进而激活MAPK信号转导通路有关; 另外, Antimycin A类化合物还具有抗炎[21]、抗虫[34]以及抑制植物生长的活性[19].
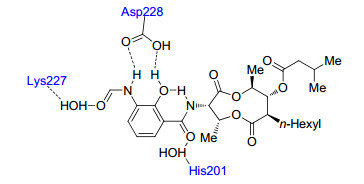
尽管Antimycin A具有广泛的生物活性, 其作用机制直到2005年才得以确认. 2005年, Berry等[35]获得了Antimycin A与牛心来源细胞色素bc1复合物的共结晶结构, 明确了Antimycin A是细胞色素bc1复合物Qi位点的抑制剂.此外, 他们还发现Antimycin A与酶活性空腔存在着以下重要作用(如图 1所示): (1) 甲酰胺的羰基与227位的赖氨酸(Lys227) 通过水形成了分子间的氢键; (2) 羟基和甲酰胺的N—H与228位的天冬氨酸(Asp228) 也形成了分子间的氢键; (3) 酰胺键的羰基与201位的组氨酸(His201) 通过一分子水形成了分子间氢键, 且羟基与酰胺键还形成了分子内氢键.
2 基于抗霉素A的结构改造
鉴于Antimycin A与细胞色素bc1复合物作用机制的明确, 越来越多科研工作者对其进行了系统深入地研究.由于Antimycin A结构复杂且合成难度大, 对光和热敏感, 且毒性较大, 科学家们对其进行了一系列的结构改造, 期望可以获得更理想的抑制剂. Antimycin A结构可分为两部分, 即九元-双内酯大环和多取代苯环, 两者以酰胺键进行连接.研究表明:苯环上酚羟基的甲基化、N-甲酰基的去除或双内酯大环在碱性条件下的断裂均会影响其抑制电子传递能力. Antimycin A1b和Antimycin A3b的区别在于双内酯大环的取代基分别为正己基和正丁基, 其活性基本相当; 而当苯环上的N-甲酰基被乙酰基取代时, 活性稍有降低.现有研究结果表明: Antimycin A结构中的芳环及其取代基应是保持生物活性的必要结构, 而双内酯大环主要是提高化合物的疏水性, 对活性影响似乎不大.因此, 对Antimycin A结构的改造主要集中在对其芳环结构的取代基优化和双内酯大环片段的改造[36], 下面我们按照时间先后顺序对具体的结构改造进行详细介绍.
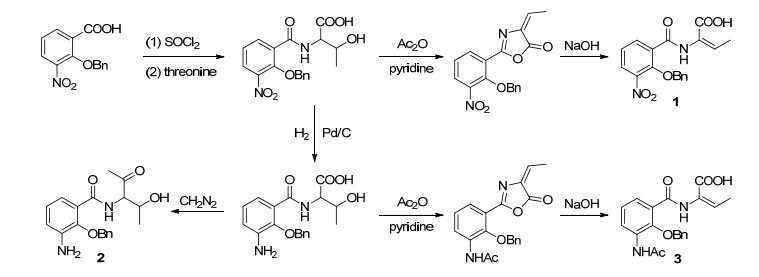
1959年, Okumura等[37]以较高收率合成了Antimycin A的类似物1~3, 其合成路线如Scheme 1所示.
1963年, Dickie等[36]以各种脂肪长链烷基取代Antimycin A的双内酯大环, 合成了一系列3-甲酰胺水杨酸的酰胺衍生物4a~4g, 该系列化合物对细胞色素bc1复合物具有一定的抑制活性, 但其活性均不如Antimycin A(表 3).此外, 在这些化合物中, 酰胺键相连的侧链为十六烷基时活性最高, 且抑制活性随侧链碳原子个数的减少而降低, 这说明增加化合物的疏水性有利于抑制剂与酶的结合.此外, 他们还发现取代苯环中的甲酰胺基被硝基代替后, 所得化合物的活性有所降低.因此, 这些实验结果表明: Antimycin A的活性药效团是取代芳环部分, 双内酯大环主要起到提高侧链疏水性的作用.
 表 3
Antimycin A类似物4a~4g的合成路线及活性测试
Table 3.
Synthetic route and biological activities of antimycin A analogues 4a~4g
表 3
Antimycin A类似物4a~4g的合成路线及活性测试
Table 3.
Synthetic route and biological activities of antimycin A analogues 4a~4g

1990年, Selwood研究小组[38]借助计算机模拟的方法, 用4条合成路线合成了31个Antimycin A类似物(如表 4所示).生物活性测试结果表明:化合物5a~5g对魏氏盖头丝虫(Dipetalonema Viteae)具有较好的抑制作用, 而活性最好化合物5b的EC50达到了14.5 nmol/L(如表 4).
 表 4
Antimycin A类似物5a~5g的合成路线及生物活性结果
Table 4.
Synthetic routes and biological evaluation of antimycin A analogues 5a~5g
表 4
Antimycin A类似物5a~5g的合成路线及生物活性结果
Table 4.
Synthetic routes and biological evaluation of antimycin A analogues 5a~5g

1990年, Hayes等[39]在Selwood工作的基础上进一步合成了化合物BWA728C (6a)和BWA466C (6b, 如表 5所示), 对其进行活性研究发现, 它们对彭亨布鲁线虫(B. pahangi)和寄生蠕虫(A. viteae)具有比较好的抑制活性, 对寄生蠕虫的EC50分别为33和11 nmol•L-1, 而Antimycin A的EC50仅为3000 nmol•L-1.
 表 5
化合物BWA728C (6a)和BWA466C (6b)的结构与生物活性
Table 5.
Structures and activities of BWA728C (6a) and BWA466C (6b)
表 5
化合物BWA728C (6a)和BWA466C (6b)的结构与生物活性
Table 5.
Structures and activities of BWA728C (6a) and BWA466C (6b)

1993年, Miyoshi等[40]通过保留有效活性基团, 对其侧链进行了结构改造.他们引入二苯醚结构单元来取代其双内酯环结构, 合成了一系列Antimycin A类似物, 其合成路线如表 6所示.此后, 他们将所合成的化合物与一种人工合成的Antimycin A进行比较, 最终筛选发现了其类似物7 (pI50为7.08, 其中pI50=-logI50)和Antimycin A (pI50为7.42) 对细胞色素bc1复合物的抑制活性相当.以上结果表明:在合适的条件下, Antimycin A的分子结构可以允许水杨酸基团与其紧密结合; 此外, 双内酯环状部分对于抑制剂是非常重要的, 它不仅可以增强分子的疏水性, 还可以更好地与细胞色素bc1复合物的活性腔匹配.
 表 6
Antimycin类似物7的合成路线及活性结果
Table 6.
Synthetic route and biological activities of antimycin A analogue 7
表 6
Antimycin类似物7的合成路线及活性结果
Table 6.
Synthetic route and biological activities of antimycin A analogue 7

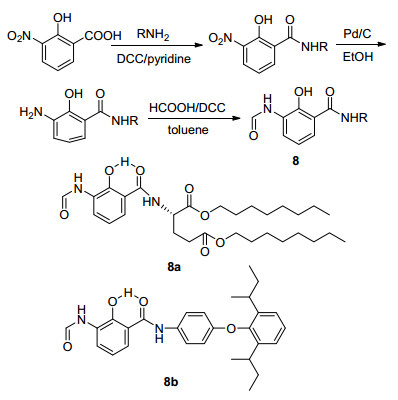
1995年, Miyoshi研究小组[41]通过保留主要的有效活性基团, 将其双内酯大环片段改造成长链双酯片段以及二苯醚片段, 合成了一系列Antimycin A类似物8, 其合成路线如Scheme 2所示.进一步的生测结果表明, 化合物8a和8b对细胞色素bc1复合物的抑制活性很高, 与Antimycin A接近(如表 7所示).
 表 7
化合物8a和8b与Antimycin A的活性比较
Table 7.
Inhibitory activity of antimycin A and the synthetic analogues 8a and 8b against the bc1 complex
表 7
化合物8a和8b与Antimycin A的活性比较
Table 7.
Inhibitory activity of antimycin A and the synthetic analogues 8a and 8b against the bc1 complex

1996年, Shenin等[42]对Antimycin A左边苯环上的酰胺键进行了磷酸化的改造, 合成了一系列Antimycin A类似物9, 其合成路线如Eq. 1所示.然而遗憾的是, 所合成化合物的杀虫活性和调节植物生长活性均不理想.
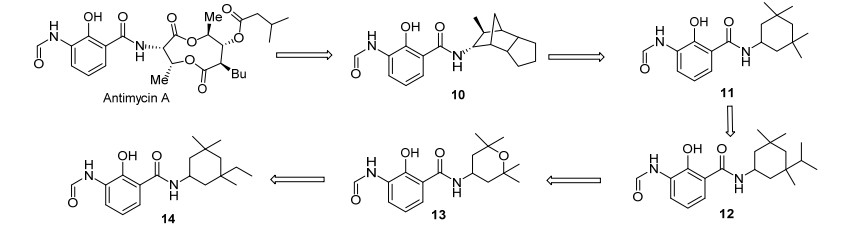
在Antimycin A结构改造方面, 尤为引人关注的是陶氏化学科学家们所做的贡献[43]. 2001年, 他们保留了Antimycin A中的N-酰胺水杨酰胺部分, 将双环内酯部分改造为芳香环、脂肪环(开环和闭环)、杂环、二环及三环结构, 最后合成了五大系列共750多个化合物, 并从这些化合物中筛出了5个具有代表性的高活性化合物10~14 (Scheme 3).其中最理想的是化合物14, 它具有广谱杀菌活性, 尤其是对葡萄和蔬菜灰霉病(BOTRCI)、颖枯壳小球腔菌(LEPTNO)、叶枯病菌(SEPTTR)、霜霉病(PLASVI)、马铃薯晚疫病菌(PHYTIN)都有良好的防效(表 8).
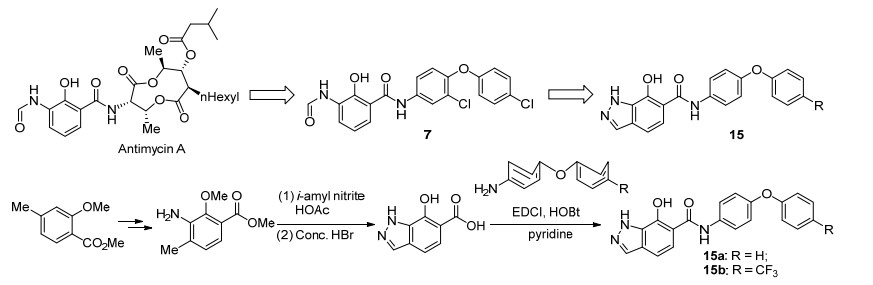
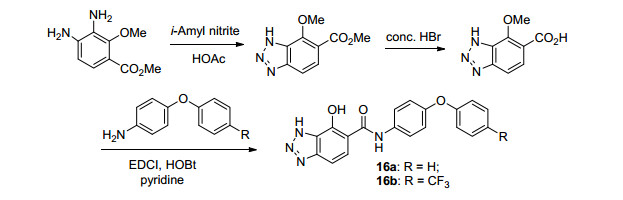
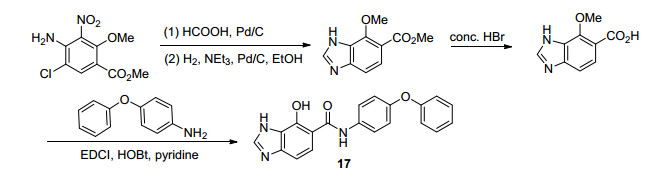
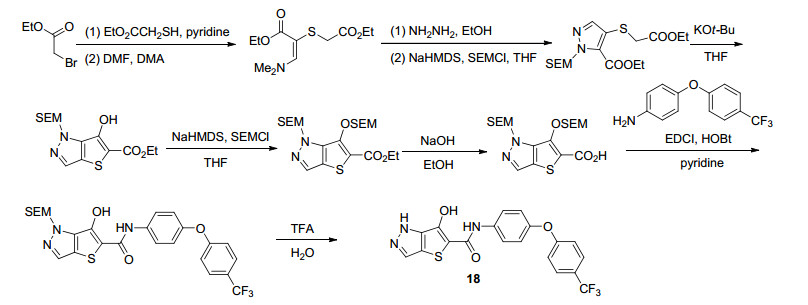
2006年, Clark等[44]利用生物电子等排原理在Antimycine A类似物7的基础上进行了进一步结构改造, 并合成了一系列的Antimycin A衍生物.首先, 他们合成了吲唑类化合物(其设计思路与合成路线如Scheme 4所示), 并进行了的生物活性测试.结果表明:化合物15a和15b对细胞色素bc1复合物和壳针孢叶斑病具有较好的抑制活性, 但与Antimycin A相比仍有一定差距(表 9); 此外, 他们还合成了苯并三唑系列化合物(Scheme 5), 并对其进行了生物活性测试.研究结果表明:化合物16b (I50=5 nmol•L-1)的酶抑制活性有了显著提高, 其活性与Antimycin A (I50=2 nmol•L-1)接近(表 9); 然而, 他们对壳针孢叶斑病并无防效.在上述结果的启发下, 他们还合成了苯并咪唑化合物17 (Scheme 6), 但它的活性基本丧失(表 9).令人欣喜的是, 将上述苯并咪唑片段改造为吡唑并噻吩的尝试较为成功(Scheme 7), 所得化合物18 (I50=20 nmol•L-1)对bc1复合物和壳针孢叶斑病均有一定的抑制活性与(表 9).最后, 他们还以15a为代表性化合物, 确定了其结合位点为细胞色素bc1复合物的Qi位点.
 表 9
Antimycin A衍生物15~18对细胞色素bc1复合物和细胞生长的抑制活性a
Table 9.
Inhibition activities of antimycin A analogues 15~18 against the bc1 complex and cell growth
表 9
Antimycin A衍生物15~18对细胞色素bc1复合物和细胞生长的抑制活性a
Table 9.
Inhibition activities of antimycin A analogues 15~18 against the bc1 complex and cell growth

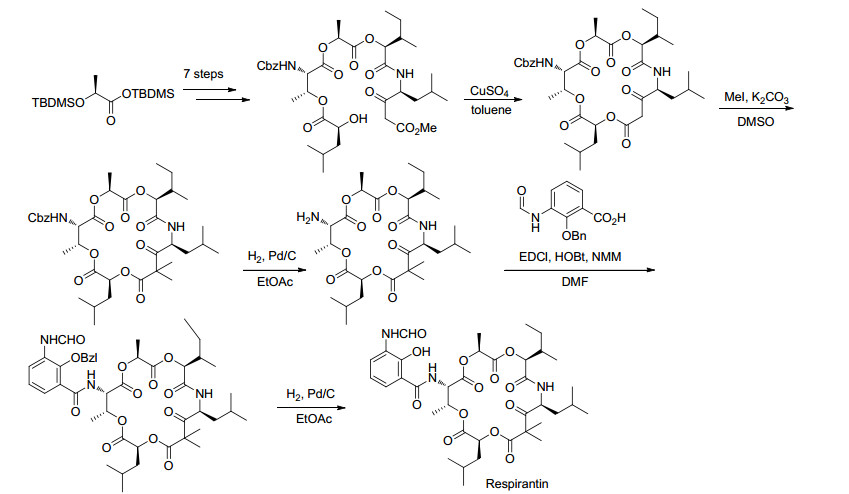
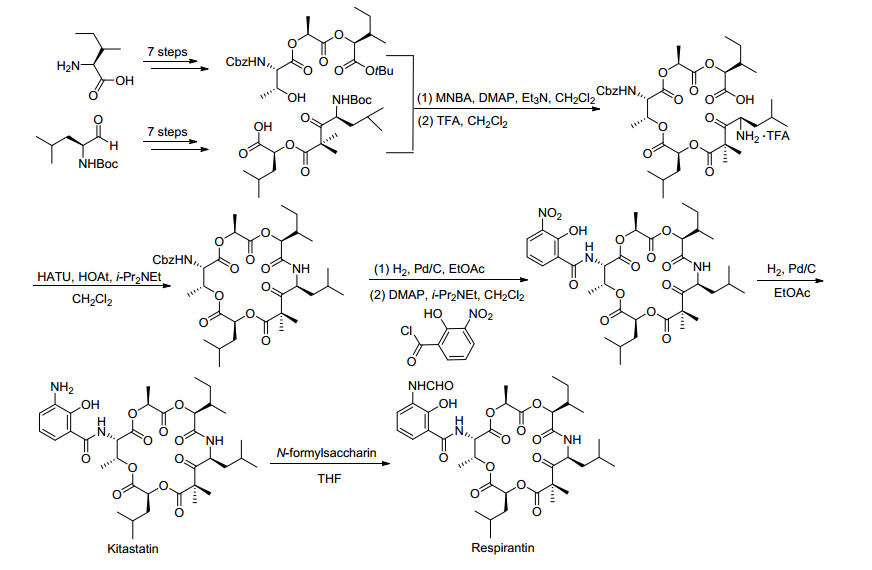
2007年, Pettit小组[45]完成了18元环Antimycin A类似物Respirantin的全合成工作, 合成中最关键的步骤是一个分子间的酯交换反应(Scheme 8).此外, 他们还比较了所合成的Respirantin与其类似物Kitastatin和19的生物活性结果.实验结果表明:这三个化合物对癌细胞生长均有良好的抑制活性(表 10).最后, 他们还发现Respirantin对新型隐球菌(Cryptococcus neoformans)具有一定的抑制活性.
 表 10
Respirantin与其类似物Kitastatin和19的癌细胞生长抑制活性比较a
Table 10.
Comparision of the cancer cell growth inhibition (GI50) of respirantin and its analogues kitastatin and 19
表 10
Respirantin与其类似物Kitastatin和19的癌细胞生长抑制活性比较a
Table 10.
Comparision of the cancer cell growth inhibition (GI50) of respirantin and its analogues kitastatin and 19

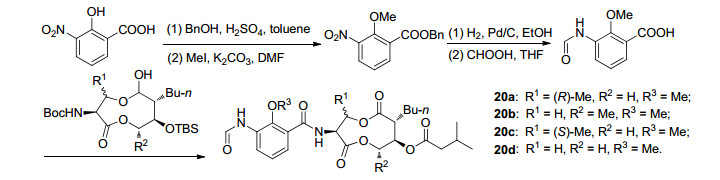
2008年, Han课题组[46]对Antimycin A对左边苯环上的酚羟基进行了结构改造, 共合成了4个全新的Antimycin A类似物20a~20d, 其具体结构和合成路线如Scheme 9所示, 但他们并没有报道其生物活性测试结果.
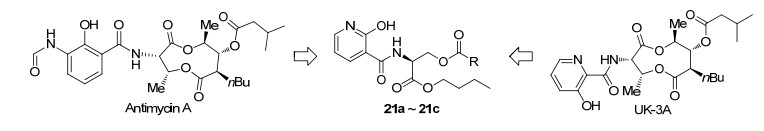
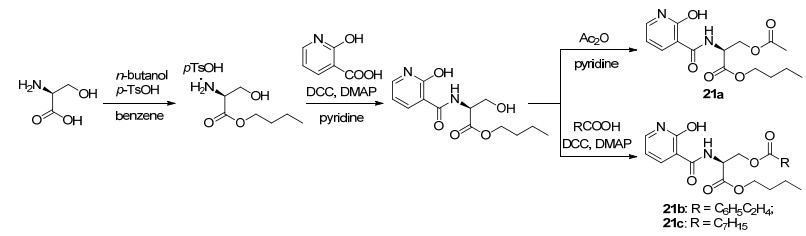
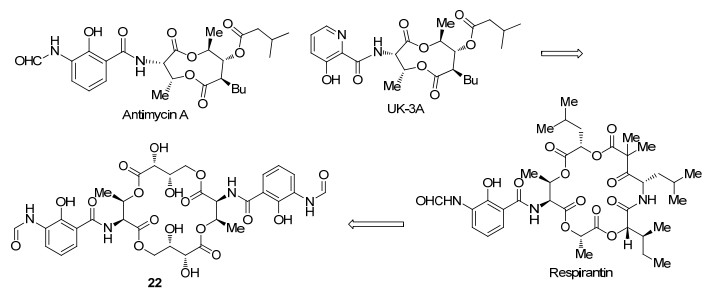
UK-3A是一个含有九元内酯结构的化合物, 具有优良的抗菌活性, 其结构类似于Antimycin A. 2010年, Arsianti等[47]在Antimycin A和UK-3A的基础上合成了一系列2-羟基烟酰-丝氨酸丁基酯衍生物(Scheme 10).在这篇工作中, 作者们通过打开九元内酯体系及改变酯基侧链, 并用廉价易得的2-羟基烟酰酸酯代替3-羟基吡啶甲酸酯对UK-3A进行结构改造, 合成了21a~21c这三个抗霉素类似化合物, 其合成路线如Scheme 11.与UK-3A相比, 所合成的这类酯结构更简单, 且生物活性更高.此外, 他们还测试了这三个化合物对大肠杆菌(E. coli)、枯草芽孢杆菌(B. subtilis)、金黄色葡萄球菌(S. aureus)和白色念珠菌(C. albicans)四种真菌的抑制活性.结果表明:化合物21c对大肠杆菌的活性与Antimycin A相当, 对枯草芽孢杆菌、金黄色葡萄球菌的活性高于Antimycin A (表 11).
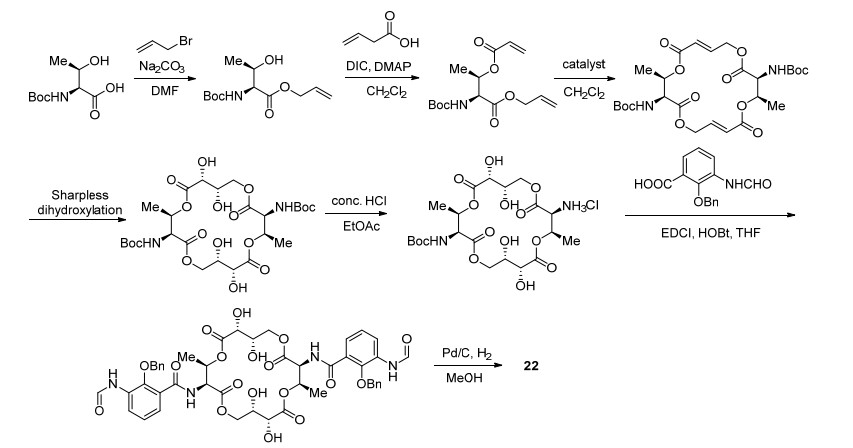
2012年, Arsianti等[48]在原有工作的基础上进行了进一步结构改造, 结合UK-3A、Antimycin A和Respirantin的结构特点合成了Antimycin A类似物22 (Scheme 12), 其合成路线如Scheme 13所示.此外, 他们发现该化合物对癌细胞(尤其是HeLa细胞、乳腺癌MDA-MB-231和前列腺PC-3型细胞)有良好的抑制效果(表 12).
 表 12
Antimycin A与其类似物22的活性比较
Table 12.
Comparision of the biological activities between antimycin A and its analogue 22
表 12
Antimycin A与其类似物22的活性比较
Table 12.
Comparision of the biological activities between antimycin A and its analogue 22

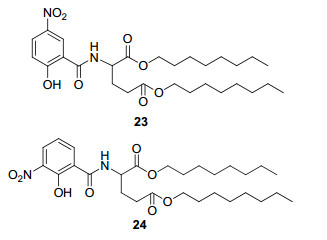
2013年, Shikanai小组[49]共合成了53个抗霉素类似物, 并通过生物活性筛选发现化合物23和24可以有效抑制破裂叶绿体中光合作用光系统Ⅰ (photosystem Ⅰ)周围的循环式电子传递(cyclic electron transfer)(图 2).
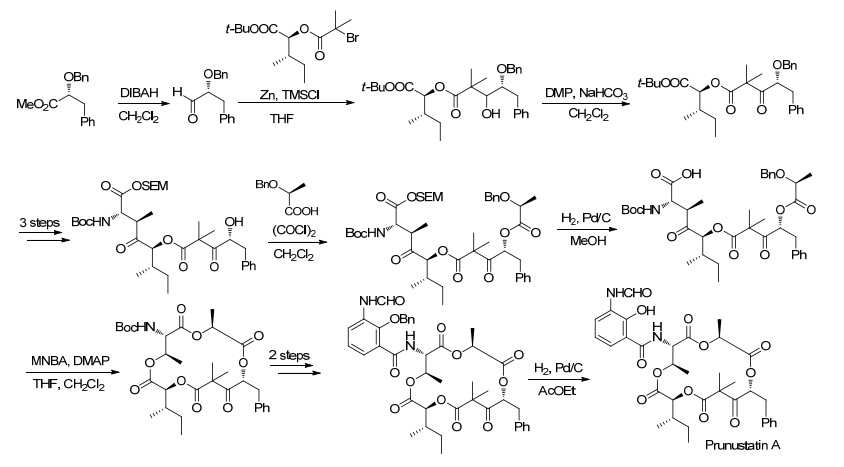
2014年, Kawanishi等[50]首次完成了天然产物Prunustatin A的全合成工作, 而Prunustatin A是一种新颖的、可以有效抑制葡萄糖调节蛋白78 (GRP78) 表达的Antimycine A类似物, 其具体合成路线如Scheme 14所示.这篇全合成的最大特色在于15元环的关环反应, 作者们巧妙利用了Shiina内酯化反应来实现该步反应.
2014年, Batey等[51]完成了上述提及的两种Antimycin A类似物Kitastatin和Respirantin的全合成工作, 其具体合成路线如Scheme 15所示.他们以一种会聚的方式完成了该分子的合成, 主要反应步骤包括MNBA促进的酯化反应、高效C端和N端同时发生的脱保护反应、以及HATU促进的大环内酯化反应.此外, 他们还首次利用异戊烯基三氟硼酸盐来实现羰基的加成反应.
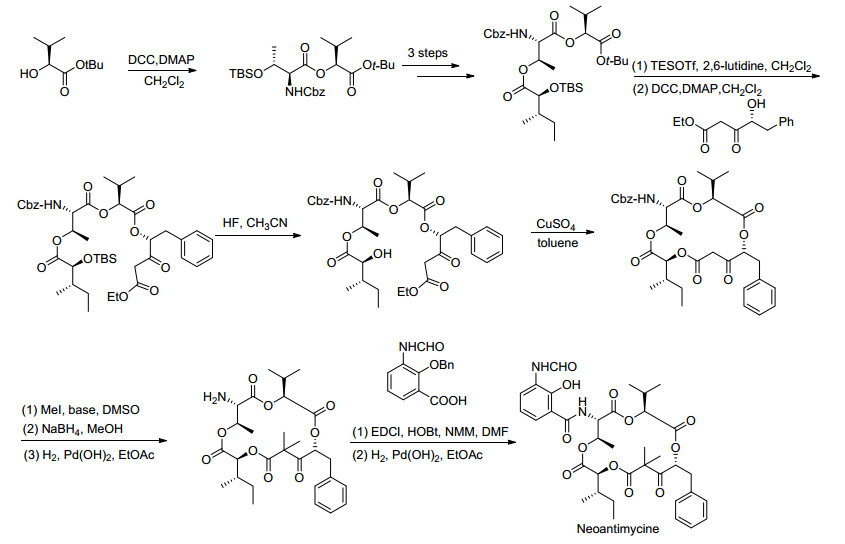
2015年, Usuki等[52]通过分子内的酯交换等步骤首次完成了15元环Neoantimycine的全合成工作, 该化合物是一个极其罕见、含有15元环骨架的Antimycin A类似物, 其具体合成路线如Scheme 16所示.在这条合成路线中, 最关键的步骤是利用分子内的酯交换反应构建15元内酯大环.
3 结论与展望
综上所述, 基于Antimycin A的结构改造主要集中在以下几点: (1) 对甲酰胺基的改造; (2) 对酚羟基的改造; (3) 对苯环结构的改造; (4) 对双内酯大环的改造.各部分结构改造对活性的影响可总结如下: (1) 甲酰胺基的自由旋转是必须的, 同时它的大小也正好适合与细胞色素b相结合.当甲酰基中的氢被位阻更大的基团取代时, 空间位阻效应影响了所得化合物与细胞色素b的结合, 从而导致活性降低.此外, 当甲酰基中的氢被吸电子基团取代时, 所得化合物的活性有所提高; (2) 酚羟基是与细胞色素b相结合所必须的, 同时它的氢原子与侧链酰胺键中的氮原子形成氢键, 对其进行结构改造会破坏分子间的氢键作用,从而导致活性大幅降低. (3) 当左边苯环被改为硝基取代的苯环、吡啶、吲唑、苯并三唑、苯并咪唑等时, 活性与结构的构效关系并不明显. (4) 对双内酯大环进行改造时, 通常疏水性越强, 所得化合物的活性越高.此外, 进行疏水性改造的同时, 与活性腔的匹配对于活性的保持也是至关重要的.
由于显著的生物活性及独特的化学结构, 天然产物Antimycin A自从首次被发现以来一直受到众多生物学家和化学家的广泛关注.然而, Antimycin A对光和热敏感, 且对哺乳动物和鱼的毒性较大, 所以对其结构进行改造从而获得高活性、结构简单且稳定、毒性较小的化合物至关重要.随着它和细胞色素bc1复合物共结晶的晶体结构被报道, 对Antimycin A的结构改造又上了一个新台阶.近年来, 随着对抗霉素生物合成途径及生物合成基因的研究, 从基因水平对抗霉素的结构进行改造获得新的抗霉素类似物成为可能[53], 相信生物合成抗霉素类似物是未来的发展方向之一, 到目前为止, 已有很多Antimycin A类似物被报道, 且部分化合物已经展现出良好的应用前景, 我们相信更多关于Antimycin A的研究成果会纷至沓来.
-
-
[1]
Leben, C.; Keitt, G. W. Phytopathology 1948, 38, 898.
-
[2]
杨永青, 伍贻康, 有机化学, 2006, 26, 1370. doi: 10.3321/j.issn:0253-2786.2006.10.005Yang, Y. Q.; Wu, Y. K. Chin. J. Org. Chem. 2006, 26, 1370. doi: 10.3321/j.issn:0253-2786.2006.10.005
-
[3]
Dunshee, B. R.; Leben, C.; Keitt, G. W. Strong, F. M. J. Am. Chem. Soc. 1949, 71, 2436. doi: 10.1021/ja01175a057
-
[4]
Lockwood, J. L.; Leben, C.; Keitt, G. W. Phytopathology 1954, 44, 438.
-
[5]
Yonehara, H.; Takeuchi, S. J. Antibiot. 1958, 11, 122.
-
[6]
Liu, W. C.; Strong, F. M. J. Am. Chem. Soc. 1959, 81, 4387. doi: 10.1021/ja01525a072
-
[7]
Schilling, G.; Berti, D.; Kluepfel, D. J. Antibiot. 1970, 23, 81. doi: 10.7164/antibiotics.23.81
-
[8]
Barrow, C. J.; Oleynek, J. J.; Marinelli, V.; Sun, H. H.; Kaplita, P.; Sedlock, D. M.; Gillum, A. M.; Chadwick, C. C.; Cooper, R. J. Antibiot. 1997, 50, 729. doi: 10.7164/antibiotics.50.729
-
[9]
Shiomi, K.; Hatae, K.; Hatano, H.; Matsumoto, A.; Takahashi, Y.; Jiang, C. L.; Tomoda, H.; Kobayashi, S.; Tanaka, H.; Ōmura, S. J. Antibiot. 2005, 58, 74. doi: 10.1038/ja.2005.10
-
[10]
Hosotani, N.; Kumagai, K.; Nakagawa, H.; Shimatani, T.; Saji, I. J. Antibiot. 2005, 58, 460. doi: 10.1038/ja.2005.61
-
[11]
Chen, G.; Lin, B.; Lin, Y.; Xie, F.; Lu, W.; Fong, W. F. J. Antibiot. 2005, 58, 519. doi: 10.1038/ja.2005.70
-
[12]
Yan, L. L.; Han, N. N.; Zhang, Y. Q.; Yu, L.Y.; Chen, J.; Wei, Y. Z.; Li, Q. P.; Tao, L.; Zheng, G. H.; Yang, S. E.; Jiang, C. X.; Zhang, X. D.; Huang, Q.; Xugela, H.; Hu, Q. B.; Zhou, L.; Liu, S. W.; Zhang, Z. Z.; He, Q.Y.; Si, S. Y.; Sun, C. H. J. Antibiot. 2010, 63, 259. doi: 10.1038/ja.2010.21
-
[13]
Wang, J. Y.; Wen, Y. M.; Chen, X. M.; Lin, Y. H.; Zhou, J. M.; Xie, Y.; Wang, H. W.; Jiang, H.; Zheng, Wei. J. Chromatogr. 2010, 1217, 5687. doi: 10.1016/j.chroma.2010.07.003
-
[14]
闫蕾蕾, 韩宁宁, 何琪杨, 陈杰, 阳素娥, 刘少伟, 陶玲, 郭琳, 靳婧, 余利岩, 张玉琴, 孙承航, 中国抗生素杂志, 2011, 36, 269.Yan, L. L.; Han, N. N.; He, Q. Y.; Chen, J.; Yang, S. E.; Liu, S. W.; Tao, L.; Guo, L.; Jin, J.; Yu, L. Y.; Zhang, Y. Q.; Sun, C. H. Chin. J. Antibiot. 2011, 36, 269.
-
[15]
Leben, C.; Keitt, G. W. Phytopathology 1948, 38, 898.
-
[16]
谭洪升, 车茜, 李德海, 顾谦群, 朱天骄, 中国抗生素杂志, 2015, 40, 892. doi: 10.3969/j.issn.1001-8689.2015.12.002Tan, H. S.; Che, Q.; Li, D. H.; Gu, Q. Q.; Zhu, T. J. Chin. J. Antibiot. 2015, 40, 892. doi: 10.3969/j.issn.1001-8689.2015.12.002
-
[17]
Xu, L. Y.; Quan, X. S.; Wang, C.; Sheng, H. F.; Zhou, G. X.; Lin, B. R.; Jiang, R. W.; Yao, X. S. J Antibiot. 2011, 64, 661. doi: 10.1038/ja.2011.65
-
[18]
Ishiyama, T.; Endo, T.; Otake, N.; Yonehara, H. J. Antibiot. 1976, 29, 804. doi: 10.7164/antibiotics.29.804
-
[19]
Imamura, N.; Nishijima, M.; Adachi, K.; Sano, H. J. Antibiot. 1993, 46, 241. doi: 10.7164/antibiotics.46.241
-
[20]
Hayashi, K. I.; Nozaki, H. J. Antibiot. 1999, 52, 325. doi: 10.7164/antibiotics.52.325
-
[21]
Yao, C B. F.; Schiebel, M.; Helmke, E.; Anke, H.; Laatsch, H. Z. Naturforsch., B 2006, 61, 320.
-
[22]
Strangman, W. K.; Kwon, H. C.; Broide, D.; Jensen, P. R.; Fenical, W. J. Med. Chem. 2009, 52, 2317. doi: 10.1021/jm801110j
-
[23]
Schilling, G.; Berti, D.; Kluepfel, D. J. Antibiot. 1970, 23, 81. doi: 10.7164/antibiotics.23.81
-
[24]
Rieske, J. S.; Lipton, S. H.; Baum, H.; Silman, H. I. J. Biol. Chem. 1967, 242, 4888.
-
[25]
Wallace, K. B.; Starkov, A. A. Annu. Rev. Pharmacol. Toxicol. 2000, 40, 353. doi: 10.1146/annurev.pharmtox.40.1.353
-
[26]
Zhang, Z. L.; Luang, L.; Shulmeister, V. M.; Chi, Y. I.; Kim, K. K.; Hung, L. W.; Croftsk, A. R.; Berry, E. A.; Kim, S. H. Nature 1998, 392, 677. doi: 10.1038/33612
-
[27]
王广华, 林壁润, 高向阳, 谢双大, 仲恺农业技术学院学报, 2006, 19, 55. doi: 10.3969/j.issn.1674-5663.2006.01.014Wang, G. H.; Lin, B. R.; Gao, X. Y.; Xie, S. D. J. Zhongkai Univ. Agric. Technol. 2006, 19, 55. doi: 10.3969/j.issn.1674-5663.2006.01.014
-
[28]
Tzung, S. P.; Kim, K. M.; Basañez, G.; Giedt, C. D.; Simon, J.; Zimmerberg, J.; Zhang, K. Y. J.; Hockenbery, D. M. Nat. Cell Biol. 2001, 3, 183. doi: 10.1038/35055095
-
[29]
Sun, J.; Trumpower, B. L. Arch. Biochem. Biophys. 2003, 419, 198. doi: 10.1016/j.abb.2003.08.028
-
[30]
Barrow, C. J.; Oleynek, J. J.; Marinelli, V.; Sun, H. H.; Kaplita, P.; Sedlock, D. M.; Gillum, A. M.; Chadwick, C. C.; Cooper, R. J. Antibiot, 1997, 50, 729. doi: 10.7164/antibiotics.50.729
-
[31]
邱小忠, 欧阳钧, 余磊, 张黎声, 陆云涛, 陈瑗, 周玫, 钟世镇, 神经解剖学杂志, 2004, 20, 167. doi: 10.3969/j.issn.1000-7547.2004.02.011Qiu, X. Z.; Ou, Y. J; Yu, L.; Zhang, L. S.; Lu, Y. T.; Chen, Y. A.; Zhou, M.; Zhong, S. Z. Chin. J. Neuroanat. 2004, 20, 167. doi: 10.3969/j.issn.1000-7547.2004.02.011
-
[32]
Yeh, C. T.; Su, C. L.; F. Huang, C. Y. F.; Lin, J. K. Y.; Lee, W. H.; H. Chang, P. M. H.; Kuo, Y. L.; Liu, Y. W.; Wang, L. S.; Wu, C. H.; Shieh, Y. S.; Jan, Y. H.; Chuang, Y. J.; Hsiao, M.; Wu, A. T. H. J. Evidence-Based Complementary Altern. Med. 2013, 2013, 910451.
-
[33]
崔树娜, 钱静, 卜平, 中国药理学与毒理学杂志, 2015, 29, 573. doi: 10.3867/j.issn.1000-3002.2015.04.007Cui, S. N.; Qian, J.; Bo, P. Chin. J. Pharmacol. Toxicol. 2015, 29, 573. doi: 10.3867/j.issn.1000-3002.2015.04.007
-
[34]
Derse, P. H.; Strong, F. M. Nature 1963, 200, 600.
-
[35]
Huang, L. S.; Cobessi, D.; Tung, E. Y.; Berry, E. A. J. Mol. Biol. 2005, 351, 573. doi: 10.1016/j.jmb.2005.05.053
-
[36]
Dickie, J. P.; Loomans, M. E.; Farley, T. M.; Strong, F. M. J. Med. Chem. 1963, 6, 424. doi: 10.1021/jm00340a018
-
[37]
Okumura, F. S.; Masumura, M.; Horie, T. J. Am. Chem. Soc.1959, 81, 5215. doi: 10.1021/ja01528a048
-
[38]
Selwood, D. L.; Livingstone, D. J.; Comley, J. C. W.; O'Dowd, A. B.; Hudson, A. T.; Jackson, P.; Jandu, K. S.; Rose, V. S. Stables, J. N. J. Med. Chem. 1990, 33, 136. doi: 10.1021/jm00163a023
-
[39]
Hayes, D. J.; O'Dowd, A. B.; Selwood, D. L.; Stables, J. N.; Comley, J. C. W.; Rees, M. J. Mol. Biochem. Parasitol. 1990, 38, 159. doi: 10.1016/0166-6851(90)90019-I
-
[40]
Tokutake, N.; Miyoshi, H.; Nakazato, H.; Iwamura, H. Biochim. Biophys. Acta 1993, 1142, 262. doi: 10.1016/0005-2728(93)90154-8
-
[41]
Miyoshi, H.; Tokutake, N.; Imaeda, Y.; Akagi, T.; Iwamura, H. Biochim. Biophys. Acta 1995, 1229, 149. doi: 10.1016/0005-2728(94)00185-8
-
[42]
Shenin, Y. D.; Belakhov, V. V.; Rozhkova, N. G. Khim. Farm. Zh. 1996, 30, 31.
-
[43]
Fitzpatrick, G. M.; Orth, A. B.; Maurice, C. H.; Richard, B. R.; Werk, T. L.; Davis, G. E. US. 6333432, 2001[Chem. Abstr. 2001, 136, 53582].
-
[44]
Bolgunas, S.; Clark, D. A.; Hanna, W. S.; Mauvais, P. A.; Pember, S. O. J. Med. Chem. 2006, 49, 4762. doi: 10.1021/jm060408s
-
[45]
Pettit, G. R.; Smith, T. H., Feng, S., Knight, J. C.; Tan, R.; Pettit, R. K. Hinrichs P. A. J. Nat. Prod. 2007, 70, 1073. doi: 10.1021/np0680735
-
[46]
Hu, Z. L.; Jiang, X. J.; Han, W. Tetrahedron Lett. 2008, 49, 5192~5195. doi: 10.1016/j.tetlet.2008.06.050
-
[47]
Arsianti, A.; Hanafi, M.; Saepudin, E.; Morimoto, T.; Kakiuchi, K. Bioorg. Med. Chem. Lett. 2010, 20, 4018. doi: 10.1016/j.bmcl.2010.05.104
-
[48]
Arsianti, A.; Tanimoto, H.; Morimoto, T.; Bahtiar, A.; Takeya, T.; Kakiuchi, K. Tetrahedron 2012, 68, 2884. doi: 10.1016/j.tet.2012.01.080
-
[49]
Taira, Y.; Okegawa, Y.; Sugimoto, K.; Abe, M.; Miyoshi, H.; Shikanai, T. FEBS Open Biol. 2013, 3, 406. doi: 10.1016/j.fob.2013.09.007
-
[50]
Yamakoshi, S.; Kawanishi, E. Tetrahedron Lett. 2014, 55, 1175. doi: 10.1016/j.tetlet.2013.12.106
-
[51]
Beveridge, R. E.; Batey, R. A. Org. Lett. 2014, 16, 2322. doi: 10.1021/ol500484f
-
[52]
Ogawa, H.; Iio, H.; Usuki, Y. Chem. Lett. 2015, 44, 1214. doi: 10.1246/cl.150509
-
[53]
Liu, J.; Zhu, X. J.; Kim, S. J.; Zhang, W. J. Nat. Prod. Rep. 2016, 33, 1146. doi: 10.1039/C6NP00004E
-
[1]
-
表 1 Antimycin A系列化合物的发现
Table 1. Discovery of antimycin A

表 2 Antimycin A系列化合物的结构
Table 2. The structures of antimycin A

表 3 Antimycin A类似物4a~4g的合成路线及活性测试
Table 3. Synthetic route and biological activities of antimycin A analogues 4a~4g

表 4 Antimycin A类似物5a~5g的合成路线及生物活性结果
Table 4. Synthetic routes and biological evaluation of antimycin A analogues 5a~5g

表 5 化合物BWA728C (6a)和BWA466C (6b)的结构与生物活性
Table 5. Structures and activities of BWA728C (6a) and BWA466C (6b)

表 6 Antimycin类似物7的合成路线及活性结果
Table 6. Synthetic route and biological activities of antimycin A analogue 7

表 7 化合物8a和8b与Antimycin A的活性比较
Table 7. Inhibitory activity of antimycin A and the synthetic analogues 8a and 8b against the bc1 complex

表 8 化合物14的生物活性
Table 8. Biological activities of compound 14

表 9 Antimycin A衍生物15~18对细胞色素bc1复合物和细胞生长的抑制活性a
Table 9. Inhibition activities of antimycin A analogues 15~18 against the bc1 complex and cell growth

表 10 Respirantin与其类似物Kitastatin和19的癌细胞生长抑制活性比较a
Table 10. Comparision of the cancer cell growth inhibition (GI50) of respirantin and its analogues kitastatin and 19

表 11 化合物21a~21c的抗菌活性
Table 11. Antibiotic activities of 21a~21c

表 12 Antimycin A与其类似物22的活性比较
Table 12. Comparision of the biological activities between antimycin A and its analogue 22

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 37
- 文章访问数: 4139
- HTML全文浏览量: 1099


 下载:
下载:

















 下载:
下载:

