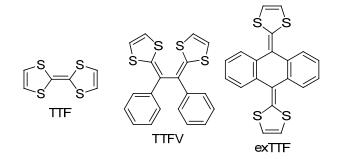
 图 1
典型TTF衍生物结构
Figure 1.
Typical structures of TTF derivatives
图 1
典型TTF衍生物结构
Figure 1.
Typical structures of TTF derivatives

Citation: Zhao Bangtun, Tao Jingjing, Chen Xiaoji, Zhu Weimin. Progress on Synthesis and Application of Triazole-Based Tetrathiafulvalene Derivatives[J]. Chinese Journal of Organic Chemistry, 2017, 37(8): 1964-1977. doi: 10.6023/cjoc201702002

四硫富瓦烯三氮唑衍生物的合成及应用研究进展
English
Progress on Synthesis and Application of Triazole-Based Tetrathiafulvalene Derivatives
-
Key words:
- click reaction
- / triazole
- / tetrathiafulvalene
- / photoelectric functional material
-
四硫富瓦烯(Tetrathiafulvalene, 简称TTF)是一种稳定可逆的两电子给体, 控制适当的电位, TTF可以以中性分子, 自由基阳离子和二价阳离子三种形式存在[1~3].为改善TTF的供电子能力和拓展应用研究, 众多π扩展TTF衍生物被设计合成, 其不仅可以导致稳定的氧化态和聚阳离子体形成, 而且可使分子的HOMO和LUMO轨道能隙更小, 供电子能力更强[4, 5], 同时通过增加π…π和S…S作用的数量来提高其维度.在π扩展TTF衍生物中, 较常见的是插烯类、苯并类、炔烃类和苯醌类等, 而基于乙烯基(Tetrathiafulvalene vinylogue, 简称TTFV)的TTF衍生物[6]和基于蒽醌基扩展的TTF衍生物(extended Tetrathiafulvalene, 简称exTTF)最为引人关注(图 1)[7].设计合成的四硫富瓦烯类化合物(TTFs)在分子识别、分子开关, 分子导线、分子梭、传感器、光诱导或离子诱导电子转移, 以及导电LB膜、有机铁磁体、非线性光学、有机导电和有机光伏材料等研究方面取得了引人瞩目的成就[8~11].三氮唑基具有芳香性, 可以扩展分子的共轭区域, 也可以起作为桥基来链接功能基团, 三氮唑衍生物在过渡金属催化、化学生物学和材料合成等领域发挥了重要作用[12], 因此, 开展四硫富瓦烯三氮唑衍生物的合成和应用研究具有重要意义.
自Sharpless[13]和Meldal[14]发现点击化学[15~19](Click chemistry)以来, 由于其反应对氧气、水不敏感, 产物选择性好, 产率较高, 反应处理及产物分离简单方便的特点, 引起了广泛的研究兴趣.点击化学反应主要包括环加成反应、亲核开环反应、非醇醛的羰基化合物缩合反应和碳碳多键的加成反应等, 其中研究最为广泛的是Cu(Ⅰ)催化的端基炔和端基叠氮的Huisgen[20]1, 3-偶极环加成反应(简称CuAAC反应).利用CuAAC反应可以得到立体专一的1, 4-取代三氮唑衍生物(Eq. 1), 并广泛应用于生物耦合[21]、药物设计[22]、高分子合成[23]、超分子[24]和材料化学[25]等领域.
近年来, 由于CuAAC反应的条件普适性强, 利用点击化学合成含有三氮唑基的四硫富瓦烯衍生物取得了重要进展, 并成为四硫富瓦烯化学的研究热点之一.通常CuAAC反应合成TTFs衍生物有三类反应:第一类是利用含端基炔的TTF化合物与含端基叠氮基的底物反应; 第二类是利用含端基叠氮基的TTF化合物与含端基炔的底物反应; 第三类是利用CuAAC反应, 合成含有TTF单元的超分子功能器件.本文简要综述利用CuAAC反应合成四硫富瓦烯三氮唑衍生物及其功能应用的研究进展.
1 含端基炔的四硫富瓦烯与对应的含端基叠氮基的底物反应
1.1 基于传统TTF的点击反应
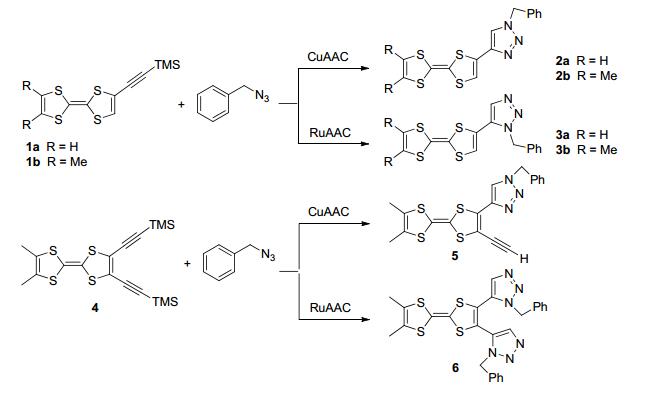
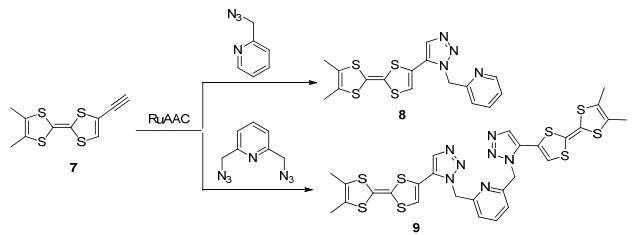
2012年, Avarvari等[26]利用CuAAC和RuAAC两种催化剂将含三甲基硅烷(TMS)保护基的端基炔TTF衍生物1和苄基叠氮点击合成1, 4-和1, 5-取代的1, 2, 3-三氮唑TTF衍生物2和3 (Scheme 1).循环伏安法实验表明, 异构体化合物2和3都是良好的电子供体化合物, 但它们供电子行为差异较大.化合物2的第一和第二半波电位均小于化合物3的相应电位, 差值均在0.1 V附近.紫外光谱实验表明, 在分子内存在从TTF单元向三氮唑单元的电子转移过程.密度泛函理论(DFT)计算结果也反映了异构体2和3的给电子能力和电子转移行为的差异性. 2014年, 该课题组利用RuAAC反应将双三甲基硅烷(TMS)保护基的端基炔TTF衍生物4和苄基叠氮点击合成TTF衍生物5和6 (Scheme 1).晶体X射线分析表明, 晶体6的结构与3b的结构差异性大, 主要归因于6中两个三氮唑基团的空间位阻作用.紫外可见光谱实验表明, 化合物6存在分子内电荷转移行为[27], 质子化6的紫外光谱红移更明显.为考察功能取代基的影响, 同年, 该课题组利用RuAAC点击反应合成了含吡啶功能基的TTF衍生物8和9 (Scheme 2)[28].晶体结构表明化合物9呈钳子型结构, 两个TTF单元平行排列.循环伏安法实验表明化合物9的第一个氧化峰裂分, 主要是由于分子中两个TTF单元能通过空间发生相互作用, 使得两个TTF单元第一氧化电位不同, 说明化合物9在溶液中仍保持钳子型分子结构.
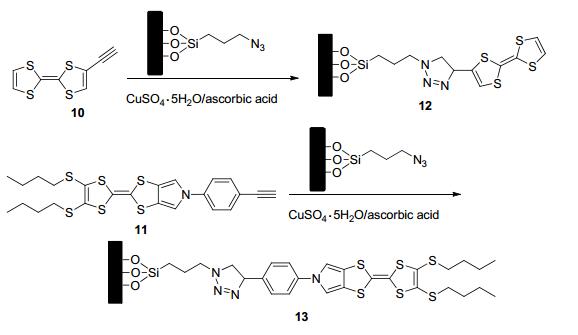
2014年, Salinas等[29]将含叠氮端基的负载有双吡啶钌[Ru(bipy)3]2+染料的硅烷化材料和含端基炔基的TTF衍生物10和11利用CuAAC反应制备出新型的门控介孔材料12和13 (Scheme 3), 利用TTF的供电子性质, 其可以与含硝基芳香类炸药如三硝基苯甲硝胺(Tetryl)、三硝基甲苯(TNT)、三硝基苯(TNB)形成电荷转移复合物.实验表明此门控介孔材料可以作为硝基芳香类炸药的荧光检测探针而广泛应用.
1.2 基于TTFV的点击反应
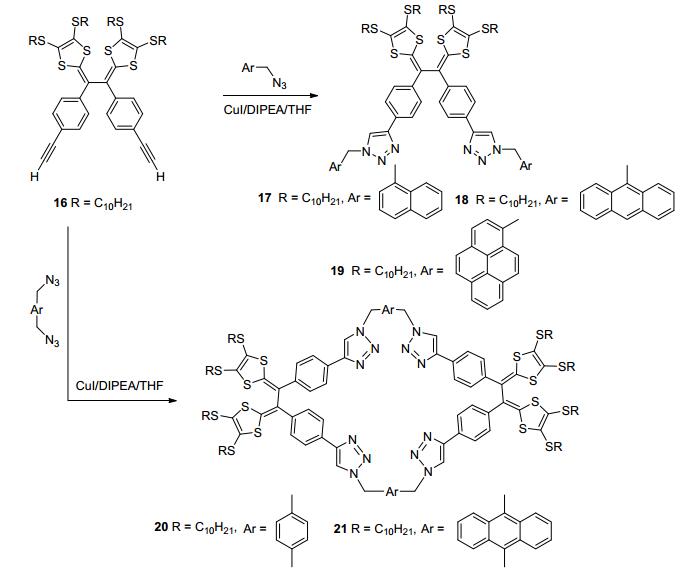
开发基于TTF的荧光传感器是超分子化学中的一个热门课题[30, 31]. 2012年, Zhao等[32]利用CuI催化剂将含端基炔的乙烯基TTFV衍生物14和9-叠氮甲基蒽反应, 点击合成新型TTFV衍生物15 (Eq. 2), 其中央TTFV核心作为电子供体, 两个蒽基团作为荧光单元, 两个三氮唑环既为电子供体和荧光单元的连接基, 又为键合金属离子的受体单元.荧光和紫外光谱实验表明, TTFV 15可作为Cu2+、Fe2+和Cd2+光谱探针, 是首例基于TTFV的光谱离子传感器, 其检测限达到微摩尔浓度级水平, 有望在环境修复、生物学研究和工业分析等领域广泛应用. 2013年, 该课题组利用同样的方法合成了基于TTFV的含稠环芳烃和大环的TTF系列衍生物17~21 (Scheme 4), 并通过紫外和荧光光谱详细研究了它们分别与富勒烯C60和C70的超分子相互作用行为, 结果表明分子钳式的TTFV衍生物17和大环结构20与富勒烯作用很弱, 而化合物18, 19和21与富勒烯作用较强, 并可以用来分离富勒烯C60和C70[33].
生物传感器一直是生物分子检测器研究热点之一[34].糖类分子传感器通常包含糖分子受体和信号输出以及二者之间的链接基三个单元.苯硼酸单元作为糖类高效分子受体可以在水相中与二元醇、多元醇等形成苯硼酸酯.信号输出单元通常是利用有机发色团、荧光基团和电化学活性基团等光电活性基团.链接基通常要满足识别和信号表达效能以及合成可能性等要求.因此, 基于苯硼酸基的糖类分子传感器有比色[35]、荧光[36]和电化学[37]等各种类型.
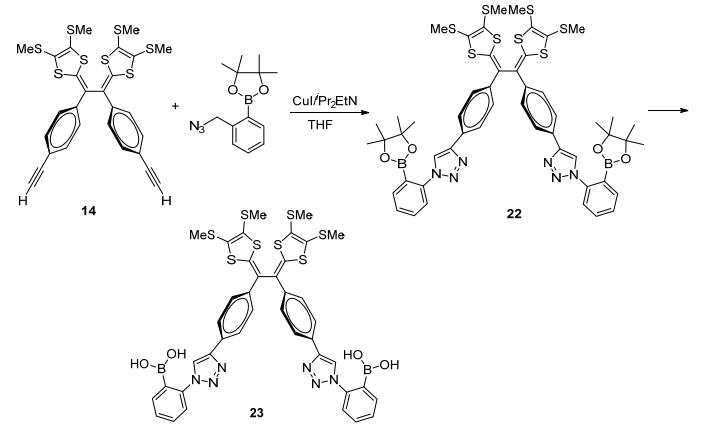
2014年, Zhao等[38]将含端基炔的乙烯基TTFV衍生物14和邻叠氮甲基苯硼酸酯利用CuI催化剂, 点击合成TTFV衍生物22, 其经水解得到新型基于TTFV的硼酸化合物23 (Scheme 5).电化学(CV和DPV)实验表明, 在磷酸盐缓冲(pH=7.41) 的DMSO-H2O溶液中, 化合物23可以和不同单糖显示选择性电化学反应, 可作为潜在应用的糖类传感器.同时化合物22可以选择性电化学识别F-离子.
1.3 基于exTTF的点击反应
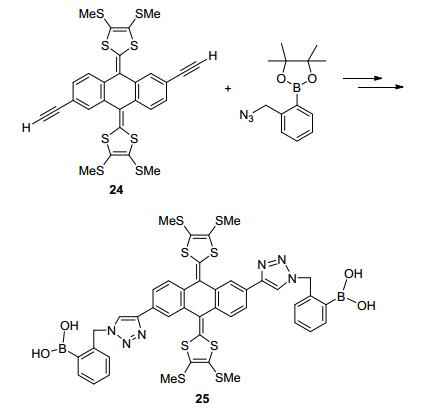
2010年, Zhao等[39]将含双端基炔的蒽醌基exTTF衍生物24和邻叠氮甲基苯硼酸酯利用CuI催化剂, 点击合成exTTFV衍生物25 (Scheme 6).电化学(DPV)实验表明, 在磷酸盐缓冲(pH=8.75) 的DMSO-H2O溶液中, 化合物25可以与果糖和核糖选择性电化学识别反应, 这是首例基于exTTF的糖类分子传感器.由于化合物25在水溶液中的溶解度和溶液粘度等限制了其定量应用范围, 因此, 修饰开发新型的基于TTF的糖类分子传感器是一个重要方向.
2 含端基叠氮基的四硫富瓦烯与对应的含端基炔的底物反应
2.1 基于传统TTF的点击反应
苝二酰亚胺(PDI)由于其高荧光量子产率和光热化学耐持久性可以作为有机太阳能电池和人工光合作用领域的研究与开发. 2009年, Nielsen等[40]以CuSO4· 5H2O-抗坏血酸为催化剂, 将端基叠氮化TTF衍生物26与端基炔的PDI衍生物反应, 点击合成含有TTF电子给体和PDI电子接受体的二联体化合物27 (Eq. 3).原子力显微(AFM)实验表明, 化合物TTF-PDI二联体27在云母表面组装形成纳米线.
基于氧化还原开关的TTF离子传感器研究已经受到广泛关注.喹啉化合物能够键合金属离子, 并且自身具有荧光性质, 将其与TTF单元结合, 有望开发具有光电信号检测的离子传感器. 2012年, Zhao等[41]利用CuI催化剂, 将含端基叠氮的TTF衍生物28与8-炔丙基取代的喹啉化合物反应, 点击合成了含三氮唑基和喹啉基的TTF衍生物29 (Eq. 4).循环伏安法实验表明, 化合物29对Zn2+离子有一定的响应能力.荧光滴定光谱和核磁滴定实验表明, Zn2+和Cd2+离子能够使化合物29的荧光显著增强, 具有高度的选择性和识别能力.实验表明TTF 29可以作为电化学和荧光双重检测Zn2+离子的传感器, 同时还可作为Cd2+离子的荧光探针.二茂铁(Fc)能够经历可逆的单电子氧化还原过程, 也是一种良好的电化学活性单元, 将TTF单元与Fc单元通过带有键合位点的基团连接起来, 有望开发新型的具有双重电化学识别信号的离子传感器. 2013年, Zhao等[42]将含端基叠氮基的TTF衍生物28和30分别与乙炔基二茂铁在CuI催化条件下发生点击反应, 合成了含三氮唑基和二茂铁基的TTF衍生物31和32 (Eq. 5).循环伏安法实验表明化合物31呈现三个可逆的氧化还原峰, 分别对应于TTF和Fc单元的氧化还原峰, 化合物32则只表现出两个可逆的氧化还原峰, 第一个氧化峰还原峰归结于Fc单元氧化峰还原峰和TTF单元的第一个氧化峰还原峰的重叠, 第二个氧化峰还原峰归结为TTF单元的第二个氧化峰还原峰.循环伏安法实验表明, 当分别加入3摩尔当量Zn2+、Cd2+、Cu2+、Pb2+、Ag+离子的高氯酸盐, 化合物31的氧化还原电位几乎没有变化, 而化合物32对Zn2+或Cd2+离子有电化学响应, 第一氧化峰电位分别正移了53和42 mV, 第二氧化峰电位分别正移了59和39 mV, 表明Zn2+和Cd2+离子对32有很强的键合能力, 这由于化合物32中的N原子和O原子能够与Zn2+或Cd2+配位, 增强32中三氮唑基的吸电子能力, 从而使TTF和Fc单元的电子云密度降低, 更难被氧化, 因此氧化峰电位正移.
基于蒽醌和TTF以及三氮唑的独特化学行为, Zhao等[43]利用以CuSO4·5H2O-抗坏血酸钠(VcNa)为催化剂, 将含端基叠氮基TTF衍生物26与1, 8-二端基炔修饰蒽醌反应, 点击合成了1, 8-二羟基蒽醌-四硫富瓦烯衍生物33 (Eq. 6).荧光滴定光谱实验表明化合物32对Al3+离子有很好的识别能力, 有望作为Al3+离子的荧光传感器.紫外滴定光谱实验表明, Sc3+、Al3+和Pb2+离子能够有效促进化合物33和四氯对苯醌之间的分子间电子转移.
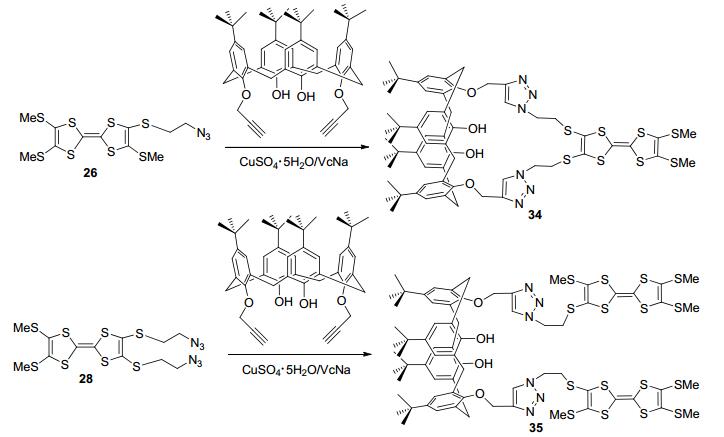
杯芳烃作为第三代超分子主体化合物得到了广泛的研究和应用, 其中CuAAC点击反应在杯芳烃衍生的合成及其分子识别方面获得了广泛的关注[44]. 2013年, Zhao等[45]首次利用CuSO4·5H2O-抗坏血酸钠(VcNa)催化剂, 将含叠氮端基TTF衍生物26和28分别与下缘含端基炔的杯芳烃发生点击反应得到三氮唑基连接的杯芳烃-四硫富瓦烯二联体34和35 (Scheme 7).循环伏安法实验表明, 34和35均显示可逆两电子氧化还原行为.同时, 紫外光谱实验研究了金属离子如Pb2+、Sc3+、Zn2+诱导的34和35分别与四氯对苯醌分子间的电子转移行为, 结果表明不同的金属离子对电子转移的影响不同.对于同一金属离子, 化合物35的电子转移能力大于34, 表明配位作用、构象和分子柔韧性等对分子间电子转移行为有重要影响, 这对于开发基于TTF超分子的分子间电子转移体系具有重要意义.
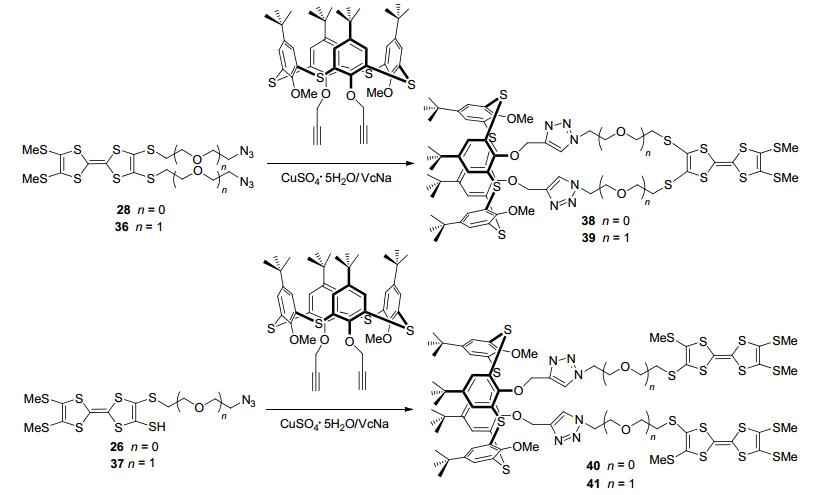
2015年, Zhao等[46]利用CuSO4·5H2O-抗坏血酸钠(VcNa)催化剂, 通过CuAAC点击反应将含叠氮端基的TTF衍生物(26、28、36、37)和含端基炔的硫桥杯芳烃(TCA)合成得到TTF-TCA二联体化合物38~41 (Scheme 8).通过紫外光谱实验探讨在非氧化性金属离子存在下, TTF-TCA二联体38、39、40和41分别与四氯对苯醌的分子间电子转移行为, 结果表明Sc3+促进电子转移行为最为有效.在同一金属离子存在下, 化合物41和40比化合物39和38表现出更高效的电子转移行为.
3 基于TTF点击反应构筑分子器件
随着超分子化学的发展, 具有特殊拓扑结构的分子构造体如索烃、轮烷、准轮烷等引起了化学家浓厚兴趣.通过以分子构造体为基本元件研制的分子内存芯片、分子阀等分子器件, 使得在超分子层次上完成信息和能量的转换、传输、存储等功能变为现实[47].拥有“箱型”空穴和刚性的缺π电子联吡啶基团的对二甲苯基4, 4-联吡啶环蕃(CBPQT)可以与富π电子芳香类化合物形成电子转移复合物.近年来, 以环蕃CBPQT为模板来构筑分子轮烷已经取得重要成果, 尤其是与富π电子TTF体系的分子器件研究最为关注[48~52].
2007年, Stoddart等[53]基于“先穿后封”的模板导向合成策略, 利用含端基叠氮并拥有萘基的TTF衍生物42作为电子供体与对二甲苯基桥联的联吡啶环番(CBPQT)电子接受体形成电子授受体准轮烷, 然后再与含端基炔封端基底物发生CuAAC点击反应, 合成构筑分子轮烷43 (Eq. 7).循环伏安法和紫外光谱实验表明, 中性状态轮烷43中TTF与CBPQT单元之间存在分子内电荷转移, 而当TTF被氧化处于二价阳离子状态时, CBPQT与萘单元之间形成电子授受体, 实验表明CBPQT单元的移动是可逆进行, 三氮唑单元的存在并不影响氧化还原反应可控开关过程的动力学和热力学行为.同年, Stoddart等[54]基于该原理, 利用TTF衍生物42和拥有醚链连接疏水基的端基炔底物发生CuAAC点击反应, 得到双稳态分子轮烷44 (Eq. 8).轮烷44中轮烷和两端介晶封端基共同促使构筑具有层状液晶状态, 进而组装成更加复杂并且在较宽的温度范围内(室温~150 ℃)可以保持的碟状近晶相, 光谱电化学实验表明, 双稳态分子轮烷44可作为电化学调控的液晶材料.
2008年, Stoddart等[55]基于模板导向合成策略, 利用含叠氮端基的三角型TTF衍生物45与电子受体CBPQT形成准轮烷, 然后与含端基炔的封端基底物发生CuAAC点击反应制得双稳定的三脚架型分子轮烷46 (Eq. 9).光谱电化学实验表明, 与类似的双稳定分子轮烷不同, 三脚架型分子轮烷46中稳定存在TTF自由基阳离子二聚体, 对于开发基于TTF的分子轮烷具有重要指导意义.同年, Stoddart等[56]将一端含醚链连接封端基, 另一端含醚链连接叠氮端基的TTF衍生物47与α环糊精混合, 然后利用CuAAC点击反应与含端基炔的封端基底物反应, 得到了基于α环糊精的TTF氧化还原型轮烷48 (Eq. 10).诱导圆二色谱(ICD)实验和1H NOESY实验表明, 轮烷48中TTF单元被α环糊精的疏水空腔包裹.紫外光谱实验也表明轮烷48中TTF的吸收峰由于α环糊精的包裹而发生吸收强度下降且显著红移.循环伏安实验表明由于包裹作用TTF的第一氧化电位明显增大, 而第二氧化电位几乎不变, 表明控制电位α环糊精可以在轮烷中移动. 1H NOESY实验进一步表明电化学可以调控供α环糊精在TTF单元和三氮唑单元之间移动, 这对于构筑电化学调控的纳米药物传输分子体系和器件具有重要指导作用.分子动态模拟(MD)计算表明, 基于环糊精的带电荷分子轮烷中分子梭运动的驱动力是水分子与轮烷组成部分的作用[57].
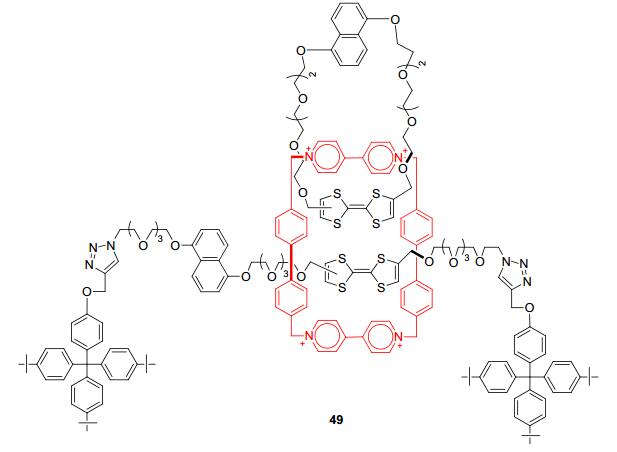
2011年, Stoddart等[58]设计构筑了更为复杂的含TTF单元和对二甲联苯基桥联的联吡啶环番的机械互联锁结构49(图 2).实验表明49诱导氧化后, 存在平移和旋转运动, 该研究对实现完成从简单分子开关的转变到多态变换的复杂分子机器构筑以及提高分子器件的信息存储具有重大意义.
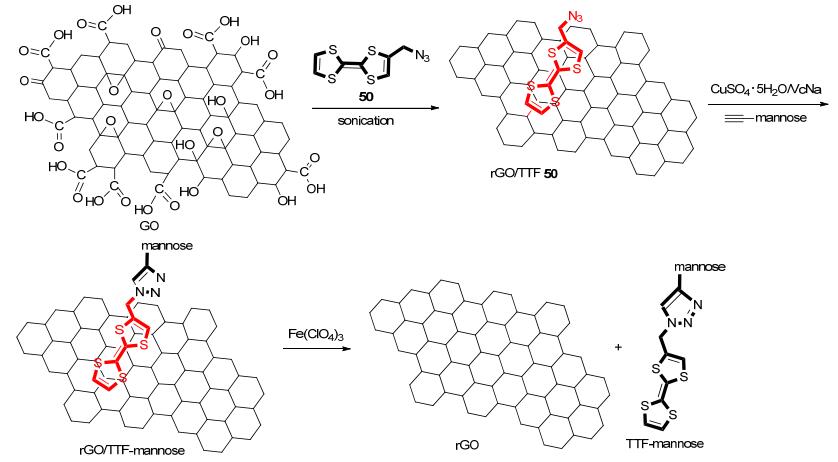
石墨烯具有二维碳六角晶格结构, 其显著的大比表面积和电、热、机械性能引起了在新型复合材料、生物传感和催化剂领域的研究兴趣. 2012年, Szunerits等[59]首先将含叠氮端基TTF衍生物50和氧化石墨烯(GO)超声溶解, 利用TTF的供电子性质将氧化石墨烯(GO)还原来构筑基于石墨烯的纳米杂化材料.然后利用CuAAC点击反应将其作为基质与含端基炔的甘露糖反应得到含糖的石墨烯材料(Scheme 9).通过Fe(ClO4)3氧化作用可以控制糖从该石墨烯基质材料中解离, 这对于开发新型基于石墨烯的纳米生物界面材料具有重要意义.
2016年, Emrick等[60]利用CuAAC点击反应, 将含有端基炔的TTF衍生物51与含有端基叠氮基的聚合物反应得到含有电化学活性TTF单元(摩尔分数约为35%)的聚合物52 (Eq. 11), 并研究了其与层状基面的MoS2的作用行为.结果表明含有TTF单元的聚合物的电化学行为与单体TTF不同, 聚合物中TTF与MoS2的作用促进形成TTF自由基二聚体, 进而扩大了聚合物表面键合和静电作用行为, 对于开发利用层状MoS2器件具有重要意义.
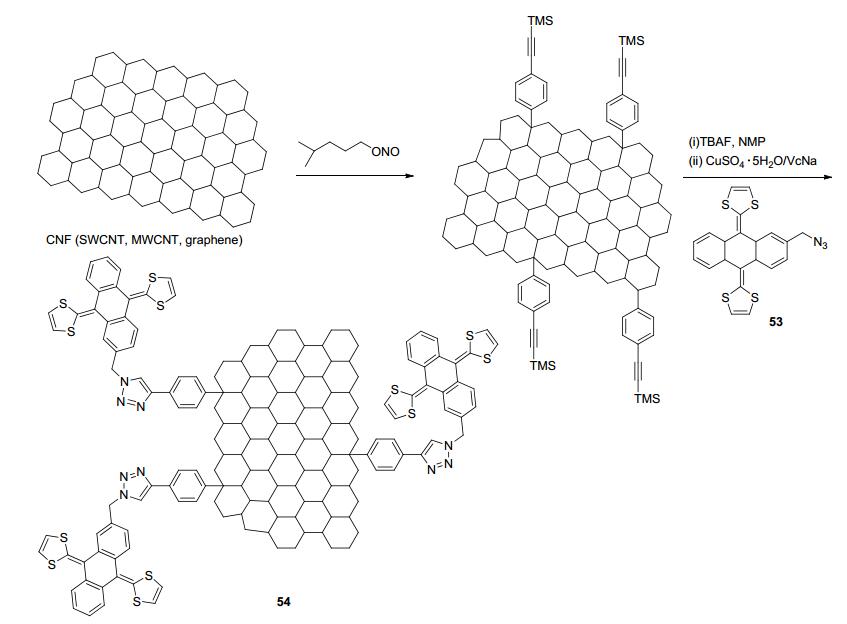
纳米科学和纳米技术的发展加快了富勒烯、碳纳米管、石墨烯等碳纳米材料的开发与利用. 2015年, Martín等[61]利用自由基诱导碳纳米材料(CNF), 如单壁碳纳米管(SWCNT)、多壁碳纳米管(MWCNT)和石墨烯(G)等发生自由基加成反应得到含端基炔的纳米碳底物, 其再与含端基叠氮基的exTTF衍生物53通过CuAAC点击反应得到含有电化学活性单元的相应碳纳米功能(CNF)材料54 (Scheme 10).电化学实验表明exTTF单元的呈现双电子准可逆氧化还原过程.光激发实验表明单壁碳纳米管(SWCNT) 54可以形成电荷分离状态, 对于开发新型光电材料具有重要意义.
4 总结与展望
点击化学是化学合成方法的重要里程碑, 其中CuAAC反应因具有原料易得、条件温和、产物立体选择性好和产率较高等优势而获得广泛应用.研究表明四硫富瓦烯(TTF)是优良的π电子供体, 其对CuAAC反应的条件是适合的, 利用含端基炔的TTF化合物与含端基叠氮基的底物反应或利用含端基叠氮基的TTF化合物与含端基炔的底物反应可制备众多的含1, 2, 3-三氮唑功能基的TTF衍生物, 在识别传感、表面修饰、纳米材料、太阳能电池材料和超分子功能器件等领域展现广泛的应用前景.可以期望随着研究的深入, CuAAC点击反应在TTF化学领域的研究更趋向于功能化和多学科化, 对于拓展TTF的研究和应用具有重要意义.
-
-
[1]
Segura, J. L.; Martin, N. Angew. Chem., Int. Ed. 2001, 40, 1372. doi: 10.1002/(ISSN)1521-3773
-
[2]
Canevet, D.; Sallé, M.; Zhang, G. X.; Zhang, D. Q.; Zhu, D. B. Chem. Commun. 2009, 45, 2245. http://europepmc.org/abstract/med/19377656
-
[3]
Pop, F.; Avarvari, N. Chem. Commun. 2016, 52, 7906. doi: 10.1039/C6CC01827K
-
[4]
Bendikov, M.; Wudl, F.; Perepichka, D. F. Chem. Rev. 2004, 104, 4891. doi: 10.1021/cr030666m
-
[5]
Zhu, Y. L.; Cao, L.; Ma, K. R.; Tian, L. B.; Wang, X. L.; Su, Z. M. Chem. J. Chin. Univ. 2013, 34, 952.
-
[6]
Bouzan, S.; Chen, G.; Mulla, K.; Dawe, L.N.; Zhao, Y. M. Org. Biomol. Chem. 2012, 10, 7673. doi: 10.1039/c2ob26275d
-
[7]
Brunetti, F. G.; López, J. L.; Atienza, C.; Martín, N. J. Mater. Chem. 2012, 22, 4188. doi: 10.1039/c2jm15710a
-
[8]
Yamada, J.; Sugimoto, T. TTF Chemistry Fundamentals and Applications of Tetrathiafulvalene, Kodansha and Springer, Tokyo, 2004.
-
[9]
Feng, M.; Gao, L.; Deng, Z. T.; Ji, W.; Guo, X. F.; Du, S. X.; Shi, D. X.; Zhang, D. Q.; Zhu, D. B.; Gao, H. J. J. Am. Chem. Soc. 2007, 129, 2204. doi: 10.1021/ja067037p
-
[10]
陈铁, 刘武军, 丛志奇, 尹炳柱, 有机化学, 2005, 25, 570. doi: 10.3321/j.issn:0253-2786.2005.05.014Chen, T.; Liu, W. J.; Cong, Z. Q.; Yin, B. Z. Chin. J. Org. Chem. 2005, 25, 570(in Chinese). doi: 10.3321/j.issn:0253-2786.2005.05.014
-
[11]
朱玉兰, 杨艳杰, 尹起范, 朱道本, 有机化学, 2005, 25, 1167. doi: 10.3321/j.issn:0253-2786.2005.10.002Zhu, Y. L.; Yang, Y. J.; Yin, Q. F.; Zhu, D. B. Chin. J. Org. Chem. 2005, 25, 1167(in Chinese). doi: 10.3321/j.issn:0253-2786.2005.10.002
-
[12]
霍景沛, 韦新平, 莫广珍, 彭湃, 钟铭丽, 陈任宏, 汪朝阳, 有机化学, 2014, 34, 92. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract343558.shtmlHuo, J. P.; Wei, X. P.; Mo, G. Z.; Peng, P.; Zhong, M. L.; Chen, R. H.; Wang, Z. Y. Chin. J. Org. Chem. 2014, 34, 92(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract343558.shtml
-
[13]
Rostovtsev, V. V.; Green, L. G.; Fokin, V. V.; Sharpless, K. B. Angew. Chem., Int. Ed. 2002, 41, 2596. doi: 10.1002/(ISSN)1521-3773
-
[14]
Tornøe, C. W.; Christensen, C.; Meldal, M. J. Org. Chem. 2002, 67, 3057. doi: 10.1021/jo011148j
-
[15]
Kolb, H. C.; Finn, M. G.; Sharpless, K. B. Angew. Chem., Int. Ed. 2001, 40, 2004. doi: 10.1002/(ISSN)1521-3773
-
[16]
Moses, J. E.; Moorhouse, A. D. Chem. Soc. Rev. 2007, 36, 1249. doi: 10.1039/B613014N
-
[17]
Wu, P.; Fokin, V. V. Aldrichim. Acta 2007, 40, 7.
-
[18]
Dondoni, A. Chem. Asian J. 2007, 2, 700. doi: 10.1002/(ISSN)1861-471X
-
[19]
Meldal, M.; Tornøe, C. W. Chem. Rev. 2008, 108, 2952. doi: 10.1021/cr0783479
-
[20]
Huisgen, R.; Szeimies, G.; Mobius, L. Chem. Ber. 1967, 100, 2494. doi: 10.1002/(ISSN)1099-0682
-
[21]
Lutz, J. F. Angew. Chem., Int. Ed. 2007, 46, 1018. doi: 10.1002/(ISSN)1521-3773
-
[22]
Angell, Y. L.; Burgess, K. Chem. Soc. Rev. 2007, 36, 1674. doi: 10.1039/b701444a
-
[23]
Sumerlin, B. S.; Vogt, A. P. Macromolecules 2010, 43, 1. doi: 10.1021/ma901447e
-
[24]
Hahn, U.; Elhabiri, M.; Trabolsi, A.; Herschbach, H.; Leize, E.; Dorsselaer, A. V.; Albrecht-Gary, A. M.; Nierengarten, J. F. Angew. Chem., Int. Ed. 2005, 44, 5338. doi: 10.1002/(ISSN)1521-3773
-
[25]
Fournier, D.; Hoogenboom, R.; Schubert, U. S. Chem. Soc. Rev. 2007, 36, 1369. doi: 10.1039/b700809k
-
[26]
Biet, T.; Cauchy, T.; Avarvari, N. Chem. Eur. J. 2012, 18, 16097. doi: 10.1002/chem.v18.50
-
[27]
Biet, T.; Avarvari, N. Org. Biomol. Chem. 2014, 12, 3167. doi: 10.1039/c4ob00148f
-
[28]
Biet, T.; Avarvari, N. CrystEngComm 2014, 16, 6612. doi: 10.1039/c4ce00736k
-
[29]
Salinas, Y.; Solano, M. V.; Sørensen, R. E.; Larsen, K. R.; Lycoops, J.; Jeppesen, J. O.; Martinez-Manez, R.; Sancenon, F.; Marcos, M. D.; Amorós, P.; Guillem. C. Chem.-Eur. J. 2014, 20, 855. doi: 10.1002/chem.v20.3
-
[30]
Zhou, Y. C.; Zhang, D. Q.; Zhu, L. Y.; Shuai, Z. G.; Zhu, D. B. J. Org. Chem. 2006, 71, 2123. doi: 10.1021/jo052579v
-
[31]
Li, X. H.; Zhang, G. X.; Ma, H. M.; Zhang, D. Q.; Li, J.; Zhu, D. B. J. Am. Chem. Soc. 2004, 126, 11543. doi: 10.1021/ja0481530
-
[32]
Mulla, K.; Dongare, P.; Thompson, D. W.; Zhao, Y. M. Org. Biomol. Chem. 2012, 10, 2542. doi: 10.1039/c2ob06828a
-
[33]
Mulla, K.; Dongare, P.; Thompson, D. W.; Zhao, Y. M. Org. Lett. 2013, 17, 4532.
-
[34]
Jelinek, R.; Kolusheva, S. Chem. Rev. 2004, 104, 5987. doi: 10.1021/cr0300284
-
[35]
Edwards, N. Y.; Sager, T. W.; McDevitt, J. T.; Anslyn, E. V. J. Am. Chem. Soc. 2007, 129, 13575. doi: 10.1021/ja073939u
-
[36]
Tan, W.; Zhang, D.; Wang, Z.; Liu, C.; Zhu, D. J. Mater. Chem. 2007, 17, 1964. doi: 10.1039/b618183j
-
[37]
Shoji, E.; Freund, M. S. J. Am. Chem. Soc. 2002, 124, 12486. doi: 10.1021/ja0267371
-
[38]
Mulla, K.; Zhao, Y. M. Tetrahedron Lett. 2014, 55, 382. doi: 10.1016/j.tetlet.2013.11.036
-
[39]
Shao, M.; Zhao, Y. M. Tetrahedron Lett. 2010, 51, 2508. doi: 10.1016/j.tetlet.2010.02.171
-
[40]
Qvortrup, K.; Petersen, M. A.; Hassenkam, T.; Nielsen, M. B. Tetrahedron Lett. 2009, 50, 5613. doi: 10.1016/j.tetlet.2009.07.108
-
[41]
Zhao, B. T.; Liu, L. W.; Li, X. C.; Qu, G. R. Chin. J. Chem. 2012, 30, 254. doi: 10.1002/cjoc.v30.2
-
[42]
Zhao, B. T.; Liu, L. W.; Li, X. C.; Qu, G. R.; Belhadj, E.; Le Derf, F.; Sallé, M. Tetrahedron Lett. 2013, 54, 23. doi: 10.1016/j.tetlet.2012.10.107
-
[43]
Zhao, B. T.; Cao, S. N.; Guo, H. M.; Qu, G. R. Synth. Met. 2013, 174, 14. doi: 10.1016/j.synthmet.2013.04.012
-
[44]
刘连委, 郭文博, 李晓川, 渠桂荣, 赵邦屯, 有机化学, 2010, 30, 1960. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract339495.shtmlLiu, L. W.; Guo, W. B.; Li, X. C.; Qv, G. R.; Zhao, B. T. Chin. J. Org. Chem. 2010, 30, 1960(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract339495.shtml
-
[45]
Zhao, B. T.; Zhu, X. M.; Chen, X. H.; Yan, Z. N. Chin. Chem. Lett. 2013, 24, 573. doi: 10.1016/j.cclet.2013.04.026
-
[46]
Zhao, B. T.; Peng, Q. M.; Zhu, X. M.; Yan, Z. N.; Zhu, W. M. J. Org. Chem. 2015, 80, 1052. doi: 10.1021/jo502390z
-
[47]
Xue, M.; Yang, Y.; Chi, X. D.; Yan, X. Z.; Huang, F. H. Chem. Rev. 2015, 115, 7398. doi: 10.1021/cr5005869
-
[48]
Spruell, J. M.; Paxton, W. F.; Olsen, J. C.; Benítez, D.; Tkatchouk, E.; Stern, C. L.; Trabolsi, A.; Friedman, D. C.; Goddard, W. A.; Stoddart, J. F. J. Am. Chem. Soc. 2009, 131, 11571. doi: 10.1021/ja904104c
-
[49]
Fahrenbach, A. C.; Hartlieb, K. J.; Sue, C. H.; Bruns, C. J.; Barin, G.; Basu, S.; Olson, M. A.; Botros, Y. Y.; Bagabas, A.; Khdaryad, N. H.; Stoddart, J. F. Chem. Commun. 2012, 48, 9141. doi: 10.1039/c2cc34427k
-
[50]
Andersen, S. S.; Share, A. I.; Poulsen, B. C.; Kørner, M.; Duedal, T.; Benson, C. R.; Hansen, S. W.; Jeppesen, J. O.; Flood, A. H. J. Am. Chem. Soc. 2014, 136, 6373. doi: 10.1021/ja5013596
-
[51]
Baggerman, J.; Haraszkiewicz, N.; Wiering, P. G.; Fioravanti, G.; Marcaccio, M.; Paolucci, F.; Kay, E. R.; Leigh, D. A.; Brouwer, A. M. Chem.-Eur. J. 2013, 19, 5566. doi: 10.1002/chem.v19.18
-
[52]
Avellini, T.; Li, H.; Coskun, A.; Barin, G.; Trabolsi, A.; Basuray, A. N.; Dey, S. K.; Credi, A.; Silvi, S.; Stoddart, J. F.; Venturi, M. Angew. Chem., Int. Ed. 2012, 51, 1611. doi: 10.1002/anie.v51.7
-
[53]
Aprahamian, I.; Dichtel, W. R.; Ikeda, T.; Heath, J. R.; Stoddart, J. F. Org. Lett. 2007, 7, 1287. http://europepmc.org/abstract/med/17326646
-
[54]
Aprahamian, I.; Yasuda, T.; Ikeda, T.; Saha, S.; Dichtel, W. R.; Isoda, K.; Kato, T.; Stoddart, J. F. Angew. Chem., Int. Ed. 2007, 46, 4675. doi: 10.1002/(ISSN)1521-3773
-
[55]
Aprahamian, I.; Olsen, J. C.; Trabolsi, A.; Stoddart, J. F. Chem.-Eur. J. 2008, 14, 3889. doi: 10.1002/chem.v14:13
-
[56]
Zhao, Y. L.; Dichtel, W. R.; Trabolsi, A.; Saha, S.; Aprahamian, I.; Stoddart, J. F. J. Am. Chem. Soc. 2008, 130, 11294. doi: 10.1021/ja8036146
-
[57]
Zhang, Q.; Tu, Y, Q.; Tian, H.; Zhao, Y. L.; Stoddart, J. F.; Ågren, H. J. Phys. Chem. B 2010, 114, 6561. doi: 10.1021/jp102834k
-
[58]
Barin, G.; Coskun, A.; Friedman, D. C.; Mark, A.; Olson, D.; Michael, T.; Colvin, R.; Sanjeev, K.; Dey, M. A.; Altan, B.; Michael, R.; Wasielewski, G.; Stoddart, J. F. Chem.-Eur. J. 2011, 17, 213. doi: 10.1002/chem.201002152
-
[59]
Kaminska, I.; Barras, A.; Coffinier, Y.; Lisowski, W.; Roy, S.; Niedziolka-Jonsson, J.; Woisel, P.; Lyskawa, J.; Opallo, M.; Siriwardena, A.; Boukherroub, R.; Szunerits, S. ACS Appl. Mater. Interf. 2012, 4, 5386. doi: 10.1021/am3013196
-
[60]
Selhorst, R. C.; Puodziukynaite, E.; Dewey, J. A.; Wang, P. J.; Barnes, M. D.; Ramasubramaniam, A.; Emrick, T. Chem. Sci. 2016, 7, 4698. doi: 10.1039/C6SC00305B
-
[61]
Mateos-Gil, J.; Rodríguez-Pérez, L.; Guldi, D. M.; Herranz, M. A.; Martín, N. Nanoscale 2015, 7, 1193. doi: 10.1039/C4NR04365K
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 2710
- HTML全文浏览量: 1134


 下载:
下载:











 下载:
下载:

