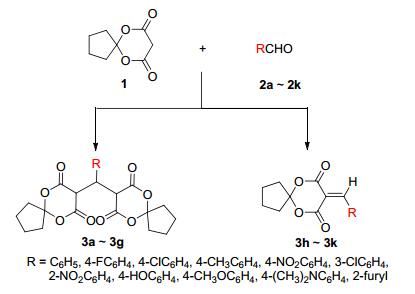
 图式1
化合物3a~3g和3h~3k的合成
Scheme1.
Synthesis of 3a~3g and 3h~3k
图式1
化合物3a~3g和3h~3k的合成
Scheme1.
Synthesis of 3a~3g and 3h~3k

Citation: Zhang Wenfeng, Xu Zhaohui, Tu Yuanhong, Liao Chuanwen. Synthesis of 5, 5-(Phenylmethylene)bis(2, 2-butylidene-1, 3-dioxane-4, 6-dione) Derivatives without Catalyst in Water[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2449-2453. doi: 10.6023/cjoc201701046

无催化剂、水相合成5, 5-(苯基亚甲基)双(2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮)衍生物
English
Synthesis of 5, 5-(Phenylmethylene)bis(2, 2-butylidene-1, 3-dioxane-4, 6-dione) Derivatives without Catalyst in Water
-
Key words:
- aromatic aldehydes
- / tandem reaction
- / synthesis in water
- / catalyst-free
-
5, 5-(苯基亚甲基)双(2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮)及衍生物因其结构的可修饰性和优良的络氨酸酶抑制性能[1], 在有机化学和医药领域已有广泛的应用.它们是合成三咪唑并嘧啶酮衍生物[2~4]、3, 4-二氢-3-甲基-2-喹唑啉酮[5]及14-乙烯基-3, 3, 11, 11-四甲基-7-苯基四氧杂螺[5.15.2]十五烷-1, 5, 9, 13-四酮[6]等杂环化合物的重要中间体.因此, 对该类化合物的研究与开发成为有机化学和药学领域的一个研究热点. 5, 5-(苯基亚甲基)双(2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮)的合成主要有: (1) 有机胺[7, 8]或无机碱[9, 10]催化法, 这些方法存在产品收率较低、反应时间长、后处理复杂等不足; (2) 无催化剂条件下极性溶剂中合成. Hedge等[11]报道了无催化剂条件下在N, N-二甲基甲酰胺(DMF)或二甲基亚砜(DMSO)溶剂中合成5, 5-(苯基亚甲基)双(2, 2-二甲基二恶烷-4, 6-二酮), 该工艺后处理复杂, 溶剂不易回收.因此发展绿色、简便和高效合成的新方法显得极为迫切.
以消除环境污染、提高反应效率和原子经济性、降低能耗为研究目的的绿色化学, 是当前化学重点发展方向之一[12].水是一种价廉﹑安全﹑无污染的绿色溶剂, 它完全克服了大多数有机溶剂带来的易燃﹑易爆﹑易挥发﹑容易污染环境的缺点, 水相中的有机合成已成为有机化学研究的热点.以水为反应介质进行的还原[13]、氧化[14]、取代[15]、加成[16]、缩合[17]、偶联[18]等反应都获得了较好的反应效果.基于此, 笔者发展了以水为反应介质, 通过芳香醛和2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮发生Knoevenagel缩合与Michael加成的串联反应合成5, 5-(苯基亚甲基)双(2, 2-亚丁基二噁烷-4, 6-二酮)衍生物的简单、有效的方法.合成路线见Scheme 1.
1 结果与讨论
1.1 反应条件的优化
以苯甲醛和2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮为模型反应, 探索了无催化剂条件下无溶剂、不同溶剂、溶剂用量、反应时间和反应温度对反应的影响, 实验结果见表 1.从表 1可以看出, 在无溶剂条件或常见有机溶剂如二氯甲烷、甲苯中检测到化合物3a较少(表 1, Entries 1~3).溶剂的极性对反应有一定的影响, 此反应在DMSO非质子极性溶剂中的收率有显著提高(表 1, Entries 5~6), 但在极性质子溶剂中反应效果更好, 而以水为反应介质效果最佳, 收率达到83%(表 1, Entries 7~11).接着考察了纯水用量对反应的影响, 当纯水用量为5.0 mL时效果最优.反应温度和反应时间对产物收率影响的结果表明, 最佳反应温度为室温, 最佳反应时间为6.0 h.综上所述, 优化的反应条件是:在无催化剂条件下, 以纯水为反应介质, 纯水用量5.0 mL, 反应原料苯甲醛与2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮的物质的量之比为1:2, 反应温度为室温, 最佳反应时间为6.0 h.
Entry Solvent (mL) Catalyst Time/h Temperature/℃ Yield c /% 1 None None 10 r.t. 36 2 1, 2-Dichloroethane (5.0) None 10 r.t. 42 3 Toluene (5.0) None 10 r.t. 44 4 CH3COOCH2CH3 (5.0) None 8 r.t. 60 5 DMSO (5.0) None 8 r.t. 65 6 CH3CH2OH (5.0) None 6 r.t. 70 7 Ethylene glycol (5.0) None 6 r.t. 66 8 Glycerol (5.0) None 6 r.t. 61 9 H2O (5.0) None 6 r.t. 81 10 H2O (5.0) None 6 40 78 11 H2O(5.0) None 8 r.t. 81 12 CH3CH2OH/H2O (V: V=1:1) b None 6 r.t. 80 a Reaction conditions: benzaldhyde (1 mmol), 2, 2-butylidene-1, 3-dioxane-4, 6-dione (2 mmol), solvent (5.0 mL); baqueous solution of ethanol/ethanol (2.5 mL) and water (2.5 mL); c isolated yield. 产物3a 的结构经1H NMR、13C NMR分析确证.核磁共振氢谱中, 在δ 1.77~1.84、1.77~1.84、1.86~1.93出现两个亚丁基的吸收峰, 在δ 4.60~4.68出现CHbenzylic和2CHMeldrum's acid的多重峰, 在δ 7.29 (d, J=7.2 Hz, 1H)、7. 34 (t, J=7.2 Hz, 2H)、7.55 (d, J=7.2 Hz, 2H)出现芳氢的吸收峰; 核磁共振碳谱分析也与其结构相吻合; ESI-MS也证明了429.2 [M+H]+的存在.
1.2 不同反应底物的普适性
在上述优化反应条件下, 对该反应体系的底物普适性进行了考察(表 2).从表 2可看出不同取代的芳香醛参与反应均可顺利进行, 并以63%~83%较高收率得到相应的目标产物.但反应底物的电子效应对反应结果有显著的影响, 带吸电子基的芳香醛反应速度快于带供电子基的芳香醛, 对于带有强供电基团如4-甲氧基苯甲醛或4-N, N-二甲氨基苯甲醛仅能发生Knoevenagel缩合反应.
Entry Product R Time/h Yieldb /% 1 3a C6H5 6.0 81 2 3b 4-FC6H4 5.0 72 3 3c 4-ClC6H4 6.0 78 4 3d 4-CH3C6H4 8.0 63 5 3e 4-O2NC6H4 5.0 74 6 3f 3-ClC6H4 6.0 83 7 3g 2-O2NC6H4 4.0 76 8 3hc 4-HOC6H4 5.0 88 9 3ic 4-CH3OC6H4 5.0 68 10 3jc 4-(CH3) 2NC6H4 5.0 73 11 3kc 2-Furyl 6.0 80 aReaction conditions: aromatic aldhydes (1 mmol), 2, 2-butylidene-1, 3-dioxane-4, 6-diones (2 mmol), water (5 mL), r.t.; bisolated yield; cobserved Knoevenagel reaction product. 1.3 反应机理探讨
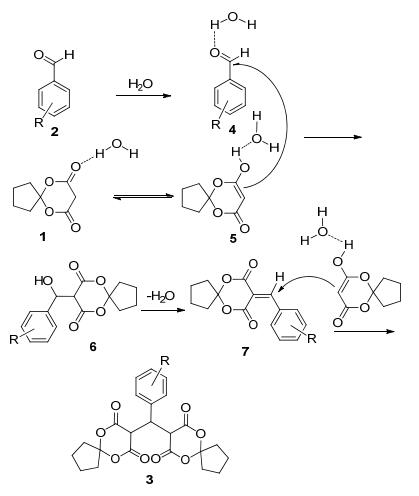
我们认为反应可能的机理如Scheme 2所示.纯水通过与2, 2-二甲基-1, 3-二噁烷-4, 6-二酮形成氢键, 增强了2, 2-二甲基-1, 3-二噁烷-4, 6-二酮的互变异构体亚甲基碳的亲核性(5), 而芳香醛与水形成氢键, 使醛羰基更易受亲核试剂的进攻, 发生Knoevenagel缩合反应生成中间体7, 带吸电子基的芳香醛有利于增强中间体7苄基碳的正电性, 再与2, 2-二甲基-1, 3-二噁烷-4, 6-二酮的互变异构体5发生Michael加成反应得目标产物3.而带有强供电基团如4-甲氧基苯甲醛或4-N, N-二甲氨基苯甲醛不能进一步发生Michael加成反应, 仅能得到Knoevenagel缩合反应产物.
2 结论
无外加催化剂条件下, 以纯水为反应介质, 以不同醛与2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮发生Knoevenagel缩合与Michael加成的串联反应, 有效合成了5, 5-(苯基亚甲基)双(2, 2-亚丁基二噁烷-4, 6-二酮)衍生物, 并确定了较好的反应条件:当反应原料芳香醛与2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮的物质的量之比为1:2, 纯水用量为5.0 mL时, 室温反应4.0~8.0 h, 产品收率为63%~83%.该反应具有反应温和、操作简单、环境友好等优点.
3 实验部分
3.1 仪器与试剂
2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮按文献[19]制备; 苯甲醛、4-甲基苯甲醛、4-氯苯甲醛、4-氟苯甲醛、3-氯苯甲醛、4-硝基苯甲醛、2-硝基苯甲醛及4-甲氧基苯甲醛(西陇化工股份有限公司, 分析纯); 其它试剂均为化学纯, 天津市永大化学试剂有限公司生产.
瑞士BuchiB-540型显微熔点仪(温度计未经校正); 德国Bruker 400 MHz型核磁共振仪(CDCl3为溶剂, TMS为内标); MS谱由ABI公司API3200三重四级杆质谱仪记录.
3.2 化合物3a~3k的合成
在20 mL试管中加入芳香醛1 mmol、2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮2 mmol和纯水5.0 mL, 于室温磁力搅拌反应4.0~8.0 h, 反应完毕, 过滤, 滤饼用10 mL蒸馏水洗涤2次, 得粗产品, 再用无水乙醇重结晶、干燥得目标化合物3a~3i.
5, 5-(苯基亚甲基)双(2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮)[20](3a):白色固体, m.p. 156~158 ℃ (lit.[20] 157~159 ℃); 1H NMR (400 MHz, CDCl3) δ: 1.77~1.84 (m, 4H), 1.86~1.91 (m, 4H), 2.16~2.30 (m, 8H), 4.59~4.69 (m, 3H), 7.29 (d, J=7.2 Hz, 1H), 7.34 (t, J=7.2, 7.6 Hz, 2H), 7.55 (d, J=7.6 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 22.60, 24.44, 38.16, 39.12, 39.15, 50.47, 114.48, 127.89, 128.57, 128.99, 140.63, 164.50, 165.87; ESI-MS m/z: 429. 2 [M+H]+.
5, 5-(4-氟苯基亚甲基)双(2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮)(3b):白色固体, m.p. 141~143 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.78~1.85 (m, 4H), 1.87~1.94 (m, 4H), 2.17~2.31 (m, 8H), 4.56~4.71 (m, 3H), 6.99~7.04 (m, 2H), 7.53~7.55 (m, 2H); 13C NMR (400 MHz, CDCl3) δ: 22.59, 24.46, 38.15, 38.51, 39.14, 50.49, 114.56, 115.66, 115.87, 130.53, 130.60, 136.14, 164.47, 165.71; HRMS (ESI) calcd for C23H24O8F [M+H]+ 447.1455, found 447.1447.
5, 5-(4-氯苯基亚甲基)双(2, 2-亚丁基-1, 3-噁烷-4, 6-二酮)(3c):白色固体, m.p. 143~145 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.78~1.85 (m, 4H), 1.87~1.94 (m, 4H), 2.16~2.30 (m, 8H), 4.54~4.70 (m, 3H), 7.30 (d, J=8.4 Hz, 2H), 7.50 (d, J=8.4 Hz, 2H); 13C NMR (400 MHz, CDCl3) δ: 22.58, 24.47, 38.15, 38.65, 39.12, 50.33, 114.60, 129.07, 130.23, 133.84, 138.84, 164.42, 165.64; HRMS (ESI) calcd for C23H24O8Cl [M+H]+ 463.1160, found 463.1168.
5, 5-(4-甲基苯基亚甲基)双(2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮)(3d):白色固体, m.p. 136~138 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.76~1.85 (m, 4H), 1.87~1.92 (m, 4H), 2.15~2.30 (m, 8H), 2.32 (s, 3H), 4.55~4.68 (m, 3H), 7.14 (d, J=8.0 Hz, 2H), 7.43 (d, J=8.0 Hz, 2H); 13C NMR (400 MHz, CDCl3) δ: 21.05, 22.59, 24.43, 38.14, 38.73, 39.14, 50.56, 114.42, 128.46, 129.62, 134.13, 137.59, 164.56, 165.90; HRMS (ESI) calcd for C24H27O8 [M+H]+ 443.1706, found 443.1798.
5, 5-(4-硝基苯基亚甲基)双(2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮)(3e):白色固体, m.p. 134~135 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.80~1.87 (m, 4H), 1.89~1.96 (m, 4H), 2.18~2.32 (m, 8H), 4.66~4.79 (m, 3H), 7.77 (d, J=8.8 Hz, 2H), 8.17 (d, J=8.8 Hz, 2H); 13C NMR (400 MHz, CDCl3) δ: 22.57, 24.49, 38.16, 39.08, 39.14, 49.92, 114.85, 123.99, 130.07, 147.37, 147.41, 164.31, 165.35; HRMS (ESI) calcd for C23H24NO10 [M+H]+ 474.1400, found 474.1406.
5, 5-(3-氯苯基亚甲基)双(2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮)(3f):白色固体, m.p. 144~146 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.79~1.86 (m, 4H), 1.88~1.95 (m, 4 H), 2.17~2.31 (m, 8H), 4.57~4.60 (m, 3H), 7.25~7.31 (m, 2H), 7.45~7.49 (m, 2H), 7.57 (s, 1H); 13C NMR (400 MHz, CDCl3) δ: 22.60, 24.49, 38.20, 38.85, 39.14, 50.30, 114.64, 127.20, 128.21, 128.60, 130.22, 134.74, 164.37, 165.70; HRMS (ESI) calcd for C23H24O8Cl [M+H]+ 463.1160, found 463.1168.
5, 5-(2-硝基苯基亚甲基)双(2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮)(3g):淡黄色固体, m.p. 158~160 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.80~1.87 (m, 4H), 1.89~1.94 (m, 4H), 2.20~2.28 (m, 8H), 4.52~5.23 (m, 3H), 7.45 (t, J=7.2 Hz, 2H), 7.61 (t, J=7.6 Hz, 2H), 7.78 (t, J=7.6 Hz, 2H), 7.45 (t, J=7.6 Hz, 2H); 13C NMR (400 MHz, CDCl3) δ: 22.59, 24.45, 33.24, 38.19, 39.13, 50.26, 114.56, 124.95, 128.60, 128.69, 133.16, 135.29, 150.12, 163.75, 165.66; HRMS (ESI) calcd for C23H24NO10 [M+H]+ 474.1400, found 474.1406.
5-(4-羟基苯基亚甲基)-2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮(3h):淡黄色固体, m.p. 173~175 ℃ (lit.[21] 169~171 ℃); 1H NMR (400 MHz, CDCl3) δ: 1.86~1.90 (m, 4H), 2.20~2.23 (m, 4H), 6.74 (s, 1H), 6.94 (d, J=8.4 Hz, 2H), 8.13 (d, J=8.4 Hz, 2H), 8.35 (s, 1H); 13C NMR (400 MHz, CDCl3) δ: 23.28, 38.44, 111.21, 113.64, 116.17 124.58, 137.84, 158.17, 161.78, 161.82, 164.84.
5-(4-甲氧苯基亚甲基)-2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮(3i):淡黄色固体, m.p. 83~85 ℃ (lit.[21] 83~85 ℃); 1H NMR (400 MHz, CDCl3) δ: 1.86~1.91 (m, 4H), 2.19~2.23 (m, 4H), 3.92 (s, 1H), 6.98 (d, J=8.9 Hz, 2H), 8.20 (d, J=8.9 Hz, 2H), 8.33 (s, 1H); 13C NMR (400 MHz, CDCl3) δ: 23.26, 38.41, 55.68, 111.65, 113.37, 114.38, 124.71, 137.48, 157.65, 161.19, 164.62.
5-(4-N, N-二甲基苯基亚甲基)-2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮(3j):橙色固体, m.p. 174~175 ℃ (lit.[21] 180~182 ℃); 1H NMR (400 MHz, CDCl3) δ: 1.83~1.87 (m, 4H), 2.17~2.21 (m, 4H), 3.15(s, 6H), 6.68 (t, J=8.8 Hz, 2H), 8.21 (t, J=8.8 Hz, 2H), 8.26 (s, 1H); 13C NMR (400 MHz, CDCl3) δ: 23.29, 38.25, 40.10, 105.62, 111.27, 112.75, 120.11, 138.86, 154.56, 157.89, 162.23, 165.87.
5-(2-呋喃亚甲基)-2, 2-亚丁基-1, 3-二噁烷-4, 6-二酮(3k):淡黄色固体, m.p. 93~95 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.83~1.92 (m, 4H), 2.13~2.24 (m, 4H), 6.75~6.76 (m, 1H), 7.85 (d, J=1.2 Hz, 1H), 8.32 (s, 1H), 8.43 (d, J=4.0 Hz, 1H); 13C NMR (400 MHz, CDCl3) δ: 23.23, 38.40, 108.26, 113.73, 115.28, 128.02, 141.08, 150.16, 150.40, 160.87, 163.87; HRMS (ESI) calcd for C13H13O5 [M+H]+ 249.0763, found 249.0752.
辅助材料(Supporting Information)化合物3a, 3b, 3c, 3d, 3h, 3k的NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Khan, K. M.; Maharvi, G. M.; Khan, M. T.; Shaikh, A. J. Bioorg. Med. Chem. 2006, 14, 344. doi: 10.1016/j.bmc.2005.08.029
-
[2]
Lipson, V. V.; Desenko, S. M.; Borodina, V. V.; Shirobokova, M. G.; Karnozhitskaya, T. M.; Musatov, V. I.; Kravchenko, S. V. Chem. Heterocycl. Compd. 2005, 41, 216. doi: 10.1007/s10593-005-0130-7
-
[3]
Lipson, V. V.; Svetlichnaya, N. V.; Shishkina, S. V.; Shishkin, O. V. Mendeleev Commun. 8, 18, 141.
-
[4]
Lipson, V. V.; Borodina, V. V.; Shirobokova, M. G. Ukr. Khim. Zh. 2005, 71, 95.
-
[5]
Strods, J.; Lielbriedis, I.; Neilands, O. Latv. PSR Zinatnu Akademijas Vestis, Kimijas Serija 1978, 2, 225.
-
[6]
Trost, B. M.; Morris, P. J.; Sprague, S. J. J. Am. Chem. Soc. 2012, 134, 17823. doi: 10.1021/ja309003x
-
[7]
King, F. E.; Felton, D. G. I. J. Chem. Soc. 1948, 13, 1371.
-
[8]
Ramachary, D. B.; Kishor, M. J. Org. Chem. 2007, 12, 5056.
-
[9]
Marco, B. A.; Manuel, T. A.; Itzia, P. M.; Francisco, M. M.; Georgina, E.; Elies, M.; Enrique, E. J. Chem. Crystallogr. 1999, 29, 759. doi: 10.1023/A:1009583417391
-
[10]
Cravotto, G.; Demetri, A.; Nano, G. M.; Palmmisano, G.; Penoni, A.; Tagliapietra, S. Eur. J. Org. Chem. 2003, 2003, 4438. doi: 10.1002/(ISSN)1099-0690
-
[11]
Hedge, J. W.; Kruse, C. W.; Snyder, H. R. J. Org. Chem. 1961, 26, 992. doi: 10.1021/jo01063a002
-
[12]
史达清, 倪赛男, 窦国兰, 有机化学, 2009, 29, 788. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract326358.shtmlShi, D.-Q.; Ni, S.-N.; Dou, G.-L. Chin. J. Org. Chem. 2009, 29, 788(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract326358.shtml
-
[13]
Finguelli, F.; Pizzo, F.; Vaccaro, L. Synthesis 2000, 646.
-
[14]
Labinger, J. A.; Herring, A. M.; Nercaw, J. E. J. Am. Chem. Soc. 1990, 112, 5628. doi: 10.1021/ja00170a031
-
[15]
Podgorsek, A.; Stavber, S.; Zupan, M.; Iskra, J. Green Chem. 2007, 11, 1212.
-
[16]
Narayan, S.; Muldoon, J.; Finn, M. G.; Fokin, V. V.; Kolb, H. C.; Sharpless, K. B. B. Angew. Chem., Int. Ed. 2005, 44, 257. doi: 10.1002/(ISSN)1521-3773
-
[17]
Mori, Y.; Manabe, K.; Kobayashi, S. Angew Chem., Int. Ed. 2001, 40, 2815. doi: 10.1002/(ISSN)1521-3773
-
[18]
Churruca, F.; SanMartin, R.; Dominguez, E. Synlett 2005, 3116.
-
[19]
严楠, 熊斌, 廖维林, 许招会, 有机化学, 2010, 30, 1391.Yan, N.; Xiong, B.; Liao, W.-L.; Xu, Z.-H. Chin. J. Org. Chem. 2010, 30, 1391(in Chinese).
-
[20]
Yu, J. J.; Wang, L. M.; Liu, J. Q.; Guo, F. L.; Liu, Y.; Jiao, N. Green Chem. 2010, 12, 216. doi: 10.1039/B913816A
-
[21]
许招会, 严楠, 廖维林, 江西师范大学学报(自然科学版), 2012, 36, 524.Xu, Z.-H; Yan, N.; Liao, W.-L. J. Jiangxi Norm. Univ. (Nat. Sci.) 2012, 36, 524(in Chinese).
-
[1]
-
表 1 化合物3a的合成条件优化a
Table 1. Optimization of reaction conditions for the synthesis of 3a
Entry Solvent (mL) Catalyst Time/h Temperature/℃ Yield c /% 1 None None 10 r.t. 36 2 1, 2-Dichloroethane (5.0) None 10 r.t. 42 3 Toluene (5.0) None 10 r.t. 44 4 CH3COOCH2CH3 (5.0) None 8 r.t. 60 5 DMSO (5.0) None 8 r.t. 65 6 CH3CH2OH (5.0) None 6 r.t. 70 7 Ethylene glycol (5.0) None 6 r.t. 66 8 Glycerol (5.0) None 6 r.t. 61 9 H2O (5.0) None 6 r.t. 81 10 H2O (5.0) None 6 40 78 11 H2O(5.0) None 8 r.t. 81 12 CH3CH2OH/H2O (V: V=1:1) b None 6 r.t. 80 a Reaction conditions: benzaldhyde (1 mmol), 2, 2-butylidene-1, 3-dioxane-4, 6-dione (2 mmol), solvent (5.0 mL); baqueous solution of ethanol/ethanol (2.5 mL) and water (2.5 mL); c isolated yield. 表 2 化合物3a~3g和3h~3k的合成a
Table 2. Synthesis of 3a~3g and 3h~3k
Entry Product R Time/h Yieldb /% 1 3a C6H5 6.0 81 2 3b 4-FC6H4 5.0 72 3 3c 4-ClC6H4 6.0 78 4 3d 4-CH3C6H4 8.0 63 5 3e 4-O2NC6H4 5.0 74 6 3f 3-ClC6H4 6.0 83 7 3g 2-O2NC6H4 4.0 76 8 3hc 4-HOC6H4 5.0 88 9 3ic 4-CH3OC6H4 5.0 68 10 3jc 4-(CH3) 2NC6H4 5.0 73 11 3kc 2-Furyl 6.0 80 aReaction conditions: aromatic aldhydes (1 mmol), 2, 2-butylidene-1, 3-dioxane-4, 6-diones (2 mmol), water (5 mL), r.t.; bisolated yield; cobserved Knoevenagel reaction product. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 1
- 文章访问数: 414
- HTML全文浏览量: 37


 下载:
下载:

 下载:
下载:

