
Citation: Wang Jintao, Xiong Jiukai, Li Juanjuan, Wang Jiali, Wang Kerang, Li Xiaoliu. Hydrogenation of Alkynes to cis-Alkenes with Hydrazine in Air[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1407-1411. doi: 10.6023/cjoc201701040

水合肼选择性还原炔烃至顺式烯烃研究
English
Hydrogenation of Alkynes to cis-Alkenes with Hydrazine in Air
-
Key words:
- transfer hydrogenation
- / hydrazine
- / alkynes
- / alkenes
- / diazene
-
氢化反应是有机合成反应中最重要的反应之一, 广泛应用于精细化工和药物合成等领域[1], 氢化反应的氢源一般为氢气.近年来, 转移氢化反应[2]引起了人们广泛关注, 具有反应条件温和、反应转化率高和不涉及高压反应器等特点[3].作为转移氢化试剂, 二氮烯N2H2 (diazene)分子在有机合成反应中的应用已经超过100年[4], 早在1960年代就发现其能选择性还原不饱和C=C双键[4].产生二氮烯N2H2分子最直接的方法是水合肼的氧化反应, 常用的氧化剂包括: H2O2、NaIO4、K3[(FeCN)6]和氧气等[4].通过氧化反应产生的N2H2分子直接作为转移氢化试剂, 可以选择性地还原不饱和C=C双键[4].与经典的过渡金属催化的还原反应相比, 转移氢化反应为还原反应提供了另一种高效温和的还原方法.
以水合肼(NH2NH2•H2O)为转移氢化试剂, 通常是在核黄素类化合物[5]、硒化合物[6]和氧气[7]等作为氧化剂下转化成二氮烯N2H2分子.目前, 水合肼作为转移氢化试剂的反应已经用于合成青蒿酸类化合物[8].然而, 以水合肼为转移氢化试剂还原不饱和C≡C叁键的研究较少[9~12], 尤其是将不饱和C≡C叁键还原为不饱和C=C双键的研究更少.根据文献报道, Balci等[13]首次发现水合肼可以将二苯乙炔分子还原为二苯乙烷和顺式-1, 2-二苯基乙烯分子, 但是顺式-1, 2-二苯基乙烯分子的产率较低, 二苯乙烷和顺式-1, 2-二苯基乙烯分子的比例为86:12, 主要产物为完全还原的产物二苯乙烷, 其反应条件为:高纯氧气作为氧化剂, 加入4倍量的水合肼, 反应时间为144 h.这是文献中首次报道的水合肼可以将炔烃还原为烯烃的反应.但是该反应存在的缺点是反应时间长、产率低.因此, 研究水合肼作为转移氢化试剂快速、高效的选择性还原炔烃至烯烃的反应具有重要的意义.
本文中, 我们在空气中以水合肼(NH2NH2•H2O)为转移氢化反应试剂, 研究了一系列具有空间位阻效应的炔烃分子转化为烯烃化合物的反应.研究发现, 水合肼(NH2NH2•H2O)作为有效的转移氢化试剂, 在没有催化剂的条件下, 在空气中高效地将炔烃还原至顺式烯烃.通过2D NOESY谱研究了顺式烯烃的构型.该研究结果为以水合肼(NH2NH2•H2O)为转移氢化反应试剂选择性还原炔烃至烯烃的研究做了初步的尝试.
1 结果与讨论
研究水合肼还原炔烃至烯烃的反应源于通过盖布瑞尔(Gabriel)合成法制备伯胺的反应.众所周知, 水合肼水解邻苯二甲酰亚胺类化合物是制备伯胺类化合物常用的反应, 即盖布瑞尔合成法[14].在我们前期的研究工作中, 通过水合肼水解化合物1制备炔基修饰三甘醇化合物1a时[15](Eq. 1) 发现制备的三甘醇衍生物是混合物, 含有炔基、烯基和烷基化合物1a~1c, 其中1a~1c的比例分别为22%、29%和50%, 混合物中烯烃化合物1b通过1H NMR谱确认, δ 5.89, 5.26和5.15的质子氢为烯烃特征氢, 进一步通过HRMS谱确认了三种化合物1a~1c的分子量.三种化合物1a~1c的含量通过1H NMR谱中的亚甲基质子氢的比例确认, 其比例为1:1.29:2.24.该结果表明水合肼在水解邻苯二甲酰亚胺的过程中将炔基还原成了烯基和烷基, 说明水合肼(NH2NH2•H2O)在空气中可作为转移氢化试剂.
进而, 我们研究了炔基修饰三甘醇化合物2的转移氢化反应.如表 1所示, 在乙醇溶剂中, 16倍量的质量分数为80%的水合肼, 反应时间为4 h, 随着温度升高, 烯烃衍生物2a的含量逐渐增加(表 1, Entries 1~6), 并且完全还原的产物2b的含量也增加.在乙醇回流的条件下, 炔基化合物转化为烯烃化合物2a和烷基化合物2b的含量分别为26%和44%, 不同组分化合物的含量通过1H NMR谱确认.进一步优化反应条件, 改变反应时间, 发现随着反应时间的延长, 完全还原的产物2b的含量逐渐增加, 当反应时间为24 h时, 炔基化合物2全部转化为烷基衍生物2b (表 1, Entries 7~12).进而, 改变水合肼的加入当量, 发现16倍量时, 化合物2的转化率较高并且烯烃化合物2a的含量较高(表 1, Entries 13~15).另外, 将端炔化合物变为中间炔基化合物3, 反应12 h只有13%的炔基化合物3转化为烯烃化合物3a(表 2).
 表 1
化合物2在不同反应温度、反应时间和水合肼当量条件下的反应结果
Table 1.
Temperature, time and equivalent effects on the reduction of compound 2
表 1
化合物2在不同反应温度、反应时间和水合肼当量条件下的反应结果
Table 1.
Temperature, time and equivalent effects on the reduction of compound 2

通过上述研究结果可知, 水合肼在空气中可以作为转移氢化试剂还原炔烃, 并且能制备其中间还原产物烯烃, 然而, 转化率较低, 并有过度还原的烷烃产物.
因此, 我们改变反应底物的结构, 研究了一系列双烷基和羟基取代的炔烃化合物4~7的还原反应, 如Eq. 2所示, 反应底物的炔基两端都具有一定的空间位阻效应.
化合物2, 5-二甲基-3-炔-2, 5-己二醇(4)在乙醇溶液中, 16倍量的80%水合肼, 回流条件下, 随着反应时间从1 h到4 h, 烯烃化合物4a的反应转化率分别为58% (1 h)、69% (2 h)、89 (3 h)和89% (4 h)(表 3).当反应时间为4 h时, 完全还原成烷烃化合物4b的转化率为3.5%, 说明反应时间为3 h为最优的反应时间, 由炔烃底物转化为烯烃化合物4a的转化率达到89%.烯烃衍生物4a经柱层析分离, 洗脱剂为CH2Cl2/CH3COOEt (V/V=3/1), 化合物结构经1H NMR、13C NMR和HRMS等表征.
进而, 研究了空间位阻效应与反应转化率的关系, 分别以3, 6-二甲基-4-炔-3, 6-辛二醇(5)、4, 7-二甲基-5-炔-4, 7-癸二醇(6)和2, 4, 7, 9-四甲基-5-炔-4, 7-癸二醇(7)为反应底物, 在乙醇溶剂中, 16倍当量的80%水合肼条件下, 在不同反应时间转化为烯烃化合物5a、6a和7a(表 4).研究结果表明, 制备的烯烃化合物5a、6a和7a的转化率分别为92%、90%和94%(表 4), 说明随着空间位阻的增大, 由炔烃转化为烯烃衍生物的转化率升高.另外, 由于反应底物的空间位阻增大, 反应时间也从化合物4a的3 h延长到21 (5a)、24 (6a)和26 h (7a).烯烃衍生物5a、6a和7a经柱层析分离, 洗脱剂为CH2Cl2/ CH3COOEt (V/V=3/1), 化合物结构经1H NMR、13C NMR和HRMS等表征.
进而研究了烯烃化合物的构型, (Z)-2, 5-二甲基-3-烯-2, 5-辛二醇(5a)的1H NMR和13C NMR与文献报道的结果一致[16].另外我们研究了不对称炔烃化合物2-甲基-4-苯基-3-炔-2-丁醇(8)选择性还原为烯烃的反应(Eq. 3), 发现反应12和24 h生成的烯烃化合物8a的转化率只有26%和25%, 随着反应时间延长, “完全”还原的产物8b的量增加, 说明芳基的引入降低了炔烃的反应活性和反应的选择性.
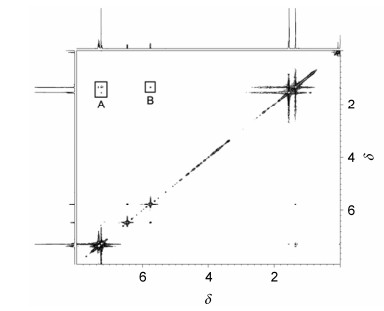
烯烃化合物8a经柱层析分离, 1H NMR和13C NMR谱表征.烯烃化合物8a的1H NMR谱显示C=C双键的质子氢分别在δ 6.47和5.77, 偶合常数为12.6 Hz, 说明其为顺式烯烃的结构.进而, 2D NOESY谱研究了化合物8a的构型, 苯基的特征质子氢(δ 7.23和7.32) 与甲基的质子氢(δ 1.36) 和羟基的质子氢(δ 1.57) 之间存在明显的相关, 如图 1所示.另外, 双键的特征质子氢(δ 5.77) 与甲基的质子氢(δ 1.57) 也存在明显的相关, 如图 1所示.这些结果说明化合物8a是顺式结构.
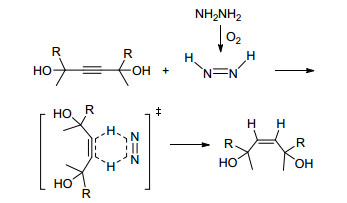
水合肼选择性还原炔烃至顺式烯烃的反应机理(Scheme 1)与文献[4]报道的水合肼将烯烃还原为烷烃的机理类似, 即水合肼在空气中氧化生成二氮烯N2H2分子[7], 进而二氮烯N2H2分子与炔烃底物分子形成六元环状过渡态, 氢原子与炔键顺式加成, 氢原子转移到炔键上.由于炔烃底物分子的空间位阻效应, 降低了生成的烯烃化合物的反应活性, 最终产物保留在顺式烯烃阶段.
2 结论
研究了一系列双烷基和双羟基修饰的炔类化合物, 在以水合肼(NH2NH2•H2O)为转移氢化试剂的条件下, 在空气中高效地将炔烃还原为顺式烯烃的反应.反应机理为水合肼在空气中氧化生成二氮烯N2H2分子, 二氮烯N2H2分子与炔烃底物分子形成六元环状过渡态, 发生顺式加成, 由于底物分子取代基的空间位阻效应, 降低了生成的烯烃化合物的反应活性, 最终产物保留在顺式烯烃阶段.进而, 通过2D NOESY谱证明了生成的不对称的烯烃化合物的构型为顺式构型.该研究结果为以水合肼为转移氢化试剂选择性将炔烃还原至烯烃的研究做了初步尝试.
3 实验部分
3.1 仪器与试剂
1H NMR、13C NMR和2D NOESY谱用RT-NMR Bruker AVANCE 600 MHz (TMS为内标)测量; 高分辨率质谱用FTICR-MD (Ionspec 7.0) 测定.
3.2 实验方法
3.2.2 合成化合物5a、6a和7a的方法
在25 mL圆底烧瓶中, 加入5.0 mmol的化合物5~7, 4.9 mL (80 mmol)的质量分数80%水合肼(NH2NH2• H2O), 加入20 mL乙醇为溶剂.反应时间为21~26 h, 停止反应, 反应液冷至室温, 旋干溶剂, 剩余物溶解在10 mL二氯甲烷溶剂中, 用5 mL水洗两次, 除去剩余的水合肼, 有机相用无水硫酸钠干燥.柱层析分离, 洗脱剂为CH2Cl2/CH3COOEt (V/V=3/1), 制备化合物5a~7a.
(Z)-3, 6-二甲基-4-烯-3, 6-辛二醇(5a):产率90%.粘稠液体. 1H NMR (600 MHz, CDCl3) δ: 0.91~0.94 (m, 6H, CH3), 1.33 (d, J=4.2 Hz, 6H, CH3), 1.59~1.63 (m, 4H, CH2), 4.13 (s, 2H), 5.21 (s, 2H, C=CH); 13C NMR (150 MHz, CDCl3) δ: 8.55 (CH3), 29.26, 29.34, 36.46, 36.55, 73.44, 135.06, 135.12; HRMS calcd for C10H20NaO2 [M+Na]+: 195.1361, found 195.1353.
(Z)-4, 7-二甲基-5-烯-4, 7-癸二醇(6a):产率88%.粘稠液体. 1H NMR (600 MHz, CDCl3) δ: 0.92 (t, J=7.2 Hz, 6H, CH3), 1.34 (d, J=3.6 Hz, 6H, CH3), 1.33~1.43 (m, 4H, CH2), 1.54~1.58 (m, 4H, CH2), 4.06 (s, 2H, OH), 5.30 (d, J=1.8 Hz, 2H, C=CH); 13C NMR (150 MHz, CDCl3) δ: 14.48, 17.50, 29.75, 29.81, 46.39, 46.47, 73.23, 135.05, 135.11; HRMS calcd for C12H25O2 [M+H]+: 201.1855, found 201.1851.
(Z)-2, 4, 7, 9-四甲基-5-烯-4, 7-癸二醇(7a):产率94%. m.p. 52.2~53.8 ℃; 1H NMR (600 MHz, CDCl3): 0.95~0.97 (m, 12H, CH3), 1.35 (s, 6H, CH3), 1.51 (d, J=6.0 Hz, 4H, CH2), 1.83~1.87 (m, 2H, CH), 4.06 (s, 2H, OH), 5.32 (s, 2H, C=CH); 13C NMR (150 MHz, CDCl3) δ: 24.54, 24.62, 24.69, 30.80, 52.73, 73.93, 135.33; HRMS calcd for C14H28NaO2 [M+Na]+: 251.1987, found 251.1985.
3.2.3 化合物8a的合成
在25 mL圆底烧瓶中, 加入800 mg (5.0 mmol)的2-甲基-4-苯基-3-炔-2-丁醇(8), 4.9 mL (80 mmol)的水合肼(NH2NH2•H2O) (80%), 加入20 mL乙醇为溶剂, 在空气中反应12 h.反应液冷至室温, 旋干溶剂, 剩余物溶解在10 mL二氯甲烷溶剂中, 用5 mL水洗两次, 除去剩余的水合肼, 有机相用无水硫酸钠干燥.柱层析分离, 洗脱剂为CH2Cl2/CH3COOEt (V/V=3/2), 得白色固体(Z)-2-甲基-4-苯基-3-烯-2-丁醇(8a) (225.8 mg), 产率25%. m.p. 57.5~58.2 ℃; 1H NMR (CDCl3, 600 MHz) δ: 1.36 (s, 6H, CH3), 1.57 (s, 1H, OH), 5.77 (d, 1H, J=12.6 Hz, CH), 6.47 (d, 1H, J=12.6 Hz, CH), 7.23 (t, 1H, J=7.2 Hz, ArH), 7.31~7.35 (4H, ArH); 13C NMR (CDCl3, 150 MHz) δ: 31.20, 72.12, 126.98, 127.89, 128.08, 129.01, 137.55, 139.34. Anal. calcd for C11H14O: C 81.44, H 8.70; found C 81.32, H 8.79.
辅助材料(Supporting Information)化合物的核磁共振谱、高分辨率质谱等数据.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
3.2.1 (Z)-2, 5-二甲基-3-烯-2, 5-己二醇(4a)的合成
25 mL圆底烧瓶中, 加入710 mg (5.0 mmol)的2, 5-二甲基-3-炔-2, 5-己二醇(4), 4.9 mL (80 mmol)的水合肼(NH2NH2•H2O) (80%), 加入20 mL乙醇为溶剂.该反应体系在空气中回流3 h, 停止反应.反应液冷至室温, 旋干溶剂, 剩余物溶解在10 mL二氯甲烷溶剂中, 用5 mL水洗两次, 除去剩余的水合肼, 有机相用无水硫酸钠干燥.柱层析分离, 洗脱剂为CH2Cl2/CH3COOEt (V/V=3/1), 得到白色固体化合物4a (628 mg), 产率87%. m.p. 68.2~68.8 ℃; 1H NMR (600 MHz, CDCl3) δ: 1.39 (s, 12H, CH3), 4.25 (s, 2H, OH), 5.34 (s, 2H, C=CH); 13C NMR (150 MHz, CDCl3) δ: 31.59 (CH3), 71.14 (C—C=C), 135.41 (C=C); HRMS calcd for C8H16NaO2 167.1048, found 167.1043.
-
-
[1]
(a) de Vries, J. G.; Elsevier, C. J. The Handbook of Homogeneous Hydrogenation. Wiley-VCH, Weinheim, 2007.
(b) Chernichenko, K.; Madarász, Á.; Pápai, I.; Nieger, M.; Leskelä, M.; Repo, T. Nat. Chem. 2013, 5, 718. -
[2]
(a) Johnstone, R. A. W. ; Wilby, A. H. ; Entwistle, I. D. Chem. Rev. 1985, 85, 129.
(b) Hauwert, P. ; Maestri, G. ; Sprengers, J. W. ; Catellani, M. ; Elsevier, C. J. Angew. Chem. Int. Ed. 2008, 47, 3223.
(c) Hauwert, P. ; Boerleider, R. ; Waesink, S. ; Weigand, J. J. ; Elsevier, C. J. J. Am. Chem. Soc. 2010, 132, 16900.
(d) Heim, L. E. ; Thiel, D. ; Gedig, C. ; Deska, J. ; Prechtl, M. H. G. Angew. Chem. , Int. Ed. 2015, 54, 10308.
(e) Yang, X. H. ; Xie, Z. M. ; He, J. ; Yu, L. Chin. J. Org. Chem. 2015, 35, 603 (in Chinese).
(阳香华, 谢珍茗, 何军, 余林, 有机化学, 2015, 35, 603. )
(f) Dai, N. ; Shang, R. ; Fu, M. C. ; Fu, Y. Chin. J. Chem. 2015, 33, 405. -
[3]
Wang, D.; Astruc, D. Chem. Rev. 2015, 115, 6621. doi: 10.1021/acs.chemrev.5b00203
-
[4]
(a) Hünig, S.; Müller, H. R.; Thier, W. Angew. Chem., Int. Ed. Engl. 1965, 4, 271.
(b) Pasto, D. J. Org. Rect. 1991, 40, 91.
(c) Gutmann, B.; Cantillo, D.; Kappe, C. O. Angew. Chem., Int. Ed. 2015, 54, 6688. -
[5]
(a) Imada, Y.; Iida, H.; Naota, T. J. Am. Chem. Soc. 2005, 127, 14544.
(b) Teichert, J. F.; den Hartog, T.; Hanstein, M.; Smit, C.; ter Horst, B.; Hernandez-Olmos, V.; Feringa, B. L.; Minnaard, A. J. ACS Catal. 2011, 1, 309.
(c) Lida, H.; Imada, Y.; Murahashi, S. I. Org. Biomol. Chem. 2015, 13, 7599. -
[6]
Schulz, G. A. S.; Comin, E.; de Souza, R. F. J. Appl. Polym. Sci. 2012, 123, 3605. doi: 10.1002/app.v123.6
-
[7]
(a) Pieber, B.; Martinez, S. T.; Cantillo, D.; Kappe, C. O. Angew. Chem., Int. Ed. 2013, 52, 10241.
(b) Santra, S.; Guin, J. Eur. J. Org. Chem. 2015, 7253. -
[8]
(a) Feth, M. P.; Rossen, K.; Burgard, A. Org. Process Res. Dev. 2013, 17, 282.
(b) Pieber, B.; Glasnov, T.; Kappe, C. O. Chem.-Eur. J. 2015, 21, 4368. -
[9]
Smit, C.; Fraaije, M. W.; Minnaard, A. J. J. Org. Chem. 2008, 73, 9482. doi: 10.1021/jo801588d
-
[10]
Imada, Y.; Iida, H.; Kitagawa, T.; Naota, T. Chem.-Eur. J. 2011, 17, 5908. doi: 10.1002/chem.v17.21
-
[11]
Lamani, M.; Ravikumara, G. S.; Prabhu, K. R. Adv. Synth. Catal. 2012, 354, 1437. doi: 10.1002/adsc.201200110
-
[12]
Lamani, M.; Guralamata, R. S.; Prabhu, K. R. Chem. Commun. 2012, 48, 6583. doi: 10.1039/c2cc32611f
-
[13]
Menges, N.; Balci, M. Synlett 2014, 25, 671. doi: 10.1055/s-00000083
-
[14]
(a) Yu, T. B.; Bai, J. Z.; Guan, Z. Angew. Chem., Int. Ed. 2009, 48, 1097.
(b) Stockdill, J. L.; lopez, A. M.; Ibrahim, A. A. Tetrahedron Lett. 2015, 56, 3503.
(c) Hua, J.; Lam, J. W. Y.; Yu, X. M.; Wu, L. J.; Kwok, H. S.; Wong, K. S.; Tang, B. Z. J. Polym. Sci: Pol. Chem. 2008, 46, 2025. -
[15]
Wang, K. R.; Yang, Z. B.; Li, X. L. Chem.-Eur. J. 2015, 21, 5680. doi: 10.1002/chem.201406447
-
[16]
Sajiki, H.; Mori, S.; Ohkubo, T.; Ikawa, T.; Kume, A.; Maegawa, T.; Monguchi, Y. Chem.-Eur. J. 2008, 14, 5109. doi: 10.1002/(ISSN)1521-3765
-
[1]
-
表 1 化合物2在不同反应温度、反应时间和水合肼当量条件下的反应结果
Table 1. Temperature, time and equivalent effects on the reduction of compound 2

表 2 化合物3在不同反应时间下的反应结果a
Table 2. Time effects on the reduction of compound 3

表 3 化合物4在不同反应时间下的反应结果
Table 3. Times effects on the reduction of compound 4

表 4 化合物5~7在不同反应时间下的反应结果
Table 4. Reduction of compounds 5, 6 and 7 with different reaction times

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 46
- 文章访问数: 5355
- HTML全文浏览量: 1551


 下载:
下载:

 下载:
下载:

