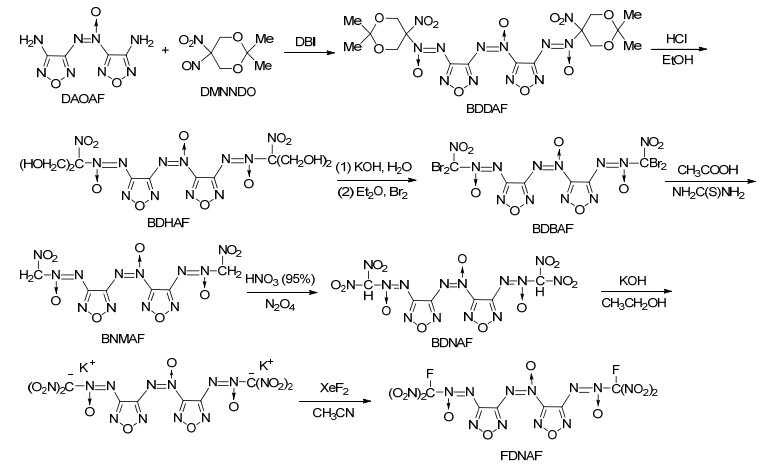
 图式1
FDNAF的合成路线
Scheme1.
Synthetic approach of FDNAF
图式1
FDNAF的合成路线
Scheme1.
Synthetic approach of FDNAF

Citation: Zhang Jiarong, Bi Fuqiang, Lian Peng, Zhang Junlin, Wang Bozhou. Synthesis and Characterization of an Energetic Compound 3, 3'-Bis(fluoronitromethyl-ONN-azoxy) azoxyfurazan[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2736-2744. doi: 10.6023/cjoc201701014

含能化合物3, 3'-双(氟二硝甲基-ONN-氧化偶氮基)氧化偶氮呋咱合成与表征
-
关键词:
- 有机化学
- / 氟二硝甲基-ONN-氧化偶氮基
- / 含能化合物
- / 合成
English
Synthesis and Characterization of an Energetic Compound 3, 3'-Bis(fluoronitromethyl-ONN-azoxy) azoxyfurazan
-
Key words:
- organic chemistry
- / fluoronitromethyl-ONN-azoxy group
- / energetic compound
- / synthesis
-
高能量、高密度是合成综合性能优异的新型含能化合物的永恒的目标之一[1], 欧美等西方国家基于致密的氮杂张力环和笼型结构作为母体结构, 通过引入NO2等含能基团, 成功设计、合成出八硝基立方烷(ONC)[2]、六硝基六氮杂异伍兹烷(CL-20) 等高能量密度化合物[3].然而, 制备新型含能母体结构存在着合成步骤长、合成难度大以及感度较高等突出问题, 短时间内设计、合成出性能优异的新型含能母体结构很难取得技术突破.近年来, 在现有氮杂母体结构上引入新型含能基团来制备含能化合物的方法, 已经成为制备新型含能材料的研究热点[4~7].多硝甲基-ONN-氧化偶氮基作为高能量密度含能基团中的新成员, 受到了科学家们的广泛关注.俄罗斯泽林斯基研究院[8~17]将该基团引入多种氮杂含能母体结构, 如呋咱环、呋咱醚和氧化呋咱环等, 设计并合成了多种新型含能化合物.其中3, 3'-双(氟偕二硝甲基-ONN-氧化偶氮基)氧化偶氮呋咱(FDNAF)是最为典型的多硝甲基氧化偶氮含能化合物之一[18].呋咱环和氧化偶氮基中含有大量N—N和C—N键, 使含能化合物分解时放出大量氮气, 产生较高能量[19~22], 西安近代化学研究所对此类含能化合物的物化、爆轰性能等进行了理论模拟计算, 发现该类化合物具有良好的爆轰性能[23].
本工作以二氨基氧化偶氮呋咱(DAOAF)和2, 2-二甲基-5-硝基-5-亚硝基-1, 3-二氧环己烷(DMNNDO)为原料, 经氧化偶联、水解、溴化、还原、硝化以及氟化等7步反应, 合成了含能化合物FDNAF (Scheme 1), 并采用红外、核磁、元素分析等手段完成了中间体和标题化合物的结构的表征.改进了水解反应合成方法, 探讨了溴化、硝化等关键步骤的合成条件, 获得最佳反应条件, 提高了反应收率.采用理论计算与实验相结合的方法, 确认并归属13C NMR, 15N NMR的化学位移和红外吸收频率, 理论结果与实验结果具有较好的一致性.开展了单硝甲基-ONN-氧化偶氮化合物(BNMAF)、二硝基甲基-ONN-氧化偶氮化合物(BDNAF)和氟二硝甲基-ONN-氧化偶氮化合物(FDNAF)三种含能化合物的物化、爆轰性能和热性能研究. FDNAF的成功合成改进了多硝甲基-ONN-氧化偶氮含能基团的构建方法, 为进一步设计、合成性能优异的新型高能量密度含能化合物提供了一条值得借鉴的思路.
1 结果与讨论
1.1 水解反应方法改进
文献[8]提供给的水解方法为:以乙酰氯和甲醇为水解试剂, 20 ℃温度下, 反应18 h.该方法反应耗时较长, 尝试采用水解能力更强的HCl/CH3CH2OH代替AcCl/CH3OH作为水解试剂, 在70 ℃反应2 h即获得纯度达到93%以上的3, 3'-双[α-(1, 3-二羟基-2-硝基-异丙基)-ONN-氧化偶氮基]氧化偶氮呋咱(BDHAF)粗品, 无需纯化即可作为溴化反应的原料, 直接进行下一步反应, 明显提高了工作效率.利用高效液相色谱(HPLC)跟踪不同时间粗品的收率和纯度, 结果表明反应时间越长, 粗品纯度越低, 而较低的粗品纯度会增加纯化的工作量且会导致下一步溴化反应收率降低.为了提高水解和溴化两步反应的收率, 表 1列出了以HCl/CH3CH2OH作为水解试剂时, 反应时间对水解产物BDHAF粗品收率和纯度的影响.
Reaction time/h Yield/% Puritya/% 1.5 98 85 2 99 93 3 98 88 4 98 80 6 97 56 10 98 48 14 97 38 a利用HPLC测试产品纯度, 测试条件为: C18硅胶柱, 25 ℃, 乙腈/水=9/1, λ=260 nm, v=1.0 mL/min. 1.2 溴化反应条件研究
研究了溴化步骤的反应条件, 结果表明温度和时间都会对溴化反应的收率产生明显影响, 因此, 考察了二者对其影响规律, 探索最佳反应条件.
1.2.1 反应温度的影响
为了确定溴化反应适宜的温度范围, 在其他条件相同的情况下, 分别考察了反应温度为0、10、20、30和40 ℃时对溴化产物3, 3'-双[α-(1, 1-二溴-硝甲基)-ONN-氧化偶氮基]氧化偶氮呋咱(BDBAF)收率的影响, 具体结果见表 2.
Temperature/℃ Yield/% 0 35 10 47 20 30 40 52 48 31 由表 2可以看出, 在0~20 ℃范围内, 随着反应温度的升高, 溴化产物BDBAF的收率逐渐提高, 在20 ℃时, 收率最高达到52%;继续升高反应温度, 收率反而略下降; 通过薄层色谱跟踪实验, 结果表明:反应温度的升高, 会使副反应更加活跃, 导致副产物增多, 从而收率下降, 因此最佳反应温度为20 ℃.
1.2.2 反应时间的影响
在反应温度20 ℃的条件下, 考察了不同反应时间对BDBAF收率的而影响, 具体结果见表 3.
Reaction time/min Yield/% 5 38 10 40 20 45 30 52 40 51 由表 3可以看出, 当反应时间为5 min时, 反应收率仅为38%, 可能是因为反应时间较短, 反应不完全, 从而导致收率较低; 当时间逐渐延长, BDBAF的收率逐渐提高; 当反应时间延长至30 min时, 收率最高达到52%, 继续延长时间, 收率没有明显提升, 因此, 优选反应时间为30 min.
1.3 硝化反应条件研究
在单硝甲基-ONN-氧化偶氮化合物BNMAF中引入硝基, 是提高化合物能量和密度, 制备性能更优异的含能化合物BDNAF和FDNAF的前提条件, 因此, 硝化BNMAF是一个至关重要的反应步骤.首先尝试采用浓度为95%的HNO3作为硝化试剂, 可是收率偏低, 最高只有30%;进一步分别采用98% HNO3和100% HNO3作为硝化试剂后, 硝化收率没有明显提升; 采用硝化能力更强的硝硫混酸作为硝化试剂, 硝化效果也没有改善; 为了提高氮氧化物浓度, 采用95% HNO3/N2O4作为硝化试剂后, 硝化反应可以顺利进行, 收率明显提高至60%, 为了强化反应, 最终采用100% HNO3/N2O4/作为硝化体系, 利用高压反应釜, 在高压状态下反应8 h, 最终以87%的收率得到BDNAF.具体硝化体系研究结果见表 4.
Nitration system Yield/% 95% HNO3 30 98% HNO3 32 100% HNO3 33 95% HNO3/98% H2SO4 25 98% HNO3/98% H2SO4 25 100% HNO3/98% H2SO4 27 95% HNO3/N2O4(atmospheric pressure conditions) 60 95% HNO3/N2O4(in high pressure reactor) 85 100% HNO3/N2O4(in high pressure reactor) 87 1.4 FDNAF的结构表征及理论研究
为了确定目标化合物FDANF的结构, 本文利用量子化学密度泛函理论[24]对FDNAF的结构、13C NMR和15N NMR化学位移以及红外的吸收频率进行了理论研究, 进一步从理论角度解释了三者之间的关系, 完成了FDNAF的NMR信号和红外吸收频率的归属.
1.4.1 FDNAF的核磁表征及理论研究
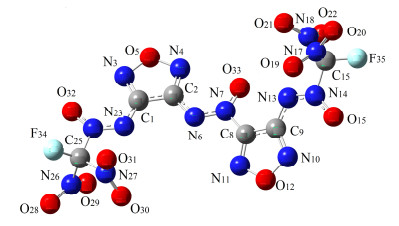
在优化FDNAF结构后(图 1), 用GIAO方法, 在不同基组水平上对分子中C和N原子的化学位移进行理论计算, 因计算所得为绝对屏蔽值, 其相对化学位移通过参比化合物(四硝基硅烷和硝基甲烷)的屏蔽值进行校准.对计算结果与实验数据进行先线性回归, 获得回归方程及相关系数, 具体数据见表 5和表 6.
 表 5
FDNAF的13C NMR实验结果与理论计算结果
Table 5.
Experimental and calculated chemical shifts of 13C NMR for FDNAF
表 5
FDNAF的13C NMR实验结果与理论计算结果
Table 5.
Experimental and calculated chemical shifts of 13C NMR for FDNAF
No. Exp. Cal. C8 154.023 164.157 C2 150.238 160.094 C1 149.131 (d, J=2 Hz) 158.509 C9 147.240 (d, J=2 Hz) 155.745 C25, C16 114.105 (d, J=319.9 Hz, 2C) C25: 122.939 C16: 122.850 Regression equation y=1.021x+6.3406 R2 0.9986  表 6
FDNAF的15N NMR实验结果与理论计算结果
Table 6.
Experimental and calculated chemical shifts of 15N NMR for FDNAF
表 6
FDNAF的15N NMR实验结果与理论计算结果
Table 6.
Experimental and calculated chemical shifts of 15N NMR for FDNAF
No. Exp. Calcd. N10 42.961 63.581 N3 37.183 55.887 N4 35.852 54.483 N11 33.585 51.791 N26 -38.854 -25.541 N27 -38.024 -26.026 N17 -38.375 -26.154 N18 -38.563 -28.886 N14 -66.752 -60.841 N7 -67.032 -64.240 N24 -68.413 -64.413 N6 -69.681 -75.184 N23 -71.630 -76.227 N13 -75.052 -79.985 Regression equation y=0.8453x-11.981 R2 R=0.9939 从表 5中可以看出化合物结构, 碳谱实测数据和理论数据三者直接的关系.值得注意的是:两个氟二硝甲基碳原子(C25和C16) 由于所处化学环境相似, 化学位移相近, 因此重叠出峰并被氟原子裂分为两个峰, 分别是δ 114.901和113.312, 从这两个碳原子的计算化学位移来看(C25为δ 122.939, C16为δ 122.850), 二者十分接近, 实际测量中很难将其分开, 验证了实验结果的合理性.从核磁图谱中可以看出, 和氟二硝甲基相近的两个呋咱碳原子C1和C9也被氟原子裂分, 由于这两个碳原子和氟原子所处距离较远, 偶合常数为2 Hz.
从相关系数上来看, 计算结果与实验值吻合较好.碳谱计算尤为准确, 最大误差小于10, 经回归后, 与实验结果相符程度非常高, 相关系数为0.997.与之相比, 氮谱误差更大, 这是因为理论计算时是在真空状态下仅考虑单个分子上的屏蔽效应, 而实际上, 由于氮元素的灵敏度较低, 需要在高浓度溶液中完成15N NMR测试, 故实验结果需要考虑分子间的相互作用.虽然氮谱略有误差, 但回归方程显示对比结果仍然比较理想, 相关系数高于0.99, 对指导氮谱指认与归属具有参考价值.综上所述, FDNAF的实验核磁化学位移和理论计算的结果相一致.
1.4.2 FDNAF的红外表征及理论研究
基于FDNAF的优化结构, 应用谐性力场计算获得了FDNAF的振动频率, 表 7列出了实验及计算得到的频率结果, 采用0.96作为谐性力场中的标度较正因子, 最后给出了FDNAF各基团红外吸收的归属结果.
Cal./cm-1 Exp./cm-1 Assignmenta 1560 1535 v(N23=N24) 1503 1493 v(C2=N6=N7=O33), δ(N7=C8=C9) 1665 1655 vas(O12=N18=O21) 1309 1346 vas(O19=N17=O20) 1279 1225 τ(C25-N, C16-N on nitro group) 1564 1541 v(N23=N24), v(N13=N14) 1311 1294 vas(O30=N27=O31), vas(O28=N25=O29) 1661 1619 vas(O12=N18=O21), vas(O19=N17=O20) 778 798 v(C25—N27), v(C25—N25), v(C16—N18), v(C16—N17) av: stretching; τ: twisting; as: antisymeemetry. FDNAF的红外吸收峰主要集中在700~1700 cm-1之间, 在1535, 1541 cm-1处的吸收带为多硝甲基氧化偶基中氧化偶氮基团的伸缩振动, 1493 cm-1处的吸收带为氧化偶氮呋咱中呋咱碳和氧化偶氮基共轭振动吸收, 1655, 1346, 1294, 1619 cm-1处的吸收带分别是四个硝基的N=O键伸缩振动吸收, 1225 cm-1处的吸收带为多硝甲基氧化偶氮基中C—N键的扭转吸收, 798 cm-1出的吸收带为硝基中的C—N键的伸缩振动引起的吸收带.结果表明, 计算结果和实验结果相吻合.
1.5 BNMAF, BDNAF, FDNAF的物化、爆轰性能
为了考察BNMAF, BDNAF和FDNAF的物化、爆轰性能, 利用量子化学中的密度泛函理论, 对化合物的性能进行理论计算研究, 考察三种化合物性能的变化规律, 结果列入表 8.
 表 8
BNMAF, BDNAF, FDNAF的部分物化、爆轰性能
Table 8.
Physicochemical properties and detonation performances of BNMAF, BDNAF and FDNAF
表 8
BNMAF, BDNAF, FDNAF的部分物化、爆轰性能
Table 8.
Physicochemical properties and detonation performances of BNMAF, BDNAF and FDNAF
Compound Density/ (g•cm-3) ΔfH(s, M, 298 K)Θ/(kJ•mol-1) Oxygen balancea/% Detonation velocity/ (m•s-1) Detonation pressure/GPa h50/cm BNMAF 1.84 727.16 -20.60 8793 35.39 23 BDNAF 1.94 660.44 0.00 9333 41.08 29 FDNAF 2.02 500.37 6.72 9735 44.90 36 RDX 1.80b 70.02b -21.61 8757b 34.7b 26c HMX 1.90b 75.39b -21.61 9100b 39.6b 29c CL-20 2.04c 394.50c -10.95 9660c 48.3c 27c aOxygen balance was calculated based on CO2; b Refs. [27~28]; cRefs. [29]~[30]. 采用密度泛函理论(DFT)的B3LYP方法[25], 在6-31G**基组水平上对化合物结构进行了全优化.采用Multwfn程序对各化合物的静电势进行统计分析, 获得静电势参数.采用Monte-Carlo法计算了100次三种分子的体积, 取其平均值为摩尔体积(Vm), 并利用Rice等提出的公式和参数进行校正(公式1), 获得化合物的密度(ρ).
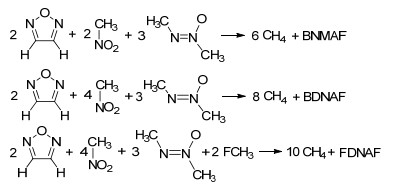
为了获得较准确的气相生成焓值, 设计了目标化合物的等键反应(Scheme 2), 利用反应焓变和其它小分子的气相生成焓值, 计算目标化合物的气相生成焓:其中等键反应方法涉及到的其它小分子化合物的气相生成焓值, 采用G3[26]方法按照原子化方案计算得出.化合物的升华焓利用Politzer等提出的公式(公式2) 和化合物的静电势参数计算得出, 进而求得固相生成焓(ΔfH(s, M, 298 K)Θ)(公式3).
将含能化合物的组成、密度和生成焓数据代入Kamlet-Jacobs公式(公式4、公式5), 可计算出理论爆速(D)和理论爆压(P).
分子结构中最弱键的键离解能(BDE)按照公式6进行计算, 以h50表示的撞击感度按照与静电势参数有关的经验公式(公式7) 进行计算.
从表 8中可以看出, 在单硝甲基氧化偶氮化合物BNMAF的基础上再引入硝基、氟原子后, 化合物的密度、爆速和爆压均依次显著提升.其中BDNAF, FDNAF的晶体密度均大于1.90 g•cm-3, 二者都是非常典型的高密度含能化合物, 其中FDNAF的密度已经超过了2.0 g•cm-3, 明显高于黑索金(RDX, 1.80 g•cm-3)和奥克托今(HMX, 1.90 g•cm-3), 与CL-20 (2.04 g•cm-3)相当.呋咱环自身的生成焓比较高, 以它为结构单元构建的含能化合物均具有较高的生成焓[25], 由表中结果可见, 3种化合物的生成焓均高于150 kJ•mol-1, 储存着较高化学能, 对于提高爆轰过程中的爆热很有帮助.爆速和爆压是含能化合物爆轰性能重要的表观参数, 受密度、生成焓、氧平衡以及分子组成的影响[23].化合物BDNAF和FDNAF的爆速均高于HMX (9100 m•s-1), 稍微低于CL-20 (9660 m•s-1), 两种化合物爆压均高于HMX (39.6 GPa). FDNAF的特性落高h50为36 cm, 在上述三种典型的多硝甲基氧化偶氮含能化合物中较稳定, 表现出良好的撞击感度性能.综上, 在呋咱母体结构上, 引入二硝甲基-ONN-氧化偶氮基和氟二硝甲基-ONN-氧化偶氮基团, 是一种设计、合成新型高能量密度含能化合物的有效途径.
1.6 BNMAF, BDNAF, FDNAF的热性能
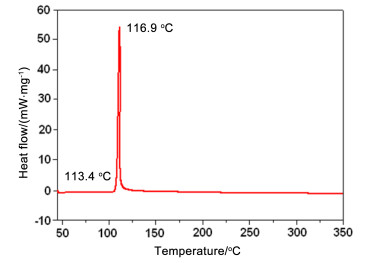
采用差示扫描量热法(DSC)对合成的三种典型多硝甲基氧化偶氮化合物BNMAF, BDNAF和FDNAF的热分解行为进行了研究, 采用TG对目标化合物热分解过程中的失重情况进行分析.实验条件为:动态氮气气氛、温度范围为10~400 ℃, 压力为0.1 MPa, 升温速率为10 ℃/min, 试样皿为铝盘.实验结果如图 2~4所示.
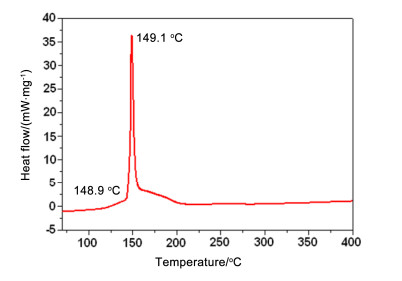
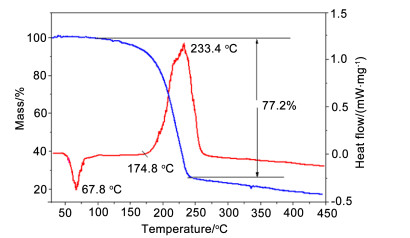
由图 2~4可见, BNMAF, BDNAF和FDNAF三者的热分解峰温依次升高. BNMAF的初始放热温度为113.4 ℃, 放热峰顶峰温度为116.9 ℃; BDNAF的初始放热温度为148.9 ℃, 放热顶峰温度为149.1 ℃, 两者放热峰形尖锐且相似, 分解时温度跨越小, 放热剧烈. 图 4中的DSC曲线显示:在57~77 ℃有一个较宽的吸热峰, 结合热重曲线在此温度范围没有失重, 因此, 此吸热峰应该是由化合物固液相变转化造成, 最高吸热峰峰温为67.8 ℃, DSC曲线显示, FDNAF在174.8 ℃开始分解, 相应TG也在此温度开始失重, 温度升高至233.4 ℃, 放热温度达到顶峰, 剧烈的失重过程也进行完毕, 整个分解过程失重约77.2%, 化合物热稳定性较好.综合图 2~4, 可以看出随着硝基、氟原子的依次引入, BNMAF, BDNAF和FDNAF的热稳定性依次增强, 可见, 多硝甲基-ONN-氧化偶氮基对化合物热稳定性较常见含能基团而言有着较为特殊的影响规律.
2 结论
本文合成了性能优异的含能化合物3, 3'-双(氟二硝甲基-ONN-氧化偶氮基)氧化偶氮呋咱(FDNAF), 采用红外、核磁、元素等手段完成了中间体及目标化合物结构表征.改进了水解合成方法, 反应时间由18 h的缩短至2 h, 且粗产品纯度达到93%.分别研究了温度和时间对溴化还原反应的影响, 在20 ℃条件下, 反应30 min, 溴化还原产物BDBAF收率达到最高为51.5%.探索了硝化反应条件, 选取100% HNO3/N2O4为硝化试剂, 在高压反应釜中, 以87%收率得到二硝甲基氧化偶氮含能化合物BDNAF.计算获得了FDNAF的碳谱、氮谱化学位移和红外吸收频率, 与实验测试结果吻合较好, 理论化学位移与实验值相关系数均大于0.99.全面研究了BNMAF、BDNAF和FDNAF三种含能化合物的物化、爆轰性能和热性能, 其中FDNAF理论密度2.02 g•cm-3、氧平衡6.72%、爆速9735 m•s-1、爆压44.9 GPa、分解峰温为233.4 ℃, 是一种综合性能突出的含能化合物.研究表明, 基于呋咱母体结构, 引入多硝甲基-ONN-氧化偶氮含能基团可显著提其能量和密度, 为进一步设计、合成结构新颖的高能量密度含能化合物提供了一条有效途径与借鉴.
3 实验部分
3.1 仪器与试剂
NEXUS 870型傅里叶变换红外光谱仪, 美国Nicolet公司; AV 500型(500 MHz)超导核磁共振仪, 瑞士BRUKER公司; AV Ⅲ HD (800 MHz)超导核磁共振仪, 瑞士BRUKER公司; 综合热分析仪, STA449型, 德国耐驰公司; Vario EL Ⅲ型自动微量有机元素分析仪, 德国Elementar gongsi; DSC-204示差扫描热量仪, 德国Netzsch公司; X-6型纤维熔点测定仪, 北京泰克仪器有限公司.
反应过程所使用的化学试剂1, 3-二溴-1, 3, 5-三嗪-2, 4, 6-三酮(DBI) (98%)、CH2Cl2、CH3CH2OH、浓HCl、液溴、KOH、硫脲、乙醚、醋酸、四氧化二氮、二氟化氙、无水乙腈是市售分析纯试剂.原料2, 2-二甲基-5-硝基-5-亚硝基-1, 3-二氧环己烷(DMNNDO)参照文献[16]的方法合成.
3.2 化合物的合成
3.2.1 3, 3'-双[α-(1, 3-二甲基-5-硝基-1, 3-二氧杂环己烷-5-基)-ONN-氧化偶氮基]氧化偶氮呋咱(BDDAF)的合成
20 ℃条件下, 在250 mL三颈烧瓶中, 加入1.9 g (10 mmol) 2, 2-二甲基-5-硝基-5-亚硝基-1, 3-二氧环己烷(DMNNDO)和65 mL二氯甲烷, 搅拌溶解后, 加入0.88 g (4.16 mmol)二氨基氧化偶氮呋咱(DAOAF)和4.3 g (15 mmol) 1, 3-二溴-1, 3, 5-三嗪-2, 4, 6-三酮(DBI), 在此温度下搅拌.薄层色谱(TLC)监测反应, 直至原料分解完毕(约13 h).室温下减压蒸出大部分二氯甲烷, 通过硅胶柱, 减压蒸馏除去溶剂, 晾干得2 g浅黄色固体, 收率为83%.用二氯甲烷/正己烷重结晶后, 得白色晶体. m.p. 118~120 ℃; 1H NMR (CDCl3, 500 MHz) δ: 1.48 (s, 3H, Me). 1.49 (d, J=2.5 Hz, 6H, Me), 1.51 (s, 3H, Me), 4.76~4.81 (m, 8H, CH2); 13C NMR (CDCl3, 125 MHz) δ: 21.7, 22.1, 23.7, 24.1 (Me), 62.3, 62.5 (CH2), 101.0, 101.1, 107.8, 108.1 (C), 148.5, 149.6, 149.6, 153.5 (furazane cycles); IR (KBr) ν: 3000, 2947, 2917, 1583, 1503, 1380, 1201 cm-1. Anal. calcd for C16H20N12O13: C 32.65, H 3.4, N 28.57; found C 32.57, H 3.303, N 28.22.
3.2.2 3, 3'-双[α-(1, 3-二羟基-2-硝基-异丙基)-ONN-氧化偶氮基]氧化偶氮呋咱(BDHAF)的合成
室温条件下, 在25 mL三颈烧瓶中, 加入0.2 g (0.34 mmol) BDDAF和10 mL乙醇, 搅拌并滴入3.5 mL浓盐酸, 加热至回流, 此温度下反应5 h, 真空除去挥发性物质油状产物, 用氯仿洗涤即获得0.17 g黄色油状产物, 收率约为100%, 无需纯化即可进行下一步反应. 1H NMR (Acetone-d6, 500 MHz) δ: 4.61 (s, 4H, CH2), 4.65 (s, 4H, CH2); 13C NMR (CDCl3, 125 MHz) δ: 60.5 (CH2), 114.8, 115.1 (C), 149.1, 150.5, 150.9, 154.8 (furazane cycles); IR (KBr) ν: 3000, 2947, 2917, 1583, 1503, 1380, 1201 cm-1.
3.2.3 3, 3'-双[α-(1, 1-二溴-硝甲基)-ONN-氧化偶氮基]氧化偶氮呋咱(BDBAF)的合成
将粗产品0.65 g (1.1 mmol) BDHAF溶于20 mL乙醚, 于6~10 ℃搅拌条件下滴入8 mL KOH (5%)溶液, 移去冰浴, 滴入液溴至溴的颜色不消失(约0.4 mL).室温反应30 min, 分液, 再次用KOH处理有机层至碱性, 再滴入液溴至溴颜色不再退去, 反应30 min, 分出有机相.依次用碳酸氢钠、水洗涤, 无水硫酸镁干燥, 过滤, 真空除去溶剂, 将所得产品溶于氯仿, 通过硅胶层, 浓缩有机溶剂, 向其中加入正己烷, 过滤, 干燥得0.4 g浅黄色固体, 收率为51.5%. m.p. 106~108 ℃; 13C NMR (CDCl3, 125 MHz) δ: 96.9, 97.2 (CBr2NO2), 148.5, 149.8, 150.0, 153.6 (furazane cycles); IR (KBr) ν: 1611, 1492, 1317, 1293 cm-1. Anal. calcd for C6Br4N12O9: C 10.24, N 23.88; found C 10.69, N 23.81.
3.2.4 3, 3'-双[单硝甲基-ONN-氧化偶氮基]氧化偶氮呋咱(BNMAF)的合成
将0.68 g (0.96 mmol) BDBAF溶于6 mL醋酸中, 滴入0.18 g硫脲4 mL水溶液, 20 ℃反应30 min, 用水稀释两次, 生成固体, 过滤、水洗、干燥, 得0.26 g白色固体, 收率为70%.分解温度: 113.4~116.9 ℃; 1H NMR (Acetone-d6, 500 MHz) δ: 7.14 (s, 2H, CH2), 7.23 (s, 2H, CH2); 13C NMR (Acetone-d6, 125 MHz) δ: 97.3, 97.4 (CH2), 149.4, 150.7, 151.1, 154.5 (furazane cycles); IR (KBr) ν: 3066, 2999, 1587, 1581, 1522, 1506, 1369 cm-1. Anal. calcd for C6H4N12O9: C 18.57, H 1.04, N 43.3; found C 18.61, H 0.98, N 43.50.
3.2.5 3, 3'-双(二硝甲基-ONN-氧化偶氮基)氧化偶氮呋咱(BDNAF)的合成
水浴条件下, 将0.1 g (0.25 mmol) BNMAF加入100% HNO3 (1.5 mL)溶液, 加入N2O4 (0.6 mL)在密封体系中于50 ℃反应8 h.反应完毕后, 将反应液冷却, 倒入冰中, 过滤、水洗、晾干得0.107 g白色固体, 收率为87%.分解温度: 149.1 ℃; 1H NMR (Acetone-d6, 500 MHz) δ: 9.36 (s, 2H, CH2); 13C NMR (Acetone-d6, 125 MHz) δ: 114.4 (CH), 148.4, 148.8, 150.7, 151.1 (furazane cycles); IR (KBr) ν: 3003, 1607, 1589, 1522, 1487, 1310 cm-1. Anal. calcd for C6H2N14O13: C 15.07, H 0.42, N 41.01; found C 15.24, H 0.46, N 41.32.
3.2.6 3, 3'-双(二硝甲基-ONN-氧化偶氮基)氧化偶氮呋咱钾盐(BDNAF-K)的合成
将0.1 g (0.21 mmol) BDNAF溶于5 mL乙醇, 加入0.023 g氢氧化钾粉末, 20 ℃反应40 min, 过滤, 干燥, 得棕色固体0.108 g, 收率94%. m.p. 151~154 ℃; 13C NMR (Acetone-d6, 125 MHz) δ: 124.6 (C-K), 150.6, 151.6, 152.5, 155.0 (furazane cycles); IR (KBr) ν: 1635, 1482, 1407, 1276, 1159 cm-1. Anal. calcd for C6K2N14O13 C 13.00, N 35.37; found C 13.28, N 35.39.
3.2.7 3, 3'-双(氟二硝甲基-ONN-氧化偶氮基)氧化偶氮呋咱(FDNAF)的合成
将0.1 g (0.21 mmol) BDNAF-K溶于4 mL无水乙腈中, 加入0.123 g二氟化氙, 20 ℃搅拌12 h.反应完毕后, 浓缩反应液, 水洗残留固体, 过滤, 得白色晶体状化合物0.05 g, 收率54%.分解温度: 174.3 ℃; 19F NMR (CDCl3-d6, 470.5 MHz) δ: -87.827 (t, 1F, CF), -87.480 (t, 1F, CF); 13C NMR (CDCl3-d6, 201 MHz) δ: 114.1 (d, J=319.9 Hz, 2C, CF), 147.2 (d, J=2 Hz, 2C), 149.1 (d, J=2 Hz, 2C), 150.2, 154.0 (furazane cycles); 15N NMR (CDCl3-d6, 201 MHz, 参照试剂: CH3NO2) δ: 42.94, 37.17, 35.84, 33.56 (NO2), -37.85, -38.03, -38.38, -38.56 (furazane cycles), -66.77, -67.12, -68.42, -69.77, -71.60, -75.07 (N2O); IR (KBr) ν: 1619, 1535, 1493, 1439, 1346, 1294 cm-1. Anal. calcd for C6F2N14O13 C 14.02, N 38.14; found C 13.93, N 38.02.
辅助材料(Supporting Information) 目标化合物3, 3'-双[α-(氟二硝甲基)氧化偶氮基]氧化偶氮呋咱(FDNAF)和各中间体的结构鉴定图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
张俊林, 肖川, 翟连杰, 王锡杰, 毕福强, 王伯周, 有机化学, 2016, 36, 1197. doi: 10.6023/cjoc201512024Zhang, J.-L.; Xiao, C.; Zhai, L.-J.; Wang, X.-J.; Bi, F.-Q.; Wang, B.-Z. Chin. J. Org. Chem. 2016, 36, 1197. doi: 10.6023/cjoc201512024
-
[2]
邱玲, 许晓娟, 肖鹤鸣, 含能材料, 2005, 13, 262. doi: 10.3969/j.issn.1006-9941.2005.04.018Qiu, L.; Xu, X.-J.; Xiao, H.-M. Chin. J. Energ. Mater. 2005, 13, 262. doi: 10.3969/j.issn.1006-9941.2005.04.018
-
[3]
庞思平, 申帆帆, 吕芃浩, 董凯, 张义迎, 孙成辉, 宋建伟, 赵信歧, 兵工学报, 2014, 5, 725. http://www.cqvip.com/QK/94928X/201405/49707142.htmlPang, S.-P.; Sheng, F.-F.; Lv, H.-F.; Dong, K.; Zhang, Y.-Y.; Sun, C.-H.; Song, J.-W.; Zhao, X.-Q. Acta Armamentarii 2014, 5, 725. http://www.cqvip.com/QK/94928X/201405/49707142.html
-
[4]
翟连杰, 王伯周, 霍欢, 李辉, 黄新萍, 刘宁, 樊学忠, 有机化学, 2013, 33, 1755. http://sioc-journal.cn/Jwk_yjhx/CN/Y2013/V33/I08/1755Zhai, L.-J.; Wang, B.-Z.; Huo, H.; Li, H.; Li, Y.-N.; Huang, X.-P.; Liu, N.; Fan, X.-Z. Chin. J. Org. Chem. 2013, 33, 1755. http://sioc-journal.cn/Jwk_yjhx/CN/Y2013/V33/I08/1755
-
[5]
Tang, Y.; Gao, H.; Parrish, D. A.; Shreeve, J. M. Chemistry (Weinheim an der Bergstrasse, Germany) 2015, 21(32), 11401.
-
[6]
Xu, C.; Bi, F. Q.; Zhang, M.; Li, Q.; Ding, K. W.; Ge, Z. X. Chin. J. Struct. Chem. 2015, 34, 1341.
-
[7]
Zhai, L. J.; Wang, B. Z.; Fan, X. Z.; Li, X. Z. Chin. J. Struct. Chem. 2014, 33, 1353. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=jghx201409014&dbname=CJFD&dbcode=CJFQ
-
[8]
Luk'yanov, O. A.; Pokhvisneva, G. V.; Ternikova, T. V. Russ. Chem. Bull. 2012, 61, 1783. doi: 10.1007/s11172-012-0245-9
-
[9]
Luk'yanov, O. A.; Salamonov, Y. B.; Struchkov, Y. T.; Burtsev, Y. N.; Viadimir, S. K. Mendeleev Commun. 1992, 2, 52. doi: 10.1070/MC1992v002n02ABEH000127
-
[10]
Luk'yanov, O. A.; Pokhvisneva, G. V.; Ternikova, T. V.; Shlykova, N. I.; Shagaeva, M. E. Russ. Chem. Bull. 2011, 60, 1703. doi: 10.1007/s11172-011-0254-0
-
[11]
Luk'yanov, O. A.; Pokhvisneva, G. V.; Ternikova, T. V.; Shlykova, N. I. Russ. Chem. Bull. 2012, 61, 360. doi: 10.1007/s11172-012-0050-5
-
[12]
Luk'yanov, O. A.; Parakhin, V. V.; Pokhvisneva, G. V.; Ternikova, T. V. Russ. Chem. Bull. 2012, 61, 355. doi: 10.1007/s11172-012-0049-y
-
[13]
Luk'yanov, O. A.; Parakhin, V. V. Russ. Chem. Bull. 2012, 61, 1582. doi: 10.1007/s11172-012-0210-7
-
[14]
Gottardi, W. Monatsh. Chem. 1968, 99, 815. doi: 10.1007/BF00901238
-
[15]
Luk'yanov, O. A.; Pokhvisneva, G. V.; Ternikova, T. V. Russ. Chem. Bull. 2015, 64, 137. doi: 10.1007/s11172-015-0832-7
-
[16]
Luk'yanov, O. A.; Salamonov, B. Y.; Bass, G. A.; Strelenko, Y. Bull. Acad. Sci. USSR, Div. Chem. Sci. 1991, 40, 93. doi: 10.1007/BF00959638
-
[17]
Luk'yanov, O. A.; Salamonov, B. Y.; Bass, G. A. Izv. Akad. Nauk, Ser. Khim. 1992, 10, 2400.
-
[18]
Luk'yanov, O. A.; Pokhvisneva, G. V.; Ternikova, T. V. Russian 2581050, 2016.
-
[19]
李洪珍, 周小清, 李金山, 黄明, 有机化学, 2008, 28, 1646. http://sioc-journal.cn/Jwk_yjhx/CN/Y2008/V28/I09/1646Li, H.-Z.; Zhou, X.-Q.; Li, J.-S.; Huang, M. Chin. J. Org. Chem. 2008, 28, 1646. http://sioc-journal.cn/Jwk_yjhx/CN/Y2008/V28/I09/1646
-
[20]
周彦水, 周诚, 王伯周, 李健康, 霍欢, 张叶高, 王锡杰, 罗义芬, 含能材料, 2011, 19, 509. doi: 10.3969/j.issn.1006-9941.2011.05.006Zhou, Y.-S.; Zhou, C.; Wang, B.-Z.; Li, J.-K.; H. H.; Zhang, Y.-G.; Wang, X.-J.; Luo, Y.-F. Chin. J. Energ. Mater. 2011, 19, 509. doi: 10.3969/j.issn.1006-9941.2011.05.006
-
[21]
李祥志, 王伯周, 李辉, 李亚南, 毕福强, 樊学忠, 有机化学, 2012, 32, 1975. http://sioc-journal.cn/Jwk_yjhx/CN/Y2012/V32/I10/1975Li, X.-Z.; Wang, B.-Z.; Li, H.; Li, Y.-N.; Bi, F.-Q.; Fan, X.-Z. Chin. J. Org. Chem. 2012, 32, 1975. http://sioc-journal.cn/Jwk_yjhx/CN/Y2012/V32/I10/1975
-
[22]
贾思媛, 张海昊, 周诚, 来蔚鹏, 李祥志, 王伯周, 有机化学, 2015, 35, 851. http://sioc-journal.cn/Jwk_yjhx/CN/Y2015/V35/I4/851Jia, S.-Y.; Zhang, H.-H.; Zhou, C.; Lai, W.-P.; Li, X.-Z.; Wang, B.-Z. Chin. J. Org. Chem. 2015, 35, 851. http://sioc-journal.cn/Jwk_yjhx/CN/Y2015/V35/I4/851
-
[23]
毕福强, 王玉, 王伯周, 张家荣, 张俊林, 翟连杰, 李祥志, 含能材料, 2016, 35, 851. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hncl201611006&dbname=CJFD&dbcode=CJFQBi, F.-Q.; Wang, Y.; Wang, B.-Z.; Zhang, J.-R.; Zhang, J.-L.; Zhai, L.-J.; Li, X.-Z. Chin. J. Energ. Chem. 2016, 35, 851(in Chi-nese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hncl201611006&dbname=CJFD&dbcode=CJFQ
-
[24]
王民昌, 毕福强, 张皋, 栾洁玉, 徐敏, 宁艳利, 樊学忠, 含能材料, 2016, 21, 473. http://www.cqvip.com/QK/90247X/201304/47009162.htmlWang, M.-C.; Bi, F.-Q.; Zhang, G.; Luan, J.-Y.; Xu, M.; Ning, Y.-L.; Fan, X.-Z. Chin. J. Energ. Mater. 2013. 21, 473. http://www.cqvip.com/QK/90247X/201304/47009162.html
-
[25]
Becke, A. D. J. Chem. Phys. 1993, 98, 5648.
-
[26]
Frisch, M. J.; Trucks, G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Dapprich, S., Gaussian 98, Revision A.7; Gaussian Inc., Pittsburgh, PA, 1998, 40.
-
[27]
吴雄, 龙新平, 何碧, 中国科学(B辑), 2008, 38, 1129. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=jbxk200812013&dbname=CJFD&dbcode=CJFQWu, X.; Long, X.-P.; He, B. Sci. China, B 2008, 38, 1129. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=jbxk200812013&dbname=CJFD&dbcode=CJFQ
-
[28]
Politzer, P.; Murray, J. S. Cent. Eur. J. Energy Mater. 2011, 8, 209.
-
[29]
Karakaya, P.; Sidhoum, M.; Christodoulatos, C.; Nicolich, S.; Balas, W. Hazard. Mater. 2005, 120, 183. doi: 10.1016/j.jhazmat.2005.01.001
-
[30]
Pospísil, M.; Vavra, P.; Concha, M. C.; Murray, J. S.; Politzer, P. J. Mol. Model. 2010, 16, 895. doi: 10.1007/s00894-009-0587-x
-
[1]
-
表 1 水解反应时间的影响
Table 1. Effect of reaction time on hydrolysis reaction
Reaction time/h Yield/% Puritya/% 1.5 98 85 2 99 93 3 98 88 4 98 80 6 97 56 10 98 48 14 97 38 a利用HPLC测试产品纯度, 测试条件为: C18硅胶柱, 25 ℃, 乙腈/水=9/1, λ=260 nm, v=1.0 mL/min. 表 2 溴化反应温度的影响
Table 2. Effect of reaction temperature on bromination reaction
Temperature/℃ Yield/% 0 35 10 47 20 30 40 52 48 31 表 3 溴化反应时间的影响
Table 3. Effect of reaction time on bromination reaction
Reaction time/min Yield/% 5 38 10 40 20 45 30 52 40 51 表 4 制备BDNAF硝化体系的选择
Table 4. Selection of nitration system to synthesize BDNAF
Nitration system Yield/% 95% HNO3 30 98% HNO3 32 100% HNO3 33 95% HNO3/98% H2SO4 25 98% HNO3/98% H2SO4 25 100% HNO3/98% H2SO4 27 95% HNO3/N2O4(atmospheric pressure conditions) 60 95% HNO3/N2O4(in high pressure reactor) 85 100% HNO3/N2O4(in high pressure reactor) 87 表 5 FDNAF的13C NMR实验结果与理论计算结果
Table 5. Experimental and calculated chemical shifts of 13C NMR for FDNAF
No. Exp. Cal. C8 154.023 164.157 C2 150.238 160.094 C1 149.131 (d, J=2 Hz) 158.509 C9 147.240 (d, J=2 Hz) 155.745 C25, C16 114.105 (d, J=319.9 Hz, 2C) C25: 122.939 C16: 122.850 Regression equation y=1.021x+6.3406 R2 0.9986 表 6 FDNAF的15N NMR实验结果与理论计算结果
Table 6. Experimental and calculated chemical shifts of 15N NMR for FDNAF
No. Exp. Calcd. N10 42.961 63.581 N3 37.183 55.887 N4 35.852 54.483 N11 33.585 51.791 N26 -38.854 -25.541 N27 -38.024 -26.026 N17 -38.375 -26.154 N18 -38.563 -28.886 N14 -66.752 -60.841 N7 -67.032 -64.240 N24 -68.413 -64.413 N6 -69.681 -75.184 N23 -71.630 -76.227 N13 -75.052 -79.985 Regression equation y=0.8453x-11.981 R2 R=0.9939 表 7 FDNAF红外实验结果与理论计算结果
Table 7. Experimental and calculated spectra of IR for FDNAF
Cal./cm-1 Exp./cm-1 Assignmenta 1560 1535 v(N23=N24) 1503 1493 v(C2=N6=N7=O33), δ(N7=C8=C9) 1665 1655 vas(O12=N18=O21) 1309 1346 vas(O19=N17=O20) 1279 1225 τ(C25-N, C16-N on nitro group) 1564 1541 v(N23=N24), v(N13=N14) 1311 1294 vas(O30=N27=O31), vas(O28=N25=O29) 1661 1619 vas(O12=N18=O21), vas(O19=N17=O20) 778 798 v(C25—N27), v(C25—N25), v(C16—N18), v(C16—N17) av: stretching; τ: twisting; as: antisymeemetry. 表 8 BNMAF, BDNAF, FDNAF的部分物化、爆轰性能
Table 8. Physicochemical properties and detonation performances of BNMAF, BDNAF and FDNAF
Compound Density/ (g•cm-3) ΔfH(s, M, 298 K)Θ/(kJ•mol-1) Oxygen balancea/% Detonation velocity/ (m•s-1) Detonation pressure/GPa h50/cm BNMAF 1.84 727.16 -20.60 8793 35.39 23 BDNAF 1.94 660.44 0.00 9333 41.08 29 FDNAF 2.02 500.37 6.72 9735 44.90 36 RDX 1.80b 70.02b -21.61 8757b 34.7b 26c HMX 1.90b 75.39b -21.61 9100b 39.6b 29c CL-20 2.04c 394.50c -10.95 9660c 48.3c 27c aOxygen balance was calculated based on CO2; b Refs. [27~28]; cRefs. [29]~[30]. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 2574
- HTML全文浏览量: 265


 下载:
下载:





 下载:
下载:

