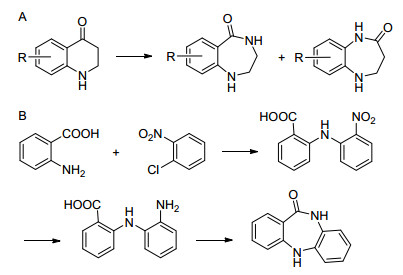
 图 图式1
文献已报道的合成路线
Figure 图式1.
Synthetic routes of the methods reported
图 图式1
文献已报道的合成路线
Figure 图式1.
Synthetic routes of the methods reported

Citation: Zhang Qingyang, Wang Xiaojian, Xiao Qiong, Yin Dali. One Pot Solvent-Free Synthesis of Benzodiazepinones Catalyzed by CuI[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 954-958. doi: 10.6023/cjoc201611020

CuI催化无溶剂一锅法合成苯二氮䓬酮类化合物
English
One Pot Solvent-Free Synthesis of Benzodiazepinones Catalyzed by CuI
-
Key words:
- solvent-free
- / one pot
- / CuI
- / benzodiazepinones
- / catalyzed-coupling reaction
-
与传统有机化学相比, 近年来, 绿色化学越来越受到人们的重视, 其不仅能够快速高效地合成目标化合物, 而且还具有条件温和、环境友好等优点[1].其中溶剂的绿色化备受关注, 如以水、离子液体等为溶剂的绿色合成方法[2]; 而最彻底的方法是无溶剂有机合成, 无溶剂反应具有污染小、成本低、反应时间短、操作简便等优点, 目前, 无溶剂反应已在化学和医药领域引起了广泛关注[3].含苯二氮䓬酮母核的化合物是一类非常重要的有机杂环化合物, 其很多衍生物具有良好的生物活性.例如, 二苯并二氮䓬酮类衍生物是一类非常重要的潜在的Chk-1 (Checkpoint kinase-1) 激活酶抑制剂[4]; 苯二氮䓬类衍生物可作为潜在的多巴胺受体抑制剂[5].因此, 探索合成苯二氮䓬酮化合物的方法具有重要的研究意义.
对于1, 4-苯二氮䓬酮环的构建, 最早的合成方法是苯并四氢喹啉酮环通过Schmidt反应扩环得到1, 4-苯二氮䓬酮环结构[6], 这种方法原料不易得、有副产物且收率较低 (Scheme 1A).目前常用的方法是选择性还原苯环上的硝基, 再进一步与苯甲酸类化合物缩合得到1, 4-苯二氮䓬酮环结构[7], 这种方法反应的条件比较剧烈, 需经过多步反应且产品收率也比较低 (Scheme 1B).近来, Wang等[8]报道了一种偶联方法, 它以邻氯苯甲酸和邻苯二胺为原料, 以氯苯为溶剂合成苯二氮䓬酮, 但得到的产品收率很低.
金属催化偶联反应为杂环的构建提供了重要的方法.与其他金属相比, Cu是一种价格低廉且低毒的金属, 却具有很好的催化活性.近年来, Cu催化的偶联反应得到了广泛应用[9]. 2004年, Buchwald课题组[10]报道了Cu催化的偶联串联反应合成杂环化合物, 此种方法往往只需一步反应即可构建杂环, 为构建杂环化合物提供了新的思路. 2006年Ma等[11]以β-羰基羧酸酯和N-三氟甲基邻碘苯胺为原料, 通过Cu催化偶联完成了不对称芳基化反应, 并进一步关环合成了吲哚酮类化合物.
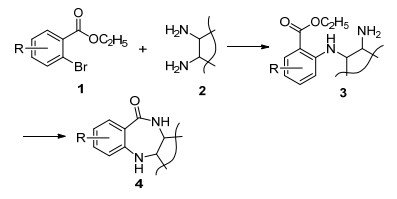
对于1, 4-苯二氮䓬酮环的合成, 以往的合成方法收率较低, 往往需要经过多步合成.经过前期研究[12], 我们构建以邻卤苯甲酸酯和邻苯二胺为原料, 通过偶联反应得中间体3, 进一步经过内酰胺化得到目标产物 (Scheme 2).此过程可以将两步合为一锅反应, 一次得到产品.基于此研究, 我们探索了一种环境友好且高效合成1, 4-苯二氮䓬酮的无溶剂绿色合成方法.
1 结果与讨论
最初研究时, 选择在不同溶剂环境下, 以2-溴苯甲酸乙酯和邻苯二胺为原料, CuI为催化剂探讨不同的反应条件.首先对比了水作为绿色溶剂和N, N-二甲基甲酰胺 (DMF), 1, 4-dioxane作为有机溶剂对反应的影响, 结果显示在这三种溶剂中产物收率不高 (表 1, Entries 1~3), 而当DMF作溶剂时, 没有得到产物 (表 1, Entry 1), 但令人欣喜的是以水作为溶剂时, 能够合成目标化合物 (表 1, Entry 3), 也为我们用绿色方法合成1, 4-苯二氮䓬酮提供了思路.分析水作为溶剂收率较低的原因, 可能是2-溴苯甲酸乙酯在碱性条件下水解造成的.随后以水作为溶剂, 选取了不同的有机碱或无机碱, 考察碱对反应的影响, 但各反应收率仍然没有明显的提高 (表 1, Entries 4~6), 而当没有碱参与反应时, 无产物生成 (表 1, Entry 7), 这说明碱是该反应发生必要的条件.而经进一步研究发现, 该实验在无溶剂的条件下, 以吡啶为碱, 反应能够得到较高的收率 (表 1, Entry 8).受到这个结果的鼓舞, 我们在无溶剂的条件下又观察不同种类的碱对反应的影响, 并且均得到了较高的收率 (表 1, Entries 9~11).最终, 发现在无溶剂情况下, 以CuI为催化剂、三乙胺 (TEA) 为碱, 能够高效合成产物4a的绿色合成方法 (表 1, Entry 11).

Entry Base (equiv.) Solvent Temp./℃ Product Yield/% 1 Cs2CO3 (2.0) DMF 120 4a — 2 Cs2CO3 (2.0) 1, 4-Dioxane 120 4a 35.3 3 Cs2CO3 (2.0) H2O 120 4a 25.5 4 K3PO4 (2.0) H2O 120 4a 31.5 5 TEA (2.0) H2O 120 4a 34.6 6 Pyridine (2.0) H2O 120 4a 28.6 7 None H2O 120 4a — 8 Pyridine (2.0) None 120 4a 67.5 9 Cs2CO3 (2.0) None 120 4a 63.2 10 DBU (2.0) None 120 4a 70.5 11 TEA (2.0) None 120 4a 83.6 12 TEA (2.0) None 80 4a 61.5 a Conditions: ethyl 2-bromobenzoate (1.0 mmol), ehtylenediamine (1.0 mmol), CuI (0.1 equiv.), base (2.0 mmol), 120 ℃, 10 h, Ar. 表 1 目标产物合成反应条件的优化a
Table 1. Optimization of reaction conditions在上述最优条件下, 我们研究了一系列不同芳香环取代基对反应的影响, 考察此方法反应底物的适用范围 (表 2).发现当苯环上有卤素取代时, 如氟、溴, 并没有影响金属催化偶联反应的进行, 且收率较高 (表 2, Entries 2~3);而以2-溴烟酸乙酯为原料, 与邻苯二胺反应也可以得到目标产物 (表 2, Entry 5), 而以2-溴-3-甲酸乙酯噻吩为原料, 没有得到相应的目标物; 当用脂肪族的邻二胺化合物, 如乙二胺、1, 2-环己二胺替代邻苯二胺时, 反应能够发生, 但收率均有不同程度的降低, 这说明此方法仍适用于脂肪族胺为底物的合成, 但芳香胺更利于反应的进行.当苯环上有甲氧基或者硝基取代时, 反应均能很好地发生 (表 2, Entries 7, 8, 10, 11).这说明无论苯环上连有供电子基还是吸电子基, 反应均能进行, 苯环上电子云密度的变化对反应收率影响很小.
 表 2
一系列不同芳香环取代基对反应的影响a
Table 2.
Synthesis of substituted benzodiazepinones from ethyl 2-bromobenzoates
表 2
一系列不同芳香环取代基对反应的影响a
Table 2.
Synthesis of substituted benzodiazepinones from ethyl 2-bromobenzoates
 表 2 一系列不同芳香环取代基对反应的影响a
表 2 一系列不同芳香环取代基对反应的影响a
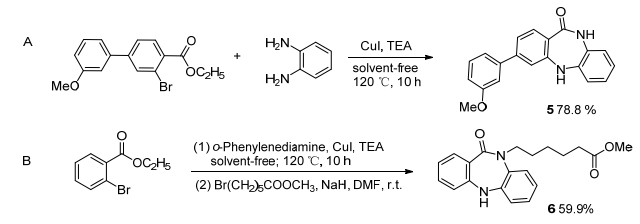
Table 2. Synthesis of substituted benzodiazepinones from ethyl 2-bromobenzoates综上所述, 此方法能用于不同结构类型和不同取代芳香二氮䓬酮类化合物的合成.受到此结果的鼓舞, 我们将此合成方法应用于了一些苯二氮䓬酮类的生物活性化合物的合成, 并取得满意的结果.化合物5是一类非常重要的潜在的Chk-1激活酶抑制剂[8], 它可通过抑制Chk-1就能够阻碍肿瘤细胞的自我修复, 从而达到增强杀伤肿瘤细胞的目的, 这类化合物具有很好的抗肿瘤活性.我们利用相应的原料, 采用本文的无溶剂的合成方法, 以78.8%的收率一步得到相应目标化合物 (Scheme 3A).而化合物6是一类苯二氮䓬酮结构的组蛋白去乙酰化酶抑制剂的重要中间体[13].组蛋白去乙酰化酶抑制剂具有干扰与组蛋白去乙酰化酶的功能, 其对肿瘤细胞迁移、侵袭、转移具有抑制作用, 已成为肿瘤靶向治疗的研究新热点.我们采用本文所述合成方法, 分两步得到了这类组蛋白去乙酰化酶抑制剂的重要中间体化合物6, 两步总收率59.9%(Scheme 3B).
2 结论
本文构建了一种无溶剂绿色高效, 一锅法合成1, 4-苯二氮䓬酮化合物的方法, 采用取代邻溴苯甲酸乙酯为起始原料与乙二胺、邻环己二胺及邻苯二胺反应, 发生金属催化偶联反应, 然后自然地进行分子内酰胺化, 一步合成取代苯并二氮杂䓬酮类化合物.该方法绿色环保, 操作简单, 收率较高, 且无需溶剂和配体, 只需催化量的CuI, 并能够用于对不同种类含有苯二氮䓬酮结构化合物的合成.我们将此合成方法应用于了一些含有苯二氮䓬酮结构的生物活性化合物的合成, 并取得满意的结果.此反应为合成苯二氮䓬酮衍生物提供了一种高效、绿色途径.
3 实验部分
3.1 仪器与试剂
1H NMR和13C NMR采用Varian Mercury 400或300, Inova-500, System-600型核磁共振仪测定, 所用溶剂为CDCl3和DMSO-d6, 以TMS为内标; 质谱仪采用Thermo LCQ Deca XP Max (ESI) 测定; 熔点测定仪采用Yanaco micrometer显微熔点测定仪 (温度未经校正).实验所用试剂均为市售分析纯试剂, 未进一步纯化处理.
3.2 实验方法
3.2.2 10N-6-己酸甲酯-5-氢-11H-二苯并[b, e][1, 4]二氮䓬-11-酮 (6) 的合成
氩气保护下, 将化合物4a (105 mg, 0.5 mmol) 溶解于干燥DMF中, 加入NaH (30 mg, 60%, 0.75 mmol).室温搅拌1 h, 然后向反应液中加入6-溴己酸甲酯 (125 mg, 0.6 mmol).反应液室温搅拌2 d, 然后加入H2O (10 mL).乙醚 (30 mL×3) 萃取, 无水Na2SO4干燥.柱层析[V(乙酸乙酯):V(石油醚)=20:80]得淡黄色固体, 收率59.9%[13]. 1H NMR (DMSO-d6, 300 MHz) δ: 7.80 (s, 1H), 7.59 (d, J=7.8 Hz, 1H), 7.32~7.27 (m, 2H), 7.12~7.03 (m, 4H), 6.94 (t, J=7.8 Hz, 1H), 3.97 (t, J=6.0 Hz, 2H), 3.53 (s, 3H), 2.20 (t, J=7.5 Hz, 2H), 1.46~1.40 (m, 4H), 1.27~1.24 (m, 2H); 13C NMR (100 MHz, DMSO-d6) δ: 173.19, 167.62, 152.06, 145.84, 133.26, 132.08, 131.91, 125.76, 124.97, 124.21, 123.54, 121.39, 120.58, 118.68, 51.14, 48.15, 33.17, 26.87, 25.34, 23.96; HRMS calcd for C20H23N2O3 339.1703, found 339.1700.
辅助材料 (Supporting Information)所合成化合物的1H NMR和13C NMR表征谱图数据.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.1 化合物4a~4k和5的合成
氩气保护下, 将2-溴苯甲酸乙酯 (276 mg, 1.0 mmol)、邻苯二胺 (108.2 mg, 1.0 mmol)、CuI (19 mg, 0.1 mmol) 和三乙胺 (TEA) (202 mg, 2.0 mmol) 加入封管中, 120 ℃反应10 h.向反应液中加入H2O 15 mL, 二氯甲烷 (30 mL×3) 萃取, 无水Na2SO4干燥.柱层析[V(乙酸乙酯):V(石油醚)=20:80]得淡黄色固体5, 10-二氢-11H-二苯并[b, e][1, 4]二氮䓬-11-酮 (4a) 175 mg, 收率83.6%. m.p. 250~253 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 9.82 (s, 1H), 7.82 (s, 1H), 7.68~7.65 (d, J=7.8 Hz, 1H), 7.35~7.29 (dt, J=7.8, 1.5 Hz, 1H), 7.00~6.85 (m, 6H); 13C NMR (DMSO-d6, 100 MHz) δ: 167.9, 150.4, 134.0, 133.2, 132.1, 129.8, 124.5, 122.9, 122.8, 121.3, 120.7, 119.8, 119.0; HRMS calcd for C13H11N2O 211.0866, found 211.0870.
化合物4a~4k和5的合成方法同化合物4a.
2-氟-5, 10-二氢-11H-二苯并[b, e][1, 4]二氮䓬-11-酮 (4b):淡黄色固体176 mg, 收率82.3%. m.p. 197~199 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 10.00 (s, 1H), 7.85 (s, 1H), 7.41~7.37 (dd, J=9.6, 3.0 Hz, 1H), 7.27~7.21 (dt, J=8.1, 3.0 Hz, 1H), 7.06~6.90 (m, 5H); 13C NMR (DMSO-d6, 100 MHz) δ: 166.8, 157.7, 155.4, 147.0, 140.2, 129.7, 124.7, 124.2, 124.2, 123.1, 121.46, 120.9, 120.8, 120.5, 120.3, 119.8, 117.3, 117.1; HRMS calcd for C13H10FN2O 229.0772, found 229.0769.
3-溴-5, 10-二氢-11H-二苯并[b, e][1, 4]二氮䓬-11-酮 (4c):淡黄色固体218 mg, 收率75.6%. m.p. 247~250 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 9.94 (s, 1H), 8.04 (s, 1H), 7.60~7.57 (d, J=8.4 Hz, 1H), 7.22 (s, 1H), 7.07~7.04 (d, J=8.4 Hz, 1H), 6.95 (s, 4H); 13C NMR (DMSO-d6, 100 MHz) δ: 166.9, 151.3, 138.7, 134.1, 129.5, 126.5, 124.6, 123.4, 123.4, 121.6, 121.4, 121.2, 119.89; HRMS calcd for C13H10BrN2O 288.9971, found 288.9968.
2-甲基-5, 10-二氢-11H-二苯并[b, e][1, 4]二氮䓬-11-酮 (4d):淡黄色固体176 mg, 收率78.8%. m.p. 225~227 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 9.80 (s, 1H), 7.69 (s, 1H), 7.48 (s, 1H), 7.16~7.14 (d, J=8.1 Hz, 1 H), 6.99~6.88 (m, 5H), 2.20 (s, 3H); 13C NMR (DMSO-d6, 100 MHz) δ: 168.0, 148.1, 140.4, 133.9, 131.9, 129.8, 129.5, 124.4, 122.7, 122.7, 121.2, 119.6, 119.1, 19.9; HRMS calcd for C14H13N2O 225.1022, found 225.1023.
6, 11-二氢-5H-苯并[b]吡啶[2, 3-e][1, 4]二氮䓬-5-酮 (4e):淡黄色固体145 mg, 收率68.8%. m.p. 247~250 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 9.94 (s, 1H), 8.04 (s, 1H), 7.60~7.57 (d, J=8.4 Hz, 1H), 7.22 (s, 1H), 7.07~7.04 (d, J=8.4 Hz, 1H), 6.95 (s, 4H); 13C NMR (DMSO-d6, 100 MHz) δ: 166.9, 151.3, 138.7, 134.1, 129.5, 126.5, 124.6, 123.4, 123.4, 121.6, 121.4, 121.2, 119.9; HRMS calcd for C13H10BrN2O 288.9971, found 288.9968.
1, 2, 3, 4-四氢-5H-苯并[e][1, 4]二氮䓬-5-酮 (4f):收率55.6%. m.p. 135~137 ℃; 1H NMR (CDCl3, 300 MHz) δ: 7.98~7.95 (d, J=8.4 Hz, 1H), 7.23~7.21 (t, J=6.9 Hz, 1H), 6.81~6.76 (t, J=7.5 Hz, 1H), 6.61~6.59 (d, J=8.1Hz, 1H), 3.59~3.56 (m, 2H), 3.52~3.50 (m, 2H), 1.79~1.74 (m, 1H); 13C NMR (CDCl3, 125 MHz) δ: 172.0, 145.8, 133.1, 132.7, 118.4, 118.0, 117.7, 49.0, 42.0; HRMS calcd for C9H10N3O3 208.0717, found 208.0719.
7-硝基-1, 2, 3, 4-四氢-5H-苯并[e][1, 4]二氮䓬-5-酮 (4g):收率60.2%. m.p. 143~145 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 8.70 (s, 1H), 8.32 (s, 1H), 8.09 (s, 1H), 7.95~7.92 (d, J=9.0 Hz, 1H), 6.77~6.74 (d, J=9.0 Hz, 1H), 3.45 (s, 2H), 3.31 (s, 2H); 13C NMR (DMSO-d6, 100 MHz) δ: 168.1, 152.2, 136.1, 131.7, 127.0, 118.8, 114.9, 47.7, 41.2; HRMS calcd for C8H10N3O 164.0818, found 164.0819.
7-甲氧基-1, 2, 3, 4-四氢-5H-苯并[e][1, 4]二氮䓬-5-酮 (4h):固体93 mg, 收率48.5%. m.p. 152~154 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 7.99 (s, 1H), 7.21 (s, 1H), 6.84~6.82 (d, J=6.0 Hz, 1H), 6.66~6.63 (d, J=8.7 Hz, 1H), 5.99 (s, 1H), 3.64 (s, 3H), 3.33~3.30 (m, 2H), 3.22 (s, 2H); 13C NMR (DMSO-d6, 100 MHz) δ: 170.3, 150.7, 141.9, 121.0, 120.2, 118.2, 114.8, 55.7, 48.9, 41.7; HRMS calcd for C10H13N2O2 193.0972, found 193.0972.
(5aR, 9aS)-5, 5a, 6, 7, 8, 9, 9a, 10-六氢-11H-二苯并[b, e]-[1, 4]二氮䓬-11-酮 (4i):淡黄色固体139 mg, 收率64.6%. m.p. 226~228 ℃; 1H NMR (CD3OD, 300 MHz) δ: 7.62~7.60 (d, J=5.7 Hz, 1H), 7.18~7.14 (t, J=5.7 Hz, 1H), 6.72~6.68 (m, 2H), 3.60 (s, 1H), 3.48~3.46 (d, J=5.7 Hz, 1H), 1.79~1.74 (m, 1H), 1.71~1.54 (m, 5H), 1.46~1.32 (m, 1H), 1.34~1.32 (m, 1H); 13C NMR (CD3OD, 125 MHz) δ: 173.4, 148.3, 133.6, 132.0, 120.1, 119.3, 61.25, 52.3, 31.7, 29.5, 23.6, 22.5; HRMS calcd for C13H17N2O 217.1335, found 217.1334.
(5aR, 9aS)-2-硝基-5, 5a, 6, 7, 8, 9, 9a, 10-六氢-11H-二苯并[b, e][1, 4]二氮䓬-11-酮 (4j):淡黄色固体203 mg, 收率77.7%. m.p. 232~234 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 8.70 (s, 1H), 8.26 (s, 1H), 7.96~7.93 (d, J=7.8 Hz, 1H), 7.68 (s, 1H), 6.90~6.87 (d, J=8.7 Hz, 1H), 3.66 (s, 1H), 3.49 (s, 1H), 1.82 (s, 1H), 1.59 (s, 5H), 1.37 (s, 2H); 13C NMR (DMSO-d6, 100 MHz) δ: 166.8, 152.2, 136.4, 131.0, 127.0, 118.9, 115.1, 57.1, 51.4, 30.6, 29.2, 21.8; HRMS calcd for C13H16N3O3 262.1186, found 262.1186.
(5aR, 9aS)-2-甲氧基-5, 5a, 6, 7, 8, 9, 9a, 10-六氢-11H-二苯并[b, e][1, 4]二氮䓬-11-酮 (4k):淡黄色固体165 mg, 收率66.8%. m.p. 215~217 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 7.90 (s, 1H), 7.09 (s, 1H), 6.85~6.82 (m, 1H), 6.75~6.73 (m, 1H), 5.39 (s, 1H), 3.66 (s, 3H), 3.48 (s, 1H), 3.31 (s, 1H), 1.73~1.70 (m, 1H), 1.59~1.49 (m, 5H), 1.35~1.34 (m, 1H), 1.24 (s, 1H); 13C NMR (DMSO-d6, 100 MHz) δ: 170.0, 152.2, 141.3, 123.2, 120.9, 119.8, 114.2, 60.2, 55.7, 50.6, 30.8, 28.7, 23.0, 21.4; HRMS calcd for C14H19N2O2 247.1441, found 247.1445.
3-(3-甲氧苯基)-5, 10-二氢-11H-二苯并[b, e][1, 4]二氮䓬-11-酮 (5):淡黄色固体65 mg, 收率78.3%. m.p. 200~202 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 9.83 (s, 1H), 7.93 (s, 1H), 7.76~7.73 (d, J=8.4 Hz, 1H), 7.40~7.37 (t, J=7.5 Hz, 1H), 7.29 (s, 1H), 7.20~7.15 (m, 3H), 6.99~6.90 (m, 5H), 3.82 (s, 3H); 13C NMR (DMSO-d6, 100 MHz) δ: 167.52, 159.75, 150.59, 144.62, 140.41, 139.48, 132.86, 130.11, 129.69, 124.47, 122.98, 121.46, 121.25, 119.78, 119.07, 118.91, 117.08, 113.91, 112.05, 55.20; HRMS calcd for C20H17N2O2 317.1285, found 317.1286.
-
-
[1]
(a) Shen, S.-C.; Sun, X.-W.; Lin, G.-Q. Green Chem. 2013, 15, 896.
(b) DeSimone, J. M. Science 2002, 297, 799.
(c) Jeon, S. J.; Li, H.; Walsh, P. J. J. Am. Chem. Soc. 2005, 127, 16416. -
[2]
(a) Poliakoff, M.; Anastas, P. Nature 2001, 413, 257.
(b) Gross, R. A.; Kalra, B. Science 2002, 297, 803.
(c) Wang, D.; Li, L.; Li, N.; Gao, T. T.; Hou, S. H.; Chen, B. H. Green Chem. 2010, 12, 45. -
[3]
(a) Singh, M. S.; Nagaraju, A.; Verma, G. K.; Shukla, G.; Verma, R. K.; Srivastava, A.; Raghuvanshi, K. Green Chem. 2013, 15, 954.
(b) Horváth, I. T. Green Chem. 2008, 10, 1024. -
[4]
(a) Sanchez, Y.; Wong, C.; Thoma, R. S.; Richman, R.; Wu, Z.; Piwnica-Worms, H.; Elledge, S. J. Science 1997, 277, 1497.
(b) Xiao, Z.; Chen, Z.; Gunasekera, A. H.; Sowin, T. J.; Rosenberg, S. H.; Fesik, S.; Zhang, H. J. Biol. Chem. 2003, 278, 21767. -
[5]
Hussenether, T.; Hübner, H.; Gmeiner, P.; Troschütz, R. Bioorg. Med. Chem. 2004, 12, 2625. doi: 10.1016/j.bmc.2004.03.023
-
[6]
Misiti, D.; Gatta, F.; Landi-Vittory, R. J. Heterocycl. Chem. 1971, 8, 231. doi: 10.1002/(ISSN)1943-5193
-
[7]
(a) Cortés, E. C.; Islas, P. M.; Romero, M. O. Z. J. Heterocycl. Chem. 1996, 33, 1723.
(b) Bunce, R. A.; Schammerhorn, J. E. J. Heterocycl. Chem. 2006, 37, 1031. -
[8]
Wang, L.; Sullivan, G. M.; Hexamer, L. A.; Hasvold, L. A.; Thalji, R.; Przytulinska, M.; Tao, Z. F.; Li, G.; Chen, Z.; Xiao, Z.; Gu, W. Z.; Xue, J.; Bui, M. H.; Merta, P.; Kovar, P.; Bouska, J. J.; Zhang, H.; Park, C.; Stewart, K. D.; Sham, H. L.; Sowin, T. J.; Rosenberg, S. H.; Lin, N. H. J. Med. Chem. 2007, 50, 4162. doi: 10.1021/jm070105d
-
[9]
(a) Liu, Y.-Y.; Wan, J.-P. Org. Biomol. Chem. 2011, 9, 6873.
(b) Liu, Y.-Y.; Wan, J.-P. Chem. Asian J. 2012, 7, 1488. -
[10]
Klapars, A.; Parris, S.; Anderson, K. W.; Buchwald, S. L. J. Am. Chem. Soc. 2004, 126, 3529. doi: 10.1021/ja038565t
-
[11]
Xie, X.; Chen, Y.; Ma, D. J. Am. Chem. Soc. 2006, 128, 16050. doi: 10.1021/ja066991j
-
[12]
Zhang, Q. Y.; Wang, X.-J.; Tian, Y.-L.; Qi, J.-G.; Li, C.; Yin, D.-L. Chin. Chem. Lett. 2013, 24, 825. doi: 10.1016/j.cclet.2013.04.049
-
[13]
Binaschi, M.; Boldetti, A.; Gianni, M.; Maggi, C. A.; Gensini, M.; Bigioni, M.; Parlani, M.; Giolitti, A.; Fratelli, M.; Valli, C.; Mineko, T.; Garattini, E. ACS Med. Chem. Lett. 2010, 1, 411. doi: 10.1021/ml1001163
-
[1]
-
表 1 目标产物合成反应条件的优化a
Table 1. Optimization of reaction conditions

Entry Base (equiv.) Solvent Temp./℃ Product Yield/% 1 Cs2CO3 (2.0) DMF 120 4a — 2 Cs2CO3 (2.0) 1, 4-Dioxane 120 4a 35.3 3 Cs2CO3 (2.0) H2O 120 4a 25.5 4 K3PO4 (2.0) H2O 120 4a 31.5 5 TEA (2.0) H2O 120 4a 34.6 6 Pyridine (2.0) H2O 120 4a 28.6 7 None H2O 120 4a — 8 Pyridine (2.0) None 120 4a 67.5 9 Cs2CO3 (2.0) None 120 4a 63.2 10 DBU (2.0) None 120 4a 70.5 11 TEA (2.0) None 120 4a 83.6 12 TEA (2.0) None 80 4a 61.5 a Conditions: ethyl 2-bromobenzoate (1.0 mmol), ehtylenediamine (1.0 mmol), CuI (0.1 equiv.), base (2.0 mmol), 120 ℃, 10 h, Ar. 表 2 一系列不同芳香环取代基对反应的影响a
Table 2. Synthesis of substituted benzodiazepinones from ethyl 2-bromobenzoates

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 11
- 文章访问数: 1297
- HTML全文浏览量: 151


 下载:
下载:


 下载:
下载:

