
Citation: Huang Ling, Zhu Zheng, Cao Tianhua, Lei Xueying, Gong Jiuhan, Guo Shengmei, Cai Hu. Rapid, Practical and Efficient Synthesis of Enol Phosphates from β-Keto Esters and Phosphites[J]. Chinese Journal of Organic Chemistry, 2017, 37(6): 1571-1576. doi: 10.6023/cjoc201611018

由β-酮酯和亚磷酸酯快速、实用和有效地合成烯醇酯
-
关键词:
- 烯醇磷酸酯
- / β-酮酯
- / Atherton-Todd反应
English
Rapid, Practical and Efficient Synthesis of Enol Phosphates from β-Keto Esters and Phosphites
-
Key words:
- enol phosphate
- / β-keto ester
- / Atherton-Todd reaction
-
烯醇磷酸酯作为一种非常重要的结构单元广泛存在于生物活性分子和天然产物中.此外, 由于磷酸酯基团可以进行有效的官能团转换, 因此烯醇磷酸酯在有机合成领域中也扮演着重要角色.例如, 利用烯醇磷酸酯的交叉偶联反应实现碳-碳键的构建和通过不对称氢化反应来实现分子的手性烷基化[1, 2].基于此, 烯醇磷酸酯的合成吸引了大量的关注, 一系列的有效合成方法也被开发出来.通常, 合成方法主要通过强碱有机锂使底物脱氢形成烯醇化合物, 然后采用氯代磷酸烷基酯淬灭该烯醇化物而得到目标产物[3].然而, 氯代磷酸酯对水分敏感且不容易获得, 并且需要在低温下反应且具有很差的官能团相容性和能量效率, 同时伴有竞争性副反应.因此, 开发一种快速、实用和区域选择性制备烯醇磷酸酯的方法就显得相当重要[4].最近, Kerr课题组[4a]报道了一例通过使用以碳中心的碱和N, N'-二甲基丙烯基脲(DMPU)为促进剂的环己酮与芳基甲酮的膦酸化反应.该反应在室温条件下具有很高的选择性. Ding课题组[4b]发明了一种在二异丙基氨基锂(LDA)存在下利用Atherton-Todd反应实现芳香酮的膦酸化反应.另外, Lee课题组[4c]利用金为催化的二苯基磷酸酯与炔的加成实现了烯醇磷酸酯的制备, 并且可以通过催化剂调节实现二苯基磷酸酯对炔的选择性加成. Li研究小组[4d]报道了以碱引发的α-芳基氧苯乙酮与膦酸酯的串联反应得到烯醇磷酸酯. Xiao课题组[4e]采用Micheal加成反应将4-氧代-烯酸酯化合物实现烯醇磷酸酯的合成.然而, 令人困惑的是, 非常重要的合成单元β-酮酯在温和条件下的膦酸化报道较少[6].在此, 我们报道了温和条件下利用Atherton-Todd反应实现β-酮酯的烯醇磷酸酯化, 该反应可为烯醇磷酸酯的构建提供替代方法.
1 结果与讨论
我们选择3-氧-3-苯基丙酸乙酯(1a)和磷酸二乙酯(2a)作为模型底物优化反应条件.如表 1所示, 当反应以CCl4, CH3CN为溶剂, 温度在80 ℃并使用有机碱, 如Et3N和吡啶时, 反应12 h后(表 1, Entries 1~2), 没有目标产物的生成.这意味着有机碱不能促进这个反应的进行.较弱的无机碱, 例如NaHCO3和Na2CO3也不能促进反应的进行(表 1, Entries 3~4).而当反应在其他条件不变下(表 1, Entry 5), 加入NaOH产生少量的目标产物.受此启发, 强碱如CS2CO3, CH3ONa, CH3CH2ONa和t-BuOLi的加入可使反应的产率提高到30%和50%之间(表 1, Entries 6~9).而在该反应检测发现t-BuOK是相对较好的碱, 可以使反应得到产率为66%的产物(表 1, Entry 10).接下来, 我们研究了溶剂对反应的影响.当二氯甲烷(DCE)、二甲亚砜(DMSO)、N, N'-二甲基甲酰胺(DMF)、N, N'-二甲基乙酰胺(DMA)和甲苯用作溶剂时, 反应仅仅产生痕量的目标产物(表 1, Entries 11~15).乙醚(EA)、二氧六环或四氢呋喃(THF)可以较好地促进反应, 但相对于CH3CN用作溶剂时差(表 1, Entries 16~18).温度对反应的影响结果表明:反应在室温下表现良好, 而当温度升高时反应却不能很好地进行(表 1, Entries 19~21).当缩短反应时间, 反应的产率反而有所上升, 反应时间减少到30 min时, 产物的产率可以增加至76%(表 1, Entry 23).可能的原因是产物在强碱和水的作用下缓慢地发生逆反应.随着时间的延长, 部分产物转化为原料.在一系列仔细研究后, 我们确定了最优的反应条件如下: 1a (0.5 mmol), 2a (1.0 mmol), t-BuOK (0.6 mmol), CCl4(1.5 mmol)在CH3CN (2 mL)为溶剂时在室温下反应30 min.

在优化的反应条件下, 我们检查了反应的适用范围, 结果如表 2所示, 首先, 我们对芳香族酮酯的适用性进行了考察.当3-(2, 4-二甲基苯基)-3-氧代丙酸乙酯(1b)为底物时, 反应可以得到产率68%的相应产物.在该反应中, 芳基环上具有卤素基团的底物可以得到适中产率的目标产物.例如, 当1c, 1d, 1e用于反应时, 相应产物的产率分别为71%, 69%和64%.苯基上具有间位取代基的底物被发现对反应的影响较小, 如底物1f和1g可分别获得62%, 60%产率的所需产物(3f, 3g).而当使用3-(4-硝基苯基)-3-氧代丙酸乙酯作为底物时, 反应不能很好地进行, 仅得到32%的产物(3h).此外直链β-酮酯如1i, 1j, 1k在该反应中也有良好的适用性, 其分别产生46%, 44%和40%的相应产物(3i, 3j, 3k).接下来, 将各种磷酸酯替代2a加入到反应中, 反应也顺利地进行, 并以中等的产率转化成所需的产物.例如, 磷酸二丁酯能以69%的产率得到所需产物(3o).值得注意的是, 二苯基氧磷也具有良好的耐受性, 可以得到63%产率的产物3q.另外, 含杂原子的直链β-酮酯也能参与该类反应的转化.当含硫底物如3-氧代-4-(对甲苯基硫代)丁酸乙酯参与该反应时, 反应得到产率为43%目标产物(3r).含氮底物如4-[甲基(苯基)氨基]-3-氧代丁酸乙酯得到产率为37%对应产物(3s).
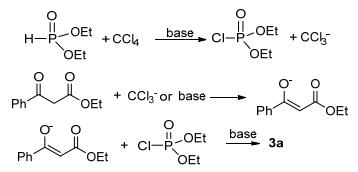
基于先前的报道[1, 4], 我们提出了如Scheme 1所示的反应的机理.首先, 在碱存在下, 亚磷酸二烷基酯和CCl4的反应形成氯代磷酸酯和CCl3-.其次, 酮酯在CCl3-或强碱的作用下转化为烯醇中间体, 随后烯醇中间体和氯代磷酸酯发生偶联反应, 从而获得目标产物.
2 结论
综上所述, 我们发现了一种快速且实用地合成烯醇磷酸酯的方法.该方法利用Atherton-Todd反应由β-酮酯合成烯醇磷酸酯, 条件温和且反应可以在30 min内完成.反应底物不仅包含芳香族β-酮酯也包含烷基β-酮酯.这为烯醇磷酸酯的合成提供了新型和替代方法.
3 实验部分
3.1 仪器与试剂
实验所用溶剂使用前均按照处理溶剂的标准方法进行, 碱、四氯化碳、磷酸酯和酮酯均为市售.板层析使用GF254硅胶, 柱层析使用200~300目硅胶, 吸附样品使用60~100目粗硅胶, 展开剂为石油醚(60~90 ℃)和乙酸乙酯(V:V=10:1), 1H NMR及13C NMR检测仪器为Bruker DRX-600及Agilent 400核磁共振仪. TMS作为内标, CDCl3作溶剂.
3.2 氮气条件烯醇磷酸酯化合物的一般方法
将β-酮酯(0.5 mmol)、t-BuOK (0.6 mmol)、亚磷酸二烷基酯(1.0 mmol)和CCl4 (1.5 mmol)的混合物在CH3CN中于室温下搅拌30 min.将反应溶液用水洗涤, 然后通过乙酸乙酯萃取三次.有机层在减压下浓缩, 留下粗产品, 将其通过硅胶柱色谱纯化.
3-[(二乙氧基磷酰基)氧代]-3-苯基丙烯酸乙酯(3a):无色液体, 产率73%. 1H NMR (400 MHz, CDCl3) δ: 7.59 (d, J=7.3 Hz, 2H), 7.33 (d, J=7.4 Hz, 3H), 5.92 (s, 1H), 4.20~4.04 (m, 6H), 1.25 (td, J=7.1, 2.4 Hz, 3H), 1.19 (t, J=6.3 Hz, 6H); 13C NMR (101 MHz, CDCl3) δ: 130.64, 128.40, 126.93, 106.53, 64.72, 60.20, 15.94, 14.21;31P NMR (162 MHz, CDCl3) δ: -7.86.
3-[(二乙氧基磷酰基)氧基]-3-(2, 4-甲氧基苯基)丙烯酸甲(3b):黄色液体, 产率63%.1H NMR (400 MHz, CDCl3) δ: 7.20 (d, J=7.4 Hz, 1H), 6.94 (d, J=10.3 Hz, 2H), 5.48 (s, 1H), 4.06~3.84 (m, 4H), 3.68 (s, 3H), 2.32 (s, 3H), 2.25 (s, 3H), 1.17~1.04 (m, 6H); 13C NMR (101 MHz, CDCl3) δ: 164.22 (d, J=1.9 Hz, 1H), 158.62 (d, J=7.4 Hz, 1H), 140.21 (s, 2H), 136.82 (s, 1H), 131.16, 129.54, 126.23, 108.43, 64.47, 51.30, 21.24, 19.92, 15.85;31P NMR (162 MHz, CDCl3) δ: -8.05.
3-(4-溴苯基)-3–[(二乙氧基磷酰基)氧基]丙烯酸甲酯(3c):黄色液体, 产率61%. 1H NMR (400 MHz, CDCl3) δ: 7.50~7.43 (m, 4H), 5.94 (d, J=6.8 Hz, 1H), 4.20~4.01 (m, 4H), 3.74~3.67 (m, 3H), 1.22 (dd, J=9.8, 3.9 Hz, 6H); 13C NMR (101 MHz, CDCl3) δ: 131.75, 128.41, 125.39, 106.42, 64.95, 51.53, 16.02; 31P NMR (162 MHz, CDCl3) δ: -7.73
3-(4-氯苯基)-3-[(二乙氧基磷酰基)氧基]丙烯酸甲酯(3d):浅黄色液体, 产率59%. 1H NMR (400 MHz, CDCl3) δ: 7.54 (d, J=8.4 Hz, 2H), 7.31 (d, J=8.5 Hz, 2H), 5.92 (s, 1H), 4.18~4.06 (m, 4H), 3.71 (s, 3H), 1.22 (t, J=7.0 Hz, 6H); 13C NMR (101 MHz, CDCl3) δ: 136.99, 128.78, 128.22, 106.37, 64.94, 51.52, 16.02;31P NMR (162 MHz, CDCl3) δ: -7.75.
3-[(二乙氧基磷酰基)氧基]-3-(4-氟苯基)丙烯酸甲酯(3e):浅黄色液体, 产率54%. 1H NMR (400 MHz, CDCl3) δ: 7.59 (dd, J=6.7, 3.8 Hz, 2H), 7.07~6.97 (m, 2H), 5.88 (s, 1H), 4.20~4.03 (m, 4H), 3.74~3.67 (m, 3H), 1.25~1.16 (m, 6H); 13C NMR (101 MHz, CDCl3) δ: 129.12, 115.75, 115.53, 105.89, 64.88, 51.44, 15.99;31P NMR (162 MHz, CDCl3) δ: -7.77.
3-[(二乙氧基磷酰基)氧基]-3-(3-甲氧基苯基)丙烯酸甲酯(3f):无色液体, 产率52%. 1H NMR (400 MHz, CDCl3) δ: 7.23~7.18 (m, 1H), 7.15 (d, J=7.8 Hz, 1H), 7.10 (s, 1H), 6.88 (d, J=7.9 Hz, 1H), 5.91 (s, 1H), 4.08 (tt, J=15.3, 7.8 Hz, 4H), 3.73 (s, 3H), 3.68 (s, 3H), 1.18 (t, J=6.7 Hz, 6H); 13C NMR (101 MHz, CDCl3) δ: 164.44, 159.53, 156.89, 135.25, 129.53, 119.33, 116.80, 112.16, 106.19, 64.81, 55.34, 51.43, 15.98;31P NMR (162 MHz, CDCl3) δ: -7.84.
3-(3-溴苯基)-3-[(二乙氧基磷酰基)氧基]丙烯酸甲酯(3g):黄色液体, 产率50%.1H NMR (400 MHz, CDCl3) δ: 7.74 (s, 1H), 7.50 (dd, J=5.2, 3.7 Hz, 2H), 7.20 (d, J=5.1 Hz, 1H), 5.93 (s, 1H), 4.20~4.05 (m, 4H), 3.71 (t, J=5.0 Hz, 3H), 1.26~1.18 (m, 6H); 13C NMR (101 MHz, CDCl3) δ: 164.11, 155.54~155.27, 135.91, 133.68, 129.98, 125.50, 122.59, 107.05, 64.95, 51.55, 16.00;31P NMR (162 MHz, CDCl3) δ: -7.83
3-[(二乙氧基磷酰基)氧基]-3-(硝基苯基)丙烯酸乙酯(3h):黄色液体, 产率32%. 1H NMR (400 MHz, CDCl3) δ: 8.21~8.13 (m, 2H), 7.66~7.57 (m, 2H), 6.17 (d, J=4.9 Hz, 1H), 4.10 (dt, J=12.1, 6.1 Hz, 4H), 4.04~3.97 (m, 2H), 1.26 (dt, J=12.1, 3.5 Hz, 6H), 1.14~1.07 (m, 3H); 13C NMR (101 MHz, CDCl3) δ: 130.17, 123.02, 109.08, 101.76, 65.18, 60.77, 16.00, 13.98;31P NMR (162 MHz, CDCl3) δ: -7.45
3-[(二乙氧基磷酰基)氧基]-2-丁烯酸异丙酯(3i):无色液体, 产率32%. 1H NMR (400 MHz, CDCl3) δ: 5.22 (s, 1H), 4.95 (dd, J=11.9, 5.7 Hz, 1H), 4.24~4.14 (m, 4H), 2.09 (s, 3H), 1.30 (td, J=6.1, 1.1 Hz, 6H), 1.18~1.15 (m, 6H); 13C NMR (101 MHz, CDCl3) δ: 163.11, 157.69, 105.84, 66.96, 64.76, 21.85, 21.58, 16.02;31P NMR (162 MHz, CDCl3) δ: -8.61.
3-[(二乙氧基磷酰基)氧基]-2-丁烯酸叔丁酯(3j):无色液体, 产率34%. 1H NMR (400 MHz, CDCl3) δ: 5.23 (d, J=9.5 Hz, 1H), 4.24 (dd, J=14.6, 7.3 Hz, 4H), 2.12 (d, J=8.8 Hz, 3H), 1.45 (d, J=10.0 Hz, 9H), 1.35 (dd, J=15.4, 7.1 Hz, 6H); 13C NMR (101 MHz, CDCl3) δ: 156.69, 107.59~106.95, 80.02, 64.85~64.50, 28.14, 21.48, 16.01;31P NMR (243 MHz, CDCl3) δ: -7.82.
3-[(二乙氧基磷酰基)氧基]-4-甲氧基-2-丁烯酸甲酯(3k):无色液体, 产率30%.1H NMR (400 MHz, CDCl3) δ: 5.97 (d, J=6.1 Hz, 1H), 4.50 (d, J=6.0 Hz, 2H), 4.16 (dd, J=13.3, 6.6 Hz, 4H), 3.66 (d, J=6.3 Hz, 3H), 3.33 (d, J=6.3 Hz, 3H), 1.36~1.25 (m, 6H); 13C NMR (101 MHz, CDCl3) δ: 165.91, 161.14, 108.29, 67.75, 64.99, 58.43, 51.64, 16.01;31P NMR (162 MHz, CDCl3) δ: -8.00.
3-[(二甲基磷酰基)氧基]-3-苯基丙烯酸乙酯(3l):黄色液体, 产率66%.1H NMR (400 MHz, CDCl3) δ: 7.58 (d, J=7.0 Hz, 2H), 7.35 (t, J=7.7 Hz, 3H), 5.94 (s, 1H), 4.17 (q, J=7.1 Hz, 2H), 3.75 (s, 3H), 3.72 (s, 3H), 1.25 (t, J=7.1 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 163.93, 156.88, 133.85, 130.84, 128.57, 126.79, 106.49, 60.29, 55.17, 14.21;31P NMR (162 MHz, CDCl3) δ: -5.35.
3-[(二异丁氧基磷酰基)氧基]-3-苯基丙烯酸甲酯(3m):黄色液体, 产率63%.1H NMR (400 MHz, CDCl3) δ: 7.66 (d, J=4.5 Hz, 2H), 7.39 (d, J=6.1 Hz, 3H), 6.00 (d, J=5.7 Hz, 1H), 4.29~4.18 (m, 2H), 3.88 (dd, J=14.1, 6.1 Hz, 4H), 1.89 (dd, J=12.7, 6.3 Hz, 2H), 1.36~1.28 (m, 3H), 0.89 (t, J=5.9 Hz, 12H); 13C NMR (101 MHz, CDCl3) δ: 134.04, 130.65, 128.43, 126.89, 106.54, 74.39, 60.22, 28.99, 18.51, 14.24;31P NMR (243 MHz, CDCl3) δ: -7.04.
3-[(二异丙基磷酰基)氧基]-3-苯基丙烯酸酯(3n):浅黄色液体, 产率62%.1H NMR (400 MHz, CDCl3) δ: 7.65 (d, J=7.2 Hz, 2H), 7.37 (d, J=6.4 Hz, 3H), 5.98 (s, 1H), 4.74 (dd, J=10.9, 5.1 Hz, 2H), 4.22 (dd, J=12.5, 5.5 Hz, 2H), 1.33~1.27 (m, 9H), 1.21~1.15 (m, 6H); 13C NMR (101 MHz, CDCl3) δ: 164.11, 156.68, 134.04, 130.55, 128.30, 127.05, 106.57, 73.60, 60.20, 23.62, 23.35, 14.23;31P NMR (162 MHz, CDCl3) δ: -9.47.
3-[(二甲基磷酰基)氧基]-3-苯基丙烯酸乙酯(3o):浅黄色液体, 产率62%.1H NMR (400 MHz, CDCl3) δ: 7.67 (t, J=5.8 Hz, 2H), 7.47~7.34 (m, 3H), 6.00 (d, J=5.9 Hz, 1H), 4.30~4.20 (m, 2H), 4.18~4.03 (m, 4H), 1.66~1.55 (m, 4H), 1.37~1.26 (m, 7H), 0.94~0.84 (m, 6H); 13C NMR (101 MHz, CDCl3) δ: 130.61, 128.39, 126.91, 106.54, 68.38, 60.18, 32.16, 18.52, 14.21, 13.49;31P NMR (243 MHz, CDCl3) δ: -6.96.
3-[(双(苄氧基)磷酰基)氧基]-3-苯基丙烯酸酯(3p):浅黄色液体, 产率52%.1H NMR (400 MHz, CDCl3) δ: 7.64 (d, J=6.2 Hz, 2H), 7.33 (t, J=23.6 Hz, 13H), 6.04 (d, J=7.1 Hz, 1H), 5.15~5.04 (m, 4H), 4.26~4.14 (m, 2H), 1.32~1.25 (m, 3H); 13C NMR (101 MHz, CDCl3) δ: 130.75, 128.60~128.25, 127.89, 126.94, 106.62, 69.96, 60.28, 14.20;31P NMR (162 MHz, CDCl3) δ: -19.82.
3-[(苯基磷酰基)氧基]-3-苯基丙烯酸酯(3q):白色液体, 产率53%. 1H NMR (400 MHz, CDCl3) δ: 7.88 (dd, J=13.5, 6.4 Hz, 4H), 7.51~7.20 (m, 11H), 5.70 (d, J=7.6 Hz, 1H), 4.03 (dd, J=15.3, 7.2 Hz, 2H), 1.17~1.09 (m, 3H); 13C NMR (101 MHz, CDCl3) δ: 164.12, 158.47, 134.58, 132.29, 130.88, 130.55, 129.50, 128.53~127.87, 127.69, 106.66, 60.09, 14.16;31P NMR (162 MHz, CDCl3) δ: 31.90.
3-[(二乙氧基磷酰基)氧代]-4-(对甲苯基硫醇)-2-丁烯酸乙酯(3r):黄色液体, 产率43%. 1H NMR (400 MHz, CDCl3) δ: 7.30 (d, J=8.1 Hz, 2H), 7.11 (d, J=7.9 Hz, 2H), 5.36 (s, 1H), 4.29 (ddd, J=7.7, 6.9, 3.5 Hz, 4H), 4.12 (q, J=7.1 Hz, 2H), 3.75 (d, J=0.5 Hz, 2H), 2.32 (s, 3H), 1.36 (td, J=7.1, 1.1 Hz, 6H), 1.24 (d, J=7.1 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 163.34, 156.38, 137.71, 131.88, 129.85, 107.31, 107.23, 65.07, 65.01, 60.04, 39.26, 29.68, 21.09, 16.07, 16.00, 14.16;31P NMR (162 MHz, D2O) δ: -8.04.
3-[(二乙氧基磷酰基)氧基]-4-[甲基(苯基)氨基]-2-丁烯酸乙酯(3s):浅黄色液体, 产率37%.1H NMR (400 MHz, CDCl3) δ: 7.37 (d, J=5.7 Hz, 2H), 6.91~6.80 (m, 3H), 5.61 (s, 1H), 4.41 (p, J=7.2 Hz, 4H), 4.31 (s, 2H), 4.24 (q, J=7.1 Hz, 2H), 3.14 (s, 3H), 1.50 (t, J=7.1 Hz, 6H), 1.35 (t, J=7.1 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 163.76, 163.74, 157.71, 157.64, 148.17, 129.26, 117.36, 112.02, 104.51, 104.44, 65.08, 65.02, 60.05, 55.65, 55.64, 38.54, 16.12, 16.05, 14.15;31P NMR (162 MHz, D2O) δ: -7.26.
辅助材料(Supporting Information) 所有新化合物的1H NMR, 13C NMR和31P NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Lindhard, A. T.; Gøgsig, T. M.; Skrystrup, T. J. Org. Chem. 2009, 74, 135.
(b) Hayashi, T.; Fujiwa, T.; Okamoto, Y.; Katsuro, Y.; Kumada, M. Synthesis 1981, 12, 1001.
(c) Lu, Q.; Chen, J.; Liu, C.; Huang, Z. Peng, P. Wang, H.; Lei, A. RSC Adv. 2015, 5, 24494.
(d) Wang, H.; Lu, Q.; Qian, C.; Liu, C.; Liu, W.; Chen, K.; Lei, A. Angew. Chem., Int. Ed. 2016, 55, 1094.
(e) Hansen, A. L.; Ebran, J. P.; Gøgsig, T. M.; Skrystrup, T. Chem. Commun. 2006, 4137.
(f) Gauthier, D.; Beckendorf, S.; Lindhard, A. T.; Gøgsig, T. M.; Skrystrup, T. J. Org. Chem. 2009, 74, 3536.
(g) Cahiez, G.; Gager, O. Synthesis 2008, 16, 2636.
(h) Hansen, A. L.; Ebran, J. P.; Gøgsig, T. M.; Skrystrup, T. J. Org. Chem. 2007, 72, 6464.
(i) Sato, M.; Takai, K.; Oshima, K.; Nozaki, H. Tetrahedron Lett. 1981, 22, 1609. -
[2]
(a) Cheruku, P.; Diesen, J.; Andersson, P. G. J. Am. Chem. Soc. 2008, 130, 5595.
(b) Zhang, W.; Zhang, X. J. Org. Chem. 2007, 72, 1020.
(c) Tang, W.; Liu, D.; Zhang, X. Org. Lett. 2003, 5, 205.
(d) Panella, L.; Feringa, B. L.; de Vries, J. G.; Minnaard, A. J. Org. Lett. 2005, 7, 4177.
(e) Li, W.; Zhang, Z.; Xiao, D.; Zhang, X. Tetrahedron Lett. 1999, 40, 6701.
(f) Cheruku, P.; Gohil, S.; Andersson, P. G. Org. Lett. 2007, 9, 1659.
(g) Meng, X.; Li, Y.; Xu, D. Tetrahedron: Asymmetry 2009, 20, 1402.
(h) Biosca, M.; Paptchikhine, A.; Pàmies, O.; Andersson, P. G.; Diéguez, M. Chem. Eur. J. 2015, 21, 3455. -
[3]
(a) Boger, D. L. In Modern Organic Synthesis, TSRL Press, La Jolla, CA, 1999, pp. 147~206.
(b) Mekelburger, H. B.; Wilcox, C. S. Comprehensive Organic Synthesis, Vol. 2, Pergamon, Oxford, 1991, pp. 99~131.
(c) Carruthers, W.; Coldham, I. Modern Methods of Organic Synthesis, Cambridge University Press, Cambridge, 2004, pp. 9~19.
(d) Moinizadeh, N.; Klemme, R.; Kansy, M.; Zimmer, R. Reissig, H.-U. Synthesis 2013, 45, 2752.
(e) Scarpi, D.; Bartali, L.; Casini, A.; Occhiato, E. G. Eur. J. Org. Chem. 2013, 1306.
(f) Sernissi, L.; Petrovic, M.; Scarpi, D.; Guarna, A.; Trabocchi, A.; Bianchini, F.; Occhiato, E. G. Chem. Eur. J. 2014, 20, 1118. -
[4]
(a) Kerr, W. J.; Lindsay, D. M.; Patel, V. K.; Rajamanickama, M. Org. Biomol. Chem. 2015, 13, 10131.
(b) Ding, Y.; Wang, W.; Liu, Z. Phosphorus, Sulfur Silicon Relat. Elem. 1996, 118, 113.
(c) Lee, P. H.; Kim, S.; Park, A.; Chary, B. C.; Kim, S. Angew. Chem., Int. Ed. 2010, 49, 6806.
(d) Song, R.-J.; Liu, Y.-Y.; Wu, J.-C.; Xie, Y.-X.; Deng, G.-B.; Yang, X.-H.; Liu, Y.; Li, J.-H. Synthesis 2012, 44, 1119.
(e) Zhu, X.-Y.; Chen, J.-R.; Lu, L.-Q.; Xiao, W.-J. Tetrahedron 2012, 68, 6032.
(f) Chary, B. C.; Kim, S.; Shin, D.; Lee, P. H. Chem. Commun. 2011, 47, 7851.
(g) Barrientos Astigarraga, R. E.; Castelani, P.; Sumida, C. Y.; Zukerman Schpector, J.; Comasseto, J. V. Tetrahedron 2002, 58, 1051. -
[5]
(a) Kim, J.; De. Castro, A. K.; Lim, M.; Rhee, H.; Tetrahedron 2010, 66, 3995.
(b) Sun, P.; Wu, Y.; Yang, T.; Wu, X.; Xu, J.; Lin, A.; Yao, H. Adv. Synth. Catal. 2015, 357, 2469.
(c) Wang, Z.; Yin, G.; Chen. A.; Hu, S.; Wu, A. Synth. Commun. 2007, 37, 4399.
(d) Supurgibekov, M. B.; Surya Prakash, G. K.; Nikolaev, V. A. Synthesis 2013, 45, 1215.
(e) Zhao, Y.; Zhao, J.; Zhou, Y.; Lei, Z.; Li, L.; Zhang, H. New J. Chem. 2005, 29, 769.
(f) Li, H.; He, Z.; Guo, X.; Li, W.; Zhao, X.; Li, Z. Org. Lett. 2009, 11, 4176.
(g) Liu, W.; Liu, J. D.; Nishihara, O. Y.; Guo, X.; Li, Z. Org. Lett. 2011, 13, 6272.
(h) Ariger, M. A.; Carreira, E. M. Org. Lett. 2012, 14, 4522.
(i) Koukabi, N.; Kolvari, E.; Zolfigol, M. A.; Khazaei, A.; Shaghasemi, B. S.; Fasahati, B. Adv. Synth. Catal. 2012, 354, 2001. -
[6]
(a) Guo, S.; Lu, L.; Gong, J.; Zhu, Z.; Xu, F.; Wei, Z.; Cai, H. Org. Biomol. Chem. 2015, 13, 4426.
(b) Guo, S.; Zhu, Z.; Lu, Lin, Zhang, W.; Gong, J.; Cai, H. Synlett 2015, 26, 543.
(c) Guo, S.; Gong, J.; Lu, L.; Zhu, Z.; Cai, H. Chin. J. Org. Chem. 2015, 35, 1348.
(d) Gong, J.; Zhu, Z.; Lu, L.; Guo, S.; Cai, H. Chin. J. Org. Chem. 2015, 35, 1917.
(e) Lu, L.; Guo, S.; Xiong, Q.; Liu, S.; Li, X.; Cai, H. Synthesis 2014, 46, 2445. -
[7]
(a) Atherton, F. R.; Todd, A. R. J. Chem. Soc. 1947, 674.
(b) Atherton, F. R.; Openshaw, H, T.; Todd, A. R. J. Chem. Soc. 1945, 660.
(c) Georgiev, E. M.; Kaneti, J.; Troev, K.; Roundhill, D. M. J. Am. Chem. Soc. 1993, 115, 10964.
(d) Le Corre, S. S; Berchel, M.; Couthon-Gourvès H.; Haelters, J.-P.; Haffrès, P.-A. Beilstein J. Org. Chem. 2014, 10, 1166.
-
[1]
-
表 1 烯醇酯化合物合成的条件优化
Table 1. Optimization of the reaction conditions

表 2 烯醇酯化合物合成的底物拓展a
Table 2. Scope of the substrates

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 18
- 文章访问数: 3227
- HTML全文浏览量: 1034


 下载:
下载:
 下载:
下载:

