
Citation: Zhang Mingdi, Liu Renrong, Gao Jianrong, Jia Yixia. Nickel-Catalyzed Intramolecular Addition of Aryl Bromides to C=O Bonds[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 652-657. doi: 10.6023/cjoc201610009

镍催化芳基溴化物对羰基的分子内加成反应
English
Nickel-Catalyzed Intramolecular Addition of Aryl Bromides to C=O Bonds
-
Key words:
- nickel
- / addition reaction
- / aryl bromide
- / dehydration reaction
- / indole
-
有机卤化物对羰基的直接加成是构建碳-碳键、获得醇类化合物的有效方法之一.传统的方法是将卤代烃制备成活泼的有机金属试剂与羰基化合物发生亲核加成反应, 如Barbier反应、Grignard反应等.活泼的有机镁、铝、锌、锂等亲核性有机金属试剂与羰基化合物反应, 可便利地获得一系列醇类化合物.然而, 这些有机金属试剂需预先制备, 且对氧气和水十分敏感, 同时反应活性高, 限制了反应中敏感基团的存在, 影响了这些方法在有机合成中的应用.因此, 发展过渡金属催化的卤代烃对醛、酮等羰基化合物的直接加成的Grignard-类型反应, 避免活泼有机金属试剂的预先制备, 提高反应中敏感官能团的兼容性, 具有重要的意义.尽管Nozaki-Hiyama-Kishi反应通过现场生成亲核性有机铬中间体, 实现了卤代烃对醛的加成反应, 然而, 该反应需要使用有毒的铬试剂, 且底物局限于醛类化合物[1].
近年来, 有机化学家发现低价过渡金属对芳基卤化物发生氧化加成后得到的有机过渡金属中间体具有一定的亲核性, 可对极性碳-杂原子重键化合物发生加成反应, 并能在还原试剂作用下再生催化剂实现催化循环.其中, 钯催化的芳香卤化物对羰基的加成反应得到了深入研究[2], 尤其通过分子内加成反应为环状化合物的构建提供了新的方法[3].而较为廉价的镍催化剂在这类反应中也表现出较好的催化活性.在镍催化剂及还原剂条件下, 芳香卤化物顺利与醛、酮及异腈酸酯等极性化合物发生反应, 得到相应加成产物[4].然而, 分子内镍催化的卤代烃对羰基化合物的加成构建环状化合物的研究并不多[5]. 2011年, 我们分别以零价镍Ni (COD)2和二价Ni (dppe) Br2为催化剂, 以及二甲基锌或锌粉为还原剂, 实现了氯苯、溴苯对酮酰胺C=O键的分子内加成反应, 发展了3-羟基-2-吲哚酮类化合物的有效合成方法[5a].随后, 该催化体系被成功应用于烯基溴化物对酮酰胺的分子内加成反应[5b].在本工作中我们进一步研究了活性较低的芳基酮的反应, 发现在以Ni (dppe) Br2为催化剂、锌粉为还原剂的条件下, 在乙二醇二甲醚溶剂中芳基溴化物对羰基的分子内加成反应能够顺利发生, 而产物3-羟基吲哚啉在反应条件下易发生脱水作用生成一系列3-取代吲哚衍生物, 从而为重要的杂环化合物吲哚的合成提供了新方法.
1 结果与讨论
1.1 反应条件优化
首先, 我们以化合物1a为标准底物对反应条件进行优化.如表 1所示, 初步结果表明:以10 mol% Ni (dppe) Br2为催化剂, 2.5 equiv.锌粉为还原剂, 在四氢呋喃溶剂中100 ℃下反应48 h后, 反应以62%的收率得到产物N-甲基-3-苯基吲哚 (2a, 表 1, Entry 1).随后的溶剂实验表明:在极性溶剂乙腈、N, N-二甲基甲酰胺、甲醇及1, 4-二氧六环中, 反应能顺利发生但产物收率均低于60%, 而在非极性溶剂甲苯中几乎未能观察到产物2a(表 1, Entries 2~8);当以乙二醇二甲醚为溶剂时, 产物收率与在四氢呋喃中相当 (表 1, Entry 7);此外, 反应在四氢呋喃与乙腈的混合溶剂中也未能获得更好的结果 (表 1, Entry 8).当以溴化镍与联吡啶的络合物为催化剂时, 反应在上述较佳溶剂四氢呋喃和乙二醇二甲醚中均获得更低的收率 (表 1, Entries 9~10).令人高兴的是, 当将锌粉的投料量降低为1.5 equiv.时, 反应在四氢呋喃中的收率得到明显提高, 可以75%的收率获得目标产物2a (Entry 11), 而在乙二醇二甲醚溶剂中反应收率最高达84% (表 1, Entry 13).基于以上实验, 我们确定较优的条件为以10 mol% Ni (dppe) Br2为催化剂、1.5 equiv.锌粉为还原剂, 在乙二醇二甲醚溶剂中100 ℃条件下反应.

Entry Cat. Zn/equiv. Solvent Yieldb/% 1 Ni (dppe) Br2 2.5 THF 62 2 Ni (dppe) Br2 2.5 CH3CN 57 3 Ni (dppe) Br2 2.5 Toluene Trace 4 Ni (dppe) Br2 2.5 DMF 26 5 Ni (dppe) Br2 2.5 MeOH 31 6 Ni (dppe) Br2 2.5 Dioxane 51 7 Ni (dppe) Br2 2.5 DME 61 8 Ni (dppe) Br2 2.5 THF/CH3CN (V:V=7:1) 59 9 Ni (bpy) Br2 2.5 THF 32 10 Ni (bpy) Br2 2.5 DME 36 11 Ni (dppe) Br2 1.5 THF 75 12 Ni (dppe) Br2 1.5 Dioxane 76 13 Ni (dppe) Br2 1.5 DME 84 a化合物1a(0.2 mmol)、催化剂 (10 mol%, 0.02 mmol)、锌粉 (0.3~0.5 mmol)、溶剂 (2.0 mL); b分离收率. 表 1 反应条件优化a
Table 1. Optimization of the reaction conditions1.2 加成反应的底物拓展
在上述较优条件下 (表 1, Entry 13), 我们对反应底物进行了拓展.首先, 对于羰基相连的芳环取代基进行了研究, 发现反应能兼容一系列取代基.如表 2所示, 无论是带有供电子基还是吸电子基的底物都能顺利发生分子内加成反应获得吲哚产物.然而, 取代基的电子效应对反应有明显影响.带有供电子基 (如甲氧基和甲基) 底物的反应收率明显优于含吸电子基 (如卤素和三氟甲基) 底物的反应 (2b~2c, 2e~2g vs. 2h~2j), 其中对甲氧基取代产物2e的收率最高达90%, 而含氟、氯、三氟甲基的产物2h~2j的收率介于38%~67%之间.取代基的位阻效应对反应也有一定的影响, 邻甲基及邻甲氧基产物 (2d, 2g) 的收率相对于对位取代基产物均有明显下降.此外, 稠环2-萘基及杂芳基噻吩的底物也能顺利发生反应, 并以较好的收率获得相应产物2k及2l.进一步将底物氮原子上的保护基由甲基变换为苄基时, 反应亦能顺利发生, 并以75%的收率获得目标产物2m.值得注意的是, 当羰基α-位带有甲基时, 反应也能顺利进行且以良好的收率获得2, 3-二取代吲哚产物2n.
 表 2 加成反应底物拓展a
表 2 加成反应底物拓展a
Table 2. Substrate scope of the reaction1.3 反应机理探讨
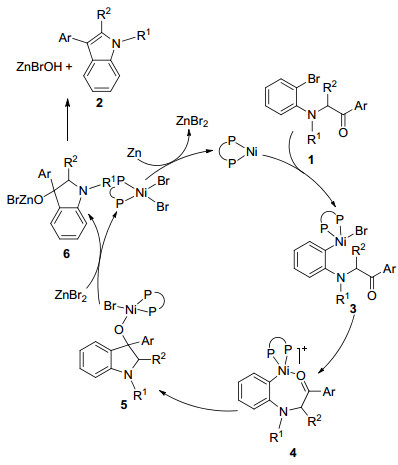
基于文献[4a]研究, 我们提出了Scheme 1所示的可能反应机理.二价镍催化剂首先经锌粉还原后生成零价镍及溴化锌, 随后零价镍与底物1芳基溴化物发生氧化加成反应而获得中间体3, 经中间体4后芳基对羰基C=O双键发生加成得到中间体5.中间体5与溴化锌经转金属化反应得到产物前体6, 并再生二价镍催化剂完成催化循环.中间体6脱去ZnBrOH后得到最终产物吲哚2.
2 结论
研究了镍催化的分子内溴苯对羰基的加成反应.利用Ni (dppe) Br2为催化剂, 在乙二醇二甲醚溶剂中, 以锌粉为还原剂, 通过分子内Grignard类型加成反应获得3-羟基吲哚啉中间体, 经原位脱水反应得到一系列3-取代吲哚化合物, 为取代吲哚的合成提供了一种新方法.
3 实验部分
3.1 仪器与试剂
实验所用溶剂使用前均按照处理溶剂的标准方法进行. 1H NMR, 13C NMR均在Bruker AVANCE Ⅲ 500 MHz型核磁共振仪上测定, 核磁试剂为CDCl3, 内标TMS; 柱层析使用200~300目硅胶, 展开剂为石油醚 (60~90 ℃) 和乙酸乙酯.所有实验药品均为市售分析纯试剂.
3.2 实验方法
3.2.2 加成反应的操作方法
以化合物2a的合成为例, 在干燥的反应管内称入2-(N-甲基) 邻溴苯胺基-1-苯基乙酮 (1a, 61 mg, 0.2 mmol)、Ni (dppe) Br2 (12.4 mg, 10 mol%), 经活化的锌粉 (19 mg, 0.3 mmol).体系置换氮气后, 用注射器加入乙二醇二甲醚2.0 mL, 密闭下加热至100 ℃反应48 h.反应结束后冷却并浓缩除去溶剂, 用柱层析色谱分离[硅胶, V(石油醚):V(乙酸乙酯)=100:1]得到3-苯基-N-甲基吲哚 (2a)[6a], 收率84%. 1H NMR (CDCl3, 500 MHz) δ: 3.81 (s, 3H), 7.17~7.22 (m, 2H), 7.24~7.29 (m, 2H), 7.35 (d, J=8.0 Hz, 1H), 7.41~7.44 (m, 2H), 7.65 (dd, J=1.0, 7.5 Hz, 2H), 7.94 (d, J=8.5 Hz, 1H).
3-(4-甲基苯基)-N-甲基吲哚 (2b)[6b]:收率79%. 1H NMR (CDCl3, 500 MHz) δ: 2.39 (s, 3H), 3.81 (s, 3H), 7.16~7.18 (m, 2H), 7.26~7.28 (m, 3H), 7.34 (d, J=8.0 Hz, 1H), 7.55 (d, J=8.0 Hz, 2H), 7.92 (d, J=8.0 Hz, 1H).
3-(3-甲基苯基)-N-甲基吲哚 (2c):收率75%. 1H NMR (CDCl3, 500 MHz) δ: 2.42 (s, 3H), 3.83 (s, 3H), 7.09 (d, J=7.5 Hz, 1H), 7.17~7.22 (m, 2H), 7.26~7.36 (m, 3H), 7.46 (d, J=8.5 Hz, 2H), 7.95 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 21.6, 32.9, 109.5, 116.8, 119.8, 120.0, 121.9, 124.5, 126.2, 126.5, 128.1, 128.7, 135.6, 137.5, 138.3; HRMS calcd for C16H16N [M+H]+ 222.1280, found 222.1267.
3-(2-甲基苯基)-N-甲基吲哚 (2d):收率54%. 1H NMR (CDCl3, 500 MHz) δ: 2.33 (s, 3H), 3.84 (s, 3H), 7.04 (s, 1H), 7.11~7.14 (m, 1H), 7.23~7.33 (m, 4H), 7.36~7.43 (m, 2H), 7.52 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 20.8, 32.8, 109.3, 116.0, 119.4, 120.2, 121.7, 125.6, 126.5, 127.5, 127.6, 130.3, 130.9, 134.5, 136.7; HRMS calcd for C16H16N [M+H]+ 222.1277, found 222.1269.
3-(4-甲氧基苯基)-N-甲基吲哚 (2e)[6c]:收率90%. 1H NMR (CDCl3, 500 MHz) δ: 3.81 (s, 3H), 3.85 (s, 3H), 6.99 (dt, J=2.5, 9.0 Hz, 2H), 7.15~7.19 (m, 2H), 7.25~7.28 (m, 1H), 7.35 (d, J=8.0 Hz, 1H), 7.56 (dt, J=2.5, 9.0 Hz, 2H), 7.89 (d, J=8.0 Hz, 1H).
3-(3-甲氧基苯基)-N-甲基吲哚 (2f):收率69%. 1H NMR (CDCl3, 500 MHz) δ: 3.81 (s, 3H), 3.86 (s, 3H), 6.82 (dd, J=2.0, 6.0 Hz, 1H), 7.17~7.29 (m, 5H), 7.34 (t, J=7.5 Hz, 2H), 7.95 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 32.9, 55.3, 109.5, 111.2, 113.0, 116.7, 119.9, 120.0, 122.0, 126.2, 126.7, 129.7, 137.1, 137.5, 160.0; HRMS calcd for C16H16NO [M+H]+ 238.1226, found 238.1224.
3-(2-甲氧基苯基)-N-甲基吲哚 (2g):收率70%. 1H NMR (CDCl3, 500 MHz) δ: 3.83 (s, 3H), 3.86 (s, 3H), 7.01~7.07 (m, 2H), 7.13~7.16 (m, 1H), 7.25~7.29 (m, 2H), 7.34~7.37 (m, 2H), 7.63 (dd, J=1.5, 6.0 Hz, 1H), 7.78 (d, J=8.0 Hz, 1H); HRMS calcd for C16H16NO [M+H]+ 238.1226, found 238.1236.
3-(4-氯苯基)-N-甲基吲哚 (2h):收率67%. 1H NMR (CDCl3, 500 MHz) δ: 3.82 (s, 3H), 7.18~7.21 (m, 2H), 7.27~7.30 (m, 1H), 7.35~7.39 (m, 3H), 7.57 (d, J=8.5 Hz, 2H), 7.88 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 32.9, 109.7, 115.6, 119.7, 120.1, 122.1, 126.0, 126.6, 128.4, 128.9, 131.3, 134.2, 137.5; HRMS calcd for C15H13ClN [M+H]+ 242.0731, found 242.0728.
3-(4-氟苯基)-N-甲基吲哚 (2i)[6d]:收率67%. 1H NMR (CDCl3, 500 MHz) δ: 3.82 (s, 3H), 7.18~7.21 (m, 2H), 7.29 (td, J=0.5, 8.0 Hz, 2H), 7.35~7.40 (m, 3H), 7.56 (dt, J=2.5, 8.5 Hz, 2H), 7.88 (d, J=8.0 Hz, 1H).
3-(4-三氟甲基苯基)-N-甲基吲哚 (2j):收率38%. 1H NMR (CDCl3, 500 MHz) δ: 3.86 (s, 3H), 7.10~7.20 (m, 4H), 7.28 (td, J=0.5, 8.0 Hz, 1H), 7.36 (d, J=8.0 Hz, 1H), 7.56~7.60 (m, 2H), 7.87 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 32.9, 109.6, 115.6 (t, J=21.6 Hz), 119.6, 119.9, 122.1, 126.1, 126.3, 128.7 (d, J=7.0 Hz), 131.7 (d, J=3.3 Hz), 137.4; HRMS calcd for C16H13F3N [M+H]+ 276.0995, found 276.0996.
3-(2-萘基)-N-甲基吲哚 (2k):收率85%. 1H NMR (CDCl3, 500 MHz) δ: 3.84 (s, 3H), 7.22~7.25 (m, 1H), 7.29~7.33 (m, 2H), 7.37~7.49 (m, 3H), 7.78~7.89 (m, 4H), 8.05~8.11 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 32.9, 109.6, 116.6, 120.0, 120.1, 122.1, 124.9, 125.1, 126.1, 126.3, 126.4, 127.0, 127.7, 128.2, 131.9, 133.2, 134.1, 137.6; HRMS calcd for C19H16N [M+H]+ 258.1277, found 258.1276.
3-(2-噻吩基)-N-甲基吲哚 (2l):收率70%. 1H NMR (CDCl3, 500 MHz) δ: 3.76 (s, 3H), 7.08~7.10 (m, 1H), 7.18~7.32 (m, 6H), 7.96 (d, J=8.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 32.8, 109.5, 110.3, 120.0, 120.1, 122.1, 122.2, 125.9, 126.5, 127.5, 137.3, 137.9; HRMS calcd for C13H12NS [M+H]+ 214.0685, found 214.0668.
3-苯基-N-苄基吲哚 (2m)[6e]:收率75%. 1H NMR (CDCl3, 500 MHz) δ: 5.34 (s, 2H), 7.15~7.33 (m, 10H), 7.41~7.44 (m, 2H), 7.67 (dd, J=1.0, 8.0 Hz, 2H), 7.97 (d, J=7.5 Hz, 1H).
1, 2-二甲基-3-苯基吲哚 (2n)[6c]:收率84%. 1H NMR (CDCl3, 500 MHz) δ: 2.48 (s, 3H), 3.73 (s, 3H), 7.09~7.12 (m, 1H), 7.19~7.23 (m, 1H), 7.27~7.32 (m, 2H), 7.34~7.50 (m, 4H), 7.66 (d, J=8.0 Hz, 1H).
辅助材料 (Supporting Information) 产物的NMR图谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.1 2-(N-甲基) 邻溴苯胺基-1-芳基乙酮 (1) 的合成
以化合物1a的合成为例, 在100 mL圆底烧瓶中加入N-甲基邻溴苯胺 (2.8 g, 15 mmol)、无水碳酸氢钠 (1.3 g, 15 mmol)、α-溴代苯乙酮 (1.5 g, 7.5 mmol) 以及乙腈溶剂 (20 mL), 该混合物在80 ℃下回流反应24 h.随后冷却至室温, 反应液加入水稀释后用乙酸乙酯萃取三次.合并有机相后, 分别用饱和碳酸钠水溶液和饱和食盐水洗涤三次, 无水硫酸钠干燥后浓缩除去溶剂.柱层析色谱分离[V(石油醚):V(乙酸乙酯)=100:1]获得1.98 g 2-(N-甲基) 邻溴苯胺基-1-苯基乙酮 (1a), 收率87%. 1H NMR (CDCl3, 500 MHz) δ: 2.99 (s, 3H), 4.62 (s, 2H), 6.87~6.90 (m, 1H), 7.27 (d, J=4.5 Hz, 2H), 7.45 (t, J=8.0 Hz, 2H), 7.52~7.58 (m, 2H), 7.95~7.97 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 41.4, 61.7, 118.5, 122.4, 124.1, 128.0, 128.6, 133.3, 133.9, 135.7, 150.2, 196.7; HRMS calcd for C15H15BrNO [M+H]+ 304.0332, found 304.0339.
2-(N-甲基) 邻溴苯胺基-1-(4-甲基苯基) 乙酮 (1b):收率74%. 1H NMR (CDCl3, 500 MHz) δ: 2.40 (s, 3H), 2.98 (s, 3H), 4.58 (s, 2H), 6.86~6.89 (m, 1H), 7.23~7.27 (m, 4H), 7.52 (d, J=8.0 Hz, 1H), 7.87 (d, J=8.0 Hz, 2H); 13C NMR (CDCl3, 125 MHz) δ: 21.7, 41.4, 61.6, 122.4, 124.0, 128.0, 128.1, 129.3, 133.2, 133.9, 150.3, 196.3; HRMS calcd for C16H17BrNO [M+H]+ 318.0488, found 318.0476.
2-(N-甲基) 邻溴苯胺基-1-(3-甲基苯基) 乙酮 (1c):收率57%. 1H NMR (CDCl3, 500 MHz) δ: 2.39 (s, 3H), 2.98 (s, 3H), 4.59 (s, 2H), 6.86~6.90 (m, 1H), 7.25~7.29 (m, 2H), 7.31~7.38 (m, 2H), 7.52~7.53 (m, 1H), 7.74~7.78 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 21.3, 41.3, 61.8, 118.5, 122.4, 124.0, 125.2, 128.0, 128.5, 128.6, 133.9, 134.1, 135.7, 138.4, 150.3, 196.8. HRMS calcd for C16H17BrNO [M+H]+ 318.0488, found 318.0481.
2-(N-甲基) 邻溴苯胺基-1-(2-甲基苯基) 乙酮 (1d):收率54%. 1H NMR (CDCl3, 500 MHz) δ: 2.46 (s, 3H), 2.98 (s, 3H), 4.46 (s, 2H), 6.85~6.89 (m, 1H), 7.20~7.27 (m, 4H), 7.34~7.37 (m, 1H), 7.51 (dd, J=1.5, 8.0 Hz, 1H), 7.59 (d, J=7.5 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 21.0, 41.3, 63.8, 118.4, 122.3, 124.0, 125.6, 128.0, 128.1, 131.4, 131.9, 133.9, 136.5, 138.1, 150.1, 201.0; HRMS calcd for C16H17BrNO [M+H]+ 318.0488, found 318.0492.
2-(N-甲基) 邻溴苯胺基-1-(4-甲氧基苯基) 乙酮 (1e):收率80%. 1H NMR (CDCl3, 500 MHz) δ: 2.97 (s, 3H), 3.86 (s, 3H), 4.55 (s, 2H), 6.86~6.97 (m, 3H), 7.25~7.29 (m, 2H), 7.52~7.53 (m, 1H), 7.93~7.98 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 41.5, 55.5, 61.5, 113.7, 118.5, 122.4, 124.0, 128.0, 128.7, 130.3, 133.9, 150.3, 163.6, 195.2; HRMS calcd for C16H17BrNO2 [M+H]+ 334.0437, found 334.0445.
2-(N-甲基) 邻溴苯胺基-1-(3-甲氧基苯基) 乙酮 (1f):收率86%. 1H NMR (CDCl3, 500 MHz) δ: 2.99 (s, 3H), 3.83 (s, 3H), 4.60 (s, 2H), 6.86~6.89 (m, 1H), 7.10 (ddd, J=0.5, 3.25, 7.75 Hz, 1H), 7.25~7.26 (m, 2H), 7.34 (t, J=8.0, 1H), 7.48~7.54 (m, 3H); 13C NMR (CDCl3, 125 MHz) δ: 41.4, 55.4, 61.7, 112.1, 118.5, 120.0, 120.5, 122.5, 124.0, 128.0, 129.6, 133.9, 137.0, 159.9, 196.5; HRMS calcd for C16H17BrNO2 [M+H]+ 334.0437, found 334.0428.
2-(N-甲基) 邻溴苯胺基-1-(2-甲氧基苯基) 乙酮 (1g):收率40%. 1H NMR (CDCl3, 500 MHz) δ: 2.97 (s, 3H), 3.82 (s, 3H), 4.60 (s, 2H), 6.83 (td, J=2.0, 7.5 Hz, 1H), 6.91 (d, J=8.5 Hz, 1H), 6.98~7.01 (m, 1H), 7.18~7.25 (m, 2H), 7.44~7.51 (m, 2H), 7.77 (dd, J=2.0, 6.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 41.1, 55.4, 65.7, 111.4, 118.1, 120.8, 122.3, 123.4, 126.8, 127.8, 130.5, 133.7, 133.8, 150.4, 158.8, 199.1; HRMS calcd for C16H17BrNO2 [M+H]+ 334.0437, found 334.0433.
2-(N-甲基) 邻溴苯胺基-1-(4-氯苯基) 乙酮 (1h):收率61%. 1H NMR (CDCl3, 500 MHz) δ: 2.96 (s, 3H), 4.54 (s, 2H), 6.88~6.91 (m, 1H), 7.24~7.29 (m, 2H), 7.40~7.45 (m, 2H), 7.53 (dd, J=1.0, 7.0 Hz, 1H), 7.91~7.94 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 41.6, 61.9, 118.7, 122.4, 124.3, 128.1, 128.9, 129.6, 133.9, 139.8, 150.0, 195.6; HRMS calcd for C15H14BrClNO [M+H]+ 337.9942, found 337.9946.
2-(N-甲基) 邻溴苯胺基-1-(4-氟苯基) 乙酮 (1i):收率61%. 1H NMR (CDCl3, 500 MHz) δ: 2.96 (s, 3H), 4.55 (s, 2H), 6.88~6.91 (m, 1H), 7.09~7.14 (m, 2H), 7.25~7.30 (m, 2H), 7.53 (dd, J=1.0, 7.0 Hz, 1H), 8.00~8.04 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 41.5, 61.8, 155.7 (d, J=21.8 Hz), 118.6, 122.4, 124.3, 128.1, 130.8 (d, J=9.4 Hz), 132.0 (d, J=3.1 Hz), 133.9, 150.0 165.8 (d, J=253.8 Hz), 195.1; HRMS calcd for C15H14BrFNO [M+H]+ 322.0237, found 322.0230.
2-(N-甲基) 邻溴苯胺基-1-(4-三氟甲基苯基) 乙酮 (1j):收率61%. 1H NMR (CDCl3, 500 MHz) δ: 2.97 (s, 3H), 4.59 (s, 2H), 6.89~6.93 (m, 1H), 7.25~7.30 (m, 2H), 7.53 (dd, J=1.0, 8.0 Hz, 1H), 7.71 (d, J=8.5 Hz, 2H), 8.09 (d, J=8.0 Hz, 2H); 13C NMR (CDCl3, 125 MHz) δ: 41.6, 62.1, 118.7, 122.5, 123.6 (q, J=270.9 Hz), 124.5, 125.7 (q, J=3.5 Hz), 126.8, 128.1, 128.5, 134.0, 134.6 (q, J=32.5 Hz), 138.3, 149.9, 195.9; HRMS calcd for C16H14BrF3NO [M+H]+ 372.0205, found 372.0217.
2-(N-甲基) 邻溴苯胺基-1-(2-萘基) 乙酮 (1k):收率58%. 1H NMR (CDCl3, 500 MHz) δ: 3.00 (s, 3H), 4.71 (s, 2H), 6.88~6.91 (m, 1H), 7.26~7.30 (m, 2H), 7.52~7.61 (m, 3H), 7.85~7.94 (m, 3H), 8.02 (dd, J=1.5, 7.0 Hz, 1H), 8.56 (s, 1H); 13C NMR (CDCl3, 125 MHz) δ: 41.6, 62.1, 118.7, 122.5, 123.8, 124.2, 126.8, 127.8, 128.1, 128.4, 128.5, 129.6, 129.9, 133.9, 125.7, 150.3, 196.6; HRMS calcd for C19H17BrNO [M+H]+ 354.0488, found 354.0472.
2-(N-甲基) 邻溴苯胺基-1-(2-噻吩基) 乙酮 (1l):收率80%. 1H NMR (CDCl3, 500 MHz) δ: 2.99 (s, 3H), 4.49 (s, 2H), 6.87~6.91 (m, 1H), 7.10~7.12 (m, 1H), 7.25~7.29 (m, 2H), 7.52~7.54 (m, 1H), 7.63 (dd, J=1.0, 4.0 Hz, 1H), 7.86 (dd, J=1.0, 3.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 41.6, 62.1, 118.6, 122.5, 124.3, 128.1, 132.3, 133.7, 133.9, 142.1, 150.0, 190.0; HRMS calcd for C13H13BrNOS [M+H]+ 309.9896, found 309.9909.
2-(N-苄基) 邻溴苯胺基-1-苯基乙酮 (1m):收率32%. 1H NMR (CDCl3, 500 MHz) δ: 4.58 (s, 2H), 4.61 (s, 2H), 6.90 (td, J=1.5, 7.5 Hz, 2H), 7.23~7.27 (m, 2H), 7.32 (t, J=7.5 Hz, 2H), 7.40~7.45 (m, 5H), 7.52~7.56 (m, 2H), 7.86~7.87 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 57.1, 57.4, 120.5, 124.7, 125.7, 127.3, 127.8, 127.9, 128.4, 128.5, 128.7, 133.2, 133.6, 135.7, 137.9, 148.7 197.7; HRMS calcd for C21H19BrNO [M+H]+ 380.0645, found 380.0660.
2-(N-甲基) 邻溴苯胺基-2-甲基-1-苯基乙酮 (1n):收率20%. 1H NMR (CDCl3, 500 MHz) δ: 1.51 (d, J=7.0 Hz, 3H), 2.77 (s, 3H), 5.07 (dd, J=6.5, 7.0 Hz, 1H), 6.79~6.86 (m, 2H), 7.03~7.06 (m, 1H), 7.28 (t, J=15 Hz, 2H), 7.42 (t, J=7.0 Hz, 1H), 7.54 (dd, J=1.0, 6.5 Hz, 1H), 7.73 (d, J=7.0 Hz, 2H); 13C NMR (CDCl3, 125 MHz) δ: 14.3, 35.1, 60.8, 199.3, 123.5, 124.0, 127.8, 128.2, 128.4, 132.7, 133.8, 136.6, 150.0, 199.5; HRMS calcd for C16H17BrNO [M+H]+ 318.0488, found 318.0507.
-
-
[1]
(a) Okude, Y.; Hirano, S.; Hiyama, T.; Nozaki, H. J. Am. Chem. Soc. 1977, 99, 3179.
(b) Jin, H.; Uenishi, J.; Christ, W. J.; Kishi, Y. J. Am. Chem. Soc. 1986, 108, 5644.
(c) Takai, K.; Tagashira, M.; Kuroda, T.; Oshima, K.; Utimoto, K.; Nozakit, H. J. Am. Chem. Soc. 1986, 108, 6048.
(d) Fürstner, A.; Shi, N. J. Am. Chem. Soc. 1996, 118, 2533.
(e) Fürstner, A.; Shi, N. J. Am. Chem. Soc. 1996, 118, 12349. -
[2]
(a) Satoh, T.; Itaya, T.; Miura, M. Chem. Lett. 1996, 25, 823.
(b) Wang, S. Z.; Xie, K.; Tan, Z. Chem. Commun. 2009, 6469.
(c) Cacchi, S.; Fabrizi, G.; Gavazza, F.; Goggiamani, A. Org. Lett. 2003, 5, 289.
(d) Wei, X. Chin. J. Org. Chem. 2005, 25, 234 (in Chinese). (魏晓芳, 有机化学, 2005, 25, 234.)
(e) Correa, A.; Martin, R. J. Am. Chem. Soc. 2009, 131, 15974. -
[3]
(a) Quan, L.-G.; Lamrani, M.; Yamamoto, Y. J. Am. Chem. Soc. 2000, 122, 4827.
(b) Pletnev, A. A.; Larock, R. C. J. Org. Chem. 2002, 67, 9428.
(c) Solé, D.; Vallverdú, L.; Solans, X.; Font-Bardía, M.; Bonjoch, J. J. Am. Chem. Soc. 2003, 125, 1587.
(d) Solé, D.; Serrano, O. Angew. Chem., Int. Ed. 2007, 46, 7270.
(e) Solé, D.; Serrano, O. J. Org. Chem. 2008, 73, 9372.
(f) Zhao, Y.-B.; Mariampillai, B.; Candito, D. A.; Laleu, B.; Li, M.-Z.; Lautens, M. Angew. Chem., Int. Ed. 2009, 48, 1849.
(g) Jia, Y.-X.; Katayev, D.; Kündig, E. P. Chem. Commun. 2010, 130.
(h) Ying, L.; Kanai, M.; Shibasaki, M. Angew. Chem., Int. Ed. 2011, 50, 7120.
(i) Shin, I.; Ramgren, S. D.; Krische, M. J. Tetrahedron 2015, 71, 5776. -
[4]
(a) Majumdar, K. K.; Cheng, C.-H. Org. Lett. 2000, 2, 2295.
(b) Huang, Y.-C.; Majumdar, K. K.; Cheng, C.-H. J. Org. Chem. 2002, 67, 1682.
(c) Rayabarapu, D. K.; Chang, H.-T.; Cheng, C.-H. Chem. Eur. J. 2004, 10, 2991.
(d) Hsieh, J. C.; Cheng, C.-H. Chem. Commun. 2005, 4554.
(e) Yin, H.; Zhao, C.; You, H.; Lin, K.; Gong, H. Chem. Commun. 2012, 7034.
(f) Wu, F.; Lu, W.; Qian, Q.; Ren, Q.; Gong, H. Org. Lett. 2012, 14, 3044.
(g) Zhao, C.; Jia, X.; Wang, X.; Gong, H. J. Am. Chem. Soc. 2014, 136, 17645.
(h) Correa, A.; Martin, R. J. Am. Chem. Soc. 2014, 136, 7253.
(i) Zhang, M.-D.; Chen, B.; Ge, C.; Liu, R.-R.; Gao, J.-R.; Jia, Y.-X. Chin. J. Org. Chem. 2016, 36, 1636 (in Chinese).
(张鸣頔, 陈斌, 葛晨, 刘人荣, 高建荣, 贾义霞, 有机化学, 2016, 36, 1636.) http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345470.shtml -
[5]
(a) Hu, J.-X.; Wu, H.; Li, C.-Y.; Sheng, W.-J.; Jia, Y.-X.; Gao, J.-R. Chem. Eur. J. 2011, 17, 5234.
(b) He, J.-Q.; Chen C.; Yu, W.-B.; Liu, R.-R.; Xu, M.; Li, Y.-J.; Gao, J.-R.; Jia, Y.-X. Tetrahedron Lett. 2014, 55, 2805. -
[6]
(a) Nakao, Y.; Kanyiva, K. S.; Oda, S.; Hiyama, T. J. Am. Chem. Soc. 2006, 128, 8146.
(b) Kashulin, I. A.; Nifant'ev, I. E. J. Org. Chem. 2004, 69, 5476.
(c) Ackermann, L.; Dell'Acqua, M.; Fenner, S.; Vicente, R.; Sandmann, R. Org. Lett. 2011, 13, 2358.
(d) Phipps, R. J.; Grimster, N. P.; Gaunt, M. J. J. Am. Chem. Soc. 2008, 130, 8172.
(e) Bedford, R. B.; Betham, M. J. Org. Chem. 2006, 71, 9403.
-
[1]
-
表 1 反应条件优化a
Table 1. Optimization of the reaction conditions

Entry Cat. Zn/equiv. Solvent Yieldb/% 1 Ni (dppe) Br2 2.5 THF 62 2 Ni (dppe) Br2 2.5 CH3CN 57 3 Ni (dppe) Br2 2.5 Toluene Trace 4 Ni (dppe) Br2 2.5 DMF 26 5 Ni (dppe) Br2 2.5 MeOH 31 6 Ni (dppe) Br2 2.5 Dioxane 51 7 Ni (dppe) Br2 2.5 DME 61 8 Ni (dppe) Br2 2.5 THF/CH3CN (V:V=7:1) 59 9 Ni (bpy) Br2 2.5 THF 32 10 Ni (bpy) Br2 2.5 DME 36 11 Ni (dppe) Br2 1.5 THF 75 12 Ni (dppe) Br2 1.5 Dioxane 76 13 Ni (dppe) Br2 1.5 DME 84 a化合物1a(0.2 mmol)、催化剂 (10 mol%, 0.02 mmol)、锌粉 (0.3~0.5 mmol)、溶剂 (2.0 mL); b分离收率. 表 2 加成反应底物拓展a
Table 2. Substrate scope of the reaction

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 10
- 文章访问数: 1724
- HTML全文浏览量: 264


 下载:
下载:
 下载:
下载:

