 图 图式 1
新型噻唑并嘧啶衍生物的合成路线
Figure 图式 1.
Synthetic routes of novel thiazolo[3, 2-a]pyrimidi-nones derivatives
图 图式 1
新型噻唑并嘧啶衍生物的合成路线
Figure 图式 1.
Synthetic routes of novel thiazolo[3, 2-a]pyrimidi-nones derivatives

Citation: Wang Dong, Wang Daolin, Qian Jianhua. An Efficient Synthesis of Benzothieno-[3', 2': 2, 3]pyrido[4, 5-d]thiazolo[3, 2-a]pyrimidin-5-ones[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 698-703. doi: 10.6023/cjoc201609031

苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶酮类衍生物的有效合成
English
An Efficient Synthesis of Benzothieno-[3', 2': 2, 3]pyrido[4, 5-d]thiazolo[3, 2-a]pyrimidin-5-ones
-
嘧啶及其稠环化合物是一类在生物化学中非常重要的杂环化合物, 已经成为临床治疗的有效药物[1].其中, 含有噻唑并嘧啶骨架结构的噻唑并[3, 2-a]嘧啶类化合物由于其结构的多样性及表现出的多种生物活性和药理活性, 如抗癌[2]、抗炎[3]、抗病毒[4]、镇痛[5]等, 近年来引起极大的关注[6].
另一方面, 苯并噻吩作为药物化学中的一种特权结构单元[7], 被用作微管蛋白聚合抑制剂[8]、乙酰辅酶A羧化酶抑制剂[9]、抗抑郁药[10]和雌激素受体调节剂[11]等.含有苯并噻吩类化合物的许多药物应用于临床, 如选择性雌激素受体调节剂雷洛昔芬 (Raloxifene)[12], 用于治疗哮喘的白三烯生物合成抑制剂齐留通 (Zileuton)[13], 和抑制麦角甾醇合成的抗真菌剂硝酸舍他康唑 (Sertaco-nazole)[14]等.
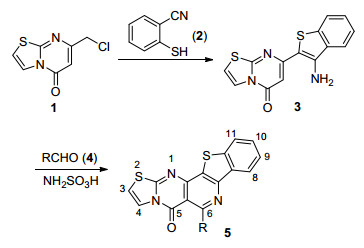
Pictet-Spengler反应 (P-S反应) 发展至今已有百年历史[15], 目前该反应仍然是合成含氮杂环化合物, 如异喹啉、咔啉衍生物等非常有效的方法[16].近年来, P-S反应在合成天然产物及小分子杂环化合物[17], 特别是在稠杂环化合物合成领域得到广泛应用[18].基于嘧啶类化合物良好的化学及生物活性, 最近, 我们以噻唑并嘧啶为研究对象, 应用Pictet-Spengler反应成功合成了苯并呋喃[19a]及吡啶并噻吩[19b]稠合的噻唑并[3, 2-a]嘧啶酮类化合物.为进一步拓展此领域的研究工作, 本文以7-氯甲基噻唑并[3, 2-a]嘧啶-5-酮为反应底物, 通过Thorpe-Ziegler环化及Pictet-Spengler反应, 将苯并噻吩单元引入到噻唑并嘧啶结构中, 合成苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶衍生物, 并期待获得良好生物活性的嘧啶衍生物新结构体系.合成路线如Scheme 1所示.
 图 图式 1
新型噻唑并嘧啶衍生物的合成路线
Figure 图式 1.
Synthetic routes of novel thiazolo[3, 2-a]pyrimidi-nones derivatives
图 图式 1
新型噻唑并嘧啶衍生物的合成路线
Figure 图式 1.
Synthetic routes of novel thiazolo[3, 2-a]pyrimidi-nones derivatives
1 结果与讨论
1.1 中间体3的合成
Thorpe-Ziegler环化反应[20]是制备杂环化合物非常重要的反应之一.本工作设计以易得的7-氯甲基噻唑并[3, 2-a]嘧啶-5-酮 (1)[21]为基础原料, 于N, N-二甲基甲酰胺 (DMF) 中, 在碳酸钾作用下, 通过与2-巯基苯甲腈 (2) 的Thorpe-Ziegler环化反应, 以85%收率, 成功制备本研究工作的重要中间体7-(3-氨基苯并噻吩-2-基) 噻唑并[3, 2-a]嘧啶-5-酮 (3) (Eq. 1).
该产物结构由1H NMR谱图中, 在δ5.97处出现的单峰, δ7.39~8.10范围出现的多重吸收峰; IR谱图中, 3426, 3356, 1682 cm-1处出现的强伸缩振动峰, 给予证实.
1.2 目标化合物5的合成条件
氨基磺酸 (SA, NH2SO3H) 是有机合成的重要催化剂[22], 在我们的研究中发现[19], 该催化剂对噻唑并嘧啶类稠杂环化合物的合成过程中同样起到良好的催化作用.
为进一步扩展研究内容, 以SA为催化剂考察了4-(3-氨基苯并噻吩-2-基)-6-甲氧基喹啉-2-酮 (3) 与苯甲醛 (4a) 的P-S反应性能.实验结果见表 1.在反应过程中, 催化剂的用量和反应温度对反应影响较大.且当SA的用量为10 mol%, 在120 ℃时产物收率达到最高 (85%) (Entry 2).增加催化剂用量 (15 mol%) 以及升高 (140 ℃) 或降低 (100 ℃) 反应温度, 产物收率均有所降低 (Entries 3~5).同时, 考察了DMSO、甲苯、EtOH、HOAc等反应溶剂对该反应的影响 (Entries 6~9).发现在DMSO中反应较快, 但收率较低 (60%); 在HOAc中该反应也可顺利进行, 但反应时间稍长; 在EtOH中反应较为缓慢.另外, 作为对比性试验, 考查了对甲基苯磺酸 (p-TsOH) 和三氟乙酸 (TFA) 对该反应的影响 (Entries 10, 11).依据以上实验结果, 选择SA (10 mol%) 为催化剂, DMF作为该反应溶剂, 在120 ℃下进行, 作为该反应的优化条件.
Entry Catalyst (mol%) Solvent Temp./℃ Time/h Yield/% 1 SA (5) DMF 120 16 36 2 SA (10) DMF 120 7 85 3 SA (15) DMF 120 9 80 4 SA (10) DMF 140 7 76 5 SA (10) DMF 100 13 72 6 SA (10) DMSO 120 5 60 7 SA (10) Toluene 110 18 66 8 SA (10) HOAc 120 12 77 9 SA (10) EtOH 80 22 54 10 p-TsOH (10) DMF 120 12 76 11 TFA (10) DMF 120 10 78 a Reaction conditions: 3a(1.0 mmol), benzaldehyde (4a, 1.0 mmol), solvent (20 mL). 表 1 合成化合物5a的反应条件的优化a
Table 1. Optimization of the reaction conditions for the synthesis of 5a在以上优化的反应条件下, 对苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶酮-5-酮类衍生物 (5) 的合成进行扩展实验 (表 2).
Entry Products R Timea/h Yieldb/% 1 5a C6H5 7 85 2 5b 4-MeC6H4 6 83 3 5c 2-MeOC6H4 8 76 4 5d 3-MeOC6H4 5 80 5 5e 4-MeOC6H4 5 88 6 5f 4-HOC6H4 6 80 7 5g 4-ClC6H4 9 77 8 5h 4-NO2C6H4 13 74 9 5i 2-Furyl 10 73 10 5j 2-Thienyl 12 76 11 5k n-Pr 14 63 12 5l n-Bu 15 67 aReaction progress monitored by TLC. b Isolated yield. 表 2 化合物5的反应时间及产率a
Table 2. Reaction times and yields of the products 5从以上反应结果 (表 2) 中可以看出, 在SA作用下, 7-(3-氨基苯并噻吩-2-基) 噻唑并[3, 2-a]嘧啶-5-酮 (3) 与芳香醛 (4) 在Pictet-Spengler反应中表现出较高的反应活性和选择性:无论是芳香醛苯环上含有供电子取代基 (Me、OMe、OH) (Entries 2~6), 还是含有吸电子取代基 (Cl、NO2) (Entries 7, 8) 该反应都得以顺利进行, 并得到良好收率 (74%~88%).另外, 杂环芳醛 (糠醛和噻吩-2-甲醛)(Entries 9, 10) 和脂肪醛 (Entries 11, 12) 在该类反应中也表现出较好的反应性能 (63%~76%).
1.3 目标化合物5的波谱特征
目标化合物5结构经过IR、1H NMR、13C NMR和元素分析确认.在该系列化合物的1H NMR谱图中, 在δ 7.6及8.2附近出现的两处双重峰, 归属于噻唑环上2个氢质子吸收; δ7.4~8.5范围内出现的多重峰, 归属于苯并噻吩结构中的4个氢质子吸收; 13C NMR谱图中, δ168附近出现嘧啶酮5-位羰基碳的吸收峰; δ106~163范围内处出现苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶结构体系中的15个碳吸收峰. IR谱图中, 发现在1680 cm-1附近出现嘧啶酮5-位羰基的强伸缩振动峰.另外, 该产物的元素分析数据也与推测的化合物结构相符.
1.4 目标化合物5的形成机理
依据以上实验结果, 对该反应进行的可能机理推测如Scheme 2所示.在碱作用下, 7-氯甲基噻唑并[3, 2-a]嘧啶酮 (1) 与2-巯基苯甲腈 (2) 进行S-烷基化, 然后烷基化产物A通过Thorpe-Ziegler环化、异构化, 得到关键中间体: 7-(3-氨基苯并噻吩-2-基) 噻唑并[3, 2-a]嘧啶酮 (3), 接着在Pictet-Spengler反应条件下与芳香醛 (4) 进行缩合, 得到P-S反应产物D, 最后经自动氧化得到最终产物苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶酮衍生物 (5).
2 结论
通过7-氯甲基噻唑并[3, 2-a]嘧啶酮与2-巯基苯甲腈的Thorpe-Ziegler环化, 及其环化产物的Pictet-Spengler反应, 成功合成了一系列苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶酮类化合物; 该方法具有原料易得、反应选择性好、反应条件温和、操作简便等优点; 该方法拓展了Pictet-Spengler反应在稠杂环化合物合成中的应用, 为构建新型噻唑并[3, 2-a]嘧啶酮类衍生物提供了有效的合成途径.
3 实验部分
3.1 仪器与试剂
熔点用WRS-1B数字熔点仪测定, 熔点未校正; NMR用Bruker DPX-400 MHz核磁共振仪测定, 四甲基硅烷为内标; IR用BIO-RAD FTS-40型傅立叶变换红外分光光度计测定, KBr压片; MS采用ZAB-HS型质谱仪测定; 元素分析用Vario EL元素分析仪测定.所用试剂均为分析纯试剂或按照文献方法合成.
3.2 实验方法
3.2.1 7-氯甲基噻唑并[3, 2-a]嘧啶酮 (1) 的制备
按照文献[21]方法, 以2-氨基噻唑和4-氯乙酰乙酸乙酯为反应原料, 在多聚磷酸作用下制得 (收率65%). m.p. 133~135 ℃(文献值[21] 133 ℃); 1H NMR (DMSO-d6, 400 MHz)δ: 4.63 (s, 2H), 6.45 (s, 1H), 7.59 (d, J=4.8 Hz, 1H), 8.08 (d, J=4.8 Hz, 1H).
3.2.3 苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶酮 (5) 的合成
将7-(3-氨基苯并噻吩-2-基) 噻唑并[3, 2-a]嘧啶酮 (3) (1.0 mmol)、醛4(1.0 mmol)、氨基磺酸 (0.1 mmol), 加入到DMF (20 mL) 中, 120 ℃下反应 (TLC监控反应).反应完毕后, 冷却至室温, 将反应液转入水 (25 mL) 中, 过滤, 得到粗产物, 干燥, DMF重结晶, 得到目标化合物5.
6-苯基苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5a):黄色结晶. Rf=0.47 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 7.49~7.50 (m, 4H), 7.61~7.64 (m, 3H), 7.71 (t, J=7.2 Hz, 1H), 8.05 (d, J=4.8 Hz, 1H), 8.22 (d, J=8.0 Hz, 1H), 8.42 (d, J=8.0 Hz, 1H); 13C NMR (DMSO-d6, 100 MHz) δ: 105.9, 114.1, 122.5, 122.6, 123.6, 126.8, 127.1, 127.9, 128.8, 130.5, 131.5, 131.9, 132.1, 140.8, 142.7, 152.8, 156.2, 158.1, 168.9; IR (KBr) ν: 1674 (C=O) cm-1.Anal. calcd for C21H11N3OS2: C 65.43, H 2.88, N 10.90; found C 65.51, H 2.96, N 10.97.
6-(4-甲基苯基) 苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5b):黄色结晶. Rf=0.43 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 2.44 (s, 3H), 7.29 (d, J=7.6 Hz, 2H), 7.50~7.55 (m, 3H), 7.62~7.66 (m, 1H), 7.70~7.74 (m, 1H), 8.05 (d, J=4.8 Hz, 1H), 8.29 (d, J=7.6 Hz, 1H), 8.42 (d, J=7.6 Hz, 1H); 13C NMR (DMSO-d6, 100 MHz) δ: 19.5, 105.8, 114.1, 115.0, 122.5, 123.5, 126.7, 127.0, 127.4, 128.0, 129.4, 131.2, 131.8, 140.7, 142.6, 144.2, 152.7, 156.4, 158.3, 168.8; IR (KBr) ν: 1672 (C=O) cm-1.Anal. calcd for C22H13N3OS2: C 66.14, H 3.82, N 10.52; found C 66.23, H 3.94, N 10.63.
6-(2-甲氧基苯基) 苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5c):黄色结晶. Rf=0.43 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (CF3CO2D, 400 MHz)δ: 2.99 (s, 3H), 7.13~7.17 (m, 2H), 7.34~7.39 (m, 2H), 7.60~7.67 (m, 2H), 7.73~7.77 (m, 1H), 8.04 (d, J=8.0 Hz, 1H), 8.12~8.13 (m, 1H), 8.40 (d, J=8.0 Hz, 1H); 13C NMR (CF3CO2D, 100 MHz) δ: 54.7, 107.1, 111.3, 114.0, 119.5, 121.0, 122.4, 122.5, 123.5, 126.7, 127.0, 128.8, 131.2, 131.7, 134.0, 141.0, 142.3, 152.2, 155.6, 155.9, 156.8, 168.5; IR (KBr) ν: 1686 (C=O) cm-1. Anal. calcd for C22H13N3O2S2: C 63.60, H 3.15, N 10.11; found C 63.69, H 3.21, N 10.23.
6-(3-甲氧基苯基) 苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5d):黄色结晶. Rf=0.45 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (CF3CO2D, 400 MHz) δ: 4.00 (s, 3H), 7.27~7.36 (m, 3H), 7.42 (d, J=4.8 Hz, 1H), 7.61 (t, J=8.0 Hz, 1H), 7.61 (t, J=8.0 Hz, 1H), 7.85 (dd, J=7.6, 8.0 Hz, 1H), 8.14 (d, J=8.4 Hz, 1H), 8.19 (d, J=4.8 Hz, 1H), 8.50 (d, J=8.4 Hz, 1H); 13C NMR (CF3CO2D, 100 MHz) δ: 55.1, 106.0, 114.1, 115.2, 116.6, 121.2, 122.5, 123.6, 126.7, 126.8, 127.0, 130.5, 131.7, 131.8, 131.9, 140.7, 142.6, 152.7, 156.1, 157.0, 158.6, 168.9; IR (KBr) ν: 1680 (C=O) cm-1. Anal. calcd for C22H13N3O2S2: C 63.60, H 3.15, N 10.11; found C 63.69, H 3.26, N 10.19.
6-(4-甲氧基苯基) 苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5e):黄色结晶. Rf=0.40 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (CF3CO2D, 400 MHz) δ: 4.02 (s, 3H), 7.21 (d, J=8.0 Hz, 2H), 7.42 (d, J=4.8 Hz, 1H), 7.64~7.73 (m, 3H), 7.84 (dd, J=7.2, 8.0 Hz, 1H), 8.13 (d, J=8.4 Hz, 1H), 8.19 (d, J=4.8 Hz, 1H), 8.51 (d, J=8.0 Hz, 1H); 13C NMR (CF3CO2D, 400 MHz) δ: 54.9, 105.8, 114.1, 114.5, 122.5, 122.6, 123.3, 123.5, 126.7, 127.0, 130.4, 131.1, 131.8, 140.7, 142.6, 152.8, 156.3, 157.6, 162.0, 168.7; IR (KBr) ν: 1678 (C=O) cm-1. Anal. calcd for C22H13N3-O2S2: C 63.60, H 3.15, N 10.11; found C 63.68, H 3.23, N 10.20.
6-(4-羟基苯基) 苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5f):黄色结晶. Rf=0.38 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (CF3CO2D, 400 MHz) δ: 7.22 (d, J=8.8 Hz, 1H), 7.43 (d, J=4.8 Hz, 1H), 7.57~7.64 (m, 2H), 7.73~7.88 (m, 2H), 8.14~7.21 (m, 3H), 8.51 (d, J=4.8 Hz, 1H); 13C NMR (CF3CO2D, 100 MHz) δ: 114.1, 115.9, 121.2, 122.6, 123.6, 126.8, 127.0, 129.9, 130.2, 130.6, 131.8, 132.0, 140.8, 142.7, 152.0, 152.8, 156.0, 157.8, 169.1; IR (KBr) ν: 3316 (OH), 1682 (C=O) cm-1. Anal. calcd for C21H11N3O2S2: C 62.83, H 2.76, N 10.47; found C 62.89, H 2.84, N 10.56.
6-(4-氯苯基) 苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5g):黄色结晶. Rf=0.34 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (CF3CO2D, 400 MHz) δ: 7.40~7.43 (m, 1H), 7.59~7.63 (m, 4H), 7.72~7.74 (m, 1H), 7.86~7.88 (m, 1H), 8.16~8.20 (m, 2H), 8.52 (d, J=8.0 Hz, 1H); 13C NMR (CF3CO2D, 100 MHz) δ: 106.0, 114.1, 122.5, 123.6, 126.8, 127.0, 128.6, 129.1, 129.3, 131.7, 131.9, 139.4, 139.5, 140.1, 142.6, 152.7, 156.1, 156.7, 168.9; IR (KBr) ν: 1684 (C=O) cm-1. Anal. calcd for C21H10ClN3OS2: C 60.07, H 2.40, N 10.01; found C 60.14, H 2.52, N 10.12.
6-(4-硝基苯基) 苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5h):黄色结晶. Rf=0.30 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (CF3CO2D, 400 MHz) δ: 7.43 (d, J=4.8 Hz, 1H), 7.74~7.77 (m, 1H), 7.87~7.93 (m, 3H), 8.17~8.20 (m, 2H), 8.51~8.55 (m, 3H); 13C NMR (CF3CO2D, 100 MHz) δ: 106.2, 114.0, 122.4, 122.5, 123.6, 123.8, 123.9, 126.9, 127.0, 129.7, 132.5, 137.3, 140.9, 142.7, 149.2, 152.7, 154.5, 155.8, 169.3; IR (KBr) ν: 1689 (C=O) cm-1. Anal. calcd for C21H10N4O3S2: C 58.59, H 2.34, N 13.02; found C 58.67, H 2.46, N 13.11.
6-(呋喃-2-基) 苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5i):黄色结晶. Rf=0.44 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (CF3CO2D, 400 MHz) δ: 6.85~6.86 (m 1H), 7.37~7.38 (m, 1H), 7.63~7.67 (m, 1H), 7.73~7.77 (m, 1H), 7.89~8.01 (m, 2H), 8.23~8.24 (m, 1H), 8.39 (d, J=3.6 Hz, 1H), 8.43 (d, J=8.4 Hz, 1H); 13C NMR (CF3CO2D, 100 MHz) δ: 103.6, 113.9, 114.4, 122.0, 122.8, 123.5, 126.1, 126.6, 126.7, 129.5, 131.7, 139.9, 142.4, 142.5, 143.6, 149.0, 153.2, 155.2, 168.3; IR (KBr) ν: 1676 (C=O) cm-1. Anal. calcd for C19H9N3O2S2: C 60.79, H 2.42, N 11.19; found C 60.87, H 2.49, N 11.26.
6-(噻吩-2-基) 苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5j):黄色结晶. Rf=0.43 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (CF3CO2D, 400 MHz) δ: 7.27~7.28 (m, 1H), 7.38 (d, J=8.8 Hz, 1H), 7.59 (d, J=4.8 Hz, 1H), 7.65~7.69 (m, 1H), 7.78~7.84 (m, 2H), 8.09 (d, J=8.4 Hz, 1H), 8.18 (d, J=4.8 Hz, 1H), 8.47 (d, J=8.4 Hz, 1H); 13C NMR (CF3CO2D, 100 MHz) δ: 106.5, 114.1, 122.5, 122.6, 123.5, 126.8, 126.9, 127.6, 129.2, 131.9, 132.2, 132.6, 140.8, 142.6, 150.1, 151.3, 152.6, 155.9, 168.8; IR (KBr): ν 1679 (C=O) cm-1. Anal. calcd for C19H9N3OS3: C 58.29, H 2.32, N 10.73; found C 58.37, H 2.44, N 10.46.
6-丙基苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5k):黄色结晶. Rf=0.51 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (CF3CO2D, 400 MHz) δ: 1.22 (t, J=6.8 Hz, 3H), 1.97~1.99 (m, 2H), 3.82~3.85 (m, 2H), 7.44~7.45 (m, 1H), 7.75~7.76 (m, 1H), 7.85~7.86 (m, 1H), 8.12~8.13 (m, 1H), 8.37~8.39 (m, 1H), 8.51~8.53 (m, 1H); 13C NMR (CF3CO2D, 100 MHz) δ: 12.2, 22.9, 36.0, 106.1, 113.8, 122.2, 122.8, 123.6, 126.7, 126.9, 130.0, 131.8, 140.6, 142.4, 152.8, 155.6, 163.3, 168.5; IR (KBr) ν: 1675 (C=O) cm-1. Anal. calcd for C18H13N3OS2: C 61.52, H 3.73, N 11.96; found C 61.63, H 3.85, N 12.05.
6-正丁基苯并噻吩并[3', 2':2, 3]吡啶并[4, 5-d]噻唑并[3, 2-a]嘧啶-5-酮 (5l):黄色结晶. Rf=0.51 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (CF3CO2D, 400 MHz) δ: 0.99 (t, J=6.8 Hz, 3H), 1.60~1.62 (m, 2H), 1.85~1.86 (m, 2H), 3.79~3.80 (m, 2H), 7.40 (d, J=3.2 Hz, 1H), 7.64~7.68 (m, 1H), 7.75~7.78 (m, 1H), 8.03 (d, J=8.0 Hz, 1H), 8.29 (d, J=3.2 Hz, 1H), 8.43 (d, J=8.0 Hz, 1H); 13C NMR (CF3CO2D, 100 MHz) δ: 11.6, 22.2, 31.4, 34.1, 106.0, 113.8, 122.1, 122.8, 123.4, 126.6, 126.8, 129.8, 131.6, 140.5, 142.2, 152.6, 155.4, 163.5, 168.4; IR (KBr) ν: 1672 (C=O) cm-1. Anal. calcd for C20H17N3OS2: C 63.30, H 4.52, N 11.07; found C 63.39, H 4.61, N 11.13.
辅助材料 (Supporting Information)化合物3和5的核磁共振氢谱、碳谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.2 7-(3-氨基苯并噻吩-2-基) 噻唑并[3, 2-a]嘧啶酮 (3) 的制备
将7-氯甲基噻唑并[3, 2-a]嘧啶酮 (1) (2.01 g, 10.0 mmol), 2-巯基苯甲腈 (2) (1.35 g, 10.0 mmol), 无水碳酸钾 (2.76 g, 20.0 mmol), 加入到DMF (25 mL) 中, 100 ℃下反应6 h, 薄层色谱 (TLC) 监控反应.冷却至室温, 将反应液转入水 (50 mL) 中, 过滤、水洗, 得到粗产物, 干燥, DMF重结晶, 得到中间体3.黄色结晶. Rf=0.55 [V(正己烷):V(乙酸乙酯)=2:1]. m.p.>300 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 5.97 (s, 1H), 7.39~7.49 (m, 5H), 7.83 (d, J=8.0 Hz, 1H), 8.01 (d, J=4.8 Hz, 1H), 8.10 (d, J=8.0 Hz, 1H); IR (KBr) ν: 3426, 3356 (NH2), 1682 (C=O) cm-1. Anal. calcd for C14H9N3OS2: C 56.17, H 3.03, N 14.04; found C 56.23, H 3.14, N 14.15.
-
-
[1]
Dinakaran, V. S.; Bomma, B.; Srinivasan, K. K. Pharma Chem. 2012, 4, 255.
-
[2]
Flefel, E. E.; M. Salama, A.; El-Shahat, M. Phosphorus, Sulfur Silicon Relat. Elem. 2007, 182, 1739. doi: 10.1080/10426500701313912
-
[3]
Tozkoparan, B.; Ertan, M.; Kelicen, P.; Demirdamar, R. Farmaco 1999, 54, 588. doi: 10.1016/S0014-827X(99)00068-3
-
[4]
Mohamed, S. F.; Flefel, E. M.; Amr, A. E.-G. E.; Abd El-Shafy, D. N. Eur. J. Med. Chem. 2010, 45, 1494. doi: 10.1016/j.ejmech.2009.12.057
-
[5]
Alam, O.; Khan, S. A.; Siddiqui, N.; Ahsan, W. Med. Chem. Res. 2010, 19, 1245. doi: 10.1007/s00044-009-9267-8
-
[6]
(a) Kulakov, I. V. Chem. Heterocycl. Compd. 2009, 45, 1019.
(b) Abbas, A. E.; Mahdieh, Z.; Ali, R. F.; Azizollah, H. Tetrahedron Lett. 2012, 53, 1351.
(c) Abd El-Galil, E. A.; Maigali, S. S.; Abdulla, M. M. Monatsh. Chem. 2008, 139, 1409. -
[7]
(a) Huang, J.; Luo, H.; Wang, L.; Guo, Y.; Zhang, W.; Chen, H.; Zhu, M.; Liu Y.; Yu, G. Org. Lett. 2012, 14, 3300.
(b) Ni, Y.; Nakajima, K.; Kanno K.; Takahashi, T. Org. Lett. 2009, 11, 3702. -
[8]
Romagnoli, R.; Baraldi, P. G.; Carrion, M. D.; Cara, C. L.; Preti, D.; Fruttarolo, F.; Pavani, M. G.; Tabrizi, M. A.; Tolomeo, M.; Grimaudo, S.; Cristina, A. D.; Balzarini, J.; Hadfield, J. A.; Brancale, A.; Hamel, E. J. Med. Chem. 2007, 50, 2273. doi: 10.1021/jm070050f
-
[9]
Chonan, T.; Wakasugi, D.; Yamamoto, D.; Yashiro, M.; Oi, T.; Tanaka, H.; Ohoka-Sugita, A.; Io, F.; Koretsune H.; Hiratate, A. Bioorg. Med. Chem. 2011, 19, 1580. doi: 10.1016/j.bmc.2011.01.041
-
[10]
Berrade, L.; Aisa, B.; Ramirez, M. J.; Galiano, S.; Guccione, S.; Moltzau, L. R.; Levy, F. O.; Nicoletti, F.; Battaglia, G.; Molinaro, G.; Aldana, I.; Monge, A.; Perez-Silanes, S. J. Med. Chem. 2011, 54, 3086. doi: 10.1021/jm2000773
-
[11]
Lee, K. C.; Moon, B. S.; Lee, J. H.; Chung, K. H.; Katzenellenbogen, J. A.; Chi, D. Y. Bioorg. Med. Chem. 2003, 11, 3649. doi: 10.1016/S0968-0896(03)00362-6
-
[12]
Vogel, V. G.; Costantino, J. P.; Wickerham, D. L.; Cronin, W. M.; Cecchini, R. S.; Atkins, J. N.; Bevers, T. B.; Fehrenbacher, L.; Pajon, E. R.; Wade, J. L.; Robidoux, A.; Margolese, R. G.; James, J.; Lippman, S. M.; Runowicz, C. D.; Ganz, P. A.; Reis, S. E.; McCaskill-Stevens, W.; Ford, L. G.; Jordan V. C.; Wolmark, N. 2006, 295, 2727.
-
[13]
Lu, P.; Schrag, M. L.; Slaughter, D. E.; Raab, C. E.; Shou, M.; Rodrigues, A. D. Drug Metab. Dispos. 2003, 31, 1352. doi: 10.1124/dmd.31.11.1352
-
[14]
Croxtall, J. D.; Plosker, G. L. Drugs 2009, 69, 339. doi: 10.2165/00003495-200969030-00009
-
[15]
Pictet, A.; Spengler, T. T. Ber. 1911, 44, 2030. doi: 10.1002/(ISSN)1099-0682
-
[16]
Chrzanowska, M.; Rozwadowska, M. D. Chem. Rev. 2004, 104, 3341. doi: 10.1021/cr030692k
-
[17]
(a) Kundu, B.; Sawant, D.; Partani, P.; Kesarwani, A. P. J. Org. Chem. 2005, 70, 4889.
(b) Duggineni, S.; Sawant, D.; Saha, B.; Kundu, B. Tetrahedron 2006, 62, 3228.
(c) Saha, B.; Sharma, D.; Sawant, D.; Kundu, B. Tetrahedron 2008, 64, 8676. -
[18]
Kundu, B.; Agarwal, P. K.; Sharma, S. K.; Sawant, D.; Man-dadapu, A. K.; Saifuddin, M.; Gupta, S. Curr. Org. Synth. 2012, 9, 357. doi: 10.2174/157017912801270559
-
[19]
(a) Wang, D. L.; Wang, D.; Yan, L.; Pan, G. Y.; Yang, J. N. Heterocycles 2016, 92, 552.
(b) Wang, D. L.; Wang, D.; Yan, L.; Pan, G. Y.; Yang, J. N. Chin. Chem. Lett. 2016, 27, 953. -
[20]
(a) Litvinov, V. P.; Dotsenko, V. V.; Krivokolysko, S. G. Russ. Chem. Bull. 2005, 54, 864.
(b) Litvinov, V. P.; Dotsenko, V. V.; Krivokolysko, S. G. In Advances in Heterocyclic Chemistry, Ed.: Katritzky, A. R., Academic, New York, 2007, 93, 117. -
[21]
Djekou, S.; Gellisa, A.; Vanelle, P.; El-Kashef, H. J. Heterocycl. Chem. 2006, 43, 1225. doi: 10.1002/jhet.v43:5
-
[22]
周建峰, 贡桂霞, 安礼涛, 孙小军, 朱凤霞, 有机化学, 2009, 29, 1988. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338499.shtmlZhou J. F.; Gong, G. X.; An, L. T.; Sun, X. J.; Zhu. F. X. Chin. J. Org. Chem. 2009, 29, 1988 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338499.shtml
-
[1]
-
表 1 合成化合物5a的反应条件的优化a
Table 1. Optimization of the reaction conditions for the synthesis of 5a
Entry Catalyst (mol%) Solvent Temp./℃ Time/h Yield/% 1 SA (5) DMF 120 16 36 2 SA (10) DMF 120 7 85 3 SA (15) DMF 120 9 80 4 SA (10) DMF 140 7 76 5 SA (10) DMF 100 13 72 6 SA (10) DMSO 120 5 60 7 SA (10) Toluene 110 18 66 8 SA (10) HOAc 120 12 77 9 SA (10) EtOH 80 22 54 10 p-TsOH (10) DMF 120 12 76 11 TFA (10) DMF 120 10 78 a Reaction conditions: 3a(1.0 mmol), benzaldehyde (4a, 1.0 mmol), solvent (20 mL). 表 2 化合物5的反应时间及产率a
Table 2. Reaction times and yields of the products 5
Entry Products R Timea/h Yieldb/% 1 5a C6H5 7 85 2 5b 4-MeC6H4 6 83 3 5c 2-MeOC6H4 8 76 4 5d 3-MeOC6H4 5 80 5 5e 4-MeOC6H4 5 88 6 5f 4-HOC6H4 6 80 7 5g 4-ClC6H4 9 77 8 5h 4-NO2C6H4 13 74 9 5i 2-Furyl 10 73 10 5j 2-Thienyl 12 76 11 5k n-Pr 14 63 12 5l n-Bu 15 67 aReaction progress monitored by TLC. b Isolated yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 2042
- HTML全文浏览量: 237


 下载:
下载:

 下载:
下载:

