 图 图式 1
mpg-C3N4催化下串联反应合成苯并噁唑和苯并咪唑
Figure 图式 1.
Synthesis of benzoxazole and benzimidazole by mpg-C3N4-catalyzed cascade reaction
图 图式 1
mpg-C3N4催化下串联反应合成苯并噁唑和苯并咪唑
Figure 图式 1.
Synthesis of benzoxazole and benzimidazole by mpg-C3N4-catalyzed cascade reaction

Citation: Dai Xiaoqiang, Zhu Yabo, Xu Xiaoliang, Weng Jianquan. Photocatalysis with g-C3N4 Applied to Organic Synthesis[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 577-585. doi: 10.6023/cjoc201609015

g-C3N4光催化剂在有机合成中的应用
English
Photocatalysis with g-C3N4 Applied to Organic Synthesis
-
Key words:
- graphite carbon nitride
- / visible light catalysis
- / organic reactions
-
光化学转换在光催化有机合成中已成为一种重要的工具[1, 2].这种方法相比于传统的方法有着可持续、反应条件温和等特点.可见光具有资源丰富、使用方便、绿色能源的特点, 对使用可见光进行光催化有机合成反应具有很大的发展前景[3~7].从1970年, Fujishima和Honda[8]发现采用TiO2和Pt组成的光电极进行光催化分解水产生氧气和氢气.这一发现让光催化逐渐在有机合成中被人们所关注.在这近几年, 光催化主要用于光催化裂解水[9, 10]、降解有机污染物[11]、CO2还原成碳氢燃料[12]、选择性有机合成[13]等一些领域.
可见光催化剂的种类繁多, 主要有贵重金属络合物, 如[Ru (bpy)3]Cl2、Ir (ppy)2(dtbbpy) PF6、Co (acac)3[14]等.有机染料, 如Eosin B、Eosin Y、rose Bengal等.半导体无机金属氧化物, 如TiO2、V2O5等.以及一些新型的金属有机骨架 (MOF) 结构和纳米石墨氮化碳 (g-C3N4)、介孔纳米石墨氮化碳 (mpg-C3N4) 光催化剂.
石墨氮化碳是一类具有固态石墨结构的催化剂, 是一种非均质光催化剂, 其具有一定的比表面积被运用在选择性有机光催化反应中[15]. 1830年Berzelius和Liebig最早发现了g-C3N4的雏形[16].在2006年, 才真正的介绍了g-C3N4被应用于非均相催化反应[17, 18].然而, 在2009年, Wang课题组[19]第一次报道了g-C3N4作为光催化剂, 利用可见光进行裂解水. 2015年, Yu等[20]从g-C3N4的制备方法、结构表征、水裂解、有机污染物降解、有机合成的原理等领域进行了综述. g-C3N4不同于半导体TiO2, 仅仅活跃在紫外光区域, 其具有2.7 eV的能带, 在可见光区域也能进行吸收, 很大程度上利用了光能[21].然而, 介孔石墨氮化碳 (mpg-C3N4) 因其具有提高光捕获能力, 提高材料的反应吸附能[22], 大的比表面积[23]和丰富的表面积位点[24]等特点被学者们研究.
本文主要根据反应类型的不同, 对石墨氮化碳这一类可见光催化剂在催化有机合成中的应用进行了简单的概述.
1 氧化反应
1.1 醇的氧化
在光催化合成中, 应用最为广泛的是Ru、Ir、Rh等贵金属络合物, 而非金属g-C3N4半导体材料具有可见光的吸收能带, 而且廉价易得, 作为一类替代贵金属光催化剂具有重要的意义.研究发现这一类非金属纳米材料在很多有机合成中得到报道, 2010年Wang课题组[25]用介孔石墨氮化碳 (mpg-C3N4) 作为半导体光催化剂, 在可见光下利用O2选择性氧化芳香醇成羰基化合物 (Eq. 1).通过结合半导体mpg-C3N4催化剂表面的碱度和催化功能, 以及通过产生活性·OOH, 该光催化体系实现高选择性催化生成相应的醛/酮.
随后2012年, Zheng等[26]利用非金属介孔石墨氮化碳 (mpg-C3N4) 作光催化剂, 催化氧化α-羟基酮成1, 2-二酮 (Eqs. 2, 3).该合成方法具有绿色、高效、路线简便等特点, 并对这一反应机理进行了阐述.
2013年, Wang课题组[27]报道了在可见光照射下, 以介孔石墨氮化碳 (mpg-C3N4) 作光催化剂, 水作溶剂, 能选择性地利用氧气将芳香醇氧化成芳香醛 (Eq. 4).相比于传统方法使用昂贵的无机氧化剂和有害的有机溶剂制备醛, 该方法具有环境友好、绿色经济等优点.但转化率及产率不高.
同年Wang课题组[28]利用3-氨基噻吩-2-甲腈 (ATCN) 与双氰胺构建了具有介孔氮化碳和噻吩共轭结构的光催化剂MCN-ATCN, 在可见光下, 以氧气作氧化剂, 选择性氧化苄醇为醛 (Eq. 5).该种催化剂具有很高的选择性, 相比于其他苄醇的氧化具有不错的转化率.
Zhang等[29]报道了直接以g-C3N4为光催化剂, 在可见光下, 利用氧气选择性氧化苄醇成醛 (Eq. 6), 并采用循环伏安法监控了反应进程.
2014年, Shiraishi等[30]也利用石墨氮化碳 (g-C3N4) 作光催化剂, 在可见光下, 用氧气氧化醇的反应制备出了双氧水, 并将醇氧化成醛 (Eq. 7).该研究为传统方法使用爆炸性气体H2/O2制备双氧水开辟了新的方法.
Chen等[31]报道了通过合成CdS/g-C3N4复合物光催化剂, 在可见光下, 能选择性地氧化芳香醇成芳醛和硝基苯还原成苯胺 (Eq. 8).这种复合物具有协同效应, 可以有效地分离和传送光激发载流子, 提高光催化活性, 证明了芳香醇是直接孔氧化、硝基苯是直接电子还原, 但这种协同效应对醇的氧化效率不高.
2015年, Wang等[32]报道了这种非金属催化体系, 介孔石墨氮化碳 (mpg-C3N4) 和N-邻苯二甲酰亚胺 (NHPI).在可见光下, 能选择性氧化各种芳香醇成醛/酮 (Eq. 9). NHPI作为有效吸氧共催化剂, 使该催化体系具有很高的选择催化活性, 提高催化系统中mpg-C3N4的比例可将苄醇氧化成苯甲醛.该反应提供了一种高效、反应条件温和、环境友好的合成方法.
2016年, Varma等[33]报道了在石墨氮化碳中负载氧化钒 (VO@g-C3N4) 作光催化剂, 在可见光介导下, 光活化VO@g-C3N4选择性地催化氧化醇成相应的醛/羰基化合物 (Eqs. 10~12).相比于不负载型的石墨氮化碳 (24 h, 10% yield), 负载VO不仅大大缩短反应时间, 而且提高了反应产率.
1.2 苯的氧化
苯酚 (Phenol) 作为一种重要的化工原料, 其生产工艺十分成熟, 异丙苯法应用于生产苯酚具有产品纯度高、原料能耗低等优点.光催化氧化苯作为21世纪的一种新方法, 为苯酚的合成提供了一条新的路线, 且反应条件温和、能源丰富、副产物少.
2009年, Wang等[34]首次报道了将石墨氮化碳 (g-C3N4) 进行修饰, 将10 wt%的Fe掺杂到石墨氮化碳中, 在可见光下, 以H2O2作氧化剂, 选择性的直接将苯氧化成苯酚 (Eq. 13).
随后, 2011年, Wang课题组[35]报道了过渡金属掺杂石墨氮化碳 (M-g-C3N4) 制备有机-无机混合物光催化剂, 并将该混合物分散在SBA-15中制得介孔光催化剂 (M-g-C3N4/SBA-15), 在可见光下, 利用双氧水作氧化剂选择性氧化苯为苯酚 (Eq. 14).该种催化剂体系还能氧化降解各种有机污染物, 具有宽广的催化活性, 但其对苯的催化氧化性能不高.
2012年, 伊朗学者Badiei等[36]将Fe、纳米多孔二氧化硅 (LUS-1)、双氰胺用热分解法合成了Fe-g-C3N4-LUS-1纳米光催化剂.在日光照射下, 用双氧水氧化苯羟基化成苯酚 (Eq. 15), 这种负载型催化剂对苯的催化氧化效果不佳.
2013年, Wang等[37]报道了FeCl3/mpg-C3N4混合物作光催化剂, 100 W汞灯用420 nm的截止滤光器滤作可见光光源辐射, 在双相反应体系中直接将苯氧化成苯酚 (Eq. 16).
2014年, Wang课题组[38]将二茂铁以C=N共价键的形式修饰到氮化碳聚合物 (Fc-MCN) 上, 使两部分形成非均相共轭体系, 在可见光和H2O2下, 这种多相Photo-Fenton系统能直接将苯催化氧化成苯酚 (Eq. 17).该创新的修饰方法能合成功能化的二面体聚合物, 为以后利用太阳能进行绿色合成具有重要的参考意义.
同年, Wang课题组[39]以双氰胺为原料利用热聚合法合成掺杂Fe的石墨氮化碳 (Fe-C3N4) 和钛硅分子筛 (TS-1) 混合材料, 将该复合材料Fe-C3N4/TS-1作为非均相催化剂, H2O2作氧化剂, 进行了选择性光催化氧化苯成苯酚 (Eq. 18).
石墨氮化碳及其修饰物作为光催化剂应用于苯的催化氧化, 为苯的氧化提供了一条新的方法和路线.但是上述反应中, 苯酚的产率都比较低, 说明苯的芳香结构比较难实现光催化的自由基反应.
1.3 胺的氧化
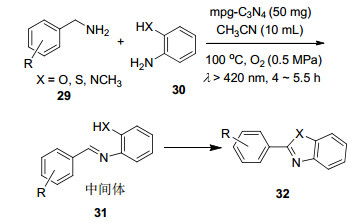
胺类的氧化在光催化反应中很多, 而利用氮化碳催化胺的氧化并不多见. 2011年, Wang课题组[40]初次报道了mpg-C3N4为光催化剂, 在可见光下, 非均相催化体系中, 无任何金属衍生物或有机氧化试剂, 利用O2将胺氧化成亚胺 (Eq. 19).而且这一反应体系利用一锅法, 通过催化串联反应可以简单有效地合成苯并噁唑和苯并咪唑等化合物 (Scheme 1).
 图 图式 1
mpg-C3N4催化下串联反应合成苯并噁唑和苯并咪唑
Figure 图式 1.
Synthesis of benzoxazole and benzimidazole by mpg-C3N4-catalyzed cascade reaction
图 图式 1
mpg-C3N4催化下串联反应合成苯并噁唑和苯并咪唑
Figure 图式 1.
Synthesis of benzoxazole and benzimidazole by mpg-C3N4-catalyzed cascade reaction
该反应对取代基具有很好的容忍性, 且反应体系对伯胺、肿胺都具有很好的转化及选择性, 为胺类的氧化提供了一种新的方法.
1.4 其他的氧化反应
2011年, Li等[41]报道了石墨氮化碳 (g-C3N4) 和N-羟基化合物作非金属共催化剂, 氧气为氧化剂.在可见光下, 具有高选择性的氧化烯丙基化合物为醛/酮 (Eq. 20), 此光催化体系活化了α位的C—H键, 使反应条件温和、高效, 但对非α位的C—H键的催化氧化转化率较差.
2012年, Wang等[42]报道了介孔石墨氮化碳 (mpg-C3N4) 中加入醛类物质, 在可见光下, O2作氧化剂, 室温下能选择性地将甲基苯硫醚氧化成亚砜 (Eqs. 21~22).该体系反应4 h转化率达到97%, mpg-C3N4可以简单地通过过滤重复利用多次仍有活性, 而且能催化带有各种基团的硫化物和苯基二硫化合物, 具有很好的容忍性.
2013年, Cao等[43]首次用介孔石墨氮化碳 (mpg-C3N4) 作光催化剂氧化裂分α-羟基酮C—C键制备苯甲酸 (Eq. 23).该合成方法独特, 反应路线简单, 且催化体系具有广泛的适用性、对各种芳香环上官能团具有很好的容忍性.
2016年, Zhao等[44]研究设计了一种氧化石墨氮化碳 (CNO), 将原始材料石墨氮化碳加入到混合的浓硫酸和浓硝酸中, 制得黄白色粉末样品为CNO.在50 W氙灯照射下, 氧气为氧化剂, 氧化石墨氮化碳 (CNO) 产生的活性单线态氧可将硫醚氧化成亚砜 (Eq. 24).相比于原始的g-C3N4, 修饰过的CNO具有很高的转化率及选择性.
2016年, 本课题组[45]报道了利用光催化氧化双甘膦制备草甘膦的方法.利用含石墨氮化碳等混合比例作光催化剂, 在可见光下, 在氧气作用下氧化制备得到了草甘膦 (Eq. 25), 该方法反应条件温和、反应步骤简便.
2 还原反应
2.1 二氧化碳的还原
温室气体二氧化碳一直是一个热点问题, 利用光催化将CO2还原制备化工原料具有重要意义. 2013年, Peng等[46]发表了一篇关于石墨氮化碳的两种制备原料不同, 其催化效果也不同.在可见光下, 由尿素制备的介孔片状结构石墨氮化碳 (u-g-C3N4) 还原CO2得甲醇和乙醇两种产物 (Eq. 26);三聚氰胺制备的无孔片状结构石墨氮化碳 (m-g-C3N4) 选择性还原CO2主要得乙醇和痕量的甲醇 (Eq. 27). NaOH在二氧化碳还原系统中扮演着两个关键的作用:其一能溶解大量的CO2; 其二OH-能作为孔清除剂, 可以延缓光生载流子复合.
2014年, Liu等[47]报道了两种能带隙不同的石墨氮化碳, 大体积石墨氮化碳 (2.77 eV) 还原二氧化碳成乙醛 (Eq. 28);石墨氮化碳纳米薄片 (2.97 eV) 还原得甲烷 (Eq. 29).此催化体系充分说明了不同能带隙结构的石墨氮化碳是影响二氧化碳还原产物的主要因素, 这一发现对以后研究选择性还原二氧化碳具有重要意义.
2015年, Yu等[48]研究了一种g-C3N4/ZnO二元态光催化剂系统 (G10), 它不同于传统的异质结构型机制, 而是Z-型机制, 具有更好的催化性能.在300 W的氙灯照射下, 氮气保护, 使用自制的Pyrex反应器能选择性的直接将二氧化碳还原成甲醇 (Eq. 30).该反应体系使用碳酸氢钠作为CO2源, GC检测反应过程, 甲醇产率相比于g-C3N4 (0.26) 能达到0.6 μmol·h-1·g-1.
同年, Chai等[49]研究报道了利用尿素和氧化石墨作前躯体, 制造出了一种类似三明治结构石墨烯-石墨氮化碳 (GCN).以15 W节能灯照射, 在温和条件下能将二氧化碳还原成甲烷 (Eq. 31).该体系以水作反应淬灭剂, 而且石墨烯通过抑制电子空穴的复合, 增加了电荷转移, 提高体系2~3倍的反应效率.
通过一系列的研究发现, 纯粹的利用石墨氮化碳 (g-C3N4) 来进行选择性催化还原二氧化碳得到想要的产物效果并不好, 研究者们通过制备各种不同石墨氮化碳掺杂复合物可以实现各种想要的化工原料. Cao等[50]研究了胺功能化石墨氮化碳还原二氧化碳成甲烷和甲醇, 日本学者Ohno等[51]发明了P-类型硼掺杂石墨氮化碳还原CO2成乙醇, 碳化硼 (B4C) 掺杂石墨氮化碳还原二氧化碳成甲烷[52], WO3/g-C3N4还原二氧化碳成甲醇[53]以及Jiang等[54]研究的石墨氮化碳纳米片和磺化聚合物形成的纳米复合物光催化材料.
2.2 其他的还原反应
2016年, Nadagouda等[55]报道了一种光活性催化剂Fe@g-C3N4, 以水合肼作为氢源, 在可见光下, 催化还原烯烃和炔烃 (Eqs. 32~33).该催化体系避免了高压加氢的风险、节约能耗且产率高.
2016年, 李东升等[56]发明的一项专利, 将贵金属 (Ag、Au) 负载在介孔石墨氮化碳 (Ag@mpg-C3N4) 中, 在可见光下, 利用硼氢化钾催化还原有机污染物对硝基苯酚为对胺基苯酚 (Eq. 34).对胺基苯酚在化工、医药及油品添加剂等工业领域有着很广泛的应用, 可将其提取作为化工合成原料具有重要意义.
3 C—C键的形成
碳-碳键的形成在有机合成中是一个永恒的主题, 非活泼C—H键活化在有机合成中更是一个热题, 其中交叉脱氢偶联 (CDC) 反应能实现更短的合成路线, 使原子利用率更高.光催化利用氮化碳催化C—C键的形成提供了一条更便捷、绿色的合成路线.
2012年, Wang课题组[57]报道了利用介孔石墨氮化碳 (mpg-C3N4) 作多相光催化剂, 三乙胺作自由基引发剂, 在可见光下催化甲基丙烯酸甲酯发生聚合反应 (Eq. 35).反应中胺的碱性和有效氢能促进反应的有利发生, 该反应条件温和、产物易分离等特点, 但反应转化率不高.
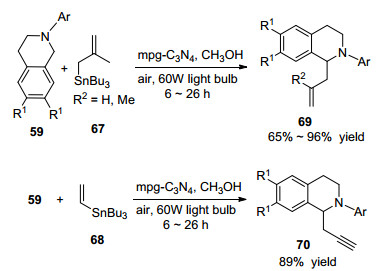
2012年, Blechert课题组[58]报道了氧化N-芳基四氢异喹啉C—C键形成, 各种亲核试剂在非常温和的条件以及环境友好的状态下采用微孔石墨氮化碳 (mpg-C3N4) 半导体作多相光催化剂, 在光照下, 氧气作末端氧化剂, 合成了N-芳基四氢异喹啉衍生物 (Eqs. 36~38).这个系统可以进一步结合脯氨酸-有机催化实现氧化串联光催化, 表明光合作用系统的这种丰富串联反应可能在光催化反应中被实现.
随后, 2014年, Blechert课题组[59]报道了Sakurai C—C键偶联反应, 使用多相微孔石墨氮化碳 (mpg-C3N4) 作光催化剂, 空气为氧化剂, 在60 W日用灯照射下, 采用弱亲核试剂烯丙基或丙二烯基锡烷合成了高产率的N-芳基四氢异喹啉衍生物 (Scheme 2).
2015年, Blechert课题组[60]报道了三氟甲基化和全氟甲基化的多相催化反应, 通过使用廉价、无金属和可循环利用的介孔石墨氮化碳 (mpg-C3N4) 作光催化剂, 在可见光下, 以三氟甲基磺酰氯为氟烷基自由基源, 进行各种芳烃的氟烷基化反应 (Eq. 39).
4 C—O键的形成-酯化反应
C—O键的形成也包括了上述苯的氧化, 而氮化碳作为光催化剂催化酯化反应是首次被报道. 2012年, Song等[61]以氧化锡和石墨氮化碳作为共催化剂 (SnO2/g-C3N4), 在可见光下, 以H2O2/HClO4为氧化剂, 将苯甲醛和醇直接转化成酯 (Eq. 40), 打破了传统工业上利用酸和醇反应制备酯, 为酯的形成提供了一种新的合成方法.虽然此共催化体系中加入SnO2能明显提高反应活性, 但反应转化率不高.
5 环化反应
2011年, Wang课题组[62]发现很多需氧反应在有机生物体中都离不开过渡金属离子, 从而利用铁、铜等掺杂石墨氮化碳制得光催化剂 (Fe/Cu-g-C3N4).在可见光下, 氧气作氧化剂, 可使苯乙烯发生环氧化 (Eq. 41).
2014年, Blechert课题组[63]采用介孔石墨氮化碳 (mpg-C3N4) 作非均相光催化剂, 在blue LED灯照射下, 有效地将2-溴-1, 3-二羰基化合物环合成环戊烷衍生物 (Eqs. 42, 43).作者研究了该反应的机械学论发现使用的溶剂THF不仅具有溶剂作用, 还是氢和电子供体.
2014年, Wang等[64]首次报道了以介孔石墨氮化碳 (mpg-C3N4) 作光催化剂, 在可见光下催化白藜芦醇及其衍生物的单电子氧化过程 (Eq. 44), 该反应条件温和简便、高效、环保的实现了白藜芦醇的二聚环氧化, 适用性广, 对以后的研究具有重要意义.
6 应用于其他反应
石墨氮化碳 (g-C3N4) 类非金属材料作为光催化剂, 不仅仅应用在上述诸多有机合成反应中, 而且在催化裂解水、降解有机污染物方面也得到很广泛的研究.
Tang等[65]研究用g-C3N4模拟光合作用催化裂解水、石墨氮化碳纳米管 (CNR)[66]、铋钒酸盐 (BiVO4) 和硫掺杂石墨氮化碳 (SCN) 复合材料[67]等应用于催化裂解水.
其中Hu等[68]以金属铬掺杂的石墨氮化碳、Fe3O4/g-C3N4纳米复合材料[69]、g-C3N4/Ag3PO4复合物[70]、钾掺杂介孔g-C3N4复合物[71]、mpg-C3N4/TiO2异质结构[72, 73]、SiO2/g-C3N4复合纳米材料[74]和贵金属修饰石墨氮化碳[75]等应用于降解有机污染物以及催化降解含氮氧化物[76~80].
7 结论与展望
石墨氮化碳 (g-C3N4) 在光催化反应中是一种多用途、廉价的非金属光催化剂, 它主要应用于裂解水、降解有机污染物、有机合成等重要领域.该综述主要列举了石墨氮化碳、介孔石墨氮化碳以及石墨氮化碳修饰后的复合物在醇、苯的氧化、二氧化碳的还原、碳-碳键的形成以及环化等反应中的反应实例.石墨氮化碳作为一种新型的光催化剂, 在有机合成中对它的研究仍不够广泛.纵观全文, 该种非金属光催剂对苯的氧化和二氧化碳的还原效果都比较差, 可能是因为苯环的芳香结构、二氧化碳的八偶体结构比较稳定; 主要对醇的氧化、α位C—H键偶联反应活性较好, 产率及转化率都高.
石墨氮化碳相比于那些贵金属络合物而言, 具有原料廉价易得、制备简单等特点.诸多报道g-C3N4制备及应用, 由于g-C3N4电子空穴复合较快、比表面积远小于理论值等原因, 致使其光催化效率仍然较低, 这意味着改进g-C3N4的表面结构以产生丰富的活性位点具有重要的意义.在这方面, 有必要开发合成制备更完美、更丰富的活性位点的g-C3N4.综上反应实例中, g-C3N4应用在一些非稳定芳香结构中以及不具有八偶体稳定结构中会使反应更高效、更有利实现, g-C3N4在光催化反应中的研究更具有意义.
-
-
[1]
Hoffmann, N. Chem. Rev. 2008, 108, 1052. doi: 10.1021/cr0680336
-
[2]
Bach, T.; Hehn, J. P. Angew. Chem., Int. Ed. 2011, 50, 1000. doi: 10.1002/anie.v50.5
-
[3]
Ciamician, G. Science 1912, 36, 385. doi: 10.1126/science.36.926.385
-
[4]
谭芬, 肖文精, 化学学报, 2015, 73, 85. doi: 10.6023/A14120860Tan, F.; Xiao, W. J. Acta Chim. Sinica 2015, 73, 85 (in Chinese). doi: 10.6023/A14120860
-
[5]
孙晓阳, 俞寿云, 有机化学, 2016, 36, 239. doi: 10.6023/cjoc201512006Sun, X. Y.; Yu, S. Y. Chin. J. Org. Chem. 2016, 36, 239 (in Chinese). doi: 10.6023/cjoc201512006
-
[6]
关保川, 许孝良, 王红, 李小年, 有机化学, 2016, 36, 1564. doi: 10.6023/cjoc201601012Guan, B. C.; Xu, X. L.; Wang, H.; Li, X. N. Chin. J. Org. Chem. 2016, 36, 1564 (in Chinese). doi: 10.6023/cjoc201601012
-
[7]
左旋, 吴文亮, 苏伟平, 化学学报, 2015, 73, 1298. doi: 10.6023/A15040284Zuo, X.; Wu, W. l.; Su, W. P. Acta Chim. Sinica 2015, 73, 1298 (in Chinese). doi: 10.6023/A15040284
-
[8]
Fujishima, A.; Hondak, K. Nature 1972, 238, 37. doi: 10.1038/238037a0
-
[9]
Kudo, A.; Miseki, Y. Chem. Soc. Rev. 2009, 38, 253. doi: 10.1039/B800489G
-
[10]
Chen, X. B.; Shen, S. H.; Guo, L. J.; Mao, S. S. Chem. Rev. 2010, 110, 6503. doi: 10.1021/cr1001645
-
[11]
Chatterjee, D.; Dasgupta, S. J. Photochem. Photobiol. C 2005, 6, 186. doi: 10.1016/j.jphotochemrev.2005.09.001
-
[12]
Habisreutinger, S. N.; Schmidt-Mende, L.; Stolarczyk, J. K. Angew. Chem., Int. Ed. 2013, 52, 7372. doi: 10.1002/anie.201207199
-
[13]
Lang, X. J.; Chen, X. D.; Zhao, J. C. Chem. Soc. Rev. 2014, 43, 473. doi: 10.1039/C3CS60188A
-
[14]
Hamada, T.; Ishida, H.; Usui, S.; Watanabe, Y.; Tsumura, K.; Ohkubo, K. J. Chem. Soc., Chem. Commun. 1993, 11, 909.
-
[15]
Su, F. Z.; Mathew, S.; Lipner, G.; Fu, X. Z.; Wang, X. C. J. Am. Chem. Soc. 2011, 331, 195.
-
[16]
Liebig, J. V. Ann. Pharm. 1834, 10, 10.
-
[17]
Goettmann, F.; Fischer, A.; Antonietti, M.; Thomas, A. Angew. Chem., Int. Ed. 2006, 45, 4467. doi: 10.1002/(ISSN)1521-3773
-
[18]
Goettmann, F.; Fischer, A.; Antonietti, M.; Thomas, A. Chem. Commun. 2006, 43, 4530.
-
[19]
Wang, X. C.; Maeda, K.; Thomas, A.; Takanabe, K.; Xin, G.; Carlsson, J. M.; Domen, K. A.; Antonietti, M. Nat. Mater. 2009, 8, 76. doi: 10.1038/nmat2317
-
[20]
Cao, S. W.; Low, J. X.; Yu, J. G.; Jaroniec. M. Adv. Mater. 2015, 27, 2150. doi: 10.1002/adma.201500033
-
[21]
Yan, S. C.; Lv, S. B.; Li, Z. S.; Zou, Z. G. Dalton Trans. 2010, 39, 1488. doi: 10.1039/B914110C
-
[22]
Chen, D. M.; Wang, K. W.; Xiang, D. G.; Zong, R. L.; Yao, W. Q.; Zhu, Y. F. Appl. Catal. B 2014, 147, 554. doi: 10.1016/j.apcatb.2013.09.039
-
[23]
Goettmann, F.; Fischer, A.; Antonietti, M.; Thomas, A. Angew. Chem., Int. Ed. 2006, 45, 4467. doi: 10.1002/(ISSN)1521-3773
-
[24]
Goettmann, F.; Fischer, A.; Antonietti, M.; Thomas, A. Chem. Commun. 2006, 43, 4530.
-
[25]
Su, F. Z.; Mathew, S. C.; Lipner, G.; Fu, X. Z.; Antonietti, M.; Blechert, S.; Wang, X. C. J. Am. Chem. Soc. 2010, 132, 16299. doi: 10.1021/ja102866p
-
[26]
Zheng, Z. S.; Zhou, X. S. Chin. J. Chem. 2012, 30, 1683. doi: 10.1002/cjoc.v30.8
-
[27]
Long, B. H.; Ding, Z. X.; Wang, X. C. ChemSusChem 2013, 6, 2074. doi: 10.1002/cssc.v6.11
-
[28]
Chen, Y.; Zhang, J. S.; Zhang, M. W.; Wang, X. C. Chem. Sci. 2013, 4, 3244. doi: 10.1039/c3sc51203g
-
[29]
Xiao, X. Y.; Jiang, J.; Zhang, L. Z. Appl. Catal. B 2013, 142, 487.
-
[30]
Shiraishi, Y.; Kanazawa, S.; Sugano, Y.; Tsukamoto, D.; Sa-kamoto, H.; Ichikawa, S.; Hirai, T. ACS Catal. 2014, 4, 774. doi: 10.1021/cs401208c
-
[31]
Dai, X.; Xie, M. L; Meng, S. G.; Fu, X. L.; Chen, S. F. Appl. Catal. B 2014, 158, 382.
-
[32]
Zhang, P. F.; Deng, J.; Mao, J. Y.; Li, H. R.; Wang, Y. Chin. J. Catal. 2015, 36, 1580. doi: 10.1016/S1872-2067(15)60871-3
-
[33]
Verma, S.; Nasir Baig, R. B.; Nadagouda, M. N.; Varma, R. S. ACS Sustainable Chem. Eng. 2016, 4, 1094. doi: 10.1021/acssuschemeng.5b01163
-
[34]
Chen, X. F.; Zhang, J. S.; Fu, X. Z.; Antonietti, M.; Wang, X. C. J. Am. Chem. Soc. 2009, 131, 11658. doi: 10.1021/ja903923s
-
[35]
Ding, Z. X.; Chen, X. F.; Antonietti, M.; Wang, X. C. ChemSus-Chem 2011, 4, 274.
-
[36]
Shiravand, G.; Badiei, A.; Ziarani, G. M.; Jafarabadi, M.; Hamzehloo, M. Chin. J. Catal. 2012, 33, 1347. doi: 10.1016/S1872-2067(11)60422-1
-
[37]
Zhang, P. F.; Gong, Y. T.; Li, H. R.; Chen, Z. R.; Wang, Y. RSC Adv. 2013, 3, 5121. doi: 10.1039/c3ra23357j
-
[38]
Ye, X. J.; Cui, Y. J.; Wang, X. C. ChemSusChem 2014, 7, 738. doi: 10.1002/cssc.201301128
-
[39]
Ye, X. J.; Cui, Y. J.; Qiu, X. Q.; Wang, X. C. Appl. Catal. B 2014, 152, 383.
-
[40]
Su, F. Z.; Mathew, S. C.; Möhlmann, L.; Antonietti, M.; Wang, X. C.; Blechert, S. Angew. Chem., Int. Ed. 2011, 50, 657. doi: 10.1002/anie.v50.3
-
[41]
Zhang, P. F.; Wang, Y.; Yao, J.; Wang, C. M.; Yan, C.; Antonietti, M.; Li, H. R. Adv. Synth. Catal. 2011, 353, 1447. doi: 10.1002/adsc.201100175
-
[42]
Zhang, P. F.; Wang, Y.; Li, H. R.; Antonietti, M. Green Chem. 2012, 14, 1904. doi: 10.1039/c2gc35148j
-
[43]
Zhang, H. Y.; Liu, W. J.; Fu, M. L.; Cen, J. H. Lin, J. X.; Cao, H. Appl. Catal. A 2013, 468, 184. doi: 10.1016/j.apcata.2013.08.008
-
[44]
Wang, H.; Jiang, S. L.; Chen, S. C.; Li, D. D.; Zhang, X. D.; Shao, W.; Sun, X. S.; Xie, J. F.; Zhao, Z.; Zhang, Q.; Tian, Y. P.; Xie, Y. Adv. Mater. 2016, 28, 6940. doi: 10.1002/adma.201601413
-
[45]
Xu, X. L.; Mao, R. J.; Li, X. N. CN 105330688, 2016[Chem. Abstr. 2016, 164, 350027].
-
[46]
Mao, J.; Peng, T. Y.; Zhang, X. H.; Li, K.; Ye, L. Q.; Zan, L. Catal. Sci. Technol. 2013, 3, 1253. doi: 10.1039/c3cy20822b
-
[47]
Niu, P.; Yang, Y. Q.; Yu, J. C.; Liu, G.; Cheng, H. M. Chem. Commun. 2014, 50, 10837. doi: 10.1039/C4CC03060E
-
[48]
Yu, W. L.; Xu, D. F.; Peng, T. Y. J. Mater. Chem. A 2015, 3, 19936. doi: 10.1039/C5TA05503B
-
[49]
Ong, W. J.; Tan, L. L.; Chai, S. P.; Yong, S. T. Chem. Commun. 2015, 51, 858. doi: 10.1039/C4CC08996K
-
[50]
Huang, Q.; Yu, J. G.; Cao, S. W.; Cui, C.; Cheng, B. Appl. Surf. Sci. 2015, 358, 350. doi: 10.1016/j.apsusc.2015.07.082
-
[51]
Sagara, N.; Kamimura, S.; Tsubota, T.; Ohno, T. Appl. Catal. B 2016, 192, 193. doi: 10.1016/j.apcatb.2016.03.055
-
[52]
Zhang, X. J.; Wang, L.; Du, Q. C.; Wang, Z. Y.; Ma, S. G.; Yu, M. J. Colloid Interface Sci. 2016, 464, 89. doi: 10.1016/j.jcis.2015.11.022
-
[53]
Ohon, T.; Murakami, N.; Koyanagi, T.; Yang, Y. J. CO2 Util. 2014, 6, 17. doi: 10.1016/j.jcou.2014.02.002
-
[54]
Gang, M. Y.; He, G. W.; Li, Z.; Cao, K. T.; Li, Z. Y.; Yin, Y. H.; Wu, H.; Jiang, Z. Y. J. Membr. Sci. 2016, 507, 1. doi: 10.1016/j.memsci.2016.02.004
-
[55]
Nasir Baig, R. B.; Verma, S.; Varma, R. S.; Nadagouda, M. N. ACS Sustainable Chem. Eng. 2016, 4, 1661. doi: 10.1021/acssuschemeng.5b01610
-
[56]
Li, D. S.; Hu, F. C.; Hou, D. F.; Qiao, X. Q.; Tian, F. Y. CN 105642329, 2016[Chem. Abstr. 2016, 165, 108778].
-
[57]
Kiskan, B.; Zhang, J. S.; Wang, X. C.; Antonietti, M.; Yagci, Y. ACS Macro Lett. 2012, 1, 546. doi: 10.1021/mz300116w
-
[58]
Möhlmann, L.; Baar, M.; Rieß, J.; Antonietti, M.; Wang, X. C.; Blechert, S. Adv. Synth. Catal. 2012, 354, 1909. doi: 10.1002/adsc.v354.10
-
[59]
Moehlmann, L.; Blechert, S. Adv. Synth. Catal. 2014, 356, 2825. doi: 10.1002/adsc.201400551
-
[60]
Baar, M.; Blechert, S. Chem. Eur. J. 2015, 21, 526. doi: 10.1002/chem.v21.2
-
[61]
Song, L. M.; Zhang, S. J.; Wu, X. Q.; Tian, H. F.; Wei, Q. W. Ind. Eng. Chem. Res. 2012, 51, 9510. doi: 10.1021/ie3010226
-
[62]
Ding, Z. X.; Chen, X. F.; Antonietti, M.; Wang, X. C. ChemSus-Chem 2011, 4, 274.
-
[63]
Woźnica, M.; Chaoui, N.; Taabache, S.; Blechert, S. Chem. Eur. J. 2014, 20, 14624. doi: 10.1002/chem.v20.45
-
[64]
Song, T.; Zhou, B.; Peng, G. W.; Zhang, Q. B.; Wu, L. Z.; Liu, Q.; Wang, Y. Chem. Eur. J. 2014, 20, 678. doi: 10.1002/chem.v20.3
-
[65]
Martin, D. J.; Reardon, P. J. T.; Moniz, S. J. A.; Tang, J. W. J. Am. Chem. Soc. 2014, 136, 12568. doi: 10.1021/ja506386e
-
[66]
Liu, J.; Huang, J. H.; Zhou, H.; Antonietti, M. ACS. Appl. Mater. Interfaces 2014, 6, 8434. doi: 10.1021/am501319v
-
[67]
Kong, H. J.; Won, D. H.; Kim, J.; Woo, S. I. Chem. Mater. 2016, 28, 1318. doi: 10.1021/acs.chemmater.5b04178
-
[68]
Hu, X. F.; Ji, H. H.; Chang, F.; Luo, Y. M. Catal. Today 2014, 224, 34. doi: 10.1016/j.cattod.2013.11.038
-
[69]
Yang, J.; Chen, H. H.; Gao, J. H.; Yan, T. T.; Zhou, F. Y.; Cui, S. H.; Bi, W. T. Mater. Lett. 2016, 164, 183. doi: 10.1016/j.matlet.2015.10.130
-
[70]
Chen, X. X.; Huang, X. T.; Yi, Z. G. Chem. Eur. J. 2014, 20, 17590. doi: 10.1002/chem.201404284
-
[71]
Chi, F. L.; Zhou, G. D.; Song, B.; Lv, Y. H.; Ran, S. L. CN 105148975, 2015[Chem. Abstr. 2015, 164, 119258].
-
[72]
Ma, S. S.; Xue, J. J.; Zhou, Y. M.; Zhang, Z. W.; Cai, Z. L.; Zhu, D. B.; Liang, S. RSC Adv. 2015, 5, 64976. doi: 10.1039/C5RA10447E
-
[73]
Liu, Z. R.; Zheng, H.; Yang, H. X.; Hao, L.; Wen, L.; Xu, T. Z.; Wu, S. Y. RSC Adv. 2016, 6, 54215. doi: 10.1039/C6RA06730A
-
[74]
Cui, Y. M.; Li, H. Q.; Miao, H. CN 105195221, 2015[Chem. Abstr. 2015, 164, 119258].
-
[75]
Pan, X. Y.; Chen, X. X.; Yi, Z. G. ACS Appl. Mater. Interfaces 2016, 8, 167060.
-
[76]
Dong, F. Zhao, Z. W.; Sun, Y. J.; Zhang, Y. X.; Yan, S.; Wu, Z. B. Environ. Sci. Technol. 2015, 49, 12432. doi: 10.1021/acs.est.5b03758
-
[77]
Ou, M.; Zhong, Q.; Zhang, S. L.; Yu, L. M. J. Alloys Compd. 2015, 626, 401. doi: 10.1016/j.jallcom.2014.11.148
-
[78]
Song, X.; Hu, Y.; Zheng, M. M.; Wei, C. H. Appl. Catal. B 2016, 182, 587. doi: 10.1016/j.apcatb.2015.10.007
-
[79]
Zhang, Z. Z.; Xu, M. K.; Ho, W. K.; Zhang, X. W.; Yang, Z. Y.; Wang, X. X. Appl. Catal. B 2016, 184, 174. doi: 10.1016/j.apcatb.2015.11.034
-
[80]
Li, Y. H.; Yang, L. P.; Dong, G. H.; Ho, W. K. Molecules 2016, 21, 36.
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 101
- 文章访问数: 4564
- HTML全文浏览量: 1223


 下载:
下载:

 下载:
下载:

