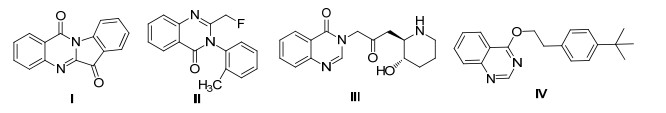
 图 1
具有生物活性的喹唑啉类化合物和其类似物
Figure 1.
Select biologically active quinazoline and their derivatives
图 1
具有生物活性的喹唑啉类化合物和其类似物
Figure 1.
Select biologically active quinazoline and their derivatives

Citation: Tang Lingjuan, Lu Xinmou, Ji Shunjun. Base Promoted Annulation of Carbodiimides to Access of Quinazoline and Their Derivatives[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 746-752. doi: 10.6023/cjoc201607010

碱促进下碳二亚胺参与构建二氢喹唑啉及其衍生物
-
关键词:
- 碳二亚胺
- / α, β-不饱和酮/酯
- / 喹唑啉
- / 无金属催化
English
Base Promoted Annulation of Carbodiimides to Access of Quinazoline and Their Derivatives
-
Key words:
- carbodiimides
- / α, β-unsaturated ketone
- / quinazoline and their derivatives
- / metal-free
-
二氢喹唑啉及其衍生物是许多精细化工产品的重要中间体, 而且还具有多种生理功能和用途[1], 在医药和工农业生产中有着广泛的应用.如首个被分离得到的含喹唑啉结构的化合物色胺酮Ⅰ, 抗菌效用明显.随后更多具有药用活性的含喹唑啉结构单元的化合物和类似物相继被发现.如利尿药甲酸喹唑酮Ⅱ、抗疟药常山碱等Ⅲ.此外, 喹唑啉类衍生物也被应用于农药开发方面, 如杀螨剂喹螨醚Ⅳ.在工业领域, 喹唑啉类衍生物可应用于有机发光材料[2]; 在润滑剂、金属萃取炼等行业也有广泛应用[3].以上可知, 喹唑啉衍生物在现代医药和工农业生产中有着广泛的应用.
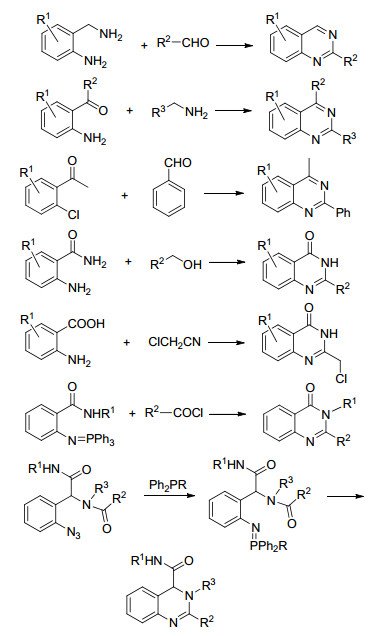
而传统合成含有喹唑啉骨架化合物的主要方法如下 (Scheme 1):以邻氨基苄胺为底物[4]、邻氨基/卤芳香酮为底物[5]的环化方法来合成是喹唑啉化合物.以邻氨基苯甲酰胺为底物[6]、邻氨基苯甲酸为底物[7], 以及利用氮杂Wittig反应来合成喹唑啉酮及其衍生物[8].而行之有效地合成二氢喹唑啉的报道相对就比较少, 并且受限于以下缺点: (1) 反应条件较为苛刻; (2) 原子经济性不高、反应的步骤繁琐; (3) 强碱和金属试剂的不同程度等.
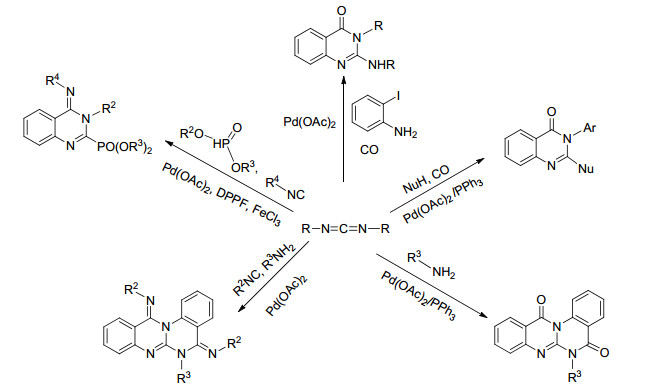
近年来, 碳二亚胺化合物参与构建喹唑啉、喹唑啉酮及其衍生物的研究获得了一系列报道.有利用邻碘苯胺、碳二亚胺和CO在钯盐催化合成[9, 10], 二-邻碘苯基碳二亚胺与有机胺化合物在钯盐催化合成[10], 以及Wu课题组[11]利用碳二亚胺、烷基异氰和烷基胺/亚磷酸二乙酯在钯盐催化合成 (Scheme 2).总结这些报道, 我们可以看到反应均需要金属催化, 有的反应甚至需要用到易爆物质, 并且合成的都是喹唑啉酮类化合物, 更为重要的二氢喹唑啉类化合物研究得较少.
2015年我们课题组[12]利用苯胺与异睛反应能以较高收率得到相应的碳二亚胺化合物, 联系前人关于碳二亚胺化合物参与构建二氢喹唑啉及其衍生物的报道[9~11], 以及我们课题组前面关于吲哚的工作[13], 如果对碳二亚胺化合物进行适当官能团修饰后, 能否在碱作用下与强亲核试剂吲哚反应并关环来构建一种含有喹唑啉及吲哚官能团结构的化合物?
1 结果与讨论
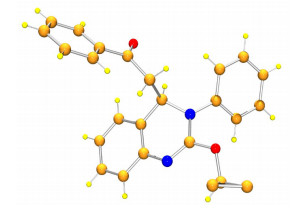
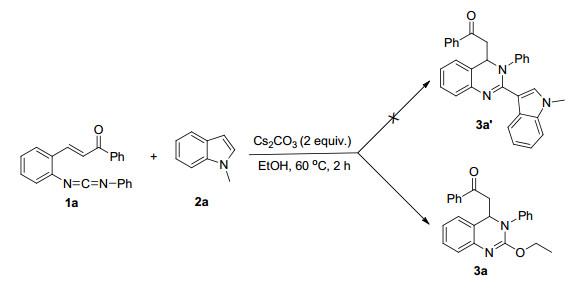
基于以上设想, 首先我们选取了1-苯基-3-(2-(((苯基亚氨基) 亚甲基) 氨基) 苯基) 丙-2-烯-1-酮 (1a)、N-甲基吲哚 (2a), 在以无水乙醇为溶剂, 2 equiv.碱作用下反应以期生成含有吲哚取代基团的喹唑啉目标化合物3a' (Scheme 3), 但从LC-MS以及核磁谱图结果来看并未生成预想的目标化合物.为进一步验证产物结构, 以乙酸乙酯为溶剂培养了化合物单晶确证了化合物3a的结构 (图 2), CCDC号为1510457.
对该反应的条件优化结果见表 1.首先我们发现在不加碱情况下反应不能发生 (Table 1, Entry 1), 然后对各种不同的无机碱进行了筛选, 发现当使用无机弱碱, 如Cs2CO3、K2CO3、Na2CO3、NaHCO3、KHCO3时, 液质收率均在60%~70%之间 (Table 1, Entries 2~6).接着改用KOH、NaOH、t-BuOK进行反应时, 反应液质收率提升至70%以上, 其中以使用NaOH为碱时液质收率最高 (77%) (Table 1, Entries 7~9).之后对几种有机碱进行了筛选, 发现反应效果均不如NaOH好 (Table 1, Entries 10~13).筛完碱后, 我们对反应时间进行了优化, 反应时间为1.5 h时液质收率最高 (Table 1, Entries 14~19).接着对反应温度进行了筛选, 发现40 ℃时反应效果最好 (Table 1, Entries 20~23).对反应所用碱NaOH的用量进行了筛选, 得出1 equiv. NaOH用量为最佳用量, 3a分离收率高达84%(Table 1, Entries 24~28).综合分析以上数据, 我们得出1a(0.5 mmol) 在1 equiv. NaOH碱存在下在2 mL EtOH中于40 ℃下反应1.5 h为最优反应条件.

Entry Base (equiv.) Tb/℃ Time/h Yieldc/% 1 — 40 1.5 NR 2 Cs2CO3 (2) 40 1.5 67 3 K2CO3 (2) 40 1.5 69 4 Na2CO3 (2) 40 1.5 63 5 NaHCO3 (2) 40 1.5 64 6 KHCO3 (2) 40 1.5 69 7 KOH (2) 40 1.5 74 8 NaOH (2) 40 1.5 77 9 t-BuOK (2) 40 1.5 71 10 Pyridine (2) 40 1.5 55 11 Piperidine (2) 40 1.5 NR 12 Et3N (2) 40 1.5 59 13 DBU (2) 40 1.5 NR 14 NaOH (2) 40 0.25 45 15 NaOH (2) 40 0.5 58 16 NaOH (2) 40 1 61 17 NaOH (2) 40 1.5 77 18 NaOH (2) 40 2 61 19 NaOH (2) 40 4 59 20 NaOH (2) 20 1.5 52 21 NaOH (2) 40 1.5 75 22 NaOH (2) 60 1.5 77 23 NaOH (2) Reflux 1.5 73 26 NaOH (0.5) 40 1.5 70 27 NaOH (1) 40 1.5 90 (84)d 28 NaOH (1.5) 40 1.5 87 aReaction conditions: 1a (0.5 mmol) reacted in 2.0 mL of EtOH. bThe temperature of the reaction in solvent. c Yields were determined by LC analysis with biphenyl as the internal standard. dIsolated yield. 表 1 条件筛选
Table 1. Optimization of reaction conditions在该最优条件下, 我们开始了对该反应底物的普适性研究 (Table 2).首先对反应在不同醇中反应进行了研究, 当反应物1a在甲醇、正丙醇、正丁醇进行时, 我们分别能以85%、74%、68%的分离收率获得目标产物3b, 3c, 3d, 但当反应物1a在异丙醇中反应时, 分离收率则下降到60% (3e), 可能是由于异丙醇空间位阻较大的原因.接着我们对R2含不同取代基团时进行了底物的拓展研究, 发现苯环上无论含有拉电子基团还是供电子基团, 反应分离收率都能达到80%以上 (3f, 3g, 3h).值得注意的是当苯环上含有强拉电子基团 (F) 时, 反应分离收率能达到99%以上 (3f), 几乎定量生成目标化合物.
 表 2 喹唑啉衍生物3的合成
表 2 喹唑啉衍生物3的合成
Table 2. Synthesis of 2-ethoxy-3, 4-dihydroquinazolines 3接着我们又对3-(2-((苯基亚氨基) 亚甲基) 氨基) 苯基) 丙烯酸酯底物进行了拓展研究 (表 3), 如所预期的那样, 在前面最优条件下, 反应能生成相应的喹唑啉目标化合物, 但是在碱性条件下, 也发生了相应的酯交换反应.对R1含不同取代基团时进行了底物的拓展研究, 发现R1为无取代苯环基团时, 分离收率为79% (4b), 而当R1苯环上含有供电子基团 (OCH3), 反应分离收率为80% (4a), 而当R1环己基时, 反应分离收率则下降至74% (4c).
 表 3 喹唑啉衍生物4的合成
表 3 喹唑啉衍生物4的合成
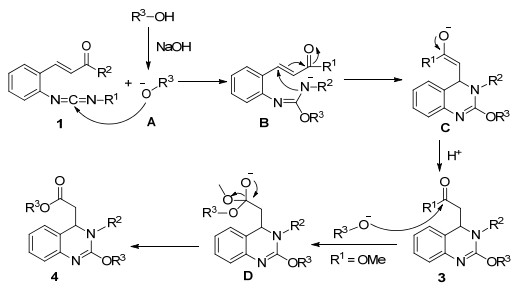
Table 3. Synthesis of 2H-pyrrolo[3, 4-c]quinolin-4(5H)-ones 4基于以上结果及查阅相关文献[8], 我们提出了一个可能的反应机理, 如Scheme 4所示.首先是醇在碱作用下生成醇盐负离子A, 醇盐负离子A对碳二亚胺化合物发动亲核进攻生成胍中间体B, 之后胍中间体B发生分子内麦克加成生成中间体C, 最后C烯醇互变生成产物3, 当R1=OMe时, 产物3发生酯交换生成最终产物4.
2 结论
发展了一种含碳二亚胺结构的α, β-不饱和酮/酯与醇类化合物反应生成一系列具有潜在生理和药理活性的2-乙氧基-3-苯基-3, 4-二氢喹唑啉杂环衍生物的方法.反应在无金属催化条件下进行, 反应条件温和, 反应耗时短, 反应收率高达99%.这为进一步构建这类喹唑啉化合物以及其他的杂环化合物提供了一种有益策略.
3 实验部分
3.1 仪器与试剂
核磁共振Varian InoVa-400 MHz或Varian NMR System 300 MHz检测完成, 以CDCl3为溶剂, TMS为内标; 红外光谱由Varian FT-1000红外光谱仪, KBr压片完成; 化合物的熔点由X-T5型熔点测定仪, 温度计未校正.其他试剂均为市售分析纯.
3.2 实验方法
化合物1 (0.5 mmol)、NaOH (0. 5 mmol) 以及3.0 mL ROH置于Schlenk反应管中, 油浴加热至40℃搅拌反应1.5 h.反应结束后减压旋蒸除去反应溶剂, 进一步柱层析[V(乙酸乙酯)/V(石油醚)=1/10]得目标化合物2, 4-二取代喹唑啉类衍生物.
2-(2-乙氧基-3-苯基-3, 4-二氢喹唑啉-4-基)-1-苯丙酮 (3a):黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.78~7.69 (m, 2H), 7.48~7.39 (m, 1H), 7.35~7.25 (m, 4H), 7.24~7.06 (m, 6H), 6.89 (ddd, J=7.6, 5.4, 3.2 Hz, 1H), 5.54 (dd, J=8.7, 4.0 Hz, 1H), 4.43 (q, J=7.1 Hz, 2H), 3.59 (dd, J=16.2, 8.7 Hz, 1H), 3.33 (dd, J=16.2, 4.0 Hz, 1H), 1.26 (t, J=7.1 Hz, 3H); IR (neat) ν: 3065, 2932, 1737, 1585, 1553, 1471, 1445, 766, 754 cm-1; 13C NMR (101 MHz, DMSO-d6) δ: 197.8, 153.4, 146.6, 142.3, 137.1, 133.8, 130.6, 129.4, 129.4, 129.1, 128.5, 126.0, 125.9, 125.7, 125.6, 123.3, 123.1, 63.0, 59.2, 44.4, 14.6. HRMS (ESI-TOF) calcd for C24H23N2O2 ([M+H]+) 371.1760, found 371.1758.
2-(2-甲氧基-3-苯基-3, 4-二氢喹唑啉-4-基)-1-苯丙酮 (3b):黄色固体, m.p. 57~59 ℃; 1H NMR(400 MHz, CDCl3) δ: 7.74~7.69 (m, 2H), 7.45~7.40 (m, 1H), 7.32~7.26 (m, 4H), 7.23~7.14 (m, 5H), 7.10~7.07 (m, 1H), 6.89 (ddd, J=7.6, 6.1, 2.6 Hz, 1H), 5.54 (dd, J=8.6, 4.0 Hz, 1H), 3.90 (s, 3H), 3.57 (dd, J=16.2, 8.7 Hz, 1H), 3.32 (dd, J=16.2, 4.0 Hz, 1H); 13C NMR (101 MHz, CDCl3)δ: 197.3, 154.1, 142.4, 141.8, 136.9, 133.2, 129.0, 128.4, 128.1, 125.9, 125.6, 125.56, 125.4, 123.4, 123.1, 59.2, 54.3, 44.1;IR (neat) ν: 3063, 2939, 1735, 1586, 1559, 1472, 1441, 761, 758 cm-1. HRMS (ESI-TOF)calcd for C23H21N2O2 ([M+H]+) 357.1603, found 357.1590.
2-(2-丙氧基-3-苯基-3, 4-二氢喹唑啉-4-基)-1-苯丙酮 (3c):黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.77~7.71 (m, 2H), 7.46 (t, J=7.4 Hz, 1H), 7.36~7.28 (m, 4H), 7.25~7.14 (m, 5H), 7.08 (d, J=7.4 Hz, 1H), 6.94~6.87 (m, 1H), 5.54 (dd, J=8.7, 4.0 Hz, 1H), 4.31 (tt, J=7.8, 3.8 Hz, 2H), 3.59 (dd, J=16.1, 8.7 Hz, 1H), 3.34 (dd, J=16.1, 4.1 Hz, 1H), 1.68~1.60 (m, 2H), 0.86 (t, J=7.4 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 197.6, 153.9, 133.3, 128.9, 128.6, 128.5, 128.2, 125.8, 125.7, 125.6, 125.5, 123.3, 123.1, 68.9, 59.2, 44.2, 22.2, 10.6; IR (neat) ν: 3069, 2935, 1732, 1584, 1558, 1472, 1441, 769, 751 cm-1. HRMS (ESI-TOF)calcd for C25H25N2O2 ([M+H]+) 385.1916, found 385.1904.
2-(2-丁氧基-3-苯基-3, 4-二氢喹唑啉-4-基)-1-苯丙酮 (3d):黄色固体, m.p. 80~82 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.80~7.70 (m, 2H), 7.53~7.44 (m, 1H), 7.38~7.27 (m, 4H), 7.24~7.13 (m, 5H), 7.08 (dd, J=7.6, 1.3 Hz, 1H), 6.95~6.86 (m, 1H), 5.54 (dd, J=8.7, 4.0 Hz, 1H), 4.36 (t, J=6.6 Hz, 2H), 3.60 (dd, J=16.1, 8.7 Hz, 1H), 3.34 (dd, J=16.1, 4.1 Hz, 1H), 1.67~1.57 (m, 2H), 1.34~1.27 (m, 2H), 0.88 (t, J=7.4 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 197.0, 153.3, 142.1, 141.5, 136.5, 132.7, 128.4, 128.0, 127.9, 127.7, 125.2, 125.2, 125.0, 124.9, 122.7, 122.6, 66.6, 58.7, 43.6, 30.3, 18.7, 13.3; IR (neat) ν: 3061, 2933, 1731, 1589, 1555, 1474, 1447, 761, 755 cm-1. HRMS (ESI-TOF) calcd for C26H27N2O2 ([M+H]+) 399.2073, found 399.2070.
2-(2-异丙氧基-3-苯基-3, 4-二氢喹唑啉-4-基)-1-苯丙酮 (3e):黄色固体, m.p 120~122 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.76 (d, J=7.3 Hz, 2H), 7.49 (t, J=7.4 Hz, 1H), 7.38~7.28 (m, 4H), 7.23~7.12 (m, 5H), 7.08 (d, J=7.3 Hz, 1H), 6.90 (td, J=7.2, 1.4 Hz, 1H), 5.53 (dd, J=8.7, 4.0 Hz, 1H), 5.42 (dt, J=12.5, 6.2 Hz, 1H), 3.59 (dd, J=16.1, 8.7 Hz, 1H), 3.34 (dd, J=16.1, 4.0 Hz, 1H), 1.33 (d, J=6.3 Hz, 3H), 1.23 (d, J=6.2 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 197.2, 152.6, 142.3, 141.67, 136.6, 132.7, 128.3, 128.0, 127.9, 127.7, 125.3, 124.9, 124.7, 122.6, 122.5, 69.7, 58.6, 43.5, 21.7, 21.1; IR (neat) ν: 3072, 2947, 1738, 1579, 1566, 1466, 1453, 774, 756 cm-1. HRMS (ESI-TOF) calcd for C25H25N2O2 ([M+H]+) 385.1916, found 385.1919.
2-(2-乙氧基-3-对氟苯基-3, 4-二氢喹唑啉-4-基)-1-苯丙酮 (3f):黄色固体, m.p. 92~93 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.75~7.67 (m, 2H), 7.47~7.40 (m, 1H), 7.31 (dd, J=8.3, 7.2 Hz, 2H), 7.23~7.13 (m, 4H), 7.09~7.04 (m, 1H), 7.02~6.94 (m, 2H), 6.90 (ddd, J=7.5, 6.2, 2.4 Hz, 1H), 5.48 (dd, J=8.1, 4.4 Hz, 1H), 4.40 (qd, J=7.1, 5.2 Hz, 2H), 3.50 (dd, J=16.1, 8.1 Hz, 1H), 3.33 (dd, J=16.1, 4.4 Hz, 1H), 1.23 (t, J=7.1 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 197.3, 153.4, 142.6, 138.0, 137.9, 136.9, 133.2, 128.5, 128.1, 127.8, 127.7, 125.4, 125.3, 123.3, 123.1, 115.8, 115.5, 63.1, 59.6, 44.1, 14.3; IR (neat) ν: 3064, 2936, 1671, 1585, 1568, 1475, 752, 744 cm-1. HRMS (ESI-TOF) calcd for C24H22FN2O2 ([M+H]+) 389.1665, found 389.1671.
2-(2-乙氧基-3-对溴苯基-3, 4-二氢喹唑啉-4-基)-1-苯丙酮 (3g):黄色固体, m.p. 108~109 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.79~7.66 (m, 2H), 7.45 (ddt, J=8.8, 6.9, 1.6 Hz, 1H), 7.42~7.36 (m, 2H), 7.32 (t, J=7.8 Hz, 2H), 7.23~7.14 (m, 2H), 7.13~7.03 (m, 3H), 6.91 (ddd, J=7.5, 6.2, 2.4 Hz, 1H), 5.50 (dd, J=8.3, 4.3 Hz, 1H), 4.42 (q, J=6.6, 6.2 Hz, 2H), 3.52 (dd, J=16.3, 8.3 Hz, 1H), 3.31 (dd, J=16.2, 4.3 Hz, 1H), 1.26 (t, J=7.1 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 197.3, 153.1, 142.3, 141.0, 136.8, 133.3, 131.9, 128.5, 128.5, 128.1, 126.7, 125.6, 125.3, 123.5, 123.2, 118.7, 63.2, 59.0, 44.0, 14.3; IR (neat) ν: 3068, 2937, 1734, 1582, 1556, 1476, 1443, 764, 755 cm-1. HRMS (ESI-TOF)calcd for C24H22BrN2O2([M+ H]+) 449.0865, found 449.0863.
2-(2-乙氧基-3-对甲氧基苯基-3, 4-二氢喹唑啉-4-基)-1-苯丙酮 (3h):黄色固体, m.p. 57~59 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.70 (dd, J=8.3, 1.4 Hz, 2H), 7.45~7.38 (m, 1H), 7.29 (t, J=7.8 Hz, 2H), 7.21~7.09 (m, 4H), 7.05 (d, J=7.0 Hz, 1H), 6.94~6.74 (m, 3H), 5.45 (dd, J=8.4, 4.2 Hz, 1H), 4.46~4.32 (m, 2H), 3.73 (d, J=1.3 Hz, 3H), 3.53 (dd, J=15.9, 8.4 Hz, 1H), 3.32 (dd, J=15.9, 4.2 Hz, 1H), 1.22 (t, J=7.1 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 197.4, 157.6, 153.9, 142.9, 136.9, 134.7, 133.1, 128.4, 128.3, 128.1, 127.7, 125.3, 125.3, 123.0, 122.9, 114.1, 62.9, 59.8, 55.3, 44.1, 14.4; IR (neat) ν: 3062, 3030, 2992, 2937, 1733, 1583, 1566, 770, 755, 741 cm-1. HRMS (ESI-TOF) calcd for C25H25N2O3 ([M+H]+) 401.1865, found 401.1854.
乙基-2-(2-乙氧基-3-(3-甲氧基苯基)-3, 4-二氢喹唑啉-4-基) 乙酸酯 (4a):黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.70 (dd, J=8.3, 1.4 Hz, 4H), 7.47~7.37 (m, 2H), 7.29 (t, J=7.8 Hz, 4H), 7.15 (d, J=6.4 Hz, 7H), 7.12 (s, 1H), 7.05 (d, J=7.0 Hz, 2H), 6.91~6.78 (m, 6H), 5.45 (dd, J=8.4, 4.2 Hz, 2H), 4.46~4.32 (m, 4H), 3.73 (d, J=1.3 Hz, 6H), 3.53 (dd, J=15.9, 8.4 Hz, 2H), 3.32 (dd, J=15.9, 4.2 Hz, 2H), 1.22 (t, J=7.1 Hz, 7H); 13C NMR (101 MHz, CDCl3) δ: 197.4, 157.6, 153.9, 142.9, 136.9, 134.7, 133.1, 128.4, 128.3, 128.1, 127.7, 125.3, 125.3, 123.0, 122.9, 114.1, 62.9, 59.8, 55.3, 44.1, 14.4; IR (neat) ν: 3066, 2936, 1730, 1587, 1566, 1475, 760 cm-1. HRMS (ESI-TOF) calcd for C21H25N2O4 ([M+H]+) 369.1814, found 369.1811.
乙基-2-(2-乙氧基-3-(3-苯基)-3, 4-二氢喹唑啉-4-基) 乙酸酯 (4c):黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.38~7.31 (m, 2H), 7.28~7.17 (m, 4H), 7.17~7.09 (m, 1H), 7.00 (dtd, J=8.6, 7.5, 1.4 Hz, 2H), 5.26 (dd, J=7.7, 5.4 Hz, 1H), 4.48~4.27 (m, 2H), 3.98 (qq, J=10.8, 7.1 Hz, 2H), 2.74 (ddd, J=22.5, 14.7, 6.6 Hz, 2H), 1.23 (t, J=7.1 Hz, 3H), 1.17~1.03 (m, 3H); 13C NMR (101 MHz, CDCl3) δ: 169.9, 152.8, 142.4, 141.4, 128.4, 128.1, 125.6, 125.4, 124.6, 124.1, 122.7, 122.7, 77.0, 76.6, 76.3, 62.5, 60.2, 59.5, 40.3, 13.9, 13.5; IR (neat) ν: 3067, 2938, 1735, 1589, 1563, 1474, 763 cm-1. HRMS (ESI-TOF) calcd for C20H23N2O3 ([M+H]+) 339.1709, found 339.1707.
乙基-2-(2-乙氧基-3-环己基-3, 4-二氢喹唑啉-4-基) 乙酸酯 (4b):黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.20~7.13 (m, 1H), 7.02 (ddd, J=20.3, 7.7, 1.4 Hz, 2H), 6.91 (td, J=7.4, 1.3 Hz, 1H), 4.93 (dd, J=9.0, 4.4 Hz, 1H), 4.42~4.32 (m, 2H), 4.03 (qd, J=7.1, 2.6 Hz, 2H), 3.80~3.66 (m, 1H), 2.62 (dd, J=14.8, 9.1 Hz, 1H), 2.47 (dd, J=14.8, 4.4 Hz, 1H), 1.99~1.92 (m, 1H), 1.81 (ddq, J=18.2, 12.7, 2.7 Hz, 2H), 1.71~1.54 (m, 4H), 1.36~1.27 (m, 5H), 1.14 (t, J=7.2 Hz, 4H); 13C NMR (101 MHz, CDCl3) δ: 170.2, 154.8, 143.0, 127.7, 124.8, 124.0, 121.9, 121.8, 62.1, 60.0, 57.2, 52.2, 41.7, 32.1, 31.5, 25.8, 25.6, 24.9, 14.1, 13.6; IR (neat) ν: 2978, 2930, 1728, 1597, 1585, 1561, 759, 722 cm-1. HRMS (ESI-TOF)calcd for C20H29N2O3 ([M+H]+) 345.2178, found 345.2169.
辅助材料 (Supporting Information)化合物3和4的核磁共振谱图.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
(a) Cai, C. -J. ; Hu, B. -C. ; Lü, C. -X. Chin. J. Org. Chem. 2005, 25, 1311.
(b) Zeng, X. -C. ; Xu, S. -H. ; Li, Y. -Q. ; Shi, W. -B. ; Deng, Q. -Y. Chin. J. Org. Chem. 2004, 24, 802.
(c) Zhao, L. ; Liang, Z. -H. ; Yuan, S. -G. J. Henan Chem. Ind. 2003, 12, 12.
(d) Zhang, J. ; Fan, X. -D. ; Liu, Y. -F. ; Li, H. J. Modern Chem. Ind. 2006, 26, 47.
(e) Zhu, H. -Y. ; Liu, F. -C. ; He, H. -P. Chin. J. Appl. Chem. 1999, 16, 71.
(f) Chen, Y. -Q. Flavour Fragrance Cosmet. 1992, 12, 14 (in Chinese).
(陈煜强, 香料香精化妆品, 1992, 12, 14. )
(g) Connolly, D. J. ; Cusack, D. ; O'Sullivan, T. P. ; Guiry, P. J. Tetrahedron 2005, 61, 10153.
(h) He, L. ; Li, H. ; Chen, J. ; Wu, X. -F. RSC Adv. 2014, 4, 12065. -
[2]
张文官, 杨联明, 王文广, 江和金, 徐锡瑛, 化学试剂, 1998, 20, 138.Zhang, W.-G.; Yang, L.-M.; Wang, W.-G.; Jiang, H.-J.; Xu, X.-Y. Chem. Reag. 1998, 20, 138 (in Chinese).
-
[3]
欧阳平, 陈国需, 张贤明, 石油学报, 2013, 29, 447.Ouyang, P.; Chen, G.; Zhang, X. Acta Petrolei Sinica 2013, 29, 447 (in Chinese).
-
[4]
(a) Eynde, J. J.; Godin, J.; Mayence, A.; Maquestiau, A.; Anders, E. Synthesis 1993, 867.
(b) Maheswari, C. U.; Kumar, G. S.; Venkateshwar, M.; Kumar, R. A.; Kantam, M. L.; Reddy, K. R. Adv. Synth. Catal. 2010, 352, 341.
(c) Zeng, Y.; Qiu, G.; Cai, L.; Pike, V. W.J. Heterocycl. Chem. 2010, 47, 1240. -
[5]
(a) Han, B.; Wang, C.; Han, R.-F.; Yu, W.; Duan, X.-Y.; Fang, R.; Yang, X.-L. Chem. Commun. 2011, 47, 7818.
(b) Yan, Y.; Wang, Z. Chem. Commun. 2011, 47, 9513.
(c) Ju, J.; Hua, R.; Su, J. Tetrahedron2012, 68, 9364. -
[6]
(a) Baker, B. R.; Almaula, P. I.J. Org. Chem. 1962, 27, 4672.
(b) Abdel, R. J.; Voelter, W.; Saeed, M. Tetrahedron Lett. 2004, 45, 3475.
(c) Zhou, J.; Fang, J. J. Org. Chem. 2011, 76, 7730.
(d) Niloofar, T.; Abolghasem, D. Chin. J. Chem. 2011, 29, 1685. -
[7]
(a) Hennequin, L. F.; Boyle, F. T.; Wardleworth, J. M.; Marsham, P. R. J. Med. Chem. 1996, 39, 695.
(b) Kalusa, A.; Chessum, N.; Jones, K. Tetrahedron Lett. 2008, 49, 5840.
(c) Adib, M.; Ansari, S.; Mohammadi, A.; Bijanzadeh, H. R. Tetrahedron Lett. 2010, 51, 30. -
[8]
(a) Sun, S. F.; Chen, L.; Yang, X. H. Chin. J. Chem. 2011, 29, 991.
(b) Hirota, S.; Sakai, T.; Kitamura, N.; Kubokawa, K.; Kutsumura, N.; Otani, T.; Saito, T. Tetrahedron2010, 66, 653.
(c) Wu, M. H.; Hu, J. H.; Shen, D. S.; Bremond, P.; Guo, H. B. Tetrahedron2010, 66, 5112.
(d) Liang, Y.; He, H.-W.; Yang, Z.-W. J. Heterocycl. Chem. 2011, 48, 88.
(e) Zhong, Y.; Wang, L.; Ding, M-W. Tetrahedron2011, 67, 3714. -
[9]
Larksarp, C.; Alper, H. J. Org. Chem. 2000, 65, 2773. doi: 10.1021/jo991922r
-
[10]
(a) Zeng, F.-L.; Alper, H. Org. Lett.2010, 12, 1188.
(b) Zeng, F.-L.; Alper, H. Org. Lett.2010, 12, 3642. -
[11]
(a) Qiu, G.-Y.-S.; He, Y.-H.; Wu, J. Chem. Commun. 2012, 48, 3836.
(b) Qiu, G.-Y.-S.; Lu, Y.; Wu, J. Org. Biomol. Chem. 2013, 11, 798. -
[12]
Zhu, T.-H.; Wang, S.-Y.; Tao, Y.-Q.; Ji, S.-J. Org. Lett. 2015, 17, 1974. doi: 10.1021/acs.orglett.5b00722
-
[13]
(a) Chen, T.; Xu, X.-P.; Ji, S.-J. J. Comb. Chem. 2010, 12, 659.
(b) Chen, T.; Xu, X.-P.; Ji, S.-J. J. Heterocycl. Chem.2013, 50, 244.
(c) Chen, T.; Xu, X.-P.; Ji, S.-J. Tetrahedron2011, 30, 5469.
-
[1]
-
表 1 条件筛选
Table 1. Optimization of reaction conditions

Entry Base (equiv.) Tb/℃ Time/h Yieldc/% 1 — 40 1.5 NR 2 Cs2CO3 (2) 40 1.5 67 3 K2CO3 (2) 40 1.5 69 4 Na2CO3 (2) 40 1.5 63 5 NaHCO3 (2) 40 1.5 64 6 KHCO3 (2) 40 1.5 69 7 KOH (2) 40 1.5 74 8 NaOH (2) 40 1.5 77 9 t-BuOK (2) 40 1.5 71 10 Pyridine (2) 40 1.5 55 11 Piperidine (2) 40 1.5 NR 12 Et3N (2) 40 1.5 59 13 DBU (2) 40 1.5 NR 14 NaOH (2) 40 0.25 45 15 NaOH (2) 40 0.5 58 16 NaOH (2) 40 1 61 17 NaOH (2) 40 1.5 77 18 NaOH (2) 40 2 61 19 NaOH (2) 40 4 59 20 NaOH (2) 20 1.5 52 21 NaOH (2) 40 1.5 75 22 NaOH (2) 60 1.5 77 23 NaOH (2) Reflux 1.5 73 26 NaOH (0.5) 40 1.5 70 27 NaOH (1) 40 1.5 90 (84)d 28 NaOH (1.5) 40 1.5 87 aReaction conditions: 1a (0.5 mmol) reacted in 2.0 mL of EtOH. bThe temperature of the reaction in solvent. c Yields were determined by LC analysis with biphenyl as the internal standard. dIsolated yield. 表 2 喹唑啉衍生物3的合成
Table 2. Synthesis of 2-ethoxy-3, 4-dihydroquinazolines 3

表 3 喹唑啉衍生物4的合成
Table 3. Synthesis of 2H-pyrrolo[3, 4-c]quinolin-4(5H)-ones 4

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 1159
- HTML全文浏览量: 138


 下载:
下载:





 下载:
下载:

