 图 图式1
检测氢离子的罗丹明类溶酶体荧光探针结构与响应机理
Figure 图式1.
Rhodamine-based fluorescent probes in the lysosome for detection
of hydrogen ions: structures and responsing reactions
图 图式1
检测氢离子的罗丹明类溶酶体荧光探针结构与响应机理
Figure 图式1.
Rhodamine-based fluorescent probes in the lysosome for detection
of hydrogen ions: structures and responsing reactions

Citation: Li Meihan, Wang Yutong, Liu Guangjian, Lü Haijuan, Xing Guowen. Recent Progress on Lysosome-Targetable Fluorescent Probes[J]. Chinese Journal of Organic Chemistry, 2017, 37(2): 356-374. doi: 10.6023/cjoc201607004

溶酶体荧光探针研究新进展
English
Recent Progress on Lysosome-Targetable Fluorescent Probes
-
Key words:
- lysosomes
- / fluorescent probes
- / cell apoptosis
- / reactive small molecules
- / cellular microenvironment
-
随着生命科学研究的发展, 人们对亚细胞结构的研究逐步深入.溶酶体作为真核细胞中一个重要的酸性细胞器, 包含超过60种的酸性水解酶、组织蛋白酶, 及各类特异性的膜蛋白.它不仅具有胞内消化的功能, 一些情况下也具有调节分泌功能.当溶酶体由于自身变异或外界影响而导致其数量、分布等发生异常时, 可能会造成肺部疾病 (矽肺、肺结核等)、溶酶体贮积症 (台-萨氏综合征、Ⅱ型糖原累积病、细胞内含物病等) 以及肿瘤等各类病症.溶酶体作为细胞内的“消化器官”, 其相关的研究一直是生命科学的热点之一[1~5].
溶酶体中的各类活性小分子 (reactive small molecules, RSMs) 参与了溶酶体内的各种生物化学反应, 其浓度与分布都会影响细胞的多种生理过程. RSMs包括氢离子H+, 还原性物种 (硫化氢H2S、硫醇类化合物半胱氨酸Cys、高半胱氨酸Hcy和谷胱甘肽GSH等), 活性氧物种 (过氧化氢H2O2、次氯酸HClO等)、活性氮物种 (一氧化氮NO、亚硝酰氢HNO等)、金属阳离子 (Cu2+、Zn2+等)、阴离子等[6~10].对溶酶体内RSMs进行研究对于理解溶酶体参与的生命活动分子机制以及与溶酶体相关的疾病诊断与治疗具有重要的意义.溶酶体微环境同样影响着溶酶体的功能, 在生物体系中起着至关重要的作用[11, 12].以粘度为例, 溶酶体内的流体粘度与溶酶体物质运输、信号转导、生物大分子之间的作用以及代谢产物的扩散等密切相关.当流体粘度逐渐增加时, 容易诱发各种疾病, 如高血压、高血脂、脑梗塞、心脏病等, 危害人们的身体健康.
荧光探针作为一个在亚细胞结构研究中强有力的手段, 在溶酶体的研究中备受瞩目.为了实现对溶酶体内RSMs时空分布与反应过程的有效检测, 研究者们设计合成了一系列基于有机小分子的溶酶体靶向荧光探针, 以此为研究工具实现对细胞、组织和生物体内溶酶体RSMs的分子成像.常见的溶酶体定位方法有三类[13~16]: (1) 利用溶酶体内酸性 (pH 4.5~5.5) 的生理环境, 这类探针多为小分子的胺类, 本身为弱碱性, 能够选择性地在酸性环境中积累; (2) 利用溶酶体的物质代谢功能, 这类探针多是大分子, 它们一般通过内吞作用进入细胞, 再经过不同的胞吞途径最终到达溶酶体; (3) 利用溶酶体的特征水解酶或者膜蛋白, 设计荧光探针, 使探针对酶或者蛋白质进行特异性识别.
为了实现对溶酶体内RSMs与微环境的有效检测, 荧光探针应具有较高的化学选择性、膜通透性、水溶性以及良好的光学性质, 在活细胞中毒性低等特点.除了探针分子中的定位基团外, 使用分子内电荷转移 (intramolecular charge transfer, ICT)、光诱导电子转移 (photoinduced electron transfer, PET)、荧光共振能量转移 (fluorescence resonance energy transfer, FRET)、聚集诱导发光 (aggregation-induced emission, AIE)、激发态分子内质子转移 (excited-state intramolecular proton transfer, ESIPT)、质子激发共振电荷转移 (protonation-activable resonance charge transfer, PARCT) 等响应机制对探针荧光团和识别基团的设计也尤为重要.本文从有机小分子荧光探针的设计、结构与功能等方面总结和评述了近几年来发展的重要的溶酶体荧光探针及其在生物学、生理学及疾病监测方面的应用.
1 单功能溶酶体定位探针
单功能溶酶体荧光探针可以定位溶酶体, 并对其进行荧光成像.通过追踪其位置变化以及观察其形态特点, 从而研究生物体的许多生理过程, 如胆固醇平衡、组织重构等.
市售的溶酶体探针大多为胺类化合物, 如中性红 (neutral red)、吖啶橙 (acridine orange)、LysoTracker 系列探针等.但是, 这些探针也存在一些缺陷, 它们对溶酶体定位的特异性不强, 一旦溶酶体内pH升高, 这类探针会离开溶酶体, 导致荧光淬灭; 更为严重的是, 中性红、吖啶橙对溶酶体有碱化作用, 如果长时间与溶酶体共孵育可能导致溶酶体内pH升高, 因而不适用于活体细胞检测.
根据溶酶体为物质代谢场所而设计的大分子荧光探针, 它们一般通过胞吞途径到达溶酶体.这类探针以荧光素修饰的葡聚糖、经过修饰的量子点和纳米颗粒 (DSiNPs) 等为代表.这类探针有时具有一些毒性, 不适用于溶酶体的长期示踪.例如, 研究表明葡聚糖会破化溶酶体正常的生理功能, 而DSiNPs在一定程度上也存在着毒性大的问题.
依据溶酶体中的特征水解酶或膜蛋白而设计的探针, 能够特异性识别溶酶体中的特征蛋白, 从而达到对溶酶体定位的效果.但是这类探针往往存在着制备费用较高、耗时较长、探针水溶性差、存储条件严格等问题, 很难普及使用[14, 17, 18].
周翔课题组[13]以罗杰斯碱 (Tröger’s base) 为骨架设计合成了靶向溶酶体的双光子荧光探针1.该探针简单易得, 首先通过一锅法制得罗杰斯碱内核, 再以Heck反应完成乙烯基的连接.探针1对溶酶体的特异性来源于其L型的构造以及端基二甲胺的碱性, 可以应用于不同的细胞系.由于罗杰斯碱衍生物具有手性, 探针1具有两种异构体 (1a、1b), 但两种对映异构体对于溶酶体的成像效果没有太大差异, 可以直接用外消旋体作为溶酶体探针.探针1的荧光量子产率为0.62, 高于商品化的溶酶体染料LT Red (0.46), 并且当探针与细胞共孵育8 h后, 探针没有表现出非特异性或者扩散, 仍然稳定地定位于溶酶体中, 说明该探针可以作为有效的溶酶体特异性荧光探针.
细胞中发生的反应往往和多个细胞器相关, 因此能够同时定位多个细胞器且不会相互影响的探针或者探针组近年来受到关注.彭孝军课题组[19]设计合成了两个结构相似的双光子荧光探针2a和2b, 其结构差异是2a的侧链含有氯原子, 2b的侧链为吗啉基团.它们可以在不影响蛋白运动的情况下完成对内质网和溶酶体的共定位.探针2b具有合适的pKa (5~6), 能够定向转移到溶酶体 (pH 4.5~5.5) 中而不在细胞质或其他细胞器中积累. Cho课题组[20]设计合成的探针3a以质子化形式在溶酶体中聚集, 能够与他们设计的检测线粒体的3b探针同时成像, 并且具有不受pH干扰, 细胞毒性小的优点.
Wong课题组[21]设计合成了基于咔唑的菁类探针4a和4b.这类染料具有良好的生物相容性, 并且在双光子成像中显示出很高的亮度.值得注意的是, 探针分子中的R基团不仅有定位作用, 也影响探针的物理性质与生物功能.通过改变R基, 可以获得溶酶体定位探针4a与线粒体定位探针4b.
为了克服传统溶酶体定位探针对细胞毒害性大、组织渗透性差的缺点, Belfield等[22]设计合成了探针5.通过在芴荧光团的9位连接聚合度为10的聚乙二醇, 探针5的水溶性增强同时细胞毒性减小.他们还设计了被Pluronic® F-127胶束包裹的探针6[23], 使其通过胞吞被细胞摄入, 经历囊泡成熟过程而被运输到溶酶体上, 可以检测HCT 116和COS-7细胞中的溶酶体. Ciccarella等[24]设计合成的探针7和8也是通过胞吞作用而进入细胞, 该类探针对pH变化不敏感, 光稳定性好, 对细胞染色后可以持续若干天时间不消失.
肖义等[18]设计合成了发射波长在近红外区 (~740 nm) 的溶酶体探针9, 该探针性质不受溶酶体内pH升降的影响.有趣的是, 两个三苯基鏻 (TPP) 基团使探针具有的特殊的溶酶体定位能力, 这与我们通常认为的带正电荷的TPP会在膜电位为负的线粒体中积累相违背.这个反常的现象可以从两个方面来解释.第一, 从分子结构上进行考虑.荧光探针对亚细胞器的选择性是由电荷数、摩尔/离子量 (molar/ionic weight) 以及探针的亲水亲脂性等多个因素共同决定的, 而非单一因素. Horobin等[25]提出探针对细胞器的选择性可以通过分析其log P (hydrophilicity/lipophilicity) 的值与电荷数得出, Log P即分配系数, 是指化合物亲水性和亲脂性的比值.根据他们的研究, 分子的log P在-5~0之间、具有不止一个正电荷的分子往往具有溶酶体的定位能力.探针9的log P为-2.89, 表明它具有强亲水性.考虑到探针9具有两个正电荷不难得出探针9具有定位溶酶体的能力.通常能定位线粒体的探针只含有一个三苯基鏻基团, 同时只有一个正电荷, 因此比探针9更具有亲脂性[26].第二, 从细胞吸收探针的途径考虑.由于细胞膜的磷脂双分子层的疏水结构, 亲水性的分子, 尤其是带高电荷的分子, 一般通过内吞作用进入细胞, 而胞吞途径的终点在于溶酶体.探针9不能通过自由扩散进入细胞, 但是可以通过缓慢的内吞作用最终到达溶酶体.该探针没有通常溶酶体探针具有的碱化作用, 因此细胞毒性小, 可以用于活体细胞的长期追踪, 如细胞凋亡、重金属刺激、细胞内吞作用的研究等.此外, 探针在近红外的发射波长位于740 nm处, 半高峰宽度小于50 nm, 与大部分荧光探针不重叠, 可有效避免干扰.
Xing等[27]以BODIPY为荧光发色团设计合成了探针10. 8-(4-氨基苯基)-BODIPY染料通常以氨基苯甲醛与吡咯衍生物缩合而成, 然而含有复杂氨基结构的BODIPY染料却难以用此法合成. Xing课题组巧妙地以Buwald-Hartwig交叉偶联反应合成出此类探针.该探针在中性环境下几乎不显示荧光, 而在酸性条件下显示强荧光.密度泛函理论 (DFT) 与含时密度泛函理论 (TD-DFT) 的计算表明荧光响应机理为PET过程.由于氨基的弱碱性, 探针会在酸性细胞器中积累, 故而能够用于溶酶体的定位.
2 检测pH的溶酶体荧光探针
由于溶酶体中的pH值在4.5~5.0左右, 比pH值为7.0~7.3的细胞质酸性更强, 其酸性条件直接影响了溶酶体内各种生物化学过程的发生.以H+为检测对象的双功能探针不仅能对溶酶体进行特异性的定位, 还可以实现对溶酶体pH值及其相关的各种胞内疾病的监测.
赵宝祥等[28~33]合成了带有胺类侧链的基于罗丹明B结构的探针11a~11f (Eq. 1).罗丹明的内酰胺螺环结构对pH较为敏感, 基于PET原理, 在中性或碱性条件下, 螺环结构得以保持, 胺类侧链导致荧光淬灭; 在酸性条件下, H+使螺环结构开环, 胺的质子化抑制了PET过程, 产生较强的荧光. 11a~11c都有较好的膜通透性, 较高的选择性及低细胞毒性, 且响应时间较短.探针11d将侧链改为带一个正电荷的季铵盐的结构, 增加了水溶性和检测敏感性. 11f避免了脂肪胺类探针常有的碱化反应, 在酸性环境中量子产率高, 成功应用于Hela细胞和血管上皮细胞中溶酶体pH变化的监控.
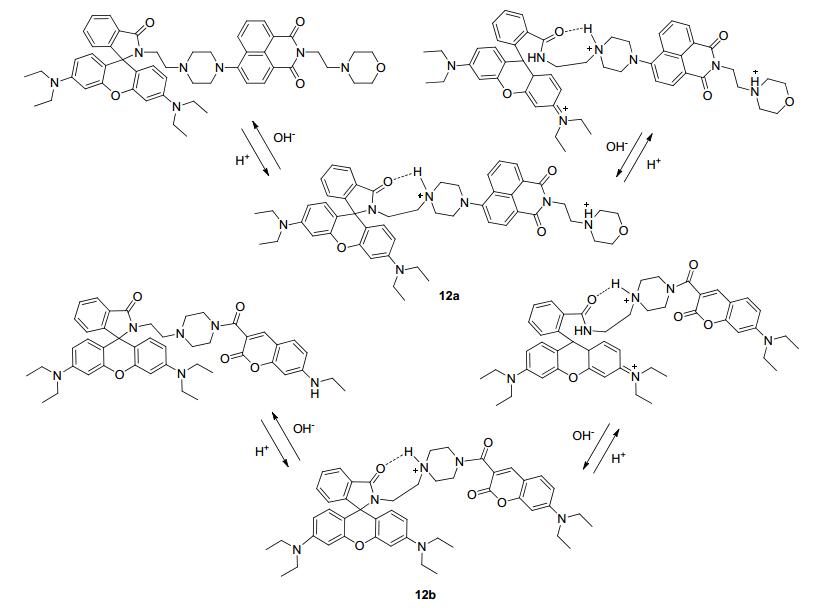
该研究组[34]还设计合成了基于PET和FRET原理的比率型双通道探针12a (Scheme 1).该探针以发射波长较短的萘酰亚胺荧光团作为FRET给体, 罗丹明作为FRET受体, 通过螺环的开闭特异性响应氢离子, 吗啉作为溶酶体的定位基团.比起之前报道的探针11, 该探针能够通过萘酰亚胺与罗丹明荧光发射强度的比率, 更为精确地反映溶酶体pH的变化.另外, 该研究组[35]也报道了基于香豆素-罗丹明体系的FRET荧光探针12b, 成功地应用于溶酶体的定位与成像.
 图 图式1
检测氢离子的罗丹明类溶酶体荧光探针结构与响应机理
Figure 图式1.
Rhodamine-based fluorescent probes in the lysosome for detection
of hydrogen ions: structures and responsing reactions
图 图式1
检测氢离子的罗丹明类溶酶体荧光探针结构与响应机理
Figure 图式1.
Rhodamine-based fluorescent probes in the lysosome for detection
of hydrogen ions: structures and responsing reactions
赵宝祥等[36]还重新探索了之前已经合成的探针13(Eq. 2) 潜在的定位于活细胞中溶酶体的能力.该探针以4-硝基苯并呋咱 (NBD) 为母体, 连接常规的吗啉基团作为溶酶体的识别基团, 是一种基于PET机制的荧光探针.探针13在酸性条件下荧光强度增加100倍, 其pKa值 (4.10) 适用于检测溶酶体内的pH变化.
余孝其等[37]使用自由基聚合反应设计合成了基于罗丹明的高分子探针14和15, 亦是通过螺环结构的开环反应对H+进行特异性识别.这两种高分子探针水溶性好, 背景干扰较小, 对pH较为敏感, 不会引起生物排斥, 实现了对活的有机体内癌变组织的荧光成像.
Bi课题组[38, 39]通过click反应设计合成了一系列特异性溶酶体pH荧光探针16a与16b.该系列探针能通过共聚焦激光扫描显微镜实现人胆管癌细胞 (RBE) 中溶酶体对药物乐铂响应的可视化检测.探针的设计基于溶酶体膜蛋白被N-连接多糖高度糖基化这一事实, 母体荧光团罗丹明与多糖之间的共轭实现了对溶酶体的定位, 螺环结构的开闭实现了对pH的检测.
葛健锋等[40]设计合成了基于苯并吩噁嗪结构的近红外探针17a和17b (Eq. 3), 这两种探针分别连接氰基与羟基.在溶酶体特异的酸性环境下实现了对H+高敏感性与高选择性的可逆应答, 5位上亚氨基N原子对H+的结合能力以及吩噁嗪结构的稳定性是影响这种质子化-去质子化平衡的主要因素.两者的区别在于, 连接氰基 (17a) 后对探针pKa影响较大, 连接羟基 (17b) 对其pKa影响较小.作为一个“关-开”型近红外探针, 以600 nm为激发波长, 17a在650~850 nm处的荧光增强最高可达38倍.
该研究组[41]基于PET原理还设计合成了以吩噁嗪为荧光团的可逆型pH探针18a和18b.探针18a连接的是带脂肪链的吗啉基团, 18b连接的则是二乙基苯胺基团, 两个探针均具有较好的生物相容性、选择性与光学性质, 能用于特异性定位溶酶体.
张晓兵等[42]报道的探针19(Eq. 4) 实现了对溶酶体pH动态变化的检测.该探针仍以吗啉作为溶酶体的定位基团, 氧杂蒽为荧光团, 通过内酰胺螺环结构“闭环”和“开环”所导致的分子内ESIPT过程的“开”和“关”, 实现对pH的动态检测.该探针的优势在于合成路线简单, 细胞毒性低, 光学性能稳定, 在对生物体内溶酶体pH的动态检测中取得了较好的效果.
江华等[43]报道了基于喹啉结构的比率型探针20(Eq. 5).该探针基于PARCT原理, 弱碱性的二甲基乙基胺基侧链质子化后富集于溶酶体中, 从而实现对活细胞中溶酶体的定位, 并能通过荧光比率测定溶酶体内的pH值.
马会民等[44]设计合成的比率型探针21(Eq. 6) 在半菁结构中引入吗啉基团, 研究了发热与溶酶体pH之间的关系, 发现当温度上升, 溶酶体内的pH会升高, 但该过程并不可逆, 即温度下降不会再引起pH降低.
萘酰亚胺由于其较高的光化学稳定性和荧光量子产率, 也常作为特异性溶酶体探针中的荧光团.李敏勇等[45]基于PET原理设计合成了以萘酰亚胺为母体, 二甲基乙基胺为定位基团的探针22.在中性环境下其荧光较弱, 当二甲基乙基胺质子化后, PET效应减弱, 荧光增强, 达到特异性定位的效果.
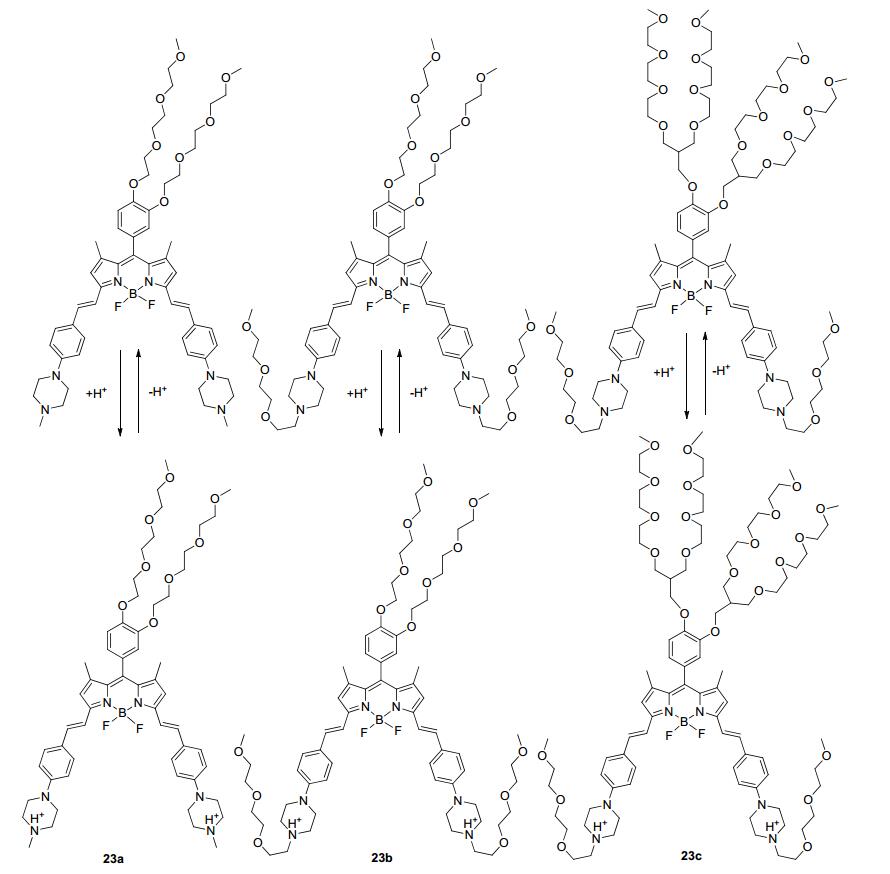
Tiwari等[46]报道了基于ICT和PET原理设计合成的BODIPY类溶酶体探针23a~23c(Scheme 2).相比之下, 探针23a、23b在水溶液中溶解度较低, 而探针23c则较高.在中性和碱性条件下, 由于哌嗪到BODIPY强的ICT过程和潜在的PET作用, 三种探针均荧光较弱; 在酸性条件下, 由于哌嗪环上N的质子化, 阻碍了ICT和PET过程, 荧光强度急剧升高.三个探针已经被成功运用于对体外的正常细胞和癌细胞的溶酶体成像.
孟庆国等[47]报道了基于可逆的环开闭过程的近红外探针24(Eq. 7), 在具有优良光物理性质以及生物相容性的硅罗丹明 (SiR) 结构中引入环状的硼酸酯作为溶酶体探针还是首次报道.螺环结构的SiR无色且无荧光, 酸性条件下开环后变成蓝色且有强的近红外荧光, 这种由H+控制的环开关平衡, 实现了对H+的特异性应答.硼酸作为识别基团, 在中性或弱碱性条件下形成相关的硼酸酯, 酸性条件下可逆水解为硼酸结构.该探针在pH从7.4~5.0时所呈现的荧光突变表明, 它可以作为理想的检测活细胞中溶酶体pH变化的荧光探针.
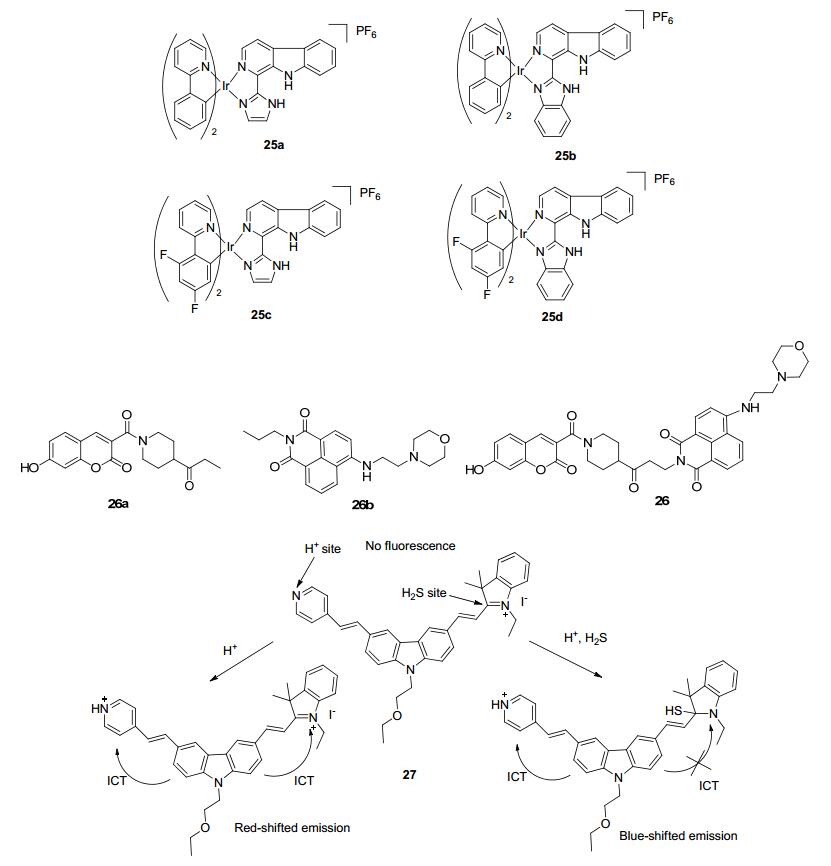
毛宗万等[48]报道了四种基于金属铱配合物具有响应pH变化和单线态氧 (1O2) 的溶酶体荧光探针25a~25d.该类探针在425 nm可见光照射下, 对癌细胞具有高选择性的光毒性 (尤其是25b). 25b被用于监测光动力疗法 (PDT) 下溶酶体的完整程度, 这为原位监测治疗结果与治疗效果的实时评估提供了一个可靠且方便的方法.
林伟英等[49]设计合成了一种基于ICT-PET-FRET机制的溶酶体探针26.该探针由“开启型”的26a与“关闭型”的26b通过一个不共轭的连接臂相连.香豆素与萘酰亚胺分别作为FRET的供体与受体荧光团, 羟基与吗啉基团分别作为pH检测和溶酶体定位基团, 通过ICT与PET过程控制香豆素与萘酰亚胺荧光的发射与淬灭.该探针为比率型探针, 在pH 4.0到8.0的范围内有良好的响应, 香豆素部分在454 nm处发蓝光, 萘酰亚胺在530 nm处发绿光.探针26已经成功应用于活体细胞中溶酶体pH值的监测, 同时也应用于氯喹刺激下活体细胞内pH的变化, 具有一定的应用前景.
3 检测还原性物种的溶酶体荧光探针
硫化氢是与一氧化氮、一氧化碳共存的第三种气体递质, 在人体内, 脑中的半胱氨酸在胱硫醚-β-合成酶 (CBS) 和胱硫醚-γ-裂解酶 (CSE) 作用下产生内源硫化氢.而硫化氢在许多生理过程中起到重要的作用, 如调节心血管、神经元、免疫系统、内分泌系统、消化系统等等[50].在动物疾病模型中显示硫化氢抑制剂与硫化氢生成剂对于一些疾病的治疗具有很大潜力[51].而硫化氢在不同细胞器中的分布和功能并不相同.对溶酶体来说, 硫化氢能引起溶酶体膜不稳定, 受钙蛋白酶激活而导致细胞自噬, 从而使细胞死亡.因此, 在活体系统中检测硫化氢的浓度和分布对于研究硫化氢的生理功能非常重要.传统的检测硫化氢的方法有比色法、电化学和气相色谱法.然而, 硫化氢在体内代谢速度很快, 上述方法可能导致浓度的持续波动, 很难对其进行准确的分析.检测硫化氢的荧光探针主要基于硫化氢分子的还原性或者亲核性设计, 为实现生理条件下硫化氢的测定提供了新方法[52].
林伟英等[53]设计合成了具有两个反应位点的双光子探针27 (Scheme 3), 实现了对活细胞中的溶酶体进行可视化定位并对其中的硫化氢进行了检测.该探针以咔唑基团为母体, 在3号位和6号位上分别连接与氢离子和硫化氢反应的基团:吡啶基团既作为氢离子的反应位点, 也充当溶酶体的定位基团; 亲电的半菁单元则作为硫化氢的反应位点.中性环境下探针本身无荧光, 在酸性条件下, 基于ICT原理, 吡啶基团的质子化使得探针的发射红移.在同时存在氢离子和硫化氢的情况下, 整体结构的共轭被破坏, ICT效应降低, 使得探针的发射蓝移.双通道荧光成像表明该探针能通过两个不同的荧光信号同时实现对溶酶体的定位和溶酶体中硫化氢的检测.
崔京南等[51]以二硝基苯醚为硫化氢反应位点、吗啉为溶酶体定位基团设计合成了检测溶酶体内硫化氢的荧光探针28a(Eq. 8).该探针由于从吗啉环上的氮原子到萘酰亚胺荧光团的PET过程被抑制, 其本身的荧光很弱; 与硫化氢反应后, 检测体系的颜色由无色变为黄色, 荧光发射也随之增强.考虑到28a与硫化氢反应后生成的离去基团二硝基苯硫酚具有毒性, 该研究组[54]基于叠氮被硫化氢还原成胺类的化学反应, 设计合成了更具生物兼容性的探针28b.
周莹等[55]设计合成的探针29具有优良的生物选择性.基于分子间还原和分子内环化反应的检测机理, 该探针只能与硫化氢反应, 而不能与生物体中的硫醇反应, 从而将硫化氢与生物体内的硫醇区分开来.研究显示该探针对硫化氢具有较好的选择性, Cys、Hcy和GSH都没有干扰.
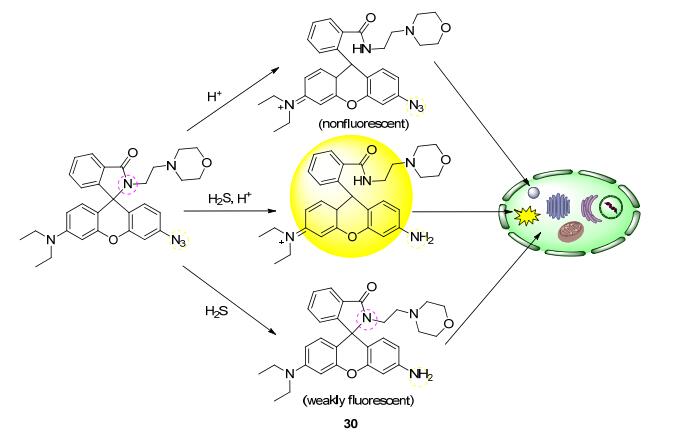
现有的双功能探针多是由定位基团和检测基团组合而来, 弱定位基团和待测物在细胞质和细胞器内的无序分布会使探针在时空上分辨率下降、灵敏度受限.杨荣华等[56]设计合成的探针30(Scheme 4) 具有检测和定位双控制开关, 探针只对溶酶体中硫化氢响应, 而对于细胞质和其他细胞器中的硫化氢不起作用.其作用机制在于探针受质子和叠氮基团二者的共同控制, 只有在溶酶体pH范围内而且叠氮基团被还原后荧光团才发射荧光.
半胱氨酸 (Cys)、高半胱氨酸 (Hcy) 和谷胱甘肽 (GSH) 是三种重要且常见的生物硫醇小分子, 具有十分重要的生理功能.生物巯基化合物的含量与许多疾病息息相关, 如半胱氨酸含量异常会导致头发变黄、水肿、肺功能障碍以及小儿生长缓慢等疾病[57].检测细胞器中生物巯基化合物的含量有助于我们进一步了解一些重要的生物过程.利用亲核取代反应是设计硫醇荧光探针的主要思路, 许多硫醇荧光探针分子中含有2, 4-二硝基苯磺酰或丹酰基. Talukdar等[57]以2, 4-二硝基苯磺酰为巯基反应位点, 以吗啉为溶酶体定位基团, 设计合成了检测溶酶体内硫醇的探针31.在pH 5时, 探针与Cys作用8 min后, 荧光增强高达95倍.尹军等[58]以丹酰衍生物为GSH响应基团, 构建了萘酰亚胺类探针32, 能够监测活体细胞溶酶体中GSH的存在.彭孝军等[59]报道的双光子探针33(Eq. 9) 能选择性识别溶酶体中的硫醇类物质.该探针以吗啉作为溶酶体的定位基团, 在萘酰亚胺荧光团上连接的二硝基苯磺酰基与各种硫醇均可以发生反应, 可以实现溶酶体中硫醇总水平的监测.
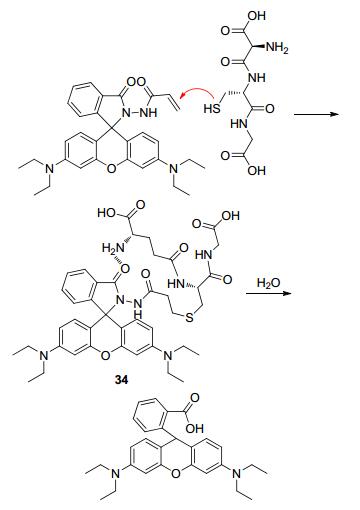
Liu等[60]基于罗丹明B设计合成了探针34(Scheme 5) 以快速检测溶酶体中的GSH.该探针以丙烯酰基作为与GSH反应的功能基团.未加入GSH前, 探针34的螺环呈现闭合状态, 荧光很弱; 加入GSH后, 探针分子先与GSH发生Michael加成, 而后加成产物中GSH残基中的氨基与罗丹明B螺环上的羰基形成氢键, 进一步促进了罗丹明B的开环, 荧光随之恢复.与已有的文献报道相比, 探针34对GSH响应非常快 (<10 s).
4 检测活性氧的溶酶体荧光探针
活性氧 (reactive oxygen species, ROS) 在许多生理进程中具有重要作用, 在一些疾病如癌症、神经失调、心血管疾病等的治疗中也伴有重要角色.因此, 检测活体细胞和组织中的ROS含量对于了解正常机体功能十分重要.在新陈代谢过程中, 生物体会产生许多ROS, 如超氧根离子 (•O2-)、羟基自由基 (•OH)、过氧自由基 (•OOR)、单线氧 (1O2)、次氯酸和次氯酸根 (HOCl/ClO-)、过氧化氢 (H2O2) 等.其中过氧化氢具有多重生理功能, 如宿主防御、免疫反应和细胞信号转导等.过氧化氢浓度升高可能会对细胞内蛋白质产生氧化性损伤, 导致老化或者疾病等.因此, 检测活体细胞中过氧化氢的含量十分重要[61~64].
过氧化氢探针常常基于与过氧化氢相关的化学反应进行设计, 这些反应包括磷化氢、二氢罗丹明、二氢吩噁嗪的氧化等.此外, 过氧化氢导致的硼酸酯、芳香磺酰、苄基、间氨基苯酚、对苯二酚的切断也被用于过氧化氢荧光探针的设计[65].另外, 还可以通过过氧化氢和金属酶的反应, 模仿生物体内的氧化还原反应来实现其荧光检测.例如, 亚铁血红素中铁-卟啉中心与过氧化氢的反应, 能够催化许多生物活性物质的氧化反应.[66]因此, 使用含铁发色团的仿生化学反应提供了一种检测过氧化氢的独特方法.其检测原理主要基于络合物中顺磁性的铁可以使荧光淬灭, 过氧化氢触发分子内铁离子载体和荧光团的氧化切除, 从而产生荧光信号.
You等[66]设计合成的过氧化氢探针35(Eq. 10) 由铁离子、含氮多齿配体、荧光素发色团构建而成.其检测机理为过氧化氢活化铁配位中心, 接着进行配体的N-去烷基化氧化反应, 释放出被铁离子淬灭的荧光团母体分子.该探针只对溶酶体中的过氧化氢有反应, 其他活性氧如•OH, t-BuOOH和O2•-等都没有干扰.基于硼酸酯为反应基团, 以萘酰亚胺为发色团, 吗啉为定位基团, Yoon等[8]设计合成了探针36(Eq. 11). 36不仅可以用于检测溶液中的H2O2, 也可以用于活体细胞中H2O2的检测.该探针的发光机理为PET过程, 探针36只有弱荧光, 而其与H2O2反应后的产物具有从哌嗪环到萘酰亚胺的电子转移, 呈现强荧光.
林伟英等[67]设计合成的双光子探针37(Eq. 12) 以萘酰亚胺作为母体, 吗啉作为溶酶体的定位基团, 硼酸酯取代基作为H2O2的反应位点.该探针能很好地对活细胞中内源及外源性H2O2成像并定位于溶酶体, 并且可以监控溶酶体中H2O2水平的变化.探针37的荧光响应机制为ICT过程, 加入H2O2后, 硼酸酯取代基转化为酚羟基, 在550 nm处, 荧光辐射大为增强.
次氯酸是一种重要的ROS, 在炎症与免疫系统抵御微生物中起着重要作用, 它还能够诱发溶酶体破裂导致培养细胞死亡.李鹏等[68]设计合成的探针38以吗啉定位溶酶体, 通过次氯酸对硒醚的选择性氧化还原反应达到检测的目的, 可以检测活细胞中外源性HOCl的含量.探针38可由含端溴的萘二甲酰亚胺衍生物与苯胺以CuI为催化剂, 发生亲核取代反应制得.然而, 用该探针检测活化后的RAW264.7细胞溶酶体内的HOCl未获成功, 可能是因为溶酶体内HOCl含量低于检测限, 也可能是因为溶酶体本身不产生HOCl, 而来自吞噬体的HOCl在到达溶酶体之前已经与还原性物质反应, 导致溶酶体中缺少内源性HOCl.
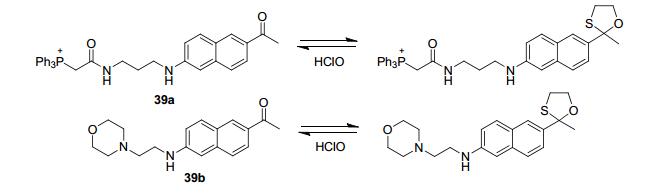
Chang等[69]设计合成了检测HOCl的“关-开”型双光子荧光探针39(Scheme 6), 其中39a为靶向线粒体探针, 39b为靶向溶酶体探针. 1-(6-二甲胺基萘-2-基) 乙酮 (acedan) 是典型的双光子荧光团, 具有“推-拉”(胺-酮) 分子结构.当羰基被保护时, 探针“拉电子”能力下降, 荧光团淬灭.而氧硫杂环戊烷保护基中的硫原子很容易被HOCl氧化成亚砜或砜.因此, 该课题组在探针中使用巯基乙醇以保护acedan中的羰基.在“推-拉”结构被破坏时, 探针不发射荧光; 而当探针与HOCl反应, 氧硫杂环戊烷去保护而羰基被释放出来时, 探针发射荧光.基于这种特殊的氧化去保护机理, 这些探针对HOCl响应时间短 (几秒之内), 检测限低 (<20 nmol/L), 对其他ROS分子基本不响应, 选择性较好.该探针已经成功用于活细胞中线粒体和溶酶体内HOCl的成像.另外, 在炎症状态下, 双光子成像表明在巨噬细胞的线粒体和溶酶体中可以检测到更多的HOCl产生.
上述方法对HOCl的检测往往基于荧光强度的变化, 而荧光强度又受外部因素如探针浓度、实验温度等因素的影响, 因此测定结果有时不是很准确.近来, 也有一些研究[70]报道了基于纳米粒子的比率型探针, 但是这类探针只能检测内源性和外源性的HOCl, 无法检测细胞器内HOCl的分布情况.林伟英等[71]设计合成了一个基于有机小分子的HOCl探针40(Eq. 14), 能够用于溶酶体内HOCl的比率成像.该探针具有细胞膜渗透性好, 反应速度快, 以及生物兼容性高等优点.探针40的设计使用ESIPT机理, 主要是基于对甲氨基酚的开环反应.与基于ICT机理的HOCl探针相比, 探针40的信号分辨率更好, 有利于荧光发射强度与比率的准确测定.与基于FRET机理的HOCl探针相比, 探针40不需要寻找连接体, 也不需要能量给体.
5 检测活性氮的溶酶体荧光探针
一氧化氮是心血管系统、神经系统、免疫系统中不可缺少的信号分子.溶酶体功能与一氧化氮水平密切相关.一氧化氮在细胞分解代谢自噬中有重要功能, 它与溶酶体分解自身细胞有关, 为细胞生长提供能量和营养; 一氧化氮也和各种紊乱与疾病有关, 如溶酶体贮藏紊乱, 高雪氏病以及肥厚型心肌病等.内源性一氧化氮由一些兴奋剂诱导产生, 如脂多糖 (LPS) 和γ-干扰素 (IFN-γ) 等.这些兴奋剂与溶酶体外若干相关蛋白质作用, 通过释放上行前体信号使溶酶体产生自吞噬过程.然而, 由于由各种物质构成的溶酶体在形态和组成上一直处于动态变化之中, 找到一氧化氮与溶酶体直接作用的证据十分困难, 一氧化氮在溶酶体中的功能还远远没有被人们充分理解[6, 72].
肖义等[6]基于PET原理, 设计合成了能够定位在溶酶体的双光子一氧化氮探针41(Eq. 15), 其中邻二氨基苯为NO的捕获基团, 吗啉为溶酶体靶向基团, 萘酰亚胺为双光子发色团.邻二氨基苯不仅是萘酰亚胺的电子给体 (荧光淬灭剂), 也是NO检测基团.该探针不仅可以对细胞外源性的一氧化氮进行检测, 而且可以检测内源性的一氧化氮, 他们首次在巨噬细胞的溶酶体中捕获了一氧化氮.该探针在正常的巨噬细胞溶酶体内荧光非常弱, 通过LPS刺激细胞后发现溶酶体内荧光逐渐增强, 说明刺激后溶酶体内一氧化氮含量增加.
与探针41的结构相类似, Kumar等[72]设计合成的“关-开”型探针42(Eq. 16), 仍以吗啉作为溶酶体定位基团, 在萘酰亚胺的芳环上连接邻苯二胺作为NO的反应位点.在NO存在的情况下, PET效应被抑制, 荧光增强, 从而实现了对NO的特异性响应.与传统探针相比, 该探针克服了脱氢抗坏血酸 (DHA)、甲基乙二醛 (MGO)、抗坏血酸 (AA) 等物质的干扰, 实现了对细胞内NO的检测.
汪亭等[73]为检测溶酶体中的NO设计合成了以硅杂罗丹明为母体的近红外探针43.该探针基于内酰胺环的闭开过程实现了对NO的特异性响应.二氨基苯结构作为反应位点, 通过与NO的反应变换为苯三唑结构, 该反应过程使得PET过程被抑制, 导致探针分子的荧光急剧增强.同时, 硅杂罗丹明环对氢离子的响应不敏感, 这使得氢离子触发的开环过程被抑制, 降低了背景荧光的干扰.
亚硝酰氢HNO是研究相对较少的活性氮物种.研究表明[74], 亚硝酰氢有区别于一氧化氮的独特生理功能.作为亲电试剂, 亚硝酰氢可以抵御哺乳动物血管中的超氧化物损伤; 作为亲核试剂, 亚硝酰氢可与金属离子配位或者还原金属离子.更重要的是, 亚硝酰氢可以通过调节与降血钙素基因相关的肽类物质来提高正常的或是衰老的心脏的收缩力, 减小其舒张力.越来越多证据表明, 亚硝酰氢对于心脏相关疾病的治疗具有重大意义.此外, 亚硝酰氢还可以从一氧化氮与硫化氢的氧化还原反应中得来.因为缺乏有效的检测手段, 亚硝酰氢的形成机制还没有被清晰地阐明[75, 76].一氧化氮可以和溶酶体以外的许多蛋白质相互作用, 从而引发自吞噬过程, 这涉及到亚硝酰氢和一氧化氮在超氧化物歧化酶存在下的相互转换.亚硝酰氢在生化系统中总是具有很高的化学反应活性, 并且容易二聚后脱水变成氧化亚氮, 该反应过程常常阻碍细胞中亚硝酰氢的精确检测.近来, Lippard研究组[77]报道了基于Cu2+络合物检测亚硝酰氢的荧光探针, 但该类探针会被生物系统中还原性物质, 如维生素C和谷胱甘肽 (GSH) 等干扰.
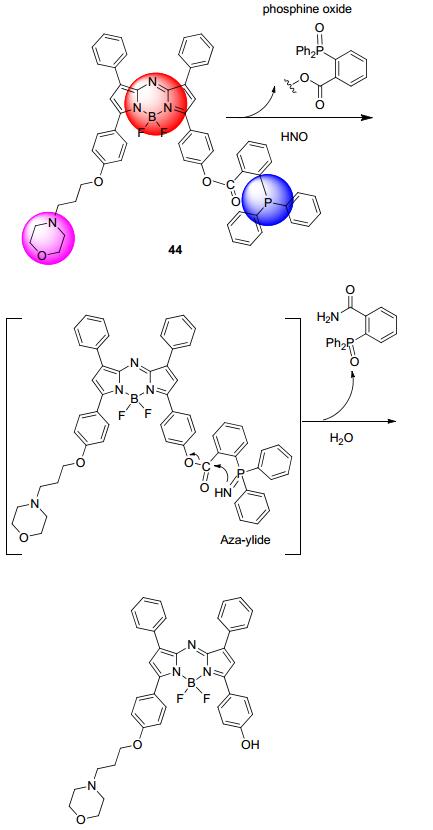
陈令新等[75]设计合成的近红外探针44(Scheme 7), 由三部分构成, aza-BODIPY为荧光发色团, 二苯膦基苯甲酰为亚硝酰氢反应基团, 吗啉为溶酶体定位基团.该探针检测亚硝酰氢的原理是基于氮叶立德试剂 (aza-ylide) 参与的分子内酯的氨解反应.具体过程是, 亚硝酰氢与三苯基膦反应生成相应的氮叶立德中间体, 进而经过分子内酯的氨解反应释放出醇和酰胺.该探针不仅可用于RAW264.7细胞溶酶体内HNO的检测, 而且实现了小鼠体内亚硝酰氢的成像, 无背景荧光干扰.
6 检测金属离子的溶酶体荧光探针
铜离子是人体中第三丰富的过渡元素, 在人体各项生命活动中起着重要作用.溶酶体中的铜离子与肝脏损伤有十分紧密的联系, 随着年龄的增长以及肝脏损伤的加剧, 一定量的铜离子就会聚集于溶酶体, 肝脏毒性与铜离子的浓度有着密切关联.因此, 检测溶酶体中铜离子的探针也成为近年来的关注对象.
唐波等[78]报道了以常见的罗丹明B为荧光团, 噻吩基团作为铜离子识别基团的探针45.在铜离子存在的情况下, 该探针无荧光的螺环结构开环, 呈现粉红色, 在pH 4.5~6.0处, 荧光有明显增强, 适用于溶酶体中铜离子的检测.王志林等[79]基于ICT原理设计的铜离子探针46以NBD作为电子受体, 四氮的双环结构为电子给体, 只在铜离子存在的情况下探针才有明显的荧光淬灭现象, 其荧光强度与铜离子浓度存在明显的线性关系, 选择性较好.另外, 该探针细胞毒性低, 水溶性较高, 具有潜在的应用前景.林伟英等[80]设计的双通道铜离子探针47以罗丹明B和萘酰亚胺为荧光团.当铜离子与该探针结合时, 铜离子与萘酰亚胺的氮原子配位使得PET过程被抑制, 同时发生反应使罗丹明的螺环结构开环, 两个识别位点均与铜离子相关, 在440和580 nm处均有明显的荧光增强现象.
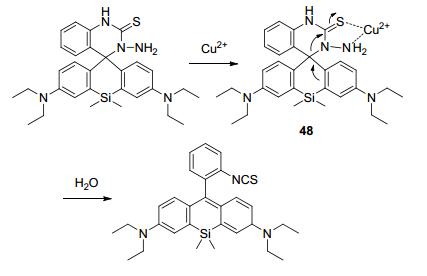
汪亭等[81]设计合成的检测溶酶体内铜离子的探针48(Scheme 8) 以硅杂罗丹明为母体并结合六元环的氨基硫脲结构, 该结构不仅是铜离子螯合与反应的位点, 同时也是溶酶体的定位基团, 使该探针在溶酶体中聚集.与五元环结构相比, 六元环结构对氢离子更不敏感, 有效降低了在酸性溶酶体环境下的背景荧光.基于铜离子控制的开环反应, 该探针很好地实现了对溶酶体中铜离子的位置与浓度的检测.
除铜离子外, 锌离子也是一种极为重要的金属离子, 与溶酶体功能紊乱以及自体吞噬等密切相关.江华等[82]设计合成了特异性检测活细胞溶酶体中锌离子的比率型探针49.该探针有较好的稳定性与水溶性, 以二甲基乙基氨基来定位溶酶体, 在加入锌离子后, 通过喹啉-DPA结构与锌离子1:1络合, 最大发射波长发生蓝移, 荧光比率发生显著改变.
7 检测阴离子的溶酶体荧光探针
氟离子对牙齿健康和骨质疏松的治疗有益, 但过多摄入氟离子却有可能造成氟中毒, 严重者可能导致癌症.因此, 特异性检测氟离子的荧光探针也成为近年来的研究热点.
基于萘酰亚胺结构, 卢志云等[83]设计合成了比色和荧光双通道氟离子探针50, 该探针可以特异性地定位于癌细胞的溶酶体.在加入氟离子后, 探针50的酚羟基与氟离子形成氢键, 通过氢键发生去质子化, 最大吸收波长发生红移, 且伴随强烈的荧光淬灭.该探针膜通透性较好, 能在细胞的溶酶体处聚集, 在细胞成像时能很好地区分癌细胞和正常细胞.
8 检测溶酶体物理性质的荧光探针
粘度通过影响物质流动性从而影响相关的生理功能, 当生物体内粘度异常时, 会导致疾病与人体稳态紊乱, 如糖尿病、心肌梗死、高血压等.通过监测细胞器粘度, 我们可以了解其位置、形态及组成.溶酶体作为细胞的循环利用中心, 不断接收细胞衰老残片或无用的大分子物质, 将其分解为小分子以供细胞再次利用.然而, 当溶酶体功能失调时, 尤其在缺少溶酶体酶的溶酶体贮积症中, 大分子物质无法分解反而在溶酶体中累积.因为溶酶体粘度随着大分子物质的数量及密度变化而波动, 实时监测溶酶体粘度的动态变化意义重大, 不仅能够加深我们对基础细胞生物学的理解, 还可以帮助与溶酶体功能失调相关的疾病诊断[11].
肖义等[11]设计合成了首个检测溶酶体粘度的荧光探针51(Eq. 17).该探针在激光共聚焦显微镜下有非常高的时空分辨率, 可以作为理想的溶酶体示踪剂.此外, 该探针还可在荧光寿命成像中定量检测活体细胞中溶酶体内粘度的变化.探针51将溶酶体的定位基团吗啉与一个典型的BODIPY旋转体相连, 通过连接苯环与BODIPY荧光团单键的旋转, 反映溶酶体粘度.
苏新艳等[12]设计合成了可以定位溶酶体的氟硼荧类探针52.由于聚醚侧链的供电子效应, 吗啉基团向氟硼荧染料的光诱导电子转移途径被阻断.随温度升高, 荧光团周围粘度减小, 探针分子的分子内转动增强, 荧光减弱, 从而实现对溶酶体粘度的检测.
9 检测溶酶体中酶类和ATP的荧光探针
溶酶体中的酶类对细胞自消化意义重大, 与蛋白质、脂质、碳水化合物等的分解息息相关.而溶酶体中的酶不足会导致一系列遗传性溶酶体贮存障碍 (LSDs).例如, 溶酶体酯酶分泌不足会导致沃尔曼病, 包括腹泻、腹胀、肝肿大、体重下降等一系列症状.
Liu等[84]设计合成的探针53(Eq. 18) 能够选择性的检测溶酶体酯酶的活性.该探针采用吗啉为溶酶体定位基团, 双水杨酰腙为荧光团, 和酯酶反应的乙酰氧基与荧光团共轭, 探针响应基于AIE与ESIPT过程.探针53对溶酶体有良好的定位, 在高浓度下也不发生自淬灭现象, 还具有高发光率、大斯托克斯位移、低细胞毒性等优点.探针53可用来定向检测溶酶体酯酶的活性, 能够在活体细胞内追踪溶酶体的移动, 对于溶酶体酯酶分泌不足导致的沃尔曼病的监测具有很大的应用潜力.
基于活性的探针 (activity-based probes, ABPs) 是一类能够共价结合特定靶酶活性位点的化学小分子探针[85, 86].由Bogyo课题组[87]开发的ABP探针54a (DCG-04)(图 9) 由三部分组成, 与半胱氨酸蛋白酶活性中心反应的环氧丁二酰基结构单元、荧光信号单元 (生物素) 和含有精氨酸残基的穿膜肽.该探针已经被证实能够识别溶酶体中的组织蛋白酶B, F, C, H, K, L, S和V.张玉慧课题组[14]同样引入了环氧丁二酰基结构单元作为反应基团, 实现了对组织蛋白酶家族的标记.她们将细胞穿膜肽-八聚精氨酸整合到荧光探针结构中, 获得了一种基于活性组织蛋白酶家族的ABP类透膜荧光小分子探针54b.该探针不仅可以标记各种活体细胞中的溶酶体, 对于固定细胞、透化细胞和被氯化铵处理过的细胞中的溶酶体也具有标记作用.此外, 该探针还可以通过检测溶酶体的变化而对细胞凋亡实施实时监测.
马会民等[88]以吗啉为溶酶体定位基团, 4-硝基-1, 8-萘酰亚胺为荧光发色团以及硝基还原酶的作用位点, 设计合成了探针55(Eq. 19), 用于检测溶酶体中的硝基还原酶.探针作用机理源于硝基还原酶催化的还原反应, 探针被还原为4-氨基-1, 8-萘酰亚胺后荧光显著增强.该探针对硝基还原酶的检测限为2.2 ng/mL, 可以用于缺氧条件下硝基还原酶的荧光成像.研究结果表明, 缺氧条件下, 溶酶体内的硝基还原酶水平高于细胞质中硝基还原酶的水平.
脂质过氧化作用 (lipid peroxidation, LPO) 在溶酶体X中非常重要, 与许多疾病相关.在动脉粥样硬化的初始阶段, 溶酶体会像泡沫一样膨胀, 许多脂蛋白积累, 导致LPO的自由基链增长反应加速.考虑到已有的LPO探针往往不能对溶酶体进行准确定位, 肖义等[89]设计合成了探针56, 成为首个能够定位于溶酶体的LPO探针 (Foam-LPO).该探针含有一个碱性的三级胺使得探针能够定位于酸性的溶酶体, 与BODIPY相连的共轭二烯单元, 在LPO的过程中会发生降解, 使得探针的荧光发射从586 nm蓝移动到512 nm.在荧光共聚焦显微镜下, 通过Foam-LPO我们不仅可以观察到溶酶体形态的动态变化, 还可以通过比率成像得到单个溶酶体内LPO的程度.此外, 该探针可以用于双色荧光标记流式细胞术 (FCM), 可以对大量处于不同阶段的细胞进行定量分析; 同时, 该探针可以对LPO过程中的低密度脂蛋白 (LDL) 与其氧化态 (ox-LDL) 所扮演的角色进行分析, 有助于人们了解动脉粥样硬化的诱因以及控制因素.
佟振合等[3]设计合成了探针57用于检测溶酶体内的缺氧程度从而得以区分含氧量低的肿瘤细胞和正常的细胞.该探针通过哌嗪将氟硼荧荧光团和偶氮苯连接起来, 偶氮苯结构既作为与缺氧程度直接相关的偶氮还原酶的靶向基团, 也作为氟硼荧荧光的淬灭基团.在偶氮还原酶的作用下, 偶氮键被还原裂解释放出含哌嗪基的氟硼荧, 该产物能被质子化从而实现对缺氧性的肿瘤细胞中溶酶体的定位.
ATP是细胞的“能量货币”, 在细胞功能中扮演十分重要的角色, 也被用作细胞生存能力和受伤程度的指示物.在星形胶质细胞和小神经胶质细胞的溶酶体中含有大量ATP, 并且可以释放ATP作为依赖Ca2+胞吐作用的重要信号分子.共轭聚合物 (conjugated polymers, CPs) 作为在化学和生物学灵敏检测的良好光学平台, 可以极大地增强荧光信号, 尤其是水溶性的聚噻吩 (PT) 衍生物, 可以用于DNA、蛋白质和生物小分子的高灵敏荧光检测.王志林等[90]设计合成了水溶性的共轭聚合物58, 其侧链包含不同的咪唑鎓盐基团, 可以作为结合位点与阴离子发生静电作用.这些聚合物在液体中可以发生无规卷曲异构化现象, 通过静电作用与ATP结合发生堆积形成聚合体.这种聚合物灵敏度高, 对ATP检测限低, 且具有良好的生物兼容性, 被成功地用于Hela细胞中溶酶体内ATP的实时监测.
10 总结与展望
近年来, 基于有机小分子定位于溶酶体的荧光探针已经被广泛应用到RSMs的检测中, 成为溶酶体探针研究的热点, 该类探针由于其特异的靶向性, 能够识别和提供客体分布的信息, 现已成为研究生物学和基础医学领域相关问题的重要手段.其中, 双光子荧光探针具有近红外光源激发而克服光漂白与光致毒的缺点, 具有高分辨率、降低组织自发荧光干扰等优点, 在溶酶体荧光探针的研究中备受关注.对一些常见的发色团 (如罗丹明、萘酰亚胺、氟硼吡咯等) 结构进行修饰, 连接吗啉等定位基团和特异性响应基团, 得到较大斯托克斯位移和较高荧光量子产率、光稳定性较好的比率型探针, 已经逐渐成为新型溶酶体探针设计合成的发展方向.
目前溶酶体探针已经开始应用于各类癌细胞的荧光成像, 能够实现对生物系统内溶酶体中RSMs的动态监测, 对部分药物 (如乐铂) 响应的可视化检测, 以及通过对溶酶体特异性膜蛋白与水解酶的测定, 对大量处于不同阶段的细胞进行定量分析.通过溶酶体探针的深入研究, 将有助于科学家们进一步理解溶酶体参与的生命活动分子机制, 以及与溶酶体相关疾病的诱因及控制因素.利用溶酶体探针进行疾病的前期诊断及后期治疗预计将成为这一领域今后重要的发展方向之一.
-
-
[1]
Davies, B. A.; Lee, J. R. E.; Oestreich, A. J.; Katzmann, D. J. Chem. Rev. 2009, 109, 1575. doi: 10.1021/cr800473s
-
[2]
Surendran, K.; Vitiello, S. P.; Pearce, D. A. Pediatr. Nephrol. 2014, 29, 2253. doi: 10.1007/s00467-013-2652-z
-
[3]
Luo, S.; Liu, Y.; Wang, F.; Fei, Q.; Shi, B.; An, J.; Zhao, C.; Tung, C.-H. Analyst 2016, 141, 2879. doi: 10.1039/C6AN00369A
-
[4]
Repnik, U.; Turk, B. Mitochondrion 2010, 10, 662. doi: 10.1016/j.mito.2010.07.008
-
[5]
Ghosh, M.; Carlsson, F.; Laskar, A.; Yuan, X.; Li, W. FEBS Lett. 2011, 585, 623. doi: 10.1016/j.febslet.2010.12.043
-
[6]
Yu, H. B.; Xiao, Y.; Jin, L. J. J. Am. Chem. Soc. 2012, 134, 17486. doi: 10.1021/ja308967u
-
[7]
李杨洁, 吕子奇, 刘敏, 邢国文, 有机化学, 2016, 36, 962. doi: 10.6023/cjoc201510012Li, Y.; Lv, Z.; Liu, M.; Xing, G. W. Chin. J. Org. Chem. 2016, 36, 962 (in Chinese). doi: 10.6023/cjoc201510012
-
[8]
Kim, D.; Kim, G.; Nam, S.; Yin, J.; Yoon, J. Sci. Rep.-UK 2015, 5, 8488. doi: 10.1038/srep08488
-
[9]
Wang, X.; Zhao, Q.; Sun, J.; Lv, J.; Tang, B. Prog. Chem. 2013, 25, 179.
-
[10]
Li, H.-M.; Wang, C.-L.; She, M.-Y.; Zhu, Y.-L.; Zhang, J.-D.; Yang, Z.; Liu, P.; Wang, Y.-Y.; Li, J.-L. Anal. Chim. Acta 2015, 900, 97. doi: 10.1016/j.aca.2015.10.021
-
[11]
Wang, L.; Xiao, Y.; Tian, W.-M.; Deng, L.-Z. J. Am. Chem. Soc. 2013, 135, 2903. doi: 10.1021/ja311688g
-
[12]
Wang, H.; Wu, Y.-Q.; Shi, Y.-L.; Tao, P.; Fan, X.; Su, X.-Y.; Kuang, G.-C. Chem.-Eur. J. 2015, 21, 3219. doi: 10.1002/chem.v21.8
-
[13]
Wu, Z.-G.; Tang, M.-L.; Tian, T.; Wu, J.-G.; Deng, Y.-L.; Dong, X.-H.; Tan, Z.; Weng, X.-C.; Liu, Z.-H; Wang, C.-J.; Zhou, X. Talanta 2011, 87, 216. doi: 10.1016/j.talanta.2011.09.065
-
[14]
Fan, F.; Nie, S.; Yang, D.; Luo, M.; Shi, H.; Zhang, Y. Bioconjugate Chem. 2012, 23, 1309. doi: 10.1021/bc300143p
-
[15]
Boya, P.; Andreau, K.; Poncet, D.; Zamzami, N.; Perfettini, J.; Metivier, D.; Ojcius, D. M.; Jäättelä, M.; Kroemer, G. J. Exp. Med. 2003, 197, 1323. doi: 10.1084/jem.20021952
-
[16]
Yu, K.-K.; Li, K.; Hou, J.-T.; Qin, H.-H; Xie, Y.-M.; Qian, C.-H.; Yu, X.-Q. RSC Adv. 2014, 4, 33975. doi: 10.1039/C4RA05215C
-
[17]
Li, Z.; Song, Y.-L.; Yang, Y.-H.; Yang, L.; Huang, X.-H.; Han, J.-H.; Han, S.-F. Chem. Sci. 2012, 3, 2941. doi: 10.1039/c2sc20733h
-
[18]
Zhang, X.-F.; Wang, C.; Han, Z.; Xiao, Y. ACS Appl. Mater. Interfaces 2014, 6, 21669. doi: 10.1021/am506750m
-
[19]
Zhang, H.; Fan, J.-L.; Dong, H.-J.; Zhang, S.-Z; Xu, W.-Y.; Wang, J.-Y.; Gao, P.; Peng, X.-J. J. Mater. Chem. B 2013, 1, 5450. doi: 10.1039/c3tb20646g
-
[20]
Han, J. H.; Park, S. K.; Lim, C. S.; Park, M. K.; Kim, H. J.; Kim, H. M.; Cho, B. R. Chem.-Eur. J. 2012, 18, 15246. doi: 10.1002/chem.v18.48
-
[21]
Yang, W.-G.; Chan, P.-S.; Chan, M.-S.; Li, K.-F.; Lo, P. K.; Mak, N. K.; Cheah, K. W.; Wong, M. S. Chem. Commun. 2013, 49, 3428. doi: 10.1039/c3cc41240g
-
[22]
Wang, X.-H.; Nguyen, D. M.; Yanez, C. O.; Rodriguez, L.; Ahn, H.; Bondar, M. V.; Belfield, K. D. J. Am. Chem. Soc. 2010, 132, 12237. doi: 10.1021/ja1057423
-
[23]
Andrade, C. D.; Yanez, C. O.; Qaddoura, M. A.; Wang, X.; Arnett, C. L.; Coombs, S. A.; Yu, J.; Bassiouni, R.; Bondar, M. V.; Belfield, K. D. J. Fluoresc. 2011, 21, 1223. doi: 10.1007/s10895-010-0801-3
-
[24]
Capodilupo, A. L.; Vergaro, V.; Baldassarre, F.; Cardone, A.; Corrente, G. A.; Carlucci, C.; Leporatti, S.; Papadia, P.; Gigli, G.; Ciccarella, G. Biochim. Biophys. Acta 2015, 1850, 385. doi: 10.1016/j.bbagen.2014.10.010
-
[25]
Horobin, R. W.; Rashid-Doubell, F. Biotech. Histochem. 2013, 88, 461. doi: 10.3109/10520295.2013.780635
-
[26]
Chalmers, S.; Caldwell, S. T.; Quin, C.; Prime, T. A.; James, A. M.; Cairns, A. G.; Murphy, M. P.; McCarron, J. G.; Hartley, R. C. J. Am. Chem. Soc. 2012, 134, 758. doi: 10.1021/ja2077922
-
[27]
Zhang, Y.; Fang, H.-M.; Zhang, X.-T.; Wang, S.; Xing, G.-W. ChemistrySelect 2016, 1, 1. doi: 10.1002/(ISSN)2365-6549
-
[28]
Lv, H.-S.; Huang, S.-Y.; Zhao, B.-X.; Miao, J.-Y. Anal. Chim. Acta 2013, 788, 177. doi: 10.1016/j.aca.2013.06.038
-
[29]
Shen, S.-L.; Chen, X.-P.; Zhang, X.-F.; Miao, J.-Y.; Zhao, B.-X. J. Mater. Chem. B 2015, 3, 919.
-
[30]
Lv, H.-S.; Huang, S.-Y.; Xu, Y.; Dai, X.; Miao, J.-Y.; Zhao, B.-X. Bioorg. Med. Chem. Lett. 2014, 24, 535. doi: 10.1016/j.bmcl.2013.12.025
-
[31]
Zhao, X.; Ge, D.; Dai, X.; Wu, W.; Miao, J.; Zhao, B. Spectro-chim. Acta, Part A 2015, 151, 218. doi: 10.1016/j.saa.2015.06.111
-
[32]
Zhao, X.; Chen, X.; Shen, S.; Li, D.; Zhou, S.; Zhou, Z.; Xiao, Y.; Xi, G.; Miao, J.; Zhao, B. RSC Adv. 2014, 4, 50318. doi: 10.1039/C4RA07555B
-
[33]
Lv, H.; Liu, J.; Zhao, J.; Zhao, B.; Miao, J. Sens. Actuators, B 2013, 177, 956. doi: 10.1016/j.snb.2012.12.014
-
[34]
Zhang, X.-F.; Zhang, T.; Shen, S.-L.; Miao, J.-Y.; Zhao, B.-X. J. Mater. Chem. B 2015, 3, 3260. doi: 10.1039/C4TB02082K
-
[35]
Zhang, X.; Zhang, T.; Shen, S.; Miao, J.; Zhao, B. RSC Adv. 2015, 5, 49115. doi: 10.1039/C5RA06246B
-
[36]
Cao, X.; Chen, L.; Zhang, X.; Liu, J.; Chen, M.; Wu, Q.; Miao, J.; Zhao, B. Anal. Chim. Acta 2016, 920, 86. doi: 10.1016/j.aca.2016.03.029
-
[37]
Yu, K.-K.; Li, K.; Hou, J.-T.; Yang, J.; Xie, Y.-M.; Yu, X.-Q. Polym. Chem.-UK 2014, 5, 5804. doi: 10.1039/C4PY00646A
-
[38]
Chen, X.; Bi, Y.; Wang, T.-Y.; Li, P.-F.; Yan, X.; Hou, S.-S.; Bammert, C. E.; Ju, J.-F.; Gibson, K. M.; Pavan, W. J.; Bi, L.-R. Sci. Rep.-UK 2015, 5, 9004. doi: 10.1038/srep09004
-
[39]
Yapici, N. B.; Bi, Y.; Li, P.-F.; Chen, X.; Yan, X.; Mandalapu, S. R.; Faucett, M.; Jockusch, S.; Ju, J.-F.; Gibson, K. M.; Pavan, W. J.; Bi, L.-R. Sci. Rep.-UK 2015, 5, 8576. doi: 10.1038/srep08576
-
[40]
Sun, R.; Liu, W.; Xu, Y.-J.; Lu, J.-M.; Ge, J.-F.; Ihara, M. Chem. Commun. 2013, 49, 10709. doi: 10.1039/c3cc46696e
-
[41]
Wang, X.; Li, X.; Sun, R.; Xu, Y.; Ge, J. Analyst 2016, 141, 2962. doi: 10.1039/C6AN00258G
-
[42]
Wang, Q.-Q.; Zhou, L.-Y.; Qiu, L.-P.; Lu, D.-Q.; Wu, Y.-X.; Zhang, X.-B. Analyst 2015, 140, 5563. doi: 10.1039/C5AN00683J
-
[43]
Li, G.-P.; Zhu, D.-J.; Xue, L.; Jiang, H. Org. Lett. 2013, 15, 5020. doi: 10.1021/ol4023547
-
[44]
Wan, Q.-Q.; Chen, S.-M.; Shi, W.; Li, L.-H.; Ma, H.-M. Angew. Chem., Int. Ed. 2014, 53, 10916. doi: 10.1002/anie.201405742
-
[45]
Chen, L.-Z.; Li, J.; Liu, Z.-Z.; Ma, Z.; Zhang, W.; Du, L.-P.; Xu, W.-F.; Fang, H.; Li, M.-Y. RSC Adv. 2013, 3, 13412. doi: 10.1039/c3ra41898g
-
[46]
Zhang, J.-T.; Yang, M.; Li, C.; Dorh, N.; Xie, F.; Luo, F.-T.; Tiwari, A.; Liu, H.-Y. J. Mater. Chem. B 2015, 3, 2173. doi: 10.1039/C4TB01878H
-
[47]
Zhu, W.-W.; Chai, X.-Y.; Wang, B.-G.; Zou, Y.; Wang, T.; Meng, Q.-G.; Wu, Q.-Y. Chem. Commun. 2015, 51, 9581. doi: 10.1039/C5CC90249E
-
[48]
He, L.; Li, Y.; Tan, C.-P.; Ye, R.-R.; Chen, M.-H.; Cao, J.-J.; Ji, L.-N.; Mao, Z.-W. Chem. Sci 2015, 6, 5409. doi: 10.1039/C5SC01955A
-
[49]
Dong, B.; Song, X.; Wang, C.; Kong, X.; Tang, Y.; Lin, W. Anal. Chem. 2016, 7, 4085. http://www.researchgate.net/publication/297679346_Dual-site_Controlled_and_Lysosome-targeted_ICT-PET-FRET_Fluorescent_Probe_for_Monitoring_pH_Changes_in_Living_Cells
-
[50]
Wang, R. Physiol. Rev. 2012, 92, 791. doi: 10.1152/physrev.00017.2011
-
[51]
Liu, T.-Y.; Xu, Z.-C.; Spring, D. R.; Cui, J.-N. Org. Lett. 2013, 15, 2310. doi: 10.1021/ol400973v
-
[52]
Chen, X.-Q.; Zhou, Y.; Peng, X.-J.; Yoon, J. Chem. Soc. Rev. 2010, 39, 2120. doi: 10.1039/b925092a
-
[53]
Liu, Y.; Meng, F.; He, L.; Liu, K.; Lin, W. Chem. Commun. 2016, 52, 7016. doi: 10.1039/C6CC02368A
-
[54]
Qiao, Q.-L.; Zhao, M.; Lang, H.-J.; Mao, D.-Q.; Cui, J.-N.; Xu, Z.-C. RSC Adv. 2014, 4, 25790. doi: 10.1039/c4ra03725a
-
[55]
Zou, X. J.; Ma, Y. C.; Guo, L. E.; Liu, W. X.; Liu, M. J.; Zou, C. G.; Zhou, Y.; Zhang, J. F. Chem. Commun. 2014, 50, 13833. doi: 10.1039/C4CC05539J
-
[56]
Yang, S.; Qi, Y.; Liu, C.-H.; Wang, Y.-J.; Zhao, Y.-R.; Wang, L.-L.; Li, J.-S.; Tan, W.-H.; Yang, R.-H. Anal. Chem. 2014, 86, 7508. doi: 10.1021/ac501263d
-
[57]
Kand, D.; Saha, T.; Lahiri, M.; Talukdar, P. Org. Biomol. Chem. 2015, 13, 8163. doi: 10.1039/C5OB00889A
-
[58]
Cao, M.-J.; Chen, H.-Y.; Chen, D.; Xu, Z.-Q.; Liu, S. H.; Chen, X.-Q.; Yin, J. Chem. Commun. 2016, 52, 721. doi: 10.1039/C5CC08328A
-
[59]
Fan, J.-L.; Han, Z.-C.; Kang, Y.; Peng, X.-J. Sci. Rep.-UK 2016, 6, 19562. doi: 10.1038/srep19562
-
[60]
Huang, R.; Wang, B.; Si-Tu, X.; Gao, T.; Wang, F.; He, H.; Fan, X.; Jiang, F.; Liu, Y. Chem. Commun. 2016, 52, 11579. doi: 10.1039/C6CC06750F
-
[61]
Dixon, S. J.; Stockwell, B. R. Nat. Chem. Biol. 2013, 10, 9. doi: 10.1038/nchembio.1416
-
[62]
Zhou, X.; Kwon, Y.; Kim, G.; Ryu, J.; Yoon, J. Biosens. Bioelectron. 2015, 64, 285. doi: 10.1016/j.bios.2014.08.089
-
[63]
Abo, M.; Minakami, R.; Miyano, K.; Kamiya, M.; Nagano, T.; Urano, Y.; Sumimoto, H. Anal. Chem. 2014, 86, 5983. doi: 10.1021/ac501041w
-
[64]
Bortolozzi, R.; Gradowski, S. V.; Ihmels, H.; Schäfer, K.; Viola, G. Chem. Commun. 2014, 50, 8242. doi: 10.1039/C4CC02283A
-
[65]
Schäferling, M.; Grögel, D. B. M.; Schreml, S. Microchim. Acta 2011, 174, 1. doi: 10.1007/s00604-011-0606-3
-
[66]
Song, D.; Lim, J. M.; Cho, S.; Park, S.; Cho, J.; Kang, D.; Rhee, S. G.; You, Y.; Nam, W. Chem. Commun. 2012, 48, 5449. doi: 10.1039/c2cc31632c
-
[67]
Ren, M.-G.; Deng, B.-B.; Wang, J.-Y.; Kong, X.-Q.; Liu, Z.-R.; Zhou, K.; He, L.-W.; Lin, W.-Y. Biosens. Bioelectron. 2016, 79, 237. doi: 10.1016/j.bios.2015.12.046
-
[68]
Qu, Z. J.; Ding, J. X.; Zhao, M. Y.; Li, P. J. Photochem. Photobiol. A, 2015, 299, 1. doi: 10.1016/j.jphotochem.2014.10.015
-
[69]
Yuan, L.; Wang, L.; Agrawalla, B. K.; Park, S.; Zhu, H.; Sivaraman, B.; Peng, J.; Xu, Q.; Chang, Y. J. Am. Chem. Soc. 2015, 137, 5930. doi: 10.1021/jacs.5b00042
-
[70]
Zhang, K. Y.; Zhang, J.; Liu, Y.; Liu, S.; Zhang, P.; Zhao, Q.; Tang, Y.; Huang, W. Chem. Sci. 2015, 6, 301. doi: 10.1039/C4SC02600D
-
[71]
Ren, M.; Deng, B.; Zhou, K.; Kong, X.; Wang, J.; Xu, G.; Lin, W., J. Mater. Chem. B 2016, 4, 4739. doi: 10.1039/C6TB01085G
-
[72]
Gupta, N.; Reja, S. I.; Bhalla, V.; Gupta, M.; Kaur, G.; Kumar, M. S., Chem.-Asian J. 2016, 11, 1020. doi: 10.1002/asia.v11.7
-
[73]
Wang, B.-G.; Yu, S.-C.; Chai, X.-Y.; Li, T.-J.; Wu, Q.-Y.; Wang, T., Chem.-Eur. J. 2016, 22, 5649. doi: 10.1002/chem.201505054
-
[74]
景晓彤, 硕士论文, 曲阜师范大学, 山东, 2015.Jin, X.-T. M.S. Thesis, Qufu University, Shandong, 2015 Chinese).
-
[75]
Jing, X.-T.; Yu, F.-B.; Chen, L.-X. Chem. Commun. 2014, 50, 14253. doi: 10.1039/C4CC07561G
-
[76]
Eberhardt, M.; Dux, M.; Namer, B.; Miljkovic, J.; Cordasic, N.; Will, C.; Kichko, T. I.; de la Roche, J.; Fischer, M.; Suárez, S.A.; Bikiel, D.; Dorsch, K.; Leffler, A.; Babes, A.; Lampert, A.; Lennerz, J. K.; Jacobi, J.; Martí, M. A.; Doctorovich, F.; Högestätt, E. D.; Zygmunt, P. M.; Ivanovic-Burmazovic, I.; Messlinger, K.; Reeh, P.; Filipovic, M. R. Nat. Commun. 2014, 5, 4381. doi: 10.1038/ncomms5381
-
[77]
Rosenthal, J.; Lippard, S. J. J. Am. Chem. Soc. 2010, 132, 5536. doi: 10.1021/ja909148v
-
[78]
Li, P.; Zhou, H.; Tang, B. J. Photochem. Photobiol., A 2012, 249, 36. doi: 10.1016/j.jphotochem.2012.08.020
-
[79]
Wang, X.-B.; Ma, X.-Y.; Yang, Z.; Zhang, Z.; Wen, J.-H.; Geng, Z.-R.; Wang, Z.-L. Chem. Commun. 2013, 49, 11263. doi: 10.1039/c3cc46585c
-
[80]
Ren, M.-G.; Deng, B.-B.; Wang, J.-Y.; Liu, Z.-R.; Lin, W.-Y. J. Mater. Chem. B 2015, 3, 6746. doi: 10.1039/C5TB01184A
-
[81]
Wang, B.; Cui, X.; Zhang, Z.; Chai, X.; Ding, H.; Wu, Q.; Guo, Z.; Wang, T. Org. Biomol. Chem. 2016, 14, 6720. doi: 10.1039/C6OB00894A
-
[82]
Xue, L.; Li, G.-P.; Zhu, D.-J.; Liu, Q.; Jiang, H. Inorg. Chem. 2012, 51, 10842. doi: 10.1021/ic301307v
-
[83]
Zheng, X.-J.; Zhu, W.-C.; Liu, D.; Ai, H.; Huang, Y.; Lu, Z.-Y. ACS Appl. Mater. Interfaces 2014, 6, 7996. doi: 10.1021/am501546h
-
[84]
Gao, M.; Hu, Q.-L.; Feng, G.-X.; Tang, B.Z.; Liu, B. J. Mater. Chem. B 2014, 2, 3438. doi: 10.1039/c4tb00345d
-
[85]
Blum, G.; Weimer, R. M.; Edgington, L. E.; Adams, W.; Bogyo, M. PLoS One 2009, 7, 6374. http://europepmc.org/articles/PMC2712068
-
[86]
Evans, M. J.; Cravatt, B. F. Chem. Rev. 2006, 106, 3279. doi: 10.1021/cr050288g
-
[87]
Greenbaum, D. Mol. Cell. Proteomics 2002, 1, 60. doi: 10.1074/mcp.T100003-MCP200
-
[88]
Zhou, J.; Shi, W.; Li, L.-H.; Gong, Q.-Y.; Wu, X.-F.; Li, X.-H., Ma, H.-M. Chem.-Asian J. 2016. 11, 2719. doi: 10.1002/asia.201600012
-
[89]
Zhang, X.-F.; Wang, B.-L.; Wang, C.; Chen, L.-C.; Xiao, Y. Anal. Chem. 2015, 87, 8292. doi: 10.1021/acs.analchem.5b01428
-
[90]
Huang, B.; Geng, Z.; Ma, X.; Zhang, C.; Zhang, Z.; Wang, Z. Biosens. Bioelectron. 2016, 83, 213. doi: 10.1016/j.bios.2016.04.064
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 226
- 文章访问数: 9449
- HTML全文浏览量: 3508


 下载:
下载:







 下载:
下载:

