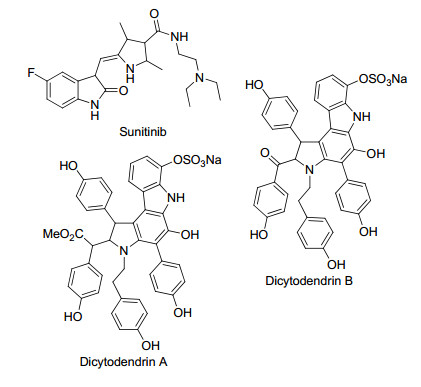
 图 1
具有抗肿瘤活性的吡咯衍生物
Figure 1.
Pyrrole derivatives with anti-tumor activity
图 1
具有抗肿瘤活性的吡咯衍生物
Figure 1.
Pyrrole derivatives with anti-tumor activity

Citation: Chen Jian, Zhang Yuankui, Zhan Xiaoping, Liu Zenglu, Mao Zhenmin. Synthesis and Anti-tumor Activity of Novel 3-Substituted-benzoyl-4-substituted-thienyl-pyrroles[J]. Chinese Journal of Organic Chemistry, 2016, 36(3): 572-579. doi: 10.6023/cjoc201510016

新型3-取代苯甲酰基-4-取代噻吩基吡咯类化合物的合成及抗肿瘤活性研究
English
Synthesis and Anti-tumor Activity of Novel 3-Substituted-benzoyl-4-substituted-thienyl-pyrroles
-
Key words:
- pyrrole
- / thiophene
- / synthesis
- / MTT assay
- / anti-tumor activity
-
吡咯是研究与应用很广泛的杂环之一, 存在于骨焦油和煤焦油中, 1857年首次被分离得到.经过一百多年的发展, 含有吡咯环结构的化合物在农药、高分子、化妆品等很多领域都有很重要的应用[1].吡咯衍生物在医药领域也有不可忽视的重要作用, 吡咯结构是许多具有重要生理活性物质的基本组成部分, 如叶绿素、血红素、维生素B12等.吡咯环上取代位点多, 能与其它环骈合组成新的母核结构, 使得吡咯衍生物的数量极速增加.由于吡咯类化合物具有优良的生物相容性和结构多样性, 医药工作者们对其进行了深入的研究, 目前已发现吡咯衍生物的生物学活性涵盖了抗真菌细菌、抗病毒、降血脂、降胆固醇、COX1/COX2抑制剂、抗肿瘤[2~4]等.其中, 具有抗肿瘤活性的吡咯类化合物包括辉瑞公司研发的Sunitinib(舒尼替尼)[5] (图 1)、来源于海洋生物的Dicytodendrins A和B[6](图 1)等.本课题组[7~9]曾报道了3, 4-二取代吡咯类系列化合物的合成及抗肿瘤活性.前期研究结果表明, 当吡咯环的1, 2, 5位无取代基, 3位为吸电子基(苯甲酰基、硝基等)取代时, 化合物具有良好的体外抗肿瘤活性.针对已报道的3, 4-二取代吡咯类化合物, 其4位取代基主要是取代苯基, 本工作设计的吡咯类新化合物在保留前期研究得出的优势结构基础上, 保留吡咯环的1, 2, 5位无取代基, 3位为取代的苯甲酰基, 在吡咯环的4位引入噻吩基及取代噻吩基.
噻吩是杂环化学中重要的研究部分[10], 噻吩也被广泛地用于新药的研发.噻吩的重要衍生物之一为生物素, 也称维生素H, 具有防止脱发、增强机体免疫力等作用; 噻吩也用于抗生素的合成, 如头孢噻啶等, 一些含有噻吩结构的抗生素比苯基同系物具有更好的疗效[11]; 由鬼臼毒素衍生而来的替尼泊苷[12]对何杰金和非何杰金淋巴瘤有明显疗效.由于噻吩环具有特殊的活性, 我们在前期报道的3, 4-二取代吡咯化合物的4位引入噻吩基团以考察噻吩基取代后的吡咯类化合物的抗肿瘤活性.
1 结果与讨论
1.1 化合物的合成
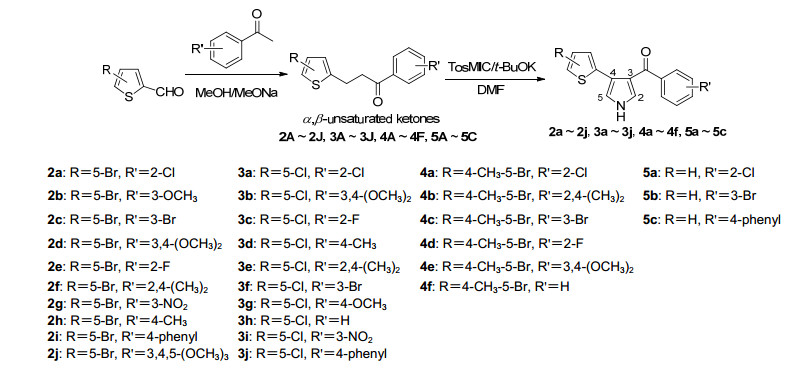
反应流程如Scheme 1, 主要分为两步. (1) α, β-不饱和酮的制备:以取代的噻吩-2-甲醛与取代的苯乙酮在碱性条件下进行Aldol缩合生成相应的α, β-不饱和酮[13], 由于原料活性和空间位阻不同, 反应时间在15 min到4 h不等. (2)环合反应:采用范勒森(Van Leusen)吡咯合成法[14], 以第一步得到的α, β-不饱和酮为原料, 与对甲基苯磺酰甲基异腈(Tosylmethyl isocyanide, TosMIC)在无水碱性环境下进行Michael加成得到相应的目标化合物.
1.2 生物活性
从表 1可以看出:部分目标化合物对所选取的3种肿瘤细胞有较强(IC50≤20 μmol•L-1)或中等(20 μmol• L-1<IC50≤50 μmol•L-1)的增殖抑制作用, 几乎所有目标化合物对正常细胞HUVEC无明显抑制作用, 具有高选择性.吡咯母核4位噻吩环分为有取代基和无取代基两种情况, 当取代基为Cl和Br时, 部分目标化合物对三种肿瘤细胞的抑制作用较无取代基的化合物抑制作用有所增强, 如化合物2c(R=5-Br, R'=3-Br)、化合物3f(R=5-Cl, R'=3-Br)与化合物5b(R=H, R'=3-Br)相比, 前两者对三种肿瘤细胞的IC50值都低于后者, 化合物2i(R=5-Br, R'=4-phenyl)、3j(R=5-Cl, R'=4-phenyl)与化合物5c(R=H, R'=4-phenyl)相比, 也是前两者对三种肿瘤细胞的IC50值都低于后者.但当溴取代的噻吩环增加一个甲基时, 即吡咯环的4位为4-甲基-5-溴噻吩取代时, 目标化合物对HCT-116细胞的增殖抑制活性明显增强, 而对Hela细胞和SGC-7901细胞的抑制活性下降, 如化合物4a~4f. 比较吡咯母核4位的卤素取代噻吩基对目标化合物的增殖抑制活性, 发现噻吩环上的卤原子对化合物的活性影响没有明显的规律, 比如化合物2c (R=5-Br, R'=3-Br)对三种肿瘤细胞株的抑制活性较3f (R=5-Cl, R'=3-Br)强; 化合物2f (R=5-Br, R'=2, 4-CH3)对三种肿瘤细胞株的抑制活性较3e(R=5-Cl, R'=2, 4-CH3)强.但化合物2a (R=5-Br, R'=2-Cl)与3a (R=5-Cl, R'=2-Cl)的抑制活性相当; 化合物2d(R=5-Br, R'=3, 4-OCH3)的活性弱于3b(R=5-Cl, R'=3, 4-OCH3), 2e(R=5-Br, R'=2-F)的弱于3c (R=5-Cl, R'=2-F), 2i(R=5-Br, R'=4-phenyl)的弱于3j(R=5-Cl, R'=4-phenyl).还有化合物2g (R=5-Br, R'=3-NO2)与3i(R=5-Cl, R'=3-NO2), 2h(R=5-Br, R'=4-CH3)与3d(R=5-Cl, R'=4-CH3)相比较, 互有强弱.
化合物 HCT-116 Hela SGC-7901 HUVEC 2a >300 >300 >300 >300 2b 73.3 145.4 180.9 212.5 2c 38.5 90.1 69.2 98.0 2d >300 >300 >300 >300 2e >300 >300 >300 >300 2f 52.1 160.3 280.1 >300 2g 63.5 60.9 51.1 85.2 2h 65.3 121.3 144.9 255.6 2i 46.1 33.1 34.1 118.6 2j 106.0 4.3 143.0 >300 3a >300 >300 >300 >300 3b 184.8 >300 >300 >300 3c 201.7 269.1 >300 >300 3d 55.2 182.7 160.5 >300 3e 135.2 233.6 >300 >300 3f 50.5 164.4 160.8 145.6 3g 55.2 71.0 201.4 173.4 3h 59.6 120.5 202.4 250.8 3i 44.4 188.0 71.7 168.8 3j 27.5 32.3 10.5 157.3 4a 30.5 >300 164.5 216.5 4b 25.6 >300 >300 156.7 4c 10.3 >300 102.8 210.0 4d 11.1 >300 153.5 >300 4e 28.4 >300 >300 119.3 4f 38.2 >300 203.1 172.4 5a >300 >300 >300 >300 5b 113.7 164.7 188.6 169.1 5c 47.7 73.1 61.6 168.6 紫杉醇 8.7 6.8 4.9 175.1 a Do not calculate IC50 value which is bigger than 300 μmol•L-1, indicates>300. 表 1 MTT实验结果[IC 50/(μmol•L -1)] a
Table 1. Result of MTT assay [IC 50/(μmol•L -1)]吡咯母核3位上的取代苯环可分为吸电子基取代、供电子基取代和无取代基的苯环, 在IC50值<100 μmol•L-1的化合物中, 苯环无取代的化合物的IC50高于苯环有取代的化合物, 如化合物4f(R=4-CH3, 5-Br, R'=H)比同系列中4a~4e对HCT-116的IC50值都高, 化合物3h(R=5-Cl, R'=H)比同系列中3d, 3f, 3h, 3i, 3j对HCT-116的IC50值都高; 当苯环取代基为强吸电子基硝基时, 化合物有一定抑制活性, 但IC50值<20 μmol•L-1的化合物4位苯环上均为供电子基和弱吸电子基取代, 如2j(R=5-Br, R'=3, 4, 5-OCH3), 3j(R=5-Cl, R'=4-phenyl), 4c(R=4-CH3, 5-Br, R'=3-Br)和4d(R=4-CH3, 5-Br, R'=2-F).
目标化合物中IC50值<20 μmol•L-1的化合物为2j, 3j, 4c和4d.其中2j(R=5-Br, R'=3, 4, 5-OCH3)是所有化合物中最有潜力的, 对Hela细胞的IC50值为4.3 μmol•L-1, 达到与紫杉醇IC50值同一数量级, 2j的苯环上有3个供电子基甲氧基取代, 推测目标化合物与Hela结合位点可能为缺电子结构; 化合物3j(R=5-Cl, R'=4-phenyl)对SGC-7901细胞的IC50值为10.5 μmol•L-1, 为紫杉醇IC50值的2.14倍, 对SGC-7901细胞有较强的增殖抑制作用.化合物4c(R=4-CH3, 5-Br, R'=3-Br), 4d(R=4-CH3, 5-Br, R'=2-F)对HCT-116细胞的IC50值分别为10.3和11.1 μmol•L-1, 与紫杉醇IC50值相近, 具有较强的细胞增殖抑制作用.
化合物2i(R=5-Br, R'=4-phenyl)与3j(R=5-Cl, R'=4-phenyl)对三种受试肿瘤细胞都显示出了不错的抗肿瘤活性, 相比其它目标化合物具有较广的抗瘤谱.
2 结论
合成了29个新型3-取代苯甲酰基-4-取代噻吩基吡咯类化合物, 部分目标化合物显示出良好的细胞增殖抑制活性, 表明结合了噻吩环与吡咯环的小分子抗肿瘤化合物有很大的研究价值与潜力, 目标化合物中2i, 3j, 4c, 4d对肿瘤细胞的IC50值低于20 μmol•L-1, 有进一步研究的意义.本工作为吡咯类抗肿瘤化合物进一步的结构修饰提供了依据, 在以后的结构改造中, 由于噻吩环部分引入卤素提高了抗肿瘤活性, 可尝试噻吩环上多卤素取代, 如二氯、二溴、5-溴-4-氟取代等, 由于化合物2i(R=5-Br, R'=4-phenyl)与3j(R=5-Cl, R'=4-phenyl)对受试肿瘤细胞有较广谱的抗肿瘤作用, 可尝试吡咯3位引入与联苯结构相近的基团, 如萘基, 考察这类萘甲酰基取代吡咯化合物的抗肿瘤活性, 此外, 还有研究表明与本工作合成的目标化合物结构相近的噻吩取代吡咯类化合物具有COX1/COX2抑制作用[16], 可尝试测定目标化合物的COX1/COX2抑制活性, 以发掘这一类化合物更多的生理作用.
3 实验部分
3.1 仪器与试剂
200~300目柱层析硅胶(青岛海洋化工厂), 薄层色谱板(GF254, 烟台江友硅胶开发有限公司), 紫外分析仪(WFH-203B, 上海精科实业有限公司), 显微熔点仪(SGW-X4, 上海精密科学仪器有限公司, 温度计未校正), 电子天平(Adventurer ARB120, 美国OHAUS)、核磁共振波谱仪(Agilent 405/54 400MHz波谱仪或Avance Ⅲ 600 MHz波谱仪, TMS为内标, 溶剂为DMSO-d6), 高分辨质谱仪(Agilent 6230 ToF); 细胞培养箱(美国Thermo公司); 酶联免疫检测仪(美国Thermo公司); 倒置显微镜(Olympus IX71);超净台(上海新苗医疗器械制造有限公司).
TosMIC (Sigma公司), 甲醇、N, N-二甲基甲酰胺(DMF)、石油醚、乙酸乙酯等常用试剂购买自国药集团化学试剂有限公司. RPMI-1640培养基(HyClone公司)、McCOY’5A培养基(Sigma公司)、南美血缘胎牛血清(HyClone公司)、青霉素-链霉素溶液(双抗, HyClone公司)、无Ca2+, Mg2+磷酸盐缓冲液(PBS, HyClone公司)、0.25%胰酶溶液(HyClone公司)、生物级DMSO ((HyClone公司)、噻唑蓝(Sigma公司)、紫杉醇(Sigma公司).
人结肠癌细胞(HCT-116, 赛百慷细胞库)、人宫颈癌细胞(Hela, 中科院细胞库)、人胃腺癌细胞(SGC-7901, 中科院细胞库)、人脐静脉血管内皮细胞(HUVEC, 中科院细胞库).
3.2 实验方法
3.2.2 生物活性实验
采用噻唑蓝(MTT)法检测细胞增值抑制活性.检测原理为活细胞线粒体中含有琥珀酸脱氢酶能将外源性MTT还原为不溶于水的蓝紫色结晶甲瓒并沉积于细胞中, 死细胞无此功能. DMSO能溶解甲瓒, 用酶联免疫检测仪测定570 nm处的吸光度(OD值), 在一定细胞数范围内, 吸光度与活细胞数量成正比, 由此能间接反映活细胞的数量. MTT法是操作简便、使用频率高的用于检测细胞增值抑制活性的方法之一[15].
具体操作步骤如下:细胞复苏后贴壁培养(HCT-116培养液为McCOY'5A, 含体积分数为10%的胎牛血清、0.0022 g/mL NaHCO3, 其余细胞培养液均为RPMI-1640, 含体积分数为10%的胎牛血清及体积分数为1%的双抗, 传代3~5代后取对数生长期的细胞, PBS冲洗后加入胰酶消化2 min, 加入5 mL培养液终止消化, 吹打成单个细胞, 计数培养液稀释后取90 μL细胞悬液接种于96孔板, 使每个孔的细胞个数大约为4000~5000.细胞培养箱中培养24 h后, 加入10 μL浓度分别为500, 200, 100, 10, 1 μg/mL的样品溶液(培养液和DMSO混合溶液, DMSO含量不超过0.05%)和阳性对照紫杉醇溶液, 使样品溶液和紫杉醇溶液终浓度为50, 20, 10, 1, 0.1 μg/mL, 每个浓度设置3个复孔, 空白对照为含等量DMSO的培养液. 24 h后, 每孔中加入20 μL 5 μg/mL MTT的PBS溶液, 继续培养4 h.小心吸去培养基, 每孔加入100 μL DMSO震荡1 min, 酶联免疫检测仪检测570 nm下吸光度.
根据化合物浓度和细胞增殖抑制率做出标准曲线, 运用SPSS非线性回归分析计算受试化合物的IC50值.
辅助材料(Supporting Information)所有目标化合物的1H NMR, 13C NMR以及ESI-HRMS谱图.这些材料可以免费从本刊网站http://sioc-journal.cn/上下载.
3.2.1 化合物的合成
称取0.09 g (3.9 mmol)金属钠加入10 mL甲醇中, 搅拌片刻制成碱性甲醇钠溶液, 加入0.40 g (2.6 mmol) 2-氯苯乙酮, 室温搅拌5 min, 加入0.50 g (2.6 mmol) 5-溴噻吩-2-甲醛, 室温反应30 min, TLC板监测反应进程, 紫外显色; 反应完毕加入硅胶粉减压旋蒸除去甲醇, 采用柱层析分离纯化, 石油醚/乙酸乙酯(V:V=60:1~20:1)梯度洗脱, 得明黄色固体2A 0.69 g, 收率80.6%. 2B~5C的合成步骤与2A相同, 该步反应收率较高, 为70%~90%.
将0.26 g (2.3 mmol) t-BuOK(叔丁醇钾)加入到12 mL DMF中, 搅拌片刻加入0.36 g (1.8 mmol) TosMIC室温搅拌5 min左右. 0.50 g (1.5 mmol) 2A溶于3 mL DMF中, 并将其滴加进反应体系, 室温反应6 h. TLC板监测反应完毕后, 反应液加入100 mL水洗, 乙酸乙酯(20 mL×3)萃取, 收集有机相, 用饱和氯化钠溶液洗, 然后用无水硫酸钠干燥有机相2 h, 抽滤, 收集滤液, 加硅胶粉减压旋蒸除去乙酸乙酯; 采用柱层析分离纯化, 石油醚/乙酸乙酯(V:V=10:1~3:1)梯度洗脱, 得棕色粉末状固体2a 0.22 g, 收率40.4%. 2b~5c合成步骤与2a相同, 产率约为30%~70%.
[4-(5-溴噻吩-2-基)-1H-吡咯-3-基](2-氯苯基)甲酮(2a):棕色粉末, 产率40.4%. m.p. 171~173 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.88 (s, 1H, pyrrole-NH), 7.54~7.40 (m, 4H, ArH), 7.33~7.28 (m, 2H, thiophene-H+pyrrole-H), 7.13 (d, J=4.0 Hz, 1H, thiophene-H), 6.99 (dd, J=2.0, 3.2 Hz, pyrrole-H); 13C NMR (101 MHz, DMSO-d6) δ: 188.8, 140.8, 138.8, 131.4, 131.2, 130.5, 130.1, 130.0, 129.1, 127.4, 126.3, 121.4, 121.0, 117.5, 109.3; ESI-HRMS calcd for C15H9ONSBrCl [M+H]+ 365.9277, 367.9319; found 365.9349, 367.9325.
[4-(5-溴噻吩-2-基)-1H-吡咯-3-基](3-甲氧基苯基)甲酮(2b):棕色粉末, 产率36.3%. m.p. 119~121 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.82 (s, 1H, pyrrole-NH), 7.42 (t, J=8.0 Hz, 1H, ArH), 7.32~7.29 (m, 3H, ArH), 7.24 (t, J=2.4 Hz, 1H, pyrrole-H), 7.17~7.15 (m, 2H, thiophene-H+pyrrole-H), 7.10 (d, J=4.0 Hz, 1H, thiophene-H), 3.81 (s, 3H, OCH3); 13C NMR (101 MHz, DMSO-d6) δ: 190.2, 159.5, 141.8, 139.4, 130.4, 129.9, 129.4, 125.9, 121.9, 120.8, 120.5, 118.1, 118.0, 114.1, 109.3, 55.7; ESI-HRMS calcd for C16H12O2NSBr [M+H]+ 361.9772, 363.9817; found 361.9844, 363.9825.
[4-(5-溴噻吩-2-基)-1H-吡咯-3-基](3-溴苯基)甲酮(2c):棕色粉末, 产率51.3%. m.p. 135~137 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.89 (s, 1H, pyrrole-NH), 7.83 (t, J=1.6 Hz, 1H, ArH), 7.79 (d, J=8.0 Hz, 1H, ArH), 7.72 (d, J=8.0 Hz, 1H, ArH), 7.46 (t, J=8.0 Hz, 1H, ArH), 7.32~7.29 (m, 2H, pyrrole-H), 7.16 (d, J=3.9 Hz, 1H, thiophene-H), 7.10 (d, J=3.9 Hz, 1H, thiophene-H); 13C NMR (101 MHz, DMSO-d6) δ: 188.8, 142.4, 139.1, 134.7, 131.7, 131.0, 130.4, 129.8, 128.3, 126.1, 122.1, 121.0, 120.1, 117.9, 109.3; ESI-HRMS calcd for C15H9ONSBr2[M+H]+ 409.8840, 411.8797; found 409.8841, 411.8822.
[4-(5-溴噻吩-2-基)-1H-吡咯-3-基](3, 4-二甲氧基苯基甲酮)(2d):棕色粉末, 产率40.5%. m.p. 162~164 ℃; 1H NMR (600 MHz, DMSO-d6) δ: 11.75 (s, 1H, pyrrole-NH), 7.41 (dd, J=1.8, 8.2 Hz, 1H, ArH), 7.35 (d,J=1.8 Hz, 1H, ArH), 7.29 (t, J=2.4 Hz, 1H, pyrrole-H), 7.27 (t, J=2.4 Hz, 1H, pyrrole-H), 7.11 (d, J=3.6 Hz, 1H,thiophene-H), 7.08 (d, J=3.6 Hz, 1H, thiophene-H), 7.05 (d, J=8.2 Hz, 1H, ArH), 3.84 (s, 3H, OCH3), 3.80 (s, 3H, OCH3);13C NMR (101 MHz, DMSO-d6) δ: 189.3, 152.6, 148.8, 139.6, 132.6, 130.4, 128.0, 125.6, 124.0, 120.7, 120.3, 118.0, 112.3, 111.1, 109.1, 56.2, 55.9; ESI-HRMS calcd for C17H14O3NSBr [M+H]+ 391.9878, 393.9927; found 391.9952, 393.9931.
[4-(5-溴噻吩-2-基)-1H-吡咯-3-基](2-氟苯基)甲酮(2e):红棕色粉末, 产率32.0%. m.p. 136~138 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.90 (s, 1H, pyrrole-NH), 7.58~7.49 (m, 2H, ArH), 7.32~7.26 (m, 4H, ArH+pyrrole-H+thiophene-H), 7.15 (s, 1H, pyrrole-H), 7.12 (d, J=4.0 Hz, 1H, thiophene-H); 13C NMR (101 MHz, DMSO-d6) δ: 186.8, 160.5, 158.0, 138.9, 132.6, 132.5, 131.0, 130.4, 130.2, 130.2, 129.7, 129.5, 126.3, 124.8, 124.7, 121.4, 121.2, 117.4, 116.6, 116.4, 109.3; ESI-HRMS calcd for C15H9ONSFBr [M+H]+ 349.9572, 351.9613; found 349.9647, 351.9627.
[4-(5-溴噻吩-2-基)-1H-吡咯-3-基](2, 4-二甲基苯基)甲酮(2f):棕色粉末, 产率40.1%. m.p. 170~172 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.76 (s, 1H, pyrrole-NH), 7.27~7.25 (m, 2H, thiophene-H), 7.24 (d, J=7.6 Hz, 1H, Ar H), 7.11 (s, 1H, pyrrole-H), 7.10 (s, 1H, pyrrole-H), 7.05 (d, J=7.6 Hz, 1H, ArH), 6.95~6.94 (m, 1H, Ar H), 2.32 (s, 3H, CH3), 2.23 (s, 3H, CH3); 13C NMR (101 MHz, DMSO-d6) δ: 192.6, 139.4, 139.3, 138.5, 135.8, 131.7, 130.3, 130.3, 128.4, 126.0, 125.9, 122.0, 120.9, 117.5, 109.1, 21.3, 19.8; ESI-HRMS calcd for C17H14ONSBr [M+H]+ 359.9979, 362.0032; found 360.0055, 362.0035.
[4-(5-溴噻吩-2-基)-1H-吡咯-3-基](3-硝基苯基)甲酮(2g):红棕色粉末, 产率33.3%. m.p. 165~167 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.97 (s, 1H, pyrrole-NH), 8.40~8.38 (m, 2H, ArH), 8.12 (d, J=6.8 Hz, 1H, ArH), 7.76 (t, J=7.6 Hz, 1H, ArH), 7.39 (s, 1H, pyrrole-H), 7.31 (s, 1H, pyrrole-H), 7.15 (d, J=2.8 Hz, 1H, thiophene-H), 7.07 (d, J=2.8 Hz, 1H, thiophene-H); 13C NMR (101 MHz, DMSO-d6) δ: 188.2, 148.0, 141.5, 138.9, 135.4, 130.6, 130.5, 130.2, 126.4, 126.3, 123.8, 121.3, 119.9, 118.0, 109.4; ESI-HRMS calcd for C15H9O3N2SBr [M+H]+ 376.9551, 378.9557; found 376.9587, 378.9567.
[4-(5-溴噻吩-2-基)-1H-吡咯-3-基](4-甲基苯基)甲酮(2h):棕色粉末, 产率61.6%. m.p. 174~176 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.82 (s, 1H, pyrrole-NH), 7.67 (d, J=8.0 Hz, 2H, ArH), 7.31 (d, J=8.0 Hz, 2H, ArH), 7.29 (s, 1H, pyrrole-H), 7.25 (s, 1H, pyrrole-H), 7.16 (d, J=3.6 Hz, 1H, thiophene-H), 7.10 (d, J=3.6 Hz, 1H, thiophene-H), 2.39 (s, 3H, CH3); 13C NMR (101 MHz, DMSO-d6) δ: 190.2, 142.3, 139.4, 137.5, 130.3, 129.6(2C), 129.3(2C), 128.7, 125.7, 120.6, 120.5, 117.9, 109.1, 21.5; ESI-HRMS calcd for C16H12ONSBr [M+H]+ 345.9857, 347.9866; found 345.9897, 347.9876.
[4-(5-溴噻吩-2-基)-1H-吡咯-3-基](4-联苯基)甲酮(2i):黄色粉末, 产率47.5%. m.p. 202~204 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.89 (s, 1H, pyrrole-NH), 7.86 (d, J=7.6 Hz, 2H, ArH), 7.81 (d, J=7.6 Hz, 2H, ArH), 7.76 (d, J=7.6 Hz, 2H, ArH), 7.52 (t, J=7.6 Hz, 2H, ArH), 7.43 (t, J=7.6 Hz, 1H, ArH), 7.37~7.30 (m, 2H, pyrrole-H+thiophene-H), 7.19 (s, 1H, pyrrole-H), 7.12 (d, J=3.6 Hz, 1H, thiophene-H); 13C NMR (101 MHz, DMSO-d6) δ: 190.0, 143.7, 139.6, 139.4, 139.1, 130.4, 130.1 (2C), 129.5, 129.1 (2C), 128.6 (2C), 127.3 (2C), 127.0, 125.9, 120.7, 120.5, 118.0, 109.2; ESI-HRMS calcd for C21H14ONSBr [M+H]+408.0013, 410.0019; found 408.0050, 410.0032.
(4-(5-溴噻吩-2-基)-1H-吡咯-3-基)(3, 4, 5-三甲氧基苯基)甲酮(2j):红棕色粉末, 产率34.7%. m.p.137~139 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.83 (s, 1H, pyrrole-NH), 7.43 (s, 1H, pyrrole-H), 7.29 (s, 1H, pyrrole-H), 7.13 (d, J=3.6 Hz, 1H, thiophene-H), 7.09 (d, J=3.6 Hz, 1H, thiophene-H), 7.06 (s, 2H, ArH), 3.82 (s, 6H, 3, 5-OCH3), 3.74 (s, 3H, 4-OCH3); 13C NMR (101 MHz, DMSO-d6) δ: 189.3, 152.9, 141.1, 139.4, 135.2, 130.3, 128.7, 125.8, 120.6, 120.4, 118.0, 109.2 (2C), 107.1 (2C), 60.6, 56.4 (2C); ESI-HRMS calcd for C18H16O4NSBr [M+H]+ 422.0017, 424.0026; found 422.0057, 424.0037.
[4-(5-氯噻吩-2-基)-1H-吡咯-3-基](2-氯苯基)甲酮(3a):红棕色粉末, 产率59.9%. m.p. 185~187 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.88 (s, 1H, pyrrole-NH), 7.53~7.43 (m, 4H, ArH), 7.34 (d, J=4.0 Hz, 1H, thiophene-H), 7.30 (t, J=2.0 Hz, 1H, pyrrole-H), 7.02 (d, J=4.0 Hz, 1H, thiophene-H), 6.99 (dd, J=2.0, 3.2 Hz, 1H, pyrrole-H); 13C NMR (101 MHz, DMSO-d6) δ: 188.8, 140.7, 136.1, 131.4, 131.2, 130.1, 130.0, 129.0, 127.3, 126.9, 126.0, 125.3, 121.4, 120.9, 117.4; ESI-HRMS calcd for C15H9ONSCl2 [M+H]+ 321.9815, found 321.9855.
[4-(5-氯噻吩-2-基)-1H-吡咯-3-基](3, 4-二甲氧基苯基)甲酮(3b):浅棕色粉末, 产率32.2%. m.p. 175~177 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.70 (s, 1H, pyrrole-NH), 7.37 (d, J=8.0 Hz, 1H, ArH), 7.31 (s, 1H, ArH), 7.25 (s, 1H, pyrrole-H), 7.22 (s, 1H, pyrrole-H), 7.08 (d, J=2.4 Hz, 1H, thiophene-H), 7.00 (d, J=8.0 Hz, 1H, Ar H), 6.92 (d, J=2.4 Hz, 1H, thiophene-H), 3.79 (s, 3H, OCH3), 3.76 (s, 3H, OCH3); 13C NMR (101 MHz, DMSO-d6) δ: 189.3, 152.6, 148.8, 136.8, 132.5, 127.9, 126.8, 125.8, 124.6, 124.0, 120.6, 120.3, 117.9, 112.2, 111.1, 56.1, 55.9; ESI-HRMS calcd for C17H14O3NSCl [M+H]+ 348.0416, found 348.0455.
[4-(5-氯噻吩-2-基)-1H-吡咯-3-基](2-氟苯基)甲酮(3c):浅棕色粉末, 产率36.7%. m.p. 135~137 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.87 (s, 1H, pyrrole-NH), 7.53~7.45 (m, 2H, ArH), 7.29~7.25 (m, 4H, Ar H+thiophene-H+pyrrole-H), 7.12 (s, 1H, pyrrole-H), 6.98 (d, J=2.4 Hz, 1H, thiophene-H); 13C NMR (101MHz, DMSO-d6) δ: 186.8, 160.5, 158.0, 136.2, 132.6, 132.5, 131.0, 130.2, 129.7, 129.5, 126.9, 126.0, 125.3, 124.7, 124.7, 121.4, 121.2, 117.5, 116.6, 116.4; ESI-HRMS calcd for C15H9ONSFCl [M+H]+ 306.0111, found 306.0151.
[4-(5-氯噻吩-2-基)-1H-吡咯-3-基](4-甲基苯基)甲酮(3d):浅棕色粉末, 产率41.4%. m.p. 181~183 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.77 (s, 1H, pyrrole-NH), 7.63 (d, J=7.6 Hz, 2H, Ar H), 7.28~7.25 (m, 3H, Ar H+pyrrole-H), 7.20 (s, 1H, pyrrole-H), 7.15 (d, J=1.6 Hz, 1H, thiophene-H), 6.95 (d, J=1.6 Hz, thiophene-H), 2.35 (s, 3H, CH3); 13C NMR (101 MHz, DMSO-d6) δ: 190.2, 142.2, 137.5, 136.7, 129.5 (2C), 129.3 (2C), 128.8, 126.8, 125.8, 124.7, 120.6, 120.5, 117.9, 21.49; ESI-HRMS calcd for C16H12ONSCl [M+H]+ 302.0362, found 302.0403.
[4-(5-氯噻吩-2-基)-1H-吡咯-3-基](2, 4-二甲基苯基)甲酮(3e):灰白粉末, 产率37.6%. m.p. 189~191 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.79 (s, 1H, pyrrole-NH), 7.29~7.28 (m, 2H, thiophene-H+pyrrole-H), 7.24 (d, J=7.6 Hz, 1H, ArH), 7.11 (s, 1H, Ar H), 7.05 (d, J=7.6 Hz, 1H, ArH), 7.01 (d, J=3.6 Hz, 1H, thiophene-H), 6.96 (s, 1H, pyrrole H), 2.32 (s, 3H, CH3), 2.24 (s, 3H, CH3); 13C NMR (101 MHz, DMSO-d6) δ: 192.6, 139.4, 138.5, 136.6, 135.8, 131.7, 130.3, 128.4, 126.8, 126.0, 125.8, 124.9, 122.0, 120.9, 117.6, 21.3, 19.8; ESI-HRMS calcd for C17H14ONSCl [M+H]+ 316.0518, found 316.0559.
[4-(5-氯噻吩-2-基)-1H-吡咯-3-基](3-溴苯基)甲酮(3f):黄棕色粉末, 产率37.6%. m.p. 153~155 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.90 (s, 1H, pyrrole-NH), 7.83 (s, 1H, ArH), 7.81 (d, J=7.8 Hz, 1H, ArH), 7.73 (d, J=7.8 Hz, 1H, ArH), 7.46 (t, J=7.8 Hz, 1H, ArH), 7.31 (s, 2H, pyrrole-H), 7.19 (d, J=3.6 Hz, 1H, thiophene-H), 7.00 (d, J=3.6 Hz, 1H, thiophene-H); 13C NMR (101 MHz, DMSO-d6) δ: 188.8, 142.4, 136.3, 134.7, 131.7, 131.0, 129.8, 128.3, 126.9, 126.0, 125.0, 122.1, 121.0, 120.1, 117.9; ESI-HRMS calcd for C15H9ONSClBr [M+H]+ 365.9347, 367.9297; found 365.9349, 367.9326.
[4-(5-氯噻吩-2-基)-1H-吡咯-3-基](4-甲氧基苯基)甲酮(3g):红棕色粉末, 产率34.6%. m.p. 153~155 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.77 (s, 1H, pyrrole-NH), 7.77 (d, J=8.6 Hz, 2H, ArH), 7.27 (s, 1H, pyrrole-H), 7.24 (s, 1H, pyrrole-H), 7.14 (d, J=3.6 Hz, 1H, thiophene-H), 7.04 (d, J=8.6 Hz, 2H, ArH), 6.98 (d, J=3.6 Hz, 1H, thiophene-H), 3.84 (s, 3H, OCH3); 13C NMR (101 MHz, DMSO-d6) δ: 189.3, 162.7, 136.8, 132.6, 131.7, 128.0, 126.8, 125.8, 124.6, 120.7, 120.3, 117.9, 114.0, 55.9; ESI-HRMS calcd for C16H12O2NSCl ([M+H]+): 318.0348, found 318.0352.
[4-(5-氯噻吩-2-基)-1H-吡咯-3-基](苯基)甲酮(3h):浅红棕粉末, 产率39.8%. m.p. 181~183 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.84 (s, 1H, pyrrole-NH), 7.74 (d, J=7.6 Hz, 2H, ArH), 7.60 (t, J=7.6 Hz, 1H, ArH), 7.50 (t, J=7.6 Hz, 2H, ArH), 7.30 (s, 1H, pyrrole-H), 7.25 (s, 1H, pyrrole-H), 7.20 (d, J=3.2 Hz, 1H, thiophene-H), 7.01 (d, J=3.2 Hz, 1H, thiophene-H); 13C NMR (101 MHz, DMSO-d6) δ: 190.5, 140.3, 136.6, 132.1, 129.3, 129.3 (2C), 128.7 (2C), 126.8, 125.9, 124.8, 120.7, 120.5, 117.9; ESI-HRMS calcd for C15H10ONSCl [M+H]+ 288.0242, found 288.0244.
[4-(5-氯噻吩-2-基)-1H-吡咯-3-基](3-硝基苯基)甲酮(3i):棕色粉末, 产率36.5%. m.p. 195~197 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 12.01 (s, 1H, pyrrole-NH), 8.44~8.42 (m, 2H, ArH), 8.16 (d, J=8.0 Hz, 1H, ArH), 7.80 (t, J=8.0 Hz, 1H, ArH), 7.43 (s, 1H, pyrrole-H), 7.36 (s, 1H, pyrrole-H), 7.21 (d, J=3.6 Hz, 1H, thiophene-H), 7.01 (d, J=3.6 Hz, 1H, thiophene-H); 13C NMR (101 MHz, DMSO-d6) δ: 188.1, 148.0, 141.5, 136.2, 135.4, 130.6, 130.2, 126.9, 126.4, 126.1, 125.2, 123.8, 121.2, 119.9, 118.0; ESI-HRMS calcd for C15H9O3N2SCl [M+H]+ 333.0056, found 333.0092.
[4-(5-氯噻吩-2-基)-1H-吡咯-3-基](4-联苯基)甲酮(3j):棕色粉末, 产率36.8%. m.p. 195~197 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.89 (s, 1H, pyrrole-NH), 7.87~7.80 (m, 4H, ArH), 7.76 (d, J=7.2 Hz, 2H, ArH), 7.51 (d, J=7.2 Hz, 2H, ArH), 7.44 (t, J=7.2 Hz, 1H, ArH), 7.35~7.33 (m, 2H, pyrrole-H), 7.22 (d, J=2.8 Hz, 1H, thiophene-H), 7.01 (d, J=2.8 Hz, 1H, thiophene-H); 13C NMR (101 MHz, DMSO-d6) δ: 190.0, 143.7, 139.6, 139.1, 136.6, 130.1 (2C), 129.5, 129.2 (2C), 128.6, 127.3 (2C), 127.0 (2C), 126.8, 125.9, 124.8, 120.7, 120.5, 117.9; ESI-HRMS calcd for C21H14ONSCl [M+H]+ 364.0554, found 364.0559.
[4-(4-甲基-5-溴噻吩-2-基)-1H-吡咯-3-基](2-氯苯基)甲酮(4a):棕色粉末, 产率74.5%. m.p. 195~197 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.83 (s, 1H, pyrrole-NH), 7.51~7.38 (m, 4H, ArH), 7.23 (s, 2H, pyrrole-H), 6.95 (s, 1H, thiophene-H), 2.10 (s, 3H, CH3); 13C NMR (101 MHz, DMSO-d6) δ: 188.8, 140.9, 137.0, 136.6, 131.2, 131.1, 130.1, 130.1, 129.1, 127.8, 127.3, 121.1, 121.1, 117.6, 106.5, 15.4; ESI-HRMS calcd for C16H11ONSClBr [M+H]+ 379.9504, 381.9457; found 379.9506, 381.9483.
[4-(4-甲基-5-溴噻吩-2-基)-1H-吡咯-3-基](2, 4-二甲基苯基)甲酮(4b):灰白色粉末, 产率68.3%. m.p. 167~168 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.73 (s, 1H, pyrrole-NH), 7.23~7.22 (m, 3H, ArH+pyrrole-H), 7.10 (s, 1H, thiophene-H), 7.04 (d, J=8.0 Hz, 1H, ArH), 6.93 (d, J=1.6 Hz, 1H, pyrrole-H), 2.32 (s, 3H, CH3), 2.23 (s, 3H, CH3), 2.13 (s, 3H, CH3); 13C NMR (101 MHz, DMSO-d6) δ: 192.5, 139.4, 138.6, 137.0, 136.9, 135.8, 131.7, 130.2, 128.4, 127.5, 126.0, 122.1, 120.6, 117.7, 106.3, 21.3, 19.8, 15.4; ESI-HRMS calcd for C18H16O-NSBr [M+H]+ 374.0170, 376.0114; found 374.0210, 376.0190.
[4-(4-甲基-5-溴噻吩-2-基)-1H-吡咯-3-基](3-溴苯基)甲酮(4c):棕色粉末, 产率46.8%. m.p. 164~166 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.88 (s, 1H, pyrrole NH), 7.84~7.78 (m, 2H, ArH), 7.72 (d, J=7.6 Hz, 1H, ArH), 7.47 (t, J=7.6 Hz, 1H, ArH), 7.31 (d, J=2.0 Hz, 1H, pyrrole H), 7.27 (d, J=2.0 Hz, 1H, pyrrole H), 7.13 (s, 1H, thiophene H), 2.12 (s, 3H, CH3); 13C NMR (101 MHz, DMSO-d6) δ: 188.8, 142.5, 137.0, 136.8, 134.6, 131.6, 130.9, 129.7, 128.3, 127.6, 122.0, 120.7, 120.1, 118.1, 106.5, 15.3; ESI-HRMS calcd for C16H11ONSBr2 [M+H]+ 423.8987, 425.8939; found 423.8999, 425.8979.
[4-(4-甲基-5-溴噻吩-2-基)-1H-吡咯-3-基](2-氟苯基)甲酮(4d):棕色粉末, 产率54.5%. m.p. 166~168 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.84 (s, 1H, pyrrole-NH), 7.54~7.45 (m, 2H, ArH), 7.29~7.23 (m, 3H, ArH+ thiophene-H), 7.20 (s, 1H, pyrrole-H), 7.11 (s, 1H, pyrrole-H), 2.10 (s, 3H, CH3); 13C NMR (101 MHz, DMSO-d6) δ: 186.8, 160.5, 158.0, 137.0, 136.6, 132.5, 132.5, 130.9, 130.9, 130.2, 130.2, 129.7, 129.5, 127.8, 124.7, 124.7, 121.5, 121.0, 117.6, 116.6, 116.3, 106.5, 15.4; ESI-HRMS calcd for C16H11ONSFBr [M+H]+ 363.9808, 365.9744; found 363.9803, 365.9783.
[4-(4-甲基-5-溴噻吩-2-基)-1H-吡咯-3-基](3, 4-二甲氧基苯基)甲酮(4e):黄色粉末, 产率52.4%. m.p. 168~170 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.70 (s, 1H, pyrrole-NH), 7.38 (d, J=8.0 Hz, 1H, ArH), 7.32 (s, 1H, ArH), 7.25 (s, 1H, pyrrole-H), 7.20 (s, 1H, pyrrole-H), 7.06 (s, 1H, thiophene-H), 7.02 (d, J=8.0 Hz, 1H, ArH), 3.81 (s, 3H, OCH3), 3.77 (s, 3H, OCH3), 2.08 (s, 3H, CH3); 13C NMR (101 MHz, DMSO-d6) δ: 189.2, 152.6, 148.8, 137.3, 136.9, 132.6, 127.9, 127.1, 124.0, 120.6, 120.1, 118.1, 112.3, 111.1, 106.2, 56.1, 55.9, 15.3; ESI-HRMS calcd for C18H16O3NSBr [M+H]+ 406.0068, 408.0074; found 406.0109, 408.0090.
[4-(4-甲基-5-溴噻吩-2-基)-1H-吡咯-3-基](苯基)甲酮(4f):棕色粉末, 产率41.7%. m.p.210~212 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.81 (s, 1H, pyrrole-NH), 7.75 (d, J=7.2 Hz, 2H, ArH), 7.59 (t, J=7.2 Hz, 1H, ArH), 7.50 (t, J=7.2 Hz, 2H, ArH), 7.26 (s, 1H, pyrrole-H), 7.24 (s, 1H, pyrrole-H), 7.15 (s, 1H, thiophene-H), 2.12 (s, 3H, CH3); 13C NMR (101 MHz, DMSO-d6) δ: 190.4, 140.3, 137.0, 136.9, 132.1, 129.3 (2C), 129.2 (2C), 128.7, 127.3, 120.5, 120.4, 118.1, 106.4, 15.3; ESI-HRMS calcd for C16H12ONSBr [M+H]+ 345.9857, 347.9871; found 345.9895, 347.9875.
[4-(噻吩-2-基)-1H-吡咯-3-基](2-氯苯基)甲酮(5a):棕色粉末, 产率44.1%. m.p. 174~176 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.79 (s, 1H, pyrrole-NH), 7.53~7.39 (m, 5H, ArH+thiophene-H), 7.36 (d, J=4 Hz, 1H, thiophene-H), 7.20 (s, 1H, pyrrole-H), 7.02 (dd, J=4.0, 4.8 Hz, 1H, thiophene-H), 6.97 (s, 1H, pyrrole-H); 13C NMR (101 MHz, DMSO-d6) δ: 188.7, 141.2, 136.9, 131.3, 131.1, 130.1, 129.1, 127.5, 127.4, 126.2, 124.4, 121.3, 121.2, 121.1, 118.4; ESI-HRMS calcd for C15H10ONSCl [M+H]+ 288.0142, found 288.0245.
[4-(噻吩-2-基)-1H-吡咯-3-基](3-溴苯基)甲酮(5b):棕色粉末, 产率33.4%. m.p. 155~157 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.80 (s, 1H, pyrrole-NH), 7.82~7.81 (m, 1H, ArH), 7.77 (d, J=8.0 Hz, 1H, ArH), 7.72 (d, J=8.0 Hz, 1H, ArH), 7.44 (t, J=8.0 Hz, 1H, ArH), 7.33 (dd, J=5.2, 1.0 Hz, 1H, thiophene-H), 7.31 (dd, J=3.6, 1.0 Hz, 1H, thiophene-H), 7.29 (dd, J=2.4, 2.8 Hz, pyrrole-H), 7.21 (t, J=2.4 Hz, 1H, pyrrole-H), 6.98 (dd, J=3.6, 5.2 Hz, 1H, thiophene-H); 13C NMR (101 MHz, DMSO-d6) δ: 188.9, 142.7, 137.1, 134.6, 131.7, 130.9, 129.4, 128.3, 127.5, 125.8, 124.4, 122.0, 120.5, 120.4, 118.6; ESI-HRMS calcd for C15H10ONSBr [M+H]+ 331.9666, 333.9713; found 331.9741, 333.9720.
[4-(噻吩-2-基)-1H-吡咯-3-基](4-联苯基)甲酮(5c):棕色粉末, 产率40.0%. m.p. 110~112 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 11.72 (s, 1H, pyrrole NH), 7.81 (d, J=8.2 Hz, 2H, ArH), 7.75 (d, J=8.2 Hz, 2H, ArH), 7.70 (d, J=7.6 Hz, 2H, ArH), 7.47 (t, J=7.6 Hz, 2H, ArH), 7.38 (t, J=7.6 Hz, 1H, ArH), 7.31 (d, J=3.5 Hz, 1H, thiophene H), 7.29 (d, J=5.1 Hz, 1H, thiophene H), 7.26 (t, J=2.0 Hz, 1H, pyrrole H), 7.18 (t, J=2.0 Hz, 1H, pyrrole H), 6.95 (dd, J=3.5, 5.1 Hz, 1H, thiophene H); 13C NMR (101 MHz, DMSO-d6) δ: 190.1, 143.6, 139.7, 139.3, 130.2 (2C), 129.5 (2C), 128.8, 128.6 (2C), 127.5 (2C), 127.4, 127.4, 126.9, 125.6, 124.2, 120.9, 120.3, 118.7; ESI-HRMS calcd for C21H15ONS [M+H]+ 330.0908, found 330.0947.
-
-
[1]
Nordmann, J.; Müller, T. J. J. Org. Biomol. Chem. 2013, 11, 6556. doi: 10.1039/c3ob41269e
-
[2]
Hopp, D. C.; Rhea, J.; Jacobsen, D.; Romari, K.; Smith, C.; Rabenstein, J.; Irigoyen, M.; Clarke, M.; Francis, L.; Luche, M.; Carr, G. J.; Mocek, U. J. Nat. Prod. 2009, 72, 276. doi: 10.1021/np800632f
-
[3]
Pham, V. C.; Shin, J.-S.; Choi, M. J.; Kim, T. W.; Lee, K.; Kim, K. J.; Huh, G.; Kim, J.; Choo, D. J.; Lee, K.-T.; Lee, J. Y. Bull. Korean Chem. 2012, 33, 721. doi: 10.5012/bkcs.2012.33.2.721
-
[4]
Bellina, F.; Rossi, R. Tetrahedron 2006, 62, 7213 doi: 10.1016/j.tet.2006.05.024
-
[5]
Raymond, E.; Dahan, L.; Raoul, J.-L.; Bang, Y.-J.; Borbath, I.; Lombard-Bohas, C.; Valle, J.; Metrakos, P. N. Engl. J. Med. 2011, 364, 501. doi: 10.1056/NEJMoa1003825
-
[6]
Gupton, J. T. Top Heterocycl. Chem. 2006, 2, 53.
-
[7]
Lan, L.; Zhan, X.-P.; Qin, W.-X.; Liu, Z.-L.; Mao, Z.-M. Heterocycles 2014, 89, 375. doi: 10.3987/COM-13-12890
-
[8]
Lan, L.; Qin, W.-X.; Zhan, X.-P.; Liu, Z.-L.; Mao, Z.-M. Anti-Cancer Agents Med. Chem. 2014, 14, 994.
-
[9]
殷昌青, 詹晓平, 兰岚, 覃维曦, 刘增路, 毛振民, 现代生物医学进展, 2014, 14, 5419. http://www.cnki.com.cn/Article/CJFDTotal-SWCX201428007.htmYin, C.-Q.; Zhan, X.-P.; Lan, L.; Qin, W.-X.; Liu, Z.-L.; Mao, Z.-M. Prog. Modern Biomed. 2014, 14, 5419 (in Chinese). http://www.cnki.com.cn/Article/CJFDTotal-SWCX201428007.htm
-
[10]
Barbarella, G.; Melucci, M.; Sotgiu, G. Adv. Mater. 2005, 17, 1581. doi: 10.1002/(ISSN)1521-4095
-
[11]
陆咏, 袁少波, 精细与专用化学品, 2002, 22, 5. http://www.cqvip.com/QK/94471A/200222/7056734.htmlLu, Y.; Yuan, S.-B. Fine Spec. Chem. 2002, 22, 5 (in Chinese). http://www.cqvip.com/QK/94471A/200222/7056734.html
-
[12]
黄一虹, 李德鹏, 陈令松, 白血病·淋巴瘤, 2003, 12, 271. http://www.cnki.com.cn/Article/CJFDTotal-BXBZ200305005.htmHuang, Y.-H.; Li, D.-P.; Chen, L.-S. J. Leukemia Lymphoma 2003, 12, 271 (in Chinese). http://www.cnki.com.cn/Article/CJFDTotal-BXBZ200305005.htm
-
[13]
Sharma, R.; Kumar, K.; Chouhan, M.; Grover, V.; Nair, V. A. RSC Adv. 2013, 3, 14521. doi: 10.1039/c3ra42569j
-
[14]
van Leusen, A. M.; Siderius, H.; Hoogenboom, B. E.; van Leusen, D. Tetrahedron Lett. 1972, 52, 5337.
-
[15]
Heo, D. S.; Park, J.-G.; Hata, K.; Day, R.; Herberman, R. B.; Whiteside, T. L. Cancer Res. 1990, 50, 3681.
-
[16]
Dannhardt, G.; Kiefer, W.; Krämer, G.; Maehrlein, S.; Nowe, U.; Fiebich, B. Eur. J. Med. Chem. 2000, 35, 499. doi: 10.1016/S0223-5234(00)00150-1
-
[1]
-
表 1 MTT实验结果[IC 50/(μmol•L -1)] a
Table 1. Result of MTT assay [IC 50/(μmol•L -1)]
化合物 HCT-116 Hela SGC-7901 HUVEC 2a >300 >300 >300 >300 2b 73.3 145.4 180.9 212.5 2c 38.5 90.1 69.2 98.0 2d >300 >300 >300 >300 2e >300 >300 >300 >300 2f 52.1 160.3 280.1 >300 2g 63.5 60.9 51.1 85.2 2h 65.3 121.3 144.9 255.6 2i 46.1 33.1 34.1 118.6 2j 106.0 4.3 143.0 >300 3a >300 >300 >300 >300 3b 184.8 >300 >300 >300 3c 201.7 269.1 >300 >300 3d 55.2 182.7 160.5 >300 3e 135.2 233.6 >300 >300 3f 50.5 164.4 160.8 145.6 3g 55.2 71.0 201.4 173.4 3h 59.6 120.5 202.4 250.8 3i 44.4 188.0 71.7 168.8 3j 27.5 32.3 10.5 157.3 4a 30.5 >300 164.5 216.5 4b 25.6 >300 >300 156.7 4c 10.3 >300 102.8 210.0 4d 11.1 >300 153.5 >300 4e 28.4 >300 >300 119.3 4f 38.2 >300 203.1 172.4 5a >300 >300 >300 >300 5b 113.7 164.7 188.6 169.1 5c 47.7 73.1 61.6 168.6 紫杉醇 8.7 6.8 4.9 175.1 a Do not calculate IC50 value which is bigger than 300 μmol•L-1, indicates>300. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 1865
- HTML全文浏览量: 405


 下载:
下载:

 下载:
下载:

