 图1
BAI分子平面和扭曲构象随温度的变化及N-甲基哌嗪基取代的BAI化合物温度响应光谱图[31]
Figure1.
Equilibrium between the planar and twisted forms of BAI and temperature dependence of the UV/vis absorption and fluorescence spectra of BAI compound with N-methylpiperazinyl substituent[31]
图1
BAI分子平面和扭曲构象随温度的变化及N-甲基哌嗪基取代的BAI化合物温度响应光谱图[31]
Figure1.
Equilibrium between the planar and twisted forms of BAI and temperature dependence of the UV/vis absorption and fluorescence spectra of BAI compound with N-methylpiperazinyl substituent[31]

Citation: Qin Tianyi, Zeng Yi, Chen Jinping, Yu Tianjun, Li Yi. Progress in Organic Fluorescent Thermometers[J]. Acta Chimica Sinica, 2017, 75(12): 1164-1172. doi: 10.6023/A17070341

有机荧光温度传感体系研究进展
English
Progress in Organic Fluorescent Thermometers
-
Key words:
- temperature sensor
- / organic dye
- / fluorescence
- / ratiometric fluorescence
- / intramolecular charge transfer
- / excimer
-
1 引言
温度是基本物理量之一, 自然界中几乎所有的物理、化学和生物过程都与温度紧密相关, 温度是工业生产、科学实验以及日常生活中普遍需要测量的一个物理量, 发展精确的温度测量方法具有重要意义[1~3].温度是一个统计物理量, 是物体分子热运动程度的集体表现, 温度的测量只能通过物体性质随温度的变化间接测量.绝大多数被测物体性质随温度变化不明显或者不便测量, 于是人们设计出温度计——基于热平衡定律的温度测量工具, 例如基于热胀冷缩性质的膨胀式温度计、基于电导率变化的热电阻温度计以及基于黑体辐射的红外温度计等, 利用这些温度计已实现多种物体或体系的温度测量.这些温度计在测量形式上可分为接触性测量和非接触性测量, 膨胀式和热电类温度计是接触式测量形式, 测量时需使用宏观尺寸的测温探头, 探头与被测物间的热交换平衡时间和扰动等问题使它们无法有效测量流体、微环境或宏观大面积等的温度变化; 非接触式温度测量技术因对被测物体不存在接触性干扰而呈现更广阔的应用空间, 受到了越来越多的关注, 如红外温度计等, 但其在微流体或微区测温时无法提供足够的空间分辨率或灵敏度[4~8].为了克服传统接触和非接触式测温方法的不足、实现在大范围、流动相、生物体等体系中的精确温度测量, 研究者们发展了荧光温度传感体系[9, 10].
化合物吸收光从基态(S0)到达最低激发单重态(S1), 假如化合物只发生光物理过程, 其S1态分子可经辐射跃迁(荧光)和非辐射跃迁(内转换和系间窜越)失活.非辐射跃迁速率常数明显受温度影响, 随温度变化非辐射跃迁过程加快或减慢, 导致荧光减弱或增强[11].基于这一原理, 研究者们发展了温敏荧光探针, 将荧光探针加入被测体系中, 根据探针荧光强度/寿命随温度的变化实现对温度的测量, 这种体系是基于单一激发态对温度的响应.在实际应用中, 单一激发态响应荧光温度传感体系的荧光强度可能受浓度变化、激发光强度波动等因素影响, 很难保证荧光强度变化完全来自温度的改变, 因此, 研究者又发展了比率荧光温度传感体系.比率荧光温度传感体系基于双发光物种构建, 两个发光物种的发光对温度响应不同, 通常一个物种的发光随温度明显变化, 另一发光物种的发光对温度无响应或弱响应[12~14], 或两个发光物种发光随温度变化趋势相反(此种情况更有利于提高测温灵敏度)[15, 16].两个发光物种可以分别是荧光探针和参比化合物, 也可以是荧光探针两个不同的激发态或单体-激基缔合物等情况, 如果两个发光物种最大发射峰位置相差较大, 可以得到发光颜色随温度变化的可视化传感结果[17~19].荧光温度传感探针的性能参数主要有:温度响应范围, 表示荧光探针能够准确传感的温度范围, 以K或℃为单位; 灵敏度, 为探针荧光强度或荧光比率随温度变化曲线的斜率, 单位为%•℃-1或℃-1; 分辨率, 表示探针能够分辨的最小温度变化, 以K或℃为单位; 精度, 表示探针对温度检测的准确和精确程度, 以%、K或℃为单位.
已报道的荧光温度传感体系主要有基于有机荧光分子、量子点、上转换纳米颗粒、荧光蛋白等的传感体系[20~25], 其中有机荧光分子是最早用于荧光温度传感的材料.相比其它几类探针, 有机荧光分子无需使用成本较高的重金属或贵金属, 无需使用毒性较高的Cd、Te或Se等元素, 比荧光蛋白类探针制备简单且易于修饰, 具有更宽的温度检测范围, 是一种良好的温敏荧光探针材料. 2013年Meier等[26]对已报道的主要有机温敏荧光探针及相应的荧光温度传感体系进行了详细的综述.近年来, 有机荧光温度传感体系有了重要发展, 在温敏荧光探针的设计、新型传感体系的构筑及应用等方面取得了突出进展, 本文将从单波长荧光强度响应和比率荧光温度传感进行分类, 结合早期的研究结果, 对近几年有机荧光温度传感体系的主要研究进展进行介绍, 并对未来新型荧光温度传感体系的发展进行展望.
2 单波长强度响应荧光温度传感体系
单波长荧光强度响应是最常见的荧光温度传感策略, 根据温度对激发态非辐射跃迁的影响可分为升温非辐射跃迁加快和升温非辐射跃迁抑制两类, 对应现象为升温荧光猝灭和升温荧光增强.下面将分别介绍近几年这两类单波长强度响应的荧光温度传感体系.
2.1 升温荧光猝灭型温度传感体系
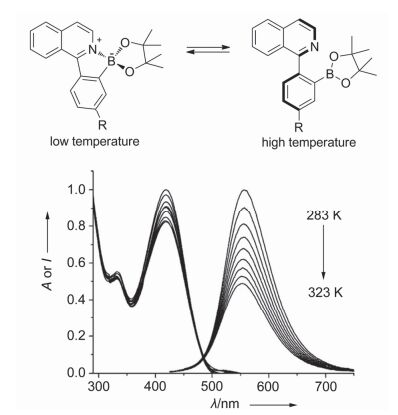
早期研究中多使用高量子产率有机荧光染料作为温敏探针[如罗丹明类、荧光素类、7-硝基苯并-2-氧杂-1, 3-二唑(NBD)类等][27~30], 这类探针随温度升高非辐射跃迁增强, 利用探针的强发光性质可在一定温度范围内得到升温荧光猝灭的传感结果.新型荧光染料分子的设计是荧光温度传感体系的一个重要研究内容, 具有多种非辐射跃迁途径可使染料分子的荧光对温度响应幅度增大, 提高检测灵敏度. 2014年Pais等[31]设计合成了一类新型荧光染料用于温度传感, 这类硼烷基芳基异喹啉染料(BAI)具有分子内电荷转移过程(ICT), 取代基R为供电子的甲氧基或N-甲基哌嗪基, 能降低发色团ICT态能量, 使发光大幅红移(图 1).分子内硼酸酯与喹啉在平面构象时存在B-N作用形成路易斯酸碱对, 分子发射ICT态荧光; 当分子处于扭曲构象时该作用消失, 荧光随之减弱.温度会引起分子构象的转变, 低温时分子为平面构象, 高温时分子为扭曲构象, 据此作者得到了在283~323 K范围BAI荧光升温猝灭、降温恢复的结果, 该过程可重复10次以上.相比之前的升温荧光猝灭型探针, 该染料受热荧光猝灭变化幅度大, 而且其分子内硼酸酯基团可与生物体内糖类分子结合, 有可能应用在生物体系中.
 图1
BAI分子平面和扭曲构象随温度的变化及N-甲基哌嗪基取代的BAI化合物温度响应光谱图[31]
Figure1.
Equilibrium between the planar and twisted forms of BAI and temperature dependence of the UV/vis absorption and fluorescence spectra of BAI compound with N-methylpiperazinyl substituent[31]
图1
BAI分子平面和扭曲构象随温度的变化及N-甲基哌嗪基取代的BAI化合物温度响应光谱图[31]
Figure1.
Equilibrium between the planar and twisted forms of BAI and temperature dependence of the UV/vis absorption and fluorescence spectra of BAI compound with N-methylpiperazinyl substituent[31]
新型温度传感体系除通过设计新型染料构筑外, 还可以通过将已知荧光分子与具有温度响应的材料结合来构筑, 增加荧光猝灭的幅度. 2014年我们课题组[32]首次报道了利用树枝形聚合物分子构象随温度变化调控外围发色团荧光变化, 实现了对温度的检测(图 2).该温度传感体系是一系列外围用四苯基乙烯(TPE)基团修饰的聚酰胺-胺(PAMAM)树枝形聚合物(PAMAM-TPE, 0~4代), 温度改变引起的树枝形聚合物构象的变化会引起外围TPE荧光变化. TPE是典型的具有聚集诱导发光性质(Aggregation-Induced Emission, AIE)的发色团, 在良溶剂中发光很弱, 而在不良溶剂中聚集或固态时因分子内苯环旋转受限荧光大大增强; 树枝形聚合物在不良溶剂中呈收缩或折叠构象, 随温度升高逐渐趋于伸展构象.甲苯为TPE的良溶剂却是树枝形骨架PAMAM的不良溶剂, PAMAM-TPE在甲苯中呈收缩构象, 分子外围有限的空间抑制了TPE基团中苯环旋转导致的非辐射跃迁, 体系荧光增强.随温度升高, PAMAM-TPE分子从收缩构象逐渐向伸展构象转变, 分子外围空间增大, 降低了对外围TPE基团的限制作用, 非辐射跃迁增强, 体系荧光减弱.高代数树枝形聚合物分子外围官能团密度随温度变化更为明显, 随温度升高或降低, 体系发光降低或增强幅度更大.此外, 升降温过程体系荧光变化可逆, 说明温度诱导构象变化过程可逆.该体系可用于荧光温度传感, 多次升降温实验表明, 该体系具有很好的稳定性.
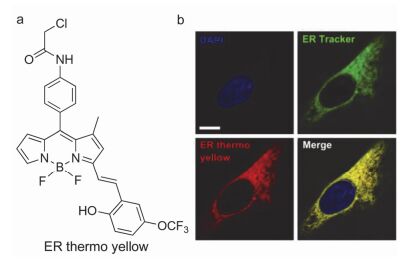
升温荧光猝灭型温度传感体系的应用研究有多种, 例如罗丹明、荧光素等用于微流体、平面薄膜温度测量, 以及生物体内的温度测量等. 2014年Arai等[33]首次利用升温荧光猝灭型探针实现了对亚细胞结构内质网(ER)的靶向富集与温度测量.作者选择具有内质网靶向性的温敏染料(ER thermo yellow), 在多种细胞内实现了内质网荧光成像及温度测量(包括Hela细胞、NIH/3T3细胞、肌管细胞C2C12、长肝细胞、棕色脂肪细胞BAT等), 该荧光温度传感体系的测温灵敏度(0.039 ℃-1)是当时生物体系荧光温度测量的最高值(图 3). 2015年他们[34]筛选出具有线粒体靶向富集作用的温敏荧光分子Mito thermo yellow, 实现了细胞内线粒体的温度传感, 测温灵敏度为0.025 ℃-1.相比纳米级荧光温度传感体系, 有机分子荧光温度传感体系在细胞内可最大程度接近相应细胞器, 有利于温度的原位实时测量; 但这类体系的不足之处是细胞温度改变的同时可能引起微环境粘度、pH值和离子强度等变化, 这些变化也会造成探针荧光波动, 影响测温精度.
升温荧光猝灭型探针随温度升高荧光逐渐减弱, 影响测温灵敏度, 要想得到更高的测温灵敏度, 通常需要使用升温荧光猝灭幅度较大的探针, 但会导致探针荧光强度随温度升高迅速降低, 在较高温度时探针荧光强度太弱, 不利于实现大范围温度的精确测量.为了解决这一问题, 研究者们发展了升温荧光增强型温度传感体系.
2.2 升温荧光增强型温度传感体系
为了解决升温荧光猝灭型温度传感体系在高温下精确度低等问题, 人们利用升温引起构象变化抑制非辐射跃迁过程, 得到了升温荧光增强型温度传感体系, 它们高温下有足够强的荧光.这类传感体系可以通过以特定取代基修饰有机温敏荧光探针获得, 也可以借助具有温度响应的材料聚N-异丙基丙烯酰胺(PNIPAM)或DNA链段构筑, 后一种方案是在聚合物或DNA上修饰有机荧光探针分子, 利用材料本身的温度响应性调控荧光分子激发态的失活过程, 实现温度传感.
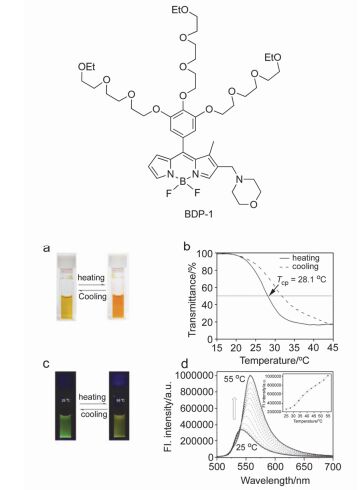
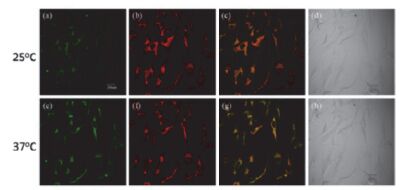
2014年Wang等[35]在BODIPY (boron-dipyrro-methene)衍生物外围修饰树枝状寡聚乙二醇链, 得到了具有升温荧光增强效果的探针分子, 并用其构筑了荧光温度传感体系.随温度升高, 寡聚乙二醇链的水合水被脱去, 导致化合物微环境粘度和疏水性增加, 分子发生明显聚集, 粘度增加使分子构象扭转受到抑制, 疏水性增加使BODIPY所处微环境由亲水转为疏水, 抑制了从寡聚乙二醇链到BODIPY基团的光致电子转移(PET)过程, 达到了升温荧光增强的效果. 2015年他们[36]采用类似的方法在该BODIPY衍生物上修饰上具有溶酶体识别能力的吗啉基团, 研究了该探针分子对Hela细胞内的溶酶体靶向性, 该探针分子的荧光在溶液中和细胞中均具有良好的温度响应(图 4).
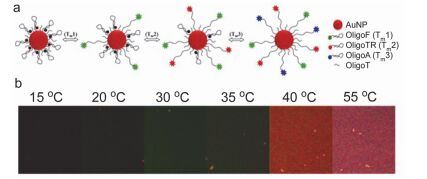
有机荧光探针分子与温度响应材料结合也是构筑升温荧光增强型温度传感体系的常用方法. L-DNA分子信标是与自然界中D-DNA互为旋光异构体、两端碱基互补的单链寡聚核苷酸, 升温使核苷酸链段从闭合变为展开状态, 研究者将半数核苷酸链段呈展开状态的温度定义为“熔点”(Tm). 2012年, Ke等[37]首先提出使用L-DNA分子信标构筑荧光温度传感体系, 他们在L-DNA分子信标两侧分别修饰荧光基团和猝灭剂, 温度升高核苷酸链段逐渐展开时, 体系荧光发生从“off”到“on”的变化, 实现荧光温度传感. 2014年, Ebrahimi等[38]在三种不同Tm的L-DNA分子信标一端分别修饰三种不同的荧光基团, 另一端修饰在金纳米颗粒上, 得到了一类升温荧光增强且荧光颜色明显变化的荧光温度传感体系(图 5).当核苷酸链段处于闭合状态时, 发色团荧光被金纳米颗粒完全猝灭, 随温度升高三种不同Tm的L-DNA分子信标依次展开, 使温度响应范围达到15~60 ℃, 分辨率达0.5 ℃.该体系实现了升温荧光增强的传感效果, 同时还可通过荧光颜色随温度的明显改变进行裸眼观察.尽管该体系使用了三个荧光基团, 但三者激发态对温度独立响应, 因此仍归属为单一激发态响应荧光温度传感体系.
温度响应材料使用最多的是具有温敏性质的高分子PNIPAM, 它在水中的低临界溶解温度(LCST)为32 ℃, 当温度高于32 ℃, 分子由线型转变为卷曲的球状, 化学交联的PNIPAM结构在升温至32 ℃左右时体积发生收缩, 升温过程高分子内部区域疏水性增加、空间更加拥挤, PNIPAM被广泛用于构筑荧光温度传感体系[39, 40]. 2003年Uchiyama等[41]首次以PNIPAM修饰苯并呋喃, 得到具有升温荧光增强的温度传感体系, 此后越来越多的基于PNIPAM和染料构筑的荧光温度传感体系被设计出来. 2008年Shiraishi等[42]报道了一种基于NIPAM和半菁染料(hemicyanine)共聚物的“turn-on”型荧光温度传感体系, 40 ℃荧光强度为25 ℃的35倍, 为当时报道的最大值.近年来基于PNIPAM和染料的荧光温度传感体系已从简单的升温荧光增强型逐渐转向比率荧光温度传感体系, 有关PNIPAM和染料构筑的比率荧光温度传感体系研究进展将在第二部分比率荧光温度传感体系中介绍.
近年来对单波长强度响应荧光温度传感体系的研究已使测温灵敏度有所提高, 并发展了可视化荧光温度传感体系, 有些已被应用于细胞、亚细胞结构的温度测量研究.但单波长强度响应的荧光温度传感体系仍存在一些弱点, 例如荧光强度容易受样品分布不均匀、激发光强度波动等影响, 导致测温精确度降低, 为解决这一问题研究者们发展了具有自校准功能的比率荧光温度传感体系.
3 比率荧光温度传感体系
比率荧光温度传感体系基于不同波长处荧光强度对温度响应不同构筑, 两个波长处的发光可以来自不同发光物种也可以来自同一化合物不同的激发态.相比单波长荧光强度响应温度传感体系, 比率荧光温度传感体系受实验条件影响小, 通常具有更高的灵敏度. Coppeta等[43]在1998年首次利用不同染料构筑了比率荧光温度传感体系, 此后, 各种比率荧光温度传感体系被发展出来, 例如含两种染料的高分子体系、基于分子内扭曲构象激发态的体系、基于单体-激基缔合物荧光的体系等.下面将分类介绍近几年比率荧光温度传感体系的研究进展.
3.1 染料共聚/掺杂高分子比率荧光温度传感体系
染料共聚/掺杂高分子是常用的构筑荧光温度传感体系的方法, 将具有不同荧光温度响应的一种或两种荧光染料共聚/掺杂在高分子材料中, 实现比率荧光温度传感[44]. 2012年Brites[45]对已报道的染料共聚/掺杂高分子比率荧光温度传感体系进行了详细的总结, 作者认为基于PNIPAM、聚(N-正丙基丙烯酰胺)(PNNPAM)等温度响应高分子的比率荧光温度传感体系有可能是未来染料共聚/掺杂高分子比率荧光温度传感体系的一大研究热点.
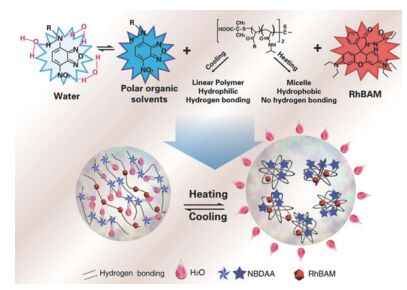
2014年Qiao等[46]以NIPAM和两种荧光染料制备共聚物构筑了比率荧光温度传感体系(RFPs), 该工作中将NIPAM与含发色团NBD的单体NBDAA (N-丙烯酰基罗丹明B酰肼)和含罗丹明发色团RhB的单体(RhBAM)分别共聚, 得到两种高分子共聚物, 将两种共聚物按一定比例混合(100:1)得到如图 6所示的荧光温度传感体系.当体系温度低于LCST时, 高分子链段呈线型, 链段中NBD发色团通过氢键与溶剂水分子结合, 荧光被猝灭, 当温度升高至LCST以上, 高分子链段收缩, 其内部环境疏水性增加, NBD与水解离, 荧光大幅度增强; 而RhB荧光增强作用仅来自升温引起的疏水性增加, 增幅较小, 作者据此得到比率荧光温度传感效果.该探针体系在细胞内34~39 ℃范围的荧光比率随温度变化具有良好的线性关系, 测温分辨率为0.3~0.5 ℃, 且具有良好的生物相容性.
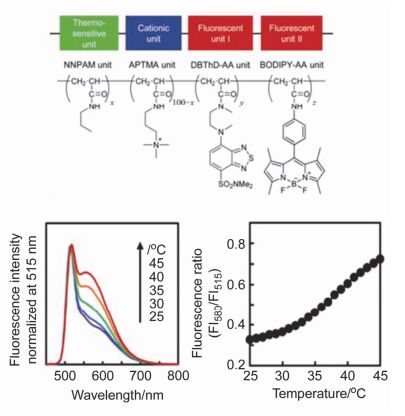
利用两种荧光温度响应不同的染料虽然得到了比率荧光温度响应的结果, 但随温度升高两种染料荧光均增强, 不利于提高测温灵敏度和可视化观察, 为了得到更好的测温灵敏度, 一种染料(参比)的荧光最好对温度响应很弱或无响应. 2015年Uchiyama等[47]选择荧光对温度无响应的BODIPY作为参比, 设计构筑了一种四嵌段PNNPAM高分子荧光温度传感体系. 图 7所示高分子结构中绿色部分为具有热致相变性质的重复单元(NNPAM), 升温引起相变, 其微环境亲疏水性变化; 蓝色部分表示侧链为阳离子的重复单元(APTMA), 该设计是为了提高分子的细胞透过能力, 并在一定程度上防止分子间团聚; 两个红色部分分别为侧链带有荧光基团DBThD和BODIPY的重复单元, DBThD是7-二甲氨基磺酰胺基-2, 1, 3-苯并氧杂噁二唑类发色团, 其荧光随微环境亲疏水变化发生改变, 而荧光对温度不敏感的BODIPY作为参比.该高分子在体外表现出良好的比率荧光温度响应, 升温过程短波长处BODIPY荧光几乎不变, 而长波长处DBThD荧光明显增强, 比率荧光随温度变化, 在25~45 ℃范围内测温灵敏度可达0.041 ℃-1.该体系比率荧光随温度变化基本不受浓度、离子强度、pH值的影响, 可用于MOLT-4细胞和HEK293T细胞内温度测量, 细胞内测温分辨率可达0.25 ℃.该工作使用荧光对温度几乎没有响应的基团作为参比, 提高了测温分辨率.
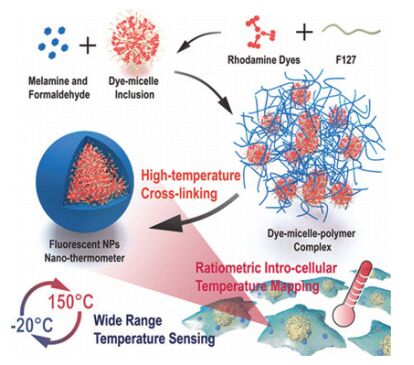
两种染料掺杂温度响应型高分子构筑的比率荧光温度传感体系的缺点是通常只在高分子相变温度附近呈明显荧光温度响应, 很难得到宽温度响应范围.将两种荧光染料掺杂到自身无温度响应的普通高分子中, 可以得到宽温度响应范围的比率荧光传感体系, 但简单掺杂构筑的荧光温度传感体系有可能存在染料不均、易受pH值和离子强度等因素干扰等问题. 2016年Wu等[48]提出了一种新的设计思路, 他们使用聚氧乙烯聚氧丙烯醚嵌段共聚物F-127掺杂罗丹明B(温敏)和罗丹明110(参比), 得到包裹了染料的胶束, 再以三聚氰胺-甲醛树脂作为高分子外壳构筑了荧光温度传感体系, 将染料包裹在胶束中保证了染料的均匀分布, 三聚氰胺-甲醛树脂外壳提高了探针体系整体的稳定性(图 8).该体系具有比率荧光温度响应, 在-20~110 ℃极宽的温度范围内其580 nm处荧光随温度升高逐渐降低, 而520 nm处荧光基本不变, 得到高的测温灵敏度(7.6%•℃-1)和明显的荧光颜色变化, 该体系可用于Hela细胞内温度成像, 且不受pH值、离子强度、溶液粘度的干扰.
3.2 基于局域和扭曲的分子内电荷转移激发态发光的比率荧光温度传感体系
有些有机荧光分子具有双发射性质, 例如扭曲的分子内电荷转移化合物, 这类分子有两个激发态, 局域激发态(local excited state, LE)和扭曲的分子内电荷转移(twisted intramolecular charge transfer, TICT)激发态. LE态发光位于较短波长处, 而TICT态发光位于较长波长处, LE态和TICT态之间存在热力学平衡, 温度改变时该热力学平衡发生移动, 随温度升高TICT态逐渐转变为LE态, 在荧光光谱上表现为短波长处发光增强和长波长处发光减弱, 因此可以实现比率荧光温度传感[49], 如果两处波长相距较远还可以观察到荧光颜色的改变[50]. 2014年Cao等[20]报道的6-(N, N-二甲基-4-苯乙炔基)-2-甲基喹啉和2016年Xia等[51]报道的双萘二酰亚胺化合物BNAP就是这类有机温敏探针.
三芳基硼化合物中心缺电子的硼与外围芳香取代基之间存在分子内电荷转移, 通过σ键与硼原子相连的芳香基团可绕σ键转动, 使分子构象发生改变, 具有LE激发态和TICT激发态双发射性质. 2011年中国科学院化学研究所杨国强课题组[52]首次利用三芳基硼化合物构筑了荧光温度传感体系, 研究结果表明, 在有机相中三芳基硼荧光探针二(1-芘基)(2, 4, 6-三异丙基苯基)硼烷(DPTB)具有比率荧光温度响应, 而且其荧光颜色随温度有显著变化, 近年来杨的课题组对三芳基硼类化合物的荧光温度传感行为开展了系统研究, 下面综述主要研究结果.
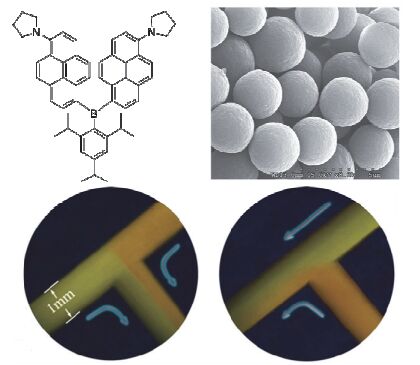
三芳基硼类化合物水溶性差, 借助高分子材料可构筑能应用于水相的三芳基硼温度传感体系. 2013年他们[53]利用三芳基硼探针和脲醛树脂(THN-PS)构筑了具有荧光温度响应的微胶囊, 并将其用于水相流体内和固体表面温度检测.该工作所用三芳基硼荧光探针为TBBD, 相比之前报道的DPTB分子其芘基团外围修饰了四氢吡咯取代基, 分子结构如图 9所示.受四氢吡咯给电子作用的影响, TBBD的吸收和荧光发射峰均向长波方向移动, 在乙酸乙酯中的最大发光峰位置在565 nm, 荧光颜色为黄色.他们制备得到了粒径约为4 μm的包裹了TBBD的THN-PS高分子微胶囊, 其温度响应范围可达-30~140 ℃, 随温度升高荧光颜色从橙色变为绿色, 测温灵敏度在0.011~0.059 ℃-1范围. 图 9为该微胶囊的扫描电子显微镜(SEM)照片以及不同温度流体以不同方向在微流体通道内流动的荧光成像.以高分子包裹疏水的三芳基硼探针可用于水相温度测量.
为了扩展三芳基硼化合物在生物体内的应用, 2015年杨课题组[54]设计合成了一种基于PNIPAM和DPTB的荧光温度传感体系, 将DPTB共价修饰在PNIPAM链段中, 得到了纳米凝胶PNDP.当温度接近相变温度(32 ℃)时, PNDP中PNIPAM构象由卷曲转变为球状, DPTB基团周围的微环境极性骤降, DPTB的LE态发光增加, 最大发光峰从500 nm蓝移至470 nm, 信号大大增强(图 10).在PNDP中负载尼罗红(NR), DPTB和NR间的FRET过程实现了比率荧光读出, 该体系的双荧光发射(绿和红)实现了自校准读出和信号增强, 从32到56 ℃比率荧光增强了13倍, 使温度测量具有高分辨率(0.2 ℃)和相对宽的温度应用范围, 在34到56 ℃的范围内PNDP-NR的比率荧光与温度呈良好的线性关系, 比率荧光随温度的变化可逆并且稳定, 作者利用PNDP-NR成功地实现了NIH/3T3细胞内的温度成像.
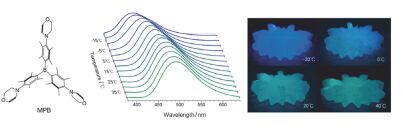
三芳基硼化合物构象变化受微环境影响, DPTB和TBBD等化合物只能在液态溶剂中作为温度指示剂, 固态高分子的高粘度限制了分子内LE态到TICT态的构象转化, 因此它们不能用于固态高分子中的温度指示.于是, 杨等[55]在2014年又设计合成了在液态溶剂和固态高分子中均呈现双荧光发射的吗啉氮取代三杜基硼化合物MPB, MPB的荧光既依赖于温度, 也依赖于介质的自由体积(图 11).与该系列其他三芳基硼化合物类似, MPB在二乙二醇二甲醚(MOE)液态溶剂中呈明显的温度响应, 随温度升高荧光光谱蓝移.基于MPB对介质自由体积依赖的特殊性质, MPB的温度传感应用可扩展到固态高分子体系.以固态高分子PEG4000为例, 从-20~40 ℃其自由体积从2.6%增大到5.3%, 溶解在其中的MPB荧光从蓝色变为绿色. MPB发光光谱和发光颜色与温度的相关性, 可通过MPB荧光光谱和荧光颜色监测体系温度.荧光光谱的自参比性质使温度测量具有很高的精度, 荧光颜色随温度变化的性质使该体系可用于裸眼或经照相机对温度直接观察.
3.3 基于单体-激基缔合物的比率荧光温度传感体系
激基缔合物由激发态分子与同种基态分子形成, 在稳态荧光光谱中表现为比单体发光更长波长处的无结构宽峰, 利用单体与激基缔合物荧光对温度的不同响应也可以设计比率荧光温度传感体系.分子间激基缔合物形成需要较高的浓度(通常>10-4 mol/L), 而高浓度的探针有可能改变被检测环境甚至造成不可逆的破坏, 因此研究者们更倾向于将多个单体修饰在同一分子中, 得到基于单体-分子内激基缔合物的比率荧光温度传感体系.
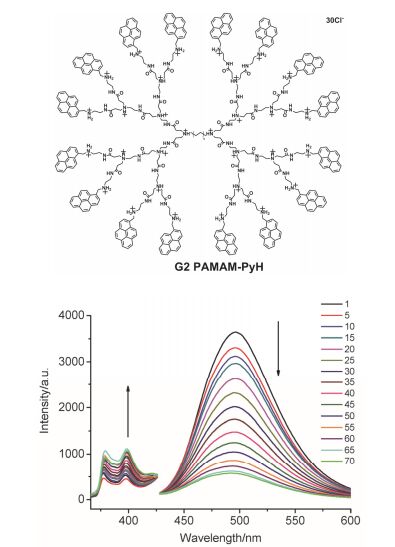
芘是一种极易形成激基缔合物的多环芳烃化合物, 早期的研究报道表明芘激基缔合物和单体的非辐射跃迁速率不同. Laibinis等[56]在1997年报道了一系列二芘基取代化合物在有机相中比率荧光的温度响应, 比率荧光Iexcimer/Imonomer在20~100 ℃温度范围内呈规律变化.此后也有研究者报道了芘在离子液体和高分子中的荧光温度响应[57], 但利用芘单体和激基缔合物的比率荧光实现水相的温度传感却鲜有报道. 2009年我们课题组[58]在抑制树枝形聚合物光捕获体系能量耗散的研究中, 设计合成了一系列外围修饰萘基团的聚酰胺-胺树枝形聚合物, 它们在水相中呈萘单体和激基缔合物的双荧光发射.在此基础上, 结合芘激基缔合物的在可见光区的发光特性, 近来我们[59]又设计合成了外围芘修饰的PAMAM树枝形聚合物, 通过将骨架质子化(G2 PAMAM-PyH)来增加分子的水溶性, 利用芘单体和激基缔合物的比率荧光实现了在水相的温度传感(图 12). G2 PAMAM-PyH在水中形成具有双分子膜的囊泡结构, 在1~70 ℃范围内, 随温度升高芘单体荧光逐渐增强, 而芘激基缔合物发光逐渐减弱, 芘激基缔合物与单体的比率荧光I495nm/I398nm随温度呈规律变化, 在1~70 ℃温度测量灵敏度在0.14~0.68 ℃-1之间, 精度为0.9 ℃; 1~70 ℃升温过程中体系荧光由绿变蓝.该荧光温度传感体系可用于水相温度梯度检测.
3.4 基于晶型变化的固态比率荧光温度传感体系
已报道的有机荧光温度传感体系多数为溶液相, 虽然也有利用高分子和有机温敏荧光探针构筑的固相荧光温度传感体系, 但相关研究报道较少.设计发展本身具有固态荧光温度响应的有机探针分子在信息记录、成像等领域有重要意义.
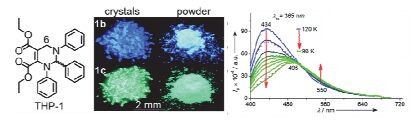
Mutai等[60]在2005年报道了具有固态发光的2, 2':6', 2''-terpyridine (tpy)分子, 其晶型随温度变化发生改变, 荧光发生off-on的变化. 2012年, Zhang等[61]报道9, 10-二苯乙烯基蒽(DSA)衍生物具有热致变色性质. 2016年Zhu等[62]利用单一分子得到了固态比率荧光和比色双重温度响应的结果, 他们设计了一种外消旋C6未取代的四氢嘧啶类化合物(THP-1, 图 13). THP-1具有聚集诱导发光性质, 不同晶型发射不同颜色的荧光, 作者对两种不同晶型的THP-1固态荧光温度响应进行了研究, 结果表明, 固态THP-1荧光随温度发生明显改变, 短波长处荧光对温度更为敏感, 比率荧光强度和发光峰位置均随温度变化, 具有非常宽的温度响应范围(77~323 K).初步认为该分子的固态荧光温度响应来自化合物吸收随温度的改变, 有关其双波长响应原理仍在进一步研究中.
4 结论与展望
荧光温度传感是一种半侵入式测温方法, 具有高灵敏度、快速响应、高空间分辨率、可视化等优点, 可用于传统测温方法难以适用的大范围、流动相和生物体内的测温.有机荧光温度传感体系已取得一些重要研究进展, 近年来新型有机温敏探针的设计和荧光温度传感体系的构筑为未来荧光温度传感体系的设计和应用奠定了基础.相比单波长荧光强度响应温度传感体系, 具有自校准功能的比率荧光温度传感体系已成为高效荧光温度传感器的必备条件之一; 利用高分子或树枝形聚合物可以解决单一有机温敏探针在应用研究中的一些问题, 如水溶性差、抗干扰能力低、生物相容性差等; 但有机荧光温度传感体系的发展仍面临挑战: (1)发展新型有机温敏荧光探针分子:理想的有机温敏荧光分子自身应具有双波长荧光发射, 其比率荧光具有显著的温度响应, 两个荧光发射最大峰位置应有明显差距.为适应生物体系荧光温度传感的需求, 探针分子还应具有良好的生物相溶性, 并且具有特定位点识别功能, 以适用于生物体内特定部位的原位温度的测量. (2)新型荧光温度传感体系的构筑:利用荧光探针分子和温敏/非温敏高分子材料或树枝形聚合物构筑荧光温度传感体系, 提高体系的亲水性、生物相容性和抗干扰能力等.拓宽温敏高分子材料的温度响应范围, 提高温度测量灵敏度, 发展宽温度范围和高灵敏度、高精度的荧光温度传感体系.荧光温度传感体系无论在科学研究还是工业生产中都有广泛的应用.
-
-
[1]
Kennedy, J. J. Rev Geophys. 2014, 52, 1. doi: 10.1002/rog.v52.1
-
[2]
Ross-Pinnock, D.; Maropoulos, P. G. Proc. Inst. Mech. Eng. B 2016, 230, 793.
-
[3]
Rolls, K.; Armstrong, K.; Keating, L.; Wrightson, D.; Walker, S.; Masters, J. Aust. Crit. Care 2014, 27, 49.
-
[4]
Sarua, A.; Ji, H. F.; Kuball, M.; Uren, M. J.; Martin, T.; Hilton, K. P.; Balmer, R. S. IEEE T Electron. Dev. 2006, 53, 2438. doi: 10.1109/TED.2006.882274
-
[5]
Ring, E. F. J. Infrared Phys. Technol. 2007, 49, 297. doi: 10.1016/j.infrared.2006.06.029
-
[6]
Lira, I.; Santos, P. R. Metrologia 1999, 36, 415. doi: 10.1088/0026-1394/36/5/3
-
[7]
Klason, P.; Holmsten, M.; Andersson, A.; Lau, P.; Kok, G. J. P. Temperature: Its Measurement and Control in Science and Industry, Vol. 8, AIP Publishing, Los Angeles, California, USA, 2013, p. 987.
-
[8]
Revil, A.; Meyer, C. D.; Niu, Q. Geophysics 2016, 81, E243. doi: 10.1190/geo2015-0281.1
-
[9]
Bennet, M. A.; Richardson, P. R.; Arlt, J.; McCarthy, A.; Buller, G. S.; Jones, A. C. Lab Chip 2011, 11, 3821. doi: 10.1039/c1lc20391f
-
[10]
Marciniak, L.; Bednarkiewicz, A.; Kowalska, D.; Strek, W. J. Mater. Chem. C 2016, 4, 5559. doi: 10.1039/C6TC01484D
-
[11]
Lou, J. F.; Finegan, T. M.; Mohsen, P.; Hatton, T. A.; Laibinis, P. E. Rev. Anal. Chem. 1999, 18, 235.
-
[12]
宋秋生, 周稳, 吴新民, 吴凡, 化学学报, 2016, 74, 435. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345452.shtmlSong, Q. S.; Zhou, W.; Wu, X. M.; Wu, F. Acta Chim. Sinica 2016, 74, 435. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345452.shtml
-
[13]
Wang, X. D.; Song, X. H.; He, C. Y.; Yang, C. J.; Chen, G. N.; Chen, X. Anal. Chem. 2011, 83, 2434. doi: 10.1021/ac200196y
-
[14]
Vlaskin, V. A.; Janssen, N.; van Rijssel, J.; Beaulac, R.; Gamelin, D. R. Nano Lett. 2010, 10, 3670. doi: 10.1021/nl102135k
-
[15]
Barilero, T.; Le Saux, T.; Gosse, C.; Jullien, L. Anal. Chem. 2009, 81, 7988. doi: 10.1021/ac901027f
-
[16]
McLaurin, E. J.; Bradshaw, L. R.; Gamelin, D. R. Chem. Mater. 2013, 25, 1283. doi: 10.1021/cm304034s
-
[17]
Gosse, C.; Bergaud, C.; Low, P. Top Appl. Phys. 2009, 118, 301. doi: 10.1007/978-3-642-04258-4
-
[18]
Heyes, A. L.; Seefeldt, S.; Feist, J. P. Opt. Laser Technol. 2006, 38, 257. doi: 10.1016/j.optlastec.2005.06.012
-
[19]
Ishiwada, N.; Ueda, T.; Yokomori, T. Luminescence 2011, 26, 381. doi: 10.1002/bio.v26.6
-
[20]
Cao, C.; Liu, X. G.; Qiao, Q. L.; Zhao, M.; Yin, W. T.; Mao, D. Q.; Zhang, H.; Xu, Z. C. Chem. Commun. 2014, 50, 15811. doi: 10.1039/C4CC08010F
-
[21]
Hsia, C. H.; Wuttig, A.; Yang, H. ACS Nano 2011, 5, 9511. doi: 10.1021/nn2025622
-
[22]
Haro-Gonzalez, P.; Martinez-Maestro, L.; Martin, I. R.; Garcia-Sole, J.; Jaque, D. Small 2012, 8, 2652. doi: 10.1002/smll.v8.17
-
[23]
Kalytchuk, S.; Polakova, K.; Wang, Y.; Froning, J. P.; Cepe, K.; Rogach, A. L.; Zboril, R. ACS Nano 2017, 11, 1432. doi: 10.1021/acsnano.6b06670
-
[24]
Li, H.; Zhang, Y. D.; Shao, L.; Htwe, Z.; Yuan, P. Opt. Mater. Express 2017, 7, 1077. doi: 10.1364/OME.7.001077
-
[25]
Deepankumar, K.; Nadarajan, S. P.; Bae, D. H.; Baek, K. H.; Choi, K. Y.; Yun, H. Biotechnol. Bioproc. E 2015, 20, 67. doi: 10.1007/s12257-014-0456-z
-
[26]
Wang, X. D.; Wolfbeis, O. S.; Meier, R. J. Chem. Soc. Rev. 2013, 42, 7834. doi: 10.1039/c3cs60102a
-
[27]
Low, P.; Kim, B.; Takama, N.; Bergaud, C. Small 2008, 4, 908. doi: 10.1002/smll.v4:7
-
[28]
Jung, W.; Kim, Y. W.; Yim, D.; Yoo, J. Y. Sensor Actuators, A-Phys. 2011, 171, 228. doi: 10.1016/j.sna.2011.06.025
-
[29]
Guan, X. L.; Liu, X. Y.; Su, Z. X.; Liu, P. React. Funct. Polym. 2006, 66, 1227. doi: 10.1016/j.reactfunctpolym.2006.03.005
-
[30]
Chapman, C. F.; Liu, Y.; Sonek, G. J.; Tromberg, B. J. Photochem. Photobiol. 1995, 62, 416. doi: 10.1111/php.1995.62.issue-3
-
[31]
Pais, V. F.; Lassaletta, J. M.; Fernandez, R.; El-Sheshtawy, H. S.; Ros, A.; Pischel, U. Chem.-Eur. J. 2014, 20, 7638. doi: 10.1002/chem.201402027
-
[32]
Zeng, Y.; Li, P.; Liu, X. Y.; Yu, T. J.; Chen, J. P.; Yang, G. Q.; Li, Y. Polym. Chem.-UK 2014, 5, 5978. doi: 10.1039/C4PY00714J
-
[33]
Arai, S.; Lee, S. C.; Zhai, D. T.; Suzuki, M.; Chang, Y. T. Sci. Rep.-UK 2014, 4, 6701.
-
[34]
Arai, S.; Suzuki, M.; Park, S. J.; Yoo, J. S.; Wang, L.; Kang, N. Y.; Ha, H. H.; Chang, Y. T. Chem. Commun. 2015, 51, 8044. doi: 10.1039/C5CC01088H
-
[35]
Wang, H.; Wu, Y. Q.; Tao, P.; Fan, X.; Kuang, G. C. Chem.-Eur. J. 2014, 20, 16634. doi: 10.1002/chem.201404292
-
[36]
Wang, H.; Wu, Y. Q.; Shi, Y. L.; Tao, P.; Fan, X.; Su, X. Y.; Kuang, G. C. Chem.-Eur. J. 2015, 21, 3219. doi: 10.1002/chem.v21.8
-
[37]
Ke, G. L.; Wang, C. M.; Ge, Y.; Zheng, N. F.; Zhu, Z.; Yang, C. J. J. Am. Chem. Soc. 2012, 134, 18908. doi: 10.1021/ja3082439
-
[38]
Ebrahimi, S.; Akhlaghi, Y.; Kompany-Zareh, M.; Rinnan, A. ACS Nano 2014, 8, 10372. doi: 10.1021/nn5036944
-
[39]
Guo, Y. Z.; Yu, X.; Xue, W. W.; Huang, S. S.; Dong, J.; Wei, L. H.; Maroncelli, M.; Li, H. P. Chem. Eng. J. 2014, 240, 319. doi: 10.1016/j.cej.2013.11.081
-
[40]
Zhou, H.; Liu, F.; Wang, X. B.; Yan, H.; Song, J.; Ye, Q.; Tang, B. Z.; Xu, J. W. J. Mater. Chem. C 2015, 3, 5490. doi: 10.1039/C5TC00752F
-
[41]
Uchiyama, S.; Matsumura, Y.; de Silva, A. P.; Iwai, K. Anal. Chem. 2003, 75, 5926. doi: 10.1021/ac0346914
-
[42]
Shiraishi, Y.; Miyarnoto, R.; Hirai, T. Langmuir 2008, 24, 4273. doi: 10.1021/la703890n
-
[43]
Coppeta, J.; Rogers, C. Exp. Fluids 1998, 25, 1. doi: 10.1007/s003480050202
-
[44]
Chen, C. Y.; Chen, C. T. Chem. Commun. 2011, 47, 994. doi: 10.1039/C0CC04450D
-
[45]
Brites, C. D. S.; Lima, P. P.; Silva, N. J. O.; Millan, A.; Amaral, V. S.; Palacio, F.; Carlos, L. D. Nanoscale 2012, 4, 4799. doi: 10.1039/c2nr30663h
-
[46]
Qiao, J.; Chen, C. F.; Qi, L.; Liu, M. R.; Dong, P.; Jiang, Q.; Yang, X. Z.; Mu, X. Y.; Mao, L. Q. J. Mater. Chem. B 2014, 2, 7544. doi: 10.1039/C4TB01154F
-
[47]
Uchiyama, S.; Tsuji, T.; Ikado, K.; Yoshida, A.; Kawamoto, K.; Hayashi, T.; Inada, N. Analyst 2015, 140, 4498. doi: 10.1039/C5AN00420A
-
[48]
Wu, Y. S.; Liu, J. J.; Ma, J. W.; Liu, Y. C.; Wang, Y.; Wu, D. C. ACS Appl. Mater. Interfaces 2016, 8, 14396. doi: 10.1021/acsami.6b03366
-
[49]
Ito, A.; Ishizaka, S.; Kitamura, N. Phys. Chem. Chem. Phys. 2010, 12, 6641. doi: 10.1039/b924176k
-
[50]
Braun, D.; Rettig, W. Chem. Phys. 1994, 180, 231. doi: 10.1016/0301-0104(93)E0423-S
-
[51]
Xia, T. K.; Wang, L. L.; Qu, Y.; Rui, Y. C.; Cao, J.; Hu, Y.; Yang, J.; Wu, J. W.; Xu, J. L. J. Mater. Chem. C 2016, 4, 5696. doi: 10.1039/C6TC01241H
-
[52]
Feng, J.; Tian, K. J.; Hu, D. H.; Wang, S. Q.; Li, S. Y.; Zeng, Y.; Li, Y.; Yang, G. Q. A. Angew. Chem., Int. Ed. 2011, 50, 8072. doi: 10.1002/anie.v50.35
-
[53]
Feng, J.; Xiong, L.; Wang, S. Q.; Li, S. Y.; Li, Y.; Yang, G. Q. Adv. Func. Mater. 2013, 23, 340. doi: 10.1002/adfm.201201712
-
[54]
Liu, J.; Guo, X. D.; Hu, R.; Xu, J.; Wang, S. Q.; Li, S. Y.; Li, Y.; Yang, G. Q. Anal. Chem. 2015, 87, 3694. doi: 10.1021/acs.analchem.5b00887
-
[55]
Liu, X.; Li, S. Y.; Feng, J.; Li, Y.; Yang, G. Q. Chem. Commun. 2014, 50, 2778. doi: 10.1039/C3CC49147A
-
[56]
Lou, J. F.; Hatton, T. A.; Laibinis, P. E. Anal. Chem. 1997, 69, 1262. doi: 10.1021/ac960745g
-
[57]
Kaushlendra, K.; Asha, S. K. J. Phys. Chem. B 2014, 118, 4951. doi: 10.1021/jp501346b
-
[58]
Zeng, Y.; Li, Y. Y.; Li, M.; Yang, G. Q.; Li, Y. J. Am. Chem. Soc. 2009, 131, 9100. doi: 10.1021/ja902998g
-
[59]
秦天依, 曾毅, 陈金平, 于天君, 李嫕, 化学学报, 2017, 75, 99. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345811.shtmlQin, T. Y.; Zeng, Y.; Chen, J. P.; Yu, T. J.; Li, Y. Acta Chim. Sinica 2017, 75, 99. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345811.shtml
-
[60]
Mutai, T.; Satou, H.; Araki, K. Nat. Mater. 2005, 4, 685. doi: 10.1038/nmat1454
-
[61]
Zhang, X. Q.; Chi, Z. G.; Xu, B. J.; Jiang, L.; Zhou, X.; Zhang, Y.; Liu, S. W.; Xu, J. R. Chem. Commun. 2012, 48, 10895. doi: 10.1039/c2cc36263e
-
[62]
Zhu, Q. H.; Yang, W. J.; Zheng, S. C.; Sung, H. H. Y.; Williams, I. D.; Liu, S. W.; Tang, B. Z. J. Mater. Chem. C 2016, 4, 7383. doi: 10.1039/C6TC01887D
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 75
- 文章访问数: 2886
- HTML全文浏览量: 674



 下载:
下载:












 下载:
下载:

